Número Atual: Janeiro-Março 2020 - Volume 4 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Alérgenos do gato nas alergias respiratórias: situação atual e novas perspectivas
Cat allergens in respiratory allergy: current status and new perspectives
Gustavo Falbo Wandalsen1; Flavio Sano2; Dirceu Solé1
1. Escola Paulista de Medicina, Universidade Federal de São Paulo, Disciplina de Alergia, Imunologia Clínica e Reumatologia - São Paulo, SP, Brasil
2. Hospital Nipo-Brasileiro, Pediatria - São Paulo, SP, Brasil
Endereço para correspondência:
Gustavo Falbo Wandalsen
E-mail: gfwandalsen@uol.com.br
Submetido em: 29/02/2020
Aceito em: 10/03/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
O gato é uma das principais fontes de alérgenos intradomiciliares. Evidências mostram que o contato com o gato em residências no Brasil é frequente, e está aumentando. No nosso meio, dados sobre a prevalência de sensibilização ao gato são escassos. Entre os oito alérgenos já identificados do gato, Fel d 1 é o principal, e responde por 60 a 90% de toda a reatividade IgE mediada ao animal. Fel d 1 é uma uteroglobulina sintetizada pelas glândulas salivares e sebáceas dos gatos, espalhada e aderida ao pelo do animal pelo hábito de se lamber. O diagnóstico de alergia ao gato é feito pela história de sintomas após exposição e pela presença de IgE específica. Medidas para redução do contato com os alérgenos dos gatos são difíceis de se implementar, principalmente se envolverem a remoção do animal, e não garantem benefício clínico. O tratamento farmacológico é feito com corticosteroides tópicos e sintomáticos. Imunoterapia subcutânea e sublingual têm demonstrado melhora dos sintomas nasais, oculares e brônquicos. Recentemente, foi desenvolvida uma ração para gatos suplementada com anticorpos neutralizantes IgY anti-Fel d 1 extraídos da gema do ovo de galinhas. Estudo com a ração suplementada observou redução significante nos níveis de Fel d 1 ativo no pelo dos gatos a partir da terceira semana, e redução média de 47% ao final de 10 semanas. Estudos complementares ainda são necessários para documentar a ação dessa ração nos sintomas respiratórios de pacientes alérgicos, mas inquestionavelmente abre-se uma nova perspectiva para o manejo da alergia a gato.
Descritores: Alergia e imunologia, gatos, rinite alérgica.
INTRODUÇÃO
A alergia a animais de pelo (cão e gato) é universal e tem aumentado nos últimos tempos. Em países industrializados a alergia a gato é apontada como a alergia de origem animal mais comum, e afeta aproximadamente 1 em cada 5 adultos em todo o mundo1. Apesar disso, no Brasil ainda a sensibilização ao cão é a predominante2,3. O convívio cada vez mais frequente e intenso com esses animais em residências, associado à exposição a níveis significativos de alérgenos dos mesmos em áreas onde nenhum animal está presente (casas, escolas, creches, locais de trabalho) tem contribuído para o aumento na frequência de alergias a esses animais1,4.
Dados recentes do Instituto Brasileiro de Geografia e Estatística apontam que 44,3% dos domicílios brasileiros têm pelo menos um cachorro, e que 17,7% ou 11,5 milhões de unidades têm pelo menos um gato, sobretudo nas regiões Norte (22,7%) e Nordeste (23,6%)2,3. Segundo outro documento, a população de gatos em domicílios brasileiros foi estimada em 22,1 milhões, o que representa aproximadamente 1,9 gato por domicílio5.
Além dos donos dos animais e seus familiares, os profissionais envolvidos no cuidado e na pesquisa com esses animais são um grupo de risco, e podem representar até um terço dos pacientes sensibilizados, com perdas de dias de trabalho e mesmo asma profissional1,4,6.
EPIDEMIOLOGIA DA SENSIBILIZAÇÃO A GATO
A prevalência de sensibilização a animais de estimação, sobretudo mamíferos com pelo, tem sido cada vez maior e variável segundo o local de estudo. Vários fatores podem justificar essa variabilidade de resultados: local do estudo, carga genética e tipo de população estudada (alérgica, não alérgica), idade, carga de exposição, tempo de exposição aos animais, método de aferição da sensibilização (testes cutâneos, IgE sérica específica), entre outros.
Estudo alemão com adultos saudáveis observou que 7,0% deles estavam sensibilizados a gato7. Por outro lado, estudo europeu em adultos com suspeita de alergia a inalantes documentou ser a prevalência de sensibilização a gatos em 26%8.
Nos Estados Unidos, em crianças maiores de 6 anos a frequência de sensibilização a gato revelou ser 12,1%9. Em crianças e adolescentes alemães a taxa de sensibilização foi 8,1%, e avaliando-se com relação à faixa etária, a sensibilização a gato variou de 5,7% entre as crianças, e 17,2% entre os adolescentes10.
No Brasil esses dados são escassos, e na sua maioria foram obtidos a partir de amostras populacionais pequenas e/ou de pacientes com suspeita de doença alérgica. Empregando-se os testes cutâneos de leitura imediata com extrato de epitélio de gato para o diagnóstico em crianças e adolescentes, obteve-se taxas entre 3,2% e 28,7%11-14. Em adultos com suspeita de doença alérgica, a prevalência de sensibilização ao gato observada variou entre 20% e 26,2%15,16.
Empregando-se a pesquisa de IgE específica ao Fel d 1, alérgeno principal do gato, em pacientes com doenças alérgicas e controles não alérgicos menores de 12 anos de vida, documentou-se ser a prevalência de sensibilização 12,3% entre os alérgicos, e 8,1% entre os controles17. Passados 12 anos, o mesmo protocolo foi realizado, e houve incremento para 29,9% e 15,3%, respectivamente18. A mudança de hábitos quanto à posse de gatos pode ser a explicação para esse aumento.
ALÉRGENOS DO GATO (FEL D 1 E OUTROS)
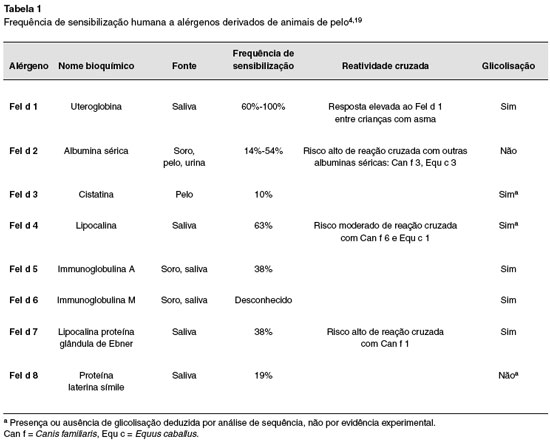
A Organização Mundial da Saúde e o Subcomitê de Nomenclatura de Alérgenos da União Internacional de Sociedades de Imunologia identificaram e registraram oito alérgenos derivados de gatos (Felis domesticus)19,20 (Tabela 1). Esses alérgenos são identificados pela denominação Fel d seguida pelo número 1 a 8, de acordo com a ordem da sua identificação. Os alérgenos principais do gato são Fel d 1 e Fel d 4, embora o significado clínico do Fel d 4 seja desconhecido4,21.
O Fel d 1 é uma uteroglobulina e responde por 60% a 90% de toda a reatividade IgE mediada ao pelo do gato22. Os demais alérgenos são apresentados na Tabela 1. Embora a monossensibilização por Fel d 1 seja comum, indivíduos sensibilizados a Fel d 2 (albumina sérica) e Fel d 4 (lipocalina) são usualmente sensibilizados ao Fel d 121,23. A presença de alérgenos tipo lipocalina (Fel d 4 e Fel d 7; Cannis familiares: Can f 1, Can f 2, Can f 4 e Can f 6; Equus caballus, Equ c 1 e Equ c 2) e albumina (Fel d 2, Can f 3 e Equ c 3) em outros animais mamíferos é a justificativa para a presença de reação cruzada entre eles21,23.
Independentemente da raça, idade, comprimento do pelo, peso corporal, viver dentro ou fora de casa, não há gato livre de alérgeno ou hipoalergênico, uma vez que todos produzem Fel d 14,19,25.Todos os gatos produzem quantidades significativas de Fel d 1, principalmente pelas glândulas salivares e sebáceas, urina de machos e, em menor quantidade, pelas glândulas lacrimais e anais19,26,27.
A produção de Fel d 1 é variável de animal para animal, assim como para o mesmo animal no decorrer do tempo28. Gatos machos produzem três a cinco vezes menos Fel d 1 após castração e, se tratados com testosterona, voltam a atingir níveis pré-castração, reforçando a possibilidade de influência da testosterona sobre a produção de Fel d 119,29.
Desconhece-se a função biológica do Fel d 1, entretanto, cogita-se a de feromônio/sinalização química19,30. A descamação da pele do Felis domesticus elimina partículas de 2 a 5 µm de diâmetro que contém o alérgeno Fel d 1, que permanece longo período em suspensão, principalmente em ambientes mal ventilados, mantendo sua potência alergênica por mais de 20 semanas, mesmo após a remoção do animal6,31,32. O Fel d 1 é transferido passivamente às roupas, pela aderência das partículas que o contém, e assim pode ser transferido a locais em que o animal não esteja presente, por donos dos mesmos19,33. Por conta disso é um alérgeno ubíquo, documentado em residências sem gatos, veículos particulares, trans-porte público e edifícios públicos em níveis (≥ 8 µg Fel d 1 por grama de poeira) que excedem o valor limite associado à sensibilização6,19,32-36. Estudos que quantificaram os níveis de Fel d 1 em escolas mostraram que apesar de detectáveis, em geral, são baixos e podem não induzir sintomas37-39.
PAPEL DOS ALÉRGENOS DO GATO NA ASMA E RINITE
Estudos epidemiológicos têm mostrado que a presença de alérgenos de animais em ambientes internos tem sido associada a aumento de risco de desenvolvimento de sintomas alérgicos. A exposição a 8 µg por grama de poeira ou mais de Fel d 1 tem sido identificada como fator de risco para sensibilização ao gato40, bem como capaz de provocar a exacerbação de sintomas alérgicos em indivíduos sensibilizados41-42.
O momento em que ocorre essa exposição parece ser crítico para a indução de sensibilização e o desenvolvimento de doença alérgica. Admite-se que se a exposição ao gato/cão ocorrer durante o primeiro ano de vida, aliada a outros fatores de risco genéticos e ambientais, poderá haver diminuição do risco de desenvolver doença alérgica ou mesmo asma alérgica43-45. Se a exposição ocorrer após o primeiro ano de idade, o risco de sensibilização e desenvolvimento de uma doença alérgica parece estar aumentado44-48.
Estudos epidemiológicos têm documentado relação positiva entre exposição a gato e desenvolvimento de asma49-51, bem como asma grave52. Por outro lado, a presença de sensibilização ao gato tem sido associada de modo mais efetivo ao desenvolvimento de alergia o gato (asma, rinite, conjuntivite).
Coorte de nascimento avaliou a sensibilização ao Fel d 1 (testes cutâneos e determinação de níveis séricos de IgE específica) durante a infância e o aparecimento de alergia a gato aos 16 anos de idade. A sensibilização ao Fel d 1 e a polissensibilização a três ou mais alérgenos do gato, além do Fel d 1, foi o melhor preditor para o desenvolvimento de alergia ao gato na adolescência e à reatividade cruzada com os alérgenos do cão53. Estudo com adultos brasileiros e chilenos revelou associação significante entre sensibilização a gato e frequência de asma e rinoconjuntivite. O risco relativo de desenvolver asma e rinoconjuntivite foi, em média, seis vezes mais elevados quando comparados à sensibilização aos ácaros do pó doméstico54. A sensibilização ao alérgeno maior do gato, o Fel d 1, é marcador específico de alergia ao gato, pois é o componente mais prevalente em indivíduos mono e polissensibilizados1,4,23, e os pacientes quando a ele expostos podem apresentar sintomas de rinite, asma e/ou conjuntivite1,4.
É comum que pacientes sensibilizados a alérgenos de gato sejam sensibilizados a outros animais, como cão, cavalo, cobaia, entre outros1,4,23. Comentase que 75% dos indivíduos sensibilizados a um animal de estimação têm 14 vezes mais chances de serem sensibilizados a outros alérgenos, sobretudo de outros animais28. A possibilidade de reatividade cruzada entre alérgenos de cães e gatos torna o diagnóstico resolvido por componentes como essencial21. Com relação aos padrões de reatividade cruzada mais significativos entre cães, gatos e outros mamíferos, pode-se afirmar que:
- algumas lipocalinas têm até 60% de identidade na sequência de aminoácidos, o que explica a reatividade cruzada entre eles, por exemplo Can f 6 (cão), Equ 1 (cavalo), Fel d 4 (gato), Ory c 4 (coelho), Mus m 1 (camundongo) e Rat n 1 (rato)55,56;
- Imunoglobulina E sérica específica (sIgE) ao Fel d 1 está presente em 95% dos pacientes que são alérgicos a gatos, assim como em outras famílias de felinos, tais com tigres, jaguares, pumas e leões9;
- sIgE ao Can f 6 está presente em 38% dos pacientes sensibilizados a cães, entretanto, aparece em 60% dos pacientes sensibilizados a ambos cães e gatos e pode ser relacionado a sua identidade com o Fel d 422;
- embora tenham grande similaridade estrutural, o Can f 2 e Equ c 1 não mostram reatividade cruzada22;
- a sequência de amino-ácidos do Can f 6 e do Equ c 1 têm 57% de identidade22;
- Can f 1 tem reatividade cruzada com a lipocalina da lágrima humana22;
- Can f 5 tem homologia parcial com o antígeno prostático específico (PSA) por pertencer à família da calecreína55. Especula-se que a sensibilização prévia ao Can f 5 possa estar associada à maior propensão de manifestar reações alérgicas ao fluido seminal humano56.
Frequentemente alérgicos a gato mostram-se sensibilizados a cães e outros animais. A homologia e/ou similaridade estrutural dos diferentes alérgenos de cães e gatos (albuminas e lipocalnas) explicam a reatividade cruzada entre eles e com outros mamíferos. Eles também explicam parcialmente a presença de sensibilização simultânea a cães, gatos e outros mamíferos mesmo na ausência de exposição a esses animais. O Fel d 1 não esboça reatividade cruzada com alérgenos de outros animias, assim quando presente, a cossensibilização é mais provável. Pacientes polissensibilizados a gato têm níveis mais elevados de IgE e sintomas mais frequentemente que os monossenbilizados23,53. Asma atual e sintomas de asma após contato com gato estão associados a cossensibilização ao Fel d 1 e Fel d 457.
Os indivíduos sensibilizados a gato mostram grau elevado de heterogeneidade segundo o grupo de sensibilização. Cada um deles (monossensibilizado, sensibilizado ao Fel d 1, polissensibilizados) está associado a risco substancial de asma, rinite e associação asma e rinite sem haver, no entanto, aumento das exacerbações por asma, valores previstos de VEF1, idas à emergência, ou uso regular de esteroides58,59. Crianças com asma grave tinham níveis elevados de IgE ao cão, gato e cavalo. O emprego do diagnóstico molecular para pacientes com asma grave e sensibilizados a cão, gato e cavalo possibilitou revelar a polissensibilização a vários componentes alergênicos entre esses pacientes60.
DIAGNÓSTICO DA ALERGIA AO GATO
Pacientes alérgicos ao gato com manifestações clinicamente relevantes geralmente apresentam reações de hipersensibilidade, reprodutíveis, à exposição aos antígenos do gato, em concentrações toleráveis pela maioria dos indivíduos não alérgicos4,6.
Faz parte do diagnóstico a obtenção de uma boa história clínica relacionada à exposição e suspeita da sensibilização. A sensibilização alérgica é identificada pela presença de IgE específica, que pode ser investigada pelo teste cutâneo de leitura imediata (TCHI) com os alérgenos específicos, ou pela detecção de IgE sérica específica4,6. Mesmo sendo positivos qualquer um dos exames, o diagnóstico de alergia só será confirmado se houver manifestações clínicas alérgicas quando o paciente for exposto ao animal.
Os extratos utilizados na realização dos TCHI para o diagnóstico da alergia ao gato são extraídos de diversas fontes naturais, como pelos, saliva, urina e/ou epitélio e contêm quantidade variada de proteínas, alergênicas ou não61,62. A utilização de extratos padronizados é recomendada para aumentar a comparabilidade e consistência entre os alérgenos fornecidos por diversos fabricantes61,62. O teste é barato, simples e rápido de ser realizado, e deve ser utilizado como teste inicial.
A determinação dos níveis séricos de IgE específica é recomendada particularmente quando os sintomas do paciente e o resultado do TCHI são contraditórios, especialmente antes de se iniciar imunoterapia alérgeno específica8,9. No caso dos gatos, a determinação da IgE específica é um teste altamente sensível, mas existe a probabilidade de resultados falso-positivos; desta forma, se torna um método com menor acurácia do que os TCHI8,9,19,20.
A aquisição do diagnóstico molecular na última década tem facilitado o manejo de pacientes alérgicos de maneira geral. Nele são utilizados alérgenos purificados ou recombinantes, além de componentes da proteína fonte63,64. A purificação e caracterização do componente proteico Fel d 1 do gato ocorreu em 1973, por Ohman et al.65. Esta descoberta propiciou a mensuração de anticorpos classe específica e a realização do diagnóstico laboratorial sérico da sensibilização ao gato1.
O diagnóstico molecular possui vantagens claras sobre a utilização de extratos totais, especialmente em indivíduos polissensibilizados, sendo capaz de distinguir sensibilização específica real de uma sensibilização devida à reatividade cruzada64. É de grande valia na recomendação de se evitar um alérgeno específico e na determinação de uma imunoterapia mais exata. Sua mensuração pode ser útil na predição de sintomas clínicos e sua gravidade60,66. É a proteína dominante e determinante na detecção da alergenicidade, e cerca de 96% dos pacientes com sintomas clínicos relacionados aos gatos reagem a ela67.
Existem partículas maiores (> 9 µm) e menores (< 4,7 µm) que podem ser carregadas pelo ar. Entretanto, as partículas menores podem ficar em suspensão por alguns dias38, sendo capazes de atingir brônquios de pequenos calibres e induzir asma21,27.
Cerca de 93% dos indivíduos que manifestam sintomas à exposição ao gato têm teste cutâneo positivo31. A correlação entre os sintomas clínicos e o teste alérgico positivo mostra sensibilidade, especificidade e acurácia de 0,9 para todos os índices68.
A concordância entre o TCHI e a dosagem de IgE sérica específica foi de 94% pelo Phadebas RAST34, e de 91% quando realizado pelo Pharmacia CAP System69.
Os testes de provocação brônquica, nasal e ocular não são utilizados na prática clínica, sendo realizados apenas em pesquisas. Esses testes avaliam clinicamente a reatividade aos alérgenos nos órgãos específicos, à semelhança de uma exposição natural66.
Mais recentes, testes de provocação nasal em indivíduos com teste cutâneo negativo e IgE específica indetectável, identificaram a produção de IgE específica no nariz, sugerindo que esses indivíduos poderiam estar apresentando a indução da rinite alérgica local70.
ABORDAGEM TERAPÊUTICA DA ALERGIA AO GATO
Medidas de como evitar o contato com os alérgenos dos gatos incluem: remover o animal da residência 25,27,71, banhá-lo regularmente25,72, mantê-lo fora do quarto27,73,74, uso de purificadores de ar com filtro HEPA75, uso regular de aspiradores de pó de alta eficiência27, uso de capas de colchões e travesseiros27,76, remoção de almofadas ou outros ítens que podem servir de reservatórios27, uso de alvejantes e ácido tânico77, uso de fluxo laminar de temperatura controlada durante o período noturno78, aplicações de loções tópicas nos pelos dos animais e a combinação de várias destas medidas27.
Apesar da remoção do animal da residência ser a medida mais comumente recomendada, ela geralmente é muito difícil de ser aceita pelos pacientes. Desta forma, as medidas e tentativas de diminuir a quantidade de alérgenos do ambiente, embora algumas vezes pouco eficazes, se tornam as mais praticadas. Estas medidas devem ser recomendadas conjuntamente e mantidas ao longo do tempo, apesar de não garantirem benefício clínico ou diminuição da evolução da doença. Convém lembrar que os alérgenos são bastante estáveis e podem persistir no ambiente por até 6 meses21,22,64.
Fel d 1 tem sido encontrado em escolas e lares onde não existem gatos9. Os alérgenos dos gatos podem ser transportados das casas onde esses animais habitam a espaços públicos onde eles não existam, sobretudo por populações em que estes pets sejam mais comuns74. A abrangência do contato indireto é significante, uma vez que a prevalência da alergia a gatos em pacientes que nunca tiveram gato em suas residências seja em torno de 34%79. Casas com gatos podem apresentar altas concentrações de antígenos do gato, mesmo se o animal não estiver presente o tempo todo e os pacientes podem desenvolver sintomas mesmo na ausência dos animais79. Exposições por um tempo prolongado aos alérgenos em uma dose relativamente pequena podem levar a alterações na saúde respiratória dos indivíduos atópicos, mesmo sem provocar sintomas perceptivos80.
O tratamento sintomático com anti-histamínicos e a utilização tópica de corticosteroides são utilizados quando os sintomas ainda persistem, apesar das tentativas de se evitar o contato com os alérgenos do animal6.
A imunoterapia subcutânea (SCIT) e a sublingual (SLIT) com os antígenos do gato consistem na introdução lenta e gradual de doses crescentes de alérgenos por um tempo de 3 a 5 anos. Estão associadas a mudanças na função das células T sugerindo uma transição do perfil fenotípico T helper 2 (Th2) para perfil T helper 1 (Th1) e indução de células T regulatórias81.
A SCIT com extratos de gato tem demonstrado melhora estatisticamente significante nos sintomas oculares, nasais e brônquicos em indivíduos com rinoconjuntivite e asma ao gato após 12 meses de tratamento82-84, bem como aumento significante, dose dependente, da IgG total e IgG4; e redução da resposta no TCHI88,85,86. Estudos em crianças demonstraram resultados semelhantes82,87.
SLIT com extratos de gato tem demonstrado melhora dos sintomas nasais, oculares e brônquicos em adultos, após 12 meses de tratamento88.
Os chamados animais "hipoalergênicos" com me-nos pelos ou menor produção de Fel d 1 têm sido citados25. Entretanto, estas alterações nos fenótipos dos gatos não garantem a eliminação de antígenos menores presentes na saliva, e que participam do desencadeamento de sintomas clínicos27.
Não existem evidências científicas que suportem a indicação da opção de gatos hipoalergênicos, uma vez que não foram encontradas evidências significantes no nível de alérgenos encontrados nos ambientes frequentados por gatos hipoalergênicos
ou não25,27,72.
NOVAS PERSPECTIVAS NA ABORDAGEM DA ALERGIA AO GATO
A presença de um aninal doméstico no domícilio pode se associar a vários benefícios psicológicos e de saúde, incluindo a redução da pressão arterial, da sensação de solidão, melhoria no controle da depressão e maior facilidade na manutenção/ perda de peso89. Famílias que possuem um animal doméstico, como o gato, usualmente desenvolvem um forte vínculo emocional com o animal, e a sua remoção do domicílio em função da alergia muitas vezes é difícil e traumática para a família90.
Diversas tentativas de diminuir a alergenicidade dos gatos ou de neutralizar seus alérgenos já foram feitas visando a melhor coexistência de pessoas alérgicas com seus gatos, e incluem mudanças na composição da dieta e a própria imunização dos gatos ao Fel d 190. Entre essas tentativas, se destaca a iniciativa de desenvolver anticorpos neutralizantes capazes de bloquear os epítopos do Fel d 1 e impossibilitar sua ligação com a IgE e o subsequente desencadeamento de sintomas alérgicos91.
Fel d 1 é uma proteína tetramérica com características conformacionais específicas, sendo composta por dois heterodímeros, cada um com duas cadeias distintas (Figura 1A)90. Essa conformação do Fel d 1 é importante para a alergenicidade da proteína que possui pelo menos três epítopos conhecidos e explica, pelo menos em parte, o motivo do maior sucesso dos anticorpos neutralizantes policlonais do que dos monoclonais90.
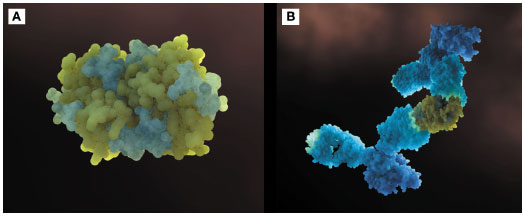
Figura 1 Configuração tridimensional da proteína de Fel d 1 (A) e estrutura formada por Fel d 1 após ligação com dois anticorpos IgY anti-Fel d 1 (B). Fonte: Purina Institute
Recentemente foram desenvolvidos anticorpos neutalizantes para Fel d 1 na galinha (Figura 1B)91. Esses anticorpos da classe IgY (equivalente da IgG dos mamíferos nas aves) são naturalmente encontrados no soro e na gema do ovo de galinhas expostas ao alérgeno, e podem ser estimulados com a exposição do animal ao alérgeno91. Assim, grandes quantidades de anticorpos IgY anti-Fel d 1 podem ser retirados da gema do ovo, purificados e adicionados à ração do gato91. Na medicina veterinária, anticorpos originados do ovo da galinha são considerados seguros e eficazes para administração oral a animais domésticos91.
No gato, as maiores concentrações de Fel d 1 são encontradas na saliva, produzidas pelas gândulas salivares. Pelo hábito do gato de se lamber, esse alérgeno é espalhado e aderido ao pelo do animal91.
Em um ensaio inicial, ração com adição de anticorpo IgY anti-Fel d 1 foi dada a seis gatos por seis semanas. Saliva dos gatos foram coletadas quatro vezes ao dia (pós-alimentação) e cinco vezes por semana, antes (2 semanas) e durante a administração da ração suplementada91. Foi observada redução significativa das concentrações de Fel d 1 imunologicamente ativo a partir da segunda semana de alimentação com a ração suplementada com anticorpos neutralizantes, com redução média de 30%91. Em seguida, os autores alimentaram 20 gatos por quatro semanas com ração suplementada (11 gatos) ou com ração controle (9 gatos). Observou-se redução significante nos níveis de Fel d 1 ativos na saliva a partir da terceira semana de alimentação suplementada, com redução média de 24%. Dos 11 gatos alimentados com a ração teste, 9 apresentaram diminuição de pelo menos 20% nos níveis de Fel d 1 ativos91.
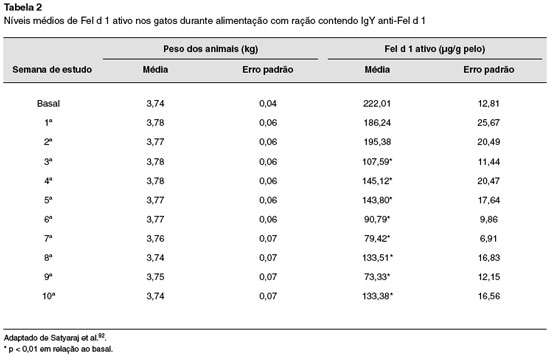
Estudo posterior do mesmo grupo avaliou os níveis de Fel d 1 ativo no pelo de 105 gatos alimentados por 10 semanas com ração contendo IgY anti-Fel d 192. Redução significante nos níveis de Fel d 1 ativo foi encontrada a partir da terceira semana. Ao final das 10 semanas houve redução média de 47% (variação de 33% a 71%), conforme mostrado na Tabela 2. Gatos com maiores níveis de Fel d 1 apresentaram as maiores reduções nos níveis de Fel d 1 ativo92. Do total, 86% dos gatos apresentaram diminuição dos níveis de Fel d 1 ativo de pelo menos 30%, e metade dos gatos tiveram redução de pelo menos 50%. Não houve diferenças no peso dos gatos com a ração teste, e não foram observados problemas de saúde associados a ela92.
Em relação à saúde dos gatos, não foram observados efeitos adversos em parâmetros clínicos e em testes laboratoriais (incluindo possíveis efeitos mutagênicos) em gatos alimentados com ração suplementada com IgY anti-Fel d 1 por 26 semanas93.
Ainda não são disponíveis estudos robustos sobre os efeitos da redução dos níveis de Fel d 1 com a ração suplementada com IgY anti-Fel d 1 sobre a saúde de pacientes alérgicos ao gato. Estudo apresentado no último congresso da Academia Europeia de Alergia e Imunologia Clínica (EAACI, 2019) avaliou a resposta de 15 pacientes alérgicos ao gato após provocação com cobertores de gatos alimentados com ração controle ou ração suplementada com IgY anti-Fel d 1 em câmaras de desencadeamento94. Em comparação ao desencamento inicial (realizado para documentar a alergia ao gato), foi observada redução no escore total de sintomas nasais e no escore de alguns sintomas oculares após provocação com cobertores de gatos alimentados com ração suplementada94.
Especula-se que não seria necessário a eliminação total dos níveis de Fel d 1 no domicílio para melhora dos sintomas dos pacientes alérgicos ao gato, mas sim a redução dos seus níveis abaixo de um limiar capaz de induzir resposta clínica90. Estudos complementares ainda são necessários para documentar de forma consistente a ação dessa ração no controle dos sintomas respiratórios de pacientes alérgicos, mas inquestionavelmente abre-se uma nova perspectiva para o manejo da alergia a gato.
REFERÊNCIAS
1. Satyaraj E, Wedner HJ, Bousquet J. Keep the cat, change the care pathway: a transformational approach to managing Fel d 1, the major cat allergen. Allergy. 2019;74(sup 107):5-17.
2. Pesquisa Nacional por Amostra de Domicílios. 2013. Animais de estimação. Disponível em: https://biblioteca.ibge.gov.br/visualizacao/livros/liv94074.pdf. Acessado em: outubro/2019.
3. População de animais de estimação no Brasil. Disponível em: http://www.agricultura.gov.br/assuntos/camaras-setoriais-tematicas/documentos/camaras-tematicas/insumos-agropecuarios/anosanteriores/ibge-populacao-de-animais-de-estimacao-no-brasil-2013-abinpet-79.pdf. Acessado em: outubro/2019.
4. Dávila I, Domínguez-Ortega J, Navarro-Pulido A, Alonso A, Antolín- Amerigo D, González-Mancebo E, et al. Consensus document on dog and cat allergy. Allergy. 2018;73(6):1206-22.
5. Levantamento posterior entre 2013 e 2018 aponta aumenta de 8,2% no número de Gatos em lares brasileiros (gatos podem superar cães com animais de estimação no Brasil. Disponível em: https://tribunadejundiai.com.br/mais/mundo-pet/gatos-podem-superarcaes- como-animais-de-estimacao-no-brasil-diz-estudo/ . Acessado em: outubro/2019.
6. Chan SK, Leung D. Dog and cat allergies: current state of diagnostic approaches and challenges. Allergy Asthma Immunol Res. 2018;10:97-105.
7. Haftenberger M, Laußmann D, Ellert U, Kalcklösch M, Langen U, Schlaud M, et al. Prevalence of sensitisation to aeraoallergens and food allergens: results of the German Health Interview and Examination Survey for Adults (DEGS1). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2013:56:687-97.
8. Heinzerling LM, Burbach GJ, Edenharter G, Bachert C, Bindslev- Jensen C, Bonini S, et al. GA(2)LEN skin test study I: GA(2)LEN harmonization of skin prick testing: novel sensitization patterns for inhalant allergens in Europe. Allergy. 2009;64:1498-506.
9. Konradsen JR, Fujisawa T, van Hage M, Hedlin G, Hilger C, Kleine-Tebbe J, et al. Allergy to furry animals: new insights, diagnostic approaches, and challenges. J Allergy Clin Immunol. 2015;135:616-25.
10. Schmitz R, Ellert U, Kalcklosch M, Dahm S, Thamm M. Patterns of sensitization to inhalant and food allergens - findings from the German Health Interview and Examination Survey for Children and Adolescents. Int Arch Allergy Immunol. 2013:162:263-70.
11. Rizzo MCFV, Solé D, Rizzo A, Holanda MA, Rios JB, Wandalsen NF, et al. Atopic disease in Brazilian children - etiologic multicentric study. J Pediatr (Rio J). 1995;71(1):31-5.
12. Pastorino AC, Kuschnir FC, Arruda LK, Casagrande RR, de Souza RG, Dias GA, et al. Sensitisation to aeroallergens in Brazilian adolescents living at the periphery of large subtropical urban centres. Allergol Immunopathol (Madr). 2008;36(1):9-16.
13. Sarinho EC, Mariano J, Sarinho SW, Medeiros D, Rizzo JA, Almerinda RS, et al. Sensitisation to aeroallergens among asthmatic and nonasthmatic adolescents living in a poor region in the Northeast of Brazil. Allergol Immunopathol (Madr). 2009;37(5):239-43.
14. Baldaçara RP, Fernandes M de F, Baldaçara L, Aun WT, Mello JF, Pires MC. Prevalence of allergen sensitization, most important allergens and factors associated with atopy in children. Sao Paulo Med J. 2013;131(5):301-8.
15. Galvão CES, Graudenz GS, KalilI J, Castro FFM. Sensitization to cat allergen and its association with respiratory allergies: crosssectional study. Sao Paulo Med J. 2017;135(5):488-90.
16. Maniglia SF, Tsuru FM, Santos VC, Ueda DM. Sensitization Profile to Allergens in Patients Using Multi-Test II. Int Arch Otorhinolaryngol. 2014;18:391-7.
17. Naspitz CK, Solé D, Jacob CA, Sarinho E, Soares FJ, Dantas V, et al. Sensitization to inhalant and food allergens in Brazilian atopic children by in vitro total and specific IgE assay. Allergy Project- PROAL. J Pediatr (Rio J). 2004;80(3):203-10.
18. Aranda CS, Cocco RR, Pierotti FF, Mallozi MC, Franco JM, Porto A, et al. Increased sensitization to several allergens over a 12-year period in Brazilian children. Pediatr Allergy Immunol. 2018;29(3):321-4.
19. Bonnet B, Messaoudi K, Jacomet F, Michaud E, Fauquert JL, Caillaud D, et al. An update on molecular cat allergens: Fel d 1 and what else? Chapter 1: Fel d 1, the major cat allergen. Allergy Asthma Clin Immunol. 2018;14(1):14.
20. WHO/IUIS Allergen Nomenclature Sub‐Committee. Allergen Nomenclature: Fel d 1. Disponível em: http://www.allergen.org/viewallergen.php?aid=319. Acessado em: outubro/2019.
21. Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, et al. EAACI Molecular Allergology User's Guide. Pediatr Allergy Immunol. 2016;27(Suppl 23):1-250.
22. Nilsson OB, van Hage M, Gronlund H. Mammalian-derived respiratory allergens - implications for diagnosis and therapy of individuals allergic to furry animals. Methods. 2014;66:86-95.
23. Suzuki S, Nwaru BI, Ekerljung L, Sjölander S, Mincheva R, Rönmark EP, et al. Characterization of sensitization to furry animal allergen components in an adult population. Clin Exp Allergy. 2019;49:495-505.
24. Käck U, Asarnoj A, Grönlund H, Borres MP, van Hage M, Lilja G, et al. Molecular allergy diagnostics refine characterization of children sensitized to dog dander. J Allergy Clin Immunol. 2018;142(4):1113-20.
25. Butt A, Rashid D, Lockey RF. Do hypoallergenic cats and dogs exist? Ann Allergy Asthma Immunol. 2012;108:74-6.
26. Platts-Mills T, Vervloet D, Thomas W, Aalberse R, Chapman M. Indoor allergens and asthma: report of the Third International Workshop. J Allergy Clin Immunol. 1997;100:S2-S24.
27. Portnoy J, Kennedy K, Sublett J, Phipatanakul W, Matsui E, Barnes C, et al. Environmental assessment and exposure control: a practice parameter-furry animals. Ann Allergy Asthma Immunol. 2012;108:223.e1-15.
28. Bastien BC, Gardner C, Satyaraj E. Influence of time and phenotype on salivary Fel d 1 in domestic short hair cats. J Feline Med Surg. 2019;21(10):867-74.
29. Morris DO. Human allergy to environmental pet danders: a public health perspective. Vet Derm. 2010;21:441-9.
30. Jalil-Colome J, de Andrade AD, Birnbaum J, Casanova D, Mège JL, Lanteaume A, et al. Sex difference in Fel d 1 allergen production. J Allergy Clin Immunol. 1996;98:165-8.
31. Wood RA, Chapman MD, Adkinson NF Jr, Eggleston PA. The effect of cat removal on allergen content in household-dust samples. J Allergy Clin Immunol. 1989;83(4):730-4.
32. Kelly SM, Karsh J, Marcelo J, Boeckh D, Stepner N, Santone B, et al. Fel d 1 and Fel d 4 levels in cat fur, saliva and urine. J Allergy Clin Immunol. 2018;142:1990-2.
33. Zahradnik E, Raulf M. Respiratory allergens from furred mammals: environmental and occupational exposure. Vet Sci. 2017;4:38.
34. Grant T, Rule AM, Koehler K, Wood RA, Matsui EC. Sampling devices for indoor allergen exposure: pros and cons. Curr Allergy Asthma Rep. 2019;19:9.
35. Sander I, Lotz A, Neumann HD, Czibor C, Flagge A, Zahradnik E, et al. Indoor allergen levels in settled airborne dust are higher in day‐care centers than at home. Allergy. 2018;73(6):1263-75.
36. Esty B, Phipatanakul W. School exposure and asthma. Ann Allergy Asthma Immunol. 2018;120(5):482-7.
37. Rullo VE, Rizzo MC, Arruda LK, Solé D, Naspitz CK. Daycare centers and schools as sources of exposure to mites, cockroach, and endotoxin in the city of São Paulo, Brazil. J Allergy Clin Immunol. 2002;110(4):582-8.
38. Permaul P, Hoffman E, Fu C, Sheehan W, Baxi S, Gaffin J, et al. Allergens in urban schools and homes of children with asthma. Pediatr Allergy Immunol. 2012;23(6):543-9.
39. Almqvist C, Wickman M, Perfetti L, Berglind N, Renström A, Hedrén M, et al. Worsening of asthma in children allergic to cats, after indirect exposure to cat at school. Am J Respir Crit Care Med. 2001;163:694-8.
40. Tranter DC. Indoor allergens in settled school dust: a review of findings and significant factors. Clin Exp Allergy. 2005;35(2):126-36.
41. Gelber LE, Seltzer LH, Bouzoukis JK, Pollart SM, Chapman MD, Platts-Mills TA. Sensitization and exposure to indoor allergens as risk factors for asthma among patients presenting to hospital. Am Rev Respir Dis. 1993;147(3):573-8.
42. Ingram JM, Sporik R, Rose G, Honsinger R, Chapman MD, Platts- Mills TA. Quantitative assessment of exposure to dog (Can f 1) and cat (Fel d 1) allergens: relation to sensitization and asthma among children living in Los Alamos, New Mexico. J Allergy Clin Immunol. 1995;96(4):449-56.
43. Almqvist C, Garden F, Kemp AS, Quiang L, Crisafulli D, Tovey ER, et al. Effects of early cat or dog ownership on sensitisation and asthma in a high-risk cohort without disease-related modification of exposure. Paediatr Perinat Epidemiol. 2010;24(2):171-8.
44. Lodge CJ, Allen KJ, Lowe AJ, Hill DJ, Hosking CS, Abramson MJ, et al. Perinatal cat and dog exposure and the risk of asthma and allergy in the urban environment: a systematic review of longitudinal studies. Clin Dev Immunol. 2012;2012:176484.
45. Collin SM, Granell R, Westgarth C, Murray J, Paul E, Sterne JA, et al. Pet ownership is associated with increased risk of non-atopic asthma and reduced risk of atopy in childhood: findings from a UK birth cohort. Clin Exp Allergy. 2015;45:200-10.
46. Gaffin JM, Phipatanakul W. The role of indoor allergens in the development of asthma. Curr Opin Allergy Clin Immunol. 2009;9(2):128-35.
47. Park YB, Mo EK, Lee JY, Kim JH, Kim CH, Hyun IG, et al. Association between pet ownership and the sensitization to pet allergens in adults with various allergic diseases. Allergy Asthma Immunol Res. 2013;5:295-300.
48. Pyrhonen K, Nayha S, Laara E. Dog and cat exposure and respective pet allergy in early childhood. Pediatr Allergy Immunol. 2015;26:247-55.
49. Schafer T, Stieger B, Polzius R, Krauspe A. Associations between cat keeping, allergen exposure, allergic sensitization and atopic diseases: results from the Children of Lubeck Allergy and Environment Study (KLAUS). Pediatr Allergy Immunol. 2009;20(4):353-7.
50. Moncayo AL, Vaca M, Oviedo G, Erazo S, Qinzo I, Fiaccone RL, et al. Risk factors for atopic and non-atopic asthma in a rural area of Ecuador. Thorax. 2010;65(5):409-16.
51. Freitas MS, Monteiro JCS, Camelo-Nunes IC, Solé D. Prevalence of Asthma Symptoms and Associated Factors in Schoolchildren from Brazilian Amazon Islands. J Asthma. 2012;49(6):600-5.
52. Gent JF, Belanger K, Triche EW, Bracken MB, Beckett WS, Leaderer BP. Association of pediatric asthma severity with exposure to common household dust allergens. Environ Res. 2009;109(6):768-74.
53. Asarnoj A, Hamsten C, Wadén K, Lupinek C, Andersson N, Kull I, et al. Sensitization to cat and dog allergen molecules in childhood and prediction of symptoms of cat and dog allergy in adolescence: A BAMSE/MeDALL study. J Allergy Clin Immunol. 2016;137(3):813-21.
54. Rona RJ, Vargas C, Vianna EO, Bustos P, Bettiol H, Amigo H, et al. Impact of specific sensitization on asthma and rhinitis in young Brazilian and Chilean adults. Clin Exp Allergy. 2008;38(11):1778-86.
55. Hentges F, Leonard C, Arumugam K, Hilger C. Immune responses to inhalant Mammalian allergens. Front Immunol. 2014;5:234. 56. Nilsson OB, Binnmyr J, Zoltowska A, Saarne T, van Hage M, Gronlund H. Characterization of the dog lipocalin allergen Can f 6: the role in cross-reactivity with cat and horse. Allergy. 2012;67:751-7.
57. Basagana M, Bartolome B, Pastor C, Torres F, Alonso R, Vivanco F, et al. Allergy to human seminal fluid: cross-reactivity with dog dander. J Allergy Clin Immunol. 2008;121:233-9.
58. Bjerg A, Winberg A, Berthold M, Mattsson L, Borres MP, Ronmark E. A population‐based study of animal component sensitization, asthma, and rhinitis in schoolchildren. Pediatr Allergy Immunol. 2015;26(6):557-63.
59. Nwaru BI, Suzuki S, Ekerljung L, Sjölander S, Mincheva R, Rönmark EP, et al. Furry animal allergen component sensitization and clinical outcomes in adult asthma and rhinitis. J Allergy Clin Immunol Pract. 2019;7(4):1230-8.
60. Konradsen JR, Nordlund B, Onell A, Borres MP, Gronlund H, Hedlin G. Severe childhood asthma and allergy to furry animals: refined assessment using molecular‐based allergy diagnostics. Pediatr Allergy Immunol. 2014;25(2):187-92.
61. Martinez A, Martinez J, Sanz ML, Bartolom. B, Palacios R. Dander is the best epithelial source for dog allergenic extract preparations. Allergy. 1994;49:664-7.
62. Curin M, Reininger R, Swoboda I, Focke M, Valenta R, Spitzauer S. Skin prick test extracts for dog allergy diagnosis show considerable variations regarding the content of major and minor dog allergens. Int Arch Allergy Immunol. 2011;154:258-63.
63. Valenta R, Lidholm J, Niederberger V, Hayek B, Kraft D, Grönlund H. The recombinant allergen-based concept of component-resolved diagnostics and immunotherapy (CRD and CRIT). Clin Exp Allergy. 1999;29:896-904.
64. Liccardi G, Bilo MB, Manzi F, Piccolo A, Di Maro E, Salzillo A. What could be the role of molecular-based allergy diagnostics in detecting the risk of developing allergic sensitization to furry animals? Eur Ann Allergy Clin Immunol. 2015;47:163-7.
65. Lodge CJ, Allen KJ, Lowe AJ, Hill DJ, Hosking CS, Abramson MJ, et al. Perinatal cat and dog exposure and the risk of asthma and allergy in the urban environment: a systematic review of longitudinal studies. Clin Dev Immunol. 2012;2012:176484.
66. Scadding GW, Eifan A, Penagos M, Dumitru A, Switzer A, McMahon O, et al. Local and systemic effects of cat allergen nasal provocation. Clin Exp Allergy. 2015;45:613-23.
67. Perfetti L, Hebert J, Lapalme Y, Ghezzo H, Gautrin D, Malo JL. Changes in IgE-mediated allergy to ubiquitous inhalants after removal from or diminution of exposure to the agent causing occupational asthma. Clin Exp Allergy. 1998;28:66-73.
68. Adinoff AD, Rosloniec DM, McCall LL, Nelson HS. Immediate skin test reactivity to Food and Drug Administration-approved standardized extracts. J Allergy Clin Immunol. 1990;86:766-74.
69. Gleeson M, Cripps AW, Hensley MJ, Wlodarczyk JH, Henry RL, Clancy RL. A clinical evaluation in children of the Pharmacia ImmunoCAP system for inhalant allergens. Clin Exp Allergy. 1996;26:697-702.
70. Rondón C, Campo P, Togias A, Fokkens WJ, Durham SR, Powe DG, et al. Local allergic rhinitis: concept, pathophysiology, and management. J Allergy Clin Immunol. 2012;129:1460-7.
71. Kilburn S, Lasserson TJ, McKean M. Pet allergen control measures for allergic asthma in children and adults. Cochrane Database Syst Rev. 2003:CD002989.
72. Vredegoor DW, Willemse T, Chapman MD, Heederik DJ, Krop EJ. Can f 1 levels in hair and homes of different dog breeds: lack of evidence to describe any dog breed as hypoallergenic. J Allergy Clin Immunol. 2012;130:904-9.
73. Crocker DD, Kinyota S, Dumitru GG, Ligon CB, Herman EJ, Ferdinands JM, et al. Effectiveness of home-based, multi-trigger, multicomponent interventions with an environmental focus for reducing asthma morbidity: a community guide systematic review. Am J Prev Med. 2011;41:S5-32.
74. Custovic A, Green R, Fletcher A, Smith A, Pickering CA, Chapman MD, et al. Aerodynamic properties of the major dog allergen Can f 1: distribution in homes, concentration, and particle size of allergen in the air. Am J Respir Crit Care Med. 1997;155:94-8.
75. Wood RA, Johnson EF, Van Natta ML, Chen PH, Eggleston PA. A placebo-controlled trial of a HEPA air cleaner in the treatment of cat allergy. Am J Respir Crit Care Med. 1998;158:115-20.
76. Krouse HJ. Environmental controls and avoidance measures. Int Forum Allergy Rhinol. 2014;4 Suppl 2:S32-34.
77. Barnes CS, Kennedy K, Johnson L, Forrest E, Gard L, Pacheco F, et al. Use of dilute sodium hypochlorite spray and home cleaning to reduce indoor allergen levels and improve asthma health parameters. Ann Allergy Asthma Immunol. 2008;101:551-2.
78. Hodson T, Custovic A, Simpson A, Chapman M, Woodcock A, Green R. Washing the dog reduces dog allergen levels, but the dog needs to be washed twice a week. J Allergy Clin Immunol. 1999;103:581-5.
79. Ichikawa K, Iwasaki E, Baba M, Chapman MD. High prevalence of sensitization to cat allergen among Japanese children with asthma, living without cats. Clin Exp Allergy. 1999;29:754-61.
80. Luczynska CM, Li Y, Chapman MD, Platts-Mills TA. Airborne concentrations and particle size distribution of allergen derived from domestic cats (Felis domesticus). Measurements using cascade impactor, liquid impinger, and a two-site monoclonal antibody assay for Fel d I. Am Rev Respir Dis. 1990;141:361-7.
81. Matsuoka T, Shamji MH, Durham SR. Allergen immunotherapy and tolerance. Allergol Int. 2013;62:403-13.
82. Sundin B, Lilja G, Graff-Lonnevig V, Hedlin G, Heilborn H, Norrlind K, et al. Immunotherapy with partially purified and standardized animal dander extracts. I. Clinical results from a double-blind study on patients with animal dander asthma. J Allergy Clin Immunol. 1986;77:478-87.
83. Varney VA, Edwards J, Tabbah K, Brewster H, Mavroleon G, Frew AJ. Clinical efficacy of specific immunotherapy to cat dander: a doubleblind placebo-controlled trial. Clin Exp Allergy. 1997;27:860-7.
84. Alvarez-Cuesta E, Cuesta-Herranz J, Puyana-Ruiz J, Cuesta- Herranz C, Blanco-Quiros A. Monoclonal antibody-standardized cat extract immunotherapy: risk-benefit effects from a double-blind placebo study. J Allergy Clin Immunol. 1994;93:556-66.
85. Ewbank PA, Murray J, Sanders K, Curran-Everett D, Dreskin S, Nelson HS. A double-blind, placebo-controlled immunotherapy dose-response study with standardized cat extract. J Allergy Clin Immunol. 2003;111:155-61.
86. Nanda A, O'Connor M, Anand M, Dreskin SC, Zhang L, Hines B, et al. Dose dependence and time course of the immunologic response to administration of standardized cat allergen extract. J Allergy Clin Immunol. 2004;114:1339-44.
87. Bertelsen A, Andersen JB, Christensen J, Ingemann L, Kristensen T, Ostergaard PA. Immunotherapy with dog and cat extracts in children. Allergy. 1989;44:330-5.
88. Alvarez-Cuesta E, Berges-Gimeno P, Gonzalez-Mancebo E, Fernandez-Caldas E, Cuesta-Herranz J, Casanovas M. Sublingual immunotherapy with a standardized cat dander extract: evaluation of efficacy in a double-blind placebo controlled study. Allergy. 2007;62:810-17.
89. Human-Animal bond research initiative. The pet effect 2018. [site na Internet]. Disponível em: https://habri.org/the-pet-effect. Acessado em: novembro/2019.
90. Satyaraj E, Wedner H, Bousquet J. Keep the cat, change the care pathway: a transformational approach to maning Fel d 1, the major cat allergen. Allergy. 2019;74 (Suppl 107):5-17.
91. Satyaraj E, Li Q, Sun P, Sherrill S. Anti-fel d1 immunoglobulin Y antibody-contaning egg ingredient lowers allergen levels in cat saliva. J Fel Med Surg. 2019;1-7.
92. Satyaraj E, Gardner C, Filipi I, Cramer K, Sherrill M. Reduction of active Fel d1 from cats using an antiFel d1 egg IgY antibody. Immun Inflamm Dis. 2019;7:68-73.
93. Matulka R, Thompson L, Corley D. Multi-level safety studies of anti Fel d 1 IgY ingredient in cat food. Front Vet Sci. 2020;6:477.
94. Wedner H, Satyaraj E, Gardner C. Pilot study to determine the effect of feeding cat food made with egg product containing anti-Fel d 1 antibodies to cats on human allergy symptoms (Abstract TP1327). Allergy. 2019;74 (Suppl 106):690.