Número Atual: Janeiro-Março 2020 - Volume 4 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
ARTIGO ESPECIAL
Guia prático de abordagem da criança e do adolescente com asma grave: Documento conjunto da Associação Brasileira de Alergia e Imunologia e Sociedade Brasileira de Pediatria
Practical guide to approaching children and adolescents with severe asthma: a joint document of the Brazilian Association of Allergy and Immunology and the Brazilian Society of Pediatrics
Herberto J. Chong-Neto1,2,3, Gustavo F. Wandalsen1,2,4, Antonio C. Pastorino1,2,5, Caroline Dela Bianca2,6, Débora C. Chong-Silva1,3, Carlos A. Riedi1,3, José Dirceu Ribeiro1,7, Nelson A. Rosário1,2,3, Fábio C. Kuschnir1,2,8, Emanuel C. Sarinho1,2,6, Neusa F. Wandalsen2,9, Fernanda C. Lanza2,10, Adriana A. Antunes1,2,6, Maria de Fátima P. March1,11, Renato Kfouri1,12, Luciana R. Silva1,13, Flávio Sano2, Dirceu Solé1,2,4
1. Sociedade Brasileira de Pediatria - SBP
2. Associação Brasileira de Alergia e Imunologia - ASBAI
3. Unversidade Federal do Paraná - UFPR
4. Universidade Federal de São Paulo - UNIFESP
5. Universidade de São Paulo - USP
6. Universidade Federal de Pernambuco - UFPE
7. Universidade de Campinas - UNICAMP
8. Universidade do Estado do Rio de Janeiro - UERJ
9. Faculdade de Medicina do ABC - FMABC
10. Universidade Federal de Minas Gerais - UFMG
11. Universidade Federal do Rio de Janeiro - UFRJ, e Universidade Federal Fluminense - UFF
12. Sociedade Brasileira de Imunizações - SBIm
13. Universidade Federal da Bahia - UFBA
Endereço para correspondência:
Herberto J. Chong-Neto
E-mail: h.chong@uol.com.br
Submetido em: 06/01/2020
Aceito em: 15/01/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Asma grave é a asma que requer tratamento com altas doses de corticosteroide inalado associado a um segundo medicamento de controle (e/ou corticosteroide sistêmico) para impedir que se torne "descontrolada" ou permaneça "descontrolada" apesar do tratamento. Asma grave é considerada um subtipo de asma de difícil tratamento. A prevalência em crianças evidenciada pelo International Study of Asthma and Allergies in Childhood variou entre 3,8% e 6,9%. Existem diversos instrumentos para avaliação subjetiva, como diários de sintomas e questionários, bem como para avaliação objetiva com função pulmonar e avaliação da inflamação por escarro induzido, ou óxido nítrico exalado. A abordagem terapêutica varia desde doses altas de corticosteroide inalado e/ou oral, broncodilatadores de longa duração, antaganonistas de receptores muscarínicos, até os mais recentes imunobiológicos que bloqueiam a IgE ou IL-5.
Descritores: Criança, asma grave, imunobiológicos.
I - CONSIDERAÇÕES GERAIS
Definição e epidemiologia
Força-tarefa da American Thoracic Society e da European Respiratory Society definiu asma grave como a asma que requer tratamento com altas doses de corticosteroide inalado (CI), associado a um segundo medicamento de controle (e/ ou corticosteroide sistêmico), para impedir que se torne "descontrolada" ou permaneça "descontrolada" apesar do tratamento1. A maioria das crianças com asma atinge o controle dos sintomas com doses baixas a médias de CI; no entanto, há um grupo pequeno, mas significativo, de crianças com asma grave que necessita de doses maiores de CI com um medicamento controlador adicional para manter o controle dos sintomas ou permanecem descontroladas, apesar dessa terapia2.
Asma grave é considerada um subtipo de asma de difícil tratamento. Significa a asma que não está controlada, apesar da adesão à terapia otimizada máxima e tratamento de fatores contribuintes, ou que piora quando o tratamento com altas doses é reduzido1.
Segundo o International Study of Asthma and Allergies in Childhood (ISAAC), a prevalência global de asma grave em adolescentes é de 6,9%, variando de 3,8% na Ásia Pacífico, Norte e Leste da Europa a 11,3% na América do Norte3. Atualmente, a asma afeta 8,6% das crianças menores de 18 anos nos Estados Unidos4.
As crianças com asma grave apresentam maior risco de resultados adversos, incluindo efeitos colaterais relacionados a medicamentos, exacerbações com risco de vida e qualidade de vida prejudicada5. O impacto econômico da asma grave nos Estados Unidos é significativo, e gerou em 2007 o custo de US$ 56 bilhões6, sendo 50% desse valor devido a custos indiretos, como consultas médicas, hospitalizações, medicações e dias perdidos na escola e no trabalho7. Maior comprometimento da asma em crianças tem sido associado a maior custo. O custo total anual da asma grave é duas vezes maior que o com asma mal controlada, parcialmente controlada ou bem controlada8. Entre as crianças de 5 a 17 anos, a asma é uma das causas mais comuns de perda de aulas, comprometimento do desempenho acadêmico, assim como da participação em atividades relacionadas à escola9,10. O menor controle da asma infantil tem sido associado à menor qualidade de vida do cuidador11.
Análise de escolares (6-17 anos) do Programa Nacional de Pesquisa em Asma Grave (SARP) do National Heart, Lung and Blood Institute entre 2001 e 2011, descobriu que, de modo semelhante aos adultos com asma grave, as crianças apresentam alta carga de sintomas de asma, e têm maior probabilidade de procurar atendimento médico para exacerbações agudas. Além disso, quase 30% das crianças com asma grave na SARP relataram história de intubação ao longo da vida e insuficiência respiratória fatal, sugerindo que as crianças apresentavam alto risco de morbidade por asma7.
Avaliação do controle da asma
O controle da asma é avaliado por história clínica detalhada incluindo a frequência dos sintomas, alterações no sono, limitação das atividades e utilização de medicação de resgate nas últimas quatro semanas. A adesão ao tratamento, bem como técnica inalatória e existência de comorbidades, devem ser verificados periodicamente2. Os consensos internacionais para tratamento da asma enfatizam a importância de se avaliar o controle da asma, tanto quanto a sua gravidade, a fim de direcionar as definições terapêuticas2.
Asma controlada é definida como o estágio da doença em que os sintomas diminuem ou mesmo desaparecem após o tratamento12. São descritos dois componentes de controle de asma: controle dos sintomas, e riscos futuros. O controle de sintomas se refere aos sintomas diurnos e noturnos (tosse, chiado, dispneia, limitação às atividades físicas), utilização de medicação de resgate (beta2-agonistas de curta ação) para o tratamento dos sintomas e comprometimento das atividades rotineiras (brincadeiras, sono, absenteísmo escolar), manutenção da função pulmonar normal ou quase normal2. Os riscos futuros incluem a prevenção das exacerbações graves (necessidade de hospitalizações, idas à emergência e/ou corticoterapia sistêmica) com algum prejuízo da função pulmonar e efeitos colaterais das medicações utilizadas no tratamento2.
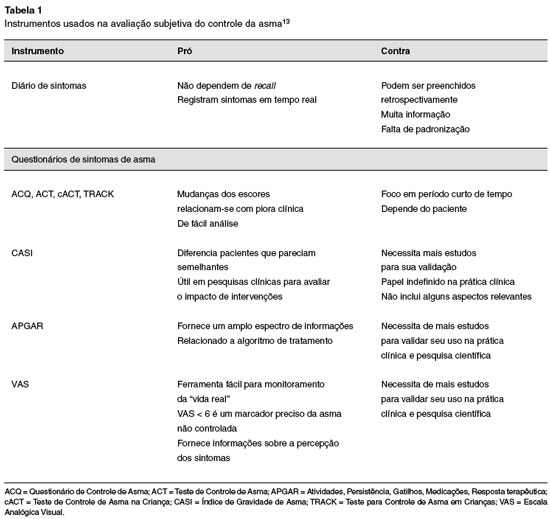
O monitoramento do paciente com asma pode ser realizado por medidas subjetivas, como diário de sintomas, questionários baseados em escores clínicos e mesmo medidas objetivas, incluindo espirometria, teste de hiper-reatividade brônquica e biomarcadores inflamatórios presentes nas vias aéreas13.
A Tabela 1 reúne alguns dos instrumentos validados para o monitoramento da asma da criança e do adolescente14-17.
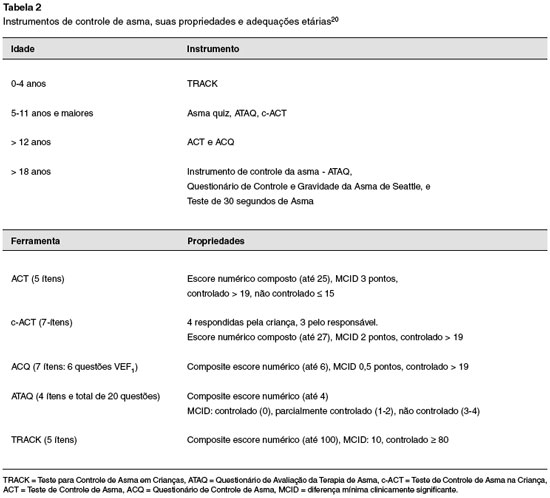
Os instrumentos mais utilizados na prática clínica são o Teste de Controle de Asma (ACT), o Questionário de Controle de Asma (ACQ) e o Teste de Controle de Asma Pediátrico (c-ACT)12. Cada um tem particularidades tais como idade do avaliado, intervalo de avaliação, número e pontuação de cada quesito, quem é o avaliado (criança ou responsável), consumo de medicação, valor de parâmetro de função pulmonar, entre outros14-19.
A Tabela 2 reúne as principais características dos instrumentos mais utilizados para o controle da asma, com suas respectivas adequações etárias20. O baixo controle da asma, verificados por esses escores numéricos, estão associados a redução da função pulmonar e aumento da fração exalada de óxido nítrico20. Os estudos mostram que as mudanças nesses escores refletem as mudanças clínicas observadas e a consequente necessidade de evoluir na programação terapêutica21.
Apesar de validados, esses escores compartilham desvantagens que limitam sua utilidade na prática clínica20. Embora seu curto período de tempo facilite a lembrança dos eventos recentes, eles falham em representar as flutuações deste controle. Crianças podem estar muito bem controladas em um momento, e na estação seguinte ter pouco controle. Além disso, exacerbações do quadro de asma podem ocorrer em crianças com controle de curto prazo21. As exacerbações correspondem a um importante componente do domínio de comprometimento do controle da asma, não são contemplados pelo ACT21, c-ACT22, e ACQ23, porém são checados no TRACK24 e no Índice de Gravidade de Asma22.
Diagnóstico diferencial
O diagnóstico de asma muitas vezes é um desafio, especialmente quando os pacientes apresentam sintomas atípicos. Portanto, é importante conhecer os diagnósticos diferenciais de asma de modo amplo. Deve-se ter alto índice de suspeita, principalmente quando os pacientes não respondem à terapia convencional25,26.
As doenças que mimetizam asma em crianças e adolescentes e que podem cursar com sibilância recorrente e simular o diagnóstico de asma incluem: bronquiolite obliterante, fibrose cística, aspiração de corpos estranhos, discinesia ciliar primária, deficiência de alfa 1 antitripsina, doenças cardíacas congênitas, tuberculose, obstruções de vias aéreas altas, síndrome de pânico e bronquiectasias25. Situações em que o diagnóstico de asma grave pode ser mascarado: categorias de doença pulmonar a considerar frente ao diagnóstico diferencial27,28 (Figura 1).
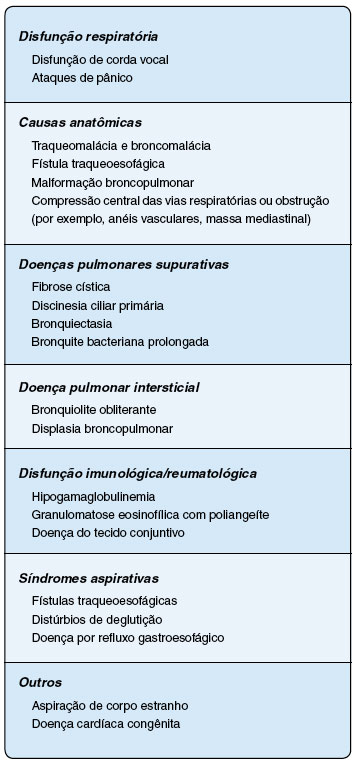
Figura 1 Principais diagnósticos diferenciais para asma na criança
A Tabela 3 mostra alguns fatores a serem considerados no diagnóstico diferencial de asma grave e a conduta inicial básica a ser tomada29.
Comorbidades são altamente prevalentes e pioram o controle da asma grave. Por isso, o seu manejo adequado é uma etapa fundamental para a evolução favorável da asma grave, e faz parte da ação de diagnóstico diferencial.
Recentemente sugeriu-se nova abordagem do diagnóstico diferencial de asma grave, a saber 30:
1. Comorbidades de alta prevalência na asma grave: síndrome da apneia obstrutiva do sono (SAOS); rinite alérgica, doença do refluxo gastro esofágico (DRGE), obesidade, Asthma CPOD Overlap Syndrome (ACOS);
2. Doenças associadas à asma grave: aspergilose brocopulmonar alérgica (ABPA), sensibilidade à aspirina, broncoespasmo induzido por exercícios, granulomatose eosinofílica;
3. Doenças que mimetizam asma: doenças pulmonares obstrutivas crônicas, fibrose cística, discinesia ciliar, malformações pulmonares, tuberculose, bronquiolite obliterante, síndrome do pânico, etc.
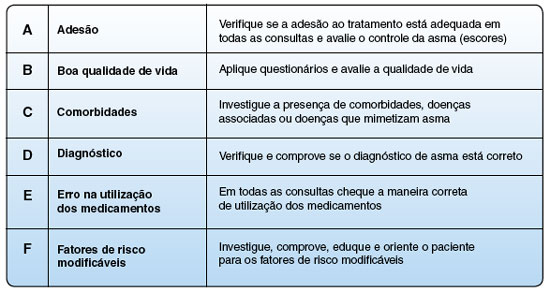
Por isso, antes de buscar diagnósticos diferenciais de asma grave procure intensivamente verificar se o paciente está adequadamente ajustado e comprovado para as variáveis relacionadas à asma grave (Regra do abecedário A,B,C,D,E e F), descritas na Figura 2.
Em conclusão:
1) O diagnóstico diferencial de asma grave demanda o conhecimento de sua definição e de seus vários genótipos e endótipos;
2) O diagnóstico correto de asma, a adesão ao tratamento, comorbidades associadas, uso correto dos medicamentos e o conhecimento de fatores de risco controláveis (psicológicos e ambientais) são os marcadores e as vigas mestras mais importantes para o conhecimento, diagnóstico diferencial e manejo das várias apresentações da asma grave. O manejo adequado destes ítens permitirá um diagnóstico robusto, a definição sobre a necessidade ou não de busca de diagnósticos alternativos, e uma boa qualidade de vida aos pacientes com asma grave;
3) Outras doenças que se apresentam com sibilância recorrente ou insuficiência respiratória obstrutiva crônica, mimetizando asma, podem fazer parte do diagnostico diferencial da asma grave e devem ser motivo de busca quando não se consegue o diagnóstico efetivo de asma.
Avaliação da função pulmonar
Diferente do que se observa no adulto, a criança com asma grave pode apresentar valores de função pulmonar (FP) próximos do normal31. Espirometrias realizadas em pacientes com asma grave de difícil controle, fora das exacerbações, mostraram discretas alterações obstrutivas e em muitos casos estava normal. Uma explicação pode estar na história natural da doença ou no fato de crianças com asma grave refratárias ao tratamento apresentarem labilidade excessiva do tônus broncomotor31. Isso não nos tranquiliza em relação às alterações histopatológicas, como o remodelamento brônquico, que podem surgir na idade pré-escolar, se concretizando na idade escolar e adolescência, segundo estudos que realizaram biópsias transbrônquicas, mesmo em pacientes que apresentavam FP normal32,33.
Este mesmo grupo estudou 96 crianças com asma e 35% demonstraram obstrução à primeira espirometria e em 8% dos casos a função pulmonar não normalizou com o tratamento com corticosteroide oral (10 dias) associado a broncodilatador. Mesmo sendo um grupo pequeno, o perfil daqueles cuja FP não normalizou apontou para asmáticos moderados e graves, atópicos e com história prévia de bronquiolite viral aguda31.
Estudo com crianças com faixa etária semelhante e diagnóstico de asma grave, mostrou que 50,8% delas apresentaram valores de volume expiratório forçado no primeiro segundo (VEF1) e da relação VEF1/CFV (capacidade vital forçada) menores que 80% do previsto34. Neste estudo medidas espirométricas subsequentes foram obtidas em grupos tratados com budesonida inalada em doses superiores e inferiores a 800 µg/dia. Não houve diferenças do VEF1, relação VEF1/CVF e do fluxo expiratório forçado entre 25 e 75% da CVF (FEF25-75%) segundo a dose de budesonida recebida34. Tais dados apontam para o fato de doses altas de corticosteroide inalado (CI) não prevenirem a redução da função pulmonar em crianças com asma grave. O FEF25-75% manteve-se em platô precoce, que era esperado em fase mais tardia da vida35,36.
A medida reduzida do FEF25-75% tem sido um indicador sensível da doença das pequenas vias aéreas e tem-se mostrado útil na identificação de asma persistente e de asma de difícil controle entre pacientes com sintomas persistentes e os com sintomas transitórios. Há indicações de que valores baixos de FEF25-75% na infância seriam preditivos de asma na vida adulta, diferentemente do VEF135,36.
A avaliação da resposta ao broncodilatador (BD) pode ser um instrumento válido na avaliação da função pulmonar em crianças com asma grave. A ausência de resposta ao broncodilatador identifica asmáticos com baixa função pulmonar basal e controle inadequado. Estudo que avaliou coortes de crianças com asma grave (média idade = 11,8 ± 3,0 anos) e não grave (média idade = 11,3 ± 3,1 anos) mostrou que ter asma grave, ser exposto à fumaça de cigarro, ter níveis mais altos de óxido nítrico exalado (FeNO), níveis elevados de IgE e quantidades baixas de neutrófilos sanguíneos periféricos indicam o grupo de crianças com maior probabilidade de reversibilidade da obstrução ao fluxo aéreo após broncodilatação máxima37. Apesar da resposta ao BD ter sido maior, no grupo asma grave, a melhor medida do VEF1 permaneceu menor que a das crianças com asma leve a moderada, além disso, a limitação do fluxo aéreo, definida como uma redução no VEF1/CVF, melhorou após broncodilatação em ambos os participantes (asma grave e não grave), mas foi significativamente maior no grupo asma grave37.
Este dado interessa, uma vez que estudos anteriores apontaram a resposta à broncodilatação máxima como associada à frequência maior de exacerbações e hospitalizações por asma, bem como pior função pulmonar e controle da asma após um ano de acompanhamento38.
O diagnóstico da asma grave no pré-escolar é um desafio, e requer o entendimento do impacto das infecções virais e de diferentes fatores genéticos e ambientais na origem da doença. Utilizar a função pulmonar para este diagnóstico é um desafio ainda maior. O uso da FP em lactentes e pré-escolares é limitado pelas dificuldades técnicas, e, diante disso, tem tido pouco impacto no manejo e diagnóstico da asma na prática médica por ser realizada apenas em poucos centros de pesquisa, necessitar de sedação e equipamentos caros e sofisticados, com equipe altamente especializada39.
A oscilometria de impulso (IOS) é uma técnica simples e não invasiva que avalia a função pulmonar durante a respiração corrente, sem necessidade da realização de manobras respiratórias, por isso tem sido considerada uma técnica interessante de se empregar em crianças na idade pré-escolar. A IOS permite mensurar a impedância pulmonar e seus componentes (resistência [R] e reactância [X]) em diferentes frequências (5 a 20 Hz). Nas crianças com asma observa-se um padrão obstrutivo, com aumento de R5 e da frequência de ressonância [Fres] e R5-20, além de redução de X5 (valores mais negativos)39. Considera-se resposta positiva ao broncodilatador quando há redução nos valores de R5 entre 25% e 35%.
Estudo onde foi realizado IOS em pré-escolares mostrou que um terço dos que sibilaram no último ano tinham IOS alterada. Houve tendência de aumento de R5-R20 (p = 0,07) entre os asmáticos mais graves. A resposta após broncodilatador foi significantemente maior nos com pior função pulmonar, nos pacientes com sibilos no primeiro ano de vida, nos que internaram, e nos meninos. Entre os parâmetros avaliados pela IOS, o R5 associou a diversos marcadores de gravidade clínica40.
Apesar de desafiador, a avaliação pulmonar é relevante nas crianças com asma, especialmente naquelas com quadros graves e de difícil controle. Estudos têm buscado o melhor marcador funcional para determinar a gravidade, a resposta ao tratamento e o prognóstico destas crianças. As medidas do FEF25-75% permanentemente baixos e a resposta significativa ao broncodilatador parecem ser achados de crianças com asma grave. O aumento da resistência das vias aéreas totais (valores de R5 Hz) é visto na IOS de pré-escolares com asma grave.
Avaliação da inflamação
Sangue periférico
É consenso que compreender a inflamação da asma impacta de forma contundente no tratamento e controle da doença. É bem aceito que um desequilíbrio das citocinas desempenhe um papel vital na asma41,42.
O estudo do perfil de interleucinas (IL) de crianças com asma moderada à grave, comparado ao de controles saudáveis, buscou a associação dos níveis de IL-4, IL-6 e IL-12, do subconjunto de células T, imunossupressão de eritrócitos e função pulmonar antes e após tratamento hospitalar padronizado41. Este estudo demonstrou que, após o tratamento, houve redução significante dos níveis de IL-4, IL-6 e de imunossupressão de eritrócitos com aumento dos de IL-12, CD4 e CD8 entre os com asma. Assim, concluiu-se que os níveis de IL-4 e do complexo imune de eritrócitos, além da relação VEF1/CVF e Pico de Fluxo Expiratório (EPFR) baixos, se correlacionam positivamente e se comportam como fatores de risco isolados para resposta ao tratamento da asma moderada-grave41.
O estudo da expressão de células mononucleares (PBMC) em sangue periférico de crianças com asma grave, comparadas a controles saudáveis, estimuladas com lipopolissacarídeo bacteriano (LPS), documentou que os PBMC daquelas produzem quantidades menores de IL-12 e maiores de IL-17 (pró-inflamatória) e de IL-10 (regulatória)42.Concluiu-se que os asmáticos graves apresentam redução de citocinas importantes para uma resposta imunológica adequada, como a IL-12, o que corrobora com a hipótese de que a asma e provavelmente outras doenças atópicas apresentem hiporregulação herdada do eixo IFN-γ / IL-12, levando à resposta Th1 defeituosa e consequente predisposição à exacerbação relativa da resposta Th242.
Buscou-se correlacionar o perfil inflamatório sanguíneo com o encontrado em lavado broncoalveolar em crianças com asma grave refratária a tratamento43. As avaliações mostraram que a eosinofilia no sangue foi associada à eosinofilia das vias aéreas, no entanto, os níveis normais de eosinófilos no sangue não excluíram a inflamação eosinofílica das vias aéreas, e que a contagem periférica não foi confiável para caracterizar a inflamação das vias aéreas em crianças asmáticas graves expostas a altas doses de esteroides44.
Escarro induzido
O escarro induzido tem sido um método útil para identificar fenótipos e endótipos de asma grave, e cada vez mais aplicado na população pediátrica.
Quando buscou-se relacionar o predomínio de eosinófilos no escarro e a gravidade da asma, comparando asmáticos graves controlados e não controlados (resistentes ao tratamento - AGRT), notou-se que o padrão inflamatório eosinofílico foi predominante nos dois grupos de pacientes, entretanto, o grupo AGRT apresentou porcentagem proporcionalmente maior de neutrófilos no escarro, comparados aos asmáticos graves controlados45. Além da citologia, o estudo pesquisou níveis de IL no sobrenadante e verificou que os níveis de IL-10, GM-CSF, INFγ e TNFα no escarro foram significativamente maiores no grupo AGRT, em comparação ao grupo controlado, e o GM-CSF e o TNF-α apresentaram relação inversa com o controle, sinalizando que estas citocinas possam funcionar como biomarcadores de asma grave resistente ao tratamento em crianças e adolescentes46.
Com relação à citologia do escarro, os dados têm sido variáveis, a depender do fenotipo da asma. Tratamento com CI por três meses seguiu-se por redução importante do número de eosinófilos no escarro induzido45.
Estudo avaliou citologia de escarro induzido de crianças com asma e verificou predomínio do padrão eosinofílico em 53,8% delas, seguido do paucigranulocítico (26,9%), misto (15,4%) e neutrofílico (3,8%)46. Ao estudar a relação com o controle da asma, percebeu-se predomínio de crianças assintomáticas (controle total) no grupo com padrão de escarro eosinofílico, sendo percebido somente em três crianças no padrão paucigranulocítico e em nenhuma criança nos padrões neutrofílico e misto, corroborando com a ideia de menor resposta ao tratamento com CI nos fenótipos não eosinofílicos. A positividade ao TCA e a presença de obstrução à espirometria não mostrou diferenças entre os grupos46.
Fração de Óxido Nítrico Exalado
Estudos têm buscado estabelecer possível relação entre os valores de fração exalada de óxido nítrico (FeNO) com os do VEF1 e o grau de controle da asma em crianças e adolescentes com asma, em uso regular ou não de CI47. Houve associação entre os valores de VEF1 e o grau de controle da asma em todos os pacientes analisados, independentemente do uso de CI, mas não houve associação entre os valores de VEF1 e os níveis de FeNO, concluindo que a correlação observada entre o controle e o VEF1 reforça a importância da espirometria no seguimento clínico desses pacientes. Apesar destes achados, a dosagem de FeNO pode constituir um método precoce para detectar inflamação nas vias aéreas, antes mesmo dos sintomas e das alterações espirométricas47.
Estudo avaliou relação entre os níveis de FeNO, contagem de eosinófilos no sangue, função pulmonar, hiper-responsividade brônquica (BHR) e o controle da asma em crianças e adolecentes com asma48. O aumento do FeNO, simultaneamente ao aumento da contagem de eosinófilos sanguíneos apresentaram prevalência mais alta de asma não controlada pelo ACT, quando comparados aos com eosinofilia isolada. Essa diferença permaneceu significativa em situação inversa em indivíduos com níveis aumentados de FeNO e contagem normal de eosinófilos no sangue, concluindo que marcadores da inflamação do tipo 2, associados, estavam relacionados a maior probabilidade de BHR e asma não controlada nesta coorte48.
Definir a inflamação na asma da criança e correlacioná-la com a gravidade e o controle da doença, mesmo diante das limitações para a aplicação prática, deve ser buscada, especialmente objetivando o tratamento personalizado. Além dos marcadores de inflamação no sangue periférico já conhecidos, definir o perfil inflamatório no escarro induzido tem se mostrado interessante e cada vez mais acessível, mesmo em crianças.
A avaliação destes marcadores associados, bem como a correlação com as medidas de função pulmonar, parecem ser armas determinantes para a abordagem terapêutica efetiva da asma grave na infância.
Comorbidades
A asma grave em crianças e adolescentes está associada a diferentes comorbidades que podem exacerbar seus sintomas e resultar em controle inadequado da doença (Tabela 4). A avaliação desses transtornos deve ser considerada antes da modificação do escalonamento terapêutico da asma.

Obesidade
Asma e obesidade têm prevalência elevada na infância e adolescência, e estudos longitudinais indicam que a obesidade é um fator de risco para o desenvolvimento da asma49,50.A associação entre obesidade e asma é complexa, e diferentes mecanismos têm sido propostos para explicar a relação causal entre ambas, tais como: fatores genéticos, inflamação sistêmica, anormalidades nas vias aéreas e da mecânica pulmonar, tipo de dieta e desequilíbrios nutricionais, alterações no microbioma intestinal e das vias aéreas, além de maior suscetibilidade a poluentes ambientais51,52.
Atualmente, dois principais fenótipos da chamada "asma obesa" na infância e adolescência têm sido reconhecidos. O primeiro, de início mais precoce, corresponde à maioria das crianças obesas com asma, e é caracterizado por alérgicos com o típico padrão inflamatório Th2, de predomínio eosínofílico, que desenvolveram obesidade posteriormente à asma, complicando seu controle53,54. O segundo, de início mais tardio, é composto principalmente por não atópicos, e é mais frequente no sexo feminino55. Este subgrupo de asmáticos apresenta características diferenciadas de função pulmonar, com valores elevados do VEF1 e da CVF, menor relação VEF1/CVF, além de hiper-responsividade brônquica exacerbada, níveis baixos de FeNO e poucos eosinófilos no escarro53,54. Em contraste com o fenótipo anterior, o perfil inflamatório das vias aéreas é predominantemente Th1, em função da ação pró-inflamatória dos macrófagos do tecido adiposo, com aumento dos níveis plasmáticos de citocinas como TNF-α, IL-6 e adipocinas, como a leptina, produzidas pelos adipócitos, levando ao desenvolvimento de inflamação sistêmica e, como consequência deste processo, à asma56.
Mais recentemente, tem sido observada a associação entre asma e as alterações metabólicas da obesidade, como a resistência insulínica, hiperglicemia e a hipertensão arterial, já presentes em faixas etárias mais jovens, que podem ocorrer independentemente do índice de massa corporal. Nestes casos, a disfunção oxidativa do epitélio brônquico e a inflamação sistêmica relacionada à síndrome metabólica parecem contribuir para a patogênese da asma57,58.
Crianças obesas tendem a ter asma de maior gravidade, risco aumentado de exacerbações graves, e podem apresentar uma resposta reduzida aos corticosteroides inalatórios, e como consequência, pobre controle da doença e pior qualidade de vida59-61. É importante ressaltar que a falta de condicionamento físico relacionado à obesidade pode levar à dispneia e limitação do exercício, e comorbidades como a apneia obstrutiva do sono e doença do refluxo gastroesofageano, mais frequentes em obesos, podem causar sintomas respiratórios que imitam a asma. Coletivamente, estes achados podem acarretar em diagnóstico incorreto ou na falsa avaliação da gravidade da asma62,63. As atuais diretrizes indicam que a perda de peso, o exercício e a reabilitação pulmonar podem desempenhar papel importante na abordagem da asma obesa. A meta de perda de peso deve ser superior a 10% para que um impacto clinicamente significativo sobre a asma seja alcançado2,64.
Doença do refluxo gastroesofageano
Diferentes estudos têm demonstrado prevalência de até 60% de refluxo gastroesofageano (RGE), identificado por phmetria esofágica, em crianças com asma. Entretanto, uma relação de causalidade entre as duas condições ainda é objeto de debate65,66. Parcela significativa destes pacientes é assintomática, e até o momento, não está estabelecido se a doença do RGE (DRGE) prejudica o controle da asma67.
Os poucos ensaios clínicos controlados sobre o tratamento da DRGE não demonstraram melhora substancial na diminuição do uso de corticosteroides inalados, melhora da função pulmonar e da qualidade de vida nestes pacientes68-70.
Um aspecto desafiador desta associação em crianças é o fato de ambas as doenças apresentarem sintomas comuns, como tosse noturna, aperto e dor no peito, com prejuízo do sono. Em consequência disso, é provável que médicos prescrevam indevidamente medicamentos para DRGE para pacientes com asma e medicações para asma, especialmente, broncodilatadores de curta ação para pacientes com DRGE. Deste modo, em pacientes com asma de difícil tratamento, pode estar indicada uma avaliação diagnóstica para DRGE, uma vez que o diagnóstico apenas pela história pode ser dificultado pela sobreposição de sintomas67.
Em função das poucas evidências de seu benefício sobre o controle/gravidade da asma, e do risco em longo prazo associado ao uso de inibidores de bomba de prótons, o tratamento de RGE em crianças com asma deve ser limitado àqueles com diagnóstico bem definido e com sintomas não responsivos às mudanças do estilo de vida e da dieta71.
Disfunção das cordas vocais
A disfunção das cordas vocais (DCV), ou o movimento paradoxal das cordas vocais, é definida como a adução involuntária das cordas vocais durante a inspiração. A prevalência de DCV na população geral é estimada em 4% a 6% com predominância do sexo feminino de até 3:172. A DCV induzida pelo exercício ocorre com maior frequência em adolescentes e adultos jovens, e estudos em população pediátrica mostraram que cerca de 75% das crianças com DCV tinham mais de 13 anos73,74.
Embora seja mais comum em adolescentes, DCV pode ocorrer também em escolares. Os principais sintomas incluem aperto na garganta ("sensação de sufocamento"), estridor, que é frequentemente confundido com sibilos, e falta de ar extrema de início e término rápidos. O exercício é o gatilho mais comum, porém a presença de irritantes laríngeos, como a DRGE, a drenagem pós-nasal, odores fortes e fatores emocionais podem desencadear o quadro75.
A DCV pode ocorrer isoladamente, representando importante diagnóstico diferencial de asma mal controlada e de broncoespasmo induzido pelo exercício (BIE), ou coexistir com a asma. Estudo com crianças americanas entre 8 e 18 anos com DCV, mostrou que 44% haviam sido rotuladas erroneamente como tendo asma76. Indivíduos adultos diagnosticados com asma e DCV concomitantes apresentaram maior frequência de sintomas e exercícios como gatilho, em comparação com aqueles com DCV isoladamente. Além disso, os primeiros realizaram mais atendimentos de emergência, exames de imagem e receberam mais cursos de esteroides orais e inalados em comparação com pacientes com DCV isolada77.
Além da história clínica, o diagnóstico diferencial entre asma e DCV pode ser baseado na aplicação de questionários específicos; pela ausência de resposta aos beta2-agonistas e aos corticosteroides; pela presença de curva de fluxo-volume achatada ou irregular na inspiração ou ins/expiração na espirometria; na presença de estridor durante o teste de provocação para BIE ou pela observação direta da adução das cordas vocais durante a inspiração à laringoscopia, considerado o padrão-ouro78,79.
O tratamento consiste em abordagem multifacetada, que inclui terapia fonoaudiológica, tratamento de comorbidades médicas e psicológicas, além do reconhecimento e prevenção de gatilhos80.
Distúrbios respiratórios do sono (apneia obstrutiva do sono)
Distúrbios respiratórios do sono (DRS) é um termo amplo, que abrange a síndrome de apneia obstrutiva do sono (AOS), distúrbios de hipoventilação, além de dessaturações intermitentes com ronco. O padrão-ouro diagnóstico de AOS é definido pela presença à polissonografia (PSG) de índice de distúrbios respiratórios obstrutivos (IDR) por hora igual ou maior do que 5, associado aos seguintes sintomas: sono não reparador, sonolência diurna, fadiga, insônia, despertar com sensação ofegante ou de asfixia, roncos altos ou apneias testemunhadas, ou 15 eventos/hora de IDR mesmo na ausência de sintomas81.
A sua prevalência na infância é estimada entre 1% e 5%, sendo mais frequente no sexo masculino, e apresenta como principais fatores de risco o sobrepeso/obesidade, a obstrução das vias aéreas superiores por hipertrofia das amígdalas e adenoides, a presença de rinite alérgica (RA) e anomalidades craniofaciais e genéticas. Embora a associação entre inflamação sistêmica e AOS seja bem conhecida nos adultos, em crianças esta relação ainda não está bem estabelecida82.
A asma e AOS geralmente coexistem, e apresentam sobreposição significativa de sintomas noturnos, o que pode complicar o reconhecimento e o tratamento de ambos os processos. Além disso, é difícil dissociar os seus sintomas de outras comorbidades como a DRGE, RA e obesidade relacionadas tanto à asma como à AOS83,84. Estudos na faixa pediátrica mostraram que crianças com asma apresentam duas vezes mais chance de manifestarem sintomas de AOS85. Adicionalmente, crianças com DRS apresentam prevalência significativamente maior de asma grave e de problemas comportamentais86,87.
Embora a relação entre o tratamento da AOS e a melhora no controle da asma na infância necessite de mais estudos, em crianças e adolescentes com asma grave não controlada, especialmente com sintomas noturnos exacerbados, é recomendada a investigação de AOS. A realização de PSG noturna deve ser considerada se o índice de suspeita for alto. Intervenções terapêuticas precoces, médicas ou cirúrgicas, podem ser benéficas neste grupo de asmáticos graves com evidência de OSA confirmada pela PSG84.
Rinite alérgica
Estudos epidemiológicos têm comprovado que a RA é um fator de risco independente para o desenvolvimento de asma. Até 80% dos pacientes asmáticos têm RA, e de um modo geral os sintomas nasais precedem o desenvolvimento dos sintomas pulmonares88. A RA persistente em crianças também está associada ao aumento da hiper-responsividade brônquica e ao comprometimento da função pulmonar89,90. Além disso, a RA demonstrou aumentar a FeNO, sugerindo aumento da inflamação das vias aéreas inferiores91,92.
Estudos transversais realizados com crianças com asma, supostamente controlada pelo uso de corticosteroides inalatórios, a presença de RA influenciou negativamente o controle da asma, e aumentou de modo significativo o uso de serviços de emergência e o absenteísmo escolar93-95.
A semelhança entre os fatores genéticos, desencadeantes ambientais, células e respectivos mediadores envolvidos em ambas as doenças respaldam o conceito de "Vias Aéreas Unidas". Deste modo, esforços preventivos e terapêuticos visando combater as duas doenças são considerados a melhor abordagem desta comorbidade alérgica96.
Rinossinusite crônica
A rinossinusite crônica (RSC) é uma condição inflamatória dos seios paranasais que, engloba duas apresentações clínicas principais, clinicamente distintas: rinossinusite crônica sem polipose nasal (RSCsPN), mais comum, e a rinossinusite crônica com polipose nasal (RSCcPN), mais rara, porém frequentemente associada à asma mais grave97.
A RSC é doença heterogênea que pode ser causada por infecção, inflamação alérgica e/ou processos anatômicos, ou estar associada a processos específicos, como a doença respiratória exacerbada pela aspirina (DREA), caracterizada pela tríade clínica de asma de difícil controle, RSCcPN e intolerância a medicamentos que inibem a enzima ciclooxigenase 198.
Em adultos, aproximadamente de 20 a 30% dos pacientes com RSC apresentam asma concomitante, prevalência quatro vezes maior do que a da população em geral99. Entre pacientes com asma grave a taxa de RSC pode ser de até 80%. Tem sido demonstrado que o tratamento da RSC melhora os sintomas da asma, sugerindo uma expressão fisiopatológica comum a essas condições100. Entretanto, em crianças e adolescentes esta associação não é tão evidente, e alguns fenótipos de RSC, como a DREA, são incomuns nesta faixa etária.
A sinusite crônica pode se apresentar com sintomas nasais mais persistentes, sem febre, e como já citado, associada ao agravamento dos sintomas e/ ou pior controle da asma. Na presença deste quadro clínico, é importante abordar possível doença sinusal subjacente, e o seu tratamento pode envolver antibióticos, lavagens nasais salinas e corticosteroides tópicos nasais97,101.
Fatores psicossociais
Indivíduos com doenças psiquiátricas, disfunções mentais, depressão e problemas de ordem psicossocial que apresentam asma grave ou mal controlada parecem mais propensos ao não seguimento do tratamento, e tal atitude tem sido associada à morte por asma. Estes fatores são considerados pelas principais diretrizes de manejo da doença como de alto risco para asma fatal entre adolescentes2.
É necessário que se esclareça à família, à escola e aos próprios adolescentes em que ocasiões o apoio psicoterápico poderá contribuir efetivamente no tratamento da asma. Deve-se considerar esta abordagem principalmente naqueles casos em que haja doenças psiquiátricas e psicossomáticas entre os pais, idas frequentes ao serviço de emergência, adoção do papel de doente pelo paciente, faltas frequentes às aulas e diminuição das atividades sociais, além de uso excessivo de medicamentos102.
A melhor adesão à medicação é importante para o tratamento e controle geral da asma. A utilização de planos de ação da asma mostra efeitos benéficos na adesão e do controle da asma em alguns estudos103,104. Para o êxito desta abordagem é necessária uma estreita e contínua interação entre o médico, o adolescente asmático e sua família.
Outras comorbidades
Várias outras condições podem contribuir para uma maior gravidade da asma e são bem reconhecidas em adultos com asma e por vezes podem ser relevantes em crianças e adolescentes. Entre elas destacam-se a aspergilose broncopulmonar alérgica105,106 e fatores endócrinos, especialmente aqueles relacionados ao sexo feminino107.
II - ABORDAGEM TERAPÊUTICA
Corticosteroides inalados em altas doses
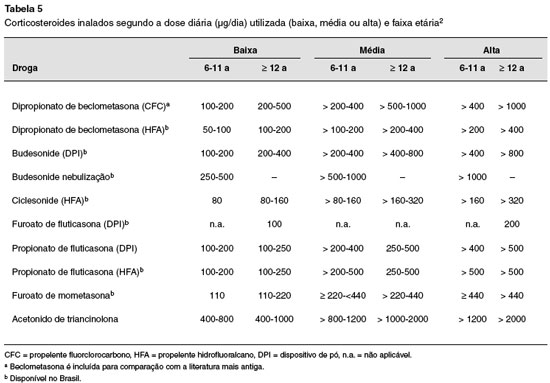
Os CI são a primeira linha e o tratamento mais efetivo para crianças com asma persistente. Os efeitos benéficos dos CI já podem ser observados em doses baixas, e a evidência clara de relação dose-resposta, linear até determinado ponto, é observada com a faixa de doses avaliadas para fins regulatórios2. A Tabela 4 reúne os CI disponíveis na atualidade distribuídos segundo a dose e faixa etária2. A classificação em dose baixa, média e alta é baseada em publicações de estudos disponíveis incluindo comparações entre elas. As doses altas são arbitrárias, mas para muitos CI, são as que em uso prolongado são associadas a aumento de efeitos adversos sistêmicos108.
Embora sejam empregados em doses equipotentes, a eficácia e os eventos adversos dos diferentes CI são diversos. A biodisponibilidade sistêmica é uma das características farmacocinéticas e farmacodinâmicas que justifica o diferencial dos CI com relação à possibilidade de eventos adversos108. A ciclesonida é liberada como pró-droga, tem alta deposição na periferia pulmonar quando é ativada. A sua alta capacidade de ligação à proteína plasmática dificulta a possibilidade de eventos adversos, mesmo em doses elevadas109, diferentemente da beclometasona e budesonida que apresentam a menor afinidade de ligação e consequentemente permanecem livres na circulação com maiores chances de atuarem em outros alvos além do pulmão108.
Rouquidão e candidíase oral são os eventos adversos locais associados ao uso dos CI2,108, enquanto que a supressão do eixo hipotálamo-hipófise-adrenal (HHA), a diminuição da velocidade de crescimento, sobretudo em indivíduos pré-púberes110,111, e a alteração do metabolismo ósseo, são os os efeitos adversos sistêmicos mais relatados. As medidas de atividade do eixo HHA, como concentrações séricas de cortisol de 24 horas, e a excreção urinária de cortisol livre de 24 horas são métodos sensíveis de aferição do HHA. Estudos retrospectivos documentaram ser a frequência de supressão do eixo HHA inferior a 10% dos pacientes tratados, e a dose e o tempo de uso constituem os principais fatores de risco para essa observação, independentemente do produto utilizado110,111.
Com relação ao comprometimento da velocidade de crescimento, este ocorre de modo mais acentuado entre indivíduos pré-púberes109,112,113. Entretanto, revisão sistemática que avaliou crianças pré-púberes com asma grave expostas a altas doses de CI, por no mínimo um ano, documentou ausência de efeitos sobre o crescimento entre os que receberam ciclesonida, mometasona ou fluticasona113. Outra revisão apontou ser o retardo na velocidade de crescimento dessas crianças, após um ano de seguimento, de -0,48 cm/ano a -1,2 cm/ano, mas com pouca repercussão sobre a estatura adulta final112.
A ação dos CI sobre o metabolismo ósseo é controversa e tem sido avaliada pela interferência sobre a produção óssea (osteocalcina, fosfatase alcalina), a degradação óssea, a concentração de 25-hidroxicolecalciferol (25OH D), além do balanço cálcio-fósforo (cálcio, fósforo, paratormônio) em soro ou urina114.
Do ponto de vista prático, o monitoramento do crescimento é parâmetro útil no acompanhamento de crianças em tratamento com doses altas de CI (Tabela 5).
Antagonistas de receptores de leucotrienos
Os antagonistas dos receptores de leucotrienos - ARLT (montelucaste, pranlucaste e zafirlucaste) são antagonistas competitivos dos receptores dos leucotrienos cisteínicos, potentes e seletivos e são aprovados pelas guias de tratamento da asma115.
Os leucotrienos cisteínicos (LT) C4, D4 e E4 estão envolvidos na modulação da inflamação das vias aéreas e no seu remodelamento, por ação direta ou indireta, reforçando a cascata inflamatória das citocinas. A administração do montelucaste, único ARLT disponível para pacientes abaixo de 12 anos, suprimiu marcadores de remodelamento de vias aéreas no escarro induzido em crianças com asma leve, mas não foram observados efeitos significativos em pacientes com asma moderada e grave, e ainda não está estabelecido se eles são efetivos em atenuar o remodelamento das vias aéreas encontrado nos asmáticos crônicos116.
Segundo a GINA, os ARLT são justificados como terapia adicional, com a finalidade de melhorar a resposta clínica com redução dos efeitos sistêmicos dos corticosteroides, baseada ou não em fenótipos específicos2.
Para adolescentes com 12 anos ou mais e adultos, os ARLT são recomendados na etapa 3 em adição aos CI em baixas doses, como alternativa aos CI em doses médias ou aos CI em baixas doses associados aos LABA. Na etapa 4, os ARLT ou o tiotrópio adicionados aos CI em doses médias são recomendados como alternativa aos CI em doses altas ou CI em doses médias associado a LABA. Na etapa 5, estão indicados os CI em altas doses em associação aos LABA, devendo-se considerar os fenótipos para adicionar tiotrópio e imunobiológicos, e mesmo baixas doses de corticosteroide oral, sem referência aos ARLT. No caso de asmáticos obesos e associação com rinite alérgica, os ARLT são preferenciais2.
Para crianças de 6 a 11 anos, o esquema é semelhante, sendo os ARLT recomendados em adição aos CI associados aos LABA nas etapas 3 e 4, podendo nesta última serem substituídos pelo tiotrópio2.
Da mesma forma, os ARLT para crianças menores de 6 anos são recomendados como drogas adicionais aos CI isolados, em doses baixas, na etapa 3 e, em doses altas, na etapa 42.
Na abordagem da asma grave, a GINA propõe para adultos e adolescentes maiores de 12 anos, a inserção dos ARLT na etapa 3, adicionados à associação CI mais LABA. Esta etapa tem como finalidade a otimização do tratamento, e, caso a asma permaneça não controlada, estará confirmado o diagnóstico de asma grave (etapa 4). Na etapa 5, deverão ser considerados os fenótipos de asma grave, comorbidades e diagnósticos diferenciais. Se houver evidências de inflamação tipo 2, está indicada a terapêutica com biológicos, acrescentada às doses altas de CI (etapa 6a); não havendo disponibilidade para essa terapia, os ARLT estão indicados como medicamento adicional aos CI em altas doses, como alternativa aos LABA, tiotrópio e macrolídeos, ainda nesta etapa2.
Níveis de leucotrienos B4 (LTB4) estão aumentados em asmáticos graves, incluindo pacientes com inflamação neutrofílica ou paucigranulocítica, e, mais ainda, na inflamação eosinofílica. Estudos in vitro demonstraram aumento da expressão dos LTB4 em resposta a sinais de ativação, contribuindo para a gravidade da asma117. Foi documentado, por outro lado, que um antagonista do LTB4 atenuou significantemente a ativação neutrofílica no fluido de lavado broncoalveolar de asmáticos atópicos. Entretanto, apesar do aumento da expressão dos LTB4, seus antagonistas não demonstraram nenhum efeito benéfico no tratamento da asma118.
Estudo em crianças e adolescentes com asma moderada a grave, controladas com doses médias/ altas de CI associados a salmeterol não documentou efeito poupador de corticosteroides com a adição de Azitromicina ou do Montelucaste ao esquema de tratamento119.
Estudos que avaliam a adição dos ARLT aos CI em adolescentes com asma grave ou persistente são raros e incluídos em estudos com adultos. Revisão recente selecionou 37 estudos e concluiu que a adição de ARLT é benéfica na redução de exacerbações moderadas a graves, na melhora da função pulmonar e no controle da asma em adolescentes e adultos com asma persistente. Entretanto, não foi possível afirmar que a adição de ARLT é superior, inferior ou equivalente a doses altas de CI, assim como seu possível efeito poupador de CI120.
Resultados interessantes foram alcançados por estudo comparando montelucaste e tiotrópio quando adicionados ao tratamento com CI associado ao LABA em adultos com asma. Ambos foram efetivos no controle dos sintomas, melhora da função pulmonar e redução da taxa de exacerbações; a adição de montelucaste associou-se à redução da inflamação eosinofílica, com diminuição do FeNO e aumento no VEF1 sem redução no espessamento das paredes das vias aéreas; em contraste, a adição do tiotrópio não alterou o FeNO, devendo sua ação na melhora da função pulmonar à diminuição do espessamento das paredes das vias aéreas e diminuição do remodelamento121.
Macrolídeos
Há vários macrolídeos com propriedades farmacológicas semelhantes, entre as quais, ação antimicrobiana e anti-inflamatória122. Para crianças com infecções graves de vias aéreas inferiores, o uso precoce de azitromicina tem sido uma opção terapêutica, devido às suas propriedades anti-inflamatórias, antineutrofílicas123 e antivirais124. Foi documentado que os macrolídeos reduzem a replicação de rinovírus em células de pacientes com fibrose cística, aumentam a expressão do receptor padrão de reconhecimento induzido por rinovírus e os níveis de INFγ123.
Três estudos com azitromicina em pré-escolares com infecção viral mostraram os seguintes resultados: o primeiro, em crianças (12 a 71 meses) com história de infecções recorrentes graves de vias aéreas inferiores, o uso precoce de azitromicina comparado a placebo, reduziu em 36% a probabilidade de progressão para episódio grave, assim como a necessidade de beta-2 de curta duração. A presença de resposta (necessidade de corticosteroide sistêmico) foi independente do índice preditivo de asma125,126, e da detecção de vírus durante os episódios de exacerbação127.
No segundo estudo randômico e controlado, o uso de azitromicina durante 3 dias reduziu a mediana de duração dos episódios de sintomas semelhantes aos da asma em crianças (1 a 3 anos); de 3,4 dias no grupo azitromicina versus 7,7 dias no grupo placebo, o que sugere ter efeito no tratamento das exacerbações agudas. Maior efetividade foi observada se a azitromicina foi iniciada antes de seis dias (83% de redução) versus 36% se o início era mais tardio128. No entanto, outro estudo demonstrou que a azitromicina não foi efetiva para reduzir a duração dos sintomas respiratórios e o tempo para a primeira exacerbação após seis meses de tratamento em pré-escolares (12 a 60 meses) com sibilância aguda atendidas em serviço de emergência, independente se foi o primeiro episódio ou não de sibilância129.
O tratamento com azitromicina neste contexto deve ser reservado para crianças com infecções respiratórias com evolução mais grave, com necessidade de corticosteroide sistêmico, ou de atendimento de cuidados intensivos. Não deve ser recomendado para crianças com doença leve; além disso, se o tratamento não for efetivo, não deve ser mantido122.
Publicação da European Respiratory Society/American Thoracic Society (ERS/ATS) recomendava não usar macrolídeos em longo prazo em adultos e crianças com asma grave, de acordo com evidências científicas. Seguiu-se a essa publicação a de estudos com delineamento científico adequado em adultos130-134 e crianças133, que colocaram em cheque a conduta anterior. Recentemente publicou-se revisão sobre o uso de macrolídeo (azitromicina, claritromicina) em asma grave, em adultos e crianças135.
Nestes estudos, não houve consenso sobre a definição de asma persistente sintomática ou com controle, e os estudos não apresentam critérios de gravidade da ERS/ATS. Três foram realizados com azitromicina; destes, 529 participantes com doses de 250 a 500 mg, 3x por semana, durante 26 a 48 semanas130,131. Outro estudo com azitromicina132 avaliou 97 pacientes, utilizando a dose de 600 mg/dia por 3 dias, e depois 600 mg/semana por 11 semanas. A claritromicina, em estudo randômico com grupo controle, com 171 participantes, foi utilizada na dose de 600 mg 2x ao dia, durante 8 a 16 semanas133,134.
Crianças de 6 a 17 anos foram randomizadas para receber azitromicina 250 mg (25 a 40 kg) ou 500 mg (> 40 kg), em dose diária, ou montelucaste (5 a 10 mg) durante 12 meses. O objetivo primário foi o tempo para controle inadequado da asma após a redução da dose de budesonida inalatória. O estudo foi interrompido com 30 semanas, devido à falta de eficácia clínica119. Comparado ao placebo, durante 48 semanas de tratamento, azitromicina reduziu o número de exacerbações eventos/pacientes/ano (1,07 versus 1,87)131; além disso, houve melhora no tempo para a primeira exacerbação. Não houve diferença na frequência de exacerbações graves, tanto em crianças como em adultos. Em relação à função pulmonar (espirometria), não houve alteração nos valores de VEF1 pré- e pós-broncodilatador em percentual do previsto130-132. O uso de macrolídeos reduziu o número de exacerbações de asma, e este resultado foi observado ser semelhante em pacientes com ou sem eosinofilia131.
Quanto aos eventos adversos (pelo menos um evento, ou eventos adversos graves) não houve diferenças em comparação ao placebo, em adultos e crianças130-133. Embora os macrolídeos possam provocar diarreia, prolongar intervalo QT, levar à perda auditiva, estes efeitos não foram diferentes do observado no placebo. A resistência bacteriana a macrolídeos foi elevada para Streptococcus nasal e de orofaringe130, mas este achado não foi encontrado por outros131. Embora houvesse aumento de germes resistentes à azitromicina no escarro, neste grupo houve menor uso de antimicrobianos e de eventos adversos secundários a infecções131. Em pacientes adultos, com asma grave persistente, o uso de azitromicina prolongado reduziu de forma significativa a carga de H. influenzae, mas não de outras bactérias. A resistência aumentou, corroborando resultados anteriores136.
É recomendação da ERS/ATS tentar o tratamento com macrolídeo para reduzir exacerbações por asma em adultos no passo 5 (GINA/NAEPP) para aqueles que permanecem sintomáticos ou com as-ma não controlada apesar de tratamento adequado (evidência baixa), e não recomenda o uso crônico de macrolídeos em crianças e adolescentes com asma grave, não controlada (recomendação condicional, qualidade de evidência baixa)135.
Por outro lado, a GINA recomenda adicionar macrolídeo em doses baixas para pacientes que não respondem ao tratamento recomendado, reforçando ser essa uma recomendação off label e sugere que se avalie a relação entre riscos e benefícios2.
Em conclusão, o uso intermitente de macrolídeos no tratamento de crianças com episódios de sibilância com evolução grave pode ser considerado, e o tratamento deve ser mantido se houver resposta clínica. Em crianças e adolescentes com asma grave não controlada, sem resposta ao tratamento, o uso de macrolídeo (add on) pode ser uma alternativa de tratamento (off label ); sempre avaliar a resposta clínica. Em pacientes adultos com asma moderada grave não controlada, o uso de macrolídeo (add on) foi efetivo para reduzir exacerbações por asma, mas não há evidência de que possa ter efeito nas exacerbações graves ou hospitalizações. Não foram descritos eventos adversos graves em relação ao uso de macrolídeos que contraindiquem o seu uso.
Associação corticosteroide e agente beta2-agonista de longa duração
A maioria dos pacientes com asma da faixa etária pediátrica atinge o controle da doença usando as medicações recomendadas e necessita apenas do uso regular de medicações em doses baixas, para atingir esse objetivo. Estudos epidemiológicos demonstram que 3 a 10% de todos os asmáticos apresentam asma de difícil controle ou asma grave1,2,137.
Os agentes beta2-agonistas de duração longa (LABA, Salmeterol em 2000 e Formoterol em 2001) após aprovação pela Food and Drugs Administration (FDA) foram cercados de grande preocupação por seu uso isolado, por determinar maior descontrole da doença e consumo excessivo de agentes beta2agonistas de curta duração (SABA), e associar-se a aumento de mortes por exacerbações agudas. Tal fato gerou a inclusão de alerta em suas bulas, e em 2010, após vários outros estudos, a FDA recomendou seu uso apenas associado aos CI em doses fixas, especificamente para crianças maiores de 4 anos e adolescentes, e, sempre que possível, após o uso de CI isolado sem os efeitos esperados138.
A partir de 2006, a GINA recomendou o uso da associação CI+LABA como primeira escolha para pacientes maiores de 6 anos com asma não controlada quando o tratamento com doses médias de CI falharam em atingir o controle da asma. Além disso, foi introduzido, também, o conceito do uso da associação CI+LABA, em particular budesonida e formoterol, para tratamento de manutenção e para a crise, referendados em seguidas revisões Cochrane sobre estas ações139,140.
Revisão Cochrane de 2015 documentou o efeito benéfico da adição dos LABA aos CI em crianças com asma baseado em 28 estudos (6.381 crianças; 11 anos)141. As seguintes conclusões foram observadas nessa revisão: em crianças com asma persistente a adição de LABA aos CI não foi associada a redução significativa das crises com necessidade de corticosteroide oral, mas foi superior na melhora da função pulmonar comparada com a mesma dose ou doses altas de CI. Não houve diferenças quanto aos eventos adversos, com vantagem da associação permitir melhor ritmo de crescimento comparado ao de altas doses de CI141.
A segurança, as vantagens farmacoeconômicas, a simplicidade do uso e a melhora na adesão com o uso da associação CI+LABA foram evidenciados em revisões recentes e estudos com a terapia SMART (Symbicort maintenance and reliever therapy )142,143.
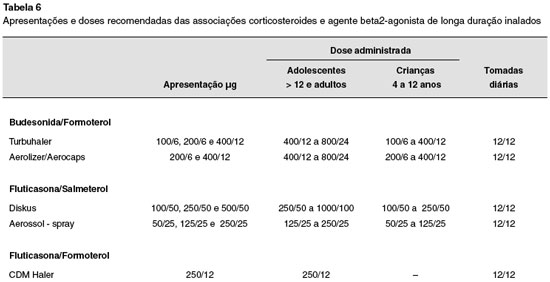
As diretrizes da GINA diferenciam a asma de difícil tratamento da asma grave, sendo essa última considerada um subtipo da asma de difícil tratamento que, apesar do máximo tratamento, adesão e controle das comorbidades, os pacientes continuam não controlados ou voltam a não estar controlados quando da redução do tratamento2. As doses máximas em bula das associações de CI+LABA estão descritos na Tabela 6.
Brometo de tiotrópio
O brometo de tiotrópio é um antagonista muscarínico de ação prolongada (LAMA) que já é utilizado no Brasil associado a CI, concomitantemente ou não a beta2-agonistas em adultos com DPOC desde 2003, e com asma grave desde 2015. É administrado com dispositivo próprio, Respimat, que gera tênue névoa. É um fármaco de elevada segurança, no entanto, são descritos efeitos adversos como exacerbação da asma, redução do peak flow (peak expiratory flow rate, PEFR), nasofaringite, e infecções respiratórias agudas144.
Revisão sobre o uso de tiotrópio em crianças e adolescentes (1 a 17 anos) com asma moderada e grave não controladas, apesar de CI e outros medicamentos, mostrou segurança e eficácia elevadas do fármaco associado a LABA. A utilização de uma dose diária de tiotrópio (5, 2,5 ou 1,25 µg) versus placebo evidenciou melhora da função pulmonar nos pacientes, medida pelo PEFR e do VEF1. Esta revisão ratificou a recomendação do uso do tiotrópio em crianças a partir dos 6 anos nos EUA145. Tais achados foram reforçados por revisão posterior, em que utilizou-se dose fixa diária de 2,5 µg146.
A diretriz GINA reconhece que em crianças maiores de 6 anos e em adolescentes a associação de CI e LABA seria a melhor opção para o tratamento da asma na Etapa 4 (etapa 4)2. No entanto, a combinação CI + tiotrópio propiciaria melhora discreta da função pulmonar e redução das exacerbações (nível de evidência A)147.
No Brasil, a Agência Nacional de Vigilância Sanitária (ANVISA) aprovou em 2018 o uso do tiotrópio Respimat (5 µg /dia) em crianças a partir dos seis anos com asma moderada não controlada com CI ou grave não controlada com CI+LABA, respectivamente.
Conclui-se que atualmente podemos considerar o tiotrópio uma opção de terapia coadjuvante ao CI ou CI+LABA para tratamento de asma grave em crianças a partir de 6 anos nas doses de 2,5 a 5 µg/dia, uma vez ao dia. Ressalta-se que o dispositivo Respimat® pode ser adaptado ao espaçador, quando indicado.
Imunobiológicos
Omalizumabe
O omalizumabe é o primeiro agente biológico desenvolvido. Um anticorpo anti-IgE humanizado aprovado para tratamento da asma atópica persistente em crianças com 6 anos ou mais, não controlada com doses altas de CI e outras medicações de manutenção. Foi demonstrado ter efeito poupador de corticosteroide, reduz o uso de medicação de resgate, melhora a função pulmonar (embora a magnitude não seja significativa) e a qualidade de vida dos pacientes. Existe evidências de que o omalizumabe sustenta estes efeitos por períodos de até um ano. Outras doenças como, por exemplo, urticária crônica, angioedema, mastocitose sistêmica, alergia ocular e dermatite atópica já foram tratadas com anti-IgE e com resultados favoráveis em alguns casos147-149.
A dose de omalizumabe a ser administrada é calculada pelo nível sérico de IgE total e o peso da criança (0,016 mg/kg de peso por UI de IgE/mL e por mês) e a sua aplicação é por via subcutânea150.
Revisão sistemática da literatura avaliou cinco estudos de vida real e três estudos randômicos e controlados, em crianças com 6 anos ou mais151. Omalizumabe melhorou a função pulmonar, o nível de controle da asma, reduziu de modo significante a dose de CI, resultou em menos hospitalizações e consultas não programadas a serviços de emergência151,152.
A administração de omalizumabe no retorno às aulas, no Hemisfério Norte, reduziu as exacerbações comuns no outono em crianças com asma, particularmente naquelas que tinham tido exacerbação recente. Isto pode ser interessante para os pacientes do Hemisfério Sul, que têm sibilância recorrente ou asma com maior frequência também nos meses de outono153.
Omalizumabe em geral é bem tolerado pela avaliação de estudos clínicos e farmacovigilância pós-marketing150,154,155. Indicado como medicação adicional, melhora o controle da asma alérgica persistente em pacientes com testes cutâneos alérgicos positivos ou IgE sérica específica para alérgenos inaláveis149,151.
A medicação não foi estudada em lactentes e, portanto, não deve ser usada off label de acordo com as diretrizes mais recentes. A sibilância nessa faixa etária em geral é relacionada à infecção respiratória viral, e não exposição a alérgenos. No entanto, níveis elevados de IgE sérica total podem ser observados nestas circunstâncias. É possível que a anti-IgE venha a ser empregada como agente preventivo de asma nestes lactentes que sibilam com infecções virais, que têm níveis elevados de IgE sérica e especialmente, com história familiar de asma2,123,156.
Mepolizumabe
A presença dos eosinófilos tem sido associada com a asma e as exacerbações da doença. Seu número está aumentado nas vias aéreas da maioria dos asmáticos, e este aumento tem sido relacionado à gravidade da mesma157,158.
A IL-5 é uma citocina específica envolvida no desenvolvimento e maturação dos eosinófilos, a partir de células precursoras presentes na medula óssea, no sangue e também participa na determinação da sobrevivência destas células nos tecidos. Sua expressão está aumentada nas vias aéreas dos asmáticos e tem sido relacionada à maior gravidade da doença e com a presença de eosinofilia das vias aéreas159.
Estas características levaram a se estudar o bloqueio terapêutico da IL-5 como um alvo potencial para o tratamento da asma. Dentre os diferentes tratamentos que visam o bloqueio da IL-5, o mepolizumabe e o reslizumabe objetivam impedir a ligação da IL-5 ao eosinófilo, enquanto o benralizumabe tem como alvo o próprio receptor de IL-5 no eosinófilo159.
Mepolizumabe é um anticorpo monoclonal humanizado (IgG1, kappa) que tem como alvo a IL-5, principal citocina responsável pelo crescimento, diferenciação, recrutamento, ativação e sobrevivência dos eosinófilos160. Aprovado, em 2015, pela Agência de Medicamentos Europeia (EMA) e pela Food and Drug Admnistration (FDA) para pacientes com asma grave eosinofílica, teve no Brasil sua autorização inicial para prescrição em adultos como tratamento complementar de asma grave eosinofílica não controlada152.
O mepolizumabe liga-se diretamente à IL-5, e assim impede a ligação desta à cadeia alfa do receptor de IL-5 presente em eosinófilos e basófilos153. Assim, inibe a sinalização intracelular da IL-5, reduz a produção, crescimento, diferenciação, recrutamento, ativação, maturação e sobrevivência dos eosinófilos161-163, além de diminuir a expressão dos receptores de IL-5 na superfície de eosinófilos e basófilos164. Ao bloqueio da IL-5 pelo mepolizumabe segue-se queda do número de eosinófilos no sangue periférico e no tecido. Efeitos clínicos foram mais significativos para pacientes com contagem sérica de eosinófilos entre 150 e 300 cel/mm3 1. Caso o paciente esteja em uso crônico de corticosteroide sistêmico, o ponto de corte seria igual ou maior a 150 cel/mm3.
O mepolizumabe foi aprovado como terapia adicional para pacientes com asma grave eosinofílica não controlada pela FDA (maiores de 12 anos) e a EMA (a partir dos 6 anos), em 2015. Recentemente, no Brasil foi liberado para uso em crianças maiores de 6 anos165.
O mepolizumabe é apresentado sob a forma de pó liofilizado para solução injetável (subcutânea), em embalagem com 1 frasco-ampola contendo 100 mg de mepolizumabe (100 mg/mL após a reconstituição)161. A mesma dose de mepolizumabe, administrada por via SC e IV, mostrou ter a biodisponibilidade da via SC variável entre 64% e 75% da IV, dependendo do local de aplicação. O tempo para atingir a concentração máxima de mepolizumabe com a formulação IV foi de aproximadamente meia hora, e consideravelmente mais longo quando administrado por via SC, podendo variar entre 2 a 14 dias166-168. No entanto, o perfil de eficácia e segurança de ambas as formulações foi comparável, conforme demonstrado no estudo DREAM169, assim a via SC foi a recomendada.
A dose de mepolizumabe (crianças = 40 mg e adultos = 100 mg) deve ser administrada por via SC a cada quatro semanas. A idade e o sexo não parecem afetar a concentração plasmática do mepolizumabe. Em pacientes de 65 anos ou mais e em pacientes com insuficiência renal ou hepática não é provável que haja necessidade de ajustes161.
Estudos não têm demonstrado risco aumentado de reações adversas com mepolizumabe. Entretanto, reações sistêmicas de hipersensibilidade, como anafilaxia, urticária, angioedema broncoespasmo, rash cutâneo e hipotensão podem ocorrer169.
Perspectivas de novos biológicos
Em relação aos novos horizontes da terapia da asma grave com produtos biológicos em crianças e adolescentes, até o momento, a anti-IL-4 e IL-13 é o único medicamento que atingiu evidências clínicas satisfatórias de eficácia e segurança170.
O dupilumabe é um anticorpo monoclonal humano recombinante do tipo IgG4 que bloqueia a ativação tanto dos receptores de IL-4, como de IL-13. Estas evidências foram observadas através dos resultados de dois ensaios clínicos (VENTURE e QUEST)171,172. Esses estudos multicêntricos examinaram 210 e 1902 pacientes, respectivamente; com idades acima de 12 anos, com asma moderada a grave não controlada ou dependente de esteroide. Os resultados mostraram que o dupilumabe é eficaz, melhorando o controle dos sintomas e a função respiratória.
Em 2018, o dupilumabe recebeu a aprovação da FDA para o tratamento complementar da asma moderada a grave em pacientes com 12 anos ou mais, com fenótipo eosinofílico ou asma dependente de corticosteroide sistêmico173; e em fevereiro de 2019, a EMA o aprovou para asma grave a partir dos 12 anos de idade, com eosinófilos sanguíneos e/ou FeNO elevados174. Está em andamento estudo (NCT03560466) em que o dupilumabe está sendo administrado a crianças com idade mais precoce, com asma moderada a grave175.
No tratamento da asma grave, uma opção terapêutica alternativa potencial e mais barata aos biológicos pode ser representada por medicamentos que atuem na inflamação das vias aéreas, como estabilizadores de mastócitos (por exemplo, pemirolast e tetomilast, um inibidor da fosfodiesterase4)176-178. No entanto, poucos estudos, limitados a adultos com asma ou doença pulmonar obstrutiva crônica, foram realizados.
Desta forma, mais estudos utilizando drogas biológicas ou não, são necessários para incrementar o arsenal terapêutico das crianças e adolescentes com asma grave170.
Corticosteroide oral
Os esteroides sistêmicos, administrados por via oral (CO), são utilizados de forma mais frequente na asma aguda grave por curto período de tempo, no máximo dez dias, e idealmente no máximo quatro vezes no ano179.
O emprego do CO como medicamento controlador por tempo prolongado na asma infantil deve ser evitado sempre que possível, contudo pode ser indicado de forma restrita como medida de exceção em crianças que, apesar do diagnóstico correto e adesão adequada ao seguir todas as estapas de tratamento, permanecem com quadro muito grave, o que representa uma proporção muito reduzida de pacientes pediátricos29.
Esta necessidade de CO pode ocorrer principalmente em alguns adolescentes que apresentam asma muito grave, mesmo quando se consegue adesão adequada e o diagnóstico correto encontra-se bem estabelecido, e como medida temporária de exceção, o uso de CO como medicamento preventivo na asma pode ser efetivo como medida extrema pela elevada frequência de eventos adversos1.
Entre os corticosteroides sistêmicos, temos: prednisona, prednisolona, metilprednisona e metilprednisolona (estas com capacidade de induzir retenção de sódio igual à da cortisona), dexametasona e betametasona (não retêm sódio, aumentam muito a glicemia), e deflazacorte. A dose deve ser a mínima efetiva possível, de no máximo 1-2 mg/kg/ dia, preferentemente pela manhã, respeitando o ritmo circadiano, e, se possivel, em dias alternados.
Para qualquer esteroide sistêmico, os efeitos colaterais sempre estão presentes, e a estratégia deve ser minimizá-los o mais rápido possível. Assim, é preferível utilizar o CO ao invés do de uso parenteral no tratamento preventivo da exacerbação da asma, pela possibilidade de ajuste de doses e esquemas terapêuticos. Assim, o emprego de corticosteroide de depósito é perigoso e iatrogênico. O CO apresenta menor efeito mineralocorticoide, tempo de meia-vida mais curto, menos efeito metabólico e menor efeito nocivo sobre o músculo estriado.
Antes de se iniciar o tratamento com corticosteroide sistêmico prolongado em paciente com asma, é fundamental que seja feita uma avaliação inicial minuciosa, que inclua anamnese, exame físico completo e abordagem laboratorial. Devem ser investigadas a história pregressa pessoal e familiar de diabete, hipertensão arterial sistêmica, dislipidemia, glaucoma, tuberculose e doenças imunossupressoras. Nessa ocasião, devem ser solicitados hemograma, ionograma, glicemia de jejum, perfil lipídico, PPD, radiografia de tórax e avaliação oftalmológica, além de ser feita aferição da pressão arterial e mensuração dos dados antropométricos do paciente.
O seguimento de longo prazo deve tentar rastrear precocemente as potenciais complicações desse tratamento. A pressão arterial, o peso e a altura do paciente devem ser aferidos em todas as consultas sequenciais. Orienta-se que os exames laboratoriais supracitados sejam repetidos em intervalos de três a seis meses, e a avaliação oftalmológica e a densitometria óssea semestralmente ou anualmente. Se o PPD for maior ou igual a cinco milímetros, ou se houver cicatriz à radiografia de tórax, iniciar profilaxia com isoniazida por seis meses.
Os pacientes devem ter cuidados de higiene corporal, manter uma alimentação saudável e balanceada a fim de manter bom estado nutricional, praticar atividades físicas, evitar contatos com pessoas doentes, não receber vacinas de vírus vivos e utilizar antibióticos precocemente aos primeiros sinais de infecção. Também seria importante a realização de tratamento anti-helmíntico, sendo a ivermectina a droga de escolha.
Para qualquer paciente em que se inicie tratamento com glicocorticoides e que haja previsão de manutenção por um período maior ou igual a três meses, deverá ser feita investigação quanto à possibilidade de fratura no futuro. Essa investigação inclui a pesquisa de outros fatores de risco concomitantes, como tabagismo, alcoolismo, história de quedas frequentes e baixo índice de massa corporal, bem como a realização de densitometria óssea e dosagem de vitamina D.
O tratamento com glicocorticoides deve ser retirado gradualmente a partir do momento em que se atinja o benefício terapêutico máximo. A diminuição da dose da medicação deve ser cuidadosa, a fim de evitar reativação da doença subjacente ou ocorrência de insuficiência adrenal, resultante da supressão do eixo hipotalâmico-hipofisário-adrenal. A insuficiência adrenal é mais comum nos pacientes em uso de prednisona 20 mg/dia ou dose equivalente por mais de três semanas.
A suspensão da medicação deve ser imediata nos casos de psicose induzida pelo corticosteroide sem resposta a antipsicóticos e nos casos de úlcera corneana de etiologia herpética.
Quando a medicação foi usada por menos de três semanas, independentemente da dose utilizada, o tratamento pode ser suspenso sem necessidade de desmame gradual. Existem vários esquemas diferentes de desmame, com doses diárias ou em dias alternados, porém não há evidência consistente que dê preferência a um deles em detrimento dos demais, o importante é acompanhar, orientar e ter cuidado com este paciente, tanto em relação ao agravemento da asma, quanto ao evento adverso decorrente da suspensão do cortiocosteroide sistêmico.
Dispositivos inalatórios
A via inalatória é a preferida para a tratamento da asma, pois possibilita início rápido de ação dos medicamentos, requer doses menores e reduz os efeitos sistêmicos, especialmente dos CI, em comparação com outras vias de administração2,156.
Vários dispositivos estão disponíveis para administração das medicações inaladas, e cada um deles apresenta vantagens e desvantagens que devem ser levadas em consideração ao prescrevê-los, sendo fundamental identificar a capacidade da criança ou do adolescente de utilizá-los corretamente. O uso inadequado dos dispositivos inalatórios é muito frequente, e as dificuldades técnicas necessitam ser abordadas rotineiramente para melhor aproveitamento da medicação.
São quatro os tipos de dispositivos inalatórios: (a) inaladores dosimetrados pressurizados (IDPs), que utilizam o hidrofluoralcano (HFA) como propelente; (b) inaladores de pó; (c) nebulizadores de jato ou nebulizadores ultrassônicos; e (d) nebulizadores de membrana vibratória2,156.
Visa-se com o uso dos dispositivos inalatórios a produção de aerossóis, soluções ou suspensões de partículas sólidas em um gás180, com a capacidade de se depositarem nas pequenas vias aéreas181.
A deposição pulmonar média dos aerossóis pode variar muito, dependendo do tipo de dispositivo utilizado, da técnica aplicada, das medicações utilizadas e do grau de obstrução das vias aéreas, partindo de menos de 10% e podendo alcançar até 60% da dose nominal, quando a técnica é adequada180.
A escolha do dispositivo deve ser individualizada e dinâmica, baseada no custo, facilidade de assimilação e manutenção da técnica de uso, assim como na avaliação criteriosa de fatores relacionados ao paciente, ao medicamento e ao próprio dispositivo183.
Em crianças maiores de 6 anos e adolescentes, o inalador de pó (IPo) e o inalador dosimetrado pressurizado (IDP) ou aerossol dosimetrado, geralmente são preferíveis à nebulização devido a sua maior efetividade na deposição pulmonar, menor custo e risco de efeitos colaterais, além de ser o de uso mais conveniente184.
Além das características de cada dispositivo inalatório, a técnica adequada é um dos principais fatores considerados no controle da doença, e deve sempre ser verificada em cada consulta do asmático grave pediátrico2,156.
Técnica do uso dos dispositivos inalatórios185
a) IDPs sem espaçador
- Retirar a tampa e agitar o dispositivo;
- Posicionar o IDP verticalmente e seu bocal a 3-5 cm da boca. Isso reduz a velocidade e o tamanho do aerossol (evaporação de gás), aumentando a deposição pulmonar, e reduz o risco de disparo no queixo e nariz;
- Manter a boca aberta (quando disparo for longe da boca) e expirar normalmente. (A expiração forçada pode provocar broncoespasmo e maior deposição em vias aéreas superiores);
- Acionar o dispositivo no início de inspiração lenta e profunda (< 30 L/min). Isso reduz o fluxo turbilhonado de ar e aumenta a deposição periférica do aerossol;
- Fazer pausa pós-inspiratória de, no mínimo, 10 segundos; e
- Repetir a técnica quando orientado, sem a necessidade de aguardar 30 segundos entre acionamentos.
b) IDP com espaçador
- Retirar a tampa do IDP e agitar o dispositivo;
- Acoplar o IDP ao espaçador e posicionar a saída do bocal verticalmente;
- Expirar normalmente e introduzir o bocal do espaçador na boca;
- Disparar o IDP e inspirar pela boca, lenta e profundamente (fluxo inspiratório < 30 L/min);
- Tampar o nariz para evitar inspiração nasal, evitar iniciar inspiração > 2 segundos após o disparo, pois isso reduz a deposição pulmonar;
- Fazer pausa pós-inspiratória de no mínimo 10 segundos; e
- Repetir todas as etapas anteriores para cada acionamento do IDP.
c) Inalador de Pó (DPI)
Para preparar a dose:
- Inaladores de cápsula: retirar ou suspender a tampa do DPI e colocar uma cápsula, em seguida perfurá-la, comprimindo os botões laterais ou o botão na frente, dependendo de cada tipo de dispositivo;
- Turbuhaler®: retirar a tampa, manter o DPI na vertical, girar a base colorida no sentido anti-horário e depois no sentido horário até escutar um clique. No primeiro uso: repetir estas etapas por três vezes antes de inalar pela primeira vez;
- Diskus®: rodar o disco no sentido anti-horário, em seguida, puxar a alavanca para baixo até escutar um clique.
Para o uso:
- Expirar normalmente e colocar o dispositivo na boca;
- Inspirar o mais rápido e profundo possível (fluxo inspiratório mínimo de 30 L/min);
- Fazer pausa pós-inspiratória de 10 segundos;
- No caso de DPI de cápsula, fazer nova inspiração, mais profunda que a anterior, caso reste pó na cápsula.
d) Nebulizadores a jato
- Diluir a dose de medicamento em 3-4 mL de solução de cloreto de sódio a 0,9% (soro fisiológico);
- Adaptar a máscara firmemente sobre a face (cobrindo a boca e o nariz);
- Ligar o compressor ou liberar o fluxo de oxigênio/ar comprimido (6-8 L/min). Atenção: compressores ineficazes e fonte de ar/oxigênio com fluxo < 5 L/min não geram aerossóis respiráveis (1-5 µ);
- Respirar de boca aberta em volume corrente;
- A nebulização não deve durar mais de 10 minutos.
e) Nebulizadores de membrana vibratória
- Diluir a dose de medicamento em 3-4 mL de solução de cloreto de sódio a 0,9% (soro fisiológico);
- Adaptar a máscara firmemente sobre a face (cobrindo a boca e o nariz);
- Ligar o aparelho, que é protátil, carregado com pilhas ou cabo USB;
- Respirar de boca aberta em volume corrente;
- Limpar o equipamento, seguindo as instruções do fabricante.
Tratamentos não-farmacológicos
Além do tratamento medicamentoso de crianças e adolescentes com asma grave, o tratamento não farmacológico é estratégia utilizada pela equipe multiprofissional como objetivo de melhorar a qualidade de vida do paciente2.
O principal objetivo do fisioterapeuta nesse contexto é melhorar a capacidade de fazer exercício e reduzir o descondicionamento físico186.
A intolerância ao exercício é sensação frequentemente referida pelos pacientes com asma grave. Os mecanismos que propiciam essa intolerância são: ventilação pulmonar ineficiente, alteração na troca gasosa e redução na capacidade do músculo em manter o metabolismo oxidativo (menor quantidade de fibras tipo I)187. Estas anormalidades favorecem o acúmulo de ácido láctico nos tecidos, que resulta em fadiga durante o exercício e término precoce das atividades15,188.
Crianças e adolescentes com asma têm redução no nível de atividade física diária189,190 e também da capacidade em realizar exercício físico191,192. Além dos fatores já citados, o broncoespasmo induzido pelo exercício agrava essa condição193. Portanto, reabilitação pulmonar é alternativa de intervenção.
Reabilitação pulmonar
A reabilitação pulmonar é reconhecida pela American Thoracic Society (ATS)/European Respiratory Society (ERS)188 como estratégia para reduzir a dispneia, melhorar qualidade de vida e capacidade de exercício. De maneira sucinta, um programa estruturado de reabilitação pulmonar consta de educação do paciente sobre sua doença, adequação do automanejo e o plano de ação, e programa de exercício físico188.
Resumidamente, as adaptações crônicas ao exercício físico são: aumento no metabolismo oxidativo nos músculos periféricos, melhor remoção de lactato, melhor ventilação pulmonar e maior fração de ejeção194.
Para que ocorra a adaptação frente ao exercício, o mesmo deve ser feito de maneira supervisionada, por um fisioterapeuta qualificado na área, e alguns princípios devem ser seguidos186: (a) sobrecarga: há necessidade de "estressar" os sistemas respiratório, cardiovascular e metabólico para que ocorra alteração; (b) intensidade deve ser moderada, ou seja, entre 60 e 80% do VO2 pico (consumo de oxigênio), ou da frequência cardíaca máxima, constatados pelo teste de exercício cardiopulmonar. Pacientes graves devem ser submetidos devidamente a aquecimento prévio, antes de alcançar a intensidade de exercício proposta, com a finalidade de evitar o broncoespasmo induzido pelo exercício186; (c) frequência/duração: três a cinco vezes na semana, cada sessão deve durar entre 30 e 60 minutos. A duração do programa de reabilitação é de três meses, no mínimo.
Protocolos de exercício físico têm sido publicados para crianças e adolescentes com asma195,196. Há evidências na literatura a respeito do programa de reabilitação pulmonar como estratégia para a melhora do condicionamento e capacidade funcional em asmáticos196-199. No final da década de 1990, Neder e cols. descreveram os benefícios do treinamento aeróbio em crianças com asma moderada/grave200. Houve aumento no VO2 pico e redução na quantidade de uso de medicação nos pacientes considerados mais sedentários ao início do protocolo. Posteriormente, França-Pinto e cols. descreveram redução da hiperresponsividade brônquica e no perfil inflamatório (FeNO e interleucinas), além da melhora na qualidade de vida, em asmáticos moderado/grave201.
Wanrooij e cols., em revisão sistemática sobre exercício físico em crianças e adolescentes com as-ma, constataram redução do broncoespasmo induzido pelo exercício nos pacientes com asma grave, melhora nos sintomas e diários e na qualidade de vida. Nesse estudo, 29 ensaios clínicos foram incluídos, totalizando 1.045 participantes202.
Por fim, metanálise recentemente publicada, sobre os efeitos do exercício físico em crianças com doença pulmonar crônica, incluiu 14 artigos em pacientes asmáticos203. Os desfechos abordados foram: capacidade de exercício avaliado pelo VO2, qualidade de vida e função pulmonar. Os protocolos de treinamento tiveram as seguintes características: (a) intensidade de 50-90%, sendo a maior parte entre 60-80%; (b) frequência: duas vezes na semana até diariamente, mais comum três vezes na semana; (c) duração de um mês até três anos, sendo mais frequente três a seis meses. Os autores concluem que o exercício físico melhora cerca de 5 mL/kg no VO2 (aumento clinicamente relevante), discreta melhora na qualidade de vida, e que não há alteração na função pulmonar. Adicionalmente, não houve evento adverso nos protocolos de reabilitação com crianças e adolescentes asmáticos, sendo constatada a segurança em realizálo de maneira supervisionada.
Fisioterapia respiratória
Não há evidências para o uso das técnicas de remoção de secreção pulmonar na melhora da condição de saúde da criança e adolescente com asma204. Não há razão para realizar técnicas percussivas, p.e. vibrocompressão, tapotagem, drenagem postural, ou qualquer outra técnica manual que tenha como objetivo remover secreção pulmonar nessa condição de saúde.
Alternativa para os pacientes muito dispneicos é aplicação de exercícios respiratórios, que precisam ser devidamente treinados em momentos fora da exacerbação205. Exercícios respiratórios que favorecem a respiração tranquila e contribuem com o aumento no CO2 alveolar e consequente redução do broncoespasmo, minimizam o trabalho respiratório e a dispneia.
Em conclusão, dentre os possíveis tratamentos não farmacológicos descritos, aquele que apresenta melhor evidência e benefício é a prática regular de exercício físico, ou seja, protocolo de reabilitação pulmonar. O mesmo é seguro se feito de maneira supervisionada por profissional especialista. Evidencia-se melhora na qualidade de vida, aumento na capacidade funcional e redução de sintomas após programa de reabilitação pulmonar.
Imunizações
Pacientes com asma têm risco aumentado de desenvolver formas graves de infecções respiratórias, como pneumonias, influenza e coqueluche206.
Além disso, infecções respiratórias virais ou bacterianas podem descompensar a doença de base, sendo muitas vezes o gatilho para desencadear um episódio de crise asmática, ou exacerbar quadros controlados207.
As exacerbações infecciosas das doenças respiratórias crônicas são relacionadas à maior morbidade e mortalidade - as que acometem o trato respiratório inferior, por exemplo, ocorrem de forma significativa em todo o mundo e, no Brasil, representam a terceira causa de mortalidade geral208.
Algumas dessas infecções podem ser prevenidas pela imunização, e a recomendação de vacinação específica neste grupo torna-se ferramenta importante no controle e seguimento desses pacientes.
A vacinação efetiva pode reduzir a carga da doença nessa população. Alguns estudos demonstraram que pacientes asmáticos adequadamente vacinados para influenza e pneumonia realizam menos visitas a setores de emergência. O tratamento destas infecções implica em custos financeiros e possível incremento de resistência bacteriana global209.
Em relação à imunização do paciente com asma, o pediatra deve estar atento ao calendário próprio de vacinação para a idade, que deve estar atualizado, independente do quadro pulmonar associado. Além disso, as vacinas especialmente recomendadas para este grupo de pacientes, são:
a. Influenza;
b. Vacina pneumocócica conjugada (VPC);
c. Vacina pneumocócica polissacarídica (VPP);
d. Vacina Haemophilus influenza tipo b (Hib);
e. Vacina Coqueluche.
Vacina Influenza (Gripe)
A influenza ou gripe é doença infecciosa aguda do trato respiratório, extremamente comum, altamente contagiosa, causada por vírus da família Orthomyxoviridae. Cerca de 15% das crianças são acometidas anualmente pela doença210.
É transmitida por via direta, através das secreções respiratórias da pessoa infectada, ou indireta, pelo contato das mãos em superfícies recém-contaminadas por secreções respiratórias. É caracterizada, normalmente, por início abrupto dos sintomas, com febre alta, calafrios, cefaleia, tosse seca, mialgia, fadiga e anorexia210.
Os grupos de maior risco para desenvolver formas graves e complicações são: extremos de idade (crianças e idosos), gestantes, imunocomprometidos e pacientes com doenças crônicas como a asma211.
Por meio de diferentes mecanismos, a infecção pelo vírus influenza predispõe a infecções respiratórias bacterianas secundárias, sendo o pneumococo o agente infeccioso mais frequentemente implicado nessas complicações212.
Devido à sua alta capacidade de mutação, epidemias relacionadas às variantes de subtipos ocorrem em cada temporada, daí a necessidade de formulação anual da vacina ajustada a essas alterações211.
A vacinação deve ser realizada de maneira rotineira em pacientes asmáticos, anualmente, idealmente antes do período de maior circulação do vírus (outono). Trata-se de vacinas inativadas, sem risco de causar doença em quem a recebe213.
Duas formulações estão licenciadas no Brasil: trivalente, contendo três variantes do vírus: AH1N1, AH3N2 e um subtipo B, e a tetravalente, com quatro variantes: dois subtipos A H1N1 e H3N2 e dois subtipos B (linhagem Victoria e Yamagata)214.
A vacina é extremamente segura e tem eficácia ao redor de 60% a 70%, dependendo da temporada. A formulação trivalente está disponível no Programa Nacional de Imunizações (PNI) para crianças menores de seis anos de idade e para portadores de asma de qualquer idade, durante a campanha anual de vacinação. A vacina tetravalente está disponível, por ora, somente em clínicas privadas215.
Vacina Pneumocócica Conjugada (VPC10 e VPC13)
As infecções causadas pelo Streptococcus pneumoniae (SP) são as principais complicações associadas a pacientes com asma. SP está envolvido em diferentes quadros infecciosos, desde doenças do trato respiratório superior, como otite média aguda (OMA), sinusite, pneumonias da comunidade, até doenças de gravidade maior, invasivas, como pneumonia bacterêmica, meningite e septicemia216.
Os principais fatores de risco para o desenvolvimento da doença são: os extremos das idades - lactentes jovens e idosos - pacientes com algum grau de imunossupressão e portadores de doenças crônicas, como a asma216.
Um estudo avaliou o risco de doença pneumocócica invasiva (DPI) em indivíduos com asma. Foram incluídos 1.282 pacientes com DPI, e 12.785 controles. Do total de casos com DPI, 7,1% tinham asma, contra 2,5% dos controles (sem DPI). Após análise por modelo de regressão logística pareada, chegou-se a um risco (OR) independente de DPI de 2,8 (95% CI 2,1 a 3,6) associada à asma de baixo risco (sem necessidade de internação hospitalar nos últimos 12 meses, porém, com suporte medicamentoso) e de 12,3 (95%CI 5,4 a 28,0) para asma de alto risco (≥ uma internação hospitalar nos últimos 12 meses). Os autores concluem que é importante que a população portadora de asma seja protegida por meio da vacinação contra o pneumococo217,218. Desta maneira, a vacinação pneumocócica pode prevenir tanto pneumonias, quanto a exacerbação aguda da asma.
Duas vacinas conjugadas estão licenciadas no Brasil para uso em crianças, contendo antígenos de 10 (VPC10) ou 13 (VPC13) sorotipos de pneumococo. A vacina pneumocócica conjugada 10-valente (VPC10) contém antígenos dos sorotipos 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F e 23F, e está licenciada para crianças menores de cinco anos de idade. Já a VPC13, que inclui mais três sorotipos (3, 6A e 19A), está licenciada para todas as idades219,220.
A conjugação do polissacarídeo capsular do pneumococo a uma proteína carreadora faz participar da resposta imune os linfócitos T (resposta T dependente), com indução de anticorpos de maior avidez, memória imunológica e capacidade de reduzir o estado de portador são, com consequente efeito protetor indireto da vacinação218,221.
O PNI disponibiliza a VPC10 para crianças no esquema de rotina aos 2, 4 e 12 meses de idade, e a VPC13 para indivíduos vivendo com HIV/AIDS, transplantados e oncológicos207.
A Sociedade Brasileira de Imunizações (SBIm) preconiza o uso da VPC13 para crianças e adolescentes com asma222.
Vacina Pneumocócica Polissacarídea (VPP23)
A VPP23 contém polissacarídeos da cápsula de 23 sorotipos do SP: 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F e 33F. Esses sorotipos são responsáveis por cerca de 90% dos casos de infecções pneumocócicas invasivas, tanto em países da Europa e nos Estados Unidos, como no Brasil, sendo 20 deles responsáveis por mais de 70% dos casos de DPI223.
Embora não possua as vantagens da vacina conjugada, está recomendada, após os dois anos de idade, para crianças e adolescentes asmáticos, idealmente após a administração da vacina conjugada, no esquema sequencial, com o intuito de ampliar a proteção para mais sorotipos. A SBIm recomenda a vacinação rotineira de asmáticos com a VPC13 seguida, após oito semanas, da VPP23. Para aqueles que antes receberam uma dose de VPP23, devese respeitar um intervalo de um ano para aplicar a VPC13, e agendar uma segunda dose de VPP23 para cinco anos após a primeira VPP23224.
Vacina Haemophilus influenza tipo b (Hib)
O Haemophilus influenzae tipo b (Hib) é agente causador de doenças de mucosa (otites, sinusites e pneumonias) e também de formas invasivas (meningite, sepse, epiglotite, pneumonia bacterêmica, entre outras). Na era pré-vacinal era o principal agente responsável pelas formas graves de pneumonias e meningites bacterianas na criança225.
Algumas condições, tanto em crianças como em adolescentes, são consideradas fatores de risco para o desenvolvimento da doença invasiva pelo Hib: imunodeficiências primárias, imunossupressão devido a drogas ou câncer, asplenia anatômica ou funcional, deficiência de complemento, transplantados de órgãos sólidos ou células tronco hematopoiéticas (TCTH) e portadores de doença pulmonar crônica207.
A vacina Hib faz parte do calendário público da criança saudável, aplicada aos 2, 4 e seis meses.
Para crianças e adolescentes asmáticos, não vacinados previamente, a vacina deve ser aplicada em dose única207.
Vacina Coqueluche (DTP, DTPa e dTpa)
A coqueluche persiste como importante problema de saúde pública, ocorrendo na forma endêmica e epidêmica, mesmo nos países em que as coberturas vacinais no primeiro ano de vida são elevadas. Tanto a infecção natural como a vacinação não levam à imunidade permanente, e reinfecções podem acontecer ao longo da vida226.
Os quadros mais graves ocorrem em lactentes jovens, especialmente no primeiro semestre de vida, idade onde o esquema vacinal primário ainda não foi completado. Indivíduos portadores de comorbidades, entre eles os asmáticos, também têm risco maior de desenvolver formas graves e complicações se infectados pela Bordetella pertussis226.
Pacientes com doença pulmonar com comprometimento de função respiratória podem apresentar elevada morbimortalidade associada às intensas crises de tosse características da coqueluche227.
Não existe vacina isolada para a coqueluche. Para imunização de crianças e adolescentes, o componente pertussis é contemplado na vacina tríplice bacteriana (DTPw), disponível no PNI para crianças de até sete anos de idade. Em clínicas privadas estão disponíveis vacinas coqueluche acelulares, infantil (DTPa) ou adulto (dTpa), que contêm também os toxoides tetânico e diftérico, além de uma vacina quádrupla acelular do tipo adulto (dTpa-VIP), contendo, além dos já mencionados, também antígenos inativados da poliomielite228.
As vacinas pertussis são muito eficazes na prevenção de formas graves da doença, porém menos eficazes para prevenir formas atenuadas. A duração da proteção induzida por essas vacinas é relativamente curta, necessitando doses de reforço a cada 10 anos229.
Vacinação do Profissional da saúde e dos conviventes do paciente asmático
Importante lembrar que profissionais da saúde e conviventes de pacientes asmáticos devem também estar em dia com sua vacinação, com o intuito de proteger não somente o indivíduo vacinado, mas também seus pacientes e contactantes230.
Em conclusão, crianças e adolescentes com asma são mais vulneráveis a infecções respiratórias virais e bacterianas, que são a maior causa de exacerbações das crises, hospitalização, progressão da doença e mortalidade neste grupo de indivíduos; a vacinação adequada desta população pode reduzir a carga da doença e suas complicações, e deve fazer parte do manejo clínico da asma, possibilitando reduzir a suscetibilidade e o risco de quadros infecciosos graves, prevenir a descompensação da asma causada por infecções e melhorar a qualidade e a expectativa de vida desses pacientes.
Esquema terapêutico
O esquema terapêutico para o tratamento da asma grave na criança a partir de 6 anos está representado na Figura 3.
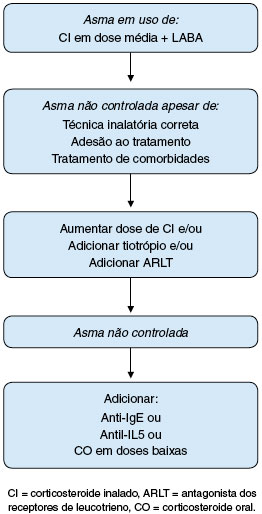
Figura 3 Esquema terapêutico para o tratamento da asma grave na criança a partir de 6 anos
REFERÊNCIAS
1. Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014;43:343-73.
2. Global Initiative for Asthma (GINA). Global Strategy for Asthma Management and Prevention. 2019 - up date. Disponível em: http://www.ginasthma.org. Acessado em: 18/11/2019.
3. Lai CK, Beasley R, Crane J, Foliaki S, Shah J, Weiland S. Global variation in the prevalence and severity of asthma symptoms: phase three of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax. 2009; 64:476-83.
4. Centers for Disease Control and Prevention. 2014 National Health Interview Survey (NHIS) data; Table 4-1 Current asthma prevalence percents by age, United States: National Health Interview Survey. Disponível em: https://www.cdc.gov/asthma/nhis/2014/table4-1. htm. Acessado em: 18/11/2019.
5. Fleming L, Wilson N, Bush A. Difficult to control asthma in children. Curr Opin Allergy Clin Immunol. 2007;7:190-5.
6. Centers for Disease Control and Prevention. Asthma in the US [site na Internet]. Disponível em: https://www.cdc.gov/vitalsigns/asthma/. Acessado em: 18/11/2019.
7. Fitzpatrick AM. Severe asthma in children: lessons learned and future directions. J Allergy Clin Immunol Pract. 2016;4:11-9.
8. Szefler SJ, Zeiger RS, Haselkorn T, Mink DR, Kamath TV, Fish JE, et al. Economic burden of impairment in children with severe or difficultto- treat asthma. Ann Allergy Asthma Immunol. 2011;107:110-9.
9. Centers for Disease Control and Prevention. Asthma-related missed school days among children aged 5 to 17 years [site na Internet]. Disponível em: https://www.cdc.gov/asthma/asthma_stats/missing_days.htm. Acessado em: 18/11/2019.
10. Moonie SA, Sterling DA, Figgs L, Castro M. Asthma status and severity affects missed school days. J Sch Health. 2006;76:18-24.
11. Bellin MH, Osteen P, Kub J, Bollinger ME, Tsoukleris M, Chaikind L, et al. Stress and quality of life in urban caregivers of children with poorly controlled asthma: a longitudinal analysis. J Pediatr Health Care. 2015;29:536-46.
12. Dinakar C, Chipps BE. Clinical tools to assess asthma control in children. Pediatrics. 2017;139:e20163438.
13. Licari A, Brambilla I, Marseglia A, De Filippo M, Paganelli V, Marseglia GL. Difficult vs. Severe Asthma: Definition and Limits of Asthma Control in the Pediatric Population. Front Pediatr. 2018;6:170.
14. Santanello NC, Davies G, Galant SP, Pedinoff A, Sveum R, Seltzer J, et al. Validation of an asthma symptom diary for interventional studies. Arch Dis Child. 1999;80:414-20.
15. Santanello NC, Demuro-Mercon C, Davies G, Ostrom N, Noonan M, Rooklin A, et al. Validation of a pediatric asthma caregiver diary. J Allergy Clin Immunol. 2000;106:861-6.
16. Santanello NC, Barber BL, Reiss TF, Friedman BS, Juniper EF, Zhang J. Measurement characteristics of two asthma symptom diary scales for use in clinical trials. Eur Respir J. 1997;10:646-51.
17. Juniper EF, O'Byrne PM, Ferrie PJ, King DR, Roberts JN. Measuring asthma control. Clinic questionnaire or daily diary? Am J Respir Crit Care Med. 2000;162:1330-4.
18. Skinner EA, Diette GB, Algatt-Bergstrom PJ, Nguyen TT, Clark RD, Markson LE, et al. The Asthma Therapy Assessment Questionnaire (ATAQ) for children and adolescents. Dis Manag. 2004;7(4):305-13.
19. Chipps B, Zeiger RS, Murphy K, Mellon M, Schatz M, Kosinski M, et al. Longitudinal validation of the Test for Respiratory and Asthma Control in Kids in pediatric practices. Pediatrics. 2011;127(3):e737-e747.
20. Cloutier MM, Schatz M, Castro M, Clark N, Kelly HW, Mangione- Smith R, et al. Asthma outcomes: composite scores of asthma control. J Allergy Clin Immunol. 2012;129(3 Suppl):S24-S33.
21. Brand PL, Mäkelä MJ, Szefler SJ, Frischer T, Price D; ERS Task Force Monitoring Asthma in Children. Monitoring asthma in childhood: symptoms, exacerbations and quality of life. Eur Respir Rev. 2015;24(136):187-93.
22. Chipps BE, Zeiger RS, Dorenbaum A, Borish L, Wenzel SE, Miller DP, et al. Assessment of asthma control and asthma exacerbations in the epidemiology and natural history of asthma: outcomes and treatment regimens (TENOR) observational cohort. Curr Respir Care Rep. 2012;1(4):259-69.
23. Jackson DJ, Sykes A, Mallia P, Johnston SL. Asthma exacerbations: origin, effect, and prevention. J Allergy ClinImmunol. 2011;128(6):1165-74.
24. Wandalsen GF, Dias RG, Chong-Neto HJ, Rosário N, Moraes L, Wandalsen NF, et al. Test for respiratory and asthma control in kids (TRACK): validation of the portuguese version. World Allergy Organ J. 2018;11:40.
25. Gherasim A, Dao A, Bernstein JA. Confounders of severe asthma: diagnoses to consider when asthma symptoms persist despite optimal therapy. World Allergy Organ J. 2018;11(1):29.
26. Ribeiro JD, Fischer GB. Chronic obstructive pulmonary diseases in children. J Pediatr (Rio J). 2015;91(6 Suppl 1):S11-25.
27. Tillie-Leblond I. Difficult Childhood Asthma: Management and Future. Clin Chest Med. 2012;33:485-503.
28. Barsky EE, Giancola LM, Baxi SN, Gaffin JM. A practical approach to severe asthma in children. Ann Am Thorac Soc. 2018;15(4):399-408.
29. Guilbert TW, Bacharier LB, Fitzpatrickc AM. Severe asthma in children. J Allergy Clin Immunol Pract. 2014;2(5):489-500.
30. Schoettler N, Strek ME. Recent Advances in Severe Asthma: From Phenotypes to Personalized Medicine. Chest. 2019 Oct 31 pii: S0012-3692(19)34108-X.
31. Rodrigues AM, Roncado C, Santos G, Heinzmann-Filho JP, Souza RG, Vargas MHM, et al. Características clínicas de crianças e adolescentes brasileiros com asma grave resistente a terapia. J Bras Pneumol. 2015;41(4):343-50.
32. Saglani S, Payne DN, Zhu J, Wang Z, Nicholson AG, Bush A, et al. Early detection of airway wall remodeling and eosinophilic inflammation in preschool wheezers. Am J Respir Crit Care Med. 2007;176(9):858-64.
33. Payne DN, Rogers AV, Adelroth E, Bandi V, Guntupalli KK, Bush A, et al. Early thickening of the reticular basement membrane in children with difficult asthma. Am J Respir Crit Care Med. 2003;167(1):78-82.
34. Queiroz MVNP, Alvim CG, Cruz AA, Lasmar LMLBF. Lung function in severe pediatric asthma: a longitudinal study in children and adolescents in Brazil. Clin Transl Allergy. 2017;7:48.
35. Piccioni P, Tassinari R, Carosso A, Carena C, Bugiani M, Bono R. Lung function changes from childhood to adolescence: a seven-year follow-up study. BMC Pulm Med. 2015;15:31.
36. Siroux V, Boudier A, Dolgopoloff M, Chanoine S, Bousquet J, Gormand F, et al. Forced mid expiratory flow between 25% and 75% of forced vital capacity is associated with long-term persistence of asthma and poor asthma outcomes. J Allergy ClinImmunol. 2016;137(6):1709-16.
37. Coverstone AM, Bacharier LB, Wilson BS, Fitzpatrick AM, Teague WG, Phipatanakul W. Clinical significance of the bronchodilator response in children with severe asthma. Pediatr Pulmonol. 2019;54(11):1694-703.
38. Tantisira K, Fuhlbrigge A, Tonascia J, Natta MV, Zeiger RS, Strunk RC, et al. Childhood Asthma Management Program Research. Bronchodilation and bronchoconstriction: predictors of future lung function in childhood asthma. J Allergy ClinImmunol. 2006;117:1264-71.
39. de Oliveira Jorge PP, de Lima JHP, Chong e Silva DC, Medeiros D, Solé D, Wandalsen GF. Impulse oscillometry in the assessment of children's lung function. Allergol Immunopathol (Madr). 2019;47(3):295-302.
40. de Oliveira Jorge PP, de Lima JHP, Wandalsen GF, Sole D. Avaliação de oscilometria de impulso em pré-escolares sibilantes. Arq Asma Alerg Imunol. 2017;1(Supl 1):S16.
41. Ai-Hua Cui, MM, Jing Zhao MM, Shu-Xiang Liu MM, Ying-Shuang Hao MB. Associations of IL-4, IL-6, and IL-12 levels in peripheral blood with lung function, cellular immune function, and quality of life in children with moderate-to-severe asthma. Medicine. 2017;96:12.
42. Falcai A, Soeiro-Pereira PV, Kubo CA, Aranda CS, Solé D, Condino-Neto A. Peripheral blood mononuclear cells from severe asthmatic children release lower amounts of IL-12 and IL-4 after LPS stimulation. Allergol Immunopathol (Madr). 2015;43(5):482-6.
43. Kansal P, Nadan D, Agawal S, Patharia N, Arya N. Correlation of induced sputum eosinophil levels with clinical parameters in mild and moderate persistent asthma in children aged 7-18 years. J Asthma (online). Disponível em: http://www.tandfonline.com/loi/ijas20. Acessado em: 10/11/2019.
44. Ullmann N, Bossley CJ, Fleming L, Silvestri M, Bush A, Saglani S. Blood eosinophil counts rarely reflect airway eosinophilia in children with severe asthma. Allergy. 2013;68:402-6.
45. Bitencourt ES, Eli D, Cunha R, Ribas D, Chong-Neto HJ, Riedi CA, et al. Endótipo da asma grave na criança: estamos sempre diante da asma eosinofílica? Arq Asma Alerg Imunol. 2019;1(Supl 1):S83.
46. Eller MCN. Avaliação do perfil inflamatório dos pacientes pediátricos com asma grave e sua correlação com o controle da doença e parâmetros funcionais [dissertação]. São Paulo (SP): FMUSP; 2018.
47. Salviano LDS, Taglia-Ferre KD, Lisboa S, Costa ACC, Campos HS, March MFP. Associação entre a fração exalada de óxido nítrico e dados da espirometria e controle clínico da asma em crianças e adolescentes. Rev Paul Pediatr. 2018;36(1):17-24.
48. Malinovschi A, Janson C, Borres M, Alving K. Simultaneous lyincreased fraction of exhaled nitric oxide levels and blood eosinophil counts relate to increased asthma morbidity. J Allergy Clin Immunol. 2016;138(5):1301-8.
49. Weinmayr G, Forastiere F, Buchele G, Weinmayr G, Forastiere F, Büchele G, et al. Overweight/obesity and respiratory and allergic disease in children: international study of asthma and allergies in childhood (ISAAC) phase two. PLoSOne. 2014; 9:e113996.
50. Mebrahtu TF, Feltbower RG, Greenwood DC, Parslow RC. Childhood body mass index and wheezing disorders: a systematic review and meta-analysis Pediatr Allergy Immunol. 2015;26(1):62-72.
51. Frey U, Latzin P, Usemann J, Maccora J, Zumsteg U, Kriemler S. Asthma and obesity in children: current evidence and potential systems biology approaches. Allergy. 2015;70(1):26-40.
52. Lu KD, Breysse PN, Diette GB, Curtin-Brosnan J, Aloe C, Williams DL, et al. Being overweight increases susceptibility to indoor pollutants among urban children with asthma. J Allergy Clin Immunol. 2013;131:1017-23.
53. Peters U, Dixon A, Forno E. Obesity and Asthma. J Allergy Clin Immunol. 2018;141(4):1169-79.
54. Diaz J, Farzan S. Clinical Implications of the Obese-Asthma Phenotypes. Immunol Allergy Clin N Am. 2014;34:739-51.
55. Castro-Rodríguez JA, Holberg CJ, Morgan WJ, Wright AL, Martinez FD. Increased incidence of asthmalike symptoms in girls who become overweight or obese during the school years. Am J Respir Crit Care Med. 2001;163(6):1344-9.
56. Sharma N, Akkoyunlu M, Rabin RL. Macrophages-common culprit in obesity and asthma. Allergy. 2018;73(6):1196-205.
57. Wood LG. Metabolic dysregulation. Driving the obese asthma phenotype in adolescents?Am J Respir Crit Care Med. 2015;191:121-2.
58. Kuschnir FC, Felix MMR, Kuschnir MC, Bloch KV, EOC Jordão, Solé D, et al. Severe asthma is associated with metabolic syndrome in Brazilian adolescents. J Allergy Clin Immunol. 2018;141(5):1947-9.
59. Okubo Y, Nochioka K, Hataya H, Sakakibara H, Terakawa T, Testa M. Burden of Obesity on Pediatric Inpatients with Acute Asthma Exacerbation in the United States. J Allergy Clin Immunol Pract. 2016; 4:1227-31.
60. Forno E, Lescher R, Strunk R, Weiss S, Fuhlbrigge A, Celedon JC, et al. Decreased response to inhaled steroids in overweight and obese asthmatic children. J Allergy Clin Immunol. 2011;127:741-9.
61. Ahmadizar F, Vijverberg SJ, Arets HG, de Boer A, Lang JE, Kattan M, et al. Childhood obesity in relation to poor asthma control and exacerbation: a meta-analysis. Eur Respir J. 2016;48:1063-73.
62. Lang JE, Hossain MJ, Lima JJ. Overweight children report qualitatively distinct asthma symptoms: analysis of validated symptom measures. J Allergy Clin Immunol. 2015;135:886-93.
63. Lang JE, Hossain J, Holbrook JT, Teague WG, Gold BD, Wise RA, et al. Gastro-oesophageal reflux and worse asthma control in obese children: a case of symptom misattribution? Thorax. 2016;71:238-46.
64. Ricketts HC, Cowan DC. Asthma, obesity and targeted interventions. an update.Curr Opin Allergy Clin Immunol. 2019;19:68-74.
65. Havemann BD, Henderson CA, El-Serag HB. The association between gastro-oesophageal reflux disease and asthma: a systematic review. Gut. 2007;56(12):1654-64.
66. Thakkar K, Boatright RO, Gilger MA, El-Serag HB. Gastroesophageal reflux and asthma in children: a systematic review. Pediatrics. 2010;125(4):e925-30.
67. Blake K, Teague WG. Gastroesophageal reflux disease and childhood asthma.Curr Opin Pulm Med. 2013;19(1):24-9.
68. MiceliSopa S, Radzik D, Calvani M. Does treatment with proton pump inhibitors for gastroesphogeal reflux disease (GERD) improve asthma symptoms in children with asthma and GERD? A systematic review. J Investig Allergol Clin Immunol. 2009;19(1):1-5.
69. Stordal K, Johannesdottir G, Bentsen B. Acid suppression does not change respiratory symptoms in children with asthma and gastroesophageal reflux disease. Arch Dis Child. 2005;90:956-60.
70. Holdbrook J, Wise R, Gold B. Lansoprazole for children with poorly controlled asthma: a randomized clinical trial. JAMA. 2012;307:373-81.
71. Dachs R, Endres J, Graber MA. PPIs, childhood asthma, and the problem of therapeutic creep. Am Fam Physician. 2014;15;89(6):476-80.
72. Gimenez LM, Zafra H. Vocal cord dysfunction: an update. Ann Allergy Asthma Immunol. 2011;106(4):267-74.
73. Johansson H, Norlander K, Berglund L, Janson C, Malinovschi A, Nordvall L, et al. Prevalence of exercise-induced bronchoconstriction and exercise-induced laryngeal obstruction in a general adolescent population. Thorax. 2015;70(1):57-63.
74. Hseu A, Sandler M, Ericson D, Ayele N, Kawai K, Nuss R. Paradoxical vocal fold motion in children presenting with exercise induced dyspnea. Int J Pediatr Otorhinolaryngol. 2016;90:165-9.
75. Petrov AA. Vocal Cord Dysfunction: The Spectrum Across the Ages. Immunol Allergy Clin N Am. 2019;39(4):547-60.
76. Maturo S, Hill C, Bunting G, Baliff C, Ramakrishna J, Scirica C, et al. Pediatric paradoxical vocal-fold motion: presentation and natural history. Pediatrics. 2011;128:e1443-9.
77. Traister RS, Fajt ML, Petrov AA. The morbidity and cost of vocal cord dysfunction misdiagnosed as asthma. Allergy Asthma Proc. 2016;37(2):25-31.
78. Morris MJ, Christopher KL. Diagnostic criteria for the classification of vocal cord dysfunction. Chest. 2010;138(5):1213-23.
79. Traister RS, Fajt ML, Landsittel D, Petrov AA. A novel scoring system to distinguish vocal cord dysfunction from asthma. J Allergy Clin Immunol In Pract. 2014;2(1):65-9.
80. Ferster AP, Shokri T, Carr M. Diagnosis and treatment of paradoxical vocal fold motion in infants. Int J Pediatr Otorhinolaryngol. 2018;107:6-9.
81. Sateia MJ. International classification of sleep disorders-third edition: highlights and modifications Chest. 2014;146(5):1387-94.
82. Gulotta G, Iannella G, Vicini C, Polimeni A, Greco A, de Vincentiis M, et al. Risk factors for obstructive sleep apnea syndrome in children: state of the art. Int J Environ Res Public Health. 2019;16(18). pii: E3235.
83. Salles C, Terse-Ramos R, Souza-Machado A, Cruz AA. Obstructive sleep apnea and asthma. J Bras Pneumol. 2013;39(5):604-12.
84. Min YZ, Subbarao P, Narang I. The bidirectional relationship between asthma and obstructive sleep apnea: which came first? J Pediatr. 2016;176:10-6.
85. Desager KN, Nelen V, Weyler JJ, De Backer WA. Sleep disturbance and daytime symptoms in wheezing school-aged children. J Sleep Res. 2005;14:77-82.
86. Sulit LG, Storfer-Isser A, Rosen CL, Kirchner HL, Redline S. Associations of obesity, sleep-disordered breathing, and wheezing in children. Am J Respir Crit Care Med. 2005;171:659-64.
87. Ross KR, Storfer-Isser A, Hart MA, Kibler AM, Rueschman M, Rosen CL, et al. Sleep-disordered breathing is associated with asthma severity in children. J Pediatr. 2012;160:736-42.
88. Togias A. Rhinitis and asthma: evidence for respiratory system integration. J Allergy ClinImmunol. 2003;111(6):1171-83.
89. Choi SH, Kim DK, Yoo Y, Yu J, Koh YY.Comparison of delta FVC between patients with allergic rhinitis with airway hypersensitivity and patients with mild asthma. Ann Allergy Asthma Immunol. 2007;98:128-33.
90. Ciprandi G, Cirillo I, Pistorio A. Impact of allergic rhinitis on asthma: effects on spirometric parameters. Allergy. 2008;63:255-60.
91. Jouaville LF, Annesi-Maesano I, NguyenLT, Bocage AS, Bedu M, Caillaud D. Interrelationships among asthma, atopy, rhinitis and exhaled nitric oxide in a population based sample of children. Clin Exp Allergy. 2003;33:1506-11.
92. Zhao Z, Huang C, Zhang X, Xu F, Kan H, Song W, et al. Fractional exhaled nitric oxide in Chinese children with asthma and allergies - a two-city study. Respir Med. 2013;107:161-71.
93. de Groot EP, Nijkamp A, Duiverman EJ, Brand PL. Allergic rhinitis is associated with poor asthma control in children with asthma. Thorax. 2012;67:582-7.
94. Lasmar LM, Camargos PA, Ordones AB, Gaspar GR, Campos EG, Ribeiro GA. Prevalence of allergic rhinitis and its impact on the use of emergency care services in a group of children and adolescents with moderate to severe persistent asthma. J Pediatr (Rio J). 2007;83(6):555-61.
95. Deliu M, Belgrave D, Simpson A, Murray CS, Kerry G, Custovic A. Impact of rhinitis on asthma severity in school-age children Allergy. 2014;69(11):1515-21.
96. Bousquet J, Khaltaev N, Cruz AA, Denburg J, Fokkens WJ, Togias A, et al. Allergic rhinitisand its Impact on Asthma (ARIA) 2008 update. Allergy. 2008;63(Suppl 86):8-160.
97. Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. EPOS 2012: European position paper on rhinosinusitis and nasal polyps 2012. A summary for otorhinolaryngologists. Rhinology. 2012;50(1):1-12.
98. Stevens WW, Peters AT, Hirsch GA, Nordberg C, Schwartz BS, Dione Mercer D, et al. Clinical characteristics of patients with chronic rhinosinusitis with nasal polyps, asthma, and aspirin exacerbated respiratory disease. J Allergy Clin Immunol Pract. 2017;5(4):1061-70.
99. Joe SA, Thakkar K. Chronic rhinosinusitis and asthma. Otolaryngol Clin N Am. 2008;41:297-309.
100. Pearlman AN, Chandra RK, Chang D, Conley DB, Tripathi-Peters A, Grammer LC, et al. Relationships between severity of chronic rhinosinusitis and nasal polyposis, asthma, and atopy. Am J Rhinol Allergy. 2009;23:145-8.
101. Chandran S, Higgins T. Pediatric rhinosinusitis: definitions, diagnosis, and management - an overview. Am J Rhinol Allergy. 2013;1(3):16-9.
102. Sander N. Belief systems that affect the management of childhood asthma. Immunol Allergy Clin N Am. 1998;18(1):99-112.
103. Agrawal S, Singh M, Mathew J, Malhi P. Efficacy of an individualized written homemanagement plan in the control of moderate persistent asthma: a randomized, controlled trial. Acta Paediatr. 2005;94:1742-6.
104. Ducharme F, Zemek R, Chalut D, McGillivray D, Noya FJ, Resendes S, et al. Written action plan in pediatric emergency room improves asthma prescribing, adherence, and control. Am J Respir Crit Care Med. 2011;183:195-203.
105. Ghosh S, Hoselton S, Schuh J. Allergic inflammation in Aspergillus fumigatus induced fungal asthma. Curr Allergy Asthma Rep. 2015;15:1-11.
106. Greenberger PA, Bush RK, Demain JG, Luong A, Slavin RG, Knutsen AP. Allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2014;2(6):703-8.
107. Zhang P, Zein J. Novel insights on sex-related differences in asthma.Curr Allergy Asthma Rep. 2019;19(10):44.
108. Allen DB. Systemic effects of inhaled corticosteroids in children. Curr Opin Pediatr. 2004;16(4):440-4.
109. Bateman ED. Efficacy and safety of high-dose ciclesonide for the treatment of severe asthma Expert Rev Respir Med. 2013;7(4):339-48.
110. Cavkaytar O, Vuralli D, Yilmaz EA, Buyuktiryaki B, Soyer O, Sahiner UM, et al. Evidence of hypothalamic-pituitary-adrenal axis suppression during moderate-to-high-dose inhaled corticosteroid use. Eur J Pediatr. 2015;174:1421-31.
111. Anuradha KWDA, Prematilake GLDC, Batuwita BAUI, Kannangoda KASR, Hewagamage US, Wijeratne S, et al. Effect of long term inhaled corticosteroid therapy on adrenal suppression, growth and bone health in children with asthma. BMC Pediatrics. 2019;19:411.
112. Loke YK, Blanco P, Thavarajah M, Wilson AM. Impact of Inhaled Corticosteroids on Growth in Children with Asthma: Systematic Review and Meta-Analysis. PLoS One. 2015 Jul 20;10(7):e0133428.
113. Pruteanu AI, Chauhan BF, Zhang L, Prietsch SO, Ducharme FM. Inhaled corticosteroids in children with persistent asthma: dose-response effects on growth. Evid Based Child Health. 2014;9(4):931-1046.
114. Stelmach I, Olszowiec-Chlebna M, Jerzynska J, Grzelewski T, Stelmach W, Majak P. Inhaled corticosteroids may have a beneficial effect on bone metabolism in newly diagnosed asthmatic children. Pulm Pharmacol Ther. 2011;24(4):414-20.
115. Trinh, HKT, Lee, S, Cao, TBT, Park, HS. Asthma pharmacotherapy: an update on leukotriene treatments. Exp Rev Respir Med. 2019;13(12):1169-78.
116. Hoshino M, Ohtawa J, Akitsu K, Satoh T. Effect of the addition of montelukast on airway inflammation and remodeling in symptomatic asthma. Eur Respir J. 2017;50:PA4680.
117. Pal K, Feng X, Steinke JW, Borish L. Leukotriene A4 hydrolase activation and leukotriene B4 production by eosinophils in severe asthma. Am J Respir Cell Mol Biol. 2018;60(4):413-9.
118. Evans DJ, Barnes PJ, Spaethe SM, van Alstyne EL, Mitchell MI, O'Connor BJ. Effect of a leukotriene B4 receptor antagonist, LY293111, on allergen induced responses in asthma. Thorax. 1996;51:1178-84.
119. Strunk RC, Bacharier LB, Phillips BR, Szefler SJ, et al. Azitromycin or montelukast as Inhaled Corticosteroid-Sparing Agents in Moderate to Severe Childhood Asthma Study. J Allergy Clin Immunol. 2008;122(6):1138-44.
120. Chauhan BF, Jeyaraman MM, Singh Mann A, Lys J. addition of anti-leukotriene agents to inhaled corticosteroids for adults and adolescentes with persistent asthma. Cochrane Database Syst Rev. 2017; Mar 16;3:CD010347.
121. Hoshino M, Akitsu K, Ohtawa J. Comparison between montelukast and tiotropium as add-on therapy to inhaled corticosteroids plus a long-acting B2-agonist in for patients with asthma. J Asthma. 2019;56(9):995-1003.
122. Bush A. Azithromycin is the answer in Paediatric Respiratory Medicine, but what was the question? Paediatr Respir Rev. 2019; Aug 16. pii: S1526-0542(19)30065-X.
123. Kwong CG, Bacharier LB. Management of asthma in the preschool child. Immunol Allergy Clin N Am. 2019;39:177-90.
124. Schögler A, Kopf BS, Edwards MR, Johnston SL, Casaulta C, Kieninger E, et al. Novel antiviral properties of azithromycin in cystic fibrosis airway epithelial cells. Eur Respir J. 2015;45:428-39.
125. Castro-Rodriguez J, Holberg CJ, Wright AL, Martinez FD. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med. 2000;162(4):1403-6.
126. Guilbert TW, Morgan WJ, Krawiec M, Lemanske RF Jr, Sorkness C, Szefler SJ, et al. The prevention of early asthma in kids study: design, rationale and methods for the childhood asthma research and education network. Control Clin Trials. 2004;25(3):286-310.
127. Bacharier LB, Guilbert TW, Mauger DT, Boehmer S, Beigelman A, Fitzpatrick AM, et al. Early administration of azithromycin and prevention of severe lower respiratory tract illnesses in preschool children with a history of such illnesses: a randomized clinical trial. JAMA. 2015;314:2034-44.
128. Stokholm J, Chawes BL, Vissing NH, Bjarnadóttir E, Pedersen TM, Vinding RK, et al. Azithromycin for episodes with asthmalike symptoms in young children aged 1-3 years: a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2016;4:19-26.
129. Mandhane PJ, Paredes Zambrano de Silbernagel P, Aung YN, Williamson J, Lee BE, Spier S, et al. Treatment of preschool children presenting to the emergency department with wheeze with azithromycin: A placebo-controlled randomized trial. PLoSOne. 2017;798 12:e0182411.
130. Brusselle GG, Vanderstichele C, Jordens P, Deman R, Slabbynck H, Ringoet V, et al. Azithromycin for prevention of exacerbations in severe asthma (AZISAST): a multicentrerandomised double-blind placebo-controlled trial. Thorax. 2013;68(4):322-9.
131. Gibson PG, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, et al. Effect of azithromycin on asthma exacerbations and quality of life in adults with persistent uncontrolled asthma (AMAZES): a randomised, double-blind, placebo-controlled trial. Lancet. 2017;390(10095):659-68.
132. Hahn DL, Grasmick M, Hetzel S, Yale S, Group AS. Azithromycin for bronchial asthma in adults: an effectiveness trial. J Am Board Fam Med. 2012;25(4):442-59.
133. Sutherland ER, King TS, Icitovic N, Ameredes BT, Bleecker E, Boushey HA, et al. A trial of clarithromycin for the treatment of suboptimally controlled asthma. J Allergy Clin Immunol. 2010;126(4):747-53.
134. Simpson JL, Powell H, Boyle MJ, Scott RJ, Gibson PG. Clarithromycin targets neutrophilic airway inflammation in refractory asthma. Am J Respir Crit Care Med. 2008;177(2):148-55.
135. Holguin F, Cardet JC, Chung KF, Diver S, Ferreira DS, Fitzpatrick A, et al. Management of Severe Asthma: a European Respiratory Society/American Thoracic Society Guideline. Eur Respir J.2020 Jan 2;55(1).pii: 1900588.
136. Taylor SL, Leong LEX, Mobegi FM, Choo JM, Wesselingh S, Yang IA, et al. Long-Term Azithromycin Reduces Haemophilus influenzae and Increases Antibiotic Resistance in Severe Asthma. Am J Respir Crit Care Med. 2019;200(3):309-17.
137. Haselkorn T, Fish JE, Zeiger RS, Szefler SJ, Miller DP, Chipps BE, et al. Consistently very poorly controlled asthma as defined by impairment domain of the Expert Panel Report 3 guidelines, increases risk for future severe asthma exacerbations in The Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens (TENOR) study. J Allergy Clin Immunol. 2009;124:895-902.
138. Zhou EH, Kang EM, Seymour S, Iyasu S. Long-acting beta2- adrenergic agonist in pediatric and adolescent asthma patients, 2003-2011. J Asthma. 2014;51(10):1061-7.
139. Kew KM, Karner C, Mindus SM, Ferrara G. Combination formoterol and budesonide as maintenance and reliever therapy versus combination inhaler maintenance for chronic asthma in adults and children. Cochrane Database Syst Rev. 2013;(12):CD009019.
140. Cates CJ, Karner C. Combination formoterol and budesonide as maintenance and reliever therapy versus current best practice (including inhaled steroid maintenance), for chronic asthma in adults and children. Cochrane Database Syst Rev. 2013;(4):CD007313.
141. Chauhan BF, Chartrand C, Ni Chroinin M, Milan SJ, Ducharme FM. Addition of long-acting beta2-agonists to inhaled corticosteroids for chronic asthma in children. Cochrane Database Syst Rev. 2015;(11):CD007949.
142. Lin J, Zhou X, Wang C, Liu C, Cai S, Huang M. Symbicort® Maintenance and Reliever Therapy (SMART) and the evolution of asthma management within the GINA guidelines. Exp Rev Respir Med. 2018;12(3):191-202.
143. Jorup C, Lythgoe D, Bisgaard H. Budesonide/formoterol maintenance and reliever therapy in adolescent patients with asthma. Eur Respir J. 2018;51(1). pii:1701688.
144. Brometo de tiotrópio [Internet]. Disponivel em: https://consultaremedios.com.br/brometo-de-tiotropio/bula. Acessado em: 19/12/2019.
145. Murphy KR, Chipps BE. Tiotropium in children and adolescents with asthma. Ann Allergy Asthma Immunol. 2020;124(3):267-76 e3.
146. Mansfield L, Duong-Quy S, Craig T. Burden of asthma and role of 2.5 µg Tiotropium Respimat as an add-on therapy: a systematic review of phase 2/3 trials. Adv Ther. 2019;36:2587-99.
147. Humbert M, Busse W, Hanania NA, Lowe PJ, Canvin J, Erpenbeck VJ, et al. Omalizumab in asthma: an update on recent developments. J Allergy Clin Immunol Pract. 2014;2:525-36.
148. Alhossan A, Lee CS, MacDonald K, Abraham I. "Real-life" effectiveness studies of omalizumab in adult patients with severe allergic asthma: metaanalysis. J Allergy Clin Immunol Pract. 2017;5:1362-70.
149. Chipps BE, Lanier B, Milgrom H, Deschildre A, Hedlin G, Szefler SJ et al. Omalizumab in children with uncontrolled allergic asthma: Review of clinical trial and real-world experience. J Allergy Clin Immunol. 2017;139:1431-44.
150. Licari A, Marseglia A, Caimmi S, Castagnoli R, Foiadelli T, Salvatore B, et al. Omalizumab in Children. Pediatr Drugs. 2014;16:491-502.
151. Corren J, Kavati A, Ortiz B, Colby JA, Ruiz K, Maiese BA, et al. Efficacy and safety of omalizumab in children and adolescents with moderate-to-severe asthma: A systematic literature review. Allergy Asthma Proc. 2017;38:250-63.
152. Krings JG, McGregor MC, Bacharier LB, Castro M. Biologics for severe asthma: treatment-specific effects are important in choosing a specific agent. J Allergy Clin Immunol Pract. 2019;7:1379-92.
153. Teach SJ, Gill MA, Togias A, Sorkness CA, Arbes Jr SJ, Calatroni A, et al. Preseasonal treatment with either omalizumab or an inhaled corticosteroid boost to prevent fall asthma exacerbations. J Allergy Clin Immunol. 2015;136:1476-85.
154. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014;1:CD003559.
155. Casale TB, Chipps BE, Rosen K, Trzaskoma B, Haselkorn T, Omachi TA, et al. Response to omalizumab using patient enrichment criteria from trials of novel biologics in asthma. Allergy. 2018;73:490-7.
156. Chong Neto HJ, Solé D, Rosário NA, Sarinho EC, Chong-Silva DC, Kiertsman B, et al. Diretrizes da Associação Brasileira de Alergia e Imunologia e Sociedade Brasileira de Pediatria para sibilância e asma no pré-escolar. Arq Asma Alerg Imunol. 2018;2:163-208.
157. Bousquet J, Chanez P, Lacoste JY, Barneon G, Ghavanian N, Enander I, et al. Eosinophilic Inflammation in Asthma. N Engl J Med. 1990;323:1033-9.
158. Menzies-Gow A, Robinson DS. Eosinophils, eosinophilic cytokines (interleukin-5), and antieosinophilic therapy in asthma. Curr Opin Pulm Med. 2002;8:33-8.
159. Robinson DS, Ying S, Bentley AM, Meng Q, North J, Durham SR, et al. Relationships among numbers of bronchoalveolar lavage cells expressing messenger ribonucleic acid for cytokines, asthma symptoms, and airway methacholine responsiveness in atopic asthma. J Allergy Clin Immunol. 1993;92:397-403.
160. Smith DA, Minthorn EA, Beerahee M. Pharmacokinetics and pharmacodynamics of mepolizumab, an anti-interleukin-5 monoclonal antibody. Clin Pharmacokinet. 2011;50(4):215-27.
161. Gnanakumaran G, Babu KS. Technology evaluation: mepolizumab, GlaxoSmithKline. Curr Opin Mol Ther. 2003;5(3):321-5.
162. Molfino NA, Gossage D, Kolbeck R, Parker JM, Geba GP.Molecular and clinical rationale for therapeutic targeting of interleukin-5 and its receptor. Clin Exp Allergy. 2012;42(5):712-37.
163. Ortega HG, Yancey SW, Mayer B, Gunsoy NB, Keene ON, Bleecker ER, et al. Severe eosinophilic asthma treated with mepolizumab stratified by baseline eosinophil thresholds: a secondary analysis of the DREAM and MENSA studies. Lancet Respir Med. 2016;4(7):549-56.
164. Cardet JC, Israel E. Update on reslizumab for eosinophilic asthma. Expert Opin Biol Ther. 2015;15:1531-9.
165. Wandalsen GF, Sano F, Falcão ACA, Machado AS, Serpa FS, Rizzo JA, et al. Guia para o manejo da asma grave - 2019 - Associação Brasileira de Alergia e Imunologia. Arq Asma Alerg Imunol. 2019;3(4):337-62.
166. 125526 Mepolizumab Statistical PREA - FDA [Internet]. Disponível em: www.fda.gov/media/95129/download . Acessado em: junho/2019.
167. Pouliquen IJ, Kornmann O, Barton SV, Price JA, Ortega HG. Characterization of the relationship between dose and blood eosinophil response following subcutaneous administration of mepolizumab. Int J Clin Pharmacol Ther. 2015;53(12):1015-27.
168. Matucci A, Vultaggio A, Danesi R. The use of intravenous versus subcutaneous monoclonal antibodies in the treatment of severe asthma: a review. Respir Res. 2018;19:154.
169. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371:1198-207.
170. Giallongo A, Parisi GF, Licari A, Pulvirenti G, Cuppari C, Salpietro C, et al. Novel therapeutic targets for allergic airway disease in children. Drugs Context. 2019 Jul 9;8:212590.
171. Rabe KF, Nair P, Brusselle G, Maspero JF, Castro M, Sher L, et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N Engl J Med. 2018;378:2475-85.
172. Castro M, Corren J, Pavord ID, Maspero J, Wenzel S, Rabe KF, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med. 2018;378:2486-96.
173. FDA Approved Drug Products. Dupilumab [Internet]. Disponível em: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&varApplNo=761055. Acessado em: 01/04/2019.
174. European Medicines Agency. Dupixent [Internet]. Disponível em: https://www.ema.europa.eu/en/medicines/human/summariesopinion/dupixent. Acessado em: 01/04/2019.
175. Clinical Trials.gov. Assessment of the safety and efficacy of dupilumab in children with asthma (liberty asthma excursion) [Internet]. Disponível em: https://clinicaltrials.gov/ct2/show/NCT03560466. Acessado em: 01/04/2019.
176. Clinical Trials.gov. Safety and Efficacy of CRD007 in Adult Asthma Subjects [Internet]. Disponível em: https://clinicaltrials.gov/ct2/show/NCT02615080. Acessado em: 01/04/2019.
177. Giembycz MA. Can the anti-inflammatory potential of PDE4 inhibitors be realized: guarded optimism or wishful thinking? Br J Pharmacol. 2008;155;288-90.
178. Clinical Trials. gov. Pilot Study of Tetomilast in Chronic Obstructive Pulmonary Disease (COPD) Associated With Emphysema (EMPHASIS) [Internet]. Disponível em: https://clinicaltrials.gov/ct2/show/NCT00874497. Acessado em: 02/04/2019.
179. Hogan AD, Bernstein JA. GINA Updated 2019: Landmark changes recommended for asthma management. Ann Allergy Asthma Immunol. 2019; Nov 14. pii: S1081-1206(19)31385-7.
180. Sanchis J, Corrigan C, Levy ML, Viejo JL, ADMIT Group. Inhaler devices-from theory to practice. Respir Med. 2013;107(4):495-502.
181. Heyder J, Gebhart F, Rudolf G, Schiller C F, Stahlhofen W. Deposition of particles in the human respiratory tract in the size range 0.005-15 µm. J Aerosol Sci. 1986;17:811-25.
182. Broeders ME, Sanchis J, Levy ML, Crompton GK, Dekhuijzen PN; ADMIT Working Group. The ADMIT series-issues in inhalation therapy. 2. Improving technique and clinical effectiveness. Prim Care Respir J. 2009;18(2):76-82.
183. Lewis RM, Fink JB. Promoting adherence to inhaled therapy: building partnerships through patient education. Respir Care Clin N Am. 2001;7(2):277-301.
184. Dolovich M, Ahrens R, Hess D, Anderson P, Dhand R, Rau J, et al. Device selection and outcomes of aerosol therapy: Evidencebased guidelines: American College of Chest Physicians/ American College of Asthma, Allergy and Immunology. Chest. 2005;127:335-71.
185. Pereira LF. Dispositivos para uso de aerossóis. In: Pereira CA, ed. Medicina Respiratória, 2ª ed. São Paulo: Atheneu; 2012.
186. World Confederation of Physical Therapy (WCPT) [Internet]. Disponível em: https://www.wcpt.org/policy/ps-descriptionPT. Acessado em: 10/12/2019.
187. Armstrong M, Vogiatzis I. Personalized exercise training in chronic lung diseases. Respirology. 2019;24(9):854-62.
188. Spruit MA, Singh SJ, Garvey C, ZuWallack R, Nici L, Rochester C, et al. ATS/ERS Task Force on Pulmonary Rehabilitation. An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation. Am J Respir Crit Care Med. 2013;188(8):e13-64.
189. World Health Organization (WHO) (2015) Physical activity and young people. WHO. World Health Organization [Internet]. Disponível em: https://www.who.int/dietphysicalactivity/factsheet_young_people/en/. Acessado em 10/12/2019.
190. Bhagat D, Fagnano M, Halterman JS, Reznik M. Asthma symptoms, interactive physical play and behavioral and academic outcomes in urban children with persistent asthma. J Asthma. 2019;56(7):711-8.
191. Lochte L, Nielsen KG, Petersen PE, Platts-Mills TA. Childhood asthma and physical activity: a systematic review with metaanalysis and Graphic Appraisal Tool for Epidemiology assessment. BMC Pediatr. 2016;16:50.
192. Reimberg MM, Pachi JRS, Scalco RS, Serra AJ, Fernandes L, Politti F, et al. Patients with asthma have reduced functional capacity and sedentary behavior. J Pediatr (Rio J). 2018. pii: S0021-7557(18)30555-2.
193. Villa F, Castro AP, Pastorino AC, Santarém JM, Martins MA, Jacob CM, et al. Aerobic capacity and skeletal muscle function in children with asthma. Arch Dis Child. 2011;96(6):554-9.
194. van der Kamp MR, Thio BJ, Tabak M, Hermens HJ, Driessen J, van der Palen J. Does exercise-induced bronchoconstriction affect physical activity patterns in asthmatic children? J Child Health Care. 2019 Oct 13:1367493519881257.
195. Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee I-M, et al. American College of Sports Medicine position stand. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011;43:1334-59.
196. Schultz K, Seidl H, Jelusic D, Wagner R, Wittmann M, Faller H, et al. Effectiveness of pulmonary rehabilitation for patients with asthma: study protocol of a randomized controlled trial (EPRA). BMC Pulm Med. 2017;17(1):49.
197. Reimberg MM, Castro RA, Selman JP, Meneses AS, Politti F, Mallozi MC, et al. Effects of a pulmonary rehabilitation program on physical capacity, peripheral muscle function and inflammatory markers in asthmatic children and adolescents: study protocol for a randomized controlled trial. Trials. 2015;16:346.
198. Ahmaidi SB, Varray AL, Savy-Pacaux AM, Prefaut CG. Cardiorespiratory fitness evaluation by the shuttle test in asthmatic subjects during aerobic training. Chest. 1993;103:1135-41.
199. Andrade LB, Britto MC, Lucena-Silva N, Gomes RG, Figueroa JN.The efficacy of aerobic training in improving the inflammatory component of asthmatic children. Randomized trial. Respir Med. 2014;108:1438-45.
200. Basaran S, Guler-Uysal F, Ergen N, Seydaoglu G, Bingol-Karakoç G, Ufuk Altintas D. Effects of physical exercise on quality of life, exercise capacity and pulmonary function in children with asthma. J Rehabil Med. 2006;38:130-5.
201. Neder JA, Nery LE, Silva AC, Cabral AL, Fernandes AL. Short-term effects of aerobic training in the clinical management of moderate to severe asthma in children. Thorax. 1999;54(3):202-6.
202. França-Pinto A, Mendes FA, de Carvalho-Pinto RM, Agondi RC, Cukier A, Stelmach R, et al. Aerobic training decreases bronchial hyperresponsiveness and systemic inflammation in patients with moderate or severe asthma: a randomised controlled trial. Thorax. 2015;70(8):732-9.
203. Wanrooij VH, Willeboordse M, Dompeling E, van de Kant KD. Exercise training in children with asthma: a systematic review. Br J Sports Med. 2014;48(13):1024-31.
204. Joschtel B, Gomersall SR, Tweedy S, Petsky H, Chang AB, Trost SG. Effects of exercise training on physical and psychosocial health in children with chronic respiratory disease: a systematic review and meta-analysis. BMJ Open Sport Exerc Med. 2018;4(1):e000409.
205. Whelan MA, Hwan WH, Shaffer T, Padman R, Cox T, Oldham H, et al. Efficacy of chest physiotherapy (CPT) in pediatric patients with acute asthma exacerbations. Pediatr Asthma Allergy Immunol. 2009; 22(2):69-74.
206. Macedo TM, Freitas DA, Chaves GS, Holloway EA, Mendonça KM. Breathing exercises for children with asthma. Cochrane Database Syst Rev. 2016 Apr 12;4:CD011017. doi: 10.1002/14651858. CD011017.pub2.
207. Manual dos Centros de Referência para Imunobiológicos Especiais. Ministério da Saúde do Brasil. 5ª ed. Disponível em: http://portalarquivos2.saude.gov.br/images/pdf/2014/dezembro/09/manual-cries-9dez14-web.pdf. Acessado em: 16/12/2019.
208. Moreno D, Barroso J, Garcia A. Vaccines for Patients with COPD. Recent Pat Inflamm Allergy Drug Discov. 2015;9:23-30.
209. Corrêa RA, José BPS, Malta DC, Passos VMA, França EB, Teixeira RA, et al. Burden of disease by lower respiratory tract infections in Brazil, 1990 to 2015: estimates of the Global Burden of Diseases 2015 study. Rev Bras Epidemiol. 2017;20(1):171-81.
210. Froes F, Roche N, Blasi F. Pneumococcal vaccination and chronic respiratory diseases. Int J Chron Obstruct Pulmon Dis. 2017;12:3457-68.
211. Kfouri RA, Marano SB. Influenza. In: Amato Neto V (ed.). Atualizações, orientações e sugestões sobre imunizações. São Paulo: Segmento Farma; 2011. p. 297-310.
212. Grohskopf LA, Alyanak E, Broder KR, Walter EB, Fry AM, Jernigan DB. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices - United States, 2019-20 Influenza Season. MMWR Recomm Rep. 2019;68(3):1-21.
213. Morris DE, Cleary DW, Clarke SC. Secondary bacterial infections associated with influenza pandemics. Front Microbiol. 2017;8:1041.
214. Kopsaftis Z, Wood-Baker R, Poole P. Influenza vaccine for chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2018; issue 6. Art. No.: CD002733.
215. Tisa V, Barberis I, Faccio V, Paganino C, Trucchi C, Martini M, et al. Quadrivalent influenza vaccine: A new opportunity to reduce the influenza burden. J Prev Med Hyg. 2016;57:E28-33.
216. Informe Técnico 21ª Campanha Nacional de Vacinação contra a Influenza. Secretaria de Vigilância em Saúde (SVS) - Ministério da Saúde do Brasil. Disponível em: http://portalarquivos2.saude.gov.br/images/pdf/2019/marco/01/Informe-Cp-Influenza-29-02-2019-final.pdf. Acessado em: 16/12/2019.
217. Torres A, Blasi F, Dartois N, Akova M. Which individuals are at increased risk of pneumococcal disease and why? Impact of COPD, asthma, smoking, diabetes, and/or chronic heart disease on community-acquired pneumonia and invasive pneumococcal disease. Thorax. 2015;70(10):984-9.
218. Klemets P, Lyytikäinen O, Ruutu P, Ollgren J, Kaijalainen T, Leinonen M, et al. Risk of invasive pneumococcal infections among working age adults with asthma. Thorax. 2010; 65(8):698-702.
219. Vacina Pneumocócica 10 Valente (conjugada). Bula do produto [Internet]. Disponível em: http://www.anvisa.gov.br/datavisa/fila_bula/frmVisualizarBula.asp?pNuTransacao=13177362016&pIdAnexo=3137117. Acessado em: 16/12/2019.
220. Vacina Pneumocócica 13 Valente (conjugada). Bula do produto [Internet]. Disponível em: http://www.anvisa.gov.br/datavisa/fila_bula/frmVisualizarBula.asp?pNuTransacao=10025292013&pIdAnexo=1881834. Acessado em: 16/12/2019.
221. Golos M, Eliakim-Raz N, Stern A, Leibovici L, Paul M. Conjugated pneumococcal vaccine versus polysaccharide pneumococcal vaccine for prevention of pneumonia and invasive pneumococcal disease in immunocompetent and immunocompromised adults and children. Cochrane Database Syst Rev. 2016; Issue 8. Art. No: CD012306.
222. Pneumologia. Guia de Imunização SBIm/SBPT 2018/2019 [Internet]. Disponível em: https://sbim.org.br/images/files/guiapneumologia-sbim-2018-2019.pdf. Acessado em: 16/12/2019.
223. Pneumovax 23. Bula do produto [Internet]. Disponível em: http://www.anvisa.gov.br/datavisa/fila_bula/frmVisualizarBula.asp?pNuTransacao=15393712016&pIdAnexo=3304945. Acessado em: 26/05/2019.
224. Calendários de Vacinação SBIm. Pacientes Especiais [Internet]. Disponível em: https://sbim.org.br/images/calendarios/calendsbim-pacientes-especiais.pdf. Acessado em: 16/12/2019.
225. Agrawal A, Murphy TF. Haemophilus influenzae infections in the H influenzae type b conjugate vaccine era. J Clin Microbiol. 2011;49(11):3728-32.
226. Centers for Disease Control and Prevention (CDC). Burden and Prevention of Influenza and Pertussis Among Pregnant Women and Infants - United States. Weekly / October 11, 2019 / 68(40);885-92.
227. Capili CR, Hettinger A, Rigelman-Hedberg N, Fink L, Boyce T, Lahr B, et al. Increased risk of pertussis in patients with asthma. J Allergy Clin Immunol. 2012;129:957-63.
228. Calendário de Vacinação da SBP 2019 [Internet]. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/21273o-DocCient-Calendario_Vacinacao_2019.pdf. Acessado em 16/12/2019.
229. World Health Organization (WHO). Pertussis vaccine. WHO Position Paper. 28 August 2015, 90th Year. No. 35, 2015, 90, 433-60.
230. Petraglia T. Vacinação de pacientes com comorbidades e seus contactantes. In: Ballalai I. Manual prático de imunizações. São Paulo: AC Farmacêutica; 2013.