Número Atual: Outubro-Dezembro 2019 - Volume 3 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Abordagem da conjuntivite em paciente com dermatite atópica em uso de dupilumabe
Management of conjunctivitis in patients with atopic dermatitis using dupilumab
Mara Giavina-Bianchi; Pedro Giavina-Bianchi
DOI: 10.5935/2526-5393.20190056
Disciplina de Imunologia Clínica e Alergia da Faculdade de Medicina da Universidade de São Paulo, FMUSP - São Paulo, SP, Brasil
Endereço para correspondência:
Pedro Giavina-Bianchi
E-mail: pbianchi@usp.br
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 04/12/2019
Aceito em: 16/12/2019
RESUMO
O dupilumabe foi aprovado para o tratamento de dermatite atópica moderada a grave em adultos e adolescentes no Brasil. Ensaios clínicos e estudos de vida real mostraram alta eficácia e segurança deste imunobiológico, porém a frequência de conjuntivite no grupo de pacientes com dermatite atópica tratado com esse medicamento foi mais alta do que no grupo controle. A conjuntivite é mais frequente em pacientes com dermatite atópica do que na população geral, e foi o efeito adverso mais frequente nos pacientes com dermatite atópica em uso do dupilumabe. A maioria dos casos apresentou quadro leve, sem necessidade de suspender a medicação. Apresentamos uma sugestão de algoritmo para a abordagem da conjuntivite nos pacientes em uso do dupilumabe para tratamento da dermatite atópica.
Descritores: Dermatite atópica, dupilumabe, conjuntivite, efeito adverso.
A dermatite atópica é uma doença inflamatória crônica da pele, caracterizada por eczema de localização típica segundo a idade, e prurido intenso1,2. A prevalência de DA, que é de aproximadamente 15% em crianças e 5% em adultos, está aumentando3,4. É a principal queixa dermatológica da infância, e a segunda na adolescência, que leva o paciente a procurar o especialista, conforme mostra estudo brasileiro recente5. Devido à sua natureza crônica e recidivas frequentes, viver com DA pode ser um fardo, principalmente para aqueles que necessitam de tratamento sistêmico em longo prazo, uma vez que os imunossupressores utilizados podem levar a reações adversas graves. Prurido e lesões cutâneas causam distúrbios do sono, ansiedade, depressão, baixa autoestima e incapacidade para atividades física, escolar e laboral, comprometendo a qualidade de vida dos pacientes e familiares6. Casos graves são um desafio para médicos, pacientes e suas famílias. Há associação entre a gravidade da doença e a diminuição da qualidade de vida, tanto para o paciente, como para sua família7.
Atualmente, a DA é estudada como uma doença com diversos fenótipos e endótipos8. Sua patogênese é complexa, e geralmente envolve a reação de hipersensibilidade tipo I, com a participação de linfócitos T auxiliares que secretam citocinas de perfil predominantemente Th2 (IL-4, IL-5 e IL-13). São características a sensibilização a aeroalérgenos, com produção de IgEs específicas que é associada às ações da IL-4 e IL-13, e a inflamação eosinofílica que é associada à ação da IL-5. Além da resposta alérgica, na DA há alterações na função de barreira da pele, em alguns casos associadas a mutações no gene da filagrina, e aumento da colonização cutânea por Staphylococcus aureus1.
Pacientes com dermatite atópica (DA) frequentemente apresentam outras doenças atópicas associadas, como a conjuntivite alérgica, inclusive um fenótipo mais crônico e grave denominado ceratoconjuntivite atópica. Estudo realizado nos EUA em pacientes adultos para avaliar a associação entre DA e conjuntivite, entre 2001-2015, comparou a frequência de conjuntivite em pacientes com DA e sem DA. O risco de conjuntivite foi 4 vezes maior em indivíduos com DA (OR = 4,38; IC 95% 1,39-13,79; p = 0,012) e, especificamente, foi 8 vezes maior para conjuntivite alérgica (OR = 8,03; IC 95% 1,76-36,58; p = 0,007). Praticamente 2/3 das visitas por conjuntivite em pacientes com DA foi por conjuntivite alérgica, enquanto que no grupo de pacientes sem DA, foi de apenas 35%. A conclusão é que adultos com DA têm um risco significativamente maior de conjuntivite alérgica, quando comparados aos indivíduos sem DA9. É fundamental que os médicos que assistem esses pacientes tenham conhecimento dessa questão, e que aprendam a reconhecer e manejar a conjuntivite alérgica. Outros estudos em adultos no Irã10 e na Holanda11 também evidenciaram resultados semelhantes, assim como outras pesquisas em crianças12-14.
A associação DA e conjuntivite alérgica pode ser explicada por estas doenças apresentarem mecanismos fisiopatológicos semelhantes. Ambas envolvem background genético atópico e a resposta imune Tipo II, na maioria das vezes desencadeada por alérgenos, mas também apresentam alterações de barreira física. Além da disfunção na barreira cutânea, estudos sugerem a existência de problemas no epitélio da superfície ocular em indivíduos com DA, o que os tornaria mais susceptíveis à conjuntivite15,16.
Conjuntivite é uma inflamação da conjuntiva, membrana fina e transparente que reveste a parte anterior da esclera e a parte interna das pálpebras. A conjuntivite alérgica foi primeiramente reconhecida como entidade clínica por Bostock em 181917 e, hoje, tem prevalência estimada em 20% da população mundial18. Os sintomas são prurido, lacrimejamento, hiperemia e edema da conjuntiva (quemose), além de turvação visual nos casos mais graves19. O tratamento inclui agentes tópicos como anti-histamínicos, estabilizadores de mastócitos, anti-inflamatórios não esteroidais e corticoides. Evitar os alérgenos também é fundamental e o uso de lentes de contato deve ser evitado durante as crises para prevenir a contaminação por agentes infecciosos e complicação do quadro9.
O dupilumabe é um anticorpo monoclonal totalmente humano da classe IgG4 que tem como alvo direto a cadeia alfa compartilhada dos receptores da IL-4 e IL-1320. Essas duas citocinas estão envolvidas na resposta imune Th2, induzindo sensibilização a alérgenos, promovendo inflamação atópica e diminuindo a função e a estrutura da barreira cutânea. O anticorpo inibe a ação dessas citocinas e tem sido associado a alterações na expressão gênica nas lesões de DA, melhorando sua assinatura molecular21. Diversos estudos mostraram a eficácia impactante e a segurança do dupilumabe no tratamento da DA, em diversas situações e faixas etárias22-24. Estudos de vida real, inclusive no Brasil, têm mostrado resultados semelhantes aos observados nos estudos pivotais25-27. Essa nova abordagem terapêutica baseia-se na patogênese da doença, e é um marco no tratamento da DA. Com a comprovação de sua eficácia e segurança, a tônica da discussão sobre o uso deste imunobiológico deve ser: custo, acesso, população-alvo, critérios de resposta terapêutica, critérios para retirada da medicação e criação de centros de referência para acompanhamento dos pacientes com fenótipos mais graves da doença.
Em paralelo aos benefícios observados nos pacientes com dermatite atópica com o uso do dupilumabe, a utilização do anticorpo monoclonal que inibe as ações da IL-4 e IL-13 está permitindo grande aprendizado sobre os mecanismos fisiopatológicos da doença. O medicamento tem se mostrado extremamente eficaz e também seguro. Entretanto, três reações adversas não esperadas e, de certa forma, inusitadas, foram observadas:
1. conjuntivite;
2. novas dermatoses regionais. Aparecimento de dermatites novas ou exacerbação de lesões antigas, em locais específicos, principalmente na face. Geralmente quadros leves e que requerem apenas tratamento local, sem a necessidade da suspensão do imunobiológico;
3. eosinofilia "laboratorial", sem acompanhamento de lesões orgânicas e manifestações clínicas.
Durante os estudos sobre a segurança e eficácia do dupilumabe, a conjuntivite foi uma das reações adversas mais comumente notadas. Nos estudos pivotais, a incidência de conjuntivite foi estatisticamente maior no grupo tratado com dupilumabe (8,6-22,1%) do que no grupo placebo (2,1-11,1%)22-24. Estudo recente de vida real, que incluiu 29 centros franceses e 241 pacientes, mostrou taxa de conjuntivite maior, de 38%. Neste estudo, o desenvolvimento da conjuntivite esteve significativamente associado à história pessoal de conjuntivite alérgica, e em 4% dos casos foi motivo para a descontinuação da medicação25. Portanto, médicos que utilizam o dupilumabe devem estar cientes dos sinais, sintomas e opções de tratamento nos casos de conjuntivite que podem vir a ocorrer.
Os achados mais significativos da conjuntivite associada ao uso do dupilumabe foram a hiperemia conjuntival, com acentuação na região limboesclerocorneana28-30, prurido, lacrimejamento, irritação ocular, sensação de corpo estranho e diminuição de acuidade visual28,31-33. O tempo médio para o desenvolvimento da conjuntivite variou de 2 a 8 semanas durante os ensaios clínicos, e o número de casos novos foi crescente ao longo do tempo, estabilizando ao redor de 20-24 semanas34. Independente do uso do dupilumabe, alguns fatores associados ao aparecimento de conjuntivite em pacientes com DA foram observados nos estudos; quanto mais grave a DA, maior a probabilidade da conjuntivite, estando o paciente em uso do placebo ou do dupilumabe34-36. Portanto, os pacientes com DA de intensidade moderada a grave, que são os que têm indicação de uso do anticorpo monoclonal, também são os mais propensos a desenvolverem conjuntivite alérgica. O nível basal de biomarcadores sorológicos, como TSLP, IgE ou eosinófilos, também se associou com a incidência de conjuntivite, independente do uso do dupilumabe34.
Interessantemente, essa reação adversa não é notada em pacientes com asma37,38, rinossinusite crônica com pólipos nasais39 e esofagite eosinofílica40 tratados com dupilumabe. Não se conhece a patogêneses da conjuntivite associada ao tratamento com dupilumabe, mas algumas teorias incluem a redução de citocinas que poderiam favorecer a proliferação de ácaros do gênero Demodex levando à inflamação41 e a diminuição da produção de muco pelas células caliciformes da conjuntiva, esse último efeito devido a inibição da IL-1342.
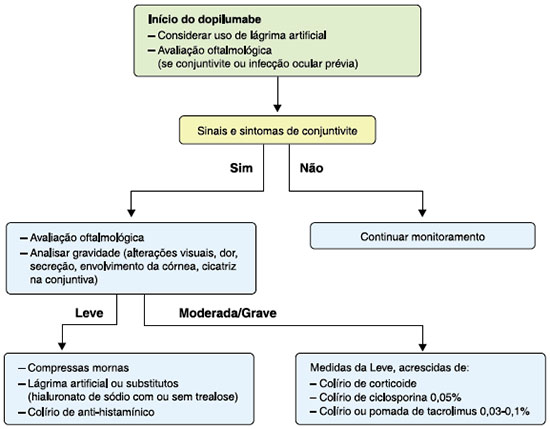
A maioria dos casos de conjuntivite induzida por dupilumabe descritos na literatura é leve, que requer apenas tratamento conservador, com compressas de água quente, colírio de lágrimas artificiais ou seus substitutos à base de hialuronato sódico, ou colírio de anti-histamínicos. Já nos casos moderados/graves de conjuntivite ou casos leves que não responderam ao tratamento conservador, colírios ou pomadas de ação anti-inflamatória, contendo corticosteroides, ciclosporina ou inibidores da calcineurina devem ser utilizados28,32,33,35,43-45. Dentre os colírios de corticosteroides, o de fuorometalona 0,1-1% seria um dos mais indicados, devido à sua baixa penetração no olho, comparado aos demais, levando a menor risco de catarata e glaucoma28,45. Colírios ou pomadas de tacrolimus 0,03-0,1% são outras opções de tratamento, com boa resposta e baixo risco a longo prazo28,32,33,35,44-47. Colírios à base de ciclosporina também têm o mesmo efeito e perfil de segurança, mas podem causar ardor na aplicação32,43,48,49. Nestes quadros mais graves é imprescindível a avaliação oftalmológica, a qual também pode ser solicitada preventivamente nos pacientes que já apresentam conjuntivite antes do início do anticorpo monoclonal. No entanto, é importante salientar que a história prévia de conjuntivite não contraindica o tratamento com o dupilumabe35. Espaçar as injeções de dupilumabe pode ser medida adicional, pois diminui a prevalência da conjuntivite30-32,43,50. A Figura 1 traz uma sugestão de algoritmo de abordagem de conjuntivite em paciente com DA em uso de dupilumabe.
Em conclusão, a conjuntivite é uma das reações adversas mais frequentes do tratamento da dermatite atópica com dupilumabe, acometendo 10-20% dos pacientes, e tem mecanismos fisiopatológicos ainda não esclarecidos. Caso o paciente apresente olhos hiperemiados e prurido, a hipótese de conjuntivite deve ser considerada, sendo fundamental que o médico tenha ciência e aprenda a manejar essa reação. A avaliação e acompanhamento do oftalmologista são essenciais, especialmente se o paciente necessitar de tratamento com colírios/pomadas de corticoides, tacrolimus ou ciclosporina. A dermatite atópica moderada a grave tem um efeito muito nocivo sobre o paciente, comprometendo sua qualidade de vida e de seus familiares. Suspender o tratamento de um paciente que está evoluindo bem com o uso do dupilumabe devido à conjuntivite é indesejável e inadequado. Felizmente, é raro que isso aconteça, pois o diagnóstico e tratamento precoces da conjuntivite possibilitam o controle da grande maioria dos casos e permitem que os pacientes prossigam com o tratamento da dermatite atópica e consigam o tão desejado controle da doença51. Há evidências científicas abundantes mostrando a eficácia e segurança do dupilumabe que está mudando a maneira como tratamos pacientes com DA moderada a grave.
REFERÊNCIAS
1. Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018;32(5):657-82.
2. Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol. 2018;32(6):850-78.
3. Kay J, Gawkrodger DJ, Mortimer MJ, Jaron AG. The prevalence of childhood atopic eczema in a general population. J Am Acad Dermatol. 1994;30(1):35-9.
4. Silverberg JI, Hanifin JM. Adult eczema prevalence and associations with asthma and other health and demographic factors: a US population-based study. J Allergy Clin Immunol. 2013;132(5):1132-8.
5. Giavina Bianchi M, Santos AP, Cordioli E. The majority of skin lesions in pediatric primary care attention could be managed by Teledermatology. PLoS One. 2019;14(12):e0225479.
6. Silverberg JI, Gelfand JM, Margolis DJ, Boguniewicz M, Fonacier L, Grayson MH, et al. Symptoms and diagnosis of anxiety and depression in atopic dermatitis in U.S. adults. Br J Dermatol. 2019;181(3):554-65.
7. Campos ALB, Araújo FM, Santos MALD, Santos AASD, Pires CAA. Impact of atopic dermatitis on the quality of life of pediatric patients and their guardians. Rev Paul Pediatr. 2017;35(1):5-10.
8. Czarnowicki T, He H, Krueger JG, Guttman-Yassky E. Atopic dermatitis endotypes and implications for targeted therapeutics. J Allergy Clin Immunol. 2019;143(1):1-11.
9. Wu KK, Borba AJ, Deng PH, Armstrong AW. Association between atopic dermatitis and conjunctivitis in adults: a population-based study in the United States. J Dermatolog Treat. 2019 Sep 2:1-5. doi: 10.1080/09546634.2019.1659480.
10. Shokouhi Shoormasti R, Pourpak Z, Fazlollahi MR, Kazemnejad A, Nadali F, Ebadi Z, et al. The Prevalence of Allergic Rhinitis, Allergic Conjunctivitis, Atopic Dermatitis and Asthma among Adults of Tehran. Iran J Public Health. 2018;47(11):1749-55.
11. Thyssen JP, Toft PB, Halling-Overgaard AS, Gislason GH, Skov L, Egeberg A. Incidence, prevalence, and risk of selected ocular disease in adults with atopic dermatitis. J Am Acad Dermatol. 2017;77(2):280-6.e1.
12. Schneider L, Hanifin J, Boguniewicz M, Eichenfield LF, Spergel JM, Dakovic R, et al. Study of the Atopic March: Development of Atopic Comorbidities. Pediatr Dermatol. 2016;33(4):388-98.
13. Henriksen L, Simonsen J, Haerskjold A, Linder M, Kieler H, Thomsen SF, et al. Incidence rates of atopic dermatitis, asthma, and allergic rhinoconjunctivitis in Danish and Swedish children. J Allergy Clin Immunol. 2015;136(2):360-6.e2.
14. Stensballe LG, Klansø L, Jensen A, Haerskjold A, Thomsen SF, Simonsen J. The validity of register data to identify children with atopic dermatitis, asthma or allergic rhinoconjunctivitis. Pediatr Allergy Immunol. 2017;28(6):535-42.
15. Yokoi K, Yokoi N, Kinoshita S. Impairment of ocular surface epithelium barrier function in patients with atopic dermatitis. Br J Ophthalmol. 1998;82(7):797-800.
16. Mantelli F, Mauris J, Argüeso P. The ocular surface epithelial barrier and other mechanisms of mucosal protection: from allergy to infectious diseases. Curr Opin Allergy Clin Immunol. 2013;13(5):563-8.
17. Bostock J. Case of a Periodical Affection of the Eyes and Chest. Med Chir Trans. 1819;10(Pt 1):161-5.
18. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet. 1998;351(9111):1225-32.
19. Cronau H, Kankanala RR, Mauger T. Diagnosis and management of red eye in primary care. Am Fam Physician. 2010;81(2):137-44.
20. Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013;368(26):2455-66.
21. Guttman-Yassky E, Bissonnette R, Ungar B, Suárez-Fariñas M, Ardeleanu M, Esaki H, et al. Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis. J Allergy Clin Immunol. 2019;143(1):155-72.
22. Simpson EL, Paller AS, Siegfried EC, Boguniewicz M, Sher L, Gooderham MJ, et al. Efficacy and Safety of Dupilumab in Adolescents With Uncontrolled Moderate to Severe Atopic Dermatitis: A Phase 3 Randomized Clinical Trial. JAMA Dermatol. 2019 Nov 6. doi: 10.1001/jamadermatol.2019.3336.
23. Simpson EL, Bieber T, Guttman-Yassky E, Beck LA, Blauvelt A, Cork MJ, et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016;375(24):2335-48.
24. Blauvelt A, de Bruin-Weller M, Gooderham M, Cather JC, Weisman J, Pariser D, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017;389(10086):2287-303.
25. Faiz S, Giovannelli J, Podevin C, Jachiet M, Bouaziz JD, Reguiai Z, et al. Effectiveness and safety of dupilumab for the treatment of atopic dermatitis in a real-life French multicenter adult cohort. J Am Acad Dermatol. 2019;81(1):143-51.
26. Giavina-Bianchi M, Rizzo LV, Giavina-Bianchi P. Severe atopic dermatitis: Dupilumab is not just safer, but more efficient. Allergol Immunopathol (Madr). No prelo 2020.
27. Giavina-Bianchi MH, Giavina-Bianchi P, Rizzo LV. Dupilumab in the treatment of severe atopic dermatitis refractory to systemic immunosuppression: case report. Einstein (Sao Paulo). 2019;17(4):eRC4599.
28. Wollenberg A, Ariens L, Thurau S, van Luijk C, Seegräber M, de Bruin-Weller M. Conjunctivitis occurring in atopic dermatitis patients treated with dupilumab-clinical characteristics and treatment. J Allergy Clin Immunol Pract. 2018;6(5):1778-80.e1.
29. Shen J, Lei QQ, Chen X, Cao C, Cen Y. Diagnostic performance of micropthalmia transcription factor for melanoma: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci. 2014;18(6):798-805.
30. Barnes AC, Blandford AD, Perry JD. Cicatricial ectropion in a patient treated with dupilumab. Am J Ophthalmol Case Rep. 2017;7:120-2.
31. Treister AD, Kraff-Cooper C, Lio PA. Risk Factors for Dupilumab-Associated Conjunctivitis in Patients With Atopic Dermatitis. JAMA Dermatol. 2018;154(10):1208-11.
32. Maudinet A, Law-Koune S, Duretz C, Lasek A, Modiano P, Tran THC. Ocular Surface Diseases Induced by Dupilumab in Severe Atopic Dermatitis. Ophthalmol Ther. 2019;8(3):485-90.
33. Gooderham M, McDonald J, Papp K. Diagnosis and Management of Conjunctivitis for the Dermatologist. J Cutan Med Surg. 2018;22(2):200-6.
34. Akinlade B, Guttman-Yassky E, de Bruin-Weller M, Simpson EL, Blauvelt A, Cork MJ, et al. Conjunctivitis in dupilumab clinical trials. Br J Dermatol. 2019;181(3):459-73.
35. Thyssen JP, de Bruin-Weller MS, Paller AS, Leshem YA, Vestergaard C, Deleuran M, et al. Conjunctivitis in atopic dermatitis patients with and without dupilumab therapy - international eczema council survey and opinion. J Eur Acad Dermatol Venereol. 2019;33(7):1224-31.
36. Uchio E, Miyakawa K, Ikezawa Z, Ohno S. Systemic and local immunological features of atopic dermatitis patients with ocular complications. Br J Ophthalmol. 1998;82(1):82-7.
37. Wenzel S, Castro M, Corren J, Maspero J, Wang L, Zhang B, et al. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting β2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial. Lancet. 2016;388(10039):31-44.
38. Rabe KF, Nair P, Brusselle G, Maspero JF, Castro M, Sher L, et al. Efficacy and Safety of Dupilumab in Glucocorticoid-Dependent Severe Asthma. N Engl J Med. 2018;378(26):2475-85.
39. Bachert C, Mannent L, Naclerio RM, Mullol J, Ferguson BJ, Gevaert P, et al. Effect of Subcutaneous Dupilumab on Nasal Polyp Burden in Patients With Chronic Sinusitis and Nasal Polyposis: A Randomized Clinical Trial. JAMA. 2016;315(5):469-79.
40. Hirano I, Dellon ES, Hamilton JD, Collins MH, Peterson K, Chehade M, et al. Efficacy of Dupilumab in a Phase 2 Randomized Trial of Adults With Active Eosinophilic Esophagitis. Gastroenterology. 2020;158(1):111-22.e10.
41. Thyssen JP. Could conjunctivitis in patients with atopic dermatitis treated with dupilumab be caused by colonization with Demodex and increased interleukin-17 levels? Br J Dermatol. 2018;178(5):1220.
42. Bakker DS, Ariens LFM, van Luijk C, van der Schaft J, Thijs JL, Schuttelaar MLA, et al. Goblet cell scarcity and conjunctival inflammation during treatment with dupilumab in patients with atopic dermatitis. Br J Dermatol. 2019;180(5):1248-9.
43. Levine RM, Tattersall IW, Gaudio PA, King BA. Cicatrizing blepharoconjunctivitis occurring during dupilumab treatment and a proposed algorithm for its management. JAMA Dermatol. 2018;154(12):1485-6.
44. Fukuda K, Ishida W, Kishimoto T, Fukushima A. Development of conjunctivitis with a conjunctival proliferative lesion in a patient treated with dupilumab for atopic dermatitis. Allergol Int. 2019;68(3):383-4.
45. Aszodi N, Thurau S, Seegräber M, de Bruin-Weller M, Wollenberg A. Management of dupilumab-associated conjunctivitis in atopic dermatitis. J Dtsch Dermatol Ges. 2019;17(5):488-91.
46. Levine BB. Immunologic mechanisms of penicillin allergy. A haptenic model system for the study of allergic diseases of man. N Engl J Med. 1966;275(20):1115-25.
47. Gooderham M, Lynde CW, Papp K, Bourcier M, Guenther L, Gulliver W, et al. Review of Systemic Treatment Options for Adult Atopic Dermatitis. J Cutan Med Surg. 2017;21(1):31-9.
48. Beck KM, Seitzman GD, Yang EJ, Sanchez IM, Liao W. Ocular Co-Morbidities of Atopic Dermatitis. Part II: Ocular Disease Secondary to Treatments. Am J Clin Dermatol. 2019;20(6):807-15.
49. Zirwas MJ, Wulff K, Beckman K. Lifitegrast add-on treatment for dupilumab-induced ocular surface disease (DIOSD): A novel case report. JAAD Case Rep. 2019;5(1):34-6.
50. Ivert LU, Wahlgren CF, Ivert L, Lundqvist M, Bradley M. Eye Complications During Dupilumab Treatment for Severe Atopic Dermatitis. Acta Derm Venereol. 2019;99(4):375-8.
51. Agnihotri G, Shi K, Lio PA. A Clinician's Guide to the Recognition and Management of Dupilumab-Associated Conjunctivitis. Drugs R D. 2019;19(4):311-8.