Número Atual: Abril-Junho 2019 - Volume 3 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Anafilaxia: dados de um registro de pacientes atendidos em um serviço especializado
Anaphylaxis: data from a patient registry in a specialized service
Patricia Guerzet Ayres Bastos; Inês Cristina Camelo-Nunes; Renata Rodrigues Cocco; Dirceu Solé; Luis Felipe Chiaverini Ensina
DOI: 10.5935/2526-5393.20190029
Escola Paulista de Medicina -Universidade Federal de São Paulo (EPM-UNIFESP), Disciplina de Alergia, Imunologia Clínica e Reumatologia, Departamento de Pediatria - São Paulo, SP, Brasil
Endereço para correspondência:
Patricia Guerzet Ayres Bastos
E-mail: patriciaguerzet@hotmail.com
Submissão em: 22/05/2019
Aceite em: 01/06/2019
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: Dados relacionados à prevalência e incidência da anafilaxia são escassos, especialmente no Brasil.
OBJETIVO: Descrever o perfil epidemiológico e características das reações em pacientes com diagnóstico de anafilaxia assistidos em um ambulatório especializado de alergia.
MÉTODOS: Análise de um registro de pacientes (maio/2017 a junho/2018) com diagnóstico de anafilaxia. Informações sobre idade, sexo, apresentação clínica, desencadeantes, conhecimento prévio do desencadeante, estudos diagnósticos realizados, antecedentes pessoais de atopia, tempo entre a exposição e a reação, ambiente onde ocorreu a reação, tratamento e gravidade foram analisados.
RESULTADOS: Do total de 150 pacientes (43 dias de vida a 67 anos), 52% eram homens e 66% tinham menos de 18 anos. As principais manifestações clínicas referidas foram as cutâneas e as respiratórias. O tempo entre a exposição ao desencadeante e a reação foi mais comumente menor de 10 minutos. A maioria dos pacientes teve anafilaxia em ambiente não hospitalar, porém, 78% foram tratados em ambiente hospitalar e 57% destes receberam adrenalina intramuscular (IM). Os desencadeantes foram confirmados em 78% dos casos, e os alimentos e as drogas foram os mais implicados. Os pacientes que apresentaram reações desencadeadas por alimentos eram mais jovens e relatavam mais frequentemente reações em menos de 10 minutos e em ambiente não hospitalar. Estes pacientes também relatavam mais frequentemente que conheciam previamente o desencadeante, apresentam antecedente pessoal de atopia e receberam tratamento com adrenalina intramuscular (IM). Dezesseis pacientes apresentaram reações graves, sendo mais frequentes nas mulheres e nos maiores de 18 anos.
CONCLUSÃO: A anafilaxia por drogas ou por alimentos manifesta diferenças clínicas quanto à idade, ter antecedentes de atopia, local da reação e tempo para início da reação. A gravidade das reações anafiláticas associou-se à idade dos pacientes.
Descritores: Anafilaxia, hipersensibilidade a drogas, hipersensibilidade alimentar.
INTRODUÇÃO
A anafilaxia é uma reação sistêmica aguda, grave e potencialmente fatal. A prevalência estimada de anafilaxia durante a vida é de 0,05 a 2%. Estudos epidemiológicos sugerem que a anafilaxia ocorra mais frequentemente na comunidade do que em ambientes hospitalares e, na maior parte dos casos, em crianças e adolescentes1. Os agentes desencadeantes variam de acordo com a idade, sendo os alimentos a causa mais frequente de anafilaxia fatal em crianças, e os medicamentos e o veneno de insetos nos adultos e idosos1.
No entanto, os dados relacionados à prevalência e à incidência de anafilaxia são escassos, especialmente em nosso meio, assim como dados sobre os desencadeantes mais importantes e frequentes. Entre 2008 e 2010, Solé e col. avaliaram os dados de 634 pacientes registrados espontaneamente por médicos de 15 países da América Latina em uma plataforma on-line. Este estudo permitiu observar que os medicamentos foram a principal causa de reações anafiláticas, e que menos de 30% dos pacientes foram tratados de forma adequada2.
Com a intenção de conhecer melhor os aspectos clínicos e epidemiológicos relacionados às reações anafiláticas, Worm e col. desenvolveram um registro on-line para permitir a coleta padronizada de informações de diversos centros, em diferentes regiões3. As informações obtidas a partir desse registro certamente auxiliarão no aperfeiçoamento do diagnóstico e do tratamento da anafilaxia, assim como na provisão de meios para avaliar e priorizar medidas preventivas, diminuindo o risco de novas reações3. A utilização desta plataforma em nosso meio poderá auxiliar no entendimento destes mesmos aspectos epidemiológicos e clínicos, em nossa população.
Nosso objetivo foi descrever o perfil epidemiológico e as características das reações de pacientes com diagnóstico de anafilaxia assistidos em ambulatório especializado de alergia, a partir do registro de dados clínicos e do resultado das investigações realizadas.
PACIENTES E MÉTODOS
Estudo unicêntrico e retrospectivo, realizado no ambulatório de Alergia da Disciplina de Alergia, Imunologia Clínica e Reumatologia do Departamento de Pediatria da Escola Paulista de Medicina (UNIFESP), na cidade de São Paulo/SP, no período de maio de 2017 a junho de 2018.
Foram incluídos os dados de prontuário médico de 150 pacientes com diagnóstico confirmado de anafilaxia4. Os dados relativos à reação anafilática, assim como as investigações realizadas para determinar a sua etiologia, foram transferidos a um questionário padrão. Este questionário, originalmente desenvolvido em inglês, está disponível on-line no site ANAPHYLAXIE.net5. Os dados coletados foram transferidos para o Network for Online-Registration of Anaphylaxis (NORA)5 e organizados, automaticamente, em uma planilha eletrônica própria (Microsoft Office Excel®) para análise. Os pacientes foram identificados no registro eletrônico por um número, preservando a sua identidade.
Dentre os 150 pacientes, 117 tiveram os desencadeantes confirmados pela pesquisa de imunoglobulina E (IgE) específica in vitro (Immunocap®)6 e/ou in vivo (puntura e/ou intradérmico)6,7 e/ou teste de provocação oral6,8.
Dos 117 pacientes cuja etiologia foi confirmada, em 104 foi relacionada a drogas ou alimentos. As variáveis analisadas em relação a estes desencadeantes foram: sexo (masculino e feminino), idade (< 18 anos e ≥ 18 anos), tempo entre a exposição e a reação (< 10 minutos e ≥ 10 minutos), ambiente onde ocorreu a reação (hospitalar/clínica e não hospitalar), tratamento realizado ou não com adrenalina IM, conhecimento prévio do desencadeante, gravidade (de acordo com os critérios de Brown: moderada e grave)9 e antecedentes pessoais de atopia (asma, rinite alérgica [RA], dermatite atópica [DA] e alergia alimentar [AA]).
Já a gravidade da reação (moderada ou grave) foi avaliada de acordo com: sexo (masculino e feminino), idade (< 18 anos e ≥ 18 anos), tempo entre a exposição e a reação (< 10 minutos e ≥ 10 minutos), ambiente onde ocorreu a reação (hospital/clínica e não hospitalar), tratamento realizado ou não com adrenalina IM, desencadeante envolvido (alimentos ou drogas) e conhecimento prévio ou não do desencadeante da reação.
De acordo com a natureza das variáveis estudadas, foram empregados testes paramétricos ou não paramétricos fixando-se em 5% o nível de rejeição para a hipótese de nulidade.
O estudo foi submetido e aprovado pelo Comitê de Ética em Pesquisa (CEP) da UNIFESP, protocolo CAAE 80287417.4.0000.5505. Todos os procedimentos foram iniciados somente após a aprovação do estudo. Pela natureza do estudo - análise de banco de dados - houve dispensa por parte CEP da assinatura do Termo de Consentimento Livre e Esclarecido.
RESULTADOS
Foram avaliados os dados de 150 pacientes com idades entre 43 dias de vida e 67 anos (66% menores de 18 anos, média de 16 anos e mediana de 8,5 anos), sendo 52% homens. Cerca de 47% dos pacientes apresentavam antecedente pessoal de atopia: AA (45%), RA (38%), asma (30%) e DA (11%).
As principais manifestações clínicas da anafilaxia foram as cutâneas (angioedema e urticária), associadas às respiratórias (dispneia e sintomas de rinite) (Tabela 1).
O tempo entre a exposição ao desencadeante e o início da reação foi variável: 53,3% a manifestaram em menos de 10 minutos, 24% entre 10 e 30 minutos, e 17,3% após 30 minutos ou mais. Não houve informação em 5,3% dos prontuários. Apenas um paciente apresentou reação bifásica (5 horas após a inicial), porém o desencadeante suspeito foi AINE, não confirmado.
A maioria dos pacientes apresentou anafilaxia em ambiente não hospitalar: 59% em domicílio, 5,2% em outro local (jardim/parque/escola/creche). Em 32% as reações ocorreram em ambiente hospitalar/clínica.
Dos 150 pacientes inicialmente incluídos, 46 (31%) referiam ter manifestado alguma reação alérgica prévia à anafilaxia, e em 83% deles (38/46) o fator desencadeante dessas reações foi o mesmo responsável pelo episódio de anafilaxia: alimento (74%), droga (13%), veneno de inseto (10) e látex (3%).
Com relação ao tratamento recebido para a reação anafilática: 8% não informaram, 14% dos casos receberam tratamento exclusivamente domiciliar com anti-histamínicos via oral (VO), e 78% foram tratados em ambiente hospitalar. No hospital/clínica, cerca de 58% receberam adrenalina (57% IM e 0,6% inalatória), 47% anti-histamínicos (22% VO e 25% via endovenosa [EV]), 44% corticosteroides sistêmicos (18% VO e 26% EV) e 10% broncodilatador (inalatório). Receberam expansão volêmica e oxigenioterapia, 3% e 9% dos pacientes, respectivamente. Após essa abordagem inicial, 23% foram hospitalizados: 15% em leito de observação por até 24 horas, e 8% em Unidade de Terapia Intensiva por mais de 24 horas.
Dentre os 117 pacientes que tiveram o desencadeante confirmado, os alimentos, as drogas e os venenos de insetos foram implicados em 52%, 37% e 9% dos casos, respectivamente (Tabela 2). As drogas e os alimentos foram os principais agentes apontados como desencadeantes suspeitos da anafilaxia para 28 pacientes cujo diagnóstico não foi confirmado. Em 3% dos prontuários não havia referência a qualquer desencadeante suspeito da reação.
Ao analisarmos os 104 pacientes cuja reação havia sido desencadeada por drogas ou alimentos, vimos ser mais comum anafilaxia no sexo masculino (66%), a ocorrência de reações moderadas (79%) e o desconhecimento prévio da reação (67%) (Figuras 1a, 1b e 1c).
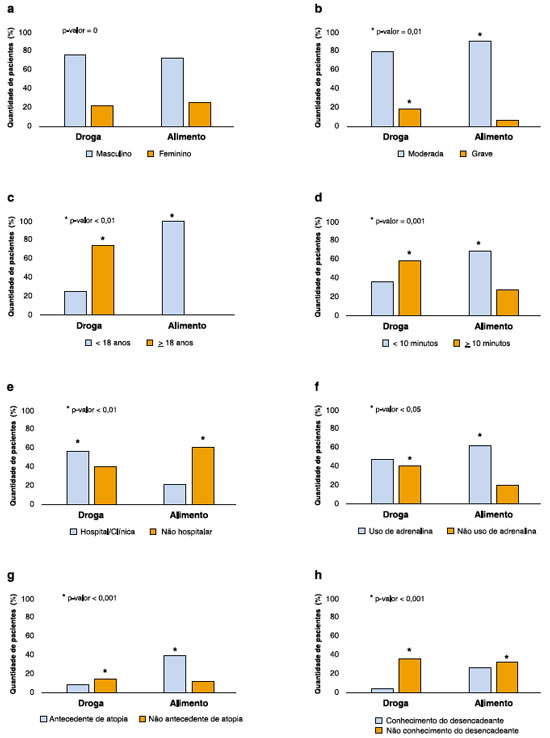
Figura 1 Anafilaxias desencadeadas por drogas e por alimentos de acordo com: o sexo (a), a gravidade da reação (b), a idade (c), o tempo entre exposição e reação (d), o ambiente da ocorrência da reação (e), o uso de adrenalina IM (f), o antecedente pessoal de atopia (g) e o conhecimento prévio do desencadeante (h) (N = 104)
Não houve diferença significante entre as reações desencadeadas por alimentos e aquelas desencadeadas por drogas quanto ao sexo e a gravidade (Figuras 1a e 1b). Por outro lado, as anafilaxias desencadeadas por alimentos foram associadas mais frequentemente a pacientes mais jovens (< 18 anos), reações mais rápidas (< 10 minutos), ambiente não hospitalar, uso de adrenalina IM, conhecimento prévio do desencadeante e antecedente pessoal de atopia (Figuras 1d, 1e, 1f, 1g e 1h).
Manifestaram reações moderadas e graves: 87% (101/117) e 13% (16/117) dos pacientes, respectivamente. Ao analisarmos as anafilaxias confirmadas de acordo com a gravidade da reação (117/150), vimos que, na maioria dos casos ela ocorreu em ambiente não hospitalar (62%), e a maioria dos pacientes desconhecia previamente o desencadeante (66%) (Figuras 2a e 2b).
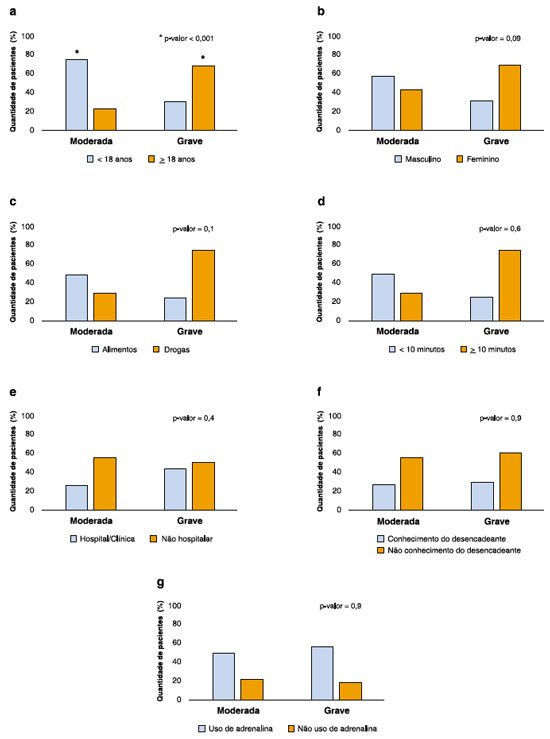
Figura 2 Anafilaxias moderadas e graves de acordo com a idade (a), o sexo (b), os desencadeantes (drogas e alimentos) (c), o tempo entre exposição e reação (d), o ambiente em que ocorreu a reação (e), o conhecimento prévio ou não do desencadeante (f) e o uso de adrenalina IM (g) (N = 117)
As reações graves, quando comparadas às moderadas, ocorreram mais frequentemente em ambiente não hospitalar, pacientes mais velhos (≥ 18 anos), mulheres, foram associadas a drogas e manifestações após 10 minutos ou mais após a exposição (Figuras 2a, 2c, 2d, 2e, 2f e 2g). De maneira semelhante, foi mais comum entre esses pacientes com manifestações mais graves o desconhecimento prévio do desencadeante e o uso de adrenalina (Figura 2b e 2g). Apesar disso, essas diferenças só atingiram significância no que dizia respeito à idade.
DISCUSSÃO
No Brasil, pesquisas sobre a epidemiologia da anafilaxia são escassas. De maneira geral, as reações anafiláticas ocorrem com maior frequência em maiores de 18 anos, e sexo masculino entre as crianças10.
Em nosso estudo, a maioria dos pacientes tinha menos de 18 anos, o que se justifica pela própria natureza de nosso serviço - referência em alergia pediátrica. Nessa faixa etária houve predomínio de meninos e, entre aqueles com 18 anos ou mais, o predomínio foi de mulheres, à semelhança do relatado por outros autores10.
Vários fatores têm sido associados a maior risco de anafilaxia, destacando-se em ordem decrescente a presença de história pessoal de asma, DA e de outras doenças alérgicas respiratórias11. Embora não tenha sido nosso objetivo identificar possíveis fatores de risco associados à anafilaxia, observamos frequência elevada de relato de antecedente pessoal de doenças alérgicas, notadamente AA, RA e asma.
Com relação às manifestações clínicas apresentadas por nosso pacientes, verificamos que as cutâneas associadas às respiratórias foram as mais comuns, à semelhança do relatado por outros3,12-16.
No tocante aos principais desencadeantes de anafilaxia, é descrito haver variações na dependência da faixa etária, meio ambiente e hábitos da população em estudo. Os alimentos têm sido apontados como os principais agentes etiológicos de anafilaxia ao redor do mundo, mais comumente em crianças, adolescentes e adultos jovens3,16-22. No Brasil, os agentes etiológicos mais implicados têm sido medicamentos, alimentos e insetos19. Anafilaxias idiopáticas, por medicamentos e por venenos de insetos, costumam ocorrer em pacientes mais velhos13,23. Em nosso estudo, os alimentos foram os mais envolvidos na anafilaxia de pacientes menores de 18 anos, mormente abaixo dos 4 anos (Tabela 2). Vimos, ainda, que entre as crianças menores de 4 anos, o leite de vaca e derivados e o ovo foram os mais frequentemente implicados. Amendoim, frutas secas, ovo e leite têm sido apontados como desencadeantes fundamentais de anafilaxia em populações pediátricas dos EUA24.
Entre os maiores de 18 anos, as drogas foram os principais agentes etiológicos, sobretudo os AINEs3,13-16. Salienta-se ainda que em nosso estudo apenas 3 pacientes menores de 12 anos tiveram seus quadros associados a drogas. Na América Latina, as reações anafiláticas induzidas por drogas ocorreram mais comumente em adultos e em mulheres em comparação às crianças e/ou adolescentes, sendo os AINEs os mais implicados25. E quando essas reações ocorreram só em crianças, os AINEs também foram os mais implicados em um estudo brasileiro26.
Uma das crianças incluídas em nosso registro tinha história de anafilaxia após vacinação para febre amarela. Ao submetê-la à investigação constatamos que a mesma era alérgica a ovo, e não referia história prévia de reação grave. Vale a pena ressaltar que a incidência de eventos adversos graves associados à vacina de febre amarela é rara, e que a maioria dos eventos adversos pós-vacinais são de natureza local (dor no local da aplicação)27.
O tempo entre a exposição ao desencadeante e a reação anafilática variou, e na maioria das vezes foi de no máximo 30 minutos. As evidências disponíveis demonstram que após a resolução do quadro anafilático inicial, 10 a 20% dos pacientes podem ter uma nova onda de manifestações, mesmo na ausência de nova exposição ao desencadeante - reação bifásica28, e frequentemente ocorrem na anafilaxia por alimentos23. Em nosso estudo apenas um paciente (0,6%) teve anafilaxia bifásica, e a suspeita é que tenha sido desencadeada por droga.
Embora a maioria de nossos pacientes tenha manifestado anafilaxia em ambiente não hospitalar (principalmente domiciliar), porcentagem significativa deles (78%) recebeu tratamento em ambiente de emergência. Observamos ainda que mais da metade dos assistidos em ambiente hospitalar receberam o tratamento considerado de primeira linha para anafilaxia - adrenalina IM. Esta não tem sido a realidade observada em estudos nacionais ou mesmo internacionais3,25,26. No estudo OLASA, por exemplo, a maioria das reações também ocorreu em domicílio e a maior parte dos pacientes foi assistida em hospital, porém a minoria recebeu adrenalina IM, isoladamente ou em associação com outra medicação3.
O sexo e a gravidade da reação não diferiram nas anafilaxias induzidas por drogas ou por alimentos (Figuras 1a e 1b). Por outro lado, os pacientes que tiveram a anafilaxia desencadeada por alimentos eram significantemente mais jovens (< 18 anos) e relatavam com maior frequência reações mais rápidas (< 10 minutos), em ambiente não hospitalar/clínica, receberam adrenalina, tinham conhecimento prévio desse desencadeante e antecedente pessoal de atopia. A anafilaxia induzida por drogas associou-se a risco maior de reação grave quando comparada aos outros desencadeantes, como alimentos e venenos de insetos, conforme o apontado por Worm e col.29.
Pelos critérios empregados na determinação da gravidade9, constatamos que 13% dos registros apresentavam relato de reações consideradas graves. Quanto ao possível papel das variáveis analisadas sobre a gravidade, observamos que a idade pode ter influenciado a ocorrência de reações mais graves, que foram significantemente mais frequentes em pacientes com 18 anos ou mais, o mesmo foi documentado por outros9. Worm e col. também identificaram que idade mais avançada e mastocitose eram importantes preditores de risco para anafilaxia grave29. Exercício físico vigoroso, sexo masculino e sobrecarga psicológica estavam frequentemente associados a reações graves, entretanto, os pacientes com asma tinham risco relativamente menor de desenvolver anafilaxia grave29. Anafilaxia desencadeada por droga, história de doença alérgica e idade mais avançada foram identificados como preditores de reações graves em um estudo coreano30.
CONCLUSÃO
A anafilaxia desencadeada por drogas ou por alimentos tem diferenças clínicas quanto à idade dos pacientes, ter antecedentes de atopia, o local onde a reação ocorre e o tempo para início da reação. A gravidade das reações anafiláticas associou-se à idade dos pacientes.
Mais estudos poderão confirmar ou não eventuais associações entre gravidade da reação anafilática e os demais fatores estudados.
CONSIDERAÇÕES FINAIS
A divulgação de programas educacionais para a população em geral e de diretrizes de anafilaxia na comunidade médica deve ser incentivada buscando melhorar o conhecimento sobre esta emergência, assim como o seu diagnóstico e tratamento. Reconhecer rapidamente um quadro de anafilaxia e realizar tratamento precoce e adequado previne internação e óbito.
REFERÊNCIAS
1. Simons FER, Sampson HA. Anaphylaxis epidemic: fact or fiction? J Allergy Clin Immunol. 2008;122:1166-8.
2. Worm W, Timmermans F, Moneret-Vautrin A, Muraro A, Maimheden Yman II, Lovik M, et al. Towards a European registry of severe allergic reactions: current status of national registries and future needs. Allergy. 2010;65:671-80.
3. Sole D, Ivancevich JC, Borges MS, Coelho MA, Rosario NA, Ardusso LR, et al. Anaphylaxis in Latin America: a report of the online Latin American survey on anaphylaxis (OLASA). Clinics (Sao Paulo). 2011;66:943-7.
4. Sampson HA, Muñoz-Furlong A, Campbell RL, Adkinson NF Jr, Bock SA, Branum A, et al. Second symposium on the definition and management of anaphylaxis: summary report-Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol. 2006;117:391-7.
5. European data from the network of severe allergic reactions (NORA). Disponível em: www.anaphylaxie.net.
6. Waserman S, Bégin P, Watson W. IgE-mediated food allergy. Allergy Asthma Clin Immunol. 2018;14(2):55.
7. Heinzerling L, Mari A, Bergmann KC, Bresciani M, Burbach G, Darsow U, et al. The skin prick test - European standards. Clin Transl Allergy. 2013;3:3.
8. Mill C, Primeau MN, Medoff E, Lejtenyi C, O'Keefe A, Netchiporouk E, et al. Assessing the diagnostic properties of a graded oral provocation challenge for the diagnosis of immediate and nonimmediate reactions to amoxicillin in children. JAMA Pediatr. 2016;170:e160033.
9. Brown SGA. Clinical features and severity grading of anaphylaxis. J Allergy Clin Immunol. 2004;114(2):371-6.
10. Lieberman P, Kemp SF, Oppenheimer J, Lang DM, Bernstein L, Nicklas RA. The diagnosis and management of anaphylaxis: An updated practice parameter. J Allergy Clin Immunol. 2005;115:483-524.
11. Chipps BE. Update in pediatric anaphylasis: a systematic review. Clin Pediatr (Phila). 2013 May;52(5):451-61.
12. Bernd LA, Solé D, Pastorino AC, Prado EA, Castro FF, Rizzo MC, et al. Anafilaxia: guia prático para o manejo. Rev Bras Alerg Imunopatol. 2006;29:283-91.
13. Lieberman PP. Anaphylaxis. In: Adkinson Jr. NF, Bochner BS, Busse WW, Holgate ST, Lemanske Jr. RF, Simons FER, eds. Middleton's Allergy: Principles and Practice, 7ª ed. New York: Mosby-Elsevier; 2008. p. 1026-50.
14. Mcgrath KG. Anaphylaxis and other generalizaed hypersensitivity. In: Grammer LC & Greenberger PA, eds. Patterson's Allergic Diseases, 7ª ed. Philadelphia: Lippincott Williams & Wilkins; 2009. p. 197-219.
15. Caballero M, Lane S, Leen T. Anaphylaxis. In: Kay AB, Kaplan AP, Bousquet J, Holt PG, eds. Allery and allergic diseases. 2ª ed. Oxford, UK; 2008. p. 1897-920.
16. Bernd LAG, Fleig F, Alves MB, Bertozzo R, Coelho M, Correia J, et al. Anafilaxia no Brasil - Levantamento da ASBAI. Rev bras alerg imunopatol. 2010;33:190-8.
17. Hoffer V, Scheuerman O, Marcus N, Levy Y, Segal N, Lagovsky I, et al. Anaphylaxis in Israel: experience with 92 hospitalized children. Pediatr Allergy Immunol. 2011;22:172-7.
18. De Swert LF, Bullens D, Raes M, Dermaux AM. Anaphylaxis in referred pediatric patients: demographic and clinical features, triggers, and Therapeutic approach. Eur J Pediatr. 2008;167:1251-61.
19. Orhan F, Canitez Y, Bakirtas A, Yilmaz O, Boz AB, Can D, et al. Anaphylaxis in Turkish children: a multi-centre, retrospective, case study. Clin Exp Allergy. 2011;41:1767-76.
20. Mullins RJ. Anaphylaxis: risk factors for recurrence. Clin Exp Allergy. 2003;33:1033-40.
21. Smit DV, Cameron PA, Rainer TH. Anaphylaxis presentations to an emergency department in Hong Kong: incidence and predictors of biphasic reactions. J Emerg Med. 2005;28:381-8.
22. Moro Moro M, Tejedor Alonso MA, Esteban Hernández J, Múgica García MV, Rosado Ingelmo A, Vila Albelda C. Incidence of anaphylaxis and subtypes of anaphylaxis in a general hospital emergency department. J Investig Allergol Clin Immunol. 2011;21:142-9.
23. Simons FER. Anaphylaxis: Recent advances in assessment and treatment. J Allergy Clin Immunol. 2009;124:625-36.
24. Sampson HA, Mendelson L, Rosen JP. Fatal and near-fatal anaphylactic reactions to food in children and adolescents. N Engl J Med. 1992;6:327-80.
25. Jares EJ, Baena-Cagnani CE, Sánchez-Borges M, Ensina LF, Arias-Cruz A, Gómez M, Cuello MN, Morfin-Maciel BM, De Falco A, Barayazarra S, Bernstein JA, Serrano C, Monsell S, Schuhl J, Cardona-Villa R; Latin America Drug Allergy Interest Group. Drug-Induced Anaphylaxis in Latin American Countries. J Allergy Clin Immunol Pract. 2015 Sep-Oct;3(5):780-8. doi: 10.1016/j. jaip.2015.05.012. Epub 2015 Jul 2. PMID: 26143020.
26. Ensina LF, de Lacerda AE, de Andrade DM, Machado L, Camelo-Nunes I, Solé D. Drug-induced anaphylaxis in children: nonsteroidal anti-inflammatory drugs and drug provocation test. J Allergy Clin Immunol Pract. 2014 Nov-Dec;2(6):825. doi: 10.1016/j. jaip.2014.08.016. Epub 2014 Nov 6. PMID: 25439388.
27. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de vigilância epidemiológica de eventos adversos pós-vacinação / Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância das Doenças Transmissíveis, 3ª ed, Brasília: Ministério da Saúde, 2014. 250 p.: il.
28. Ellis AK. Biphasic Anaphylaxis: a Review of the Incidence, Characteristics and Predictors. Open Allergy J. 2010;3:24-8.
29. Worm M, Francuzik W, Renaudin JM, Bilo MB, Cardona V, Scherer Hofmeier K, et al. Factors increasing the risk for a severe reaction in anaphylaxis: An analysis of data from The European Anaphylaxis Registry. Allergy. 2018;73:1322-30.
30. Ye YM, Kim MK, Kang HR, Kim TB, Sohn SW, Koh YI, Park HK, Jang GC, Kim CW, Jee YK, Hur GY, Kim JH, Kim SH, Choi GS, Lee SK, Park HS, KAAACI Work Group on Urticaria/Angioedema/ Anaphylaxis. Predictors of the severity and serious outcomes of anaphylaxis in Korean adults: a multicenter retrospective case study. Allergy Asthma Immunol Res. 2015 Jan;7(1):22-9.



