Número Atual: Outubro-Dezembro 2018 - Volume 2 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Anafilaxia por polietilenoglicol em dieta parenteral
Anaphylaxis to polyethylene glycol in a parenteral diet
Amanda Rocha Firmino Pereira; Mayra Coutinho Andrade; Marcelo Vivolo Aun; Antonio Abílio Motta; Pedro Giavina-Bianchi
DOI: 10.5935/2526-5393.20180063
Faculdade de Medicina da Universidade São Paulo (FMUSP), Disciplina de Imunologia Clínica e Alergia - São Paulo, SP
Endereço para correspondência:
Amanda Rocha Firmino Pereira
E-mail: amandafirpe@yahoo.com.br
Submetido em: 04/12/2018
Aceito em: 10/12/2018
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Os casos de reações de hipersensibilidade à dieta parenteral são muito raros. Determinar o agente etiológico nestes casos não é uma tarefa fácil, pois são muitos os componentes que podem causar a reação, e também por não haver padronização adequada dos testes. Outro problema enfrentado é a dificuldade ao acesso aos elementos da dieta para os testes. Descrevemos um caso clínico e toda a investigação diagnóstica detalhada de anafilaxia por dieta parenteral em um paciente adulto, tendo como principal agente suspeito o polietilenoglicol (PEG). Os polietilenoglicóis, ou macrogóis, compreendem uma família de polímeros hidrofílicos amplamente utilizados em produtos industrializados farmacêuticos, alimentares e cosméticos. Nenhum estudo até agora examinou a prevalência da hipersensibilidade ao PEG, e a ocorrência é provavelmente subestimada. A suspeita de alergia ao PEG deve ser considerada em: pacientes com reações de hipersensibilidade do tipo imediata (RHI) para produtos contendo PEG, nos quais a sensibilização aos ingredientes ativos foi excluída; pacientes com RHI repetidas com medicamentos e produtos não relacionados; e em pacientes com RHI para apenas certas marcas ou doses do mesmo medicamento. RHI aos medicamentos PEGuilados estão bem estabelecidas, porém IgE específica contra o PEG ainda não foi identificada. Este relato mostra que os produtos normalmente considerados como inócuos não devem estar acima de suspeitas durante a investigação alergológica.
Descritores: Anafilaxia, polietilenoglicol, reações de hipersensibilidade à dieta parenteral.
INTRODUÇÃO
Os casos de reações de hipersensibilidade a componentes da dieta parenteral são muito raros e mais descritos em crianças1. Os polietilenoglicóis (PEGs) ou macrogóis, compreendem uma família de polímeros hidrofílicos amplamente utilizados em produtos industrializados farmacêuticos, alimentares e cosméticos. Este grupo mantinha desde o seu desenvolvimento uma reputação de segurança e utilidade, porém, desde 1990, as reações de hipersensibilidade de tipo imediato (RHIs) para os PEGs têm sido cada vez mais relatadas. Entretanto, devido à falta de suspeita em relação aos excipientes, à não padronização de nomenclatura de ingredientes e à inadequada rotulagem de produtos, a conscientização dos PEGs como agentes indutores de RHIs permanece mínima. Consequentemente, os pacientes correm o risco de repetidas reações.
Nenhum estudo até agora examina a prevalência de RHIs ao PEG, e a ocorrência é provavelmente subestimada2. O objetivo deste relato é descrever um caso clínico com investigação diagnóstica detalhada de anafilaxia por dieta parenteral em um paciente adulto, tendo como principal agente suspeito o polietilenoglicol.
RELATO DE CASO
Paciente do sexo feminino, 22 anos, do lar, residente em Esperantina/TO, foi internada por Paracococcidiodomicose subaguda disseminada. Foi indicada dieta parenteral para melhor aporte nutricional e tratamento de quadro de quilotórax e ascite que se desenvolveu por acometimento do sistema linfático.
Após 15 minutos da primeira infusão da dieta parenteral com lipídios, a paciente referiu prurido nas proximidades do acesso, evoluindo com placas urticariformes disseminadas, tosse, dispneia e estridor laríngeo. A dieta foi suspensa e a reação anafilática tratada.
A paciente negava comorbidades e uso de medicações contínuas antes desta internação. Referia uso de polivitamínicos na infância sem reações. Negava atopias ou alergias, e qualquer reação ao contato com látex. História de um parto normal aos 20 anos, com uso de anestesia local, sem intercorrências.
Para iniciar a investigação foram solicitados IgEs específicas para látex, clara de ovo, soja e trigo que resultaram negativas. A paciente foi submetida a testes de punctura com a dieta parenteral com lipídios, dieta parenteral sem lipídios, polivitamínico A, polivitamínico B, lipídios TCM 20%, clara de ovo crua e cozida, gema de ovo crua e cozida, soja crua e cozida, porém todos foram negativos, incluindo o controle positivo. A paciente havia recebido anti-histamínicos e corticosteroide recentemente.
Devido à urgência de aporte nutricional, realizouse teste de provocação com a dieta sem o componente lipídio e a paciente apresentou após 35 minutos da infusão (total de volume infundido de 16 mL), queixa de prurido nos membros superiores e evolui imediatamente com urticária, tosse, sibilos à ausculta, queda do pico de fluxo, queda da saturação, exantema e angioedema de face. A infusão foi interrompida e a paciente medicada, apresentando melhora.
Os testes de punctura com os componentes da dieta foram repetidos, resultando em positivos apenas para o polivitamínico A (vitaminas A, D3, E, K1, B1, B2, B3, B5, B6, C, hidroxiestearato de polietilenoglicol, BHT, BHA, ácido cítrico, hidróxido de sódio e álcool etílico). A dieta parenteral sem o polivitamínico A foi administrada, e não houve reações.
Prosseguimos com a investigação para elucidar qual componente do polivitamínico A foi o responsável pela reação. Apresentamos dificuldades na realização dos testes devido à limitação na aquisição dos medicamentos, pois alguns não são comercializados em separado e outros não estavam disponíveis na forma injetável. Realizamos testes cutâneos com as vitaminas K, B1, B6, D3, C e A+D que resultaram negativos. Utilizamos de um polivitamínico injetável C (vitaminas A, B1, B2, B6, B9, B12, C, D3, E, H, PP e ácido pantotênico; glicina; ácido glicólico, lecitina de soja, hidróxido de sódio, ácido clorídrico) para testes de punctura e provocação endovenosa que foram negativos. O teste de provocação endovenosa com vitamina K1 também foi negativo.
Diante da suspeita do polietilenoglicol como principal agente causal e da dificuldade em adquirir o mesmo, realizamos o teste com omeprazol injetável de marca que contém polietilenoglicol com peso molecular de 400 g/mol em sua composição. Os testes cutâneos foram negativos na paciente e nos controles e o teste de provocação negativo. Entretanto, o peso molecular do polietilenoglicol contido no polivitamínico A era de 1.500 g/mol, o que poderia explicar a discrepância entre a reação e o teste de provocação. A paciente recebeu alta com orientação de excluir o uso de medicamentos ou qualquer produto que contenham as vitaminas B3 e B5, o hidroxiestearato de polietilenoglicol, o BHT e BHA, e não apresentou novas reações.
DISCUSSÃO
Descrevemos um caso de anafilaxia induzido pela nutrição parenteral, onde o polietilenoglicol é o provável agente etiológico. É importante ressaltar que os polietilenoglicóis possuem numerosos sinônimos, como polímero de oxietileno, polímero de etileno glicol, óxido de polietileno, polioxietileno diol, entre outros. Eles são sintetizados via polimerização de óxido de etileno, resultando em polímeros de PEG que variam em comprimento de cadeia e peso molecular. Os pesos moleculares comercialmente disponíveis variam de 200 a 35.000 g/mol. A absorção e toxicidade diminuem com o aumento do peso molecular. Os PEGs com 400 g/mol são facilmente absorvidos através da mucosa gastrointestinal intacta, em comparação com < 10% para PEG 3300 g/mol e < 2% para mais elevados. Similarmente, apenas PEG com peso molecular abaixo de aproximadamente 3350 g/mol são absorvidos através de pele intacta.
Os PEGs servem como ingredientes ativos de laxantes e preparações intestinais. Ainda mais frequentemente, são usados como excipientes e revestimento de comprimidos, preparações parenterais, lubrificantes, gel de ultrassom, pomadas, supositórios e curativos para feridas. Os PEGs também podem ser ligados covalentemente a medicamentos sistêmicos para aumentar o peso molecular, prolongar o tempo de circulação e proteger a droga do sistema imunológico, impedindo a opsonização. As drogas PEGuiladas são comuns em câncer, gota e imunoterapia. Na indústria de cosméticos e fragrâncias, os PEGs estão presentes em cremes, loções, xampus, géis de cabelo, batons, cremes para barbear e produtos de higiene em geral. Os PEGs também figuram como aditivos alimentares.
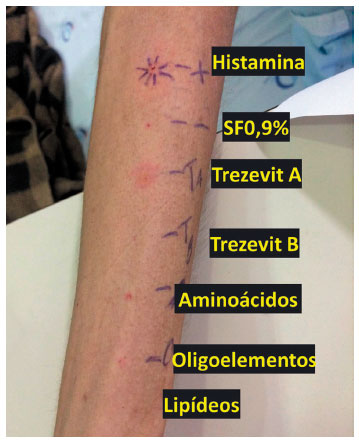
Figura 1 Teste de punctura com componentes (puro)
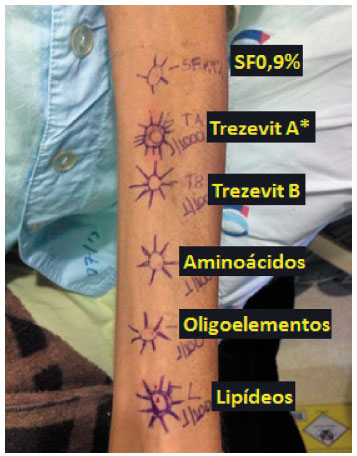
Figura 2 Teste intradérmico com componentes (1:100)
* Trezevit A = 1:1000
Uma revisão de literatura sobre RHIs a PEGs identificou 37 relatos de casos (com 74 reações) entre janeiro de 1977 e abril de 2016. Nenhuma reação foi relatada em crianças. As reações, em sua maioria, foram graves, 76% preenchiam critérios para anafilaxia e tinham início rápido. Todos os casos que receberam PEG injetável desenvolveram anafilaxia, enquanto 36% das exposições orais relataram um desfecho anafilático. Apenas 27% dos casos relataram RHIs após contato cutâneo com o PEG, e nenhum destes apresentou anafilaxia. Apenas um caso de RHI alimentar por polissorbato derivado de PEG 80 no sorvete é descrito3.
A dose de PEG pode ser um fator crítico na ocorrência de RHI. Pacientes com teste de punctura positivo para PEG 3350 e 6000 não apresentaram reação durante o desafio oral com PEG 400. Autores interpretam que a dose e/ou o peso molecular possam ser muito baixos para provocar uma reação. Infelizmente, o peso molecular dos PEGs quase nunca está identificado nos rótulos de ingredientes, e há um dilema prático em determinar que produtos um paciente com RHI prévia pode tolerar. PEGs de alto peso podem demonstrar maior multivalência, exigindo concentrações mais baixas para desencadear reações. Há necessidade de se testar PEGs de vários pesos moleculares para se determinar a reatividade cruzada2.
No presente caso fica interrogado se a lesão do sistema linfático pelo paracoco poderia ter facilitado a sensibilização, e se a reação se desenvolveria por via e peso molecular específicos. Decidimos por orientar a exclusão do uso de qualquer produto com polietilenoglicol diante da gravidade da reação anafilática inicial.
A suspeita de alergia ao polietilenoglicol (PEG) deve ser considerada em: pacientes com RHI a produtos contendo PEG nos quais a sensibilização aos ingredientes ativos foi excluída; pacientes com RHIs recorrentes com medicamentos e produtos não relacionados; e pacientes com RHIs induzidas por apenas certas marcas ou doses do mesmo medicamento. RHIs aos medicamentos PEGuilados estão bem estabelecidas. Recentemente, uma dessensibilização para PEG-IFN foi realizada com sucesso4.
Até o momento, IgE específica contra o PEG ainda não foi identificada diretamente em pacientes com reações, mas estudos com teste de ativação de basófilos (BAT) e western blot forneceram alguns indícios. Uma revisão de 2016 sugere concentrações de teste de punctura de 1/10.000 a pura para PEGs de 3000-4000 e 6000, e puro para PEGs de 300. Nesta mesma revisão, sugere-se que os testes intradérmicos sejam realizados na concentração de 1/10.000. Os testes em pacientes com antecedentes de RHIs graves devem ser iniciados usando concentrações mais diluídas de PEG. Além disso, a interpretação dos resultados do teste de punctura para o PEG não deve ser concluída antes de 30 min. Em estudos, 40% dos testes intradérmicos resultaram em reações sistêmicas. Devido ao risco de reações graves, o desafio oral com PEGs não deve, portanto, ser tentado para fins de diagnóstico, a menos que os teste de punctura e intradérmico sejam negativos1.
CONCLUSÃO
O presente caso demonstra que produtos normalmente considerados como inócuos não devem estar acima de suspeitas durante a investigação alergológica de RHIs. É importante estar atento, pois muitos medicamentos utilizados para o tratamento de reações alérgicas, como anti-histamínicos e corticoides também podem conter polietilenoglicol como aditivo5,6.
REFERÊNCIAS
1. Hernández CR, Ponce EC, Busquets FB, Hernández DS, Oliva SM, Santacruz EL, et al. Hypersensitivity reaction to components of parenteral nutrition in pediatrics. Nutrition. 2016 Nov- Dec;32(11-12):1303-5.
2. Wenande E, Garvey LH. Immediate-type hypersensitivity to polyethylene glycols: a review. Clin Exp Allergy. 2016 Jul;46(7):907-22.
3. Shelley WB, Talanin N, Shelley ED.Polysorbate 80 hypersensitivity. Lancet. 1995;345:1312-3.
4. Poreaux C, Bronowicki JP, Debouverie M, Schmutz JL, Waton J, Barbaud A. Clinical allergy. Managing generalized interferon-induced eruptions and the effectiveness of desensitization. Clin Exp Allergy. 2014;44:756-64.
5. Bordere A, Stockman A, Boone B, Franki AS, Coppens MJ, Lapeere H, et al. A case of anaphylaxis caused by macrogol 3350 after injection of a corticosteroid. Contact Dermat. 2012;67(6):376-8.
6. Hyry H, Vuorio A, Varjonen E, Skytta J, Makinen-Kiljunen S. Two cases of anaphylaxis to macrogol 6000 after ingestion of drug tablets. Allergy. 2006;61(8):1021.



