Número Atual: Julho-Setembro 2018 - Volume 2 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Achados epidemiológicos de alergia alimentar em crianças brasileiras: análise de 234 testes de provocação duplo-cego placebo-controlado (TPDCPCs)
Epidemiological findings in food allergic Brazilian children: an analysis of 234 double-blind placebo-controlled food challenge (DBPCFC) tests
Simone Nabuco de Senna1; Mariana Faria Scalco2; Sílvia Paschoalini Azalim3; Lídia Lacerda Guimaraes1,2; Wilson Rocha Filho1,2
DOI: 10.5935/2526-5393.20180041
1. Hospital Felício Rocho - Belo Horizonte, MG
2. Hospital Infantil João Paulo II - Belo Horizonte, MG
3. Hospital Regional João Penido - FHEMIG - Juiz de Fora, MG
Endereço para correspondência:
Lídia Lacerda Guimarães
E-mail: lidiamarshal@yahoo.com.br
Submissão em: 02/08/2018
Aceite em: 25/08/2018
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: Os dados sobre prevalência de alergia alimentar são escassos e limitados no Brasil. Este trabalho objetiva descrever as características clínicas de crianças brasileiras com alergia alimentar diagnosticada através de teste de provocação duplo-cego placebo-controlado (TPDCPC).
MÉTODOS: Dos pacientes avaliados, foram selecionadas, de forma prospectiva, no Ambulatório de Alergia e Pneumologia Pediátrica, 234 crianças com suspeita clínica de alergia alimentar e teste alérgico positivo para alimento, no período de 1993 a 2005. Para confirmar o diagnóstico de alergia alimentar, foram realizados TPDCPCs com o alimento suspeito.
RESULTADOS: Dos 234 TPDCPCs realizados, 30 foram positivos (12,8%), sendo mais frequentes em crianças abaixo de dois anos e do sexo masculino. Dos testes positivos, 26 (86,6%) foram positivos para ovo ou leite de vaca. Pacientes com diagnóstico inicial de dermatite atópica ou alergia gastrointestinal apresentaram TPDCPC positivo mais frequentemente do que pacientes com sintomas respiratórios. Entre os sintomas apresentados durante o TPDCPC, prevaleceram os sintomas cutâneos (60%) e respiratórios (56,67%).
CONCLUSÃO: A incidência de alergia alimentar na população com suspeita clínica foi de 12,8%. Leite de vaca e ovo são os principais alimentos responsáveis pela alergia alimentar em nosso meio, que é mais frequente em crianças abaixo de dois anos. O teste alérgico positivo é um fraco preditor de alergia alimentar (VPP = 13,5%), mas o teste alérgico negativo praticamente afasta o diagnóstico, pois o seu valor preditivo negativo na população estudada foi próximo de 100%.
Descritores: Criança, hipersensibilidade alimentar, estudos epidemiológicos, diagnóstico.
INTRODUÇÃO
Alergia alimentar é uma resposta imunológica anômala do organismo que ocorre após a ingestão e/ou contato com um determinado alimento. Sua prevalência no mundo vem aumentando nas últimas 2 a 3 décadas, e atualmente acomete cerca de 10% da população mundial. As crianças são mais acometidas do que os adultos. Estima-se que a prevalência seja de aproximadamente 6% em menores de 3 anos, e de 3,5% em adultos1. No Brasil, os dados sobre prevalência de alergia alimentar são escassos e limitados a grupos populacionais, o que dificulta uma avaliação mais próxima da realidade2.
Diversos alimentos já foram reconhecidos como potencialmente alergênicos, mas uma pequena parcela deles tem sido responsabilizada pela maioria das reações ocorridas. Isto varia de acordo com a faixa etária do paciente e a região geográfica onde habitam3. Estudos prospectivos realizados no passado relatam que 1/4 dos pais acreditam que suas crianças já experimentaram pelo menos uma reação adversa a alimento. Após avaliação criteriosa, somente 1/3 destes sintomas foi reproduzível, e somente 2 a 4% destas crianças tinham o diagnóstico de alergia alimentar confirmado4,5. Isto mostra que existe uma grande diferença entre a percepção de sintomas relacionados a um determinado alimento e o diagnóstico correto de alergia alimentar.
Em 2010, um grupo de experts patrocinados pelo National Institute of Allergy and Infectious Diseases (NIAID) desenvolveu as diretrizes para o diagnóstico e manejo da alergia alimentar nos Estados Unidos, e em 2018 foi publicado o Consenso Brasileiro sobre Alergia Alimentar. Para se diagnosticar alergia alimentar IgE mediada, recomenda-se uma história clínica e exame físico minuciosos, dietas de exclusão do alimento, teste cutâneo de leitura imediata, dosagem de IgE sérica específica e teste de provocação oral6. Mas o diagnóstico de certeza nem sempre é uma tarefa fácil, principalmente quando se considera os baixos valores preditivos positivos (VPP) do teste alérgico. Estudos realizados quase sempre em países desenvolvidos indicam que os VPP do teste alérgico para um alimento varia entre 30 e 50% dependendo da população estudada, indicando que o teste alérgico positivo não é suficiente para confirmar o diagnóstico7. Por isto, é necessário em muitos casos, o teste de provocação duplo-cego placebo-controlado (TPDCPC) para se confirmar diagnóstico8.
Os alimentos que mais frequentemente causam alergia alimentar são: leite, ovo, soja, peixe, trigo e amendoim. Estes alimentos são responsáveis por 90% de todas as reações de alergia alimentar em crianças em países desenvolvidos. Em adultos, os alimentos mais frequentemente envolvidos são amendoim, nozes, castanhas, peixe e frutos do mar1.
Dados sobre alergia alimentar em países em desenvolvimento são muito escassos na literatura. Não existem estudos que indicam o perfil da alergia alimentar nestes países. Frequentemente, crianças são submetidas a restrição dietética baseada apenas em uma história clínica duvidosa, ou em reações positivas no teste cutâneo, que não são suficientes para confirmar o diagnóstico. Estas dietas podem ser nutricionalmente deficientes e difíceis de serem mantidas, além de submeter a criança e sua família a um desgaste desnecessário para manter a adesão à dieta prescrita.
Este estudo tem como objetivo descrever as características clínicas de pacientes com alergia alimentar diagnosticados através de TPDCPC. Até onde é do nosso conhecimento, trata-se do primeiro estudo longitudinal de grande porte na América Latina.
MATERIAIS E MÉTODOS
Foram selecionadas de forma prospectiva, no Ambulatório de Alergia e Imunologia Pediátrica do Hospital Felício Rocho, Belo Horizonte, MG, no período de 1993 a 2005, crianças com história sugestiva de alergia alimentar e presença de IgE para o alimento em questão, detectada por teste cutâneo por puntura ou dosagem sérica da IgE específica (CAP-RAST). Para a realização do teste cutâneo por puntura foram utilizados 18 diferentes antígenos alimentares do Laboratório Hollister-Stier U.S.A. Este teste foi realizado seguindo critérios internacionalmente conhecidos, sendo considerado positivo quando ocorria pápula maior que 3 mm em relação ao controle negativo. A medida do tamanho da pápula era feita 15 minutos após a aplicação do antígeno na pele. Além disso, foram selecionadas crianças com teste alérgico negativo, mas com história fortemente sugestiva de alergia alimentar caracterizada por sintomas clínicos reprodutíveis que ocorriam até duas horas após ingestão do alimento suspeito. Foram excluídas crianças com história reprodutível de anafilaxia ao alimento suspeito. O protocolo do estudo foi aprovado pelo Comitê de Ética de nossa instituição, que é reconhecido pelo Conselho Nacional de Ética e Pesquisa do Ministério da Saúde.
A realização do TPDCPC seguiu os critérios recomendados pela American Academy of Allergy Asthma and Immunology (AAAAI)9-11. O exame era realizado no mesmo dia, em duas etapas, uma contendo placebo e a outra o alimento suspeito oferecido em doses crescentes até o máximo de 20 g da proteína liofilizada, ou 100 g do alimento in natura. O paciente era avaliado antes da administração de cada dose. Após a ingestão da última dose, o paciente permanecia em observação por mais 2 horas, sendo avaliado a cada 30 minutos. Quando a história indicava a possibilidade de sintomas respiratórios induzidos pelo alimento suspeito, era realizada, também, prova de função pulmonar. O procedimento era realizado antes do início da provocação oral, e repetido 15 a 30 minutos após ingestão de cada dose do alimento testado. Verificava-se sempre se o valor de FEV1 atingia uma queda igual ou superior a 20% do basal, o que levava à interrupção do teste. Em caso de dermatite atópica ou urticária, a pele era analisada detalhadamente e, quando alterada, a área acometida recebia uma pontuação utilizando escore de grande queimado adaptado10. O TPDCPC era considerado positivo se houvesse um aumento absoluto de nove pontos, ou uma variação maior que 300% do escore basal inicial. A presença de sintomas nasais, oculares e gastrointestinais também foram avaliados; sua presença caracterizava um teste positivo independente dos sintomas cutâneos e pulmonares. O teste era interrompido no momento em que os critérios clínicos de positividade fossem atingidos.
RESULTADOS
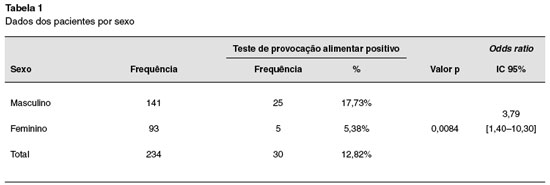
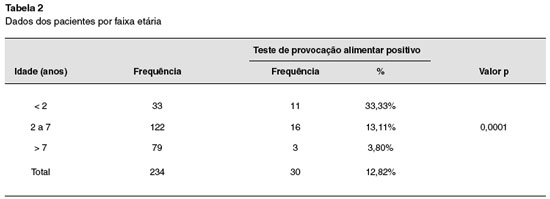
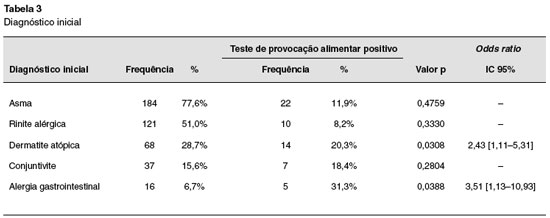
Foram incluídas 234 crianças, sendo realizados 234 TPDCPC. Nenhuma delas tinha história de reação anafilática ao alimento testado. Cento e quarenta e um (60%) eram do sexo masculino, e 93 (40%) do sexo feminino (Tabela 1). Dos 234 TPDCPC realizados, a maioria foi realizada na faixa etária abaixo de 7 anos (Tabela 2). Dos pacientes estudados, 184 (77,6%) tinham o diagnóstico de asma, 121 (51%) de rinite alérgica, 68 (28,7%) de dermatite atópica, 37 (15,6%) de conjuntivite alérgica, e 16 (6,7%) de alergia gastrintestinal (Tabela 3).
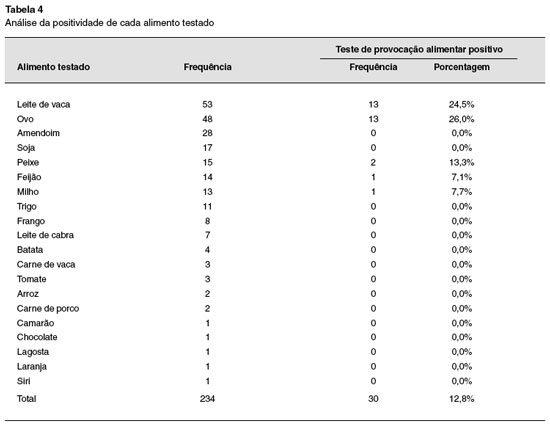
Vinte alimentos foram usados no TPDCPC (Tabela 4). Os alimentos mais utilizados no teste de provocação foram: leite de vaca 53 vezes (22,65%), ovo 48 vezes (20,51%), e amendoim 28 vezes (11,97%).
Dos 234 TPDCPC, 30 (12,8%) foram positivos, sendo 13 para ovo, 13 para leite de vaca, 2 para peixe, 1 para feijão e 1 para milho. O TPDCPC positivo foi significativamente mais frequente em crianças abaixo de 2 anos de idade, OR: 12,67% [3,24%-49,45%]; (p = 0,0001), e do sexo masculino (OR: 3,79% [1,40%-10,3%]; p = 0,0084).
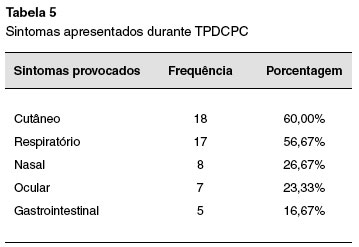
Dos 30 pacientes com TPDCPC positivo (Tabela 5), os sintomas mais frequentes induzidos pela provocação foram cutâneos (60%), e respiratórios (56,67%). Observou-se, também, que 20,3% dos pacientes com diagnóstico inicial de dermatite atópica apresentaram provocação positiva, quando comparados com apenas 11,9% dos pacientes com diagnóstico inicial de asma (Tabela 3). Pacientes com diagnóstico de dermatite atópica tiveram maior razão de chance de apresentar TPDCPC positivo (OR: 2,43 [1,11-5,31]; p = 0,00308), o que também foi observado em crianças com alergia gastrintestinal com OR: 3,51 [1,13-10,93]; p = 0,0388. A maioria das reações induzidas pela provocação foi rápida e facilmente revertida com medicação apropriada. No entanto, um paciente testado com leite de vaca apresentou reação anafilática grave, com hipotensão. Este paciente recuperou-se completamente após algumas horas de tratamento adequado. Apenas um paciente com teste alérgico negativo apresentou TPDCPC positivo.
DISCUSSÃO
Reações adversas a alimentos podem ser de origem imunológica, ou não imunológica. Alergia alimentar resulta de uma resposta imunológica anormal e reprodutível, após a ingestão de um alimento, que pode ou não ser mediada por IgE. Intolerância alimentar é o resultado de mecanismos não imunológicos, e é a causa mais frequente de reação adversa a um determinado alimento12.
A real prevalência de reações alimentares adversas varia com a população estudada. Estudos recentes sugerem que alergia alimentar afeta 6% das crianças americanas menores de 5 anos, e 3,5 a 4% da população geral12. Pacientes suspeitos devem ser adequadamente diagnosticados através de uma avaliação cuidadosa, que inclui uma história precisa e exames apropriados para cada caso. Deve-se sempre ter em mente a diferença entre sensibilidade assintomática e alergia alimentar, sendo muito importante a interpretação adequada do teste alérgico e dos valores de IgE específica. O teste de provocação duplo-cego é o padrão ouro no diagnóstico de alergia alimentar, e é imprescindível em algumas situações. No entanto, na maioria das vezes o diagnóstico de certeza pode ser obtido com testes de provocação aberto ou cego simples, quando a história, teste alérgico e/ou IgE específica não forem suficientes para confirmar o diagnóstico.
Este estudo não foi desenhado para determinar a incidência de alergia alimentar na população estudada. No entanto, trata-se do primeiro estudo na América Latina com um número elevado de pacientes, utilizando TPDCPC em pacientes com suspeita de alergia alimentar. Os dados obtidos indicam que a alergia alimentar, como ocorre em países desenvolvidos, é mais frequente no sexo masculino (OR: 3,79% [1,40%–10,3%]; p = 0,0084), em crianças menores de 2 anos de idade anos (33,33%), e que a incidência decresce com o aumento da idade13-17 (Tabela 2). Cabe salientar, ainda, que a incidência de alergia alimentar na população geral deve ser bem mais baixa, pois as crianças estudadas eram provenientes de um ambulatório de referência, e a maioria tinha teste alérgico positivo para um alimento. Além disto, verificou-se uma maior incidência de alergia alimentar naqueles portadores de dermatite atópica e sintomas gastrointestinais, fato que também está de acordo com outros estudos18.
O teste alérgico é útil, mas não confirma o diagnóstico. Estudos da literatura indicam que tanto o teste alérgico quanto a IgE para o antígeno alimentar são equivalentes15. Apesar de apresentarem uma excelente especificidade e um ótimo valor preditivo negativo, geralmente acima de 95%, a sua sensibilidade e valor preditivo positivo deixam muito a desejar, e geralmente estão entre 30 e 50%9,10,19. Como consequência, diante de um teste alérgico ou IgE negativo para um determinado alimento, podemos praticamente afastar a possibilidade de alergia IgE mediada. Em contrapartida, um teste alérgico positivo para um alimento não nos permite firmar o diagnóstico de alergia mediada por IgE. A dosagem quantitativa da IgE específica pode ajudar em muito no diagnóstico de certeza. Dependendo do alimento suspeito e do nível de IgE específica, pode-se atingir um valor preditivo positivo acima de 95%, que praticamente confirmaria o diagnóstico de alergia alimentar mediada por IgE. Nosso estudo indica uma sensibilidade ainda mais baixa do teste alérgico em relação aos relatados na literatura, com um valor preditivo positivo de apenas 13,5%.
Estudos realizados em países desenvolvidos demonstraram que os alimentos que mais frequentemente causam alergia são amendoim, ovo, leite de vaca, soja, trigo e peixe, sendo estes responsáveis por 90% dos casos de alergia alimentar mediada por IgE1,10. No nosso estudo, podemos constatar que mais de 86,6% dos casos de alergia alimentar são causados por leite de vaca e ovo. Amendoim, soja, peixe e trigo não foram causas frequentes de alergia alimentar. Esta diferença em relação aos outros estudos publicados provavelmente se deve aos diferentes hábitos alimentares da nossa população. Por outro lado, sendo o Brasil um país de dimensões continentais e de diferentes hábitos alimentares, os alimentos mais prevalentes como causadores de alergia alimentar podem variar de região para região. No Brasil e em outros países da América Latina, frequentemente o chocolate é rotulado como causa de alergia alimentar. O diagnóstico é feito baseado em dados subjetivos e, no mínimo, questionáveis. Nossos dados estão de acordo com aqueles encontrados na literatura que indicam que alergia a chocolate é extremamente rara.
Asma foi o diagnóstico mais frequentemente encontrado na população estudada. Isto se deve principalmente à característica do nosso serviço na época do estudo, onde 70% dos pacientes atendidos são portadores de patologias respiratórias. Apesar de asma ser mais frequente na população estudada, a positividade do TPDCPC foi maior nos pacientes portadores de dermatite atópica, ou com sintomas gastrointestinais. Estes dados também estão de acordo com os da literatura, que indicam uma maior incidência de alergia alimentar em pacientes com doenças dermatológicas, principalmente dermatite atópica. Em média, 35% das crianças com dermatite atópica moderada a grave apresentam alergia alimentar mediada por IgE1,10. Nosso estudo mostrou que a incidência de alergia alimentar em pacientes com dermatite atópica foi de apenas 20,3%, abaixo do que é relatado na literatura.
Por fim, podemos concluir que a incidência de alergia alimentar foi de 12,8% na população estudada. Este achado provavelmente está superestimado em relação à população geral, onde provavelmente encontraremos uma incidência bem menor. O teste alérgico e a IgE específica não são exames confiáveis para se confirmar o diagnóstico de alergia alimentar devido à alta incidência de falso-positivo, sendo, na população estudada, de apenas 13,5%. Ovo e leite de vaca são os principais alimentos responsáveis por mais de 90% dos casos de alergia alimentar em nosso meio. Os médicos devem abordar com cautela pacientes com suspeita de alergia alimentar, sendo o mais criteriosos possível, evitando diagnósticos errôneos com prejuízo para o paciente e sua família. Em caso de dúvida no diagnóstico, deve-se sempre tentar realizar o teste de provocação duplo-cego, que é, até o momento, o padrão ouro no diagnóstico de alergia alimentar.
REFERENCES
1. Sicherer SH, Sampson HA. Food allergy: a review and update on epidemiology, pathogenesis, diagnosis, prevention, and management. J Allergy Clin Immunol. 2018;141:41-58.
2. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 1 - Etiopatogenia, clínica e diagnóstico. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia. Arq Asma Alerg Imunol. 2018;2(1):7-38.
3. Burks AW, Tang M, Sicherer S, Muraro A, Eigenmann PA, Ebisawa M, et al. ICON: food allergy. J Allergy Clin Immunology. 2012;129(4):906-20.
4. Bock SA. Prospective appraisal of complaints of adverse reactions to foods in children during the first 3 years of life. Pediatrics. 1987;79(5):863-8.
5. Kayosaasari M. Food allergy in Finnish children aged 1 to 6 years. Acta Paediatr Scand.1982;71,815-9.
6. Shridhar KS, Changqi L, Zaffran VD. Food Allergy. Annu Rev Food Sci Technol. 2016;7,191-220
7. Barclay L, Lie D. New Guidelines Issued for Food Allergies. Annals of Allergy, Asthma and Immunology. March 2006.
8. Burks W, Jones SM, Boyce JA, Sicherer SH, Wood RA, Assa’ad A, Sampson HA. NIAID-sponsored 2010 Guidelines for Managing Food Allergy: Applications in the Pediatric Population. Pediatrics. 2011;128;955.
9. Wood RA. Oral food challenge testing. In: Adkinson Jr. N, Bochner B, Burks A, Busse W, Holgate S, Lemanske R, O’Hehir R. Allergy Principles and Practice. Vol.II. 8ª ed. Elsevier; 2013.
10. Bock AS, Sampson HA, Atkins FM, Zeiger RS, Lehrer Samuel, Sachs Martin, et al. Double-blind, placebo-controlled food challenge (DBPCFC) as na office procedure: a manual. J Allergy Clin Immunol. 1988;82:986-97.
11. Bock S. In vivo diagnosis: skin testing and oral challenge procedures. In: Metcalfe D, Sampson HA, Simon RA. Food allergy: adverse reactions to foods and food additives. 2ª ed. Cambridge Massachusets: Blackwell Science; 1997. p. 151-66.
12. Nowak-Wegrzyn A, Burks W, Sampson HA. Reactions to foods. In: Adkinson Jr. N, Bochner B, Burks A, Busse W, Holgate S, Lemanske R, O’Hehir R. Allergy Principles and Practice. Vol.II. 8ª ed. Elsevier; 2013.
13. Kivity S, Dunner K, Marian Y. The pattern of food hypersensivityin patients with onset after 10 years off age. Clin Exp Allergy. 1994;24:19-22.
14. Bernstein M, Day JH, Welsh A. Double-blind food challenge in the diagnosis of food sensitivity in the adult. J Allergy Clin Immunol. 1982;70:205-10.
15. Atkins FM, Steinberg SS, Metcalfe DD. Evaluation of immediate adverse reactions to foods in adult patients. II. A detailed analysis of reactions patterns during oral food challenge. J Allergy Clin Immunol. 1985;75(3):356-63.
16. Ostterballe M, Hansen TK, Mortz CG, Host A, Bindslev-Jensen C. The Prevalence of food hypersensitivity in an unselected population of children and adults. Pediatrics Allergy & Immunolog. 2005;16:567-73.
17. Wood RA. The Natural History of Food Allergy. Pediatrics. 2003;111:1631-7.
18. Eigenmann PA, Sicherer SH, Borkowski TA, Cohen BA, Sampson HA. Prevalence of IgE-mediated food allergy among children with atopic dermatitis. Pediatrics. 1998;101:8.
19. Sampson HA, Albergo R. Comparison of results of skin tests, RAST, and double-blind, placebo-controlled food challenges with atopic dermatitis. J Allergy Clin Immunol. 1984;74:26.
20. Metcalfe DD, Sampson HA. Workshop on experimental methodology for clinical studies of adverse reactions to foods and foods additives J Allergy Clin Immunol. 1990;3(part 2 suppl):421-42.
21. Burks AW, Sampson HA. Double-blind placebo-controlled trial of oral cromolyn in children with atopic dermatitis and documented food hypersensitivity. J Allergy Clin Immunol. 1988;81:417.
22. Leinhas JL, McCaskill CC, Sampson HA. Food allergy challenges: guidelines and implications. J Am Diet Assoc. 1987;87(5):604-8.
23. Host A, Halken S. A prospective study of cow milk allergy in Danish infants during the first 3 years of life. Allergy. 1990;45:587-96.
24. Schrander JJP, van den Bogart JPH, Forget PP, Scrander-Stumpel CTRM, Kuijten RH, Kester ADM. Cow’s milk protein intolerance in infant under 1 year of age: a prospective epidemiological study. Eur J Pediatr. 1993;152:640-4.
25. Bock SA, Atikins FM. Patterns of food hypersensitivity during sixteen years of double- blind placebo-controlled food challenge. J Pediatr. 1990;70:561-7.
26. Silber GM, Sampson HÁ. Nasal mediator release following doubleblind placebo-controlled oral food challenges [abstract]. J Allergy Clin Immunol. 1988;81:185.
27. Sampson HA, Broadbent JB, Scalon SM. Food-induced respiratory reactions in children with atopic dermatitis [abstract]. J Allergy Clin Immunol. 1989;83:241.
28. Sampson HA, Mendelson L, Rosen JP. Fatal and near fatal-induced anaphilaxyis. N Engl Med. 1992;327:380-4.
29. Koerner CB, Sampson HÁ. Diets and nutrition. In: Metcalf DD, Sampson HÁ, Simon RA, eds. Food allergy. Adverse reactions to foods and food additives. Boston: Blackwell Scientific Publications; 1991. p. 333-53.
30. Sampson HA. Food Allergy. Part 1: Imunopathogenesis and clinical disorders. J Allergy Clin Immunol. 1999;103:717-28.
31. Sampson HA. Food Food Allergy. Part 2: Diagnosis and management. J Allergy Clin Immunol. 1999;103:981-9.