Número Atual: Outubro-Dezembro 2017 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Hipersensibilidade a anti-inflamatórios não esteroidais em crianças: relato de dois casos e revisão das novas classificações
Hypersensitivity reactions to nonsteroidal anti-inflammatory drugs in children: report of two cases and review of new classifications
Mara Morelo Rocha Felix1,2; Gladys Reis e Silva de Queiroz3; Carolina Sanchez Aranda4,5; Marcelo Vivolo Aun6,7; Ullissis Pádua de Menezes8; Adriana Teixeira Rodrigues9; Inês Cristina Camelo-Nunes5; Monica Soares de Souza1; Emanuel Sávio Cavalcanti Sarinho10; Maria Fernanda Malaman11
DOI: 10.5935/2526-5393.20170060
1. Hospital Federal dos Servidores do Estado (HFSE), Setor de Alergia e Imunologia Pediátrica - Rio de Janeiro, RJ, Brasil
2. Faculdade de Medicina Souza Marques, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
3. Universidade Federal de Pernambuco (UFPE), Hospital das Clínicas - Recife, PE, Brasil
4. Hospital do Servidor Público Municipal de Sao Paulo, Clínica de Alergia - Sao Paulo, SP, Brasil
5. Universidade Federal de Sao Paulo (UNIFESP-EPM), Disciplina de Alergia, Imunologia Clínica e Reumatologia - Departamento de Pediatria - Sao Paulo, SP, Brasil
6. Universidade de Sao Paulo (FMUSP), Disciplina de Imunologia Clínica e Alergia - Sao Paulo, SP, Brasil
7. FICS Albert Einstein, Disciplina Agente Hospedeiro - Sao Paulo, SP, Brasil
8. Faculdade de Medicina de Ribeirao Preto (FMUSP-Ribeirao Preto), Serviço de Alergia e Imunologia Clínica e Pediátrica - Ribeirao Preto, SP, Brasil
9. Hospital do Servidor Público de Sao Paulo (IAMSPE), Serviço de Alergia e Imunologia - Sao Paulo, SP, Brasil
10. Universidade Federal de Pernambuco (UFPE), Centro de Pesquisas em Alergia e Imunologia Clínica - Recife, PE, Brasil
11. Universidade Tiradentes, Faculdade de Medicina - Aracaju, SE, Brasil
Endereço para correspondência:
Mara Morelo Rocha Felix
E-mail: maramorelo@gmail.com
Submetido em: 05/09/2017
Aceito em: 16/10/2017
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
Os anti-inflamatórios nao esteroidais (AINEs) sao amplamente utilizados para tratamento de dor e/ou febre em crianças. Atualmente, constituem a principal causa de reaçao de hipersensibilidade (RH) a medicamentos em adultos e crianças de vários países, inclusive do Brasil. Existem dois mecanismos envolvidos nessas reaçoes: mecanismos nao imunológicos (devido à inibiçao da enzima ciclooxigenase), e mecanismos imunológicos responsáveis pelas reaçoes alérgicas (mediadas por IgE ou células T). As reaçoes mais comuns em crianças e adolescentes sao aquelas decorrentes de mecanismos nao imunológicos. As manifestaçoes clínicas variam desde urticária/angioedema/anafilaxia, que ocorrem em poucos minutos a horas após a administraçao do AINE, até reaçoes tardias, que podem surgir vários dias após o início do tratamento. A história clínica detalhada é fundamental para o diagnóstico. Os testes in vitro sao pouco validados, mas os testes cutâneos podem ser realizados nos casos de suspeita de uma RH seletiva, com provável mecanismo imunológico. O teste de provocaçao oral (TPO) é considerado o padrao ouro para o diagnóstico, e pode auxiliar na escolha de uma alternativa segura. Este artigo relata dois casos de hipersensibilidade a AINEs em crianças que ilustram tipos diferentes de mecanismos (nao imunológico e imunológico) com manifestaçoes clínicas distintas: urticária (imediata) e erupçao fixa por droga (nao imediata). Existe dificuldade na classificaçao das RHs aos AINEs, assim como ocorreu em um dos casos descritos. Portanto, há necessidade de mais estudos nessa área buscando ampliar o conhecimento e melhorar a avaliaçao e seguimento dessas crianças com RH a AINEs.
Descritores: Anti-inflamatórios, hipersensibilidade a drogas, criança.
INTRODUÇAO
As reaçoes adversas a drogas e, em especial, as reaçoes de hipersensibilidade (RH), representam um grande problema de saúde na prática clínica em pediatria1. Cerca de 10% dos pais relatam que seus filhos apresentam hipersensibilidade a pelo menos um medicamento1. Entretanto, somente poucas reaçoes sao confirmadas após uma investigaçao alergológica completa1. Sabe-se, também, que alguns aspectos da hipersensibilidade a drogas diferem entre adultos e crianças. Portanto, há necessidade de dados epidemiológicos de alta qualidade realizados em crianças, a fim de reduzir a extrapolaçao de dados de adultos para a faixa etária infantil1.
Os anti-inflamatórios nao esteroidais (AINEs) sao amplamente utilizados para tratamento de dor e/ou febre em crianças. Atualmente, constituem a principal causa de RH a medicamentos em adultos e crianças de vários países, inclusive do Brasil2-5.
Existem dois mecanismos envolvidos nessas reaçoes: mecanismos nao imunológicos (devido à inibiçao da enzima ciclooxigenase - COX), e mecanismos imunológicos, responsáveis pelas reaçoes alérgicas (mediadas por IgE ou células T)3,6.
As reaçoes mais comuns em crianças e adolescentes sao aquelas decorrentes de mecanismos nao imunológicos3. Os AINEs mais implicados nessas reaçoes sao o paracetamol e o ibuprofeno3,7. Estes AINEs, além das pirazolonas, também sao os desencadeantes mais frequentes das reaçoes seletivas IgEmediadas em crianças6. As reaçoes seletivas tardias sao infrequentes em crianças, mas foram associadas ao ibuprofeno, naproxeno e dipirona6.
As manifestaçoes clínicas decorrentes das RH aos AINEs variam desde urticária/angioedema/anafilaxia que ocorrem em poucos minutos a horas após a administraçao do AINE, até reaçoes tardias, que podem surgir vários dias após o início do tratamento8. As reaçoes cutâneas tardias nao graves em crianças podem se apresentar como exantema maculopapular, urticária, dermatite de contato, erupçao fixa por drogas (EFD) e doença do soro-símile9.
A EFD apresenta-se clinicamente como uma lesao localizada, circunscrita, com formato redondo ou oval, de coloraçao eritematosa ou violácea, algumas vezes com vesículas e/ou bolhas9. A principal característica é que a lesao reaparece no mesmo local cada vez que o fármaco desencadeante for administrado, e pode reaparecer em menor intervalo de tempo se houver administraçoes subsequentes9. Geralmente, surge dentro de duas semanas após administraçao da droga, e ocorre regressao das lesoes em uma semana, deixando na maior parte dos casos lesao residual acinzentada. Acredita-se que a patogênese se enquadra na reaçao de hipersensibilidade tipo IVc6,9.
Várias classificaçoes foram propostas para os pacientes com RH aos AINEs, porém a maioria delas baseou-se em estudos realizados em adultos8,10,11. A classificaçao mais recente elaborada pelo ENDA (European Network for Drug Allergy) divide as RH a AINEs em cinco fenótipos: (1) doença respiratória exacerbada por AINEs (DREA); (2) doença cutânea exacerbada por AINEs (DCEA); (3) urticária/angioedema induzidos por AINEs (UAIA); (4) urticária/ angioedema ou anafilaxia induzidos por AINE único (UAAIUA); e (5) reaçoes tardias induzidas por AINE único (RHTIUA)8. Os fenótipos 1, 2 e 3 do ENDA sao também conhecidos como intolerantes cruzados (reagem a mais de um AINE), e o 4 e o 5 sao os reatores seletivos (reagem a um AINE único)3. Entretanto, muitas crianças com RH a AINEs nao se encaixam nessa classificaçao. Há casos de pacientes pediátricos em que ocorrem fenótipos mistos (DREA e UAIA).
Cousin e colaboradores realizaram um estudo prospectivo observacional com 635 crianças, das quais 107 tiveram confirmaçao da RH através de testes de provocaçao oral (TPO)12. Destas, 43 (40,2%) nao puderam ser completamente classificadas utilizando a classificaçao do ENDA12. Baseados nesses resultados, eles propuseram uma nova classificaçao para a faixa etária pediátrica em três grupos: grupo I: hipersensibilidade nao alérgica aos AINEs; grupo II: urticária/angioedema/anafilaxia induzidos por AINE único; e grupo III: reaçoes tardias induzidas por AINE único12.
Em outro estudo, Arikoglu e colaboradores investigaram 106 crianças com suspeita de hipersensibilidade a AINEs13. Houve confirmaçao da RH em 31 pacientes, sendo que 8 (24,2%) nao puderam ser classificados de acordo com a proposta do ENDA13.
Outro aspecto particular das RH a AINEs em crianças é que a doença respiratória exacerbada por AINEs nao é comumente observada nessa faixa etária12. De fato, no estudo de Cousin e colaboradores, nao houve nenhum paciente com esse diagnóstico, e no trabalho de Arikoglu, apenas um paciente teve diagnóstico de doença respiratória12,13. Cavkaytar e colaboradores analisaram 30 crianças com diagnóstico de RH a AINEs, e apenas uma apresentava doença respiratória exacerbada por AINEs14.
As manifestaçoes clínicas mais comuns das RH a AINEs em crianças e adolescentes sao a urticária e o angioedema3,12. A avaliaçao clínica baseia-se principalmente na história e nos TPOs3,15,16. Os testes cutâneos in vivo e os testes in vitro sao de limitado valor diagnóstico, e sao utilizados quando há suspeita de reaçoes imunológicas6,15. O TPO é considerado o padrao ouro para o diagnóstico, e pode auxiliar na escolha de uma alternativa segura3,17.
O objetivo deste artigo é relatar dois casos de hipersensibilidade a AINEs em crianças, e discutir a abordagem diagnóstica.
DESCRIÇAO DOS CASOS
Caso 1
Criança do sexo masculino, 4 anos de idade, pardo, compareceu ao ambulatório de Alergia e Imunologia de um hospital terciário pela primeira vez aos 7 meses de idade. A mae relatava surgimento de placas eritematosas disseminadas pelo corpo após uso oral de dipirona, ibuprofeno e paracetamol. As reaçoes ocorreram cerca de 1 hora após a administraçao das medicaçoes citadas, sem sintomas respiratórios, digestivos e/ou cardiovasculares associados. Referia que na maioria dos episódios, a criança apresentava febre, sendo esta a indicaçao do AINE. Negava outras patologias ou sintomas semelhantes sem a ingestao das drogas suspeitas. Como tratamento desses episódios, o paciente recebeu anti-histamínico, com melhora dos quadros de urticária.
O paciente foi avaliado através de um questionário padronizado e adaptado do ENDA em outubro de 2013, e, após a assinatura de um termo de consentimento pelo responsável, ele foi submetido a um TPO com benzidamina gotas em ambiente hospitalar. O teste foi realizado sem placebo, sob supervisao médica, com programaçao de 4 etapas (10%, 20%, 30% e 40% da dose total) e intervalos de 30 minutos entre as doses. Após a segunda dose, o paciente apresentou placas urticariformes em face e tronco, sendo administrada fexofenadina oral. O teste foi suspenso e a criança foi liberada após 2h de observaçao com melhora do quadro e orientaçao para uso de antihistamínico oral em casa. Recebeu uma lista com os nomes dos AINEs para evitar o uso, e programaçao para realizaçao futura de um TPO com paracetamol.
O paciente permaneceu sem retornar ao Serviço até 2016, quando foram realizados TPOs com dipirona e paracetamol gotas em diferentes datas. O TPO com um inibidor forte da COX-1 (dipirona) teve como objetivo confirmar o diagnóstico, e verificar se o paciente apresentava reatividade cruzada a mais de um AINE de grupo químico diferente, como era sugerido pela história clínica. O TPO com um inibidor fraco da COX-1 (paracetamol) objetivou oferecer uma alternativa terapêutica para a criança. Os testes foram realizados em ambiente hospitalar, sob supervisao médica, e após assinatura do termo de consentimento. Ambos os testes foram positivos, com surgimento de rash cutâneo após a 2ª dose da dipirona (dose cumulativa 75 mg), e urticária após 20 minutos da 1ª etapa do teste com paracetamol (dose cumulativa 25 mg). Ele foi tratado com hidroxizina (anti-histamínico disponível no hospital) em ambas situaçoes, e houve recuperaçao completa do quadro após cerca de 1 hora, sem outras manifestaçoes. A mae foi orientada a evitar o uso de todos os AINEs, inclusive paracetamol. Em caso de febre, os corticosteroides orais foram prescritos como opçao aos anti-inflamatórios.
Caso 2
Criança do sexo feminino, com 10 anos, foi atendida num ambulatório de Alergia e Imunologia de um hospital escola em 2010. A genitora relatava aparecimento de lesao eritematosa com posterior formaçao de bolha na regiao sacral após uso de paracetamol via oral em doses habituais desde os 9 anos de idade. Foram quatro episódios, todos no mesmo local, com surgimento aproximadamente 48 horas após ingestao da medicaçao, e que regrediam após 1 semana, deixando mácula hipercrômica residual.Todas as lesoes se iniciaram com eritema local, prurido e posterior formaçao de bolhas de conteúdo hialino. O paracetamol foi suspenso, porém um novo surto aconteceu após uso de dipirona endovenosa em doses habituais, com ampliaçao das lesoes residuais e surgimento de novas lesoes (regioes pubiana e inframamárias), sem formaçao de bolhas.
A paciente foi avaliada através do questionário padronizado e adaptado do ENDA, em outubro de 2010. Foram realizados testes de contato (TC) após assinatura do termo de consentimento pelo responsável em todos os momentos em que houve realizaçao de procedimentos. O TC foi realizado sobre as lesoes residuais (sacral e inframamárias) com paracetamol na concentraçao de 20% (correspondente a 80 mg de 400 mg/dose estabelecida para idade), sendo negativo. De toda forma, foi recomendado a evitar o paracetamol. Quando retornou ao nosso serviço após 6 meses, houve relato da reaçao acima descrita com dipirona. Nessa ocasiao, foi realizado novo TC nos locais referidos acima com dipirona, paracetamol e ibuprofeno, todos preparados na concentraçao de 20% (correspondente a 80 mg de 400 mg/dose estabelecida para idade da dipirona e do paracetamol, e 30 mg de 150 mg/dose estabelecida para idade do ibuprofeno), com positividade para dipirona (Figura 1). Em 17/10/11, pela negatividade do TC ao paracetamol e ibuprofeno, procedeu-se a realizaçao do TPO com o paracetamol, mantendo a paciente internada sob supervisao médica, com programaçao de 3 etapas e intervalos de 12 horas (25%, 25% e 50%). Em seguida, foi administrado o paracetamol de 6/6 horas (15 mg/kg). Apresentou eritema e prurido na regiao sacral após 48 horas do início do TPO, sendo tratada com prednisona e loratadina por 7 dias. Foi orientada a suspender o paracetamol e a dipirona e continuar utilizando o ibuprofeno.
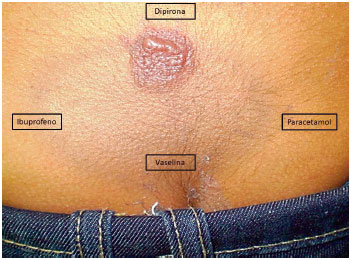
Figura 1 Teste de contato com AINEs no local da lesao residual (regiao sacral) da erupçao fixa por droga (EFD). Teste positivo para dipirona e negativo para ibuprofeno e paracetamol
A paciente continuou sendo acompanhada no Serviço. Houve relato de uso de viminol para cefaleia, escopolamina para cólicas, ibuprofeno e nimesulida (administraçao realizada por iniciativa da genitora) somente para febre, sem reaçoes. Em 2015, apresentou eritema e prurido com lesoes residuais nas regioes habituais, após cerca de 6 horas da ingestao de água no mesmo copo em que o genitor havia tomado dipirona.
DISCUSSAO
Os casos acima descritos representam dois tipos diferentes de hipersensibilidade a AINEs em crianças. O primeiro é observado mais frequentemente, sendo causado por mecanismo nao imunológico, com intolerância cruzada a vários AINEs de grupos químicos diferentes. Já o segundo, é uma situaçao incomum, com uma hipersensibilidade tardia a dois AINEs. Ambos os pacientes foram investigados através do questionário padronizado do ENDA e TPO, e o segundo foi submetido também ao TC, importante ferramenta diagnóstica para casos de EFD.
O caso 1 pode ser classificado como um caso de UAIA (grupo 3 do ENDA), ou como hipersensibilidade nao alérgica por AINEs (grupo I da classificaçao nova proposta por Cousin e colaboradores)8,12. A investigaçao foi realizada através da anamnese obtida de uma forma sistematizada com o questionário padronizado do ENDA. Como a história era bastante sugestiva de hipersensibilidade imediata a vários AINEs, inicialmente buscou-se uma alternativa segura através do TPO com a benzidamina (inibidor fraco da COX-1), que nao havia sido utilizado anteriormente. Entretanto, o teste foi positivo. Depois, o paciente permaneceu três anos sem procurar o Serviço. Como ele ainda nao havia sido testado com um inibidor forte da COX-1, e o diagnóstico de intolerância cruzada inclui o TPO com esse tipo de AINE, optou-se por realizar TPO com a dipirona (inibidor forte da COX-1) para confirmar o diagnóstico, e com o paracetamol (inibidor fraco da COX-1), para oferecer uma alternativa. Ambos os testes foram considerados positivos, pois houve manifestaçoes objetivas (rash cutâneo e urticária). Na faixa etária pediátrica, o uso dos coxibes (inibidores seletivos de COX-2) está contraindicado. Optou-se, entao, por orientar o uso dos corticosteroides como antiinflamatórios em caso de febre.
O caso 2 é uma situaçao infrequente, na qual a paciente apresentou quadro clínico característico de EFD a dois AINEs de estruturas diferentes (paracetamol e dipirona), e que tolera ibuprofeno e nimesulida15. Portanto, ela nao se encaixaria em nenhuma das duas classificaçoes citadas anteriormente, pois teve reaçao tardia a dois AINEs, e nao a um AINE único. As categorias mais próximas seriam a RHTIUA (grupo 5 do ENDA), e a reaçao tardia induzida por AINE único (grupo III da classificaçao de Cousin e colaboradores)8,12. Este fato é interessante, pois observa-se que mesmo as classificaçoes mais novas sao incapazes de abranger todo o espectro de RH aos AINEs.
A história clínica detalhada é fundamental para o diagnóstico das RH aos AINEs, e deve incluir a descriçao dos sintomas, o intervalo de tempo entre a administraçao da droga e o início dos sintomas, as drogas envolvidas, as drogas toleradas após a reaçao, a via de administraçao, o número de episódios e as doenças concomitantes15.
No caso 1, o paciente apresentava história sugestiva de intolerância cruzada com três episódios de manifestaçoes cutâneas após a ingestao de três AINEs de grupos químicos diferentes. Nao apresentava história de doenças atópicas ou urticária crônica. No caso 2, a paciente apresentava história clínica compatível com EFD com paracetamol (vários episódios) e dipirona (sinais e sintomas mais exacerbados). A EFD nao é difícil de ser diagnosticada quando se conhece as suas características de apresentaçao clínica e evoluçao. As áreas do corpo mais comumente acometidas por essa condiçao sao lábios, genitália (principalmente masculina), e, ocasionalmente, mucosa oral. Estudos ainda investigam a predileçao por algumas áreas do corpo, a depender da droga envolvida pela EFD6.
Os testes cutâneos podem ser realizados nos casos de suspeita de uma RH seletiva, com provável mecanismo imunológico6. Os testes de puntura e intradérmico de leitura imediata sao utilizados nas reaçoes agudas (mediadas por IgE), e os testes intradérmicos de leitura tardia e/ou de contato nas reaçoes tardias6. Em 2013, a European Network on Drug Allergy (ENDA) e a European Academy of Allergy and Clinical Immunology (EAACI) publicaram um artigo recomendando concentraçoes para realizaçao de testes cutâneos em casos de RH a medicamentos (entre eles, TC para AINEs) utilizando como critério uma especificidade de 95%, sendo estabelecida a concentraçao de 10% para TC com AINEs18. No entanto, no caso 2, os TC foram realizados em 2010 e, como no referido período havia divergência nas concentraçoes, optou-se por utilizar 20%18,19.
No caso 1, como a história era compatível com mecanismo nao imunológico, o paciente nao foi submetido a testes cutâneo3. No caso 2, foi realizado TC com o paracetamol que nao positivou, mesmo após quatro episódios com esse fármaco. Posteriormente, foram realizados TC com repetida negatividade ao paracetamol, positividade à dipirona e negatividade para o ibuprofeno. Em todos os TC, foram utilizadas as formas comercializadas das drogas e a concentraçao de 20%. O TC com paracetamol possui uma boa especificidade, porém com uma sensibilidade baixa. Ele é importante porque reduz a necessidade do TPO, entretanto um TC negativo nao exclui a hipersensibilidade à droga testada. Em casos de reaçoes tardias nao graves, pode-se considerar a realizaçao de um TPO para melhor avaliaçao da RH19.
Na EFD, as células T CD8+ têm um papel primordial na lesao da epiderme, pois estao presentes na pele com ou sem crise20. Essas células mantêm a memória específica da droga sem estímulo antigênico presente e, na fase aguda, produzem grande quantidade de interferon-g. Atualmente, sabe-se que existe uma complexa interaçao entre alguns vírus e as RH a medicamentos, como no caso da EFD, que pode ocorrer antes, durante e após a RH, com curso clínico e gravidade variáveis21.
Os testes in vitro sao pouco validados para investigaçao de RH aos AINEs6. De toda forma, podem ser realizados em casos onde há suspeita de mecanismo imune. Existem relatos descrevendo dosagem de IgE específica para alguns AINEs como as pirazolonas, mas nao há padronizaçao, e os resultados sao pouco convincentes22. O teste de ativaçao basofílica (BAT) mostrou ser útil para reaçoes a pirazolonas, porém com uma sensibilidade em torno de 50%23. No caso 1, como nao havia suspeita de mecanismo imune, estes testes seriam pouco úteis. Por outro lado, os testes in vitro para avaliaçao de RH aos AINEs mediada por células T também precisam ter sua utilidade melhor elucidada, pois nao houve demonstraçao de boa acurácia nos estudos realizados até o momento6.
Os TPOs em crianças podem ser realizados para confirmar a RH ou, mais frequentemente, para encontrar uma alternativa terapêutica segura. Existem diversos protocolos, sendo que a maioria dos pediátricos utiliza intervalos de 60-90 minutos3. Uma opçao bastante segura é o paracetamol (inibidor fraco da COX-1), geralmente bem tolerado nas doses habituais (15-20 mg/kg). Um estudo demonstrou hipersensibilidade ao paracetamol em apenas 4% das crianças avaliadas por TPO3. Entretanto, alguns pacientes reagem até mesmo ao paracetamol, como foi o caso 1. Nessas situaçoes, o arsenal terapêutico fica restrito. Alguns pesquisadores estudaram o uso off-label de inibidores seletivos de COX-2 (p. ex. etoricoxibe) e consideram estes medicamentos uma alternativa segura para crianças mais velhas (peso ≥ 40 kg) com hipersensibilidade a múltiplos AINEs24. Como o paciente do caso 1 ainda tem 4 anos, optouse por nao realizar testes com o etoricoxibe. No caso 2, houve necessidade de realizaçao de TPO com o paracetamol, o qual reproduziu reaçao característica da EFD. Na literatura existe uma grande diversidade de recomendaçoes para TPOs a depender da intensidade de sintomas, entao foi decidido realizar TPO com doses pequenas crescentes e, dependendo da evoluçao, chegar à posologia terapêutica até desencadear a lesao de pele3,6,8,15. Ressalta-se que como o caso 2 tratava-se de uma hipersensibilidade tardia, o TPO foi realizado com intervalos maiores e com duraçao superior ao caso 1.
CONCLUSAO
Os AINEs constituem a principal causa de RH a medicamentos em crianças e adultos no Brasil. Os dois casos descritos de RH a AINEs em crianças ilustram tipos diferentes de mecanismos (nao imunológico e imunológico) com manifestaçoes clínicas distintas: urticária (imediata) e EFD (nao imediata). O intercâmbio de experiências e conhecimentos entre os centros de referência em alergia em nosso meio será essencial na produçao de estudos multicêntricos que contribuam para o diagnóstico e classificaçao das RH aos AINES.
AGRADECIMENTOS
Agradecimento especial aos médicos do Hospital Federal dos Servidores do Estado-RJ, Drs. Aniela Bonorino Xexéo Castelo Branco, Jaqueline Coser Vianna, Raquel Grinapel e José Roberto Coelho dos Santos, pela contribuiçao no Ambulatório de Reaçoes Adversas a Medicamentos.
Agradecimento merecido aos médicos do Hospital das Clínicas da Universidade Federal de Pernambuco-PE pela colaboraçao em um dos casos clínicos, Drs. Dayanne Mota Veloso Bruscky, Luiz Alexandre Rocha, e à Coordenaçao do Centro de Pesquisas em Alergia e Imunologia Clínica: Drs. José Angelo Rizzo, Almerinda Maria do Rêgo Silva e Décio Medeiros Peixoto.
REFERENCIAS
1. Gomes ER, Brockow K, Kuyucu S, Saretta F, Mori F, Blanca-Lopez N, et al. Drug hypersensitivity in children: report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy. 2016;71(2):149-61.
2. Jares EJ, Sánchez-Borges M, Cardona-Villa R, Ensina LF, Arias-Cruz A, Gómez M, et al. Multinational experience with hypersensitivity drug reactions in Latin America. Ann Allergy, Asthma Immunol. 2014;113(3):282-9.
3. Blanca-López N, Cornejo-García JA, Plaza-Serón MC, Doña I, Torres-Jaén MJ, Canto G, et al. Hypersensitivity to nonsteroidal antiinflammatory drugs in children and adolescents: cross-intolerance reactions. J Investig Allergol Clin Immunol. 2015;25(4):259-69.
4. Aun MV, Blanca M, Garro LS, Ribeiro MR, Kalil J, Motta AA, et al. Nonsteroidal anti-inflammatory drugs are major causes of drug-induced anaphylaxis. J Allergy Clin Immunol Pract. 2014;2(4):414-20.
5. Ensina LF, de Lacerda AE, de Andrade DM, Machado L, Camelo- Nunes I, Solé D. Drug-induced anaphylaxis in children: nonsteroidal anti-inflammatory drugs and drug provocation test. J allergy Clin Immunol Pract. 2014;2(6):825.
6. Blanca-López N, Cornejo-García JA, Pérez-Alzate D, Pérez- Sánchez N, Plaza-Serón MC, Doña I, et al. Hypersensitivity reactions to nonsteroidal anti-inflammatory drugs in children and adolescents: selective reactions. J Investig Allergol Clin Immunol. 2015;25(6):385-95.
7. Alves C, Romeira AM, Abreu C, Carreiro-Martins P, Gomes E, Leiria-Pinto P. Non-steroidal anti-inflammatory drug hypersensitivity in children. Allergol Immunopathol (Madr). 2017;45(1):40-7.
8. Kowalski ML, Asero R, Bavbek S, Blanca M, Blanca-Lopez N, Bochenek G, et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs. Allergy. 2013;68(10):1219-32.
9. Noguera-Morel L, Hernández-Martín A, Torrelo A. Cutaneous drug reactions in the pediatric population. Pediatr Clin North Am. 2014;61(2):403-26.
10. Stevenson DD, Sanchez-Borges M, Szczeklik A. Classification of allergic and pseudoallergic reactions to drugs that inhibit cyclooxygenase enzymes. Ann Allergy, Asthma Immunol. 2001;87(3):177-80.
11. Kowalski ML, Makowska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al. Hypersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) - classification, diagnosis and management: review of the EAACI/ENDA# and GA2LEN/HANNA*. Allergy. 2011;66(7):818-29.
12. Cousin M, Chiriac A, Molinari N, Demoly P, Caimmi D. Phenotypical characterization of children with hypersensitivity reactions to NSAIDs. Pediatr Allergy Immunol. 2016;27(7):743-8.
13. Arikoglu T, Aslan G, Yildirim DD, Batmaz SB, Kuyucu S. Discrepancies in the diagnosis and classification of nonsteroidal anti-inflammatory drug hypersensitivity reactions in children. Allergol Int. 2017;66(3):418-24
14. Cavkaytar O, Arik Yilmaz E, Karaatmaca B, Buyuktiryaki B, Sackesen C, Sekerel BE, et al. Different phenotypes of non-steroidal antiinflammatory drug hypersensitivity during childhood. Int Arch Allergy Immunol. 2015;167(3):211-21.
15. Ortega N, Doña I, Moreno E, Audicana MT, Barasona MJ, Berges- Gimeno MP, et al. Practical guidelines for diagnosing hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. J Investig Allergol Clin Immunol. 2014;24(5):308-23.
16. Torres MJ, Barrionuevo E, Kowalski M, Blanca M. Hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Immunol Allergy Clin North Am. 2014;34(3):507-24.
17. Defrance C, Bousquet P-J, Demoly P. Evaluating the negative predictive value of provocation tests with nonsteroidal antiinflammatory drugs. Allergy. 2011;66(11):1410-4.
18. Brockow K, Garvey LH, Aberer W, Atanaskovic-Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs - an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2013;68(6):702-12.
19. Barbaud A. Skin testing and patch testing in non-IgE-mediated drug allergy. Curr Allergy Asthma Rep. 2014;14(6):442.
20. Shiohara T, Mizukawa Y. Fixed drug eruption: a disease mediated by self-inflicted responses of intraepidermal T cells. Eur J Dermatol. 2017;17(3):201-8.
21. Shiohara T, Ushigome Y, Kano Y, Takahashi R. Crucial role of viral reactivation in the development of severe drug eruptions: a comprehensive review. Clin Rev Allergy Immunol. 2015;16;49(2):192-202.
22. Himly M, Jahn-Schmid B, Pittertschatscher K, Bohle B, Grubmayr K, Ferreira F, et al. IgE-mediated immediate-type hypersensitivity to the pyrazolone drug propyphenazone. J Allergy Clin Immunol. 2003;111(4):882-8.
23. Gómez E, Blanca-Lopez N, Torres MJ, Requena G, Rondon C, Canto G, et al. Immunogloblin E-mediated immediate allergic reactions to dipyrone: value of basophil activation test in the identification of patients. Clin Exp Allergy. 2009;39(8):1217-24.
24. Loh W, Lim HH, Rao R, Goh A, Ong LX, Chiang WC. Tolerance to etoricoxib in children with nonsteroidal anti-inflammatory drug hypersensitivity. Asia Pac Allergy. 2015;5(1):40.



