Número Atual: Outubro-Dezembro 2017 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Dermatite autoimune à progesterona
Autoimmune progesterone dermatitis
Danilo Gois Gonçalves; Jorge Kalil; Pedro Giavina-Bianchi
DOI: 10.5935/2526-5393.20170053
Disciplina de Imunologia Clínica e Alergia da Faculdade de Medicina da Universidade de Sao Paulo (USP) - Sao Paulo, SP, Brasil
Endereço para correspondência:
Danilo Gois Gonçalves
E-mail: dangoisg@hotmail.com
Submetido em: 03/11/2017
Aceito em: 20/11/2017
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A dermatite autoimune à progesterona (DAP) é uma reaçao autoimune à progesterona de origem endógena ou exógena, caracterizada por manifestaçoes clínicas e mecanismos fisiopatológicos diversos. Doença complexa, subdiagnosticada e associada à alta morbidade. O diagnóstico de DAP baseia-se na associaçao de sintomas cíclicos ou induzidos por progesterona exógena, testes cutâneos e/ou de provocaçao à progesterona positivos, e resposta clínica à inibiçao da ovulaçao.
Descritores: Dermatite, autoimunidade, progesterona.
Acredita-se que a dermatite autoimune à progesterona (DAP) seja uma reaçao autoimune à progesterona de origem endógena ou exógena, caracterizada por lesoes cutâneas cíclicas em cerca de 73% dos pacientes1-3, geralmente durante a fase lútea do ciclo menstrual, quando os níveis de progesterona estao elevados em mulheres de idade fértil4. Os sintomas geralmente começam 3 a 10 dias antes da menstruaçao, e terminam normalmente até 3 dias após o início da menstruaçao, uma vez que os níveis de progesterona diminuem espontaneamente5-7. A idade média de início da sintomatologia é de 27,3 anos3. Mulheres ou mesmo homens que tomam progesterona sintética podem ser afetados, sendo que cerca de 45% dos pacientes foram previamente expostos1,3,5. Algumas pacientes apresentam lesoes cutâneas contínuas que pioram na fase lútea do ciclo menstrual3.
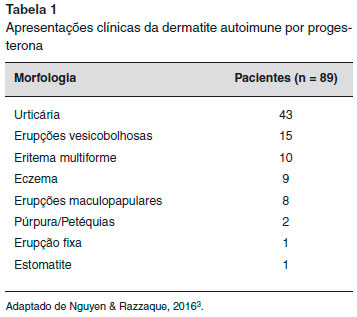
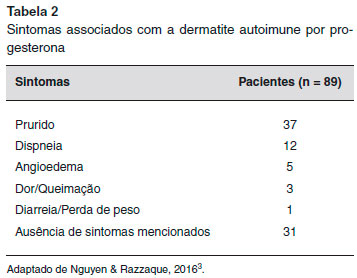
A urticária e o angioedema sao as manifestaçoes mais comuns da DAP. No entanto, a apresentaçao clínica varia e também pode incluir anafilaxia, eczema, pompholyx, lesoes morbiliformes, eritema multiforme, síndrome de Stevens-Johnson, reaçoes vesiculobolhosas, lesoes mucosas, erupçoes papulovesiculares ou papulopustulares, eritema anular centrífugo, erupçoes fixas, púrpura e prurido vulvovaginal4-6,8-10 (Tabelas 1 e 2). Além disso, um paciente pode ter mais de um tipo de lesao cutânea11,12.
A patogênese nao está clara, e vários mecanismos provavelmente estao envolvidos. Uma hipótese consiste em hipersensibilidades de tipo I, III e IV após uma provável exposiçao anterior à progesterona, como evidenciado por testes cutâneos com progesterona positivos (teste intradérmico positivo após 15 a 20 minutos, 6 a 8 horas ou 48 a 72 horas, respectivamente)13. Pacientes com DAP com anticorpos IgE contra progesterona foram relatados11. Em alguns casos, foram encontrados anticorpos IgG específicos para progesterona, que sugerem uma base autoimune5. Em poucos casos, os achados histológicos cutâneos mostram imunofluorescência direta positiva, o que indica deposiçao de imunocomplexos4. A doença pode ficar latente em algumas mulheres grávidas, uma vez que a gravidez "imita" um processo de dessensibilizaçao12. No entanto, a DAP pode ocorrer durante a gestaçao3. Foram relatados casos familiares raros13.
Pouco se sabe sobre o papel da progesterona na urticária. Um estudo mostrou que 10% das mulheres com urticária espontânea crônica relatam agravamento com contracepçao oral, o que nao foi evidenciado em mulheres com angioedema histaminérgico isolado14. Os hormônios sexuais modulam as funçoes imune e inflamatória das células12. Os mastócitos humanos expressam receptores de progesterona, que podem ter um efeito direto de liberaçao de histamina5. Um estudo evidenciou uma expressao aumentada de angiogenina em pele lesional de pacientes com DAP, tipicamente encontrada em células de papila dérmica humana, que também expressam receptores de progesterona15. O receptor de vitamina D (VDR) é induzido pela progesterona em células T e promove regulaçao imunológica mediante a supressao de células Th1 produtoras de interferon e de células Th17 produtoras de interleucina-1716. Isso pode justificar DAP latente em algumas mulheres grávidas e após um processo de dessensibilizaçao.
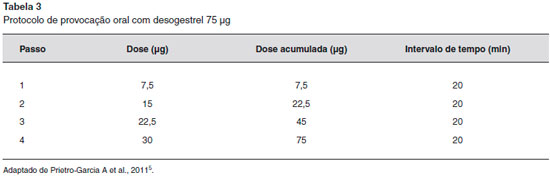
O diagnóstico de DAP baseia-se na associaçao de sintomas cíclicos ou induzidos pela progesterona, teste de hipersensibilidade à progesterona positivo e resposta clínica à inibiçao da ovulaçao. Os critérios de diagnóstico foram propostos por Warin: lesoes cíclicas recorrentes e relacionadas ao ciclo menstrual, teste cutâneo intradérmico com progesterona positivo (Figura 1), ou outro teste que comprove hipersensibilidade e cessaçao das lesoes pela inibiçao da ovulaçao17,18. Há experiência na realizaçao de teste intradérmico com 0,03 mL a 0,05 mL de acetato de medroxiprogesterona a 0,5 mg/mL e 5 mg/mL e provocaçao oral com 75 µg de desogestrel em 4 doses divididas (10%, 20%, 30% e 40%)19 (Tabela 3 e Figura 2). Outros testes de hipersensibilidade sao a detecçao de anticorpos anti-progesterona por imunofluorescência indireta, prick test com progesterona, patch test com progesterona, teste de ativaçao de basófilos com progesterona e produçao de interferon-gama por células sensibilizadas à progesterona, por ELISpot3,13. Outros testes de provocaçao foram realizados com acetato de medroxiprogesterona intramuscular e progesterona vaginal13,20.

Figura 1 Teste intradérmico mostrando controle negativo (superior) e teste positivo com acetato de medroxiprogesterona 0,5 mg/mL com formaçao de enduraçao (12 x 8 mm). Pápula inicial de 4 x 4 mm nao representada na figura
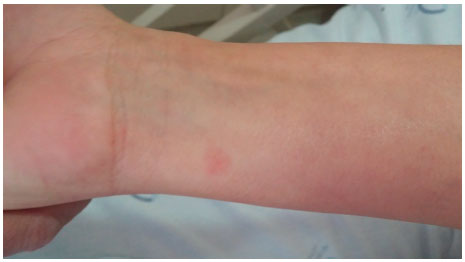
Figura 2 Pápula de aproximadamente 3 mm de diâmetro em face anterior do antebraço esquerdo após 6,5 horas do início do teste de provocaçao com desogestrel 75 μg
As alteraçoes histopatológicas sao inespecíficas, e o achado histológico mais comum relatado foi infiltrado inflamatório perivascular, sendo visto em 72% dos casos4,15. Além disso, infiltrado inflamatório nao específico ou intersticial foi descrito em 31% dos casos, com 41% com componente eosinofílico e 21% com componente neutrofílico misturado com o infiltrado linfocítico predominante4,18. A dermatite de interface foi o segundo achado mais comum, com 36% apresentando dermatite de interface de grau leve a intenso4 (Tabela 4).
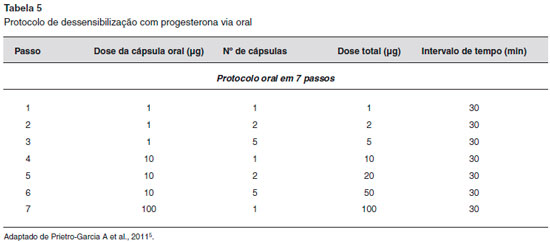
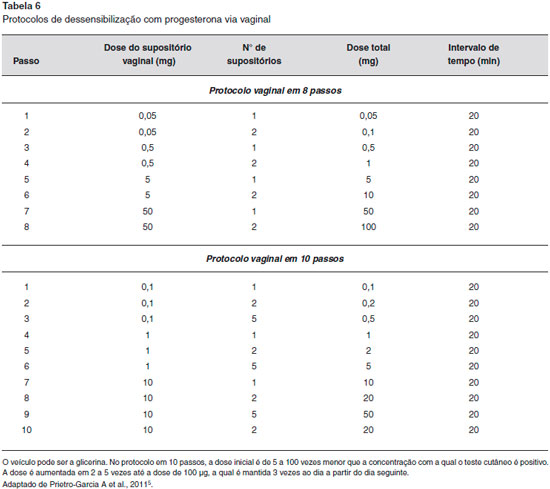
As modalidades de tratamento geralmente visam inibir a secreçao de progesterona endógena pela supressao da ovulaçao, uma vez que a terapia anti-histamínica e os corticosteroides tópicos sao geralmente infrutíferos e sao necessárias altas doses de corticosteroides sistêmicos para suprimir os sintomas1,6,9,13. Os contraceptivos orais e os estrogênios conjugados têm eficácia limitada1,9. Já foi utilizado o estrogênio conjugado 0,625-1,25 mg/dia em um ciclo de 21 dias20. Os agonistas do hormônio de liberaçao de gonadotropina (isto é, buserelina e triptorelina) foram usados com sucesso1,9, uma vez que os análogos do hormônio liberador do hormônio luteinizante (LHRH) suprimem a ovulaçao através da ocupaçao contínua de receptores de LHRH20. O danazol tem sido utilizado como profilaxia a uma dose de 200 mg duas vezes por dia, com início 3 dias antes da menstruaçao e continuando por 3 dias depois, mas podem desencadear efeitos adversos, como a hepatopatia e o hiperandrogenismo13,20. O tamoxifeno tem sido utilizado para suprimir a ovulaçao na DAP, numa dose de 10 mg duas vezes ao dia; no entanto, os efeitos da desmineralizaçao óssea limitam o seu uso em longo prazo20. Outros agentes terapêuticos, como azatioprina, hidroxicloroquina, dapsona ou ciclosporina, também foram descritos. No entanto, eles podem ser ineficazes ou ter efeitos colaterais significativos1,9,20. Para casos refratários a tratamentos clínicos, a ooforectomia bilateral pode ser considerada um tratamento definitivo1,6. Para pacientes que devem usar progesterona como tratamento para outros fins, como a fertilizaçao in vitro ou a hemorragia uterina, um protocolo de dessensibilizaçao de progesterona pode ser tentado5 (Tabelas 5 e 6).
REFERENCIAS
1. Özmen İI, Aktürk E. Autoimmune progesterone dermatitis presenting with purpura. Cutis. 2016;98(5):E12-E13.
2. Toms-Whittle LM, John LH, Griffiths DJ, Buckley DA. Autoimmune progesterone dermatitis: a diagnosis easily missed. Clin Exp Dermatol. 2011;36(4):378-80.
3. Nguyen T, Razzaque Ahmed A. Autoimmune progesterone dermatitis: Update and insights. Autoimmun Rev. 2016;15(2):191-7.
4. James T, Ghaferi J, LaFond A. The histopathologic features of autoimmune progesterone dermatitis. J Cutan Pathol. 2017;44(1):70-4.
5. Prieto-Garcia A, Sloane DE, Gargiulo AR, Feldweg AM, Castells M. Autoimmune progesterone dermatitis: clinical presentation and management with progesterone desensitization for successful in vitro fertilization. Fertil Steril. 2011;95(3):1121.e9-13.
6. Kaygusuz I, Gumus II, Sarifakioglu E, Eser A, Bozkurt B, Kafali H. Autoimmune progesterone dermatitis. Taiwan J Obstet Gynecol. 2014;53(3):420-2.
7. Hacinecipoğlu F, Benar H, Gönül M, Okçu Heper A. A case of autoimmune progesterone dermatitis characterized by grouped small vesicles. Clin Exp Dermatol. 2016;41(6):681-2.
8. Grunnet KM, Powell KS, Miller IA, Davis LS. Autoimmune progesterone dermatitis manifesting as mucosal erythema multiforme in the setting of HIV infection. JAAD Case Rep. 2017;3(1):22-4.
9. Salman A, Ergun T. Autoimmune progesterone dermatitis mimicking fixed drug eruption. J Dtsch Dermatol Ges. 2017;15(2):219-20.
10. Fournier JB. Resolution of autoimmune progesterone dermatitis after treatment with oral contraceptives. JAAD Case Rep. 2015;1(5):319-20.
11. Honda T, Kabashima K, Fujii Y, Katoh M, Miyachi Y. Autoimmune progesterone dermatitis that changed its clinical manifestation from anaphylaxis to fixed drug eruption-like erythema. J Dermatol. 2014;41(5):447-8.
12. Camoes S, Sampaio J, Rocha J, Tiago P, Lopes C. Autoimmune progesterone dermatitis: case report of an unexpected treatment reaction. Australas J Dermatol. 2017 Aug;58(3):e132-e134.
13. Lahmam Bennani Z, El Fekih N, Baccouche D, Khaled A, Zaglaoui F, Fazaa B. Autoimmune progesterone dermatitis. Ann Dermatol Venereol. 2012;139(12):832-5.
14. Amsler E, Augey F, Soria A, Boccon-Gibod I, Doutre MS, Mathelier- Fusade P, et al. Chronic urticaria and hormones: is there a link? J Eur Acad Dermatol Venereol. 2016;30(9):1527-30.
15. Poffet F, Abraham S, Taramarcaz P, Fontao L, Borradori L. Autoimmune progesterone dermatitis: potential role of cutaneous angiogenin expression? Dermatology. 2011;223(1):32-5.
16. Kim CH. A functional relay from progesterone to vitamin D in the immune system. DNA Cell Biol. 2015;34(6):379-82.
17. Warin AP. Case 2. Diagnosis: erythema multiforme as a presentation of autoimmune progesterone dermatitis. Clin Exp Dermatol. 2001;26(1):107-8.
18. Lee MK, Lee WY, Yong SJ, Shin KC, Lee SN, Lee SJ, et al. A case of autoimmune progesterone dermatitis misdiagnosed as allergic contact dermatitis. Allergy Asthma Immunol Res. 2011;3(2):141-4.
19. Gonçalves DG, Oliveira M, Yonekura C, Pedroso NF, Garro LS, Aun MV, et al. Dermatite autoimune por progesterona (Anais do XLIII Congresso Brasileiro de Alergia e Imunologia, 2016, Curitiba]. Braz J Allergy Immunol. 2016;3(4):190.
20. Le K, Wood G. A case of autoimmune progesterone dermatitis diagnosed by progesterone pessary. Australas J Dermatol. 2011;52(2):139-41.