Número Atual: Outubro-Dezembro 2017 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Biomarcadores na dermatite atópica
Biomarkers in atopic dermatitis
Messias E. Faria1; Vanessa C. E. S. A. Orso2; Isabela A. R. Lisciotto3; Cybele C. Faria4; Messias E. F. Filho5; Bárbara T. G. Soares4; Marina A. de Siqueira4
DOI: 10.5935/2526-5393.20170051
1. Pós-graduaçao em Alergia e Imunologia pelo IPEMED
2. Alergista e Imunologista pela Faculdade de Medicina de Ribeirao Preto - FMRP
3. Dermatologista pela Faculdade de Ribeirao Preto - FMRP
4. Graduanda de Medicina da Universidade de Ribeirao Preto - Unaerp
5. Graduando de Medicina Universidade de Itaúna
Endereço para correspondência:
Messias Eustáquio Faria
E-mail: messiaseustaquio@hotmail.com
Submetido em: 14/08/2017
Aceito em: 29/09/2017
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
O objetivo deste estudo é descrever os achados de artigos recentemente publicados a respeito dos avanços diagnósticos, prognósticos e terapêuticos sobre o uso de biomarcadores na dermatite atópica. Foi realizada revisao bibliográfica de 19 artigos publicados no Journal of Allergy and Clinical Immunology e no The New England Journal of Medicine. Atualmente, mais de 1 bilhao de pessoas têm algum tipo de doença alérgica, entre as quais a dermatite atópica é altamente prevalente. Por mais que possa ser diagnosticada de forma clínica através dos critérios de Hanifin e Rajka, estes sao avaliador-dependentes, havendo grande variaçao dos resultados. Da mesma forma, a dosagem de IgE nao é específica. Assim, tais métodos nao sao precisos para o diagnóstico, aumentando a importância da descoberta de novos marcadores mais fidedignos. Os biomarcadores sao características biológicas quantificáveis que fornecem medidas objetivas do estado de saúde ou doença. Eles têm potencial para estratificaçao de risco, detecçao precoce, identificaçao do tratamento, monitorizaçao de resposta e prevençao da progressao para marcha atópica. Os avanços tecnológicos permitem aos clínicos determinar um grande número de biomarcadores através de fluidos corporais, o que resultará em uma melhor caracterizaçao e estratificaçao dos pacientes com dermatite atópica, bem como acarretará medidas objetivas da resposta terapêutica e melhores comparaçoes entre tratamentos correntes e novas terapias.
Descritores: Dermatite atópica, biomarcadores, imunologia.
INTRODUÇAO
Dermatite atópica (DA) é uma condiçao multifatorial e crônica da pele caracterizada por xerose, prurido, pápulas eritematosas e placas cuja morfologia e distribuiçao dependem da idade do paciente1.
Afeta 10-20% das crianças e 1-3% dos adultos nos países industrializados2.
Participa da marcha atópica, sendo que geralmente, a DA é a primeira manifestaçao, seguida da rinite alérgica e asma1.
Em funçao da dificuldade do controle da atividade da doença moderada a grave, novas ferramentas têm sido estudadas, sendo uma delas os biomarcadores, que sao características biológicas quantificáveis que fornecem medidas objetivas do estado de saúde ou doença. Eles têm potencial para estratificaçao de risco, detecçao precoce, identificaçao do tratamento, monitorizaçao de resposta e prevençao da progressao para marcha atópica3.
FISIOPATOLOGIA
A dermatite atópica é uma doença caracterizada por ativaçao imune, hiperplasia da epiderme e disfunçao da barreira epitelial. Os principais mecanismos incluem anormalidades na diferenciaçao dos queratinócitos, levando a um estrato córneo defeituoso e sensibilizaçao de IgE4,5.
Quarenta por cento da populaçao portadora da DA severa possui mutaçoes que levam à perda da funçao da filagrina (FLG)6, proteína considerada a chave da estabilizaçao das estruturas e funçoes do estrato córneo7, levando ao início precoce da sintomatologia da DA, maior tendência a pele seca, e outras comorbidades. Já crianças com DA e que nao têm mutaçoes nos genes da filagrina podem ter desregulaçao dos processos metabólicos dos lipídios6.
A pele nao lesional na DA já mostra infiltrados imunes produzidos por mediadores inflamatórios, que contribuem para a disfunçao da barreira epitelial. O defeito na barreira conduz a penetraçao de antígenos percutâneos que encontram as células de Langerhans na derme e epiderme, o que leva à ativaçao imune e recrutamento de células inflamatórias, levando à fase aguda da DA. A ativaçao das vias TH2 e TH22,associada ao aumento discreto das vias TH1 e TH17 ocorre no início da fase aguda. A progressao da ativaçao de TH2 e TH22, assim como TH1, caracteriza o estágio de fase crônica da DA. Citocinas (IL4 e IL13) e quimiocinas (CCL17, CCL18, CCL19, CXCL9, CXCL10 e CXCL11) ativam a produçao de células T e células dendríticas que induzem ativaçao e recrutamento adicional de mais células imunes. Com o aparecimento da fase aguda, a via TH22 induz liberaçao de IL22, que induz hiperplasia epitelial e, sinergicamente com as citocinas da via TH17 (ex: IL17), conduzem ao abrupto aumento de genes de diferenciaçao terminal, especificamente as proteínas S100A7, S100A8 e S100A9. Ao longo da progressao da DA, há aumento dessas proteínas com diminuiçao de genes da barreira epitelial, como a FLG, loricrina e corneodesmosina. As vias TH2 e TH22 e suas citocinas contribuem para inibir a diferenciaçao das proteínas terminais. IL31 é abruptamente upregulated na doença aguda, sendo responsável pelo prurido8.
Além disso, diversas outras citocinas exercem funçao essencial nas modificaçoes epiteliais e da funçao imune de cada indivíduo. Entre elas, a IL4 e IL13 sao associadas à induçao de espongiose6 e inibiçao da diferenciaçao e produçao de peptídeos antimicrobianos9, da diferenciaçao terminal dos queratinócitos, juntamente com IL31, IL25/TH2, IL22/ TH22 e TNF, e da síntese de lipídeos, com IL-31 e TNF. Enquanto isso, TSLP mostrou ser relevante na regulaçao negativa da FLG e, consequentemente, no comprometimento da barreira epidérmica4, além de induzir o prurido juntamente com IL316.
MANIFESTAÇOES CLINICAS E DIAGNOSTICO
Nao há exames laboratoriais ou histológicos para DA, logo o diagnóstico é exclusivamente clínico. Muitos critérios foram desenvolvidos, como por exemplo, os critérios de Hanifi e Rajka, que têm confiabilidade reconhecida. As principais características clínicas sao os antecedentes familiares de DA, e pessoais de atopia, prurido e as lesoes eczematosas, que podem ser agudas, subagudas ou crônicas. As lesoes podem ocorrer em qualquer parte do corpo, mas tipicamente têm morfologia e distribuiçao dependente da idade do paciente. Características comuns incluem xerose cutânea, surgimento precoce e atopia. Outros sinais e sintomas sao hiperlinearidade plantar, pregas de Dennie-Morgan, sinal de Hertogue, pitiríase alba, prurido ocular, queilite, queratose pilar, escurecimento infraorbitário, ictiose vulgar, eczema de mamilo, alopecia areata, pregas anteriores no pescoço, ceratocone e palidez ou eritema facial.
Vários métodos sao estabelecidos para medir a gravidade da doença. O Eczema Area Severity Index (EASI) e o Scoring of Atopic Dermatitis Index (SCORAD) sao usados para demonstrar os sintomas, sinais objetivos, qualidade de vida e o controle em longo prazo do tratamento. A Organizaçao Mundial de Alergia usa a presença ou ausência do IgE para distinguir entre eczema atópico e nao atópico10.
APLICAÇOES CLINICAS DOS BIOMARCADORES
Para manejo adequado do diagnóstico, terapêutica e prognóstico
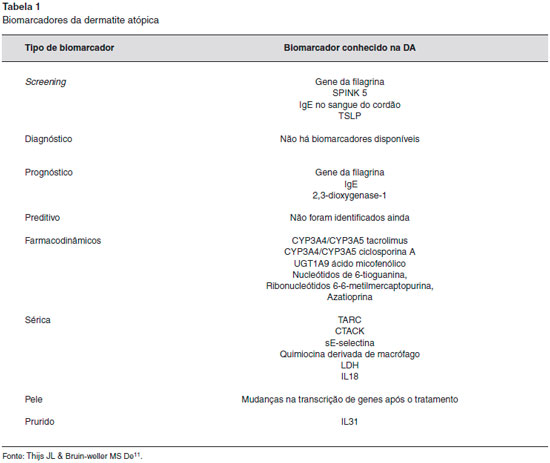
Há duas categorias de biomarcadores que têm diversos subtipos. A primeira categoria representa os biomarcadores que sao usados para seleçao/ estratificaçao de pacientes. Biomarcadores nesta categoria sao usados para screening, diagnóstico, prognóstico e preditivos. Biomarcadores prognósticos auxiliam a estimar o provável curso de uma doença e dos futuros riscos do paciente, como por exemplo, hospitalizaçoes, etc. Um biomarcador preditivo identifica subpopulaçoes de pacientes que responderao melhor a determinada terapia. A segunda categoria de marcadores é usada para monitorar a resposta clínica à terapia dada ou à intervençao feita. Esta categoria inclui biomarcadores de severidade e os farmacodinâmicos.
Para estratificaçao da heterogenicidade dos pacientes
DA tem características clínicas muito heterogêneas, e por isso, grandes esforços sao feitos para estratificar os pacientes baseados no quadro clínico. Pacientes sao divididos de acordo com seu fenótipo clínico, idade de surgimento da sintomatologia, severidade e antecedentes de infecçoes virais ou bacterianas secundárias. Classicamente, DA é divida em intrínseca e extrínseca, com base nos níveis de IgE. Embora níveis elevados de IgE em pacientes com DA extrínseca sugiram aumento da expressao de genes relacionados a resposta TH2, Suarez-Farinas e colaboradores recentemente observaram que pacientes com DA extrínseca e intrínseca mostraram níveis semelhantes de genes TH2 relacionados. Isto sugere que há uma sobreposiçao desses tipos na DA, e que a caracterizaçao com base nas queixas clínicas nao é confiável para refletir a diversidade patofisiológica dos pacientes com DA. Biomarcadores podem ajudar a definir de forma precisa os endótipos - que sao os grupos de pacientes com características fisiopatogênicas semelhantes.
Para predizer a resposta ao tratamento
Pacientes com DA grave e nao responsiva ao tratamento padrao sao frequentemente tratados de forma off-label, com imunossupressores. A terapia com imunossupressores como Ciclosporina A, Metotrexate e Azatioprina falha em cerca de 40 a 50% dos casos, e tem diversos efeitos colaterais. Portanto, a incerteza sobre a evoluçao do tratamento com imunossupressores é uma das grandes preocupaçoes dos médicos, e também dos pacientes. Biomarcadores preditores da resposta terapêutica para estes medicamentos ainda nao foram descritos. Acredita-se que biomarcadores farmacogenéticos podem identificar os respondedores e nao respondedores ao tratamento, e podem ser usados para evitar efeitos colaterais e otimizar a dosagem desses medicamentos, visto que estudos já comprovaram que as estratificaçoes na asma baseadas nos biomarcadores séricos sao uteis na terapêutica, pois pacientes com níveis aumentados de periostina mostraram melhor resposta ao anti- IL-13 (lebrikizumab), comparados com pacientes com baixos níveis. A asma, assim como a DA, é uma doença heterogênea, logo um biomarcador semelhante será útil para poder introduzir de forma eficaz e segura novas terapias na DA.
Para prever a severidade da doença
Há mais de 20 critérios para medir a gravidade da DA, porém estas escalas muitas vezes falham na sua acurácia. Hoje, o Eczema Area and Severity Index é o recomendado para ser usado nos ensaios clínicos, só que ainda nao é totalmente confiável. Por isso, os biomacardores para monitorar a severidade da doença serao extremamente úteis, e poderao refletir de forma mais objetiva os sintomas dos pacientes, além do que o uso desses marcadores irao tornar os estudos sobre DA possíveis de ser comparados, e facilitará para metanálises, pois padronizará os meios para avaliar a gravidade da DA11,12.
TIPOS DE BIOMARCADORES
Biomarcadores diagnósticos
O diagnóstico da DA é clínico, sendo que nao há biomarcadores disponíveis para confirmar o diagnóstico. Pacientes com DA instrínseca têm níveis normais de IgE, e sao muitas vezes referidos como nao alérgicos ou nao atópicos. Pacientes do subtipo extrínseco mostram níveis altos de IgE e sao frequentemente sensibilizados para múltiplos alérgenos. Os níveis séricos totais de IgE nao podem ser usados para diagnóstico porque 20% dos pacientes com DA intrínseca cursam sem alteraçoes de IgE, e também porque eles podem estar aumentados em outras patologias, como asma ou rinite alérgica10,11.
Biomarcadores de screening e prognóstico
DA tem um caráter extremamente hereditário, e um dos grandes fatores de risco para desenvolvê-la é ter antecedentes familiares portadores de DA. Será muito importante ter biomarcadores de screening para identificar e tratar precocemente populaçoes de risco. Muitos estudos identificaram vários genes associados à DA, sendo o mais relevante as mutaçoes da FLG para identificar aqueles com DA grave ou que terao início precoce na vida. Outros biomarcadores foram propostos para screening como, por exemplo, os níveis de IgE no sangue do cordao umbilical e proteína TSLP, que também foram associados com início precoce da DA em crianças com risco para desenvolvê-la. Staudacher e colaboradores mostraram que o 2,3-dioxigenase-1 é um candidato em potencial para identificar o fenótipo específico para eczema herpético.
Biomarcadores preditores
Nao foram identificados biomarcadores específicos para isso ainda.
Biomarcadores farmacodinâmicos
Farmacogenética é definida como o estudo da variabilidade da resposta da droga causada pela hereditariedade. As pesquisas na farmacogenética exploram os efeitos da farmacocinética, farmacodinâmica, eficácia e a segurança dos tratamentos em relaçao às variaçoes genéticas. As variaçoes genéticas mais estudadas sao os polimorfismos de um único nucleotídeo (SNPs), variaçoes do número de cópias genéticas, as inserçoes e deleçoes nos genes. Essas variaçoes têm influências nas respostas dos pacientes às drogas. Apesar de pouco estudados, podem ser usados para personalizar e otimizar o tratamento, como por exemplo quando é necessário lançar mao do tacrolimus e/ou da Ciclosporina A (CsA).
O tacrolimus e a CsA sao metabolizados pela CYP3A4 e CYP3A5. A análise da expressao de SNPs nos genes para CYP3A4 e CYP3A5 pode classificar os pacientes em metabolizadores fracos, intermediários ou fortes do tacrolimus, e podem ser úteis no tratamento com CsA, porém requer mais estudos.
Aceponato de metilprednisolona (MPA) é usado de forma off-label no tratamento para DA quando há falha da CsA. Contudo, é efetivo em apenas metade dos pacientes. Os marcadores podem ser a chave para otimizar o tratamento, pois quando sao encontrados baixos níveis de MPA nos rins indica pouca eficácia. Baixos níveis no sangue também estao relacionados com a presença do SNPs nos genes promotores da regiao UGT1A9, pois é principalmente metabolizado nesta regiao. Isso mostra a importância de um biomarcador para identificar os responsivos e nao responsivos ao MPA.
Biomarcadores de monitorizaçao
Níveis séricos de IgE total sao os biomarcadores mais comumente medidos nos ensaios clínicos de DA. Embora pacientes com doença severa tendam a ter níveis aumentados de IgE total, os pacientes com DA intrínseca nao têm alteraçoes. Uma recente metanálise mostrou que IgE total relaciona-se fracamente com a severidade da DA.
Outros biomarcadores que foram reportados para monitorizar a atividade da doença sao a proteína eosinofílica catiônica e ativaçao regulada da quimiocina (TARC/CCL17). O TARC é o biomarcador mais confiável disponível. CTACK, sE-selectina, macrófago derivado de quimiocina, lactato desidrogenase (LDH) e IL18 mostraram resultados promissores, porém requerem mais estudos. Recentemente, alguns estudos multivariados que consistiram na dosagem de TARC, PARC, IL22 e Sil-2R mostraram serem sensíveis para detectar a gravidade. Embora tenha sido apenas um estudo piloto, isso demonstra que usar diversos biomarcadores em conjunto pode ser necessário, pois a DA é uma doença complexa e multifatorial11,13.
BIOMARCADORES ATUALMENTE ESTUDADOS
Citocinas IL13, IL22, IL22 e quimiocina CCL17
Ungar e colaboradores estudaram o uso de citocinas como biomarcadores antes e depois do tratamento com CsA. Foi encontrado aumento em citocinas séricas e quimiocinas (IL13, IL22, CCL17) em peles de pacientes com DA e reduçao com o tratamento, que estao relacionadas com o SCORAD. Os níveis séricos de CCL17 correlacionam-se inversamente com a idade, sendo maiores até 1 ano de idade3 e correlaciona-se com a gravidade em múltiplos ensaios clínicos14.
TSLP
Kim e colaboradores estudaram a acurácia como preditor do surgimento de DA na infância. Foram medidas várias proteínas da epiderme em pacientes com 2 meses de idade e a sua expressao foi associada à incidência de DA aos 24 meses. Há induçao da inflamaçao pela via TH2, ativaçao de células dendríticas e downregulation da expressao da FLG. A elevada expressao de TSLP no início da vida pode estar associada ao desenvolvimento de DA tardia13.
TEWL
As intervençoes que têm o intuito de melhorar a funçao da pele sem lesao aparente, mas com aumento da TEWL, podem prevenir ou atenuar as manifestaçoes clínicas da DA e a progressao na marcha atópica1.
A TEWL aumentada na pele de crianças com DA foi significativamente correlacionada com a resposta TH17/TH22, e a alguns biomarcadores de TH2, destacando a interaçao entre alteraçoes de barreira e ativaçao de citocinas na criaçao do fenótipo DA de início precoce TEW5.
K16
O K16 nao é visto em peles normais e tem importante papel na hiperplasia epitelial. Suzanne Tintle et al. avaliaram a resposta tecidual do k16 em peles lesionais e nao lesionais antes e após tratamento com UVB. A espessura da epiderme lesionada prétratamento foi 141% maior que as nao lesionais, e ambas foram significativamente reduzidas após o tratamento5.
A associaçao k16 e ki67 estimam a espessura e proliferaçao dos queratinocitos. Saakshi Khattri et al. identificaram, após 12 semanas de tratamento com Ciclosporina A, que 17 dos 19 pacientes obtiveram diminuiçao na pontuaçao SCORAD em 50%, e negativaçao do biomarcador. Em relaçao ao grupo controle, a biópsia mostrou que a barreira epitelial antes do tratamento era 197% mais espessa (p < 0,01)9.
S100
Estudos mostraram que S100 afeta o crescimento e a diferenciaçao celular, e que pode contribuir para o recrutamento de células imunes para desencadear a ocorrência da doença16. Além disso, mostrou-se ser um biomarcador reversível da doença, já que supressoes na resposta TH2 e TH22 sao relacionadas ao seu downregulation no tratamento9.
MicroRNAS
Os miRNAs sao moléculas de RNA de cadeia simples de 19 a 25 nucleótidos que medeiam o silenciamento de genes17. Sao estáveis e podem ser medidas com relativa facilidade3.
miR-155 é expresso por células T de pele, células dendríticas e mastócitos. Foi demonstrada a supressao da proteína 4 associada aos linfócitos T citotóxicos (CTLA-4), um regulador negativo da célula T, pois o CTLA-4 reconhece a funçao antiproliferativa em células T ativadas.
A deficiência de miR-21 diminuiu o crescimento de células progenitoras de eosinófilos e aumentou a apoptose durante a diferenciaçao em eosinófilos maduros. Aqueles com déficit de miR-223, por outro lado, apresentam proliferaçao aumentada, e podem exercer seu efeito ao regular positivamente o IGF1R.
O miR-181a aumenta a sensibilidade das células T aos antígenos peptídicos.
MiR-221, miR-222 e miR-146a sao reguladas positivamente após a ativaçao do mastócito e a superexpressao nos mastócitos leva a maior apoptose, a diminuiçao da migraçao e aumento da adesao17.
miR-125b atua como um supressor da proliferaçao de queratinócitos, muito provavelmente através do direcionamento direto do receptor do fator de crescimento de fibroblastos-218.
Sangue do cordao umbilical
O fator circulante estudado é o ligando de Fas solúvel (sFasL), níveis que foram aumentados no sangue do cordao umbilical de recém-nascidos com DA. A relevância biológica relaciona-se à apoptose de queratinócitos e à severidade da doença na infância.
Vernix caseoso
O vernix é geralmente abundante na pele do recém-nascido e pode ser coletado de formas nao invasivas. Sua composiçao proteica reflete as respostas funcionais da pele com várias famílias de proteínas encontradas no vernix, incluindo proteínas do citoesqueleto, moléculas de adesao celular, proteínas de junçao celular e fatores de transcriçao. Correlaciona-se com o desenvolvimento da DA aos 2 anos, sendo sugeridos como biomarcadores candidatos para a identificaçao de RN predispostos ao desenvolvimento de DA3,18.
TARC
Os níveis séricos de TARC sao marcadores em potencial para mostrar a gravidade da DA e avaliar o curso da doença. É um dos melhores para ser utilizado como biomarcador de gravidade, uma vez que teve resultados positivos em estudos longitudinais, porém requer melhores ensaios clínicos12.
MDC/CCL22 (macrófago derivado da quimiocina)
É um biomarcador similar ao TARC, pois é uma quimiocina para expressao do CCR4 nas células T. Foi correlacionado em dois estudos longitudinais que mostraram correlaçao com a gravidade da DA. No entanto, necessita de mais estudos para investigar e se mostra como um biomarcador em potencial.
ECP
É uma proteína liberada durante a desgranulaçao dos eosinófilos. Foi um dos primeiros biomarcadores relacionados à gravidade da DA; no entanto, este marcador foi avaliado em diversos estudos de follow-up que mostraram correlaçao baixa, sendo questionáveis em alguns estudos.
IgE total
É o mais frequentemente estudado. No entanto, diversos estudos longitudinais mostraram que tem apenas moderada correlaçao com a gravidade da doença. Portanto, nao é apropriado para o follow-up da doença e da severidade da DA.
CTACK/CCL27
É uma quimiocina que atrai células T e que sao importantes na inflamaçao da pele na DA. CTACK é produzida por queratinocitos e liga-se ao receptor CCR10, que é expresso nas células T. Níveis séricos de CTACK foram reportados em dois estudos longitudinais e em diversos estudos transversais. É associado com a gravidade da DA, porém precisa de mais estudos para determinar sua funçao.
sE-selectina
É uma molécula de adesao celular expressa no endotélio vascular. É importante na migraçao de células inflamatórias do sangue para o tecido. A sE-selectina é um marcador em potencial para avaliar a gravidade da doença, mas requer mais estudos.
CD30
Os níveis séricos de CD30 sao investigados para uso em diversas doenças imunomediadas. No entanto, pesquisas demonstram grandes variaçoes nos resultados em que avaliaram este biomarcador na DA, por isso a correlaçao é inconclusiva, e precisa de mais estudos.
LDH
É uma enzima encontrada em quase todas as células teciduais e tem como funçao catalisar a conversao do piruvato em lactato. LDH é liberado quando há dano tecidual, e frequentemente é usado como um marcador para avaliar malignidade, doenças cardíacas e hemólise. Alguns estudos avaliaram a possibilidade de usar o LDH como marcador de gravidade da DA, porém faltam mais estudos para concluir, mas é um biomarcador em potencial e com grande custo-benefício, pois é amplamente disponível e de fácil dosagem.
Vitamina D
Os níveis séricos da vitamina D foram estudados em diversas pesquisas que nao correlacionaram com a severidade da DA. Portanto, nao é um biomarcador indicado para avaliar a gravidade da DA12,19.
CONCLUSAO
As pespectivas futuras em alinhamento com os avanços tecnológicos permitem aos clínicos determinar um grande número de biomarcadores através de fluidos corporais. Isto irá resultar em uma melhor caracterizaçao e estratificaçao dos pacientes com DA, e resultará em medidas objetivas da resposta ao tratamento e melhores comparaçoes entre tratamentos correntes e novas terapias. Em um futuro próximo, os pacientes com DA serao estratificados com base na expressao dos biomarcadores nos fluídos corporais (sangue/saliva/lagrimas), tecidos (biopsias/pele), variaçoes genéticas, e com escores compostos de diversos biomarcadores medidos em conjunto. Muitas novas terapias que estao sendo investigadas em fase I e III nos ensaios clínicos serao melhores avaliadas através de biomarcadores, pois irao identificar melhor os pacientes que podem se beneficiar dessas drogas extremamente específicas, porém com custos elevados. Biomarcadores serao essenciais para uma medicina preditiva, personalizada, preventiva e participatória11.
Estudos relacionados com biomarcadores representam uma área interdisciplinar em que é necessária a cooperaçao de clínicos e cientistas de diferentes áreas, como Imunologia Básica, Biologia de RNA, Genética, Química de Proteínas e Bioinformática18.
REFERENCIAS
1. Gupta J, Grube E, Ericksen MB, Stevenson MD, Lucky AW. Intrinsically defective skin barrier function in children with atopic dermatitis correlates with disease severity. J Allergy Clin Immunol. 2008 Mar;121(3):725-730.e2
2. Lebovidge JS, Elverson W, Timmons KG. Clinical reviews in allergy and immunology Multidisciplinary interventions in the management of atopic dermatitis. J Allergy Clin Immunol. 2017;138(2):325-34.
3. Boyce JA, Finkelman F, Shearer WT, Skevaki C, Berg J Van Den, Jones N, et al. Mechanisms of allergic diseases Immune biomarkers in the spectrum of childhood noncommunicable diseases. J Allergy Clin Immunol. 2016;137(5):1302-16.
4. Wawrzyniak P, Akdis CA, Finkelman FD, Rothenberg ME. Advances and highlights in mechanisms of allergic disease in 2015. J Allergy Clin Immunol. 2016;137(6):1681-96.
5. Tintle S, Shemer A, Suárez-Fariñas M, Fujita H, Gilleaudeau P, Sullivan-Whalen M, et al. Reversal of atopic dermatitis with narrowband UVB phototherapy and biomarkers for therapeutic response. J Allergy Clin Immunol. 2011 Sep;128(3):583-93.
6. Leung DYM, Guttman-yassky E. Deciphering the complexities of atopic dermatitis : Shifting paradigms in treatment approaches. J Allergy Clin Immunol. 2015;134(4):769-79.
7. Egawa G, Kabashima K. Current perspectives multifactorial skin barrier deficiency and atopic dermatitis: essential topics to prevent the atopic march. J Allergy Clin Immunol. 2016;138(2):350-8
8. Gittler JK, Shemer A, Suárez-Fariñas M, Fuentes-Duculan J, Gulewicz KJ, Wang CQF, et al. Progressive activation of TH2/ TH22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol. 2012;130(6):1344-54.
9. Khattri S, Shemer A, Rozenblit M, Dhingra N. Cyclosporine in patients with atopic dermatitis modulates activated inflammatory pathways and reverses epidermal pathology. J Allergy Clin Immunol. 2014 Jun;133(6):1626-34.
10. Weidinger S, Novak N, Kiel C. Atopic dermatitis (Seminar). Vol. 6736. Elsevier Ltd; 2015.
11. Thijs JL, Bruin-weller MS De. Current and future biomarkers in atopic dermatitis. Immunol Allergy Clin North Am. 2017;37(1):51-61.
12. Thijs JL, Nierkens S, Herath A, Bruijnzeel-Koomen CAF, Knol EF, Giovannone B, et al. A panel of biomarkers for disease severity in atopic dermatitis. Clin Exp Allergy. 2015;45(3):698-701.
13. Nomura T, Kabashima K. Advances in atopic dermatitis in 2015. J Allergy Clin Immunol. 2015;138(6):1548-55.
14. Muraro A, Lemanske RF, Hellings PW, Akdis CA, Bieber T. Precision medicine in patients with allergic diseases: Airway diseases and atopic dermatitis-PRACTALL document of the European Academy of Allergy and Clinical Immunology and the American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2016;137(5):1347-58.
15. Czarnowicki T, Krueger JG, Guttman-Yassky E. Novel concepts of prevention and treatment of atopic dermatitis through barrier and immune manipulations with implications for the atopic march. J Allergy Clin Immunol. 2017;139(6):1723-34.
16. Esaki H, Brunner PM, Renert-Yuval Y, Czarnowicki T, Huynh T, Tran G, et al. Early-onset pediatric atopic dermatitis is TH2 but also TH17 polarized in skin. J Allergy Clin Immunol. 2016;138(6):1639-51.
17. Lu TX, Rothenberg ME. Diagnostic, functional, and therapeutic roles of microRNA in allergic diseases. J Allergy Clin Immunol. 2014;132(1):3-13.
18. Rebane A, Akdis CA. MicroRNAs: essential players in the regulation of inflammation. J Allergy Clin Immunol. 2013;132(1):15-26.
19. Thijs J, Krastev T, Weidinger S, Buckens CF. Biomarkers for atopic dermatitis: a systematic review and meta-analysis.Curr Opin Allergy Clin Immunol. 2015;15(5):453-60.