Número Atual: Janeiro-Fevereiro 2016 - Volume 4 - Número 1
Editorial
Mecanismo de ação da terapia com omalizumabe na urticária crônica espontânea: há um papel para autoimunidade?
Mechanism of action of the therapy with omalizumab in chronic spontaneous urticaria: is there a role for autoimmunity?
Luisa Karla de Paula Arruda, MD, PhD1; Juliana Augusta Sella, MD2; Thais Nociti Mendonça, MD3; Janaina Michelle Lima Melo, MD, PhD4; Mariana Paes Leme Ferriani, MD, PhD5
DOI: 10.5935/2318-5015.20160001
Faculdade de Medicina de Ribeirao Preto, Universidade de Sao Paulo, FMRP-USP, Ribeirao Preto, SP
Endereço para correspondência:
L. Karla Arruda
E-mail: karla@fmrp.usp.br
A eficácia da terapia anti-IgE com omalizumabe no tratamento de pacientes com urticária crônica espontânea (UCE), previamente conhecida como urticária crônica idiopática, tem sido amplamente demonstrada tanto por estudos clínicos randomizados, duplo-cegos, controlados com placebo, de fase 3, e por análises sistemáticas da literatura, como por estudos de vida real1-4. O benefício clínico está presente nao só com o controle das lesoes de urticária como também do angioedema que acompanha a urticária crônica em 40% a 50% dos casos, comprometendo de forma marcante a qualidade de vida dos pacientes (Figura 1)5-7. Quando se considera o sucesso da terapia com omalizumabe em pacientes com UCE, um dos aspectos mais intrigantes é o fato de que a maioria dos pacientes com UCE nao apresenta resposta IgE exuberante a alérgenos inalantes ou alimentares, e nao associa o aparecimento dos sintomas com a exposiçao a alérgenos específicos, como observamos em pacientes com asma e rinite alérgicas, ou anafilaxia8. A capacidade do omalizumabe de baixar os níveis de IgE livre e diminuir receptores de alta afinidade para IgE (FcεRI) na superfície de mastócitos e basófilos é bem estabelecida8-10. Estudos em pacientes com doenças alérgicas, particularmente asma alérgica, revelaram que a reduçao da liberaçao de mediadores inflamatórios requer uma reduçao de 95% no nível sérico de IgE total, para modificar a resposta alérgica via down regulation do FcεRI. Deste modo, a dosagem de omalizumabe para asma alérgica é determinada pelo nível de IgE total sérica e o peso do paciente, para atingir a reduçao na IgE livre. Por outro lado, a eficácia de dose fixa de omalizumabe de 300 mg a cada 4 semanas, aprovada para uso em pacientes com UCE, indica que a UCE nao é uma doença clássica induzida por alérgenos8.
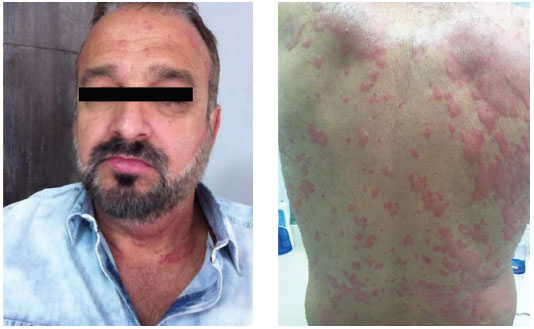
Figura 1 - Paciente com urticária crônica espontânea (UCE), em exacerbaçao pelo uso de inibidor da cicloxigenase 1 (Dipirona). Teve urticária aguda prévia com cetoprofeno, 10 anos antes do surgimento da UCE (reproduçao com permissao do paciente)
O mecanismo de açao que resulta no desaparecimento ou melhora dos sintomas de UCE com omalizumabe nao é ainda totalmente compreendido. Uma chave para a compreensao deste enigma é entender o papel da autoimunidade na UCE e o papel da IgE na autoimunidade. Uma outra questao intrigante na resposta de pacientes com UCE é a existência de respondedores rápidos, que muitas vezes melhoram de forma dramática com desaparecimento dos sintomas logo após a primeira aplicaçao ou no período de um mês após a primeira aplicaçao, e de respondedores lentos, que requerem pelo menos 3 a 5 doses do omalizumabe para terem uma resposta11. Finalmente, um desafio atual é como quantificar de forma objetiva a atividade da urticária e/ou angioedema, o controle dos sintomas e o impacto da doença na qualidade de vida dos pacientes, e como avaliar de forma precisa a eficácia do tratamento instituído.
URTICARIA CRONICA, AUTOIMUNIDADE, E IgE
Há uma forte correlaçao entre UCE e doenças autoimunes. Em um estudo envolvendo 12.778 pacientes com UCE, usando dados de período de 17 anos, foi mostrado que a chance de pacientes com urticária crônica apresentarem uma ou mais doenças autoimunes, em geral em até 10 anos de seu diagnóstico de urticária crônica, foi de 7,7 a 28,8 vezes mais alta que em indivíduos controle12. Estas doenças autoimunes incluíam hipotireoidismo, tireoidite, artrite reumatoide, lúpus eritematoso sistêmico (LES), síndrome de Sjögren, doença celíaca e diabetes tipo I. Em estudo prospectivo de uma coorte de 100 pacientes com UCE por período de 10 anos, realizado por Diogini e cols. em nosso meio, doenças associadas estiveram presentes em aproximadamente 50% dos pacientes com UCE. Infecçoes foram diagnosticadas em 29% dos pacientes (sífilis, parasitoses, H. pylori, infecçao urinária, tuberculose, hepatites B e C); doenças autoimunes em 21% dos pacientes (tireoidite, artrite reumatoide e síndrome do anticorpo antifosfolípide); imunodeficiência primária em 4% (deficiência de IgA e de IgG2); e leucemia mieloide crônica em 1%13. Esses dados indicam que pacientes com urticária crônica teriam mais propensao a autoimunidade, e que em muitos pacientes com urticária crônica, a urticária parece ser a primeira ou única manifestaçao de autoimunidade8,14,15.
É conhecido já de longa data que autoanticorpos contra FcεRI e/ou IgE podem ter papel importante em aproximadamente 40-45% dos pacientes com UCE. Na situaçao mais comum (35-40%), autoanticorpo IgG contra a cadeia α do receptor de alta afinidade para IgE causa o cross-linking da subunidade α levando à liberaçao de histamina por basófilos e degranulaçao de mastócitos em alguns pacientes. Uma menor fraçao de pacientes com UCE (5-10%) tem autoanticorpos funcionais IgG anti-IgE que causam liberaçao de histamina de basófilos.
A presença de autoanticorpos IgG contra antígenos tireoidianos, contra FcεRI e IgE em pacientes com UCE sugere que UCE está associada com autoimunidade, ou que existe um subgrupo autoimune de pacientes UCE em quem autoanticorpos podem contribuir para a patogênese da doença. Mais recentemente, o papel de autoanticorpos IgE contra autoantígenos, particularmente tireoperoxidase (TPO), DNA de dupla hélice (double stranded DNA dsDNA) ou DNA de única hélice (single stranded DNA ssDNA) tem se tornado evidente8,16.
Portanto, a autorreatividade em pacientes com UCE pode ser descrita em dois subtipos. No primeiro subtipo (tipo I), pacientes afetados produzem autoanticopos IgG contra FcεRI, IgE, ou ambos, que podem fazer o cross-linking de FcεRI ocupados ou livres de IgE, ativando mastócitos e basófilos. Este fenômeno foi originalmente relatado por Grattan e cols. em 1986, após a observaçao de que o soro de alguns pacientes com urticária crônica produzia reaçao do tipo pápula e eritema no local da injeçao intradérmica no próprio paciente, sendo descrito o chamado teste cutâneo do soro autólogo (Autologous Serum Skin Test ASST), com prevalência de 45% em pacientes adultos com UCE17. No segundo subtipo de autoimunidade (tipo II) os pacientes produzem anticorpos IgE contra autoantígenos. Pacientes com UCE com frequência apresentam IgE total elevada e têm doenças autoimunes, especialmente desordens autoimunes da tireoide, como tireoidite de Hashimoto. Vários estudos independentes relataram uma proporçao significante de pacientes, de até 33% dos casos em alguns estudos, que exibiam níveis elevados de IgE contra tireoperoxidase (TPO). Entretanto, nao houve diferença em termos de atividade e duraçao da doença em pacientes com IgE anti-TPO positivos e IgE anti-TPO negativos. Níveis significantemente mais elevados de IgE contra dsDNA foram também identificados em pacientes com UCE.
A importância de autoanticorpos IgE na patogênese do LES tem sido demonstrada. Níveis de IgE total estao aumentados em pacientes com LES, e se correlacionam com manifestaçoes mais graves da doença. Em uma coorte de pacientes com LES, foram encontrados anticorpos IgE autorreativos contra pelo menos 7 autoantígenos, e níveis de IgE específica para dsDNA mostraram a correlaçao mais significante com atividade da doença e hipocomplementemia. Todos os outros autoanticorpos IgE identificados, incluindo anti-Sm, SS-A e SS-B, tiveram correlaçao com atividade do LES. Estes dados forneceram a premissa básica para um estudo clinico em andamento, que usa o omalizumabe para o tratamento de pacientes com LES (NCT01716312)8. Em nosso meio, em estudo multicêntrico de uma coorte de 852 pacientes com LES de início na infância, Ferriani e cols. mostraram que UCE foi observada em 10 pacientes (1,17%), e que pacientes com LES e UCE tiveram índice de atividade de LES e velocidade de hemossedimentaçao mais elevados que pacientes com LES sem UCE. Este estudo revelou a ligaçao entre UCE e LES de início na infância, e mostrou que a UCE ocorreu 3 anos antes a 5 anos depois do surgimento de LES, sendo mais frequentemente observada no início da doença18.
Nos casos de UCE em que anticorpos IgG autorreativos contra FcεRI, IgE, ou ambos, ou anticorpos IgE autorreativos contra autoalérgenos, estes anticorpos sao fatores causais, e IgE, FcεRI, e mastócitos sao sem dúvida o centro do processo patológico. Para os casos remanescentes de UCE, IgE, FcεRI e mastócitos têm provavelmente um papel patogênico essencial, embora os fatores causais nao tenham sido identificados. De forma interessante, a terapia com omalizumabe é bem sucedida tanto em pacientes com autoanticorpos anti FcεRI ou IgE, ou autoanticorpos IgE contra tireoperoxidase (TPO), quanto em pacientes sem estes autoanticorpos.
A Figura 2 resume de forma esquemática os mecanismos de ativaçao de mastócitos por via autoimune.
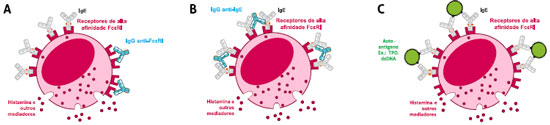
Figura 2 - Representaçao esquemática da ativaçao de mastócitos por via autoimune. A) Ativaçao por anticorpos IgG anti-FcεRI. B) Ativaçao por anticorpos anti-IgE. C) Ativaçao por autoantígenos que induziram sensibilizaçao IgE (ex. tireoperoxidase TPO, DNA de dupla hélice dsDNA). Figura criada e generosamente fornecida por Ricardo T. Russo, PhD, Novartis Brasil, baseada em Greaves M. J Allergy Clin Immunol 2000;105:664-72; Kaplan AP, Greaves M. Clin Exp Allergy 2009;39:777-87; Metz M, Maurer M. Curr Opin Allergy Clin Immunol 2012;12:406-11
MECANISMOS DE AÇAO CONHECIDOS E POTENCIAIS DO OMALIZUMABE NA URTICARIA CRONICA ESPONTANEA
Omalizumabe foi desenvolvido para se ligar com alta afinidade à IgE livre, em sua regiao Cε3, prevenindo a ligaçao da IgE ao FcεRI. Dessa forma, o omalizumabe nao se liga à IgE na superfície da célula, e portanto nao ativa diretamente mastócitos e basófilos.
Em mastócitos, basófilos e células apresentadoras de antígeno, há regulaçao fina da expressao de FcεRI na superfície da célula determinada pelos níveis de IgE circulante. O número de receptores FcεRI na superfície de basófilos tem mediana de 150.000 por basófilo em indivíduos com IgE total normal, e pode aumentar para até 900.000 quando a IgE circulante está elevada19. A taxa de ocupaçao de FcεRI por IgE em basófilos também se correlaciona com os níveis séricos de IgE, com ocupaçao de 80% a 95% quando a IgE total está entre 45 a 90 UI/mL. Mastócitos apresentam maior grau de heterogeneidade de tamanho, com densidade de FcεRI de 130.000 a 200.000 moléculas/mastócito, e taxa de ocupaçao por IgE entre 50% e 60%19.
A ligaçao da IgE ao FcεRI em mastócitos e basófilos estabiliza o receptor, prevenindo sua degradaçao e/ou aumentando o tempo de degradaçao do mesmo. Quando os níveis de IgE circulante sao reduzidos pelo omalizumabe, nao só ocorre uma diminuiçao da expressao de FcεRI na superfície de mastócitos e basófilos, como também ocorre a rápida internalizaçao e degradaçao do FcεRI livre, nao ligado à IgE, pela célula. A presença do complexo FcεRI - IgE na superfície de mastócitos e basófilos torna a célula mais susceptível à ativaçao, com subsequente liberaçao de mediadores inflamatórios. A ligaçao da IgE monomérica a FcεRI, sem cross-linking via IgE, é um mecanismo importante de potencializaçao das atividades de mastócitos, mesmo na ausência de degranulaçao. O mastócito aumenta a adesao, migraçao, degranulaçao, produçao de mediadores químicos, citocinas e outros fatores que promovem a diferenciaçao e o aumento da sua sobrevida8. Por outro lado, a combinaçao de IgE livre diminuída, menor quantidade de FcεRI e maior frequência de receptores livres, nao complexados a IgE, que acontece durante o tratamento com omalizumabe, torna a célula mais resistente à ativaçao por vários agonistas, incluindo autoanticorpos anti-FcεRI, anti-IgE e autoalérgenos, relevantes em pacientes com UCE, ou alérgenos ambientais e alimentares em pacientes com doenças alérgicas8. Portanto, o efeito do omalizumabe de forma geral consiste na reduçao da atividade do eixo IgE-FcεRI-mastócito/basófilo, e aumento do limiar para degranulaçao de mastócitos e basófilos, por vários fatores.
De forma interessante, a velocidade de mudança para suprimir IgE, receptores de IgE e resposta alérgica varia de acordo com o tipo de célula. Reduçao significante de FcεRI em basófilos foi observada precocemente, em até três dias após a primeira dose de omalizumabe. Por outro lado, esta reduçao em mastócitos pode levar algumas semanas, tendo sido observada posteriormente à melhora dos sintomas em alguns pacientes. Há evidência de que basófilos de pacientes com UCE têm uma via de ativaçao por FcεRI anormal, e que estas células sao recrutadas para as lesoes de UCE, causando a basopenia que é observada em pacientes com UCE. Dois estudos observacionais em pacientes adultos encontraram uma relaçao inversa entre número de basófilos circulantes e gravidade da doença9. Foi demonstrado que o omalizumabe atua nesse fenótipo, revertendo o recrutamento de basófilos para a pele, a basopenia, e as anormalidades do receptor de IgE. Estudo que comparou o tratamento com omalizumabe e placebo em pacientes com UCE, revelou aumento da contagem média de basófilos periféricos já nos primeiros 8 dias, que continuou até o dia 85 de tratamento, nos pacientes que usaram omalizumabe9. De forma semelhante, a reduçao da IgE ligada a basófilos e da expressao de FcεRI em basófilos foi evidente já no dia 8, persistindo durante todo o período de tratamento com omalizumabe. É importante salientar que o tempo das alteraçoes em basófilos periféricos esteve alinhado com o início da melhora dos sintomas9. Entretanto, ainda nao está claro se as anormalidades no basófilo, que podem ser revertidas pelo omalizumabe, sao patogênicas para a subpopulaçao em que foram evidentes, ou se seriam consequência apenas da presença da UCE.
Estudo recente mostrou que níveis de células positivas para FcεRI e IgE na pele de pacientes com UCE diminuiram tanto em pele apresentando lesoes de urticaria como em pele sem lesao após o tratamento com omalizumabe9. Entretanto, em alguns casos o tempo para esta diminuiçao, que foi significante no dia 85 de tratamento, nao foi visto dentro do timeframe do início da melhora dos sintomas. Agrupando os resultados dos três estudos de fase 3 com o omalizumabe em UCE, foi verificado que aproximadamente 10% dos pacientes experimentaram resposta parcial ao omalizumabe (Urticaria Activity Score -7 days UAS7 ≤ 6) após uma semana de tratamento, e que após 2 semanas 30% e 15% dos pacientes tiveram resposta parcial (UAS7 ≤ 6) ou controle completo (UAS7 = 0) dos sintomas, respectivamente. Esta resposta clínica rápida ocorreu bem mais cedo que a resposta dos receptores e dos aspectos funcionais em mastócitos cutâneos9. É possivel que outros mecanismos possam contribuir para o efeito muito rápido do omalizumabe nestes casos de respondedores precoces.
Devido à relaçao próxima entre coagulaçao e inflamaçao, coagulaçao pode ter um papel relevante na patogênese da UCE20,21. Em uma série de estudos foram encontrados níveis elevados de fragmentos de clivagem da protrombina, resultantes de uma ativaçao da via extrínseca da coagulaçao, que poderia ter um papel na patogênese da UCE. Marcadores plasmáticos da geraçao de trombina estavam elevados em pacientes com UCE ativa, e esses marcadores diminuíram durante remissao da doença20. Cugno e cols. demonstraram o aumento nos níveis plasmáticos de dois marcadores de ativaçao da coagulaçao, F1+2 (fragmento de protrombina) e D-dímero (fragmento de fibrina), e aumento da expressao de fator tissular em biópsias de pele, em pacientes com urticária crônica autoimune em atividade quando comparados a controles saudáveis22. Foi também descrito que os níveis plasmáticos de D-dímero aumentaram em paralelo com a atividade da doença, e que níveis elevados foram associados com resistência da doença à terapia com anti-histamínicos20. Por outro lado, reduçao de D-dímero foi observada durante a terapia com omalizumabe em pacientes com UCE23. Entretanto, ativaçao do sistema da coagulaçao nao é específica para UCE, ocorrendo em outras doenças cutâneas como penfigoide bolhoso e angioedema hereditário por deficiência do inibidor de C1. Em nosso meio, Criado e cols. também mostraram aumento significante de D-dímero em pacientes com urticária crônica ativa, quando comparados àqueles com urticária crônica em remissao, ou com psoríase24. É possível que a geraçao acelerada de trombina possa ativar mastócitos e aumentar a permeabilidade de vasos da pele. Em estudos com mastócitos de roedores foi demonstrado que trombina induziu degranulaçao de mastócitos, entretanto este achado ainda nao foi reproduzido em humanos com UCE8. Dos potenciais mecanismos discutidos, este é o mais especulativo em termos de um papel direto ou indireto do omalizumabe.
A Figura 3 resume os potenciais mecanismos de açao do omalizumabe na UCE.
PORQUE EXISTEM RESPONDEDORES RAPIDOS E RESPONDEDORES LENTOS AO OMALIZUMABE?
Observaçoes ex vivo por Eggel e cols., de que uma elevada concentraçao de omalizumabe catalisa a rápida dissociaçao de IgE ligada a basófilos humanos isolados de pacientes com doenças alérgicas, poderia explicar respostas rápidas ao omalizumabe em pacientes com UCE25. Entretanto, nao se sabe se esses achados sao fisiologicamente relevantes na prática clínica quando concentraçoes de omalizumabe sao mais baixas. Um outro estudo investigou in vitro o mecanismo de açao do omalizumabe em mastócitos e basófilos26. Uma linhagem celular de mastócitos humanos (LAD2) previamente sensibilizados com IgE, e basófilos ex vivo de indivíduos normais foram incubados com omalizumabe em diferentes doses, e o efeito em vários eventos foi analisado. Os resultados mostraram que omalizumabe dissociou IgE pré-ligada de mastócitos e basófilos de forma dose e tempo dependente, resultando em diminuiçao da degranulaçao e da síntese de leucotrienos. De forma interessante, em células LAD2, níveis elevados de omalizumabe (2-0,5 mg/mL) foram capazes de dissociar IgE pré-ligada tao cedo quanto em 4 horas; entretanto, doses mais baixas de omalizumabe (100-30 µg/mL), mais próximas aos níveis fisiológicos de omalizumabe (25- 60 µg/mL), necessitaram de incubaçao por tempo mais longo (24 horas) para serem eficazes. Resultados semelhantes foram observados com basófilos, em concordância com o estudo de Eggel e cols.25. É importante destacar que nestes estudos a inibiçao da ativaçao de mastócitos e basófilos ocorreu em poucas horas, e foi consistente com a rápida resposta clínica ao omalizumabe observada em alguns pacientes. A capacidade do omalizumabe de causar dissociaçao da IgE pré-ligada a FcεRI em mastócitos e basófilos é um mecanismo de açao adicional para explicar sua eficácia em controlar os sintomas de UCE rapidamente, dentro de 24 horas da administraçao, que nao poderia ser explicada por internalizaçao de FcεRI resultante do desaparecimento da IgE livre26.
Recente estudo de Gericke e cols. revelou que a presença de teste de liberaçao de histamina por basófilos (Basophil Histamine Release Assay BHRA) e teste cutâneo com soro autólogo (Autologous Serum Skin Test ASST) positivos foram associados a resposta mais lenta ao omalizumabe27. Neste estudo, os autores trataram 64 pacientes com UCE nao controlada com anti-histamínicos em doses até 4 vezes maiores que as doses recomendadas, com injeçoes subcutâneas de 300 mg de omalizumabe em 3 doses, a cada 4 semanas. Ao final da 12ª semana, 56 (88%) responderam ao omalizumabe (UAS7 ≤ 6) e 8 (12%) foram nao respondedores. Dos 56 respondedors, 39 pacientes (70%) responderam em 8 dias (respondedores rápidos), sendo 18 (32%) no primeiro dia. Dezessete pacientes (30%) responderam entre 8 dias e 3 meses (respondedores lentos). O cut-off de 8 dias entre os respondedores rápidos e lentos foi escolhido considerando que 8 dias corresponde ao pico do nível plasmático do omalizumabe após sua injeçao inicial. Houve uma correlaçao significante entre os resultados de BHRA e ASST. Respondedores ao omalizumabe BHRA-positivos e ASST-positivos tiveram 4,5 e 5,5 mais chance de serem respondedores lentos quando comparados a respondedores BHRA-negativos e ASST-negativos27. Os resultados deste estudo sugerem que omalizumabe funciona através da reduçao da expressao de FcεRI nesses pacientes. Os autores formularam a hipótese de que uma resposta lenta ao omalizumabe ocorre em pacientes com UCE nos quais anticorpos IgG contra receptores de IgE nao ocupados (FcεRI) ativam a liberaçao de mediadores de mastócitos que causam a formaçao de pápulas e angioedema. Esta hipótese é baseada no conhecimento de que o omalizumabe primeiro forma complexos com a IgE livre, depois sequestra IgE dissociada de mastócitos, deixando descobertos FcεRI, que subsequentemente decairao lentamente ao longo de várias semanas27.
MEDIDAS OBJETIVAS DE AVALIAÇAO DE PACIENTES COM URTICARIA CRONICA ESPONTANEA E POTENCIAIS BIOMARCADORES
No momento presente, a avaliaçao da atividade da UCE, do seu impacto na qualidade de vida, da eficácia do tratamento e do controle da doença é puramente clínica e inclui a história clínica do paciente, o exame físico e o uso de questionários como o Urticaria Activity Score (UAS), o Angioedema Activity Score (AAS), o Chronic Urticaria Quality of Life Questionnaire (CU-Q2oL), o Angioedema Quality of Life Questionnaire (AE-QoL) e o Urticaria Control Test (UCT)28. Neste número do BJAI, Valle e cols. apresentam uma avaliaçao detalhada dessas ferramentas, algumas delas já validadas para o português do Brasil, e enfatizam o grande valor das mesmas para a monitorizaçao de pacientes com urticária crônica29. Estas ferramentas se caracterizam como PROs (Patient Reported Outcomes), definidos como qualquer relato do status da condiçao de saúde de um paciente que vem diretamente do paciente, sem interpretaçao da resposta do paciente por um médico ou qualquer outra pessoa. Em outras palavras, ferramentas PRO medem o que pacientes sao capazes de fazer e como eles se sentem, a partir da formulaçao de perguntas. PROs sao importantes por várias razoes, incluindo: avaliam de forma consistente o estado de saúde do paciente; ajudam na tomada de decisoes terapêuticas; padronizam e melhoram o processo de registro de dados médicos; melhoram a avaliaçao da resposta ao tratamento; e aumentam a satisfaçao do médico e do paciente. Portanto, eles devem ser utilizados e incorporados de forma rotineira ao manejo de pacientes com a doença28,29. PROs disponíveis e validados na UCE sao resumidos na Figura 4.
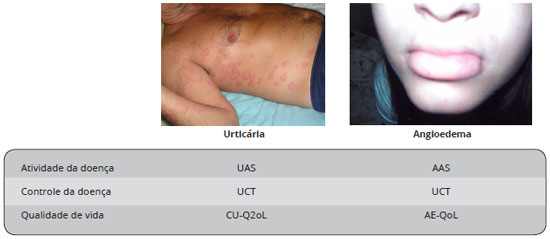
Figura 4 - Patient Related Outcomes (PROs) disponíveis e validados em pacientes com urticária crônica espontânea
Um outro conceito relevante é o de Minimal Important Difference (MID). Algumas vezes a mudança de um escore clínico pode ser estatisticamente significante, entretanto nao ser clinicamente relevante; portanto, a definiçao de MID é uma mudança de escore que é clinicamente relevante. Para as ferramentas usadas na UCE, já existe determinaçao de MID para UAS7 (10-12 pontos), AAS7 (8 pontos), e UCT (3 pontos)30,31.
Embora de relevância clínica muito bem estabelecida, ferramentas clínicas para avaliaçao de pacientes com UCE têm a desvantagem de serem instrumentos retrospectivos e/ou subjetivos. Portanto, há uma falta de indicadores objetivos mensuráveis para complementar a avaliaçao da atividade da UCE e eficácia do tratamento. Recentemente, vários estudos têm sugerido que parâmetros no sangue periférico poderiam indicar atividade e duraçao da doença, e ajudar na monitorizaçao do tratamento, podendo ser considerados possíveis marcadores de prognóstico na UCE. Rabelo-Filardi e cols. evidenciaram que níveis plasmáticos de fragmento de protrombina 1+2 (F1+2), D-dímero e Proteína C-reativa (PCR) poderiam funcionar como marcadores de gravidade de UCE, em revisao sistemática da literatura32. Mais recentemente, Kolkhir e cols. identificaram 10 biomarcadores que têm suporte de evidência forte para distinguir pacientes com UCE de controles saudáveis, ou para avaliar atividade da UCE. Entretanto, concluíram que há necessidade de estudos adicionais para identificar biomarcadores que possam prever o desfecho, prognóstico ou a resposta ao tratamento em UCE33. Os autores encontraram forte evidência para diferenças significantes entre pacientes com UCE e controles saudáveis em níveis sanguíneos ou valores de D-dímero, PCR, metaloproteinase de matriz-9 (MMP-9), volume médio de plaquetas (VMP), fator VIIa, F1+2, fator de necrose tumoral (TNF), com valores mais elevados em pacientes com UCE quando comparados a controles saudáveis; e sulfato de dehidroepiandrosterona (DHEA-S), e vitamina D, com valores mais baixos em pacientes com UCE versus controles saudáveis. Os resultados mais promissores vieram de estudos que avaliaram D-dímero, PCR e vitamina D, sugerindo um possível papel na fisiopatologia da urticária. Além disso, houve evidência forte para associaçao significante entre atividade de UCE e níveis sanguíneos ou valores de D-dímero, F1+2, PCR, IL-6 e VMP. Evidência forte para contagem reduzida de basófilos em sangue periférico e altos níveis de IgG anti-FcεRI no subgrupo de pacientes com UCE com teste cutâneo do soro autólogo (ASST) positivo foi demonstrada. Finalmente, associaçao significante entre níveis de biomarcadores antes e depois do tratamento com omalizumabe, ciclosporina ou suplementaçao de vitamina D foi demonstrada. D-dímero e IL-31 no caso do omalizumabe; PCR, IL-2R, IL-5 e TNF no tratamento com ciclosporina e dosagem sérica de vitamina D na suplementaçao de vitamina D. Atualmente, D-dímero e IL-3134 sao os candidatos a biomarcadores mais promissores para resposta ao tratamento, entretanto mais estudos sao necessários para validar estes achados e identificar novos biomarcadores em potencial33.
Um problema geral com potenciais biomarcadores é a baixa especificidade do respectivo marcador. Por exemplo, níveis de D-dímero ou PCR que foram encontrados elevados em UCE e se correlacionaram com atividade da doença, podem nao ser específicos o suficiente para urticária, pois podem estar elevados em muitas outras doenças que sao frequentemente comorbidades em pacientes com UCE, ou mesmo causa subjacente de UCE (infecçoes, doenças autoimunes)33.
CONCLUSOES
Embora esteja claro que o omalizumabe é um tratamento eficaz para muitos dos pacientes com UCE, seu mecanismo de açao ainda nao é completamente conhecido9,35. Nenhuma teoria atual, sozinha ou em combinaçao, pode explicar todos os aspectos dos mecanismos que explicam a eficácia do omalizumabe em pacientes com UCE. Mecanismos conhecidos como diminuiçao da ativaçao e liberaçao de mediadores de mastócitos, ou down regulation de receptores de IgE nao explicam todos os efeitos do omalizumabe. A reversao da basopenia e a melhora da funçao dos receptores de IgE em basófilos observadas com o uso de omalizumabe nao explicam os efeitos em mastócitos e outras células envolvidas em lesoes de UCE. Além disso, a incidência de autoanticorpos IgG contra FcεRI e IgE, e de autoanticorpos IgE contra autoantígenos, tem ainda que ser estabelecida, sendo estimada em um máximo de 50% dos pacientes. A taxa de melhora clínica nao está alinhada temporalmente à taxa de efeitos do omalizumabe em mastócitos. Outros fatores como o envolvimento do sistema de coagulaçao na UCE precisam ser melhor investigados.
Considerando que subgrupos de indivíduos com UCE podem ter diferentes mecanismos de doença que ainda nao sao completamente compreendidos, o desafio de encontrar evidências para mais de um mecanismo é grande. Estudos adicionais sao necessários para explorar cada uma destas explicaçoes potenciais para o mecanismo do omalizumabe (papel dos mastócitos versus basófilos, reatividade celular, autoanticorpos, e potenciais fatores séricos ainda desconhecidos), e a interaçao potencial entre estas teorias.
Areas adicionais para estudos futuros incluem a capacidade do omalizumabe de inibir a liberaçao de citocinas inflamatórias, quimiocinas, e mediadores de mastócitos cutâneos, basófilos e vasculatura. Quando pacientes resistentes a anti-histamínicos e antileucotrienos sao estudados, aproximadamente 40% tem uma resposta completa ao omalizumabe (UAS7 = 0), com uma taxa total de resposta (UAS7 ≤ 6) de aproximadamente 50% a 70% após 12 semanas. Uma fraçao menor responde de forma extraordinariamente rápida (em poucos dias) enquanto que o restante dos pacientes melhora gradualmente, entre 2 a 19 semanas. Portanto, mecanismos únicos podem ser relevantes para subpopulaçoes de pacientes com UCE, e estudos que forneçam evidência definitiva sobre o mecanismo de açao do omalizumabe deverao ajudar a definir a patogênese desta importante condiçao clínica9.
REFERENCIAS
1. Maurer M, Church MK, Gonçalo M, Sussman G, Sánchez-Borges M. Management and treatment of chronic urticaria (CU). J Eur Acad Dermatol Venereol. 2015 Jun;29 Suppl 3:16-32.
2. Giménez-Arnau AM, Toubi E, Marsland AM, Maurer M. Clinical management of urticaria using omalizumab: the first licensed biological therapy available for chronic spontaneous urticaria. J Eur Acad Dermatol Venereol. 2016;30 Suppl 5:25-32.
3. Zhao ZT, Ji CM, Yu WJ, Meng L, Hawro T, Wei JF, et al. Omalizumab for the treatment of chronic spontaneous urticaria: a meta-analysis of randomized clinical trials. J Allergy Clin Immunol. 2016;137(6):1742-50.
4. Ensina LF, Valle SO, Juliani AP, Galeane M, Vieira dos Santos R, Arruda LK, et al. Omalizumab in Chronic Spontaneous Urticaria: A Brazilian real-life experience. Int Arch Allergy Immunol. 2016;169(2):121-4.
5. Maurer M, Sofen H, Ortiz B, Kianifard F, Gabriel S, Bernstein JA. Positive impact of omalizumab on angioedema and quality of life in patients with refractory chronic idiopathic/spontaneous urticaria: analyses according to the presence or absence of angioedema. J Eur Acad Dermatol Venereol. 2016 Dec 2. doi: 10.1111/jdv.14075.
6. Zazzali JL, Kaplan A, Maurer M, Raimundo K, Trzaskoma B, Solari PG, et al. Angioedema in the omalizumab chronic idiopathic/spontaneous urticaria pivotal studies. Ann Allergy Asthma Immunol. 2016;117(4):370-7.
7. Staubach P, Metz M, Chapman-Rothe N, Sieder C, Bräutigam M, Canvin J, et al. Effect of omalizumab on angioedema in H1-antihistamineresistant chronic spontaneous urticaria patients: results from X-ACT, a randomized controlled trial. Allergy. 2016;71(8):1135-44.
8. Chang TW, Chen C, Lin CJ, Metz M, Church MK, Maurer M. The potential pharmacologic mechanisms of omalizumab in patients with chronic spontaneous urticaria. J Allergy Clin Immunol. 2015;135(2):337-42.
9. Kaplan AP, Giménez-Arnau AM, Saini SS. Mechanisms of action that contribute to efficacy of omalizumab in Chronic Spontaneous Urticaria. Allergy. 2016 Nov 15. doi: 10.1111/all.13083.
10. Fine LM, Bernstein JA. Guideline of Chronic Urticaria Beyond. Allergy Asthma Immunol Res. 2016;8(5):396-403.
11. Kaplan A, Ferrer M, Bernstein JA, Antonova E, Trzaskoma B, Raimundo K, et al. Timing and duration of omalizumab response in patients with chronic idiopathic/spontaneous urticaria. J Allergy Clin Immunol. 2016;137(2):474-81.
12. Confino-Cohen R, Chodick G, Shalev V, Leshno M, Kimhi O, Goldberg A. Chronic urticaria and autoimmunity: associations found in a large population study. J Allergy Clin Immunol. 2012;129:1307-13.
13. Dionigi PC, Menezes MC, Forte WC. A prospective ten-year follow-up of patients with chronic urticaria. Allergol Immunopathol (Madr). 2016;44(4):286-91.
14. Kolkhir P, Church MK, Weller K, Metz M, Schmetzer O, Maurer M. Autoimmune chronic spontaneous urticaria: what we know and what we do not know. J Allergy Clin Immunol. 2016 Oct 21. pii: S0091-6749(16)31212-X. doi: 10.1016/j.jaci.2016.08.050.
15. Calamita Z1, Pelá Calamita AB. Chronic spontaneous urticaria: epidemiological characteristics focusing on the histocompatibility profile and presence of antibodies. Inflamm Allergy Drug Targets. 2013;12(1):8-11.
16. Sanjuan MA, Sagar D, Kolbeck R. Role of IgE in autoimmunity. J Allergy Clin Immunol. 2016 Jun;137(6):1651-61.
17. Grattan CE, Wallington TB, Warin RP, Kennedy CT, Bradfield JW. A serological mediator in chronic idiopathic urticaria - a clinical, immunological and histological evaluation. Br J Dermatol. 1986;114:583-90.
18. Ferriani MP, Silva MF, Pereira RM, Terreri MT, Saad Magalhaes C, Bonfá E et al. Chronic Spontaneous Urticaria: a survey of 852 cases of childhood-onset Systemic Lupus Erythematosus. Int Arch Allergy Immunol. 2015;167(3):186-92.
19. Lawrence MG, Woodfolk JA, Schuyler AJ, Stillman LC, Chapman MD, Platts-Mills TA. Half-life of IgE in serum and skin: Consequences for anti-IgE therapy in patients with allergic disease. J Allergy Clin Immunol. 2016 Jul 14. pii: S0091-6749(16)30600-5. doi: 10.1016/j.jaci.2016.04.056.
20. Asero R, Tedeschi A, Marzano AV, Cugno M. Chronic spontaneous urticaria: immune system, blood coagulation, and more. Expert Rev Clin Immunol. 2016;12(3):229-31.
21. Criado PR, Criado RFJ, Maruta CW, Reis VMS. Chronic urticaria in adults: state-of-the-art in the new millennium. An Bras Dermatol. 2015;90(1):74-89.
22. Cugno M, Tedeschi A, Borghi A, Bucciarelli P, Asero R, Venegoni L, et al. Activation of blood coagulation in two prototypic autoimmune skin diseases: a possible link with thrombotic risk. PLoS One. 2015;10(6):e0129456. doi: 10.1371/journal.pone.0129456.
23. Yalcin AD, Celik B, Gumuslu S. D-dimer levels decreased in severe allergic asthma and chronic urticaria patients with the omalizumab treatment. Expert Opin Biol Ther. 2014;14(3):283-6.
24. Criado PC, Maruta CW, Antinori LCL, Reis VMS. Evaluation of D-dimer serum levels among patients with chronic urticaria, psoriasis and urticarial vasculitis. An Bras Dermatol. 2013;88(3):355-60.
25. Eggel A, Baravalle G, Hobi G, Kim B, Buschor P, Forrer P, et al. Accelerated dissociation of IgE-FcεRI complexes by disruptive inhibitors actively desensitizes allergic effector cells. J Allergy Clin Immunol 2014;133(6):1709-19.
26. Serrano-Candelas E, Martinez-Aranguren R, Valero A, Bartra J, Gastaminza G, Goikoetxea MJ, et al. Comparable actions of omalizumab on mast cells and basophils. Clin Exp Allergy. 2016 Jan;46(1):92-102.
27. Gericke J, Metz M, Ohanyan T, Weller K, Altrichter S, Skov PS, et al. Serum autoreactivity predicts time to response to omalizumab therapy in chronic spontaneous urticaria. J Allergy Clin Immunol. 2016 Nov 9. pii: S0091-6749(16)31282-9. doi: 10.1016/j.jaci.2016.07.047.
28. Weller K, Siebenhaar F, Hawro T, Altrichter S, Schoepke N, Maurer M. Clinical measures of Chronic Urticaria. Immunol Allergy Clin North Am. 2017 Feb;37(1):35-49. doi: 10.1016/j.iac.2016.08.005.
29. Valle SO, Motta AA, Amaral CS, Ensina LF, Mallozi MC, Spengler MG, et al. O que há de novo na urticária crônica espontânea? Braz J Allergy Immunol. 2016;4(1):9-25.
30. Mathias SD, Crosby RD, Zazzali JL, Maurer M, Saini SS. Evaluating the minimally important difference of the urticaria activity score and other measures of disease activity in patients with chronic idiopathic urticaria. Ann Allergy Asthma Immunol. 2012;108(1):20-4.
31. Mathias SD, Crosby RD, Rosén KE, Zazzali JL. The minimal important difference for measures of urticaria disease activity: Updated findings. Allergy Asthma Proc. 2015;36(5):394-8.
32. Rabelo-Filardi R, Daltro-Oliveira R, Campos RA. Parameters associated with chronic spontaneous urticaria duration and severity: a systematic review. Int Arch Allergy Immunol. 2013;161(3):197-204.
33. Kolkhir P, Andre F, Church MK, Maurer M, Metz M. Potential blood biomarkers in chronic spontaneous urticaria. Clin Exp Allergy. 2016 Dec 7. doi: 10.1111/cea.12870.
34. Altrichter S, Hawro T, Hänel K, Czaja K, Lüscher B, Maurer M, et al. Successful omalizumab treatment in chronic spontaneous urticaria is associated with lowering of serum IL-31 levels. J Eur Acad Dermatol Venereol. 2016;30(3):454-5.
35 Bulkhi A, Cooke AJ, Casale TB. Biologics in Chronic Urticaria. Immunol Allergy Clin North Am. 2017;37(1):95-112. doi: 10.1016/j.iac.2016.08.004.




