Número Atual: Fevereiro- 2015 - Volume 3 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
Artigo de Revisão
Epigenética da asma: revisão
Epigenetics of asthma: a review
Ataualpa P. Reis
MD, PhD. Instituto de Ensino e Pesquisa da Santa Casa de Belo Horizonte, Belo Horizonte, MG
Endereço para correspondência:
Ataualpa P. Reis
E-mail: ataualpapreis@gmail.com
Submetido em: 19/03/2014.
Aceito em: 20/06/2016.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
O tratamento atual da asma permite controlar os sintomas, mas nao modifica a sua história natural. Mecanismos epigenéticos aumentaram muito nosso conhecimento do início e progressao da asma, e novas estratégias de tratamento serao desenvolvidas para esta geraçao e para prevençao de asma de geraçoes futuras. O campo certamente avançou muito nos últimos anos. O objetivo deste trabalho foi fazer uma revisao de estudos experimentais e clínicos publicados nos últimos anos. As fontes de dados incluiram artigos originais, revisoes e publicaçoes concernentes indexados nos bancos de dados PubMed, MEDLINE, LILACS, SciELO e publicaçoes on line nos últimos 20 anos. Os resultados da presente revisao mostraram que marcadores epigenéticos (metilaçao do DNA, modificaçoes das histonas e síntese de RNAs nao codificadores) trabalham em concerto com outros componentes do mecanismo regulador celular para controlar a expressao de genes. Alteraçoes nestes marcadores epigenéticos estao associadas com exposiçoes relevantes para a asma, particularmente dieta, poluiçao atmosférica, endotoxinas, alérgenos ambientais e fumaça de cigarro, assim como com fenótipos de asma. Por outro lado, estudos estao começando a decifrar o papel da regulaçao epigenética da expressao dos genes associados ao desenvolvimento de asma alérgica. Em conclusao, avanços tecnológicos recentes têm tornado possível o estudo de marcadores epigenéticos nos pulmoes, e está sendo antecipado que este conhecimento vai melhorar a compreensao da biologia dinâmica nos pulmoes e que levará ao desenvolvimento de novos meios de diagnóstico e tratamento para pacientes com asma.
Descritores: Asma, epigenética, fatores ambientais, doenças alérgicas.
INTRODUÇAO
Doenças complexas em geral, e asma em particular, sao amplamente conhecidas como condiçoes nas quais tanto genes quanto fatores ambientais têm papéis críticos. O componente ambiental da asma tem relevância pelo aumento marcante da prevalência da doença nas últimas décadas1, fato incompatível com mecanismos puramente genéticos. Para aumentar a complexidade, a asma é altamente influenciável por fatores do desenvolvimento na primeira infância, independente da idade na qual o diagnóstico de asma é realizado2. Neste contexto, a epigenética que estuda as mudanças herdadas na expressao do gene sobre os fenótipos celulares, mas que nao envolve mudanças na sequência subjacente do DNA3-5, tem emergido como um campo promissor de investigaçao. Certamente os mecanismos epigenéticos sao essenciais para elucidar a resposta dada pelas exposiçoes ambientais e pelos processos de desenvolvimento, e contribuem para o conhecimento da origem das doenças e entendimento da variabilidade fenotípica. A observaçao de que exposiçao ambiental a certos agentes na primeira infância, tais como infecçao, poluentes e fármacos, pode contribuir para o desenvolvimento de asma alérgica, levanta questoes fundamentais sobre o mecanismo da doença. Se atopia e a resposta imunológica polarizada para Th2 sao mecanismos precursores no desenvolvimento da asma na infância, como entao uma infecçao viral respiratória pode mudar o fenótipo das células T helper? A epigenética pode dar resposta a esta indagaçao.
O interesse atual da epigenética na asma é também o resultado da falta de elucidaçoes dadas pelos estudos abordando a genética da asma. Tanto os estudos da associaçao genética simples quanto os mais recentes da associaçao a nível genômico (genomewide association) foram eficientes em identificar um número de genes candidatos a terem significado biológico7-10, mas pecaram por nao elucidar grande parte das variaçoes genotípicas responsáveis pela asma11-12. Isto motivou estudos de procura de fontes das variaçoes fenotípicas que fossem baseadas no DNA, mas que nao fossem puramente genéticas.
A ênfase na epigenética se tornou possível com os avanços tecnológicos. Os estudos do genoma amplo abriram a possibilidade de análise de alguns marcadores genéticos importantes, tais como a metilaçao do DNA e modificaçoes de histonas pós-transcriçao13-14. A metilaçao do DNA surgiu como método viável em estudos populacionais, pois pode usar pequenas quantidades de DNA, mesmo que conservadas por períodos longos, permitindo a utilizaçao ampla deste método de estudo de epigenética15-16.
METILAÇAO DO DNA, ALTERAÇAO DAS HISTONAS E EXPRESSAO DE MICRORNAS ABERRANTES
As modificaçoes epigenéticas mais comuns envolvem a metilaçao do DNA ou modificaçao pós-transcriçao de grupos de aminoácidos das histonas por acetilaçao, metilaçao ou fosforilaçao18-19.
A metilaçao do DNA é um processo bioquímico que envolve a adiçao de um grupo metil aos nucleotídeos de DNA cisteína ou adenina. É considerada um processo epigenético que leva principalmente ao silenciamento do gene, e subsequente inibiçao da transcriçao gênica. Em geral, a metilaçao de DNA ocorre em diferentes CpGs (regioes do DNA onde nucleotídeos citosina ocorrem próximos a nucleotídeos guanina, separados apenas por um fosfato), agrupados em ilhas na maioria dos genes. Essas ilhas ricas em CpGs têm um papel crítico nas regioes promotoras dos genes. Uma vez que estas CpGs sejam metiladas, a transcriçao gênica pode nao acontecer; por outro lado, quando sao desmetiladas, as regioes promotoras podem se tornar ativas, permitindo a interaçao com vários fatores de transcriçao que controlam a ativaçao gênica. Por exemplo, nas células T a metilaçao tem um papel importante no desenvolvimento, ativaçao e manutençao da célula T efetora. A desmetilaçao da regiao da FOX P3 (forkhead box protein P3) favorece o desenvolvimento de células T reguladoras. Durante este desenvolvimento das células T em efetoras ou outros tipos de células T, existe um intenso mecanismo de alteraçoes epigenéticas. As principais enzimas associadas à metilaçao do DNA sao as DNA metiltransferases (DNMTs) e estas enzimas têm um papel preponderante no processo de metilaçao. DNMT1 é a principal DNMT, e é importante na manutençao da metilaçao do DNA, mantendo o silenciamento do mesmo. DNMT3a e DNMT3b sao as principais enzimas responsáveis por novas metilaçoes e sao mediadoras da repressao do gene. Estas também podem interagir com DNMT1 e proporcionar um efeito cooperativo18-19.
Histonas sao proteínas altamente alcalinas encontradas no núcleo de células eucarióticas, que promovem o empacotamento e a ordenaçao do DNA em unidades estruturais denominadas nucleossomos. O DNA é geralmente envolvido em torno de duas cópias das histonas H2A, H2B, H3 ou H4. O principal mecanismo de regulaçao da cromatina é através de modificaçoes pós-traduçao na cauda proteica dessas histonas. Do ponto de vista bioquímico, as principais modificaçoes sao acetilaçao, metilaçao, fosforilaçao, ubiquitinaçao e sumoilaçao (adiçao de SUMOs, small ubiquitin-like modifiers). Os efeitos de tais modificaçoes variam desde a ativaçao de genes até o silenciamento de genes, podendo ter também algumas funçoes no reparo de DNA. Acetilaçao de diferentes resíduos de lisina em histonas representa um dos melhores exemplos neste sentido, resultando em ativaçao da transcriçao. Essa ativaçao é catalisada por histona acetiltransferases (HATs). Existem duas famílias de HATs: as do tipo A, localizadas no núcleo e que estao envolvidas na expressao de genes através de acetilaçao de histonas nucleossômicas, e as HATs do tipo B, que estao localizadas no citoplasma e sao responsáveis pela acetilaçao de histonas recentemente sintetizadas, antes de serem montadas no nucleossoma. Modificaçoes de histonas nas células T têm um papel importante no desenvolvimento de células T para diferentes subtipos, tendo papel importante em condiçoes tanto fisiológicas como patológicas. Por exemplo, metilaçao de H3K9 é eficiente mecanismo de silenciamento em muitos genes efetores Th1 e Th2. Além disso, Th-POK (Th inducing POZ-Kruppel factor), o fator de transcriçao primário para CD4, recruta diferentes histonas deacetilases, que silenciam muitos dos genes CD8, e como resultado, células T sao induzidas ao desenvolvimento de subpopulaçao CD418-19.
Cada um destes mecanismos está envolvido na regulaçao da expressao de genes20. Um mecanismo adicional consiste na expressao aberrante de microRNAs. MicroRNAs sao pequenas moléculas de RNA nao codificadores envolvidas na repressao da transcriçao e silenciamento de genes. Estes microRNAs sao moléculas de RNA simples com 21-23 nucleotídeos de extensao e que induzem a degradaçao do mRNA alvo. O conhecimento da atividade destes microRNAs em asma ou outras doenças complexas talvez seja o menos conhecido entre os mecanismos epigenéticos. Um microRNA em particular pode ter centenas de genes alvos e, portanto, pode influenciar na expressao de uma grande quantidade de proteínas, causando sobretudo silenciamento do gene21.
Coletivamente, estes três principais mecanismos epigenéticos afetam interaçoes do DNA com fatores de transcriçao, estabilidade da transcriçao, posicionamento do nucleossoma, compactaçao da cromatina e organizaçao nuclear, todos determinando se um gene ou um grupo de genes vai ser ativado ou silenciado, e quando e onde um gene será expresso. Eles portanto têm papel crucial em determinar programas de transcriçao de determinados tecidos. Quando, por epigenética, um gene é alterado durante o desenvolvimento, o novo código epigenético torna-se plataforma para futuras modificaçoes epigenéticas que normalmente ocorrem durante o desenvolvimento22 (Figura 1).
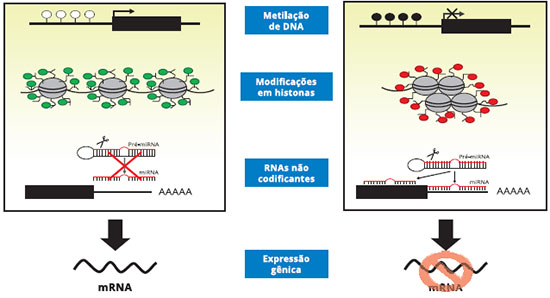
Figura 1 - Diagrama esquemático de mecanismos da regulaçao epigenética: metilaçao do DNA, modificaçao das histonas e RNAs nao codificantes. A esquerda, modificaçoes epigenéticas levando a aumento da expressao do gene, e à direita, modificaçoes epigenéticas causando supressao da expressao do gene
Fonte: acesso livre por Internet.
EPIgEnéTICA E O SISTEMA IMUnE
O desenvolvimento de uma célula T imatura (naive) para célula Th1 ou Th2 do sistema imune é associado com mudanças de linhagem específica com características epigenéticas. Durante a diferenciaçao para Th1, ocorre metilaçao na regiao entre interleucina IL-4 e IL-13 no cromossomo 5q2123, enquanto ocorre também acetilaçao de histonas em nível comparável nestas células T imaturas24. Ambos os efeitos levam a uma reduçao de atividade Th2. Além disso, a ligaçao de T bet ao promotor de interferon gama nao somente induz a aumento de atividade mas também desloca complexos de histona deacetilases, o que torna impossível a ligaçao de acetiltransferase25, desta forma fazendo que o lócus genético do interferon gama seja reprimido. Metilaçao deste lócus também impede que o fator nuclear das células T seja ativado pelo interferon gama26. Em contraste, as regioes IL-13 e IL-4 sofrem intensa desmetilaçao na diferenciaçao de Th2, o que facilita a transcriçao dos fatores STAT6 e GATA323. Simultaneamente à desmetilaçao de DNA24, as histonas nas regioes IL-13 e IL-4 sao acetiladas, promovendo modificaçoes estruturais no lócus27. O desenvolvimento e a funçao das células T reguladoras (Treg) é mediado predominantemente por FOXP3, e diversos estudos mostram que este fator de transcriçao é influenciado por mecanismos epigenéticos. Um mecanismo estimulador é a metilaçao de FOXP3 nas células T CD4+CD25 e nas células T CD4+, mas ocorre desmetilaçao no caso das células T reguladoras naturais28. Como os inibidores de deacetilase das histonas aumentam a expressao de FOXP3, foi também sugerido que o nível de acetilaçao das histonas do lócus FOXP3 tem importante papel no desenvolvimento de células T reguladoras29. A acetilaçao de histonas pode estar envolvida na diferenciaçao de células T para Th1730. Além das células T, também os mastócitos sofrem regulaçao epigenética no lócus IL-4/IL-1331. Para outras células do sistema imune, muito pouco é conhecido.
EXPOSIÇOES AMBIENTAIS IMPLICADAS NA EPIGENÉTICA DA ASMA
Uma das exposiçoes ambientais implicadas na asma e regulaçao epigenética é dieta. Existem vários estudos implicando modificaçoes de dieta com maior ou menor risco de asma, tais como suplementaçao com vitamina D, E , soja e dieta Mediterrânea32-34. Contudo, a suplementaçao dietética mais documentada como relacionada com induçao epigenética relevante para asma é ácido fólico como fonte de doaçao de radicais metil. Em ensaios com animais experimentais, a suplementaçao de ácido fólico administrado durante a gravidez e durante a amamentaçao foi associada com aumento da hiperreatividade brônquica e maior inflamaçao eosinofílica35. Em humanos, a suplementaçao de ácido fólico está associada com maior risco de asma diagnosticada em crianças, e talvez exista uma janela na gravidez em que a suplementaçao com ácido fólico induza a alteraçoes de epigenética, levando a maior risco de asma na infância36-38.
Outra exposiçao ambiental há muito tempo considerada como fator de risco para desenvolvimento de asma em crianças é o tabagismo materno39-41. Alguns estudos demonstram que o mecanismo de açao pode ser transmitindo por várias geraçoes. De forma interessante, o tabagismo da avó durante a gestaçao aumentou o risco de asma para os netos, mesmo que nao tenha havido tabagismo da mae42. Uma açao epigenética da exposiçao ao cigarro é mediada por rompimento da homeostase de histona acetiltransferase/histona diacetilase nas células imunes do sistema respiratório43. Importante assinalar que neste trabalho ficou demonstrado que fumaça de cigarro atenuou a açao dos corticosteroides nos macrófagos alveolares, levando a resistência aos corticosteroides. O cigarro pode ainda exercer açoes epigenéticas por metilaçao do DNA, ou por sequências regulatórias44-45.
Exposiçao a poluentes do tráfico de veículos também é considerada como indutor de asma por via epigenética46. Existe a influência da poluiçao por gases do tráfico de veículos nas maes e desenvolvimento de asma nos filhos, e há envolvimento de hidrocarbonetos policíclicos aromáticos que parece ser devido à metilaçao do DNA na regiao promotora ACSL3. Quanto mais exposiçao aos hidrocarbonetos, maior a metilaçao. Existe também poluiçao por hidrocarbonetos derivados da preparaçao de alimentos com uso de carvao ou defumados47.
Exposiçao a endotoxinas bacterianas na primeira infância pode proteger contra asma, mas exposiçao mais tardia pode predispor à doença48-52. Em alguns estudos de populaçao rural, a exposiçao a endotoxina bacteriana esteve relacionada à proteçao contra rinite e asma53. Existe indicaçao de interaçao genética, sendo que a endotoxina afeta principalmente polimorfismo de CD14 e imunoglobulina IgE54-55. As endotoxinas podem ainda produzir efeito no polimorfismo dos toll-like receptors (TLRs) destas populaçoes rurais56. Um importante mecanismo descrito seria uma reprogramaçao epigenética do TNF-α destas células imunes por remodelamento da cromatina57. Além disso, foi também demonstrado que histonas sofrem desmetilaçao na regiao IL-1β após estimulaçao dos leucócitos humanos por endotoxinas48.
Em estudo de coorte comparando maes e recémnascidos expostos a ambiente de fazenda versus nao expostos, um número aumentado de células positivas para FOXP3 foi encontrado em células mononucleares de sangue de cordao de recém-nascidos de maes com intensa exposiçao a ambiente de fazenda. Além disso, a funçao de células T reg foi mais eficiente naqueles com a exposiçao a fazenda. Estes achados foram associados à desmetilaçao do promotor de FOXP3 nas crianças de maes com exposiçao a leite de fazenda, quando comparadas a maes controle58.
Exposiçao a alérgenos ambientais, incluindo ácaros, está associada a sensibilizaçao e desenvolvimento de asma, e aqui também o mecanismo proposto envolve alteraçoes dos TLRs, que funcionam como sentinelas ativadoras do sistema imune inato e têm papel crucial na programaçao da resposta Th258. Exposiçao a estes alérgenos ativa TLR4 e aumenta a expressao de um conjunto de microRNAs, incluindo miRNA-16, miRNA-21 e miRNA-12659. O bloqueio seletivo do miRNA-126 leva a melhor controle de sintomas de asma e diminuiçao de resposta Th2, inflamaçao e hiperreatividade das vias aéreas. O mecanismo é a supressao da expressao de GATA-3 pelo miRNA-126.
Estudo sobre exposiçao ambiental de crianças na cidade de Boston, nos Estados Unidos, a alérgenos ambientais, endotoxina, fungos e poluentes atmosféricos, mostrou que altos níveis de metilaçao na regiao promotora dos receptores beta-2-adrenérgicos foram associados de forma significante à diminuiçao de relato de dispneia, e à tendência para diminuiçao de sintomas de asma e obstruçao das vias aéreas60.
CONCLUSOES
Mesmo ainda nos seus estágios iniciais, a análise epigenética oferece uma ferramenta poderosa para explorar os mecanismos das doenças complexas, tais como a asma, e ajuda a melhor definir os vários fenótipos desta doença. Usando a epigenética para entender a dinâmica biológica no trato respiratório, e aplicando este conhecimento para desenvolver novas oportunidades de diagnóstico e tratamento da asma, poderemos oferecer a nossos pacientes novas estratégias de controle da doença.
AGRADECIMENTO
Nosso agradecimento ao Prof. Dr. Sérgio D. J. Pena, geneticista do Departamento de Bioquímica e Imunologia do ICB da UFMG, pela revisao do artigo.
REFERENCIAS
1. Eder W, Ege MJ, von Mutius E. The asthma epidemic. N Engl J Med. 2006;355:2226-35.
2. Martinez FD, Vercelli D. Asthma. Lancet. 2013;382(9901):1360-72.
3. Jirtle RL, Skinner MK. Environmental epigenomics and disease susceptibility. Nat Rev Genet. 2007;8:253-62.
4. Vercelli D. Genetics, epigenetics and the environment: Switching, buffering, releasing. J Allergy Clin Immunol. 2004;113:381-6.
5. Jaenisch R, Bird A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat Genet. 2003;33 Suppl:245-54.
6. Vercelli D. Discovering susceptibility genes for asthma and allergy. Nat Rev Immunol. 2008;8:169-82.
7. Li X, Howard TD, Zheng SL, Haselkorn T, Peters SP, Meyers D, et al. Genome. wide association study of asthma identifies RAD50-IL13 and HLA-DR/DQ r regions. J Allergy Clin Immunol. 2010;125:328-35.
8. Moffatt MF, Gut IG, Demenais F, Strachan DP, Bouzigon E, Heath S, et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med. 2010;363:1211-21.
9. Moffatt MF, Kabesch M, Liang L, Dixon AL, Strachan D, Heath S, et al. Genetic variants regulating ORMDL3 expression contribute to the risk of childhood asthma. Nature. 2007;448:470-3.
10. Torgerson DG, Ampleford EJ, Chiu GY, Gauderman WJ, Gignoux CR, Graves PE, et al. Meta-analysis of genome-wide association studies of asthma in ethnically diverse North American populations. Nat Genet. 2011;43:887-92.
11. Eichler EE, Flint J, Gibson G, Kong A, Leal SM, Moore JH, et al. Missing heritability and strategies for finding the underlying causes of complex disease. Nat Rev Genet. 2010;11:446-50.
12. Manolio TA, Collins FS, Cox NJ, Goldstein DB, Hindorff LA, Hunter DJ, et al. Finding the missing heritability of complex diseases. Nature. 2009;461:747-53.
13. Laird PW. Principles and challenges of genomewide DNA methylation analysis. Nat Rev Genet. 2010;11:191-203.
14. Bernstein BE, Kamal M, Lindblad-Toh K, Bekiranov S, Bailey DK, Huebert DJ, et al. Genomic maps and comparative analysis of histone modifications in human and mouse. Cell. 2005;120:169-81.
15. Palmke N, Santacruz D, Walter J. Comprehensive analysis of DNAmethylation in mammalian tissues using MeDIP-chip. Methods. 2011;53:175-84.
16. Weber M, Davies JJ, Wittig D, Oakeley EJ, Haase M, Lam WL, et al. Chromosome- wide and promoter-specific analyses identify sites of differential DNA methylation in normal and transformed human cells. Nat Genet. 2005;37:853-62.
17. Isidoro-Garcia M, Davila-Gonzalez I, Pascual de Pedro M, Sanza-Lozano C, Lorente, Toledano F. Interactions between genes and the environment. Epigenetics in allergy. Allergol Immunopathol. 2007;35:254-8.
18. Miller RL, Herbstman J. Epigenetic mechanisms in asthma. In: Haslberger A, Gressler S, editors. Epigenetics nutrition and environmental health. Berlin: Wiley; 2009. p. 253-63.
19. Tarantini L, Bonzini M, Apostoli P, Pegoraro V, Bollati V, Marinelli B, et al. Effects of particulate matter on genomic DNA methylation content and iNOS promoter methylation. Environ Health Perspect. 2009;117:217-22.
20. Ho SM. Environmental epigenetics of asthma: an update. J Allergy Clin Immunol. 2010;126(3):453-65.
21. Rebane A, Akdis CA. MicroRNAs: essential players in the regulation of inflammation. J Allergy Clin Immunol. 2013;132:15-26.
22. Joss-Moore LA, Albertine KH, Lane RH. Epigenetics and the developmental origins of lung disease. Mol Genet Metab. 2011;104(1-2):61-6.
23. Lee DU, Agarwal S, Rao A. Th2 lineage commitment and efficient IL-4 production involves extended demethylation of the IL-4 gene. Immunity. 2002;16:649-60.
24. Avni O, Lee D, Macian F, Szabo SJ, Glimcher LH, Rao A. TH cell differentiation is accompanied by dynamic changes in histone acetylation of cytokine genes. Nat Immunol. 2002;3:643-51.
25. Chen GY, Osada H, Santamaria-Babi LF, Reiji K. Interaction of GATA-3/T-bet transcription factors regulates expression of sialyl Lewis X homing receptors on Th1/Th2 lymphocytes. Proc Natl Acad Sci. 2006;103:16894-9.
26. Jones B, Chen J. Inhibition of IFN-gamma transcription by sitespecific methylation during T helper cell development. EMBO J. 2006;25:2443-52.
27. Ansel KM, Djuretic I, Tanasa B, Rao A. Regulation of Th2 differentiation and Il4 locus accessibility. Annu Rev Immunol. 2006;24:607-56.
28. Lal G, Zhang N, van der Touw W, Ding Y, Ju W, Bottinger EP, et al. Epigenetic regulation of Foxp3 expression in regulatory T cells by DNA methylation. J Immunol. 2009;182:259-73.
29. Tao R, de Zoeten EF, Ozkaynak E, Chen C, Wang L, Porrett PM, et al. Deacetylase inhibition promotes the generation and function of regulatory T cells. Nat Med. 2007;13:1299-307.
30. Akimzhanov AM, Yang XO, Dong C. Chromatin remodeling of interleukin-17 (IL-17)-IL-17F cytokine gene locus during inflammatory helper T cell differentiation. J Biol Chem. 2007;282:5969-72.
31. Ansel KM, Lee DU, Rao A. An epigenetic view of helper T cell differentiation. Nat Immunol. 2003;4:616-23.
32. Devereux G, Turner SW, Craig LC, McNeill G, Martindale S, Harbour PJ, et al. Low maternal vitamin E intake during pregnancy is associated with asthma in 5-year-old children. Am J Resp Crit Care. 2006;174:499-507.
33. Devereux G, Litonjua A, Turner SW, Craig LC, McNeill G, Martindale S, et al Maternal vitamin D intake during pregnancy and early childhood wheezing. Am J Clin Nutr. 2007;85:853-9.
34. Castro-Rodriguez JA, Garcia-Marcos L, Sanchez-Solis M, Pérez-Fernández V, Martinez-Torres A, Mallol J. Olive oil during pregnancy is associated with reduced wheezing during the fi rst year of life of the offspring. Pediatr Pulmonol. 2010;45:395-402.
35. Blatter J, Han YY, Forno E, Brehm J, Bodnar L, Celedón JC. Folate and asthma. Am J Respir Crit Care Med. 2013;188(1):12-7.
36. Whitrow M, Moore V, Rumbold A, Davies M. Effect of supplemental folic acid in pregnancy on childhood asthma: a prospective birth cohort study. Am J Epidemiol. 2009;170:1486-93.
37. Haberg SE, London SJ, Nafstad P, Nilsen RM, Ueland PM, Vollset SE, et al. Maternal folate levels in pregnancy and asthma in children at age 3 years. J Allergy Clin Immunol. 2011;127:262-4.
38. Steegers-Theunissen RP, Obermann-Borst SA, Kremer D, Lindemans J, Siebel C, Steegers EA, et al. Periconceptional maternal folic acid use of 400 mg per day is related to increased methylation of the IGF2gene in the very young child. PLoS One. 2009;4:e7845.
39. Moshammer H, Hoek G, Luttmann-Gibson H, Neuberger MA, Antova T, Gehring U, et al. Parental smoking and lung function in children: an international study. Am J Respir Crit Care Med. 2006;173:1255.
40. Alati R, Al-Mamun A, O'Callaghan M, Najman JM, Williams GM. In utero and postnatal maternal smoking and asthma in adolescence. Epidemiology. 2006;17:138-44.
41. Eisner MD. Environmental tobacco smoke exposure and pulmonary function among adults in NHANES III: impact on the general population and adults with current asthma. Environ Health Perspect. 2002;110:765-70.
42. Li Y-F, Langholz B, Salam MT, Gilliland FD. Maternal and grandmaternal smoking patterns are associated with early childhood asthma. Chest. 2006;127:1232-41.
43. Ito K, Lim S, Caramori G, Chung KF, Barnes PJ, Adcock IM. Cigarette smoking reduces histona deacetylase 2 expression, enhances cytokine expression and inhibits glucocorticoid action in alveolar macrophages. FASEB J. 2001;15:1110-2.
44 Yanagawa N, Tamura G, Oizumi H, Takahashi N , Shimazaki Y, Motoyama T, et al. Frequent epigenetic silencing of the p16gene in non small cell lung cancer of tobacco smokers. Jpn J Cancer Res. 2002;93:1107-13.
45. Diegel H, Lubbert M. DNA methylation disturbances as novel therapeutic target in lung cancer: preclinical and clinical results. Crit Rev Oncol Hematol. 2005;55:1-11.
46. Perera F, Tang WY, Herbstman J, Tang D, Levin L, Miller R, et al. Relation of DNA methylation of 5′-CpG island of ACSL3 to transplacental exposure to airborne polycyclic aromatic hydrocarbons and childhood asthma. PLoS One. 2009;4:e4488.
47. Hon J, Hershey GKK. Genetic and epigenetic influence on the response to environonmental particulate matter. J Allergy Clin Immunol. 2012;129:33-41.
48. Douwes J, Pearce N, Heederik D. Does environmental endotoxin exposure prevent asthma? Thorax. 2002;57:86-90.
49. Chan C, Li L, McCall CE, Yoza BK. Endotoxin tolerance disrupts chromatin remodeling and NF-kappaB transactivation at the IL-1beta promoter. J Immunol. 2005;175:461-8.
50. Biswas SK, Lopez-Collazo E. Endotoxin tolerance: new mechanisms, molecules and clinical significance. Trends Immunol. 2009;30:475-87.
51. Foster SL, Hargreaves DC, Medzhitov R. Gene-specific control of inflammation by TLR-induced chromatin modifications. Nature. 2007;447:972-8.
52. Nahid MA, Pauley KM, Satoh M, Chan EK. miR-146a is critical foendotoxin-induced tolerance: Implication in innate immunity. J Biol Chem. 2009;284:34590-9.
53. Braun-Fahrlander C, Riedler J, Herz U, Eder W, Waser M, Grize L, et al. Environmental exposure to endotoxin and its relation to asthma in school-age children. N Engl J Med. 2002;347:869-77.
54. Simpson A, John SL, Jury F, Niven R, Woodcock A, Ollier WE A, et al. Endotoxin exposure, CD14, and allergic disease: an interaction between genes and the environment. Am J Resp Crit Care. 2006;174:386-92.
55. Zambelli-Weiner A, Ehrlich E, Stockton ML, Grant AV, Zhang S, Levett PN, et al. Evaluation of the CD14/-260 polymorphism and house dust endotoxin exposure in the Barbados Asthma Genetics Study. J Allergy Clin Immunol. 2005;115:1203-9.
56. Eder W, Klimecki W, Yu L, von Mutius E, Riedler J, Braun-Fahrländer C, et al. Toll-like receptor 2 as a major gene for asthma in children of European farmers. J Allergy Clin Immunol. 2004;113:482-8.
57. Belinsky SA, Liechty KC, Gentry FD, Wolf HJ, Rogers J, Vu K, et al. Promoter hypermethylation of multiple genes in sputum precedes lung cancer incidence in a high-risk cohort. Cancer Res. 2006;66:3338-44.
58. Yang IV, Schwartz DA. Epigenetic mechanisms and the development of asthma. J Allergy Clin Immunol. 2012;130:1243-55.
59. Mattes J, Collison A, Plank M, Phipps S, Foster PS. Antagonism of microRNA-126 suppresses the effector function of TH2 cells and the development of allergic airways disease. Proc Natl Acad Sci USA. 2009;106:18704-9.
60. Gaffin JM, Phipatanakul W. Beta-2 adrenergic receptor methylation influences asthma phenotype in the school inner city asthma study. Receptors Clin Investig. 2014;1:4-6.



