Número Atual: Novembro-Dezembro 2013 - Volume 1 - Número 6
Editorial
Asma sim, mortes por asma não!
Asthma yes, deaths for asthma no!
L. Karla Arruda, Elcio O. Vianna
DOI: 10.5935/2318-5015.20130043
MD, PhD. Faculdade de Medicina de Ribeirao Preto, Universidade de Sao Paulo (FMRP-USP), Ribeirao Preto, SP. Editora-Chefe do BJAI
Endereço para correspondência:
Luisa Karla Arruda
E-mail: karla@fmrp.usp.br
A cada ano, morrem entre 2.000 a 3.000 pacientes por crise de asma no Brasil, e há razões para se acreditar que pelo menos algumas dessas mortes poderiam ser evitadas1. Há dados consistentes no Brasil e em outros lugares do mundo indicando que apenas 5% dos pacientes apresentam forma grave da doença, com sintomas persistentes apesar de tratamento adequado por médicos especialistas, de acordo com guidelines atuais2,3. Portanto, 95% dos pacientes podem ser tratados de forma efetiva com os medicamentos disponíveis para asma, com controle dos sintomas incluindo diminuição da frequência e intensidade das exacerbações agudas graves, que podem levar ao óbito por insuficiência respiratória. Porque então pessoas ainda morrem por crise de asma?
Fernandes e cols. examinaram em estudo caso-controle os fatores de risco para mortes por asma entre pacientes participantes do Programa para o Controle da Asma na Bahia (ProAR), no período de 2002 a 20104. Parâmetros demográficos, clínicos, espirométricos e socioeconômicos foram comparados entre grupo de 58 pacientes asmáticos graves que foram a óbito e que tinham dados disponíveis (dentre os 62 óbitos identificados no período de 8 anos de análise) e grupo de 232 controles vivos com asma grave participantes do ProAR. Os óbitos, na sua maioria, foram atribuídos a causas respiratórias, seguidas de causas cardiovasculares, e ocorreram dentro de uma Unidade de Saúde. Os resultados revelaram que gênero masculino, VEF1 pré-broncodilatador < 60% do previsto e asma não controlada no último ano foram os fatores de risco significantemente e independentemente associados à mortalidade nesse grupo de asmáticos graves4. Em estudo realizado nos Estados Unidos, pacientes adultos com asma e concomitante limitação ao fluxo aéreo, definida por VEF1/CVF < 70%, tiveram um risco aumentado de morrer de 114% durante seguimento de aproximadamente 40 anos, quando comparados a pacientes sem asma e sem limitação ao fluxo aéreo (harzard ratio ajustada 2.14; 95% IC 1.64-2.79)5. Goeman e cols. estudaram causas de morte por asma na Austrália entre 2005 e 2009, e identificaram 283 casos com idade menor ou igual a 70 anos. Fatores de risco associados a morte por asma incluíram: barreiras físicas (localização rural ou remota, institucionalização), aspectos psicossociais (desajuste social, doença mental, viver sozinho, estar desempregado), tabagismo, dependência de álcool e drogas, alergias, infecções do trato respiratório, tratamento inadequado e retardo em procurar ajuda6. Um estudo prospectivo de 25 anos de duração realizado na Dinamarca, em uma coorte de adultos com asma bem caracterizada, mostrou maior mortalidade entre asmáticos quando comparados a controles pareados, explicada principalmente por status asthmaticus e doença pulmonar obstrutiva. Pacientes que morreram de asma ou doença pulmonar obstrutiva eram mais velhos, tinham maior duração da asma, nível mais baixo de VEF1 e de VEF1/CVF, maior grau de reversibilidade com broncodilatador e contagem de eosinófilos em sangue periférico mais alta7. Embora fatores de risco para morte por asma sejam variáveis entre diferentes populações, destacam-se a limitação ao fluxo aéreo, a falta de controle dos sintomas e o tratamento inadequado. Em nosso meio, Araujo e cols. relataram que a falta de adesão à medicação prescrita foi o fator mais importante em pacientes com asma de difícil controle, identificado em 68% dos casos8. Carvalho-Pinto e cols., estudando grupo de 128 adultos asmáticos graves não controlados atendidos no Hospital das Clínicas da Faculdade de Medicina de São Paulo, observaram que pacientes com limitação persistente ao fluxo aéreo, definida por FEV1 ou FEV1/FVC < 75% do valor predito, após broncodilatador, apresentaram maior frequência de crises graves com admissão em UTI (56%). Uma observação importante foi a elevada frequência de eosinofilia em escarro induzido presente no grupo de pacientes com asma grave, independente de terem fenótipo alérgico ou não alérgico, indicando persistência da inflamação a despeito de tratamento apropriado com altas doses de corticosteroide inalatório2.
Quais seriam os mecanismos fisiopatológicos subjacentes em pacientes com asma grave de difícil controle? Em nosso meio, o grupo da Prof. Thais Mauad e colaboradores incluindo Profs. Rafael Stelmach, Alberto Cukier e Paulo Saldiva, da Faculdade de Medicina da USP, tem realizado estudos que revelaram o papel importante do músculo liso das vias aéreas (airway smooth muscle, ASM) na fisiopatologia da asma, sendo um potencial alvo para intervenção terapêutica9. A patologia das vias aéreas em amostras post-mortem de pacientes com asma revelou variabilidade na distribuição do remodelamento na camada de músculo liso. Pacientes puderam ser caracterizados em grupos com remodelamento de músculo liso apenas em vias aéreas de grande calibre, em vias aéreas de grande e pequeno calibre, e mais raramente apenas em vias aéreas de pequeno calibre. Aumento da espessura da camada de músculo liso foi associado com remodelamento de vias aéreas e eosinofilia, mas não com neutrofilia. Análise do perfil de transcriptoma do músculo liso das vias aéreas revelou que pacientes com asma puderam ser distinguidos de indivíduos controle atópicos e não atópicos por um perfil de expressão de genes específicos, que está associado à hiperresponsividade brônquica10. De forma interessante, Yuck e cols. mostraram que o tratamento com corticosteroide oral (prednisolona por 14 dias), em paralelo ao seu efeito anti-inflamatório, teve efeito em alterar a expressão de genes no músculo liso das vias aéreas, em pacientes com asma atópica submetidos a biópsia endobrônquica. Alteração no transcriptoma da camada de músculo liso da parede das vias aéreas de pacientes com asma mostrou correlação com melhora da hiperresponsividade brônquica (aumento de PC20)11. Avançando ainda no conhecimento da patogênese da asma grave, um estudo recente do grupo da Prof. Thais Mauad revelou pela primeira vez a presença de eosinófilos em linfonodos broncoalveolares de pacientes que morreram por crise aguda de asma, além do número aumentado destas células nas vias aéreas12. Nenhuma outra célula teve expressão diferencial em linfonodos. As grandes vias aéreas de pacientes com crise de asma fatal tiveram expressão aumentada de eosinófilos em todas as suas camadas, e expressão aumentada de células dendríticas positivas para Fator XIIIa, células T CD4+ e CD8+, células B CD20+, e células CD23+, sem correspondente expressão aumentada em linfonodos broncoalveolares. Além disso, foi mostrado que eosinófilos de ambos os sítios expressaram HLA-DR e moléculas co-estimulatórias CD40 e CD80, sugerindo fortemente que eosinófilos podem funcionar como células apresentadoras de antígeno a células T em exacerbações grave de asma que levaram à morte12. Em conjunto, estas observações indicam papel importante da eosinofilia e do espessamento da camada de músculo liso em toda a extensão da árvore brônquica na asma grave e na asma fatal.
O que pode ser feito para diminuir o número de mortes por asma? Estudo recente avaliou hospitalizações e mortalidade por asma na Costa Rica, país em que a prevalência de asma e chiado no último ano está entre as mais elevadas do mundo (até 32% a 38% em crianças e adolescentes), durante período de 15 anos, de 1997-2000 a 201113. A redução marcante de hospitalizações (em 53%) e de mortes (em 80%) por asma neste período foi associada a esforços nacionais em recomendar e facilitar o uso de corticosteroides inalatórios para asma persistente. Na Costa Rica, há cobertura universal de saúde desde a década de 40, e os medicamentos beclometasona (sem restrições para prescrição), e montelucaste e formoterol (prescrição restrita a alergistas e pneumologistas), são aprovados para o tratamento da asma pelo sistema nacional de saúde. A implantação de um Programa Nacional de Asma em 2003 (NAP) foi particularmente responsável por queda marcante de hospitalizações em adultos maiores de 20 anos, e de mortes em adultos maiores de 35 anos, sendo atribuída ao uso de corticosteroide inalatório. Este programa enfatiza o diagnóstico precoce e pronto uso de corticosteroides inalatórios, que passaram a ter permissão para prescrição por médicos não especialistas; uso de precoce de medicações de alívio (salbutamol); encaminhamento apropriado para especialistas em asma quando necessário; e controle da exposição aos alérgenos mais comuns e à fumaça de cigarro. A redução das hospitalizações e mortes por asma teve paralelo com aumento nas prescrições de beclometasona no período (aumento de 129%). Uma das conclusões deste relevante trabalho, um dos poucos desta natureza realizados em país da América Latina, foi que o acesso universal à saúde, juntamente com a implementação de programas nacionais que promovam e facilitem o uso de corticosteroide inalatório para asma persistente, poderia beneficiar economicamente de forma marcante países em desenvolvimento onde a asma é um importante problema de saúde13. No Brasil, tornaram-se disponíveis nas Farmácias Populares desde junho de 2012 os medicamentos para asma beclometasona, salbutamol e brometo de ipratrópio para uso inalatório, que podem ser obtidos sem nenhum custo mediante prescrição médica. Associação budesonida e formoterol está também disponível livre de custos para pacientes com asma via Componente Especializado de Assistência Farmacêutica. Entretanto, não há um programa nacional de asma em nosso país. Temos iniciativas locais de programas bem sucedidos de controle da asma no Brasil, destacando-se o ProAR na Bahia, o Projeto FOCA (Foco no Controle da Asma, projeto com financiamento PPSUS em Ribeirão Preto, SP) (Figuras 1 e 2), o Respira Rio (Rio de Janeiro), o Programa de Controle de Asma de Vitória, ES, e o Programa de Atendimento ao Paciente Asmático do Distrito Federal.

Figura 1 - Logotipo do projeto FOCA "Foco no Controle da Asma", projeto desenvolvido por equipe da Faculdade de Medicina de Ribeirão Preto, USP, coordenada pela Prof. Dra. Karla Arruda, em conjunto com a Secretaria de Saúde da Prefeitura Municipal de Ribeirão Preto, desde 2010. A foca é um animal de clima frio assim como o pinguim, que é símbolo de Ribeirão Preto pelo tradicional Chopp do Pinguim produzido na cidade. Ao fundo, desenho esquemático do Theatro Pedro II, ícone cultural da cidade. O estetoscópio representa a importância da ausculta pulmonar no diagnóstico e manejo de pacientes com asma
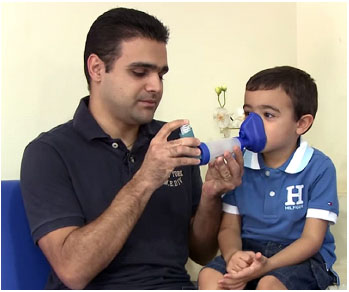
Figura 2 - O Projeto FOCA inclui a capacitação de médicos não especialistas e de outros profissionais de saúde da rede pública de Ribeirão Preto para o diagnóstico e tratamento da asma em crianças, adolescentes e adultos. Ênfase é dada no uso de beclometasona para pacientes com asma persistente, uso de medicação de resgate (salbutamol inalatório) aos primeiros sinais de crise aguda de asma, e uso correto dos dispositivos inalatórios, com especial atenção aos espaçadores valvulados, fornecidos inicialmente pelo projeto e em seguida disponibilizados para as Unidades Básicas de Saúde pela Prefeitura Municipal de Ribeirão Preto. Como parte das atividades do projeto FOCA, foi preparado vídeo educativo sobre asma que está disponível no YouTube. O vídeo completo, intitulado "Asma Sim, Crises Não" tem a duração de aproximadamente 50 minutos, e vídeos parciais mais curtos com tópicos específicos estão também disponíveis, nos links abaixo:
Asma Sim, Crises Não: http://youtu.be/tGFocMnigII
Asma e Projeto FOCA: http://youtu.be/Ur7TxiZGN8c
Tratamento da Asma: http://youtu.be/tNnjvOXBplg
Asma, Dispositivos Inalatórios e Espirometria: http://youtu.be/-QKa5YOyU5g
Asma, Gestação e Ambiente: http://youtu.be/dW2Td0HRp_M
Um dos mais importantes debates sobre o impacto do tratamento na mortalidade por asma diz respeito ao uso contínuo de broncodilatadores beta-2 adrenérgicos inalatórios14. Este debate persiste por mais de 50 anos, e até atualmente não há consenso de que se possa afastar de forma definitiva um risco maior de morte por asma em pacientes em uso contínuo de beta-2 agonistas inalados, incluindo os de ação prolongada (Long Acting Beta 2 Agonists, LABAs)15. Os LABAs salmeterol e formoterol foram introduzidos na prática clínica há mais de 20 anos. Vários estudos documentaram que, em paciente com controle subótimo da asma, a adição de um LABA ao corticosteroide inalatório traz mais benefício que dobrar a dose do corticosteroide inalado, e consensos atuais recomendam a adição de LABA para pacientes não controlados com dose moderada de corticosteroide inalado16. Além disso, tem sido demonstrado que o controle da asma é mais provável de deteriorar com a suspensão da terapia com LABA. Entretanto, aspectos relacionados à segurança do uso contínuo dos LABAs têm sido apontados. Nos anos 60, um pico de mortes por asma na Inglaterra e Pais de Gales foi epidemiologicamente associado a vendas do beta agonista não seletivo de ação ultrarrápida isoprenalina. Na década de 80, um pico de mortes por asma na Nova Zelândia foi associado a vendas de fenoterol, confirmado por estudos caso-controle, o que levou à retirada do mercado deste beta-2 agonista de ação rápida em vários países, incluindo Estados Unidos, Canadá, Austrália e Nova Zelândia. Análise subsequente identificou efeito dose-dependente dos beta-2 agonistas de ação rápida na mortalidade por asma. Nos anos 2000, mortalidade aumentada por asma foi encontrada no grupo que usou salmeterol no Salmeterol Multicenter Asthma Research Trial (estudo SMART). A maior preocupação com o uso de beta-2 agonistas inalatórios se deve ao fato de serem excelente medicação para alívio dos sintomas, podendo levar ao sub-reconhecimento da gravidade da asma e consequente subtratamento (por potencial mascaramento da inflamação). Além disso, beta-2 agonistas inalados inibem a resposta imediata a alérgenos, mas não a resposta asmática tardia que ocorre 3 a 8 horas após a exposição, e que está associada a hiperresponsividade e inflamação das vias aéreas. Consequentemente, ao inibir os sintomas imediatos à exposição, estes fármacos poderiam permitir uma exposição não protegida maior a alérgenos, com aumento das sequelas tardias. Um terceiro ponto diz respeito ao desenvolvimento de tolerância aos efeitos benéficos, e ao aumento da responsividade de vias aéreas a alérgenos, efeitos documentados com o uso contínuo de beta-2 agonistas de ação rápida e também LABAs. Apesar de todos esses aspectos, o uso de LABA acompanhado de forma mandatória a corticosteroide inalatório se mostrou repetidamente eficaz e seguro14. No entanto, o Food and Drug Administration (FDA) nos Estados Unidos requisitou que os fabricantes de LABAs conduzissem cinco estudos clínicos amplos, randomizados, de não inferioridade, para investigar a segurança de LABA em associação a corticosteroides inalatórios. Estes estudos, envolvendo um total de mais de 45.000 pacientes com asma, estão em andamento, com previsão de resultados em 201715,17. Um dos aspectos que tem recebido atenção especial é a possibilidade de que alterações genéticas no receptor beta-2 adrenérgico (codificado pelo gene ADRB2) estejam associadas a respostas variáveis ao uso de LABA, incluindo desfechos desfavoráveis como crises graves e morte por asma18. Não há evidência de que polimorfismo mais conhecido do ADRB2, Gly16Arg, seja responsável para os eventos raros de risco à vida com o uso de LABA. Entretanto, em estudo recente de Ortega e cols. a análise genética em pacientes de múltiplas etnias revelou que as variantes raras de ADRB2 Ile164 e -376ins (uma inserção de 25 pares de base na região promotora do gene) estiveram associadas a aumento de internações hospitalares por asma, aumento de exacerbações necessitando visitas urgentes a serviço médico, uso mais frequente de corticosteroide oral, e sintomas persistentes não controlados, em pacientes de raça branca não-hispânicos e em afro-americanos, em uso crônico de LABAs19. Até que a segurança do uso dos LABAs seja plenamente estabelecida, algumas recomendações para uso seguro destes medicamentos têm sido propostas: (1) monoterapia com LABA não deve ser usada na asma; (2) LABA só deve ser usado em combinação com corticosteroide e sob a forma de um único inalador, para prevenir que o LABA possa ser usado isoladamente se forem prescritos inaladores separados; (3) LABA ou produtos combinados contendo LABA não são indicados como terapia inicial; (4) tentativas de usar LABAs para diminuir a dose de corticosteroide inalatório devem ser idealmente monitorizadas com medidas diretas de inflamação de vias aéreas, como eosinófilos no escarro; (5) em pacientes com controle da asma bem estabelecido, pode ser tentada a redução de LABA de forma cuidadosamente monitorizada14. Estas recomendações devem ser estendidas aos ultra-LABAs indacaterol e vilanterol, dado o número ainda pequeno de estudos clínicos e experiência de "vida real" limitada com estes fármacos14.
A despeito de tratamento adequado, vão persistir pacientes com asma grave, de difícil controle, constituindo um desafio na prática clínica. Estes pacientes apresentam maior risco de exacerbações graves que podem levar a óbito, pela limitação ao fluxo aéreo subjacente, que é característica da maior parte desse subgrupo de asmáticos2. Análise sistemática da literatura, consensos internacionais atuais, e revisões recentes apontam para o anticorpo monoclonal humanizado anti-IgE omalizumabe como uma terapia eficaz e segura para pacientes com asma que não apresentam controle dos seus sintomas com doses elevadas de corticosteroides inalatórios associadas a beta-agonistas de ação prolongada, em seguimento clínico por médio especialista por pelo menos 3 meses, tendo sido investigadas e tratadas quando possível comorbidades associadas a asma, e tendo sido exaustivamente confirmada a adesão ao tratamento e técnica adequada de uso das medicações particularmente as inalatórias16,20,21. O omalizumabe tem um efeito marcante e consistente em diminuir exacerbações graves de asma que requerem internação e intubação endotraqueal, e em reduzir as exacerbações por asma causadas por infecções respiratórias de vias aéreas, mais comumente causadas por rhinovirus, que constituem uma das causas mais frequentes de exacerbações de asma22.
Infelizmente, o omalizumabe ainda não foi incorporado ao painel de medicamentos de alto custo fornecido pelo nosso Sistema Único de Saúde (SUS). Portaria recente, que pode ser consultada no site http://bvsms.saude.gov.br/bvs/saudelegis/sas/2014/prt0603_21_07_2014.html, ressalta que o omalizumabe foi avaliado e não aprovado pela Comissão Nacional de Tecnologias do SUS (CONITEC). Examinando o Relatório de Recomendação CONITEC número 25 (http://portalsaude.saude.gov.br/images/pdf/2014/janeiro/28/Omalizumabe-Asma-final.pdf) e a Portaria número 603, podem ser identificados elementos importantes que merecem discussão. Em primeiro lugar, a Portaria faz menção à revisão sistemática recente da Cochrane por Normansell e cols.23 de 25 ensaios clínicos envolvendo 6.382 pacientes com asma, que concluiu que o omalizumabe não apresentou efeitos significativos na redução das exacerbações de asma nos pacientes com asma grave, incluindo aqueles que necessitavam de terapia com corticosteroide oral. Entretanto, nesta metanálise foram incluídos três estudos realizados em pacientes com asma leve (Boulet 1997, 10 pacientes, estudo de tolerância e segurança; Prieto 2006, asma leve a moderada; van Resen 2009, asma leve persistente) e três estudos conduzidos em pacientes com asma não alérgica (Garcia 2012; NCT01007149; e Gevaert 2012, 16 participantes com asma alérgica e não alérgica, resumo apresentado em conferência, não publicado)23. A inclusão desses estudos com número pequeno de pacientes, e/ou em situações que não está indicado o omalizumabe, pode ter alterado o poder da análise em identificar a eficácia do omalizumabe. Suporte para esta hipótese é dado pelos resultados da análise sistemática de Rodrigo et cols.20, que incluiu 8 estudos cuidadosamente selecionados, envolvendo 3.429 participantes (mínimo de 246 pacientes por estudo), que mostrou eficácia do omalizumabe em possibilitar diminuição das doses ou suspensão completa de corticosteroides, e em prevenir exacerbações por asma em crianças, adolescentes e adultos com asma alérgica moderada a grave. A metanálise de Rodrigo e cols.20 formou a base para recomendação de omalizumabe com evidência A para tratamento de pacientes com asma moderada a grave sem controle dos sintomas apesar do uso de altas doses de corticosteroide inalatório associadas a beta-agonista de ação prolongada, com técnica correta, e boa adesão ao tratamento (não controlados no Step 4 de tratamento), pelo documento da Global Innitiative for Asthma GINA update 2014, Revisão da Estratégia Global para o Manejo e Prevenção da Asma 201416. Vale ressaltar que os médicos brasileiros Drs. Álvaro Cruz (GINA Board of Directors) e Emílio Pizzichini (GINA Scientific Committee) participaram da elaboração deste consenso. Outro argumento apresentado pela Portaria 603 é que o omalizumabe ainda não foi comparado com outros medicamentos utilizados para a asma, como os antagonistas de leucotrieno ou os corticosteroides orais23. Antagonistas do leucotrieno são comprovadamente terapia menos eficaz que corticosteroides inalatorios na asma16, portanto não faria sentido comparar omalizumabe com antileucotrienos. Corticosteroides orais podem ser eficazes em adultos com asma grave (evidência D), mas são frequentemente associados a efeitos adversos substanciais16. Neste sentido, o perfil de segurança do omalizumabe é muito superior ao dos corticosteroides orais. A frequência de anafilaxia com omalizumabe é extremamente rara, e se ocorrer poderá ser prontamente tratada em ambiente com supervisão médica21. Por outro lado, uma das razões para o insucesso da incorporação do omalizumabe pela CONITEC pode se dever ao fato de que a empresa fabricante do omalizumabe (Novartis) solicitou o medicamento para o "tratamento da asma alérgica grave não controlada, em esquema aditivo a corticosteroide oral, em pacientes acima de 6 anos", embora o mesmo seja indicado em bula para o tratamento de adultos e crianças (acima de 6 anos de idade) com asma alérgica persistente moderada a grave cujos sintomas são inadequadamente controlados com corticosteroides inalatórios, ao submeter o pedido de incorporação. O número de estudos envolvendo pacientes com asma em uso contínuo de corticosteroide oral é limitado. Por outro lado, pacientes com asma moderada a grave não controlada usam com frequência corticosteroide oral ou EV em exacerbações, além de altas doses de corticosteroides inalatórios, o que pode também trazer efeitos adversos graves. Reduzindo as exacerbações graves, em que há necessidade de corticosteroide sistêmico, há indiretamente benefício sobre os efeitos adversos dos corticosteroides.
A incorporação do omalizumabe ao SUS provavelmente não trará sobrecarga excessiva ao sistema público de saúde, uma vez que apenas 5% dos pacientes asmáticos preencherão os critérios de indicação da medicação, e possivelmente diminuirá custos com atendimentos em serviços de emergência e internações hospitalares, além de levar à melhora marcante da qualidade de vida deste subgrupo de pacientes com asma, como tem sido comprovado em outros países do mundo24,25. Além disso, estudos recentes têm documentado a eficácia de outras terapias bloqueadoras da resposta imunológica na asma, notadamente em pacientes com asma não controlada e eosinofilia persistente, apesar da terapia com doses elevadas de corticosteroides. Esses medicamentos incluem mepolizumabe e benralizumabe (anti-IL-5), dupilumabe (anti IL-4 e IL-10), e anti-TSLP (citocina produzida por células de epitélio brônquico que induz resposta Th2), e deve-se considerar que serão incorporados ao uso clínico nos próximos anos26-30.
No presente número do BJAI há dois artigos que abordam aspectos relevantes da asma. Reis e Cruz31, em artigo de revisão, destacam o papel importante das pequenas vias aéreas na asma, ressaltando avanços na investigação da anatomia e função deste segmento das vias aéreas, bem como de métodos para avaliar inflamação nas pequenas vias aéreas31. De interesse prático é a discussão sobre o papel de partículas de menor tamanho em atingir de forma mais eficiente as vias aéreas de pequeno calibre. Em particular, o impacto de partículas menores geradas pelo propelente HFA versus partículas maiores geradas por CFC ou por dispositivos de inalação de pó seco é discutido, particularmente em relação aos corticosteroides inalatórios, na melhora da eficácia do tratamento da asma. O artigo original de Silva e cols.32 avaliou mortes por asma no município do Rio de Janeiro no período de 2000 a 2009, e revelou que a análise sob o enfoque da causa múltipla de morte levou a aumento de 51,2% na magnitude da mortalidade por asma, em relação à causa básica32. A mortalidade por asma foi subestimada quando considerada apenas como causa básica. Além disso, o estudo mostrou tendência ao declínio nas taxas de mortalidade, segundo causas básicas e múltiplas, com queda entre os homens e estabilidade entre as mulheres. As razões pelas quais diferenças de gênero tiveram impacto na diminuição da mortalidade por asma merecem ser mais bem investigadas.
REFERENCIAS
1. Fernandes AG, Souza-Machado C, Souza-Machado A, Cruz AA. Fatores de risco para morte por asma. Braz J Allergy Immunol. 2013;1(3):143-8.
2. Carvalho-Pinto RM, Cukier A, Angelini L, Antonangelo L, Mauad T, Dolhnikoff M, et al. Clinical characteristics and possible phenotypes of an adult severe asthma population. Respir Med. 2012;106(1):47-56.
3. Chung KF, Wenzel SE, European Respiratory Society/American Thoracic Society Severe Asthma International Guidelines Task Force. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014;43:343-73.
4. Fernandes AG, Souza-Machado C, Coelho RC, Franco PA, Esquivel RM, Souza-Machado A, Cruz AA. Risk factors for death in patients with severe asthma. J Bras Pneumol. 2014;40(4):364-72.
5. Huang S, Vasquez MM, Halonen M, Martinez FD, Guerra S. Asthma, airflow limitation and mortality risk in the general population. Eur Respir J. 2014 Oct 16. pii: erj01085-2014.
6. Goeman DP, Abramson MJ, McCarthy EA, Zubrinich CM, Douglass JA. Asthma mortality in Australia in the 21st century: a case series analysis. BMJ Open. 2013;3(5).pii:e002539.
7. Ali Z, Dirks CG, Ulrik CS. Long-term mortality among adults with asthma: a 25-year follow-up of 1,075 outpatients with asthma. Chest. 2013;143(6):1649-55.
8. Araujo AC, Ferraz E, Borges Mde C, Filho JT, Vianna EO. Investigation of factors associated with difficult-to-control asthma. J Bras Pneumol. 2007;33(5):495-501.
9. Elliot JG, Jones RL, Abramson MJ, Green FH, Mauad T, McKay KO, et al. Distribution of airway smooth muscle remodelling in asthma: Relation to airway inflammation. Respirology. 2014 Sep 26. doi: 10.1111/resp.12384.
10. Yick CY, Zwinderman AH, Kunst PW, Grünberg K, Mauad T, Chowdhury S, et al. Gene expression profiling of laser microdissected airway smooth muscle tissue in asthma and atopy. Allergy. 2014;69(9):1233-40.
11. Yick CY, Zwinderman AH, Kunst PW, Grünberg K, Mauad T, Fluiter K, et al. Glucocorticoid-induced changes in gene expression of airway smooth muscle in patients with asthma. Am J Respir Crit Care Med. 2013;187(10):1076-84.
12. Cagnoni EF, Ferreira DS, Ferraz da Silva LF, Nicoletti Carvalho Petry AL, Gomes Dos Santos AB, Rodrigues Medeiros MC, et al. Bronchopulmonary lymph nodes and large airway cell trafficking in patients with fatal asthma. J Allergy Clin Immunol. 2014 Sep 24. pii: S0091-6749(14)01194-4.
13. Soto-Martínez M, Avila L, Soto N, Chaves A, Celedón JC, Soto-Quiros ME. Trends in hospitalizations and mortality from asthma in Costa Rica over a 12- to 15-year period. J Allergy Clin Immunol Pract. 2014;2(1):85-90.
14. Cockcroft DW and Sears MR. Are inhaled longacting β2 agonists detrimental to asthma? Lancet Respir Med. 2013;1(4):339-46.
15. Cates CJ, Wieland LS, Oleszczuk M, Kew KM. Safety of regular formoterol or salmeterol in adults with asthma: an overview of Cochrane reviews. Cochrane Database Syst Rev. 2014 Feb 6;2:CD010314.
16. Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma, (GINA) Updated 2014. Disponível em: www.ginasthma.org.
17. Suissa S, Ariel A. US Food and Drug Administration-mandated trials of long-acting β-agonists safety in asthma: will we know the answer? Chest. 2013;143(5):1208-13.
18. Burchard EG. Medical research: Missing patients. Nature. 2014;513(7518):301-2.
19. Ortega VE, Hawkins GA, Moore WC, Hastie AT, Ampleford EJ, Busse WW, et al. Effect of rare variants in ADRB2 on risk of severe exacerbations and symptom control during longacting β agonist treatment in a multiethnic asthma population: a genetic study. Lancet Respir Med. 2014;2(3):204-13.
20. Rodrigo GJ, Neffen H, Castro-Rodriguez JA. Efficacy and Safety of Subcutaneous Omalizumab vs Placebo as Add-on Therapy to Corticosteroids for Children and Adults With Asthma. A Systematic Review. Chest. 2011;139(1):28-35.
21. Humbert M, Busse W, Hanania NA, Lowe PJ, Canvin J, Erpenbeck VJ, et al. Omalizumab in asthma: an update on recent developments. J Allergy Clin Immunol Pract. 2014;2(5):525-36.
22. Busse WW, Morgan WJ, Gergen PJ, Mitchell HE, Gern JE, Liu AH, et al. Randomized trial of omalizumab (anti-IgE) for asthma in inner-city children. N Engl J Med. 2011;364(11):1005-15.
23. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014 Jan 13;1:CD003559.
24. Norman G, Faria R, Paton F, Llewellyn A, Fox D, Palmer S, et al. Omalizumab for the treatment of severe persistent allergic asthma: a systematic review and economic evaluation. Health Technol Assess 2013;17(52).
25. Dewilde S, Turk F, Tambour M, Sandström T. The economic value of anti-IgE in severe persistent, IgE-mediated (allergic) asthma patients: adaptation of INNOVATE to Sweden. Curr Med Res Opin. 2006;22(9):1765-76.
26. Bel EH, Wenzel SE, Thompson PJ, Prazma CM, Keene ON, Yancey SW, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014;371(13):1189-97.
27. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371(13):1198-207.
28. Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013;368(26):2455-66.
29. Gauvreau GM, O'Byrne PM, Boulet LP, Wang Y, Cockcroft D, Bigler J, et al. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014;370(22):2102-10.
30. Castro M, Wenzel SE, Bleecker ER, Pizzichini E, Kuna P, Busse WW, Gossage DL, Ward CK, Wu Y, Wang B, Khatry DB, van der Merwe R, Kolbeck R, Molfino NA, Raible DG. Benralizumab, an anti-interleukin 5 receptor α monoclonal antibody, versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomised dose-ranging study. Lancet Respir Med. 2014 Oct 8. pii: S2213-2600(14)70201-2.
31. Reis AP, Cruz AA. Doença das pequenas vias aéreas na asma: revisão. Braz J Allergy Immunol. 2013;1(6):313-8.
32. Silva EM, Silva GA, Rubini NPM, Sá CAM. Mortalidade por asma em adultos no município do Rio de Janeiro no período de 2000 a 2009: análise de causas múltiplas. Braz J Allergy Immunol. 2013;1(6):319-27.



