Número Atual: Maio-Junho 2013 - Volume 1 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Avaliação da densidade mineral óssea em crianças com dermatite atópica moderada ou grave
Bone mineral density in children with moderate or severe atopic dermatitis
Ariana C. Yang1; Vanessa R.A. Penterich1; Rosa M.R. Pereira2; Liliam Takayama3; Marise Lazaretti-Castro4; Jorge Kalil1; Fábio F.M. Castro1
DOI: 10.5935/2318-5015.20130016
1. MD, PhD. Disciplina de Alergia e Imunologia, Faculdade de Medicina da Universidade de Sao Paulo (FMUSP), Sao Paulo, SP
2. MD, PhD. Disciplina de Reumatologia, FMUSP, Sao Paulo, SP
3. BSc. Disciplina de Reumatologia, FMUSP, Sao Paulo, SP
4. MD, PhD. Departamento de Endocrinologia, Universidade Federal de Sao Paulo (UNIFESP), Sao Paulo, SP
Endereço para correspondência:
Ariana C. Yang
E-mail: arianacy@usp.br
Submetido em 13.12.2012.
Aceito em 14.11.2013.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
Fontes de financiamento: Instituto de Investigaçao do Milênio em Imunologia/iii-INCT; Coordenaçao Aperfeiçoamento de Pessoal de Nível Superior (CAPES); Conselho Nacional de Ciência e Tecnologia (CNPq).
RESUMO
OBJETIVO: Determinar o impacto da Dermatite Atópica (DA) no estado nutricional e metabolismo ósseo em crianças.
MÉTODOS: Quarenta e nove crianças com DA moderada ou grave (4-12 anos) e 48 crianças saudáveis foram avaliadas por z-escore altura/idade, z-escore peso/idade, z-escore IMC, duraçao e gravidade da doença, uso de Glicocorticoides (GC) tópico e parâmetros ósseos. Conteúdo mineral ósseo (CMO), densidade mineral óssea (DMO) e z-escores foram medidos por absormetria de dupla emissao de raios-X (DXA). Níveis séricos de cálcio, fósforo, fosfatase alcalina, cortisol e telopeptídeo carboxiterminal do colágeno tipo 1 (CTX), e níveis plasmáticos de 25 hidroxivitamina D (25OHD) e hormônio da paratireoide (PTH), foram determinados.
RESULTADOS: Crianças com DA apresentaram menor altura para idade quando comparadas às crianças controle (p = 0,007). Menor CMO em coluna lombar [16,5 (6,4) vs. 19,8 (8,3)g, p = 0,027] e fêmur total [12,2 (4,0) vs. 14,2 (5,0)g, p = 0,029] foi encontrado em crianças com DA. Níveis de CTX foram menores em pacientes com DA [1,36 (0,59) vs. 1,67 (0,79)ng/mL, p = 0,026] e tendência a níveis mais baixos de fosfatase alcalina foi observada em crianças com DA [228 (75,3) vs. 255 (70,7) ng/mL, p = 0,074]. Crianças com DA apresentaram níveis mais baixos de cortisol que crianças saudáveis [9,06 (4.8) 10,57 vs. (4,9), p = 0,061], sem diferença significante.
CONCLUSOES: Reduçao em altura para idade, remodelamento ósseo e conteúdo mineral ósseo em crianças com DA moderada ou grave poderia estar associada a fatores incluindo determinantes genéticos, baixa exposiçao solar, inflamaçao crônica e uso crônico do GC tópico.
Descritores: Dermatite atópica, densidade óssea, criança, estado nutricional, glicocorticoide.
INTRODUÇAO
A dermatite atópica (DA) é uma doença crônica da pele, de caráter inflamatório, caracterizada por episódios recorrentes de eczema, acompanhada de prurido, liquenificaçao, escoriaçao e crostas, evoluindo com períodos de exacerbaçao e remissao. Esta condiçao é comum na infância e resulta em morbidade significativa e comprometimento da qualidade de vida. A DA resulta de uma interaçao complexa entre falhas na funçao da barreira cutânea natural, alteraçoes imunológicas, predisposiçao genética, e agentes ambientais e infecciosos1,2. A prevalência de DA aumentou nos últimos 30 anos; estima-se que 10 a 20% das crianças e 1 a 3% dos adultos em países desenvolvidos sao afetados pela doença1.
O tratamento da DA visa diminuir o prurido, reparar a pele, tratar a infecçao e reduzir a inflamaçao. Assim, um manejo de sucesso depende de várias medicaçoes2. O uso de glicocorticoides tópicos (GC) representa a base do tratamento, controlando a inflamaçao, com efeitos imunossupressores e antiproliferativos. Existe uma grande gama de GC acessíveis aos pacientes, que variam de baixa (hidrocortisona) a alta potência (betametasona). Apesar de eficazes no controle da doença, os GC podem raramente apresentar efeitos adversos sistêmicos, incluindo retardo do crescimento em crianças, reduçao da densidade óssea e supressao do eixo hipotalâmico-pituitário-adrenal. Estes efeitos podem ocorrer em crianças que usam GC por longo período1,3.
A mineralizaçao óssea, com formaçao de novo tecido ósseo, ocorre principalmente na infância e em pré-púberes, e qualquer falha nesse processo pode levar a baixa massa óssea, e resultar em osteoporose ou outras alteraçoes ósseas futuras4. Vários fatores podem ser associados ao processo de desenvolvimento da osteoporose em doenças imuno-inflamatórias como o tempo, a gravidade da doença, imobilizaçao, atividade física, nutriçao e uso prolongado de GC5-7. Entretanto, ainda nao foi encontrada uma associaçao positiva entre o uso de GC tópico e o decréscimo na densidade mineral óssea (DMO) em crianças8-10.
A absormetria de dupla emissao de raios-X (DXA) é método preciso, rápido e de baixa radiaçao, e tem sido utilizada em diversos estudos da DMO e composiçao corporal em pacientes crônicos8,10-12. Alguns marcadores ósseos podem ser medidos no soro para ajudar a detectar o risco de baixa massa óssea em crianças. A fosfatase alcalina (FA) é uma enzima envolvida na regulaçao da mineralizaçao óssea, e está presente na membrana do osteoblasto13. Os marcadores de reabsorçao óssea sao produtos da degradaçao do colágeno tipo 1, principalmente peptídeos e pequenas moléculas que nao foram reutilizadas na síntese de novo colágeno. O mais utilizado na prática clínica é telopeptídeo carboxiterminal do colágeno tipo 1 (CTX)14,15.
Visto que doenças crônicas e uso prolongado de GC tendem a comprometer componentes da massa óssea, o objetivo deste estudo foi determinar o impacto da DA sobre o estado nutricional e o metabolismo ósseo em crianças, comparando crianças com DA moderada ou grave a grupo controle de crianças saudáveis.
SUJEITOS E MÉTODOS
Trata-se de um estudo observacional, com corte transversal, com desenho caso-controle. O estudo foi aprovado pelo conselho da ética de nossa Instituiçao. Termo de consentimento livre-esclarecido foi assinado por todos os participantes.
Pacientes
A amostra de pacientes foi selecionada por conveniência, durante o período de março de 2009 até julho de 2010. A seleçao dos participantes envolveu os seguintes critérios de inclusao: Dermatite Atópica (DA) diagnosticada pelos critérios de Hannifin & Hajka16; escore de gravidade da dermatite atópica (SCORAD) Index > 2.517; idade entre 4-12 anos; nao ter atingido a maturidade sexual, segundo os critérios de Tanner18; estar em uso contínuo de glicocorticoides tópicos (GC) por pelo menos um ano; e nao estar usando GC sistêmico. Quarenta e nove crianças com DA, entre 4 a 12 anos, preencheram todos os critérios e assinaram o Termo de Consentimento.
O grupo controle consistiu de 48 crianças saudáveis, recrutadas das famílias dos pacientes com DA (primos ou irmaos), a fim de minimizar as diferenças em alguns dos fatores de risco para osteoporose, como estilo de vida, nutriçao e fatores constitucionais e genéticos.
Causas secundárias de baixa massa óssea foram inicialmente descartadas em pacientes e controles, como a história clínica de má absorçao, insuficiência renal ou hepática, hipertireoidismo ou hipotireoidismo, tabagismo, uso de GC (por controles) e uso de drogas que causem supressao do metabolismo ósseo.
Coleta de dados
Todos os indivíduos foram entrevistados com a ajuda de seus pais através da utilizaçao de um questionário estruturado. Dados demográficos e antropométricos de pacientes e controles foram obtidos através de entrevista e exame físico, onde as variáveis coletadas foram: idade em anos, peso em quilogramas, altura em centímetros, estágio puberal de Tanner (mama, genitália masculina e pelos pubianos), uso tópico de GC, duraçao da doença, hábitos de exposiçao ao sol e escore de atividade física. O escore de atividade física foi avaliado por meio de questionário retrospectivo validado para a populaçao brasileira19.
Estado nutricional
Altura e peso foram medidos com a criança em posiçao ereta, sem sapatos. Crescimento e estado nutricional foram avaliados segundo os z-escores da Organizaçao Mundial de Saúde (OMS)20,21 de peso para idade, estatura para idade, e Indice de Massa Corporal (IMC). Um z-escore < -2 desvios padrao de peso para idade, estatura para a idade, ou IMC representa desnutriçao moderada a grave.
Densidade mineral óssea (DMO)
A DMO foi medida por absormetria de dupla emissao de raios-X (dual X-ray absorptiometry, DXA) utilizando equipamento Hologic (Hologic Inc. Bedford, MA, EUA, modelo Discoveryr) nas seguintes regioes: coluna lombar, fêmur total e corpo inteiro. A baixa DMO para a idade cronológica foi definida por um z-escore < -2 desvios padrao22. Os coeficientes de variaçao para DMO no Laboratório de Investigaçao Médica de Reumatologia da Faculdade de Medicina da Universidade de Sao Paulo, onde os exames foram realizados, foram de 0,7% para coluna lombar (L1-L4), 1,5% para colo do fêmur e 1,2% para o corpo todo.
Avaliaçao laboratorial
As amostras de sangue para análise foram coletadas antes das 10 horas da manha, com os sujeitos em jejum de 12 horas. Foram dosados os níveis séricos de cálcio, fósforo, fosfatase alcalina (FA) e cortisol, utilizando métodos padrao do Laboratório Central de Análises Clínicas da nossa Instituiçao.
O marcador de reabsorçao óssea telopeptídeo carboxiterminal de colágeno tipo 1 (CTX) foi dosado no soro, por ELISA (sistemas de diagnóstico, Serum Crosslaps CTX ELISA REF AC-02F1 Boldon, Reino Unido). O hormônio da paratireoide (PTH) foi dosado no plasma por ensaio imunoradiométrico (DIAsource, hPTH-120 min-IRMA KIP 1491 Nivelles, Bélgica). A dosagem de 25 hidroxivitamina D (25OHD) foi realizada no plasma por radioimunoensaio (DiaSorin, referência: 68100E, Stillwater, Minnesota, EUA). Deficiência de vitamina D foi definida como um nível sérico 25OHD menor que 20 ng/mL.
Análise estatística
Os dados com distribuiçao numérica e contínua foram apresentados em média e desvio padrao. Os dados categóricos foram apresentados por frequência absoluta (n) e relativa (%). A comparaçao entre os grupos foi feita pelo teste t para medidas independentes no caso das variáveis numéricas com distribuiçao normal. Para isso, os parâmetros foram testados quanto à normalidade dos dados pelo teste de Kolmogorov-Smirnov. Em casos em que o resultado do teste indicou que os dados nao tinham distribuiçao normal, foi aplicado o teste nao paramétrico de Mann-Whitney para a comparaçao dos grupos. O nível de significância foi considerado para valores de p < 0,05.
RESULTADOS
Características gerais da populaçao estudada
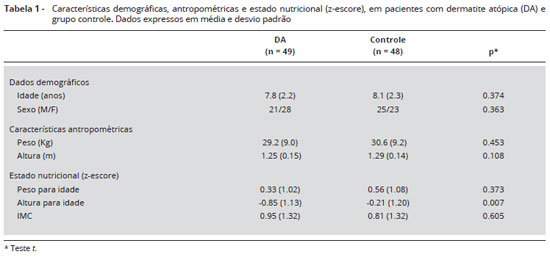
As características clínicas e antropométricas dos pacientes com DA e do grupo controle estao apresentadas na Tabela 1. A média de idade dos pacientes e controles foi de 7,8 (2,2) e 8,1 (2,3) anos, respectivamente (p = 0,374). A distribuiçao por sexo foi semelhante nos dois grupos (p = 0,363). O z-escore de altura para idade foi significantemente menor em crianças com DA quando comparadas às do grupo controle (p = 0,007). O z-escore do peso para idade e do IMC nao foi diferente entre os grupos (p = 0,373 e p = 0,605, respectivamente). Sobre o estágio de maturaçao sexual de Tanner, 100% dos pacientes com DA e indivíduos controle foram considerados pré-púberes (estágio 1 ou 2 para mama em meninas, genitália masculina e de pelos pubianos).
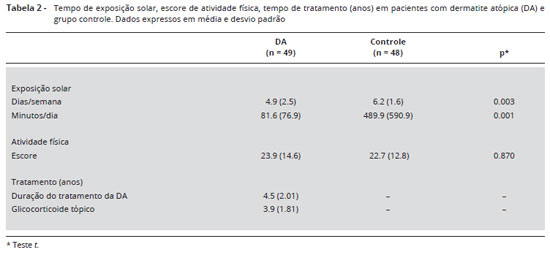
A Tabela 2 apresenta os resultados de exposiçao solar, atividade física e tempo de tratamento e de doença. O tempo de exposiçao solar foi menor em pacientes com DA do que no grupo controle, nos dois parâmetros analisados (p = 0,003 e p = 0,001). O escore de atividade física nao apresentou diferença significante entre os grupos (p = 0,870). A duraçao média da doença foi de 4,5 (2,01) anos, e o tempo de uso tópico de GC foi de 3,9 (1,81) anos. No momento da inclusao, os pacientes tinham doença de pele ativa, indicada por índice médio de SCORAD de 50,69 (18,07).
Densidade mineral óssea
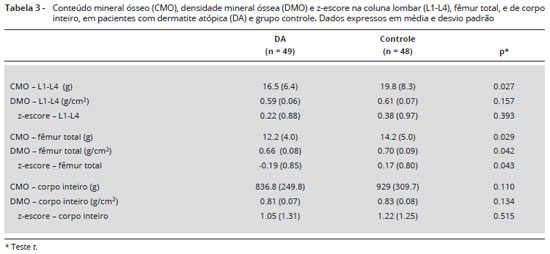
A Tabela 3 mostra que o conteúdo mineral ósseo (CMO) foi menor nos pacientes com DA em comparaçao ao grupo controle na coluna lombar [16,5 (6,4) vs. (19,8 (8,3) g, p = 0,027] e no fêmur total [12,2 (4,00 vs. 14,4 (5,0) g, p = 0,029]. Além disso, a densidade mineral óssea (DMO) no fêmur total (p = 0,042) e o z-escore (p = 0,043) foram inferiores em pacientes com DA em comparaçao ao grupo controle (Figuras 1 e 2).
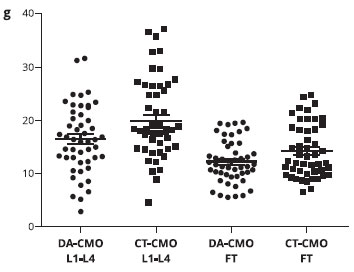
Figura 1 - Distribuiçao do conteúdo mineral ósseo (CMO) na coluna lombar (L1-L4) e no fêmur total em crianças com dermatite atópica (DA) e no grupo controle (CT)
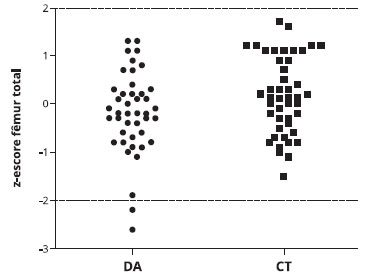
Figura 2 - Distribuiçao do z-escore do fêmur total em crianças com dermatite atópica (DA) e grupo controle (CT)
Como mostra a Figura 2, houve dois casos de pacientes com DA e z-escore < -2 para fêmur total, indicando baixa massa óssea. Um destes pacientes era do sexo feminino, com 10 anos de idade e índice SCORAD de 61, portanto classificado como DA grave. Estava em uso de GC tópico por pelo menos seis anos consecutivos, com uso intermitente mas frequente; nao usava qualquer GC sistêmico e relatava ter alergia alimentar a ovo. Apresentava um z-escore altura para a idade -1,24, com exposiçao ao sol por 30 minutos por dia. Os seus níveis séricos de cálcio (10,6 mg/dL) e 25O HD (31,5 ng/mL) foram considerados normais. O outro paciente era do sexo masculino, com 12 anos de idade, com DA moderada (SCORAD = 40). Usava GC tópico continuamente por pelo menos sete anos, sem uso de GC sistêmico, e nao apresentava alergia alimentar. Além do z-escore < -2 para fêmur total, este paciente também apresentou uma baixa massa óssea para a idade cronológica no corpo inteiro (z-escore = -2,2). Ele relatou expor-se ao sol em uma frequência alta, cerca de três horas por dia. Análise sanguínea revelou baixos níveis séricos de cálcio (7,6 mg/dL), 25O HD normal (28,8 ng/mL) e CTX igual a 1,55 ng/mL.
Parâmetros laboratoriais
Resultados dos parâmetros laboratoriais sao apresentados na Tabela 4. Os níveis séricos médios de cálcio, fósforo, PTH e 25OHD foram semelhantes entre pacientes com DA e crianças controle. Considerando a distribuiçao destes parâmetros, 6 (12,7%) crianças com DA apresentaram níveis de cálcio abaixo do normal esperado (9 mg/dL), e no grupo controle apenas 3 (7,5%) apresentavam níveis insuficientes. Uma das crianças com DA que apresentou o mais baixo nível de cálcio sérico (7,6 mg/dL) também foi considerada como tendo um baixo conteúdo de baixa massa óssea no fêmur total e no corpo inteiro.
Nos pacientes com DA a fosfatase alcalina tendeu a ser menor do que no grupo controle [228 (75,3) vs.255 (70,7) U/L, p = 0,074]. O marcador do metabolismo ósseo CTX foi significativamente mais baixo no grupo DA em relaçao ao controle [1,36 (0,59) vs. 1,67 (0,79) ng/mL, p = 0,026) (Tabela 4).
Ao considerar-se a média da dosagem de 25OHD, observou-se uma tendência a níveis séricos mais baixos nas crianças do grupo com DA em relaçao aos controles. A deficiência de 25OHD (< 20 ng/mL) foi encontrada em 19 dos 49 (38,8%) pacientes com DA, e em 11 das 48 (22,9%) crianças controle. Quando se considera a distribuiçao, foi encontrada uma diferença significante entre as crianças com DA e controles (p = 0,02). Quanto ao cortisol sérico, encontrou-se uma tendência a níveis mais baixos em pacientes com DA em comparaçao com controles [9,06 (4.8) 10,57 vs. (4,9) µg/dL, p = 0,061].
DISCUSSAO
Este estudo teve como objetivo determinar o estado nutricional, e estudar o metabolismo ósseo em crianças com DA moderada ou grave em comparaçao com crianças saudáveis. Características demográficas e antropométricas de ambos os grupos foram semelhantes, aumentando o poder da análise resultados.
O grupo de crianças com DA estudado mostrou um z-escore de altura para idade significativamente menor do que as crianças saudáveis, mas, em média, ainda dentro da faixa considerada normal na populaçao. No entanto, cinco crianças com DA apresentaram z-escore < -2 de altura para idade, e usavam em média GC tópico por 5,4 anos.
Existem poucos estudos avaliando o estado nutricional de crianças com dermatite atópica. O primeiro, realizado na Itália, com crianças menores de 4 anos de idade mostrou uma diferença significante no índice de altura para a idade, e crianças com DA foram menores quando comparadas com crianças saudáveis23. O segundo estudo foi realizado com 21 crianças, com idade média de 8,1 anos, com diagnóstico de DA moderada ou grave, mas nao foi encontrada nenhuma diferença significante no índice de altura para idade das crianças com DA em comparaçao ao grupo controle, mesmo quando relacionados com o uso de GC tópicos, sugerindo que o uso GC nao estava diretamente envolvido no crescimento destas crianças24.
A exposiçao ao sol e a atividade física podem afetar a síntese de vitamina D e a formaçao óssea25. No presente estudo, nao houve diferença no escore de atividade física entre crianças com DA e grupo controle. Considerando que o instrumento utilizado para avaliar a atividade física pode atingir uma pontuaçao máxima de 143 pontos, a mediana de 20 pontos encontrada nesta populaçao mostra que ambos os grupos praticavam pouca atividade física. O tempo de exposiçao ao sol teve uma diferença significante, sendo menor em pacientes com DA do que nos controles, sugerindo que as crianças com DA praticam menos atividades ao ar livre e isto poderia afetar a síntese de vitamina D e, portanto, a mineralizaçao óssea.
Embora existam poucos estudos sobre os efeitos adversos do uso prolongado de GC tópico, sabe-se que esta droga poderia influenciar o processo de remodelamento ósseo3,26. Na DA, GC tópicos sao a principal escolha para tratar as agudizaçoes do eczema. A quantidade de GC utilizado depende da frequência da exacerbaçao dos sintomas, e do número, extensao e gravidade das lesoes, bem como da potência do GC utilizado. Todos esses fatores podem influenciar os efeitos sistêmicos da droga. No presente estudo, foram incluídos os pacientes com doença moderada ou grave que faziam uso frequente de GC tópicos, e, portanto, estavam suscetíveis aos efeitos metabólicos do medicamento como a supressao do eixo hipotalâmico-pituitário-adrenal e sobre a massa óssea.
A coluna lombar tem o tipo de osso trabecular, enquanto o resto do corpo possui mais osso cortical. No presente estudo, encontrou-se menor conteúdo mineral ósseo na coluna lombar em crianças com DA. Este achado está de acordo com os estudos na literatura que analisaram a massa óssea de crianças com DA8,9. Os resultados de CMO, DMO e z-escore do fêmur total mostraram valores diminuídos nas crianças com DA em relaçao ao grupo controle, sugerindo que o osso cortical também pode ser afetado em doenças crônicas em que há necessidade de usar GC tópico por longo período3.
Embora os níveis séricos de cálcio nao tenham sido diferentes entre os grupos estudados, é interessante observar que as crianças com DA com os menores valores de cálcio sérico apresentaram também uma baixa massa óssea, sugerindo que a mensuraçao dos níveis séricos de cálcio poderia ser uma medida importante na prevençao primária de baixa massa óssea.
Os níveis séricos de 25OHD tenderam a ser menores nos pacientes com DA, e a frequência de crianças com deficiência de vitamina D foi maior no grupo DA. Este fato confirma o esperado, pois as crianças com DA apresentaram menor tempo de exposiçao solar.
Alguns autores apontam que estamos enfrentando uma deficiência de vitamina D endêmica, que afeta, por exemplo, 90% da populaçao no norte da Alemanha, onde há reduçao do tempo de luz solar durante o inverno27. Em nosso estudo, foi encontrado que, apesar de estarmos em um país tropical, os níveis séricos de 25OHD estavam em nível insuficiente em 38,8% dos pacientes com DA e em 22,9% dos controles, podendo esta diminuiçao da 25OHD estar associada às alteraçoes no metabolismo ósseo decorrentes da DA e seu tratamento.
O presente estudo demonstrou uma tendência a menor nível sérico de fosfatase alcalina (FA), que é marcador de formaçao óssea, e valores significantemente reduzidos do marcador de reabsorçao óssea CTX, sugerindo uma diminuiçao do remodelamento ósseo em crianças com DA. Nossos resultados sugerem a possibilidade de efeito adverso causado pelo GC tópico sobre o mecanismo de remodelamento ósseo. Sabe-se que o GC atua principalmente em osteoblastos, diminuindo sua proliferaçao, diferenciaçao e mineralizaçao óssea e aumenta a apoptose de células maduras, reduzindo a populaçao de células de osteoblastos. Além disso, também atua na inibiçao da osteoclastogênese28,29.
Embora uma das limitaçoes do estudo tenha sido falta de avaliaçao sistemática da quantidade e frequência de aplicaçao de GC tópico, foi constatado que os pacientes com DA que usavam GC tópico continuamente há mais tempo apresentaram maior reduçao na massa óssea. O presente estudo nao permite inferir que a causa da baixa massa óssea seja exclusivamente o uso do GC tópico. Para investigar esta hipótese, haveria necessidade de mais um grupo controle, o de crianças com DA moderada ou grave que nao fizessem uso de GC tópico para comparar os resultados; entretanto um grupo controle com estas características seria praticamente impossível de recrutar na prática clínica. Assim, apesar de ter sido encontrada diferença na massa óssea e no crescimento das crianças com DA, outros fatores também poderiam contribuir para estes achados, como baixa exposiçao solar, comprometimento na qualidade do sono, que é comumente observado nesta populaçao, alteraçoes na dieta e inflamaçao crônica.
A osteoporose induzida por GC é a forma mais comum de osteoporose secundária a doenças crônicas que requerem o uso de GC sistêmicos, como artrite reumatoide juvenil30,31, síndrome nefrótica32, lupus eritematoso33, dermatomiosite juvenil34. Nosso estudo traz à atençao um achado importante, porque demonstramos pela primeira vez comprometimento da massa óssea, mesmo sem o uso sistêmico de GC, fato controlado pelo Serviço que seguiu todo o tratamento destes pacientes.
Pode-se concluir que crianças com DA podem ter um maior risco de apresentar uma estatura reduzida em relaçao a crianças saudáveis da mesma idade e sexo. No presente estudo, foi demonstrada baixa massa óssea envolvendo osso trabecular e cortical, associada à diminuiçao do remodelamento ósseo em crianças com DA. Devido às limitaçoes do estudo e por tratar-se de uma doença complexa e multifatorial, nao é possível afirmar que a causa desta diferença deva-se exclusivamente ao uso prolongado do GC tópico.
REFERENCIAS
1. Watson W, Kapur S. Atopic dermatitis. Allergy Asthma Clin Immunol. 2011 Nov 10;7(Suppl 1):S4 Available from: http://www.aacijournal.com/content/7/S1/S4.
2. Ikoma A. Analysis of the mechanism for the development of allergic skin inflammation and the application for its treatment: Mechanisms and management of itch in atopy. J Pharmacological Sciences. 2009;110(3):265-9.
3. Hengge UR, Ruzicka T, Schwartz RA, Cork MJ. Adverse effects of topical glucocorticoids. J Am Acad Dermatol. 2006;54:1-15.
4. Munro M. The effect of percutaneously absorbed steroids on hypothalamic-pituitary-adrenal function after intensive use in inpatients. Br J Dermatol. 1976;94:67-76.
5. Cassidy JT. Osteopenia and osteoporosis in children. Clin Exp Rheumatol. 1999;17:245-50.
6. Pereira RMR, Corrente JE, Chahade W, Yoshinari NH. Evaluation by dual X-ray absorptiometry (DXA) of bone mineral density in children with juvenile chronic arthritis. Clin Exp Rheumatol. 1998;16:495-501.
7. Lien G, Selvaag AM, Flato B, Haugen M, Vinje O, Sorskaar D, Dale K, Egeland T, Forre O. A two-year prospective controlled study of bone mass and bone turnover in children with early juvenile idiopathic arthritis. Arthritis Rheum. 2005;52:833-40.
8. Kipen Y, Buchbinder R, Forbes A, Strauss B, Littlejohn G, Morand E, Prevalence of reduced bone mineral density in systemic lupus erythematosus and the role of steroids. J Rheumatol. 1997;24:1922-9.
9. Pedreira CC, King E, Jones G, Moore E, Zacharin M, Varigos G, Cameron FJ. Oral cyclosporin plus topical corticoisteroid therapy diminishes bone mass in children with eczema. Pediatric Dermatol. 2007;24(6):613-20.
10. van Velsen SG, Knol MJ, van Eijk RL, de Vroede MA, de Wit TC, Lam MG, Haeck IM, de Bruin-Weller MS, Bruijnzeel-Koomen CA, Pasmans SG. Bone mineral density in children with moderate to severe atopic dermatitis. J Am Acad Dermatol. 2010;63(5):824-31.
11. Genant HK, Engelke K, Fuerst T, Glüer CC, Grampp S, Harris ST, et al. Noninvasive assessment of bone mineral and structure: state of the art. J Bone Miner Res. 1996;11:707-30.
12. Brambilla P, Rolland-Cachera M-F, Testolin C, Briend A, Salvatoni A, Testolin G, Chiumello G. Lean mass of children in various nutritional states. Comparison between dual-energy X-ray absorptiometry and anthropometry. Ann N Y Acad Sci. 2000;904:433-6.
13. Eastell R, Hannan RA. Biomarkers of bone health and osteoporosis risk. Proc Nutr Soc. 2008;67:157-62.
14. Szulc P, Kaufman JM, Delmas PD. Biochemical assessment of bone turnover and bone fragility in men. Osteoporos Int 2007;18:1451-61.
15. Jurimae J. Interpretation and application of bone turnover markers in children and adolescents. Curr Opin Pediatr. 2010 Aug;22(4):494-500.
16. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol Suppl (Stockh). 1980;92:44-7.
17. European Task Force on Atopic Dermatitis. Severity scoring of atopic dermatitis: the SCORAD Index (consensus report of the European Task Force on Atopic Dermatitis). Dermatology. 1993;186:23-31.
18. Tanner JM. Growth at adolescence. 2nd ed. Oxford: Blackwell Scientific Publications; 1962.
19. Barros MVG, Assis MAA, Píres MC, Grosseman S, Vasconcelos FAG, Luna MEP, Barros SSH. Validation of a physical activity questionnaire and food ingestion to children from 7 to 10 years old. Rev Bras Saúde Materno Infantil. 2007;7(4):437-48.
20. World Health Organization. Growth Standards Reference Data. Genebra. 2007.
21. WHO Multicentre Growth Reference Study Group. WHO child growth Standards based on length/height, weight and age. Acta Paediatr Suppl. 2006;450:76-85.
22. Lewiecki EM, Gordon CM, Baim S, Leonard MB, Bishop NJ, Bianchi ML, et al. International Society for clinical densitometry 2007 adult and pediatric official positions. Bone. 2008;43;1115-21.
23. Laitinen K, Kalliomaki M, Poussa T, Lagstrom H, Isolauri E. Evaluation of diet and growth in children with and without atopic eczema follow-up study from birth to 4 years. British Journal of Nutrition. 2005;94:565-74.
24. Gradman J, Wolthers OD. Short-term growth in children with eczema during treatment with topical mometasone furoate and tacrolimus. Acta Paediatrica. 2007;96:1233-7.
25. Boot AM, de Ridder MA, Pols HA, Krenning EP, de Muinck Keizer-Schrama SM. Bone mineral density in children and adolescents: relation to puberty, calcium intake, and physical activity. J Clin Endocrinol Metab. 1997;82:57-62.
26. Canalis E, Mazziotti G, Giustina A, Bilezikian JP. Glucocorticoid-induced osteoporosis: pathophysiology and therapy. Osteoporos Int. 2007;18:1319-28.
27. Melamed ML, Michos ED, Post W, Astor B. 25-Hydroxyvitamin D levels and the risk of mortality in the general population. Arch Intern Med. 2008;168:1629-37.
28. Weinstein RS, Jilka RL, Parfitt M, Manolagas SC. Inhibition of osteoblastogeneses and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids potential mechanisms of their deleterious effects on bone. Journal of Clinical Investigation. 1998;102(2):274-82.
29. Yao W, Cheng Z, Pham A, Busse C, Zimmermann EA, Ritchie RO, Lane NE. Glucocorticoid-induced bone loss in mice can be reversed by the actions of parathyroid hormone and risedronate on different pathways for bone formation and mineralization. Arthritis Rheum. 2008;58(11):3485-97.
30. Mazziotti G, Giustina A, Canalis E, Bilezikian JP. Glucocorticoid-Induced osteoporosis: clinical and therapeutic aspects. Arq Bras Endocrinol Metab. 2007;51(8):1404-12.
31. Pereira RMR, Corrente JE, Chahade W, Yoshinari NH. Evaluation by dual X-ray absorptiometry (DXA) of bone mineral density in children with juvenile chronic arthritis. Clin Exp Rheumatol. 1998;16:495-501.
32. Leonard MB, Feldman HI, Shults J, Zemel BS, Foster BJ, Stallings VA. Long-term, high-dose glucocorticoids and bone mineral content in childhood glucocorticoid-sensitive nephrotic syndrome. N Engl J Med. 2004;353:868-75.
33. Regio PL, Bonfá E, Takayama LM, Pereira RMR. The influence of lean mass in trabecular and cortical bone in juvenile onset systemic lupus erythematosus. Lupus (Basingstoke). 2008;17:787-92.
34. Santiago RA, Silva CAA, Caparbo VF, Sallum AME, Pereira RMR. Bone mineral apparent density in juvenile dermatomyositis the role of lean body mass and glucocorticoid use. Scandinavian Journal of Rheumatology. 2008;37:40-7.
Este trabalho foi vencedor do Prêmio Oswaldo Seabra do XXXVIII Congresso Brasileiro de Alergia e Imunopatologia 2011.