Número Atual: Janeiro-Março 2025 - Volume 9 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Lucila Camargo Lopes de Oliveira
- Luciana Rodrigues Silva
- Jackeline Motta Franco
- Alexandra Sayuri Watanabe
- Abelardo Bastos Pinto Júnior
- Albertina Capelo
- Ana Paula Beltran Moschione Castro
- Antônio Carlos Pastorino
- Ariana Campos Yang
- Bruno A. Paes Barreto
- Cristina Targa Ferreira
- Ekaterini Simões Goudouris
- Elisa de Carvalho
- Elza Daniel de Melo
- Fabiane Pomiecinski Frota
- Germana Pimentel Stefani
- Gustavo Falbo Wandalsen
- Hélcio Maranhão
- Herberto José Chong Neto
- Ingrid Pimentel Cunha Magalhães Souza Lima
- Jocemara Gurmini
- José Carlison Santos de Oliveira
- José Luiz Magalhães Rios
- Mauro Batista de Moraes
- Natália Rocha do Amaral Estanislau
- Renata Rodrigues Cocco
- Rossiclei Pinheiro
- Valéria Botan Gonçalves
- Clóvis Francisco Constantino
- Fátima Rodrigues Fernandes
- Fábio Chigres Kuschnir
- Dirceu Solé
ARTIGO ESPECIAL
Atualização em Alergia Alimentar 2025: posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e Sociedade Brasileira de Pediatria
Food Allergy Update 2025: joint position statement of the Brazilian Association of Allergy and Immunology and the Brazilian Society of Pediatrics
Lucila Camargo Lopes de Oliveira1; Luciana Rodrigues Silva2; Jackeline Motta Franco1,2; Alexandra Sayuri Watanabe1; Abelardo Bastos Pinto Júnior2; Albertina Capelo1; Ana Paula Beltran Moschione Castro1; Antônio Carlos Pastorino1,2; Ariana Campos Yang1; Bruno A. Paes Barreto1,2; Cristina Targa Ferreira2; Ekaterini Simões Goudouris1,2; Elisa de Carvalho2; Elza Daniel de Melo2; Fabiane Pomiecinski Frota1; Germana Pimentel Stefani1; Gustavo Falbo Wandalsen1,2; Hélcio Maranhão2; Herberto José Chong Neto1,2; Ingrid Pimentel Cunha Magalhães Souza Lima1; Jocemara Gurmini2; José Carlison Santos de Oliveira1; José Luiz Magalhães Rios1; Mauro Batista de Moraes2; Natália Rocha do Amaral Estanislau1; Renata Rodrigues Cocco1; Rossiclei Pinheiro2; Valéria Botan Gonçalves1; Clóvis Francisco Constantino2; Fátima Rodrigues Fernandes1; Fábio Chigres Kuschnir1,2; Dirceu Solé1,2
1. Associação Brasileira de Alergia e Imunologia (ASBAI)
2. Sociedade Brasileira de Pediatria (SBP)
Endereço para correspondência:
Dirceu Solé
alergiaimunoreumatounifesp@gmail.com
Submetido em: 14/01/2025
Aceito em: 10/02/2025.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A prevalência da alergia alimentar (AA) tem aumentado em todo o mundo, o que a torna um problema de saúde pública. Responde por parte das reações adversas a alimentos, tem início geralmente precoce e suas manifestações clínicas variadas dependem dos mecanismos imunológicos envolvidos (IgE, não IgE ou misto). A identificação das variadas formas clínicas de apresentação, aliada à aquisição de novos métodos laboratoriais, possibilitaram a realização do diagnóstico etiológico de modo mais preciso, sobretudo quanto à reatividade cruzada entre alimentos e mesmo na identificação de marcadores indicativos de formas clínicas transitórias, persistentes e quadros mais graves. A padronização dos testes de provocação oral permitiu a sua realização de forma mais segura e possibilitou a sua inclusão entre as ferramentas disponíveis para confirmação etiológica da AA, assim como a melhor caracterização da Síndrome da enterocolite induzida por proteína alimentar e da Esofagite eosinofílica. Apesar da identificação de novos fatores de risco e de novos alérgenos alimentares, a exclusão do alimento responsável pelas manifestações clínicas continua sendo a principal conduta terapêutica. Entre os pacientes alérgicos às proteínas do leite de vaca, a disponibilidade de fórmulas especiais tem facilitado o tratamento substitutivo do leite de vaca para esses pacientes. A abordagem atual da anafilaxia (forma mais grave de AA mediada por IgE) é revisada, uma vez que os alimentos são os principais agentes etiológicos em crianças. Avanços na conduta de algumas manifestações gastrintestinais também são abordados. Na atualidade, a imunoterapia oral tem sido cada vez mais utilizada, e os imunobiológicos também são apresentados à luz das evidências científicas e clínicas atuais, assim como considerações sobre história natural da AA e formas de prevenção da AA. Este documento, baseado no Consenso Brasileiro sobre Alergia Alimentar de 2018, reuniu especialistas no tratamento da AA (alergologistas, gastroenterologistas, nutrólogos e pediatras) que revisaram e atualizaram os métodos diagnósticos e esquemas de tratamento disponíveis e empregados no acompanhamento de pacientes com AA, visando a melhor abordagem terapêutica desses pacientes.
Descritores: Hipersensibilidade alimentar, fatores de risco, anafilaxia, testes cutâneos, IgE sérica específica, diagnóstico, imunoterapia, fórmulas hipoalergênicas.
Introdução
Desde a publicação do Consenso Brasileiro de Alergia Alimentar em 2018, um documento desenvolvido pela Associação Brasileira de Alergia e Imunologia em parceria com a Sociedade Brasileira de Pediatria, observou-se não apenas um aumento na frequência de queixas relacionadas a possíveis alergias alimentares, mas também uma ampliação no número de alimentos potencialmente envolvidos. O avanço no conhecimento fisiopatológico das diferentes apresentações clínicas da alergia alimentar permitiu a adoção de condutas menos expectantes e mais intervencionistas, bem como adoção de medidas de prevenção primária e secundária, com o intuito de oferecer melhor qualidade de vida aos pacientes e seus cuidadores.
Neste contexto de mudanças, a Associação Brasileira de Alergia e Imunologia (ASBAI) e a Sociedade Brasileira de Pediatria (SBP), viram como imprescindível a necessidade de atualizar o documento anterior.
Definição
Em 1906, o médico austríaco Clemens von Pirquet introduziu o termo "alergia", derivando-o de duas palavras gregas: "allos", que significa "outro" ou "diferente", e "ergon", que denota "trabalho" ou "reação". Essa combinação de palavras foi escolhida para descrever uma resposta imunológica alterada ou exagerada do organismo a determinadas substâncias1.
A alergia alimentar (AA) é uma condição clínica na qual o sistema imunológico responde de forma exagerada e consistente a um alimento específico, sempre que a ele for exposto. É fundamental distingui-la da intolerância alimentar, resposta adversa que não envolve o sistema imunológico, mas sim mecanismos tóxicos, metabólicos, farmacológicos ou ainda não completamente elucidados, desencadeados pela ingestão de certos alimentos2. Portanto, o que distingue a AA de outras reações adversas a alimentos é a sua natureza imunológica.
Classificação
Os mecanismos imunológicos implicados nas diversas manifestações clínicas de AA permitem a classificação das reações em: imediatas ou mediadas por imunoglobulina E (IgE); tardias ou não mediadas por IgE; e mistas, quando ambos os mecanismos estão envolvidos (Tabela 1). Esse entendimento dos diferentes mecanismos é fundamental, pois implicará no diagnóstico e tratamento adequado dos diferentes quadros clínicos.
As reações mediadas por IgE, na maioria das vezes, ocorrem num período de minutos a duas horas após a exposição alimentar. Manifestações após esse tempo podem acontecer na anafilaxia tardia à carne vermelha e na anafilaxia por exercício dependente de alimentos3.
Mecanismos imunológicos outros não mediados por IgE são os responsáveis por sintomas geralmente gastrintestinais e cutâneos com surgimento em horas a dias após a exposição4.
Dentre as manifestações mistas, que envolvem ambos os mecanismos, destacam-se a dermatite atópica e as doenças eosinofílicas do trato gastrintestinal4.
Epidemiologia
A AA é um problema de saúde pública global e afeta cerca de 8% a 10% das crianças e adultos, com prevalência variável ao redor do mundo5. Essa variabilidade não apenas reflete diferenças metodológicas e de critérios diagnósticos, mas também particularidades genéticas, ambientais e socioeconômicas6,7.
Ao longo dos anos, a trajetória epidemiológica da AA foi impulsionada por fatores ambientais que, interferindo desde o período intrauterino e associados às mudanças no estilo de vida da população, notadamente os hábitos alimentares, com a maior industrialização, têm contribuído, por mecanismos ainda não totalmente esclarecidos, para o seu inegável aumento5.
Estudos epidemiológicos que utilizam questionários e formulários, nos quais familiares e/ou pacientes se autodefinem como alérgicos, apresentam-se como uma forma facilitadora da operacionalização e de redução dos custos das pesquisas, porém são menos precisos para a obtenção da prevalência da AA. Grandes estudos de coorte populacionais empregando teste de provocação oral (TPO) seriam mais consistentes, porém mais difíceis de serem conduzidos e de custo mais elevado8,9. Revisão sistemática recente estimou as prevalências de AA agrupada ao longo da vida e a de AA pontual em 19,9% e 13,1%, respectivamente. A prevalência pontual definida pelo nível de IgE específica foi de 16,6%, em oposição a 5,7%, pelo teste cutâneo de leitura imediata (TCLI), e de apenas 0,8% pelo TPO10. A AA ocorre com maior frequência em países desenvolvidos e em zonas urbanas10 e é mais comum em crianças do que em adultos11. Em países em desenvolvimento, a estimativa precisa da prevalência é difícil devido à escassez de dados5.
No Brasil, os dados de prevalência de AA são poucos e limitados a grupos populacionais, o que dificulta uma avaliação mais próxima da realidade. Estudo realizado por gastroenterologistas pediátricos brasileiros observou incidência de suspeita de alergia às proteínas do leite de vaca (APLV) de 2,2%, e prevalência de 5,4% nas crianças avaliadas12. Gonçalves e cols. verificaram que 23,5% dos pais relataram AA em seus lactentes, mas apenas 1,9% foram confirmados por TPO, sendo o leite de vaca (LV) o principal agente causador da AA13. O mesmo ocorreu entre pré-escolares (4 a 59 meses), com relato de 17,2%, porém confirmação de 0,61%, havendo predomínio de LV e ovo14. Silva e cols. avaliaram a prevalência de AA entre adultos brasileiros (18 a 65 anos); entre esses a taxa de sintomas referidos foi 10,8%, mas apenas 1,0% deles foram caracterizados como alérgicos após avaliação médica. Frutas, LV, camarão, carne de porco e vegetais foram os alimentos mais apontados14.
O perfil alimentar da Região Nordeste do Brasil apresenta características específicas. Estudo transversal, utilizando questionários, realizado com pré-escolares (2 a 6 anos), matriculados em escolas municipais de zona urbana (março a junho de 2019), documentou prevalência de AA autorrelatada de 11,7%, menor que a apontada pela maioria de estudos prévios. Os principais alimentos relatados pelos pais foram camarão, carne de porco e outros frutos do mar15.
De maneira semelhante, os dados sobre prevalência e incidência de anafilaxia no Brasil são escassos1618. Estudo evolutivo avaliou a incidência de anafilaxia entre crianças e adolescentes (menores de 18 anos) atendidos (janeiro de 2016 a dezembro de 2018) em pronto-atendimento de hospital pediátrico privado da cidade de São Paulo com diagnóstico potencialmente relacionado à anafilaxia. Considerando-se o número total de atendimentos naquele período, observou-se como taxa média de incidência 0,013% em 2017; 0,016% em 2018; e 0,014% em 2019. Os alimentos mais envolvidos nas reações foram LV, nozes/castanhas, banana, peixe, frutos do mar e trigo18.
Inquérito direcionado a alergistas brasileiros apontou como principais agentes causais de anafilaxia em crianças e adultos os medicamentos (anti-inflamatórios não hormonais e antibióticos), seguidos pelos alimentos (LV, clara de ovo entre lactentes e pré-escolares, crustáceos entre crianças maiores, adolescentes e adultos) e picadas de insetos (formigas de fogo, abelhas e vespas). Em cerca de 10% dos casos não houve identificação do agente etiológico (anafilaxia idiopática)16,19.
A hipersensibilidade alimentar pode ser afetada pela idade no momento do diagnóstico e pelo tipo do alimento envolvido na reação20. Uma lista limitada de alimentos é responsável pela maior parte das alergias alimentares, entre eles: amendoim, castanhas, peixe, marisco, ovo, LV, trigo, soja e sementes11. Spolidoro e cols., em revisão sistemática recente, compararam estimativas de prevalência dos oito principais alérgenos alimentares na Europa, entre os anos de 2000 a 2021, e não observaram mudanças nas taxas de prevalência de alergia a esses alimentos10.
No Brasil, estudo multicêntrico intitulado PROAL (Projeto de Alergia) avaliou mensurações de IgE específicas em pacientes atendidos em centros de referência de Alergia nas diferentes regiões do Brasil. O estudo foi conduzido em dois momentos: 2004 e após 12 anos, em 2016. Entre os alimentos avaliados, detectou-se aumento significativo na prevalência da sensibilização ao LV, amendoim e milho dentro do período e tendência a aumento no caso de outros alimentos21.
Habitualmente, adultos alérgicos apresentam alergia desde a infância, indicando que a maioria das AAs em adultos começa precocemente e persiste ao longo do tempo. No entanto, dados recentes de pesquisas nos Estados Unidos da América (EUA) sugerem que a AA de início na idade adulta pode ser mais comum do que se pensava anteriormente, afetando até metade dos adultos alérgicos a alimentos22.
Fisiopatologia
O trato gastrintestinal constitui uma barreira ao meio externo, apresentando uma superfície em contato com ele para o processamento e a absorção dos alimentos. Diversos mecanismos imunológicos e não imunológicos atuam em conjunto para prevenir a entrada de agentes externos (microrganismos e antígenos alimentares). Em condições normais, a absorção das proteínas alimentares ocorre sem que seus antígenos induzam manifestações clínicas23.
No entanto, há interação entre proteínas e microrganismos da luz intestinal com o sistema imunológico intestinal localizado na superfície epitelial e na lâmina própria. Dessa interação resulta o desenvolvimento da tolerância oral, que é definida como a supressão ativa de resposta imunológica a antígenos de alimentos ou de microrganismos potencialmente benéficos que entram em contato com a mucosa intestinal. Em relação às proteínas dos alimentos, a tolerância oral é a resposta automática frente à exposição a novos alimentos e microrganismos benéficos.
Nesse cenário, ao interagir com proteínas íntegras ou parcialmente hidrolisadas, o sistema imunológico intestinal normalmente é estimulado para o desenvolvimento de tolerância oral. Nesta resposta normal, pode ocorrer produção da imunoglobulina G (IgG) e da imunoglobulina A (IgA) que, no entanto, não desencadeiam uma reação adversa indesejável. Por outro lado, quando há falha no pleno desenvolvimento de tolerância oral, podem ocorrer reações adversas que representam a AA. Os mecanismos exatos envolvidos na falha do desenvolvimento da tolerância oral possivelmente incluem interações de múltiplos fatores24. Atualmente, acredita-se que alterações na instalação da microbiota intestinal, especialmente nos primeiros meses de vida, participem desse processo, interferindo no funcionamento normal do sistema imunológico intestinal e possibilitando o aparecimento de inflamação e doenças alérgicas24.
Deve ser destacado que a caracterização da tolerância oral em animais de laboratório pode ser feita pela demonstração da diminuição da produção de anticorpos específicos, redução de produção de citocinas nos linfonodos e diminuição das manifestações clínicas de hipersensibilidade ocasionadas pelo estímulo antigênico específico24.
Em humanos, até o presente momento, não existe método diagnóstico com aplicabilidade clínica que permita a caracterização ou não de tolerância oral nas reações adversas não mediadas pela IgE. Assim, na prática clínica, a caracterização da tolerância oral só é identificável pela exposição. O termo exposição pode tanto se referir à oferta supervisionada do alimento, através do teste de provocação oral, quanto à exposição domiciliar.
Os processos que fazem parte do desenvolvimento de tolerância oral podem ser distribuídos, fundamentalmente, em duas etapas: (1) captação de antígenos da luz do trato gastrintestinal; (2) desenvolvimento da tolerância oral propriamente dita25.
A captação de antígenos e sua apresentação ao sistema imunológico intestinal pode ser feita pelas seguintes vias:
- células M (microfold cell): são células epiteliais sem microvilosidades (achatadas) que estão localizadas próximas às placas de Peyer e que são especializadas na captação de antígenos sob forma de partículas como vírus e bactérias. Relacionam-se como a produção de IgA;
- via transcelular (vesículas) e via paracelular (entre enterócitos): que captam os antígenos solúveis. Na via transcelular, a passagem ocorre em vesículas que são degradadas pelos lisossomas. Entretanto, uma pequena parte dos antígenos parcialmente degradados pode ser liberada no espaço basolateral, interagindo com antígenos de histocompatibilidade da classe II (MHC-II) e células dendríticas;
- células caliciformes: captação de antígenos solúveis gerando GAPs (do inglês, globet-cell-associated antigen passages). As GAPs transferem antígenos exclusivamente às células dendríticas CD103+CX3CR1- da lâmina própria que participam do processo de desenvolvimento de tolerância oral. Maior quantidade de muco se associa com maior quantidade de GAPs, e, assim, ocorre incremento da transferência de antígenos para as células dendríticas;
- outras formas de captação de antígenos: antígenos na luz intestinal podem ser capturados por dendritos de macrófagos (células dendríticas). Nesse processo, a integridade do epitélio intestinal permanece completamente preservada25.
As células dendríticas CD103+CX3CR1 realizam a transferência dos complexos de MHCII-peptídeos para células dendríticas CD103+ que migram para os linfonodos e apresentam os antígenos para linfócitos naive25.
A partir da captação dos antígenos alimentares, os linfócitos T reguladores (tipo CD4+CD25+Foxp3+; Treg) desempenham papel fundamental no desenvolvimento da tolerância oral25. Outras populações de linfócitos Treg também participam do processo e expressam fator transformador de crescimento beta (TGF-b), estimulam linfócitos Treg Fox3p+, e produzem interleucina (IL)-10. Após a captação dos antígenos por células dendríticas CD103+ localizadas na lâmina própria, pelo TGF-b e ácido retinoico, ocorre a diferenciação de linfócitos T naive em linfócitos Treg. Esses linfócitos Treg recém-programados migram do linfonodo para lâmina própria, onde ocorre sua proliferação25.
A microbiota intestinal tambem participa do processo de tolerancia oral. Em camundongos demonstrou-se que a desregulacao da microbiota pode ocasionar reducao da tolerancia oral. Apesar de não ser conhecido um perfil especifico de microbiota associada a AA, certas especies de Clostridium, bifidobacterias e Bacteroides foram relacionadas a supressao de AA em camundongos. A microbiota intestinal, especialmente as especies do genero Clostridium, interagem com linfocitos Treg que sao fundamentais para suprimir a resposta Th2 (linfocito T helper tipo 2). E importante tambem o papel da microbiota na manutencao da integridade da mucosa intestinal, em outros processos imunologicos e na dismotilidade25.
Em resumo, antígenos alimentares são transportados para o linfonodo mesentérico pelas células dendríticas que expressam altos níveis de RALDH (retinaldeído desidrogenase), IDO (indolamina 2,3-dioxigenase) e TGF-β, facilitando a diferenciação de linfócitos T naives em Treg. Os linfócitos Treg expressam marcadores de direcionamento intestinal CCR9 (Receptor de quimiocina com motivo C-C 9) e a integrina α4β7 e migram de volta para a lâmina própria. Lá, ocorre a expansão de linfócitos Treg que é induzida por altos níveis de IL-10 produzidos por macrófagos. O fator estimulador do crescimento de colônias de granulócito-macrófago (GM-CSF) produzido por células linfoides de imunidade inata 3 (ILC3) também contribui para a homeostase dos Treg, agindo nas células dendríticas e macrófagos.
Na falha de aquisição da tolerância oral, podem ocorrer as reações de hipersensibilidade que caracterizam as diferentes formas de apresentação da AA.
AA mediada por IgE
As reações alérgicas mediadas por IgE (tipo I da classificação de Gell e Coombs) ocorrem como resultado da perda do estado de tolerância após o contato com o antígeno alimentar, reconhecido equivocadamente como patógeno pelo sistema imunológico. As bases fisiopatológicas incluem prejuízos das barreiras epiteliais, gastrintestinais ou cutâneas e predisposição genética que favorecem a absorção das proteínas e estimulam a liberação de citocinas inflamatórias (alarminas, IL-4, IL-5), capazes de induzir células dendríticas à promoção de um fenótipo do tipo Th2. Como consequência, há a produção de anticorpos IgE específicos contra as proteínas alimentares, a partir de linfócitos B26.
Uma vez produzidos, os anticorpos IgE específicos ligam-se às membranas de mastócitos e basófilos. A presença desses anticorpos, no entanto, não é sinônimo de reatividade clínica - o primeiro contato pode induzir apenas ao estado de sensibilização: presença de anticorpos IgE, mas ausência de alergias. Os sintomas serão deflagrados quando ocorrer exposição posterior à mesma proteína e se for capaz de incitar a liberação de mediadores pré-formados (histamina e outros, armazenados no interior das células efetoras) e neoformados (prostaglandinas). Recentemente, a presença de características físico-químicas da IgE (como a adição de açúcares na porção constante da imunoglobulina) foi descrita como um fator de maior risco para o desenvolvimento de sintomas alérgicos em pacientes sensibilizados27.
O desenvolvimento do quadro alérgico é desencadeado em contatos posteriores ao da sensibilização, em indivíduos geneticamente predispostos. A produção de quantidades adicionais de anticorpos IgE específicos além daqueles previamente acoplados, determina a ruptura da membrana e liberação dos mediadores químicos pelas células efetoras28. O mecanismo de sensibilização prévia é necessário para desencadear a cascata imunológica descrita. O contato com o antígeno pode ocorrer por vias diversas e muitas vezes desconhecidas, incluindo ingestão, inalação, veiculação pelo leite materno ou transdérmica. Os principais componentes do sistema imunológico envolvidos na indução de tolerância oral ou sensibilização incluem epitélio, células da imunidade inata, linfócitos T e B e células efetoras (mastócitos, eosinófilos e basófilos). As reações clássicas das formas de alergia mediadas por IgE consistem em sintomas imediatos, desencadeados minutos a poucas horas após o contato com o fator causal e frequentemente incluem manifestações cutâneas como urticária e angioedema. A anafilaxia por alimentos mediada por IgE é a manifestação mais grave dessa forma de alergia26.
AA não mediada por IgE
Apesar dos mecanismos ainda não estarem plenamente definidos, considera-se que a AA do tipo não mediada por IgE ocorre quando há falha no desenvolvimento da tolerância oral, ou seja, incapacidade de reconhecer e ignorar antígenos alimentares e bactérias benéficas e, por outro lado, disparar mecanismos protetores23,25.
Anormalidades na tolerância oral são fatores causais e constituem um processo que, quando restabelecido, proporciona o desaparecimento da AA. Representa, portanto, um mecanismo potencialmente útil para a prevenção e tratamento da AA24,25.
Situações clínicas nas quais há aumento da permeabilidade intestinal, como, por exemplo, quando há fragilidade na junção firme entre enterócitos, favorecem uma maior penetração alergênica. Supõe-se que se associam com aumento do risco de APLV, como por exemplo, nas enteropatias induzidas pela proteína da dieta na vigência de lesões epiteliais desencadeadas por infecção pela E. coli enteropatogênicas clássicas (menos frequentes na atualidade)29, nas doenças alérgicas em geral e, também, em outros quadros clínicos como nas doenças gastrintestinais funcionais30 e na obesidade31.
Na enteropatia induzida pela proteína da dieta, observa-se infiltração de linfócitos e plasmócitos na lâmina própria, atrofia de vilosidades intestinais, aumento de linfócitos intraepiteliais (> 25/1.000 células epiteliais), hiperplasia de criptas, redução na concentração de dissacaridases e má-absorção intestinal, que ocorrem predominantemente no intestino delgado proximal29,32. Ao contrário da doença celíaca, em geral, a enteropatia induzida pela proteína da dieta é transitória e ocorre nos primeiros anos de vida, sendo o LV o alimento mais frequentemente envolvido. Outros alimentos que podem desencadear a enteropatia induzida pelas proteínas são: soja, trigo, aveia, ovos, arroz e peixe. É importante destacar que em alguns casos pode ocorrer reação aos peptídeos presentes em fórmulas com proteínas extensamente hidrolisadas29.
Do ponto de vista fisiopatológico, a reexposição da mucosa intestinal às proteínas alergênicas, em particular do LV, ocasiona aumento de linfócitos intraepiteliais CD8 e ativação de linfócitos T auxiliadores CD4 na lâmina própria. Nas enteropatias alérgicas pode-se observar resposta predominante Th1 ou mista Th1 e Th229. Outros autores destacam que a inflamação desencadeada pelas proteínas do LV expressa citocinas produzidas por linfócitos Th232. Redução da expressão de TFG-β também faz parte do cenário fisiopatológico.
A resposta da mucosa na AA é frequentemente associada à infiltração de eosinófilos e mastócitos que produzem diferentes mediadores pró-inflamatórios, vasoativos e neuroativos. Essas células parecem estar implicadas na dismotilidade do tubo digestivo e do sistema nervoso entérico desencadeados pelo processo alérgico. Nesse processo pode ocorrer liberação luminal de triptase e proteína catiônica eosinofílica, que podem ser identificadas nas fezes. Vale destacar que a passagem de macromoléculas pela barreira intestinal, em particular por defeitos nas tight junctions entre enterócitos, é uma etapa de grande importância nesse processo. A permeabilidade intestinal pode aumentar em consequência do aumento de fator de necrose tumoral alfa (TNF-a) e interferon gama (IFN-γ)29.
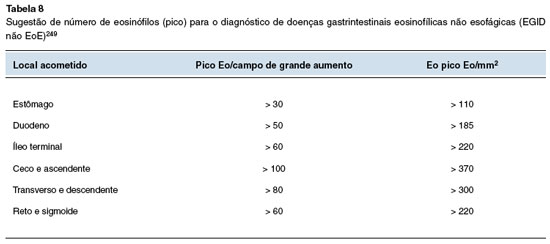
No caso da proctocolite alérgica, o acometimento ocorre preferencialmente no reto e sigmoide, sendo que a fisiopatologia ainda não é plenamente compreendida. Similarmente a outras formas de AA, apresenta maior atividade do TNF-α e redução do nível de TGF-β. A realização de biópsia não é necessária para se estabelecer o diagnóstico, no entanto, pode-se encontrar eritema e fragilidade da mucosa associada com excessiva hiperplasia nodular linfoide. A biópsia pode revelar infiltrado eosinofílico com mais de 20 eosinófilos por campo de grande aumento sem relação com os níveis de eosinófilos sanguíneos29. Nesse contexto, vale destacar que cerca da metade dos pacientes com proctocolite alérgica apresenta eosinofilia33.
AA mistas
A esofagite eosinofílica (EoE) é uma doença crônica, imunomediada, caracterizada pela infiltração eosinofílica do epitélio esofágico. É o protótipo de uma manifestação mista de AA.
A EoE é doença inflamatória crônica do esôfago associada à heterogeneidade clínica e molecular e caracterizada por defeitos de barreira epitelial, inflamação eosinofílica com predominância de Th2, e remodelação tecidual, determinando disfunção esofágica progressiva. As respostas desreguladas das células epiteliais e imunológicas são centrais na patogênese da doença associada à inflamação crônica.
Em 1995, Kelly e cols. relataram a primeira série de crianças com EoE e observaram que os sintomas e as alterações histopatológicas respondiam a uma dieta baseada em aminoácidos, e, após a reintrodução alimentar, os sintomas e a eosinofilia epitelial retornaram34. Desde então, vários ensaios prospectivos de eliminação de alimentos documentaram a capacidade da restrição alimentar de induzir a remissão histológica da EoE em 43% a 74% das crianças e adultos31. A eosinofilia periférica é encontrada em 40% a 50% dos pacientes35. Além disso, observa-se que entre 28% e 86% dos adultos e entre 42% e 96% das crianças podem ser afetadas por uma ou mais doenças alérgicas comórbidas, como a dermatite atópica, AA, asma ou rinite alérgica35.
A fisiopatologia da EoE não está totalmente esclarecida, mas sua complexidade tem sido progressivamente compreendida e parece envolver a interação de uma série de disfunções: imunológica, da barreira epitelial e neuroimune.
Disfunção imunológica
Estudos que examinam as bases moleculares da EoE concentram-se em quimiocinas conhecidas por estarem relacionadas à eosinofilia (por exemplo, eotaxina-3) e citocinas tipo 2 (por exemplo, IL-5, IL-4 e IL-13). A IL-5 participa da maturação dos eosinófilos e a sua eventual migração para o epitélio esofágico, sendo observada maior expressão de IL-5 no esôfago de pacientes com EoE37. Da mesma forma, a IL-13 está elevada em tecido de pacientes com EoE, e a estimulação do epitélio esofágico pela mesma ocasiona a produção de eotaxina-3, um importante fator quimiotático dos eosinófilos, bem como a diminuição da expressão de filagrina, resultando no comprometimento da função da barreira epitelial do esôfago38,39. Usando uma abordagem translacional, Cianferoni e cols. descobriram que as células Th2 que expressam IL-4, IL-5 e IL-13 aumentaram significativamente no sangue periférico na fase ativa de pacientes com EoE que não tinham IgE específica para LV, sugerindo ainda mais a inflamação do tipo 2 como alvo para tratamentos em EoE40. Ensaios que utilizaram anticorpos anti-IL-5 e anti-IL-13 documentaram a sua capacidade de diminuir a eosinofilia esofágica. Apesar dessas descobertas impressionantes, esses estudos não apoiaram o uso clínico porque não conseguiram atingir o objetivo final de redução dos sintomas4144. Por outro lado, ensaios clínicos com anti-IL-4Rα (dupilumabe) mostraram resultados positivos na remissão clínica, endoscópica e histopatológica da doença45.
Além disso, polimorfismos genéticos no locus da linfopoietina estromal tímica (TSLP) foram identificados em indivíduos com EoE, mas não em indivíduos controles. A expressão de TSLP está aumentada em tecidos esofágicos de pacientes com EoE. A TSLP atua nas células dendríticas, evocando uma resposta imune tipo 2. Noti e cols. demonstraram o papel da TSLP na patogênese subjacente da eosinofilia esofágica46. Nesse estudo, a inibição da TSLP causou redução das impactações alimentares e da eosinofilia em um modelo experimental de EoE em camundongos.
Um conjunto emergente de evidências apoia a associação de padrões de imunoglobulinas na EoE. Por exemplo, a IgG4 está aumentada nos tecidos de pacientes com EoE47,48. Apesar da expectativa inicial de que os mecanismos mediados por IgE possam fornecer informações diagnósticas, terapêuticas e patogênicas para pacientes com EoE, um crescente conjunto de evidências não apoia o seu papel direto. Modelos murinos de EoE demonstram a capacidade de camundongos com deficiência de células B desenvolverem eosinofilia esofágica49. A IgE sérica não está elevada em todos os pacientes com EoE e, quando aumentada, é difícil determinar se o aumento é devido à EoE ou outras condições alérgicas subjacentes ou mesmo à sensibilização decorrente de uma barreira esofágica comprometida. Omalizumabe (OMA), um anticorpo monoclonal anti-IgE, não foi eficaz em induzir remissão da EoE47.
O impacto da epigenética e dos fatores ambientais na EoE continua se destacando e sendo examinado em pesquisas. O parto cesáreo, a prematuridade, a exposição a antibióticos precocemente, a redução da amamentação e a vida em áreas menos populosas têm sido associados a aumento de EoE50,51. A diminuição da exposição a bactérias até dois a três anos após o nascimento pode evocar um estado imunológico dominante de Th2 e, portanto, uma propensão para desenvolver doenças alérgicas51,52. Com base na semelhança a outros distúrbios alérgicos clássicos, tal desvio do equilíbrio Th1/Th2 decorrente da mudança no estilo de vida poderia estar relacionado ao aumento da EoE. Por exemplo, a diminuição da exposição bacteriana na infância pode estar associada à diminuição da taxa de detecção de Helicobacter pylori na população em geral53. Essas reduções são especialmente proeminentes nos países desenvolvidos, onde a incidência de EoE parece ser elevada. Pelo menos um estudo demonstra que a taxa de infecção por Helicobacter pylori está inversamente relacionada à eosinofilia esofágica, mas não está claro se existe um vínculo causal direto ou não54. Estudo recente não observou essa mesma associação, indicando a necessidade de mais estudos epidemiológicos e fisiopatológicos55.
Disfunção de barreira epitelial
Várias hipóteses foram levantadas em relação à diminuição da função da barreira esofágica na EoE. Primeiro, alguns pacientes com EoE podem ter, de início, a barreira epitelial diminuída, quando não estão inflamados, predispondo-os assim para a sensibilização alérgica; esse modelo é semelhante ao observado na dermatite atópica. E de fato, foram encontradas alterações transcricionais no cromossoma humano 1q21, que codifica um grupo de genes relacionados à diferenciação epidérmica, incluindo a filagrina39 e outra molécula proteolítica específica do tecido, a calpaína 1456. A expressão alterada desses genes pode predispor à disfunção da barreira no início ou após ativação por citocinas do tipo 2, como a IL-1339. Estudo que mediu a espessura da barreira esofágica usando monitores de impedância em pacientes adultos com EoE observou que após o tratamento a barreira ainda estava reduzida em comparação aos valores normais, indicando um potencial defeito inato dessa57.
Em segundo lugar, a barreira prejudicada pode se desenvolver como resultado de lesão péptica ou outra. Essa hipótese se baseia na observação clínica de que a EoE pode se desenvolver após um dano epitelial causado por lesão ácida, trauma ou infecção58,59. Nessa circunstância, alimentos ou aeroalérgenos podem então entrar em contato com o epitélio danificado e com o microambiente sensibilizado na mucosa esofágica, ocasionando a ativação de uma via inflamatória tipo 2.
Finalmente, a disfunção da barreira pode ocorrer como um produto autoperpetuado da inflamação contínua. Assim, uma vez iniciado o processo inflamatório, a superfície epitelial pode se tornar cada vez mais permeável e permitir que mais alérgenos penetrem e se desenvolva um ciclo contínuo de alergia. O suporte para esse paradigma se baseia em achados histológicos de tecidos ativamente inflamados que demonstram espaços intercelulares dilatados e diminuição de desmossomos, bem como valores anormais de impedância em tecido inflamado em comparação com o tecido normal60,61.
Todas essas hipóteses podem ajudar a explicar parte do papel da disfunção de barreira na EoE, e várias linhas de evidência demonstram os caminhos subjacentes associados. Estudos genéticos lançaram a base de várias pesquisas que demonstram a importância da IL-13 na disfunção da barreira. A IL-13 regula negativamente a filagrina e a desmogleína-1 e regula positivamente a calpaína 14, o que pode contribuir para a diminuição da barreira. O silenciamento genético da desmogleína induziu ruptura da barreira in vitro62. Estudos destacaram o aumento da expressão de calpaína 14 associada a uma subpopulação de EoE56, enquanto a cultura in vitro de células epiteliais esofágicas com IL-13 levou ao aumento da expressão de calpaína 14 e a subsequente perda da função de barreira, implicando sua importância na disfunção da barreira em EoE63.
Outro aspecto diz respeito à ação eosinofílica sobre a barreira. Além do efeito direto sobre o epitélio, os eosinófilos também contribuem para a reestruturação da barreira, promovendo a remodelação/reparação dos tecidos após danos induzidos por patógenos, toxinas ou morte celular. Um duplo papel dos eosinófilos na degradação e reparação tecidual foi descrito. Na verdade, os eosinófilos liberam neurotoxina (EDN), que promove a proliferação de fibroblastos64, e proteína básica principal (MBP), que apresenta sinergia com IL-5 e TGF-β para aumentar a expressão de fibroblastos e secreção de IL-6 e IL-1165. Além do seu papel no remodelamento esofágico, o TGF-β1 também diminuiu a função da barreira epitelial in vitro, mediando uma redução na expressão da molécula de junção claudina66. Enfim, o papel de uma barreira intacta é provavelmente crítico para os processos de doença na EoE.
Disfunção neuroimune
O aumento da infiltração de eosinófilos e mastócitos no tecido esofágico pode agravar a responsividade neuronal sensorial vagal ao ácido, promover disfunção da barreira e comprometimento da permeabilidade epitelial67,68. O incremento da permeabilidade epitelial pode elevar a capacidade do ácido luminal em estimular a descarga do potencial de ação nos terminais aferentes nociceptivos. As citocinas do tipo 2 também podem causar hipercontratilidade das células musculares lisas gastrintestinais pelas vias de sinalização do transdutor de sinal e ativador da transcrição 6 (STAT6) ou da proteína quinase ativada por mitógeno (MAPK), o que pode contribuir para a disfagia67.
TRPV1 (do inglês transient receptor potential cation channel, subfamily V, member 1) e mastócitos podem modular a dor na EoE. Estudo em pacientes com EoE com dor, revelou que a dor está associada à expressão molecular de TRPV1, carboxipeptidase A3 e prostaglandina D sintase hematopoiética, mas não à eosinofilia69. Neuropeptídeos como a substância P (SP) e o peptídeo vasoativo intestinal (VIP) promovem a degranulação de mastócitos, a produção de citocinas e quimiocinas tipo 2 e uma cascata imunológica resultante70.
Os sintomas de desconforto e irritação associados à EoE podem ser definidos por circuitos moleculares e celulares que se assemelham a mecanismos de prurido, em vez de vias tradicionais associadas à dor, uma vez que os neurônios sensoriais positivos para TRPV1 são proeminentes dentro do nervo vago e têm identidade transcricional específica para prurido no nível unicelular71.
Estudos clínicos documentaram que os agentes que bloqueiam a via da IL-5 (mepolizumabe e reslizumabe) apesar de reduzirem o número de eosinófilos no tecido esofágico, tiveram um impacto mínimo sobre os sintomas4144. Os agentes direcionados à IL-13 produziram resultados positivos; são eles os anticorpos monoclonais (mAbs) anti-IL-13 QAX576 e RPC4046206,207 e dupilumabe, que inibe a sinalização de IL-4 e IL-1345,72. Dupilumabe é o primeiro medicamento aprovado pela Food and Drug Administration (FDA) dos Estados Unidos da América (EUA) para o tratamento de EoE. Em ensaios clínicos em pacientes com EoE, o dupilumabe reduziu o pico da contagem de eosinófilos intraepiteliais nos tecidos esofágicos e melhorou os escores clínicos, histológicos e endoscópicos45,72.
Fatores de risco
Diversos fatores relacionados ao antígeno, ao hospedeiro e ao ambiente podem atuar e influenciar no processo de um indivíduo se tornar sensibilizado ou tolerante a um determinado antígeno alimentar. O estudo de fatores de risco modificáveis e não modificáveis tem avançado recentemente, possibilitando futuras intervenções tanto preventivas quanto terapêuticas que mitiguem o impacto da AA sobre a população5.
Relacionados ao alérgeno
Alérgeno alimentar é qualquer componente do alimento capaz de estimular uma resposta de hipersensibilidade. Esses alérgenos são, na sua maior parte, representados por glicoproteínas hidrossolúveis com peso molecular entre 10 e 70 kDa. Eles podem ser sensibilizantes (capazes de induzir anticorpo do tipo IgE) ou não sensibilizantes, que só promovem resposta caso tenha havido sensibilização prévia por alérgeno correlacionado (reatividade cruzada)73. Os locais mais comuns de "entrada" do alérgeno no corpo são as superfícies mucosas das vias aéreas (transportado pelo ar ou gotículas de aerossol), todo o trato digestivo (incluindo a cavidade oral), e a pele, que mais recentemente tem sido reconhecida como via de sensibilização, hipótese que ganhou importância desde a descoberta dos SNPs (do inglês single nucleotide polymorphism) da filagrina associados ao desenvolvimento de alergia.
Um exemplo de verdadeiro alérgeno alimentar (sensibilizante primário) é a tropomiosina, proteína muscular do camarão que varia em nomenclatura dependendo do tipo de camarão (Pen a 1, Cra c 1, Met e 1, Lit v 1, entre outros), ou de outros crustáceos e moluscos, como lagosta (Hom a 1) e lagostim (Pro c 1). A tropomiosina e a proteína ligadora de cálcio citoplasmático parecem estar mais associadas à reatividade clínica ao camarão, enquanto a arginina quinase e a hemocianina parecem ser alérgenos de reação cruzada entre camarão e ácaros. A hemocianina e a hemoglobina têm maior probabilidade de sensibilizar através das vias respiratórias ou pelo contato com a pele num ambiente ocupacional (preparação de marisco, produção de alimentos para peixes)74.
Exemplos de verdadeiros alérgenos alimentares de plantas são as albuminas 2S de leguminosas como o amendoim (Ara h 2), nozes e castanhas (Cor a 14, Jug r 1 e Ana o 3) e sementes (Ses i 1). Embora esses alérgenos partilhem características estruturais similares, baseadas num padrão comum de ligação dissulfeto, as suas sequências primárias são bastante diversas, resultando em baixa reatividade cruzada75.
Os alérgenos podem sofrer modificações conforme o processamento do alimento ou durante a digestão, resultando em aumento ou diminuição da alergenicidade. Por exemplo, a proteína do ovo, a ovoalbumina reduz seu potencial alergênico com o cozimento do ovo a temperaturas elevadas, enquanto o amendoim tem seu potencial alergênico aumentado quando torrado.
O epítopo alergênico pode ser de origem conformacional, quando a estrutura terciária da proteína é que suscita a resposta imunológica. Esses epítopos podem perder sua capacidade de ligação ao anticorpo quando submetidos a processos de cocção, hidrólise ou outros procedimentos químicos. Epítopos também podem ser lineares, uma sequência de aminoácidos que se liga ao anticorpo e, nesse cenário, procedimentos químicos simples são incapazes de modificar sua alergenicidade75.
Os alérgenos alimentares relacionados a manifestações mais graves de alergia são, em geral, termoestáveis e resistentes à ação de ácidos e proteases. Embora virtualmente qualquer alimento possa causar alergia, a maioria das manifestações de AA ocorrem com a ingestão de LV, ovo, soja, trigo, amendoim, castanhas, peixes e crustáceos. Deve-se destacar, entretanto, que novos alérgenos têm sido descritos, como as frutas e gergelim, e alguns deles bem regionais, como a mandioca76. O gergelim foi adicionado nos EUA, como o nono alérgeno mais comum a apresentar reação desde 2023, além dos oito anteriormente citados77.
O conceito clássico de alérgeno envolve proteínas que suscitam uma resposta de hipersensibilidade; entretanto há, na AA, importante exceção que são alérgenos compostos por carboidratos. A explicação sugerida para entender esse mecanismo é que geralmente os glucanos puros são incapazes de induzir a formação de anticorpos do tipo IgE. As moléculas clássicas de MHC-II são muito eficientes na interação com peptídeos, mas são incapazes de se combinar com os glucanos puros. Contudo, para glucanos acoplados a um transportador proteico, a situação é diferente. O anticorpo ancorado em algumas células B pode interagir com o glucano. Estas células B ligam-se à glicoproteína pela interação anticorpo-glucano. Em seguida, a célula B fagocita e digere a glicoproteína e apresenta os peptídeos em associação ao seu MHC-II para a célula T. O receptor de células T interage com o complexo peptídeo-MHC-II na célula B, o que resulta na ativação da célula T. A célula T ativa a célula B, promovendo sua diferenciação em célula plasmática secretora de anticorpos. O ponto importante é que a célula Th2 convencional não reconhece o glucano e ainda assim pode induzir a célula B a produzir anticorpos anti-glucano. É possível que os glucanos possam ser alérgenos não apenas como glicoproteínas, mas também como glicolipídios, potencialmente por fontes de IL-4 que não sejam células Th2. Presumivelmente, isso é mais relevante para as respostas imunológicas a parasitas invertebrados, como helmintos e carrapatos. Dois glucanos prototípicos com atividade de ligação à IgE bem estabelecida são conhecidos, o CCD (determinante carboidrato de reatividade cruzada)78,79 e o epítopo alfa-gal80.
Os CCDs referem-se a um grupo de glucanos caracterizados por uma fucose e/ou xilose que estão ligadas de maneira específica ao núcleo do glucano. Esses glucanos são produzidos por invertebrados e plantas, mas não por vertebrados. São capazes de suscitar uma resposta imunológica e estão presentes em todas as plantas81. Quando há suspeita de alergia a muitas plantas e se detecta IgE específica a esse componente, há grande chance de reatividade cruzada sem reatividade clínica efetiva75.
O alfa-gal (nome completo: Gal-a1-3Gal-b13GlcNAc) é um açúcar presente na carne de todos os mamíferos não primatas. Está relacionada à alergia à carne vermelha82. A sensibilização ocorre através da picada de carrapato. Por razões ainda desconhecidas, o início dos sintomas sistêmicos observados após o consumo de carne não é imediato, mas tardio, incluindo anafilaxia (3 a 5 horas) após a ingestão de carnes. Em indivíduos sensibilizados, a infusão de cetuximabe pode determinar manifestações alérgicas imediatas, também por apresentar o mesmo antígeno75.
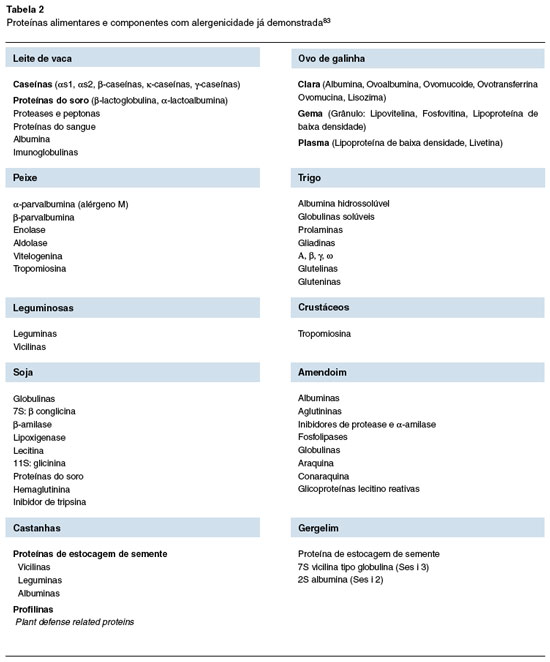
Os principais alimentos com as proteínas que mais comumente estão envolvidos na AA estão relacionados na Tabela 2. Pacientes com AA podem apresentar perfis diferentes de sensibilização, resultando em sintomas clínicos diversos.
Na AA, algumas frações do alérgeno (componentes) têm sido mais claramente associadas tanto aos fenótipos clínicos definidos, como à gravidade dos sintomas alérgicos84.
Há três formas pelas quais alguém pode se tornar alérgico a um alimento específico:
- por exposição direta a esse alimento, quer por via oral, inalatória ou transcutânea;
- por reatividade cruzada entre alimentos;
- pela reatividade cruzada entre fontes de alérgenos respiratórios e alimentos.
O exemplo mais conhecido deste último é a alergia a frutas e nozes como comorbidade com alergia ao pólen de bétula85. O mecanismo desta associação é a reatividade cruzada da IgE específica ao Bet v 1 com alérgenos estruturalmente homólogos em alimentos como maçã, pêssego, avelã e amendoim. O fenótipo clínico observado nesses pacientes é caracterizado por sintomas leves a moderados restritos à cavidade oral. Acredita-se que a explicação para a falta de sintomas sistêmicos (graves) reside na natureza sensível à protease dos alérgenos alimentares relacionados ao Bet v 1 que são facilmente digeridos no trato gastrintestinal. Maçã, Mal d 1, ou pêssego, Pru p 1, os homólogos Bet v 1 dessas frutas, são completamente digeridos antes que possam sensibilizar diretamente.86 Isto não significa que uma fruta como o pêssego não possa sensibilizar diretamente os indivíduos atópicos por meio de outro componente.
O alérgeno implicado na alergia ao pêssego é o Pru p 3, pertencente à família LTP (lipid transfer protein). Anticorpos IgE contra Pru p 3 estão associados a risco aumentado de reações sistêmicas graves87, e podem reagir de forma cruzada e ampla com outras frutas, bem como com frutas secas, leguminosas e alguns vegetais88. Este perfil mais alergênico das LTPs foi atribuído ao seu elevado grau de resistência à protease (e ao processamento de alimentos), além de entrar em solução eficazmente apenas em pH baixo, ou seja, no estômago, resultando na ausência de um sinal de alerta oral precoce. Além dos alérgenos da família das LTPs e aos relacionados ao Bet v 1, nozes, legumes e sementes contêm proteínas de armazenamento de sementes muito mais abundantes, como albuminas 2S e globulinas 7S e 11S. Estas proteínas estão envolvidas na sensibilização direta, que ocorre frequentemente em idades mais jovens. Tal como relatado para as LTPs, estas proteínas de armazenamento de sementes, em particular as albuminas 2S, são notavelmente estáveis e estão associados a sintomas mais graves. Isto foi demonstrado para o Ara h 2 do amendoim e as albuminas 2S (Cor a 14) e 11S (Cor a 9) da avelã89,90. Com base nestas e em outras observações, o diagnóstico molecular é cada vez mais utilizado para tentar avaliar de forma fiel o risco de os pacientes apresentarem sintomas graves91.92.
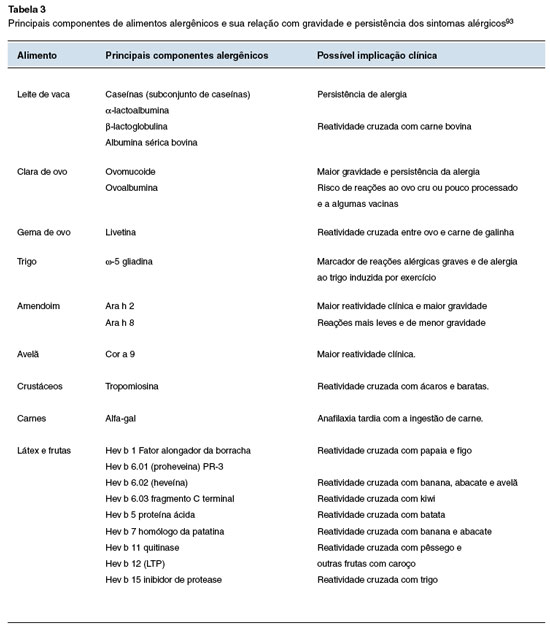
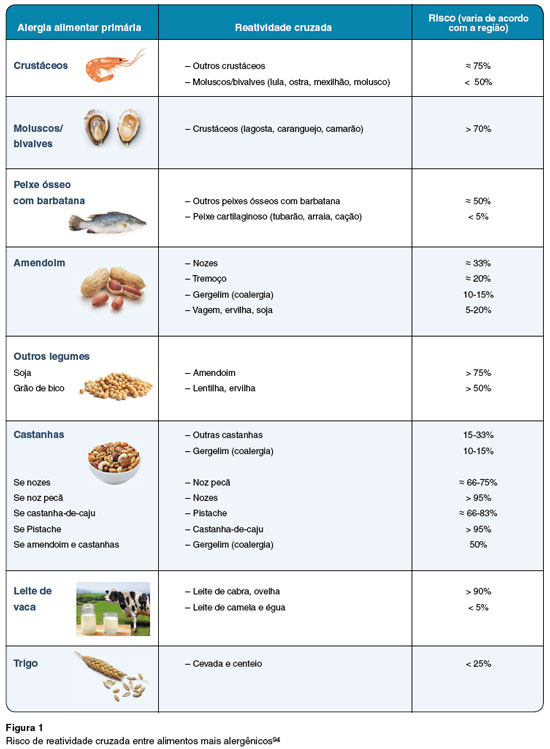
A Tabela 3 indica a relação entre os componentes alergênicos dos alimentos e sua implicação clínica, enquanto a Figura 1 demonstra o risco de reatividade cruzada.
Relacionados ao indivíduo
Genética
A história familiar de doença alérgica entre parentes de primeiro grau, diagnosticada por um profissional de saúde, é reconhecida como um fator de risco para doença alérgica, sugerindo uma base genética. Essa associação é forte entre irmãos: uma criança tem duas vezes e meia mais probabilidade de desenvolver AA, se um irmão tiver AA, mesmo na ausência de história atópica parental. Estudos com gêmeos demonstraram que a taxa de concordância de 82% entre gêmeos monozigóticos no desenvolvimento de alergia ao amendoim excede em muito a taxa de concordância de 20% observada entre gêmeos dizigóticos. Em geral, as estimativas de hereditariedade para AA chegam a 81%95,96.
A prevalência de AA vem aumentando entre todos os grupos demográficos nas últimas décadas, mas não uniformemente. Dados americanos revelam que a prevalência da AA é quatro vezes mais elevada entre americanos afrodescendentes que americanos de origem europeia. Estudos recentes mostraram que variantes em diversos genes que codificam moléculas relacionadas com Th2, como IL-4 e IL-13, apresentam maior frequência alélica nos portadores de AA, sugerindo que estes alelos foram conservados para combater infecções parasitárias em africanos, mas não em europeus. Esta trajetória evolutiva pode ser a razão para a maior prevalência de distúrbios alérgicos em americanos afrodescendentes95.
Estudos de associação genômica ampla (GWAS, do inglês genome-wide association study) e de genes prováveis sugerem associação significativa com AA nas regiões HLA-DR e HLA-DQ, bem como de variantes genéticas em diversos genes, como FLG, SPINK5, STAT6, CD14 e FOXP3, com a AA96. Diversos polimorfismos de HLA (antígeno leucocitário humano) estão em estudo e parece haver forte associação entre alguns polimorfismos e a ocorrência de alergias alimentares específicas, como: HLA-DRB1 e alergia a ovo; HLA-DQ7 e alergia ao leite de vaca; HLA-DQB1 e alergia ao amendoim95,97,98.
O papel da genética no desenvolvimento da AA é evidenciado em doenças monogênicas que apresentam maior risco de AA, como a síndrome de imunodesregulação, poliendocrinopatia e enteropatia ligada ao X (IPEX, do inglês Immunodeficiency, Polyendocrinopathy, and Enteropathy X-Linked Syndrome) e a síndrome de Loeys-Dietz. A IPEX é uma doença rara, causada por mutações no gene FOXP3, que determina desenvolvimento prejudicado de células T reguladoras CD4+CD25+. Além das condições de autoimunidade, os pacientes com IPEX apresentam alto risco de AAs, dermatite atópica e níveis elevados de IgE. A síndrome de Loeys-Dietz, resulta de mutações nos genes que codificam componentes da via de sinalização do TGF-β, como o TGFBR1 ou TGFBR295.
Outros exemplos são representados pelas doenças monogênicas causadas por genes envolvidos na formação e manutenção da barreira cutânea, nas quais a sensibilização pode ocorrer através de uma barreira cutânea deficiente, como a síndrome de Comel-Netherton. Esta síndrome é causada por mutações autossômicas recessivas no inibidor de serina protease Karzal tipo 5 (SPINK5), que codifica o inibidor linfoepitelial relacionado ao tipo Kazal (LEKTI, do inglês Lympho-epithelial Kazal-type-related inhibitor) e está envolvido na regulação da descamação. A síndrome de Comel-Netherton é caracterizada por cornificação defeituosa, inflamação crônica da pele, barreira cutânea prejudicada e múltiplas alergias, incluindo AA99,100. A ligação entre AA e doenças de pele hereditárias monogênicas reforça que é possível a sensibilização através de uma barreira cutânea deficiente.
Nesse contexto, o papel da AA na marcha atópica, que consiste na progressão de doenças alérgicas (dermatite atópica, AA, rinite alérgica e asma) não é bem compreendido, mas foi estabelecida uma forte associação entre AA e dermatite atópica. Na hipótese da exposição dupla: a barreira epitelial cutânea danificada, como ocorre na dermatite atópica, facilita a exposição de alérgenos ao sistema imunológico, resultando em sensibilização e produção de anticorpos IgE para o alérgeno101. O risco de AA é seis vezes maior em crianças com dermatite atópica do que naquelas sem a doença. Em um estudo australiano, 50% das crianças com dermatite atópica de início precoce e grave tiveram AA comprovada por TPO aos 12 meses de idade102.
O risco de AA aumenta muito na dermatite atópica grave e de início precoce, especialmente nos primeiros quatro meses de vida. Em crianças com AA, o risco de desenvolver asma e rinite alérgica é duas a cinco vezes maior do que em crianças sem AA, e tem sido maior em crianças com AA múltipla e AA grave103105. Como as células dendríticas do trato digestório são tolerogênicas, o ideal é que o lactente seja primeiramente exposto aos alimentos por via oral101.
Assim, há evidências da influência genética no desenvolvimento da AA, mas os genes envolvidos, suas funções e mecanismos fisiopatológicos ainda não estão totalmente estabelecidos, sendo necessários mais estudos para identificar associações genéticas e suas interações com fatores ambientais. Abordagens integrativas, incluindo genética com transcriptômica, proteômica e metabolômica, devem trazer novos dados, importantes para a evolução dos conhecimentos.
Epigenética
A rapidez com que vem ocorrendo o aumento da prevalência da AA nas últimas cinco décadas demonstra a importância da influência ambiental na sua ocorrência, como evidenciado em estudos com gêmeos emigrantes para os EUA, que apresentaram diferenças marcantes na incidência de alergias em relação aos seus irmãos que permaneceram nos seus países de origem95,106.
As interações entre o ambiente e a genética podem ser mediadas por mecanismos epigenéticos, que envolvem modificações químicas do próprio DNA e modificações nas proteínas que estão associadas a ele. Cada uma dessas modificações age como um sinal de regulação e modulação na expressão genética. A regulação da expressão gênica pode ser exercida por três mecanismos epigenéticos diferentes: modificações de histonas, metilação do DNA e miRNAs (RNAs não codificantes que se ligam ao mRNA e bloqueiam a tradução de proteínas, também denominados microRNAs)98,107,108.
Entre os fatores ambientais, merecem destaque o tipo de parto, o aleitamento materno, a exposição a alérgenos alimentares, os hábitos dietéticos, a ingestão de vitamina D, a poluição, os fatores relacionados à higiene, a exposição a animais de estimação, uso de medicamentos, como antibióticos e inibidores da bomba de prótons, entre outros fatores, que representam o expossoma, definido como a medida cumulativa das influências ambientais e respostas biológicas associadas ao longo da vida109-111. Por exemplo, crianças que vivem em fazendas e que têm contato frequente com animais têm menos probabilidade de desenvolver doenças alérgicas em comparação com crianças criadas nas cidades. Crianças com irmãos mais velhos e aquelas que frequentam creches nos primeiros anos de vida ou que possuem cães de estimação também têm menor probabilidade de desenvolver AAs108.
Na relação entre genética e ambiente, o microbioma e os primeiros mil dias de vida (da gestação aos dois anos de idade) representam uma "janela de oportunidades" ou uma "janela de suscetibilidades", na qual fatores ambientais, incluindo aspectos nutricionais, infecções microbianas e particularidades da microbiota intestinal, podem influenciar o risco de desenvolver alergias ou contribuir para a tolerância, por meio de mecanismos epigenéticos106,109.
Microbioma
Mais recentemente, eubiose e disbiose do microbioma têm sido muito estudados como determinantes de saúde e doença, incluindo as AAs111.
A microbiota humana forma-se e consolida-se predominantemente nos primeiros três anos de vida, sendo constituída progressivamente, em número e diversidade de microrganismos, desde a fase intrauterina, e, especialmente, a partir do momento do nascimento. Diversos fatores podem influenciar este processo, como o tipo de parto, uso de antibióticos (pré ou pós-natal), condições socioculturais e geográficas e, sobretudo, fatores nutricionais (dieta, aleitamento infantil, padrão de introdução de alimentos sólidos)107,112,113.
Duas fases são determinantes para o estabelecimento da microbiota intestinal. A primeira ocorre logo após o nascimento, durante a lactação, e resulta em dominância da microbiota intestinal por Bifidobacterium. Na segunda fase, quando as crianças começam a consumir alimentos sólidos, elas apresentam uma maior diversidade de espécies de bactérias, que incluem Enterococos, enterobactérias, Clostridium, Firmicutes, Streptococus e Bacteroides, resultando no estabelecimento de um microbioma complexo do tipo adulto113. Enquanto a microbiota intestinal de lactentes nascidos de parto normal se assemelha à microbiota vaginal de suas mães, que é dominada principalmente por Lactobacillus, a microbiota de lactentes nascidos por cesariana é mais semelhante à microbiota da pele, dominada por Staphylococcus e Clostridium, entre outros114. A colonização da pele por Staphylococcus aureus, um marcador de eczema mais grave, também está associada à sensibilização a alérgenos alimentares. Independentemente da gravidade do eczema essa colonização foi associada à sensibilização ao ovo de galinha e ao amendoim e à alergia persistente, com uma relação mais fraca observada para o LV, entre crianças até seis anos de idade. A exposição a endotoxinas domiciliares esteve associada a uma maior sensibilização ao alérgeno alimentar105,110,111.
Foi demonstrado que na microbiota intestinal de crianças com AA, há redução de bactérias produtoras de butirato, acompanhada de colonização por Clostridium paraputrificum e C. tertium. Além disso, existem diferenças na composição da microbiota intestinal de crianças que superam a AA nos primeiros oito anos de vida e aquelas que não o fazem: no primeiro grupo, Firmicutes são mais prevalentes, enquanto que no segundo há maior abundância de Bacteroidetes109.
Estas observações podem ser compreendidas pela forte relação que existe entre dieta, microbioma, barreira intestinal, resposta imune e epigenética. Metabólitos derivados da microbiota podem ser usados como substratos epigenéticos, que podem modificar a expressão gênica sem alterar as sequências do ácido desoxirribonucleico (DNA). Bifidobacterium e Lactobacillus são capazes de produzir folato, molécula essencial envolvida nos processos de metilação. Mudanças na composição bacteriana podem alterar o status de metilação do DNA do hospedeiro. Ao mesmo tempo, os ácidos graxos de cadeia curta (AGCCs), produzidos por micróbios comensais durante os padrões de fermentação, são capazes de influenciar as modificações das histonas109.
Alterações precoces na composição da microbiota intestinal e o aumento da permeabilidade da barreira epitelial intestinal promovem a resposta alérgica. Foi demonstrado que a sensibilização alimentar está associada à redução na diversidade microbiana intestinal, juntamente com o aumento na abundância de Enterobacteriaceae e diminuição de Bacteroidaceae e Ruminococcaceae. O uso excessivo de antibióticos é um importante fator de risco na indução de disbiose intestinal, pois altera a diversidade microbiana intestinal. As bactérias comensais intestinais desempenham um papel fundamental na modulação da tolerância imunológica, reduzindo as populações de basófilos circulantes, promovendo integridade da barreira epitelial e indução da diferenciação de células Treg. A disbiose da microbiota intestinal está relacionada à inflamação sistêmica e local, causando danos na barreira intestinal, com redução de bactérias benéficas, aumento da suscetibilidade e gravidade da AA. Evidências recentes sugerem que uma dieta com alto teor de gordura pode promover um aumento na produção de substâncias alergênicas no trato gastrointestinal, resultado de um desequilíbrio na microbiota intestinal, caracterizado pela alteração na proporção entre bactérias benéficas (eubióticas) e potencialmente prejudiciais (disbióticas)109.
Cada vez mais evidências sugerem que o equilíbrio da microbiota intestinal humana e a integridade da barreira intestinal podem desempenhar um papel significativo no desenvolvimento da AA. Fatores ambientais, incluindo a industrialização e o consumo de alimentos altamente processados, podem contribuir para alterar a microbiota intestinal e a barreira intestinal, aumentando a suscetibilidade à sensibilização alérgica. O aumento da permeabilidade da barreira intestinal permite a translocação de moléculas alergênicas, desencadeando respostas imunes Th2. Em condições fisiológicas, a eubiose favorece a diferenciação de linfócitos T em células Treg, que promove tolerância imunológica. Por outro lado, no contexto de uma barreira intestinal permeável e disbiose intestinal, as citocinas derivadas do epitélio, como a TSLP, IL-33 e IL-25 são liberadas, o que promove um microambiente pró-alérgico ao estimular células linfoides inatas do tipo 2 (ILC2), que libera citocinas perfil Th2, criando ambiente favorável à diferenciação de célula T em Th2 e maior liberação de citocinas inflamatórias (por exemplo, IL-4, IL-5 e IL-13). Além disso, a microbiota intestinal disbiótica induz a diferenciação de células Th2, promovendo o processo de troca de classe de IgE pelas células B. Após a sensibilização a um alérgeno alimentar específico os anticorpos IgE específicos ao alérgeno fixam na superfície de basófilos e mastócitos. Com a exposição subsequente ao alérgeno, essas células liberam histamina e outros mediadores pró-inflamatórios (por exemplo, leucotrienos e citocinas do tipo 2), aumentando a permeabilidade intestinal e ampliando a inflamação115.
Ademais, a atuação da microbiota intestinal no organismo humano não é restrita ao próprio intestino. Ela influencia as células do sistema imune de mucosas, incluindo células dendríticas, células linfoides inatas, células T e outras, que atuam no intestino e migram para outros sítios para contribuir para a defesa do hospedeiro107.
Os microrganismos intestinais produzem metabólitos de pequenas moléculas, ligantes para receptores de reconhecimento padrão, como os "MAMPs" (do inglês, microbe-associated molecular pattern), vesículas extracelulares, neurotransmissores e hormônios que podem entrar na circulação sanguínea e linfática, onde afetam o desenvolvimento e a função das células imunológicas em órgãos distantes. A comunicação de longa distância pela microbiota intestinal também pode ocorrer por comunicações neuronais entre o intestino e outros órgãos, incluindo o cérebro, pelo eixo intestino-cérebro. Compostos derivados da microbiota são detectados pelo sistema nervoso entérico, e a sinalização aferente pelo nervo vago pode permitir respostas sistêmicas coordenadas pelo sistema nervoso central116. Todos esses mecanismos podem estar envolvidos no processo de tolerância imunológica, que promove uma resposta imune Th1 a estímulos antigênicos e microrganismos não patogênicos encontrados no meio ambiente intra e extra corporal, a partir do nascimento. Uma redução na resposta Th1, com consequente manutenção e incremento da resposta Th2, é encontrada nas crianças de risco para doenças atópicas113,114.
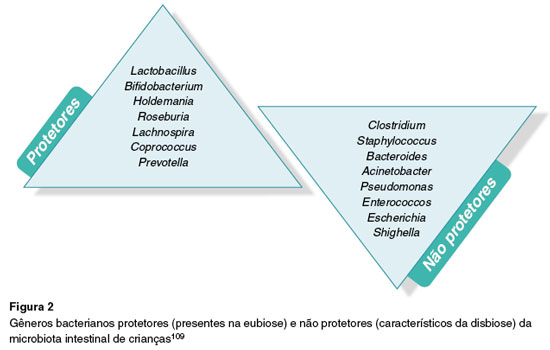
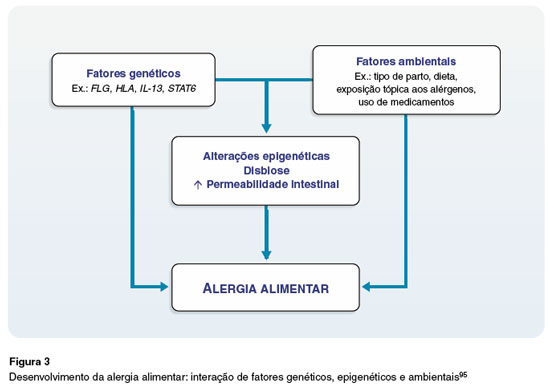
A Figura 2 demonstra os gêneros bacterianos protetores (presentes na eubiose) e não protetores (característicos da disbiose) da microbiota intestinal de crianças, e a Figura 3 ilustra a interação entre a genética, a epigenética e os fatores de risco ambientais associados à AA.
História natural das alergias alimentares
Conhecer a história natural da doença AA é importante para a decisão do melhor momento para avaliação da tolerância oral117. As alergias a LV, ovo, soja e trigo tendem a ter resolução mais precoce (geralmente na infância) e as alergias a castanhas, amendoim, peixes e crustáceos costumam ser mais persistentes117,118.
Porém, as AAs de modo geral, estão mais graves e mais persistentes nas últimas décadas119-121. Por muitos anos foi visto que as AAs em adultos geralmente se iniciavam na infância e persistiam; porém, o número de pacientes com AA de início na vida adulta também está aumentando, mesmo para ovo e LV120.
A história natural da doença varia de acordo com o alimento, idade de início e com o fenótipo e o endotipo. As alergias persistentes usualmente têm manifestações clínicas mais graves, início precoce, presença de história pessoal de atopia, história de alergia a múltiplos alimentos, doses mais baixas de alimento para desencadear reação, não tolerância aos alimentos assados e níveis mais altos de IgE sérica específica121.
As alergias mediadas por IgE são mais persistentes, enquanto nas alergias tardias, a aquisição de tolerância ocorre mais cedo, embora 30% persistam com alergia após os dois anos de idade120.
Alergia não mediada por IgE
Sem dúvida a APLV é a mais comum das alergias que cursa com as manifestações não mediadas por IgE citadas a seguir121.
Proctocolite alérgica
A proctocolite alérgica em geral se resolve no primeiro ano de vida, porém, algumas crianças podem adquirir tolerância apenas próximo aos três anos de idade122.
Cetinkaya e cols., em estudo prospectivo com 185 crianças com proctocolite alérgica, relataram como fatores preditivos de desenvolvimento tardio de tolerância: alergia não mediada por IgE a múltiplos alimentos, alergia mediada por IgE associada, uso de fórmula infantil com proteína intacta do LV antes do início da alergia e retardo no início da alimentação complementar123.
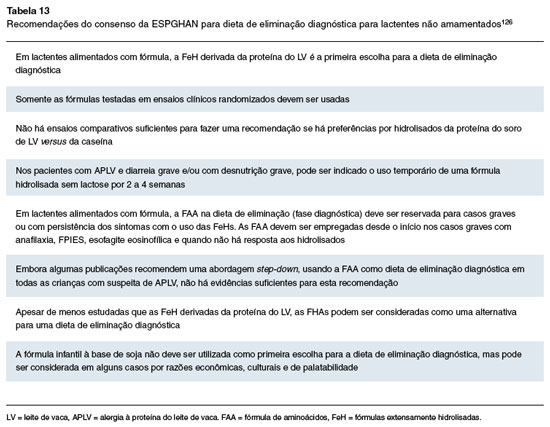
A maioria dos guias internacionais de tratamento (European Academy of Allergy and Clinical Immunology - EAACI, World Allergy Organization - WAO, Diagnosis and Rationale for Action against Cow's Milk Allergy - DRACMA, guidelines update, European Society for Paediatric Gastroenterology Hepatology and Nutrition - ESPGHAN) sugerem pelo menos seis meses de dieta de exclusão ou entre os nove e 12 meses de idade para avaliação de tolerância na proctocolite alérgica. Por outro lado, o grupo italiano sugere avaliar tolerância ao alimento três meses após o último sangramento nas fezes, e até discute se a dieta seria realmente necessária para estes pacientes124-127.
Enterocolite induzida por alergia alimentar (FPIES)
O TPO para avaliação de tolerância na FPIES (do inglês - Food Protein Induced Enterocolitis Syndrome) é recomendado a cada 12 a 18 meses após a última reação, porém, a taxa total de remissão da FPIES situa-se entre 50% e 90% aos seis anos de idade. A FPIES atípica (com presença de sensibilização alérgica) tem pior prognóstico. A FPIES pode iniciar na vida adulta e seu curso natural nessa faixa etária precisa ser mais bem estudado122,128.
Enteropatia induzida por proteína alimentar (FPE)
Na FPE as crianças devem ser reavaliadas aos 12 meses, e a maioria dos casos resolve entre um e três anos de idade122.
Alergia mediada por IgE
Existem taxas calculadas para aquisição de tolerância para cada alimento, a partir de estudos com diferentes métodos e populações.
De uma maneira geral, pode-se dizer que aproximadamente 70% a 80% dos pacientes com alergia a LV, ovo, soja e trigo têm sua alergia resolvida até os 16 anos. Cerca de 50% se resolvem até os cinco anos117,119,129-132.
A maioria dos pacientes tolera o alimento assado, visto que 69% a 83% toleram o LV em formas assadas, e 63% a 84% toleram o ovo em formas assadas. Tolerar os assados pode indicar um fenótipo mais leve e transitório do quadro alérgico133,134.
Para o gergelim e o amendoim, estudos mostram que apenas entre 20% e 30% das crianças atingem tolerância até os cinco anos117. Quanto ao peixe, 26% das crianças alérgicas podem adquirir tolerância até os cinco anos117, enquanto para as castanhas, um estudo retrospectivo mostrou taxa de resolução variando entre 9% e 14%135.
A maioria dos pacientes que iniciaram alergia a amendoim, castanhas e crustáceos na infância persistem com a alergia na vida adulta. Apenas 4% dos pacientes com alergia a crustáceos evoluem com tolerância natural117.
A chance de manifestar a síndrome da alergia pólen-alimento (FPAS, do inglês food-polen allergy syndrome) ou SAO (síndrome da alergia oral) aumenta com a idade, e elas tendem a ser persistentes117.
A melhor compreensão da história natural das AAs e o conhecimento dos fatores preditores de alergia persistente podem colaborar no desenvolvimento de novas terapias e na melhor condução destes pacientes117.
Prevenção
Medidas ambientais
Evidências recentes indicam que, à parte da predisposição genética, um conjunto de fatores ambientais que envolvem dieta, hábitos de vida e qualidade atmosférica contribuem para o aumento das doenças alérgicas. Em quaisquer destes contextos, o racional se respalda na modificação da microbiota intestinal. De forma geral, a presença abundante de lactobacilos e bifidobactérias parece estar relacionada à proteção das doenças atópicas devido à capacidade de inibir respostas do tipo Th2. Por outro lado, a colonização precoce por Clostridium difficile e Staphylococcus aureus foi associada ao desenvolvimento posterior de hipersensibilidade a alimentos136. Barker e cols. propuseram a teoria de que os primeiros 1000 dias de vida funcionariam como um período crítico, quando uma série de fatores estariam relacionados com o desenvolvimento de doenças crônicas em crianças geneticamente predispostas137. Utilizando abordagem distinta, Haahtela aborda que a falta de contato com a natureza e o estilo de vida moderno também predispõem para um desequilíbrio imunológico e consequente indução das doenças alérgicas e inflamatórias138.
Neste contexto, a intervenção sobre alguns fatores contornáveis poderia funcionar como possível medida protetora no desenvolvimento das AAs ou, segundo alguns autores, até mesmo reverter alguns efeitos negativos instalados139.
Posto isso, algumas estratégias poderiam funcionar como oportunidades de minimizar o aparecimento das AAs, conforme especificado a seguir.
Priorizar parto normal sempre que possível
A translocação de microrganismos maternos por via transplacentária e canal vaginal consiste em importante via para a colonização intestinal da criança desde as primeiras horas de vida. Evidências apontam para risco duas vezes maior de alergia a LV e ovo em bebês nascidos por parto cesariana140.
Coibir o uso indiscriminado/desnecessário de antibióticos nos primeiros meses de vida.
Evidências apontam para a clara associação entre antibióticos e desfechos alérgicos. A capacidade das drogas em modificar a microbiota parece ser prolongada: penicilinas e cefalosporinas estão mais associadas com AAs nos primeiros anos de vida, enquanto o efeito dos macrolídeos se perpetua até fases mais tardias da infância141.
Contato com a natureza.
A evolução cultural e hábitos modernos de vida indoor distanciaram o contato com a natureza e a interação com a biodiversidade. A exemplo do que a hipótese de higiene argumenta, a privação do convívio com agentes microbianos poderia ocasionar o desbalanço do microbioma, consequente distúrbio da resposta imunológica e subsequente explosão de doenças alérgicas e inflamatórias.
O contato com a natureza deve ser estimulado sempre, pelos inúmeros benefícios físicos e mentais que pode oferecer138.
Dietas na gestação e na lactação
Nas últimas décadas, mudanças ocorreram nas diretrizes de prevenção da AA. Essas alterações incluíram a compreensão sobre a interconectividade da nutrição, microbioma, sistema imunológico e epigenética, destacando os avanços alcançados no conhecimento sobre aconselhamento dietético na dieta materna durante a gravidez, no estímulo à amamentação e na idade de introdução da alimentação complementar142.
Anteriormente, as diretrizes de prevenção de alergias recomendavam que grávidas e lactantes de famílias de alto risco para desenvolver alergias, deveriam evitar amendoim e outros alérgenos alimentares143. Em 2018, uma metanálise conduzida pela Food Standards Agency (FSA), no Reino Unido, resumiu cinco ensaios clínicos e concluiu que não existiam evidências de que evitar alérgenos alimentares na gravidez estivesse associado à redução de AA144. Até o momento, também não há recomendações para restrição alimentar para mães que amamentam a fim de prevenir a AA145. A restrição alimentar durante a gestação e amamentação pode comprometer a saúde materna e fetal146,147.
Não existem evidências sugestivas de que, durante a gravidez e a amamentação, gestantes e lactantes devam comer alimentos específicos se não fizerem parte da dieta habitual. Recomendações relacionadas à suplementação vitamínica, incluindo a vitamina D, ou com óleo de peixe, e o uso de prebióticos, probióticos e simbióticos em gestantes e lactantes saudáveis, para prevenção de AA, precisam de mais investigações148.
Segundo o preconizado pelo Protocolo de Uso do Guia Alimentar para a População Brasileira na Orientação Alimentar de Gestantes, lançado em 2021, como um instrumento de apoio à prática clínica no cuidado individual das gestantes, na gestação é particularmente relevante o consumo de uma grande variedade de alimentos in natura e minimamente processados e água para suprir a necessidade de nutrientes fundamentais para esse momento da vida, como ferro, ácido fólico, cálcio, vitaminas A e D, entre outros. A alimentação saudável na gestação favorece o bom desenvolvimento fetal e a saúde e o bem-estar da gestante, além de prevenir o surgimento de doenças, como diabetes gestacional, hipertensão e ganho de peso excessivo. Isso se aplica independentemente do risco de AA do lactente149-151.
Aleitamento materno
O aleitamento materno é universalmente reconhecido como uma das melhores estratégias em saúde pública para a sobrevivência infantil, pois aumenta o vínculo mãe-filho, e é considerado o padrão ouro para a nutrição de crianças. O ato de amamentar permite um maior contato pele a pele, facilitando a colonização bacteriana do bebê e a formação do seu sistema imunológico152. Por esta razão, a Organização Mundial de Saúde (OMS), o Ministério da Saúde (MS) e a Sociedade Brasileira de Pediatria (SBP) recomendam o aleitamento materno até os dois anos de idade, devendo ser exclusivo até os seis meses de vida no Brasil150,151,153.
O leite materno humano (LM) contém macro e micronutrientes e sua composição varia de acordo com fatores ambientais. O colostro tem baixo teor de gordura, mas é rico em proteínas e relativamente rico em componentes imunoprotetores. Micronutrientes, hormônios e fatores de crescimento também desempenham vários papéis no desenvolvimento infantil. Comunidades microbianas e microRNAs ajudam a construir o sistema imunológico infantil154. A presença dos oligossacarídeos (HMO) do leite materno, glucanas complexas não digeríveis pelo organismo humano, mas que constituem o principal substrato para o microbioma, principalmente as bifidobactérias, tem papel fundamental para a proliferação da população de bactérias benéficas no trato gastrintestinal da criança, tanto pelos efeitos probióticos como prebióticos145. Entretanto, embora o LM seja conhecido pelos seus efeitos benéficos na microbiota intestinal e no sistema imunológico do lactente, seu papel na prevenção da AA ainda permanece sem comprovação148.
Há estudos que mostram efeito protetor, nenhum efeito ou até mesmo um efeito predisponente da amamentação para o desenvolvimento de AA. Revisão sistemática recente identificou cinco coortes prospectivas, que examinaram a ligação entre amamentação e alergia na população em geral e dois estudos focados em lactentes com risco aumentado para doença alérgica. No geral, o risco relativo (RR) para APLV variou entre 0,38 e 2,08, mas a evidência foi baixa e faltavam critérios para o diagnóstico155. Outra revisão sistemática não encontrou associação entre a amamentação e distúrbios alérgicos, como asma ou eczema145.
A EAACI (do inglês European Academy of Allergy and Clinical Immunology)156 e a FSA (Food Standards Agency), no Reino Unido, concluíram de suas revisões sistemáticas que o LM não reduz o risco de AA144. Essa conclusão é ainda apoiada por recomendações da Academia Americana de Pediatria e da Academia Americana de Asma, Alergia e Imunologia/ Colégio Americano de Alergia e Asma e Imunologia/ Sociedade Canadense de Alergia e Imunologia Clínica (AAAA/ACAAI/CSACI) 2020, bem como da Sociedade Japonesa e Australiana de Alergia e Imunologia Pediátrica157-159.
Em resumo, não se recomenda que gestantes nem lactantes excluam quaisquer alimentos da sua dieta, e faltam dados que apoiem o consumo ativo de alimentos alergênicos para a prevenção de AA. O aleitamento materno deve sempre ser apoiado, pelos inúmeros benefícios que proporciona à mãe, ao lactente e ao planeta.
Alimentação complementar
A alimentação complementar é definida como o conjunto de alimentos sólidos ou semissólidos ofertados no período de transição alimentar, momento em que a criança passa a não ter suas necessidades nutricionais supridas unicamente pelo leite materno (ou fórmula infantil, quando necessária). A partir dos seis meses de idade, outros alimentos devem fazer parte da refeição da criança com a transição para as refeições dos familiares e introdução completa de alimentos até os 12 meses150,151,153. Com esses marcos, pode-se definir para a nossa população, a introdução precoce como a oferta de alimentos complementares entre quatro e seis meses de idade.
Recomendações de outros países e entidades médicas podem diferir da preconizada pela OMS e pelo Brasil150,151,153. A ESPGHAN recomenda o início da introdução dos alimentos complementares entre quatro e seis meses de idade (17º e 26º semanas de vida), não devendo introduzi-los antes dos quatro, nem atrasar para além dos seis meses160.
Há duas décadas, acreditava-se que a sensibilização alérgica a alimentos era facilitada pela exposição oral no início da vida e, portanto, prevenir AA traduzia-se em retardar a introdução dos alimentos potencialmente alergênicos161. Entretanto, a despeito do atraso nessa introdução, a prevalência da AA continuava aumentando, o que levou especialistas a reavaliar as recomendações e a elaborar novas estratégias de prevenção, uma delas com foco no momento ideal da introdução dos alimentos alergênicos na dieta das crianças161,162.
Ensaios clínicos randomizados controlados com placebo foram elaborados para avaliar o efeito preventivo da introdução precoce de alguns alimentos na AA. Entre as evidências havia diversidades metodológicas relacionadas ao tipo do alimento escolhido, à sua forma de apresentação, à dose de proteína alergênica consumida e ao desfecho procurado163-169. Essas diferenças geraram conclusões variadas, por vezes antagônicas, e nem sempre comparáveis170.
A heterogeneidade dos ensaios randomizados associada às diferenças na epidemiologia da alergia ao amendoim e na forma do seu consumo entre os países, e às normas de introdução da alimentação complementar de cada país geraram distintas recomendações. As diretrizes da EAACI, atualizadas em 2020, sugeriram, em populações de alta prevalência de alergia ao amendoim, a sua introdução dos quatro aos 11 meses de idade, de forma adequada à idade para evitar risco de anafilaxia ou aspiração. Houve recomendação de consumo de 2 g de proteína do amendoim ou mais a cada semana. Para países com baixa prevalência de alergia ao amendoim, como o Brasil, não foram feitas recomendações, devendo ser introduzido na dieta de acordo com os hábitos alimentares da região156. As AAAAI, ACAAI e CSACI publicaram, em 2021, consenso sobre a prevenção primária da AA. Recomendaram que todos os lactentes, independentemente do risco, deveriam ser expostos ao ovo cozido e ao amendoim por volta dos seis meses de idade157.
Quanto ao ovo, a EAACI orientou a introdução de ovo de galinha cozido, mas não ovo cru ou pasteurizado. A quantidade inicial sugerida é de meia unidade de ovo cozido (por 10 a 15 minutos), duas vezes por semana, devendo ser introduzido ao iniciar-se a alimentação complementar156. As diretrizes da Sociedade Britânica de Alergia e Imunologia Clínica (do inglês British Society of Allergy and Clinical Immunology - BSACI) sugeriram que ovo e amendoim poderiam ser introduzidos, como parte da dieta familiar, a lactentes de alto risco, entre quatro e seis meses de idade. Porém, recomendaram a introdução do ovo antes da introdução do amendoim, porque a sensibilização ao ovo parece ocorrer previamente173.
Embora tenham ocorrido algumas reações alérgicas no estudo LEAP (do inglês - Learning early about peanut allergy), não existe recomendação de testes para pesquisa de IgE específica para alimentos como rotina para a introdução alimentar163. A excepcionalidade da AA, nessa situação, não justificaria essa recomendação, difícil de ser implantada em termos de saúde pública e que poderia, inclusive, trazer prejuízos pelo retardo na introdução alimentar. Entretanto, pode ser uma opção para famílias hesitantes, de acordo com a preferência do médico e da família, de forma individualizada157.
Estudos sobre prevenção de AA a outros alérgenos alimentares têm sido menos robustos e mostraram evidências de segurança, mas não necessariamente de eficácia172,173. Evidências sobre prevenção de outras doenças alérgicas são escassas e fracas e mais pesquisas são necessárias172,173.
Não há evidências de que a ordem de introdução dos diversos alimentos sólidos esteja relacionada a maior ou menor risco de AA174. Assim, a introdução alimentar oportuna deve seguir os hábitos dietéticos das famílias, permitindo que a criança tenha contato com todos os grupos alimentares entre seis e 12 meses de idade150,151,153. Venter e cols. demonstraram que o aumento na diversidade da dieta oferecida no primeiro ano de vida diminui a possibilidade de desenvolver AA. Ressaltam que para cada alimento alergênico adicional consumido, entre seis e 12 meses de vida, houve uma redução de 33,2% na probabilidade de AA nos primeiros 10 anos de vida175.
Frente à impossibilidade do aleitamento materno exclusivo, para lactentes que, por recomendações de um profissional de saúde, precisam de um substituto do leite materno, não há recomendação a favor ou contra o uso de fórmula infantil específica à base de LV após a primeira semana de vida para prevenir AA. A revisão da literatura concluiu que a introdução de fórmulas à base de LV após a primeira semana de vida não teve um impacto consistente no desenvolvimento de APLV na primeira infância156.
No Brasil, é recomendada a promoção do aleitamento materno de maneira exclusiva até os seis meses e complementado até os dois anos ou mais150,151,153,176. Introdução progressiva de alimentos, incluindo os alergênicos, deve ser implementada a partir dos seis meses e durante o primeiro ano de vida, de acordo com o desenvolvimento da criança177.
A alimentação complementar deverá seguir as recomendações vigentes, com oferta de todos os grupos alimentares, respeitando ideologia, cultura, condições socioeconômicas e hábitos familiares. Ressalta-se que não há evidência que justifique antecipar a introdução de alimentos alergênicos para antes dos seis meses e uma vez que o alérgeno seja introduzido, a ingestão frequente e continuada é necessária para manter tolerância.
Orientar dieta isenta de alimentos ultraprocessados.
Estudo recente demonstrou forte correlação entre alguns aditivos e emulsificantes, frequentemente incluídos na vasta lista de ingredientes de produtos ultraprocessados, com a disfunção das "tight junctions" do epitélio intestinal178. Este efeito promoveria um aumento da permeabilidade e absorção de fragmentos de proteínas com potencial alergênico.
Além disso, o consumo frequente de alimentos ultraprocessados também estaria relacionado à obesidade, síndromes metabólicas, inflamação sistêmica por estresse oxidativo e aumento na predisposição a doenças alérgicas de qualquer natureza179.
Fórmulas lácteas
O papel das fórmulas infantis, na prevenção ou como fator de risco de doenças atópicas, sofreu importantes modificações nas últimas décadas. As atuais diretrizes internacionais de AA não apoiam o uso de qualquer fórmula infantil para prevenção de AA126, o que contradiz os conceitos anteriores de que uma fórmula parcialmente hidrolisada (FpH) poderia reduzir o risco de eczema e que as fórmulas hidrolisadas poderiam prevenir o desenvolvimento da APLV. Assim, esta é uma mudança em relação às diretrizes anteriores que recomendavam o uso de fórmulas parcial e/ou extensamente hidrolisadas10.
Evidências até o momento sobre a relação entre fórmulas infantis e risco de AA são relacionadas a seguir.
- Não existem provas científicas convincentes de que evitar ou retardar a introdução de fórmulas infantis à base de LV reduz ou aumenta o risco de APLV em lactentes considerados de alto risco para doenças alérgicas.
- Não está claro se evitar o consumo regular de fórmula infantil à base de LV durante o início da vida reduz o risco de APLV em crianças.
- A complementação alimentar, ou seja, o fornecimento de qualquer tipo de fórmula infantil, além do leite materno, durante os primeiros dias de vida não é recomendado para a prevenção da APLV.
- Para lactentes com uma história familiar documentada de doença alérgica que não podem ser amamentados exclusivamente, não existem provas suficientes, no momento, para recomendar a utilização de rotina de FpH ou FeH (caseína ou proteína do soro) para prevenção da APLV.
- O papel da fórmula hidrolisada de arroz (FHA) na prevenção da APLV não foi estudado.
- Não há evidências para recomendar a fórmula infantil de soja com objetivo de prevenir a APLV126.
- O aleitamento materno deve ser sempre apoiado, a não ser que existam contraindicações ou situações que o impossibilite.
Nas situações nas quais o aleitamento materno não possa ser mantido, uma fórmula infantil derivada do LV deve ser recomendada, devido à falta de recomendações alternativas148.
Manifestações clínicas
Alergias mediadas por IgE
Os sintomas típicos de uma reação alérgica alimentar mediada por IgE geralmente têm início rápido e gravidade variável, e podem causar a morte. Por ser reação do tipo imediata, a identificação do alimento envolvido pode ser mais fácil, uma vez que a manifestação ocorre até duas horas após a ingestão do alimento. Somente excepcionalmente esse prazo pode se exceder como nas AAs induzidas por cofator ou anafilaxia pela carne de mamíferos devido a anticorpos IgE contra o oligossacarídeo galactose-alfa-1,3-galactose (alfa-gal), que podem se manifestar em até seis horas após a ingestão do alérgeno alimentar181. A descrição dos sintomas deve ser obtida em conjunto com a história alimentar detalhada.182 Devem estar incluídas perguntas sobre a ingestão alimentar habitual (refeições, lanches, bebidas); problemas de alimentação no seio/mamadeira, crescimento e alimentação em crianças e distúrbios alimentares em crianças mais velhas e adultos; índice de massa corporal (IMC) e perda de peso em adultos; e adequação dietética. Um histórico alimentar centrado na alergia também poderá identificar excesso de peso e subnutrição, deficiências de micronutrientes, se há ingestão equilibrada de macronutrientes e, em bebês e crianças pequenas, alterações de desenvolvimento, de competências alimentares e padrões alimentares de aversão183. O valor da história clínica é incontestável, no entanto pode superestimar a presença de AA e mais etapas diagnósticas são necessárias para confirmar o diagnóstico. A história clínica detalhada e focada na alergia permitirá estimar a probabilidade de um paciente ter AA mediada por IgE e orientar a seleção dos testes de alérgicos e sua interpretação4.
Os sintomas de AA mediada por IgE podem envolver quase todos os sistemas orgânicos, incluindo a pele, o trato respiratório, sistemas gastrintestinal, cardiovascular e neurológico (Tabela 4)4.

A pele é o principal órgão acometido nas manifestações agudas de AA mediadas por IgE, sendo urticas e angioedema os sintomas mais prevalentes. Urticária consiste em edema dérmico circunscrito, cercado por eritema que empalidece com a pressão e são caracteristicamente pruriginosos. As urticas resultam do extravasamento de líquido oriundo de pequenos vasos ou de capilares para a derme superficial e desaparecem em 30 minutos a 24 horas sem deixar mancha residual. Geralmente ocorrem imediatamente após a ingestão do alimento desencadeante e podem durar apenas algumas horas, sem tratamento. A recorrência acontece na dependência de nova exposição ao alimento. No angioedema, o processo é semelhante, mas há acometimento de porções mais profundas da pele que pode persistir por até 72 horas, e clinicamente se apresenta por edema em pálpebra, lábios e/ou face184.
É preciso lembrar que AA como causa de urticária ocorre em cerca de 20% dos casos de urticária aguda e em menos de 8% daqueles com urticária crônica, sendo necessário muito cuidado na valorização do alimento como fonte desencadeante. Por outro lado, a urticária pode ser o sintoma inicial de anafilaxia, uma vez que cerca de 90% dos pacientes que desenvolvem essa reação grave apresentam manifestações dermatológicas. A urticária de contato também é bastante descrita na alergia alimentar, sendo caracterizada pela formação da pápula no exato local ou bem próximo do contato do alimento com a pele. Vale destacar que a presença de urticária de contato não é necessariamente sinal de manifestação sistêmica de AA185,186. Ela é mediada por IgE e deve ser diferenciada do eczema de contato, resultante da exposição crônica a determinado alérgeno agressor, inclusive alimentos (doença profissional na maior parte dos casos), e resultante da resposta dos linfócitos T frente ao alérgeno alimentar185,186.
A urticária induzida por alimentos pode vir acompanhada de sintomas gastrintestinais ou respiratórios e, neste caso, caracteriza-se uma anafilaxia. Erupção macular eritematosa sem urticária também pode ser uma das manifestações. Erupções cutâneas eczematosas também podem ser um sintoma de AA mediada por IgE, embora mecanismos imunológicos não mediados por IgE também desempenhem um papel na sua gênese187.
Os sintomas respiratórios de AA mediados por IgE podem envolver o trato respiratório superior e inferior, porém raramente surgem como sintomas isolados. Manifestações respiratórias isoladas e recorrentes, em princípio não devem suscitar suspeita de etiologia alimentar, e causas mais prevalentes como alergias respiratórias devem ser consideradas188.
Manifestações laríngeas mediadas por IgE incluem pigarro, tosse, aperto na garganta, rouquidão e, nos casos mais graves, estridor laríngeo e obstrução de vias aéreas. O estridor é reconhecido como um som anormalmente agudo que ocorre na fase inspiratória devido ao edema no tecido laríngeo, podendo ter origem na região da supraglote, glote, subglote ou traqueia e, portanto, alerta para o risco de estreitamento da passagem das vias aéreas189.
O envolvimento gastrintestinal se manifesta por sintomas subjetivos e objetivos. Os subjetivos incluem coceira na boca ou garganta, náusea ou dor abdominal e os objetivos incluem vômitos e diarreia. O início desses sintomas é geralmente imediato, em minutos até não mais que duas a quatro horas. Sintomas como retardo de crescimento, diarreia com sangue, constipação, perda de peso, má-absorção prolongada, êmese ou diarreia após quatro horas de ingestão de alimentos não são observados em alergias mediadas por IgE26.
O envolvimento dos sistemas cardiovascular e neurológico produzem sinais e sintomas nas manifestações mais graves. Os sintomas subjetivos incluem tontura ou fraqueza; sinais objetivos podem incluir taquicardia, hipotensão, mudança no estado mental, colapso cardiovascular grave, inconsciência e morte. Os sintomas cardiovasculares e o envolvimento neurológico geralmente ocorrem com a participação de outros órgãos, como manifestações respiratórias ou cutâneas associadas189.
A anafilaxia é forma grave de reação alérgica de hipersensibilidade mediada por IgE que envolve múltiplos órgãos. A anafilaxia é de início rápido e potencialmente fatal. Os sintomas de anafilaxia podem incluir as reações cutâneas já mencionadas, juntamente com manifestações respiratórias, envolvimento do sistema gastrintestinal, cardiovascular ou neurológico. Embora seja rara, a anafilaxia também pode apresentar apenas sintomas cardiovasculares ou neurológicos, como tontura, fraqueza, taquicardia, hipotensão, colapso cardiovascular ou inconsciência189.
Muitos estudos mostraram que as manifestações clínicas diferem entre diferentes faixas etárias. Bebês com anafilaxia com mais frequência apresentam vômitos e urticária; crianças em idade pré-escolar têm sibilos e estridor. Sintomas subjetivos incluindo dificuldade em respirar ou dificuldade em engolir são os sintomas mais comuns de apresentação de anafilaxia em faixa etária de adolescente. Três por cento das crianças têm hipotensão inicial como sintoma de apresentação de anafilaxia190.
Não mediadas por IgE
Entre as manifestações das alergias não mediadas por IgE, os sintomas do lactente na primeira apresentação são fundamentais para o processo diagnóstico124. É importante considerar que podem ser variáveis e se sobrepor a queixas comuns na infância, tais como irritabilidade, choro, cólicas, gases, refluxo gastroesofágico, diarreia, constipação intestinal, presença de sangue nas fezes que podem não estar necessariamente relacionados à APLV, portanto o diagnóstico diferencial é muito importante124,191-194.
Muitas vezes, a falta de suspeição de que os sintomas possam ser alérgicos é responsável por diagnósticos tardios126. Por outro lado, o excesso de diagnósticos também é comum devido à ausência de biomarcadores definitivos para o diagnóstico de manifestações gastrintestinais e extraintestinais da APLV126.
Há algumas características especiais no grupo de APLV não mediadas por IgE leves ou moderadas, que representam os grupos mais frequentes. A pele é menos comumente envolvida e as manifestações cutâneas tendem a aparecer mais tarde durante a evolução, com lesões esparsas, assim como prurido e erupções cutâneas (rashes) não-específicas. Alguns pacientes com dermatite atópica podem apresentar piora após exposições repetidas ao alérgeno, principalmente nos primeiros seis meses de vida. Sintomas dermatológicos do tipo urticária, ao contrário, são muito comuns nas formas mediadas por IgE e são visíveis poucos minutos após o contato com o alérgeno83,124,195. Por outro lado, manifestações respiratórias isoladas são muito raras nas AAs não mediadas por IgE196-199.
Nas crianças maiores de um ano, com formas de alergia não mediadas por IgE, os sintomas podem ser mais sutis e, em geral, inespecíficos, como irritabilidade, fadiga, sono alterado, aumento da frequência de evacuações e curva de crescimento estacionária126,198. As crianças maiores, em geral, não têm sangue nas fezes, assim como outros sinais e sintomas significativos. Muitas vezes, esses pacientes são vistos como crianças normais, com sintomas sutis.
Ao exame físico é importante avaliar, em especial, os sinais de outras doenças alérgicas, como dermatite atópica, e realizar sempre o acompanhamento nutricional com avaliação do peso, altura, circunferência abdominal e perímetro cefálico121,199,200.
Ao contrário das alergias imediatas, as tardias são responsáveis por sintomas crônicos ou subagudos. Os tipos diferentes de doenças incluídas neste grupo têm achados clínicos que se confundem, mas podem ser distinguidas por suas características clínicas, idade de início, gravidade e história natural123,199.
Vale lembrar que no primeiro ano de vida, as proteínas do LV ocasionam a maioria dos casos de AA, frequentemente, com o acometimento do tubo digestivo. Na Tabela 5 são apresentadas as principais manifestações clínicas da AA não mediadas pela IgE126. Em geral, na dependência do conjunto de sinais e sintomas, a AA não mediada por IgE pode ser distribuída nas seguintes formas de apresentação clínica:
1. dismotilidade digestiva induzida por alergia à proteína da dieta;
2. proctocolite alérgica induzida pela proteína alimentar (FPIAP, do inglês food protein induced alergic proctocolitis);
3. enteropatia induzida por proteína alimentar;
4. síndrome da enterocolite induzida pela proteína alimentar (FPIES).
Dismotilidade digestiva induzida por alergia à proteína da dieta
Os sinais e sintomas da dismotilidade digestiva induzida por alergia às proteínas da dieta são inespecíficos e podem resultar de anormalidade na interação neuro-imuno-inflamatória e da alteração da permeabilidade intestinal. Em geral, é desencadeada pela proteína do LV no primeiro ano de vida, especialmente nos primeiros seis meses, mas pode ocorrer em outras faixas de idade124,126,192,195,198.
Apesar de um mecanismo imunológico não ter sido claramente especificado em todas as condições clínicas, uma parcela dos pacientes com quadro clínico de distúrbios da motilidade digestiva parece se enquadrar, na realidade, na AA não mediada por IgE124,126. Nestes pacientes observa-se melhora sintomática após a eliminação da proteína alergênica da dieta, e a recorrência após a reintrodução ou durante um TPO. Vários sintomas gastrintestinais inespecíficos podem apresentar este comportamento (melhora com exclusão e recorrência na reintrodução), entre os quais regurgitação, vômitos, cólica, irritabilidade, choro, desconforto abdominal, engasgos, recusa alimentar, flatulência excessiva, fezes amolecidas e frequentes, constipação intestinal e disquesia. Esses sintomas inespecíficos podem ocorrer em lactentes sem outras manifestações clínicas e que apresentam ganho de peso normal124,126. Além desses sintomas, pode haver erupções cutâneas (rash), pruridos, eritemas, e dermatite atópica moderada ou grave.200 Pouca evidência científica apoia o papel de alérgenos alimentares nessas formas de apresentação clínica, indicando que estudos adicionais são necessários para melhor compreensão do mecanismo pelo qual os alimentos ocasionam estes sintomas. Como não há exames laboratoriais disponíveis que possam diagnosticar com precisão a APLV não mediada por IgE, é importante que se faça um diagnóstico correto para evitar, tanto a dieta de exclusão desnecessária, como as repercussões negativas ocasionadas pela falta do diagnóstico e tratamento adequados201-203.
Refluxo gastroesofágico secundário à alergia às proteínas do leite de vaca
No lactente, a diferenciação entre a regurgitação do lactente (distúrbio gastrintestinal funcional ou distúrbio da interação entre o cérebro e intestino), doença do refluxo gastroesofágico (DRGE) e refluxo gastroesofágico secundário à APLV representa um dos problemas diagnósticos mais difíceis na assistência pediátrica, e vem sendo discutido há mais de duas décadas204,205.
Acredita-se que, em até a metade dos lactentes, as manifestações de DRGE são secundárias à APLV (Tabela 5). Por outro lado, regurgitação, choro ou cólicas, que se incluem entre os critérios para diagnóstico dos distúrbios gastrintestinais funcionais (distúrbios da interação cérebro-intestino) podem ocorrer em mais de 50% dos lactentes, fazendo parte do desenvolvimento normal do trato gastrintestinal que ocorre nos primeiros anos de vida206,207. Assim, é fundamental, não confundir a regurgitação do lactente e outros sintomas digestivos isolados que representam uma situação fisiológica, benigna e autolimitada que desaparece espontaneamente ao longo do primeiro ano de vida, com DRGE e APLV124,126,205,208.
Na DRGE secundária à APLV sugere-se que a proteína seja a causa do retardo no esvaziamento gástrico, distensão e disritmia gástrica, provocando aumento no número de episódios de refluxo209. Não há evidências convincentes que sustentem mecanismos imunológicos nesta situação clínica, no entanto, há muitas evidências de que a exclusão das proteínas da dieta se acompanha por redução expressiva dos sintomas.
Neste contexto, as diretrizes da NASPGHAN (do inglês North American Society of Pediatric Gastroenterology, Hepatology and Nutrition) e da ESPGHAN publicadas em 2009210 e 2018211 recomendam a exclusão da proteína do LV para os lactentes que não melhoram com medidas posturais e dietéticas destinadas ao tratamento do lactente com regurgitações e vômitos persistentes, antes da utilização da inibição medicamentosa da secreção ácida gástrica. De acordo com as diretrizes da NASPGHAN/ESPGHAN205,210, regurgitação frequente e persistente, mesmo como sintoma isolado, pode ser a única manifestação de APLV205,210. Por essa razão, nas crianças em aleitamento materno pode ser recomendada dieta de exclusão para a mãe e nos lactentes em aleitamento artificial, a prescrição de fórmulas extensamente hidrolisadas ou de aminoácidos em substituição às fórmulas com proteínas íntegras do LV205,210.
No Brasil, prevalece a recomendação das fórmulas com proteínas extensamente hidrolisadas como primeira opção para este cenário clínico83,195. Nesta situação, é obrigatória a confirmação da recorrência dos sintomas em reexposição após duas a quatro semanas, ou seja, após o período de recuperação em dieta de eliminação deve ser reintroduzida a fórmula com proteína íntegra e ocorrer o reaparecimento das manifestações clínicas. Na interpretação da resposta à exclusão e reintrodução da proteína do LV na dieta, deve ser considerado que as fórmulas hipoalergênicas hidrolisadas ou de aminoácidos apresentam maior velocidade de esvaziamento gástrico e digestibilidade não relacionadas especificamente com alergia alimentar195,209.
Cólica do lactente secundária à alergia às proteínas do leite de vaca
Em geral, a cólica do lactente é um distúrbio gastrintestinal funcional observado entre a segunda semana e os cinco meses de vida. Sua etiologia é multifatorial, conjugando fatores gastrintestinais, como imaturidade intestinal, aumento da motilidade, controle autonômico instável, alterações na microbiota intestinal, fatores relacionados ao sistema nervoso central, ciclo do sono e fatores ambientais126,212.
Na prática, observa-se que alguns lactentes melhoram da cólica com a exclusão das proteínas do LV na dieta da mãe (no caso de aleitamento natural) ou substituição da fórmula infantil com proteínas íntegras por uma fórmula hipoalergênica (Tabela 5). Nestes casos, a possibilidade de APLV deve ser aventada, especialmente, quando as cólicas/choro inconsolável estão associados a outros sintomas gastrintestinais, tais como vômitos, má aceitação alimentar, diarreia, constipação intestinal ou quadros dermatológicos, como a dermatite atópica. Nestes casos, a reexposição deve ser realizada e interpretada com os mesmos cuidados mencionados na discussão do RGE secundário à APLV126.
Constipação intestinal secundária à alergia alimentar
Esta possibilidade deve ser considerada quando ocorre falha no tratamento da constipação intestinal funcional ou quando se associa a outros sintomas, como cólicas, choro excessivo ou irritabilidade (Tabela 5)124,198,211,213.
Estima-se que aproximadamente 5% dos pacientes com quadro clínico compatível com constipação intestinal funcional podem apresentar AA213. A constipação intestinal é observada com maior frequência em lactentes logo após a introdução da proteína do LV na dieta, presença de fissura anal persistente, antecedente de perda de sangue nas fezes e falta de resposta à terapêutica convencional214. É interessante mencionar que a constipação intestinal por AA pode ocorrer em pré-escolares e escolares213. A interação entre a constipação intestinal e um mecanismo imunológico explanatório foi demonstrada em um estudo clínico que mostrou aumento do número de mastócitos interagindo com fibras nervosas da mucosa retal que, também, estavam correlacionadas com anormalidades manométricas209.
Mais uma vez, a reexposição alimentar deve ser realizada e interpretada com os mesmos cuidados mencionados na discussão do RGE secundário à APLV126. Nesta situação é necessário que o hábito intestinal permaneça normal na vigência da dieta de exclusão do LV, sem a utilização associada de medicamento laxativos.
Proctocolite induzida por proteína alimentar
A proctocolite induzida por proteínas alimentares se caracteriza pela presença de raias de sangue vivo nas fezes, com ou sem diarreia ou muco, que tipicamente se apresenta nos primeiros seis meses de vida, em bebês em geral saudáveis (Tabela 5)33,124,126,201,215-219.
Nos lactentes com proctocolite alérgica, observa-se que cerca da metade dos casos ocorre na vigência de aleitamento natural exclusivo, e a outra metade em lactentes em aleitamento artificial33,126,127. Nos casos em que ocorre colite alérgica na vigência do aleitamento natural exclusivo, alimentos ingeridos pelas mães (leite de vaca ou, eventualmente soja) são a causa da doença, ou seja, não se trata de alergia ao leite materno. A proctocolite alérgica é a forma mais frequente de AA em lactentes em aleitamento natural exclusivo, sendo a apresentação clínica de AA não mediada por IgE em lactentes em aleitamento materno exclusivo mais comum127,218-220.
Os pacientes com proctocolite alérgica apresentam, em geral, enterorragia, com estado geral satisfatório e ganho de peso adequado. O sangramento, na maioria das vezes, é de pequena monta, sendo referido apenas raias de sangue nas fezes. O lactente pode apresentar cólica, irritabilidade e choro excessivo.
É uma doença transitória e a maioria dos casos desaparece no primeiro ano de vida. Descrição de casos de colite alérgica ao LV, ao ovo e ao trigo foram muito raramente observadas33,126,212,221,222.
Na prática clínica, o diagnóstico da proctocolite alérgica é substancialmente clínico e, em geral, feito de forma presuntiva quando os pacientes respondem positivamente à eliminação de um alérgeno alimentar suspeito, em geral por duas a quatro semanas. A reexposição oral com alimento suspeito é diagnóstica. Pode haver eosinofilia no hemograma em metade dos pacientes33. Nenhum exame laboratorial estabelece o diagnóstico e, portanto, os exames são desnecessários na maioria das vezes124,126.
A procotocolite alérgica nos lactentes em aleitamento artificial pode ser controlada na maioria dos casos em três a quatro dias pela substituição da fórmula com proteínas do LV por fórmulas hipoalergênicas. Estudo recente confirmou que 95% dos lactentes com sangramento retal por colite alérgica têm desaparecimento do sangramento com a dieta de eliminação, apesar de apenas 30% apresentarem reexposição alimentar positiva após duas a oito semanas223. Estes dados clínicos confirmam a utilidade da dieta de exclusão para obtenção da recuperação clínica e a obrigatoriedade da reexposição para confirmação diagnóstica e, quando possível, liberação da dieta. Quando a reexposição for positiva, a mesma deve ser repetida a cada três meses223, ou no máximo após seis meses126.
Considerando que pelo menos 20% dos bebês com colite alérgica em aleitamento natural exclusivo têm resolução espontânea do sangramento, sem qualquer mudança de dieta ou uso de medicamentos191,200,224,225, alguns autores e mesmo alguns familiares de pacientes têm optado por uma conduta expectante (watch and wait), ou seja, só observar e esperar126.
Revisão recente da literatura concluiu que a conduta expectante por duas a quatro semanas pode ser adotada na colite alérgica leve em lactentes em aleitamento natural exclusivo226. Os autores enumeraram argumentos contra a conduta expectante (desparecimento e redução do tempo de sangramento, diminuição do desenvolvimento de anemia por deficiência de ferro, melhora da qualidade de vida da criança e da família, diminuição teórica do risco de desenvolvimento futuro de doenças gastrintestinais funcionais e diminuição dos custos com cuidados médicos e exames), e a favor (impactos negativos da dieta de eliminação para mãe ou lactente, possíveis recorrências do sangramento por falta de adesão à dieta, diminuição do estresse por não ser adotada dieta de eliminação e custo das fórmulas hipoalergênicas)226.
Analisando as características dos fatores apontados, é fácil concluir que se trata de uma discussão retórica, sem embasamento em evidências científicas com possibilidade de serem mensuradas objetivamente. Uma preocupação especial é a deficiência de ferro, cuja caracterização é mais difícil no primeiro semestre de vida. Poderá se instalar efetivamente após os seis meses de vida após o esgotamento das reservas corporais de ferro utilizadas precocemente durante o período expectante com permanência do sangramento.
O sangramento geralmente desaparece em uma a duas semanas após a eliminação completa da proteína da dieta materna126,215. Esse período de resolução pode ser mais longo nas crianças amamentadas126. Deve-se ponderar, entretanto, que sangramento não é um evento normal, ocasiona alto nível de estresse para a família e a dieta de eliminação do alérgeno reduz o tempo de sangramento. Ademais, a colite alérgica foi identificada como um fator de risco para distúrbios gastrintestinais funcionais futuros (distúrbios da interação cérebro-intestino) "pós-inflamatórios"205,211,215,217.
Quanto ao tratamento, na criança amamentada, pelos vários benefícios do leite materno, não se deve suspender o aleitamento, mas sim orientar a dieta de restrição para a mãe nutriz. Estes pacientes são alérgicos, habitualmente, apenas ao LV, e apresentam evolução satisfatória, com resolução dos sintomas após a retirada deste alimento da dieta da mãe nutriz126. Excepcionalmente podem ser necessárias outras restrições como soja, ovo, trigo, peixes, castanhas e outros alimentos.
Nos pacientes em uso de fórmulas poliméricas, recomenda-se a mudança para as fórmulas com proteínas extensamente hidrolisadas. Nos casos mais graves, naqueles refratários ao uso dos hidrolisados e naqueles com dermatite atópica grave, está indicada a fórmula de aminoácidos (FAA).
Em geral, a evolução é satisfatória, com resolução dos sintomas em alguns meses, ainda no primeiro ano de vida227,228.
Enteropatia induzida por proteína alimentar
A enteropatia induzida por proteína alimentar ocorre mais frequentemente nos primeiros meses de vida, após o desmame e o início das fórmulas com LV ou soja (Tabela 5). Após a introdução destes alimentos, o paciente pode apresentar um quadro temporário de ganho de peso satisfatório e boa evolução clínica, que depois declina, e as manifestações clínicas podem se tornar evidentes, dias, semanas ou até mais que um mês após a introdução do alimento, por decorrer de reação tardia, mediada por células191193.
Assim, trata-se de um quadro de má-absorção, de início insidioso, que pode se apresentar com diarreia crônica (fezes aquosas e ácidas), eritema perianal, distensão abdominal, vômitos, anemia, perda de peso e insuficiência do crescimento. De modo semelhante à doença celíaca, pode cursar com enteropatia perdedora de proteínas, hipoalbuminemia, edema e variáveis graus de desnutrição191193.
Quanto ao diagnóstico, na avaliação histológica da mucosa do intestino delgado, observa-se infiltrado inflamatório da lâmina própria, constituído por linfócitos, plasmócitos, mastócitos e eosinófilos. Além disso, pode ocorrer achatamento das vilosidades intestinais, em diferentes graus, e hiperplasia das criptas. Nestes casos, o diagnóstico diferencial com a doença celíaca deve levar em consideração a quantidade de linfócitos intraepiteliais, os níveis séricos de anticorpos anti-transglutaminase, bem como o HLA DQ2 e do DQ8126,196.
A lesão vilositária tem como consequências: a diminuição da superfície absortiva; a redução da concentração das dissacaridases; e o aumento da permeabilidade da barreira intestinal, que facilita a absorção de macromoléculas, propiciando sensibilizações a outras proteínas e mantendo um ciclo vicioso que perpetua a resposta imune alérgica. Ademais, a agressão das vilosidades e a redução das dissacaridases podem ocasionar má-absorção dos dissacarídeos. Por este motivo, a diarreia é aquosa, as fezes são ácidas e o lactente, em geral, apresenta distensão abdominal e assadura perianal. Nestes casos deve ficar claro, inclusive para a família, que o paciente pode ter intolerância à lactose, de modo secundário à lesão vilositária, retornando à capacidade absortiva após o tratamento adequado, que inclui retirada dos alérgenos e nutrição adequada126,196.
Síndrome da enterocolite induzida por proteína alimentar
A síndrome da enterocolite induzida por proteínas alimentares (FPIES) é uma alergia alimentar não mediada por IgE. De modo diferente da proctocolite e da enteropatia induzidas pelas proteínas alimentares, a FPIES determina além dos sintomas digestórios, alterações sistêmicas, como apatia, acidose, cianose e choque. Por este motivo, muitas vezes, esses pacientes recebem o diagnóstico de sepse. Além do LV e soja, arroz, banana e aveia podem desencadear a FPIES (Tabela 5)228-232.
Nos lactentes menores de seis meses, o LV e a soja são os alimentos desencadeantes mais frequentes; enquanto os sólidos (cereais, frutas, peixes), são mais comumente envolvidos nas reações das crianças maiores de 9 meses225,231.
Existem duas formas de FPIES: os quadros agudos e os crônicos, sendo os vômitos o sinal mais característico. Na FPIES aguda, os vômitos agudos e repetitivos constituem a manifestação mais característica. Além disso, os pacientes apresentam palidez, letargia e apatia. Diarreia e desidratação com hipotensão e choque podem ocorrer. Em comparação com os quadros mediados por IgE, a anafilaxia e outros sinais cutâneos ou respiratórios da AA não são vistos. Em geral, a FPIES aguda ocorre quando o alérgeno é ingerido de modo intermitente ou após um período de restrição. Nestes casos, os pacientes melhoram em 24 horas e permanecem bem entre as crises228,230.
A FPIES crônica é mais frequentemente observada em bebês mais jovens, quando o alimento ofensivo é ingerido de modo regular e repetidamente216. Os sintomas incluem vômitos crônicos ou intermitentes, diarreia e diminuição do ganho de peso e/ou insuficiência no crescimento. As Tabelas 6 e 7 resumem os critérios diagnósticos para FPIES aguda e crônica, respectivamente216,231.
Como nas outras formas de AAs, o tratamento baseia-se na dieta de restrição dos alérgenos, mas de modo diferente, na FPIES, pelo choque hipovolêmico, pode ser necessário a restauração hemodinâmica. Nas formas leves, a terapia de reidratação oral pode ser suficiente. Nas crises moderadas a graves pode ser necessário: internação, acesso venoso, reposição volêmica (10-20 mL/kg de solução salina), ondansetrona (0,15 mg/kg/dose, máxima = 16 mg/dose, nos maiores de 6 meses), metilprednisolona (em casos graves, 1 mg/kg EV, com máximo de 60 a 80 mg/dose) e/ou drogas vasoativas. A epinefrina e os anti-histamínicos parecem ter pouca eficácia no tratamento da FPIES215,216.
Outro passo importante no diagnóstico das AAs é a exclusão de outras doenças. O diagnóstico diferencial da AA inclui: intolerâncias alimentares, alterações anatômicas do trato digestório e respiratório, erros inatos do metabolismo, doença celíaca, fibrose cística, DRGE, insuficiência pancreática, linfangiectasia intestinal, imunodeficiências, infecções (trato digestório e sépsis) e doença inflamatória intestinal de início precoce, entre outras.
Alergias alimentares mistas
Caracterizam-se por vias dependentes e não dependentes de IgE. As manifestações alérgicas decorrentes de mecanismos mistos incluem a dermatite atópica associada à AA (seis a 48 horas após a exposição) e os distúrbios gastrintestinais eosinofílicos (EGIDs)233,234.
Dermatite atópica (DA)
Sabe-se que uma parcela dos casos de dermatite atópica, as formas moderadas e graves em crianças, podem ser agravadas por alimentos. Existem três padrões de reatividade clínica a alimentos em pacientes com dermatite atópica: reações do tipo imediato (mediadas por IgE nas primeiras duas horas de consumo), exacerbação tardia da dermatite atópica (não mediada por IgE), e reações mistas, com uma combinação de características clínicas mediadas e não por IgE235.
Reações do tipo imediato na dermatite atópica
As reações do tipo imediato na dermatite atópica manifestam-se com sintomas cutâneos (urticária, angioedema, rubor) ou, no contexto de anafilaxia, incluindo também sintomas do trato respiratório e/ou sintomas gastrintestinais e/ou cardiovasculares. Essas reações geralmente ocorrem nas primeiras duas horas após o consumo, variando de reações leves em um único órgão até a anafilaxia235.
Exacerbação tardia da dermatite atópica
As reações tardias não mediadas por IgE na dermatite atópica geralmente ocorrem em seis a 48 horas após o consumo dos alérgenos alimentares implicados. O padrão de exacerbação tardia da dermatite atópica não está claramente definido naquela de início na idade adulta. O TPO é essencial para a avaliação objetiva da suspeita, tendo em vista as taxas mais altas de sensibilização alimentar em comparação com controles saudáveis, muitas vezes não associadas à relevância clínica236.
Reações mistas na dermatite atópica
Alguns pacientes apresentam sintomas mais complexos, combinando sintomas mediados por IgE e exacerbação da dermatite atópica237. Estudo com 64 crianças com DA que foram submetidas a 106 testes de provocação oral, duplo-cegos, controlados por placebo, com ovo de galinha, LV, trigo ou soja, a reação mista foi observada em 45%, enquanto 12% tiveram apenas uma reação tardia238. No entanto, no estudo de coorte Danish Allergy Research (DARC), 95% dos pacientes, durante os TPOs duplo-cegos controlados por placebo, desenvolveram a reação do tipo imediata239. O fato é que a frequência e o padrão de reatividade clínica variam entre os pacientes com dermatite atópica.
Esofagite eosinofílica
A EoE é uma enfermidade que vem sendo reconhecida com frequência crescente nas últimas duas décadas. Tem-se observado uma verdadeira escalada no aparecimento de casos novos com aparente aumento na percepção diagnóstica, mas talvez não somente devido a isso240. Caracteriza-se pela presença de infiltrado eosinofílico no esôfago, sem comprometimento de outros segmentos do trato gastrintestinal241.
A EoE é doença crônica e imunomediada do esôfago, caracterizada clinicamente por manifestações de disfunção esofagiana e histologicamente por inflamação predominantemente eosinofílica241,242.
A EoE pode começar nos primeiros anos de vida, e o quadro clínico varia em relação à idade. Nos primeiros anos de vida, é comum a EoE apresentar-se como DRGE, e acredita-se que seja responsável por cerca de 10% dos casos de lactentes que necessitam de tratamento para DRGE. O quadro clínico inclui regurgitação, vômitos, às vezes ruminação, falta de apetite, choro após a alimentação e às vezes imediatamente após o início da alimentação. Esse quadro determina a recusa de alimentos e, às vezes, à postura anormal da cabeça e pescoço e ao arqueamento significativo da coluna (síndrome de Sandifer), eventualmente pode se associar à melena e à anemia por deficiência de ferro243. A presença de sintomas inespecíficos como vômitos, náuseas, dor abdominal, recusa alimentar, engasgos, baixo ganho ponderal e dificuldade na introdução de alimentos sólidos ocorre na faixa etária de lactente e pré-escolar. Sintomas mais específicos, semelhantes aos do adulto, são observados em crianças maiores e adolescentes, como disfagia e impactação de alimentos, ocorrendo também os vômitos e a dor abdominal244. Evidências atuais demostram que, em pacientes pediátricos, o tempo de progressão da doença sem intervenção terapêutica pode ocasionar remodelamento do tecido esofágico, com fibrose, o que se expressa clinicamente como disfagia e impactação de alimentos244.
Os sintomas da EoE e da DRGE são semelhantes, principalmente em lactentes e pré-escolares, o que torna o diagnóstico diferencial entre as duas doenças difícil. Pacientes pediátricos, que apresentam baixa resposta ao tratamento da DRGE podem ter EoE em 5% a 10% dos casos. Nesses casos, a falta de resposta ao inibidor de bomba de próton (IBP) deve aumentar a suspeita de EoE245.
Atualmente o critério diagnóstico de EoE se baseia na presença de sintomas de disfunção esofágica, e contagem de eosinófilos em mucosa esofagiana ≥15 células/campo de grande aumento (CGA) ao exame histológico, na área de maior densidade eosinofílica, em uma ou mais amostras de tecidos obtidas por endoscopia.
Três escalas são utilizadas em ensaios clínicos com o objetivo de mensurar e padronizar as alterações da EoE: de sintomas (Pediatric Eosinophilic Esophagitis Symptom Score - PEESS v2.0)246, endoscópica (EREFS - Endoscopic Reference Score) e histológica (EoE-specific histologic scoring system - EoEHSS)247. No entanto, a validação dos escores para o diagnóstico e acompanhamento da atividade da doença ainda não foram realizadas na população pediátrica. A última guia de tratamento, da Associação Americana de Gastroenterologia e da Força-Tarefa Conjunta sobre Parâmetros de Prática em Alergia-Imunologia, recentemente publicada, atribui aos instrumentos um papel coadjuvante, mas sem dispensar a contagem de eosinófilos intraepiteliais como fator primordial para definição do diagnóstico e atividade da doença248.
Doenças gastrintestinais eosinofílicas não esofágicas (EGIDs Não EoE)
Doenças eosinofílicas do trato gastrintestinal (EGID do inglês Eosinophilic gastrointestinal disorders excluindo a EoE, são condições raras, crônicas, inflamatórias com consequências desconhecidas em longo prazo249. São usualmente não fatais e caracterizadas por vários sintomas gastrintestinais, infiltração eosinofílica do trato gastrintestinal e, às vezes, eosinofilia periférica. O diagnóstico requer a exclusão de outras causas de infiltração eosinofílica e do envolvimento de outros órgãos. As EGIDs não EoE são doenças raras que têm prevalência estimada de 2,1 a 5,1 por 100.000, comparado com prevalência de 10 a 57/100.000 na EoE240.
As EGID não-EoE são compostas por um grupo de doenças subdivididas de acordo com o local que acometem: gastrite eosinofílica (EoG), duodenite eosinofílica (EoD), enterite eosinofílica (EoN), ileíte eosinofílica (EoI) e colite eosinofílica (EoC). A apresentação clínica das diferentes EGIDs não EoE depende do trato digestório acometido e da extensão e profundidade do infiltrado eosinofílico. O seu diagnóstico é feito quando o paciente apresenta sintomas de disfunção gastrintestinal, se há eosinófilos em número aumentado e inflamação eosinofílica nas biópsias e são excluídas outras causas de eosinofilia (Tabela 8)250. A literatura sobre as EGID não EoE é limitada, por isso o consenso recente da ESPGHAN e NASPGHAN uniformizou as denominações e definições além de auxiliar no diagnóstico e nos tratamentos. Além disso, esse consenso sugere o limite máximo aceitável ou média do número de eosinófilos (pico) a ser considerado em cada segmento intestinal (Tabela 8)249.
Gastroenterite eosinofílica alérgica
A gastroenterite eosinofílica alérgica (EoGE) é muito menos comum que EoE. Afeta adultos e crianças e raramente é observada no primeiro ano de vida251. Em crianças pequenas pode causar dor abdominal, irritabilidade, saciedade fácil, vômitos, diarreia, perda de peso, anemia e hipoalbuminemia, devido à enteropatia perdedora de proteínas. No entanto, os sintomas dependem não apenas da idade do paciente, mas também do órgão afetado, bem como da extensão (invasão através das camadas da parede intestinal)252. A eosinofilia periférica é encontrada em aproximadamente 50% dos pacientes com EoGE. Testes cutâneos e/ou pesquisa de IgE sérica específica para alimentos revelam um gatilho alimentar em menos de 50% dos casos. A infiltração eosinofílica acentuada da mucosa gástrica e/ou duodenal, totalizando pelo menos 30 eosinófilos/campo de grande aumento é observada na EoGE. Porém, é imperativo realizar um diagnóstico diferencial para excluir outras causas de hipereosinofilia com localização gastrintestinal252.
Colite eosinofílica
A colite eosinofílica (EoC) é a forma menos comum de EGID, embora, como as outras, sua frequência geral pareça estar aumentando253. É observada em adolescentes em associação com doença inflamatória intestinal e/ou doença celíaca e, mais raramente, em outras condições atópicas254. A sua associação com AA não é clara, mas provavelmente diminui com o avançar da idade. Em um estudo retrospectivo de 69 crianças com eosinofilia colônica, a AA foi responsável por 10%, a doença inflamatória intestinal por 32%, a síndrome do intestino irritável por 33% e outros diagnósticos por 25% dos casos de EoC.
Diagnósticos diferenciais
Vários diagnósticos diferenciais precisam ser lembrados nos pacientes com alergias alimentares. Em seções prévias, foram mencionados relevantes diagnósticos diferenciais de quadros de alergia não mediada por IgE.
Na Tabela 9, estão listadas as principais reações adversas a alimentos não imunológicas que devem ser consideradas como diagnósticos diferenciais das alergias alimentares.
Diagnóstico
Anamnese e exame físico
A anamnese é um item fundamental no diagnóstico de AA. Ao final de uma anamnese completa e detalhada, deve ser possível reconhecer se os sintomas são compatíveis com algumas das manifestações de AA, definir o alimento mais provável, assim como o mecanismo imunológico envolvido (mediado e/ou não por IgE). A seguir, deve ser avaliada a necessidade de exames e/ou procedimentos complementares, tais como TPO nos casos de maior risco ou dieta de restrição seguida de reexposição nos casos mais leves3,26,158,264. Os itens a serem realizados na consulta devem incluir:
- a caracterização do sintoma pelo órgão acometido, duração do episódio (quando pertinente) e gravidade;
- a idade do início do sintoma deve ser relacionada com a da introdução do alimento (para alimentos como o LV, as manifestações tendem a ocorrer nas primeiras exposições ao alérgeno);
- tempo de início dos sintomas após a exposição (minutos até duas horas na maioria dos casos mediados por IgE), se há resolução espontânea ou necessidade de medicação;
- caracterização de reprodutibilidade, ou seja, o sintoma só ocorre se a pessoa se expõe ao alimento e sempre que se expõe ao alimento;
- a quantidade e o processamento do alimento suspeito, se ofertado cru, cozido ou outro, bem como a via de exposição (oral, inalatória ou cutânea);
- pesquisa de fatores associados ao episódio com destaque para atividade física, infecções, ingesta de álcool ou medicamentos, fatores hormonais;
- se há melhora com a exclusão do alimento suspeito e piora com a reexposição.
O exame físico detalhado, fora do episódio agudo de alergia, pode detectar a presença de outras comorbidades alérgicas, como por exemplo, asma, rinite alérgica e dermatite atópica, o que vai favorecer o diagnóstico de AA mediada por IgE3,26,158,264.
Investigação da sensibilização alérgica
A investigação da sensibilização alérgica a alimento pela pesquisa de IgE específica somente faz sentido se houver suspeita de AA mediada por IgE ou como um passo inicial na investigação das alergias mistas. Importante frisar que a investigação de IgE específica para múltiplos alimentos, suspeitos e não suspeitos, não traz qualquer benefício ao diagnóstico de AA tardias e, ao contrário, pode trazer riscos de exclusões desnecessárias.
No diagnóstico das AA do tipo imediata, a determinação de IgE específica pode ser direcionada para a fonte total, como LV, ovo e amendoim, ou para seus componentes (exemplo: caseína, ovomucoide e Ara h 2).
A sensibilização alérgica pode ser detectada por exames in vivo e in vitro.
Como nem todos os testes in vivo ou in vitro são absolutos, seus resultados sempre devem ser interpretados considerando a história clínica. Se a história clínica é altamente sugestiva, a AA não pode ser descartada se os testes forem negativos e a investigação seguinte vai requerer TPO ou quando for possível teste de ativação de basófilos (BAT), na investigação da alergia a amendoim e gergelim4.
In vivo
Para a avaliação da sensibilização in vivo são utilizados testes cutâneos de leitura imediata - TCLI (testes de puntura ou prick test). São testes semiquantitativos, que devem ser sempre realizados em ambiente adequado (clínica, consultório ou hospital) por médico capacitado, pois requerem cuidados em sua execução e interpretação. A utilização de extratos padronizados confere a esses testes valores preditivos positivos de no máximo 60%, por outro lado, raramente são positivos na ausência de alergias mediadas por IgE (valor preditivo negativo [VPN] de até 95%). Há uma quantidade reduzida de extratos alimentares padronizados, e uma estratégia adicional internacionalmente reconhecida é a utilização de testes de puntura com o alimento fresco, uma técnica denominada prick to prick. É realizada puntura do alimento fresco e depois introduzido o puntor na pele de maneira percutânea. Os resultados podem ser avaliados entre 15 e 20 minutos de sua aplicação na pele e consistem na detecção e medida da pápula que se forma no local da puntura com o alimento, assim como nos locais onde foram colocados o controle positivo (histamina) e o controle negativo (solução salina). O uso de alimentos frescos aumenta a sensibilidade do teste aos alérgenos termolábeis ou lipofílicos presentes nos alimentos frescos que poderiam ser destruídos ou excluídos durante a preparação dos extratos.
Os testes in vivo apresentam resultados rápidos, visualizados pelos próprios pacientes, podendo ser usados como um recurso educacional. Apresentam alta sensibilidade, alto VPN (com exclusão em até 95% dos casos de alergia mediada por IgE diante de resultados negativos), baixo valor preditivo positivo (VPP) (alta taxa de falso positivo), permitem realizar testes com alimentos frescos, baixa especificidade e apresentam risco geralmente baixo de reações alérgicas sistêmicas258,265,266.
Os requisitos básicos para a realização e interpretação dos testes in vivo incluem um profissional treinado, a interrupção dos anti-histamínicos por pelo menos cinco a sete dias, limpeza inicial da pele e escolha de local sem lesões de pele.
São considerados testes positivos quando houver formação de pápula com pelo menos 3 mm de diâmetro médio, em pacientes cujo controle positivo também mostrou-se positivo e com ausência de pápula no local do controle negativo. Algumas guias internacionais consideram a possibilidade de "descontar" o tamanho médio da pápula do controle negativo do resultado do alérgeno, sendo que, neste cálculo, o resultado da pápula do alimento tem que ser também de 3 mm ou mais. Não há restrição de idade para a realização do teste, entretanto, deve-se ter em mente que crianças menores de seis meses de idade podem apresentar reatividade cutânea reduzida.
Os testes in vivo dependem do operador e de extratos de boa qualidade, podendo haver diferenças nos resultados obtidos. Além disso, há limitações quanto ao uso de medicamentos e presença de lesões de pele.
In vitro
A detecção de IgEs específicas circulantes para os alérgenos suspeitos também apresentam alta sensibilidade, baixa especificidade e alto VPN. Nesse contexto, um exame cujo resultado é negativo praticamente afasta o diagnóstico de AA mediada por IgE. O VPP das IgEs específicas é muito variável nas diferentes populações, pois difere com a idade, localização geográfica, etnia, assim como a presença de outras doenças alérgicas, especialmente a DA. Na dermatite atópica, em virtude dos altos níveis séricos de IgE total, é muito comum haver sensibilização para múltiplos alimentos sem que isso necessariamente tenha relação com a reatividade clínica256,257.
Outro aspecto importante na pesquisa da IgE específica é o método empregado em cada laboratório, seja a pesquisa por testes fluoroenzimáticos ou por quimioluminescência, por exemplo. Os métodos fornecem resultados diferentes e não intercambiáveis, com resultados em geral mais elevados ao usar a quimioluminescência. Essas diferenças podem acarretar falsas interpretações e interferir na condução dos casos258.
A detecção de IgE específica para alguns componentes de alimentos pode ser um instrumento que facilita o diagnóstico de AA, especialmente quando a história e/ou a IgE específica para a fonte total não esclarecem o caso (por exemplo: pacientes com dermatite atópica e exames positivos, pacientes multissensibilizados, ou em situações de reatividade laboratorial). Nesses casos e para alguns alimentos, a pesquisa de IgE específica a componentes pode ser relevante4,257.
Nas suspeitas de alergia a amendoim e avelã, os componentes Ara h 2 e Ara h 6 do amendoim e Cor a 9 e Cor a 14 da avelã, apresentaram sensibilidade moderada e especificidade elevada, auxiliando no diagnóstico em casos mais complexos. O componente Ana o 3 da castanha-de-caju apresenta valores elevados de sensibilidade e especificidade, podendo ser útil na confirmação de alergia a este alimento. Componentes do LV (alfa lactoalbumina, betalactoglobulina, caseína), ovo (ovoalbumina, ovomucoide) auxiliam de maneira mais assertiva no estabelecimento da gravidade e persistência da alergia do que no diagnóstico. A Tabela 10 apresenta componentes de alimentos que estão relacionados à AA. A avaliação simultânea de componentes pode ser feita por plataformas multiplex, pequenas quantidades de soro permitem avaliações de vários componentes simultaneamente. No Brasil o ImmunoCap ISAC® é a plataforma multiplex que está disponível até o momento4,257.
Avanços no diagnóstico da sensibilização in vitro incluem o teste de ativação de basófilos (BAT). Nesse teste os basófilos circulantes dos indivíduos com suspeita de AA são estimulados com alérgenos alimentares e quantifica-se a degranulação destas células, em comparação a controles positivos e negativo. Este teste parece apresentar VPPs mais elevados, mas há necessidade de padronização para cada um dos alérgenos a serem avaliados. O teste de ativação de mastócitos (MAT) apresenta racional semelhante ao BAT, mas de custo mais elevado e com VPN inferior4.
Na Tabela 11 apresenta-se a comparação entre as características dos testes diagnósticos para alimentos nos casos de AA mediadas por IgE.
"Patch test" ou teste de contato
O patch test para alimentos é uma variação do exame de excelência para a abordagem da dermatite de contato. Sua adaptação para o diagnóstico de AA surgiu a partir da busca por possíveis exames complementares para o diagnóstico das alergias por mecanismos mistos ou não mediados por IgE. Desde o início dos anos 2000 se procura a correta padronização para que esse exame possa ter um papel diagnóstico confiável. Por ora, os resultados são muito heterogêneos e, como consequência, não devem ser recomendados no diagnóstico de AA, exceto em situações específicas, como na suspeita de dermatite de contato alérgica por alimentos260.
Outros exames
Exames coprológicos
Devido à falta de testes que estabeleçam o diagnóstico da AA, especialmente para as não mediadas por IgE, há um interesse crescente na identificação de possíveis biomarcadores.
A dosagem de alfa-1-antitripsina fecal é utilizada para avaliar a perda gastrintestinal de proteínas e, dessa forma, pode estar alterada nos casos de enteropatia induzida pela proteína alimentar. Entretanto, é um exame não específico, não estabelecendo ou descartando a AA como causa da perda proteica177,261.
A pesquisa de hemoglobina humana nas fezes pode ser positiva nos casos de AA, especialmente nos menores de um ano com proctocolite alérgica. Da mesma forma que a alfa-1-antitripsina fecal, é um exame inespecífico, uma vez que não estabelece ou descarta o diagnóstico de AA como etiologia do sangramento. Além disso, não deve ser utilizado no acompanhamento da criança para avaliar a resolução da proctocolite alérgica. A prática de solicitar pesquisa de hemoglobina humana nas fezes no seguimento das AA, além de não ter sido validada, determina o excesso de diagnósticos e não é apoiada pelas guias internacionais de AA200,221.
A calprotectina é uma proteína citosólica que se liga ao cálcio e ao zinco e possui propriedades imunomoduladoras e antimicrobianas. É derivada principalmente dos neutrófilos e pode ser medida em vários fluidos corporais, incluindo soro e fezes. Seus níveis aumentam com a inflamação, infecção e malignidade. A calprotectina fecal é amplamente utilizada como triagem diagnóstica e monitoramento de pacientes com doença inflamatória intestinal. Como marcador de AA, os resultados dos estudos são discordantes. Estudo recente, demonstrou forte relação entre a gravidade dos sintomas usando o CoMiSS (do inglês, Cow's Milk-Related-Symptoms Score in Children) e os níveis de calprotectina262. Da mesma forma, uma metanálise concluiu que a calprotectina fecal pode ser um biomarcador simples e confiável para o diagnóstico de APLV, especialmente para os lactentes com APLV não mediada por IgE263. Outra pesquisa observou melhora ou redução dos níveis de calprotectina, nas crianças com APLV, após três meses de dieta de eliminação da proteína do LV267. Ao contrário, outros autores observaram que a calprotectina fecal não discriminou lactentes saudáveis, daqueles com APLV259. Em 2021, a ESPGHAN definiu que os níveis de calprotectina fecal mostram uma variabilidade considerável em crianças com doenças atópicas, tornando difícil ter-se conclusões definitivas sobre a eficácia desse teste no diagnóstico ou monitoramento de condições alérgicas. Sendo assim, não é recomendado usar dosagens de calprotectina fecal para o diagnóstico ou como marcador prognóstico de APLV em crianças268.
Endoscopia digestiva alta
Nos pacientes com AAs a endoscopia digestiva alta pode revelar a presença de esofagite, gastrite e hiperplasia nodular linfoide, mas só deve ser solicitada em casos individualizados e avaliados com cuidado por gastroenterologistas pediátricos experientes. O estudo histológico das biópsias endoscópicas tem importância por quantificar a distribuição de eosinófilos ao longo do esôfago e, dessa forma, fazer o diagnóstico diferencial entre a DRGE e a EoE, que no lactente, podem ter manifestações clínicas similares. A atrofia das vilosidades intestinais pode ser observada nos casos de enteropatia induzida pela proteína alimentar e na síndrome da enterocolite induzida pela proteína alimentar. Podem ser observados aumento do número de linfócitos intraepiteliais e eosinófilos na lâmina própria, criptite eosinofílica em biópsias antrais e/ou duodenais nas crianças com APLV. Todos esses achados agregam informações, mas não estabelecem ou excluem o diagnóstico de APLV, pois podem ser encontrados em outras doenças gastrintestinais do trato superior ou em alergia a outros alimentos. Dessa forma, por ser um exame invasivo, que exige sedação, não deve ser solicitado de rotina, mas somente em casos de maior gravidade ou para diagnóstico diferencial com outras doenças. Além disso, deve ser solicitado pelo especialista em gastroenterologia pediátrica em casos individualizados e realizado por endoscopista treinado126.
Colonoscopia
Os achados da colonoscopia mais comuns nos casos de AA são colite focal ou difusa, com edema e erosões, eritema focal da mucosa, perda de padrões vasculares, equimoses e hiperplasia nodular linfoide, todos esses inespecíficos. A hiperplasia nodular linfoide é um achado comum em bebês com APLV e pode ser encontrada no cólon e/ou íleo terminal. Quanto aos achados histológicos, é importante quantificar os eosinófilos nos diferentes segmentos colônicos. Na colite eosinofílica transitória neonatal, os achados endoscópicos e histológicos são os mesmos da APLV, mas o sangramento observado nesta condição é autolimitado e cessa sem dieta de eliminação da proteína do LV. Apesar desses achados, não se deve recomendar endoscopia digestiva alta ou baixa de rotina para o diagnóstico da APLV devido à falta de especificidade dos achados endoscópicos e histológicos. A realização de exames invasivos fica reservada para os casos mais graves e/ou para diagnóstico diferencial com outras condições, avaliados individualmente. A colonoscopia deve ser solicitada pelo especialista em gastroenterologia pediátrica e realizado por endoscopista treinado126.
Após a suspeição clínica, o que define o diagnóstico é a reexposição sintomática com o alimento suspeito, ou seja, após a melhora do quadro clínico ao excluir o alimento suspeito após um período, deve-se reintroduzi-lo e observar o reaparecimento dos sintomas.
O uso de fórmula de aminoácidos como opção inicial da dieta de eliminação pode representar uma ferramenta diagnóstica dominante do ponto de vista farmacoeconômico, considerando que a falta de resposta clínica, na prática, descarta a hipótese de alergia alimentar em lactentes. Estudo farmacoeconômico conduzido no Brasil, e citado recentemente em guias internacionais, avaliou o custo-efetividade do uso da fórmula de aminoácidos na dieta de exclusão para diagnóstico, seguida de reexposição e mostrou que tal estratégia representa redução de 9% no custo e 25 dias a menos de sintomas126,223. Outros países, como Austrália, China e Turquia também já utilizam essa prática126.
Testes não reconhecidos
Tem-se observado o aumento real na prevalência das AAs, assim como um diagnóstico excessivo baseado em testes alternativos que não possuem evidências científicas (especificidade, sensibilidade, justificativa, reprodutibilidade). A população deve ser alertada sobre o risco do uso indiscriminado desses testes, que causam prejuízo financeiro, psicossocial, nutricional e muitas vezes atrasam a terapia apropriada. Na Tabela 12 estão listados os testes não reconhecidos como eficazes no diagnóstico de AA, bem como algumas evidências científicas para não realizá-los.
Reexposição alimentar e Teste de Provocação Oral
O diagnóstico das AA permanece um desafio, especialmente naquelas alergias não mediadas por IgE, que consistem em reações tardias, com manifestações muitas vezes inespecíficas, como náuseas, vômitos e diarreia, e que podem estar presentes em outras doenças ou condições clínicas. Dessa forma, tanto o superdiagnóstico quanto o subdiagnóstico ocorrem com frequência. O subdiagnóstico acarreta riscos nutricionais e de reações alérgicas, inclusive reações agudas, falha no crescimento, deficiência de micronutrientes, comprometimento da qualidade de vida dos pacientes e cuidadores, aumento da morbidade e, inclusive, da mortalidade. Por outro lado, o superdiagnóstico de AA tem sido associado a várias consequências indesejáveis, tais como dietas de eliminação injustificadas, sobrecarga econômica para as famílias e o sistema de saúde. Assim, é muito importante o diagnóstico correto da AA, e a reexposição alimentar, quer seja pelo TPO (quando há riscos de manifestações graves e agudas), quer seja domiciliar, possui papel fundamental273.
Após a suspeição diagnóstica de reações graves (mediadas por IgE, FPIES, etc.), recomenda-se a dieta de eliminação do alérgeno por um período, seguida do TPO (etapa diagnóstica). Quando há a possibilidade de aquisição de tolerância ao alimento é importante a realização de um novo TPO (etapa para avaliar tolerância). Seja para definir o diagnóstico das AA ou para avaliar o desenvolvimento de tolerância, o TPO é classificado em:
- aberto: paciente e médico cientes do alimento ofertado;
- simples cego: realizado em duas etapas, apenas o médico tem conhecimento do que é placebo e alimento em teste;
- duplo cego e controlado por placebo: realizado em duas etapas, paciente e médico desconhecem se o que está sendo ofertado é placebo ou verum; o alimento deve ser preparado por um terceiro, geralmente o nutricionista.
O TPO com alimento duplo-cego e controlado por placebo representa o padrão ouro para o diagnóstico de AA, mas exige tempo, deve ser realizado em centros especializados, por médicos especialistas treinados, em ambiente hospitalar. Pelo alto custo e dificuldade de realização, esse teste tem sido utilizado apenas em situações especiais, para evitar viés de interpretação ou quando o objetivo é a pesquisa científica. Assim, pela simplicidade e por razões socioeconômicas, o teste simples cego e o desafio aberto são considerados satisfatórios para o propósito do diagnóstico, na prática clínica177,273.
A indicação do TPO envolve criteriosa avaliação clínica e laboratorial, com estratificação de riscos, exemplificados como de maiores riscos de reações:
- reação após contato nos últimos seis a 12 meses;
- antecedente de anafilaxia;
- presença de asma não controlada ou asma induzida por exercício;
- história de reação a alimentos associados à maior gravidade da reação;
- presença de cofatores (menstruação, doenças infecciosas, jejum, uso de medicações como inibidores de bomba de prótons e ingestão de álcool);
- níveis elevados de IgEs séricas específicas, especialmente para marcadores proteicos como ovomucoide, caseína, ω-5-gliadina e proteínas de estocagem274,275.
Dieta de eliminação do alérgeno
Após a suspeição diagnóstica, deve-se proceder à dieta de eliminação do alérgeno. Para os lactentes com APLV em aleitamento materno exclusivo, deve-se orientar dieta de restrição do LV para a mãe nutriz, com suplementação de cálcio e vitamina D para a mãe no período da restrição alimentar. Para o lactente não amamentado ou em aleitamento misto, as fórmulas extensamente hidrolisadas (FeH) são a primeira escolha para o tratamento da APLV201. Na presença de diarreia com duração superior a uma semana, pode-se suspeitar de deficiência de lactase e, nestes casos, recomenda-se o uso da FeH sem lactose126,276,277. As fórmulas de aminoácidos (FAA) estão indicadas quando ocorre persistência dos sintomas com as FeH ou nos casos de maior gravidade como: (i) anafilaxia; (ii) impacto nutricional importante e/ou falha no crescimento; (iii) alergias alimentares múltiplas e graves; (iv) FPIES aguda e crônica graves; (v) EoE que não responde a uma dieta de exclusão de alérgenos; (vi) situações clínicas com necessidade de evitar qualquer risco de sensibilização278,279.
Embora algumas diretrizes recomendem uma abordagem step-down que inicia com FAA na dieta de eliminação diagnóstica, essa abordagem não é amplamente aplicada. No Brasil, o uso de FAA como dieta diagnóstica de eliminação seguida de reexposição alimentar é uma abordagem farmacoeconômica e resulta em menor número de dias com sintomas223. No conceito step-down, uma FAA é usada como dieta de eliminação diagnóstica, e quando a reexposição é sintomática, uma FeH é usada para a dieta de eliminação terapêutica. Existem outras publicações que recomendam as FAA como dieta de eliminação diagnóstica276.
As fórmulas hidrolisadas de arroz (FHA) têm sido um opção para lactentes com APLV, quando disponíveis280,281. No entanto, o número de estudos com a fórmula de arroz em lactentes com APLV é limitado em comparação ao número de estudos com fórmulas extensamente hidrolisadas e de aminoácidos126. Como o teor de arsênico contido na FHA é 10 vezes menor que o limite preconizado pela OMS elas foram avaliadas como seguras pelo Comitê de Nutrição da ESPGHAN282,283. Até o momento, não há dados sobre a eficácia das FHAs em lactentes que não toleram as FeH como alternativa às FAA. Essas fórmulas não foram avaliadas quanto à segurança e aspectos nutricionais da mesma forma que as FeHs ou FAA.
A Tabela 13 resume as recomendações do consenso da ESPGHAN para dieta de eliminação para lactentes não amamentados, e a Figura 4 ilustra o algoritmo modificado da reexposição alimentar para APLV. Ressalta-se que, dada a especificidade de cada hidrolisado, a fórmula para a dieta terapêutica se confirmada a alergia deve ser a mesma utilizada na fase de eliminação diagnóstica.
A indicação da reexposição alimentar, quer seja por TPO (ambiente controlado e equipe treinada), quer seja domiciliar, nos casos de menor risco de reações graves, e o momento de sua execução devem ser decididos em conjunto com o médico e o paciente/sua família, considerando aspectos como história clínica, idade, tipo de sintoma, época da última reação, interpretação dos resultados de exames de sensibilização in vivo e/ou in vitro e valor nutricional do alimento suspeito.
A resolução dos sintomas nas AAs é variável: algumas horas nas imediatas e FPIES, até várias semanas na enteropatia induzida por proteínas alimentaresa196. Em geral recomenda-se a dieta de eliminação por duas a quatro semanas, podendo ser necessário até oito semanas nos casos graves de enteropatia induzida pela proteína alimentar 273. Se os sintomas persistirem, a dieta precisa ser cuidadosamente reavaliada, pela possibilidade de contato cruzado, ou outro diagnóstico pode ser considerado260. Após este período, se houver melhora clínica, deve-se proceder o enfrentamento com a reexposição alimentar para definir o diagnóstico.
O TPO não deve ser realizado nos pacientes com doenças febris agudas, sintomas respiratórios e/ou uso de beta-agonistas para tratamento de crise de asma nas 48 horas anteriores, uma vez que estas condições podem aumentar o risco de reações. Da mesma forma, betabloqueadores devem ser suspensos, se possível, por comprometer a ação da adrenalina. Gestação, doença cardiovascular descompensada ou doença pulmonar crônica grave consistem em contraindicações relativas. Os anti-histamínicos devem ser suspensos em média sete dias antes do teste275. Para finalidade diagnóstica, o alimento deve ser reintroduzido após duas a quatro semanas de dieta, na forma in natura197.
Local
O Teste de provocação oral, procedimento médico a ser realizado em ambiente preparado para o tratamento de possíveis anafilaxias, por especialistas e equipe treinada, é indicado para:
- alergia alimentar mediada por IgE;
- formas graves não mediadas por IgE, como na FPIES;
- FPIES atípicas (associadas à positividade da IgE específica para o alimento).
Por outro lado, a reexposição alimentar pode ser realizada sob supervisão dos responsáveis, em domicílio, apenas para os pacientes com:
- formas leves/moderadas de alergia não mediadas por IgE, como a proctocolite induzida pela proteína alimentar;
- manifestações leves e inespecíficas de alergia não mediadas por IgE (dor abdominal, náuseas, dismotilidades)284.
Como fazer: protocolos preconizados de acordo com o mecanismo imunológico envolvido
Antes de iniciar o TPO, é importante que o paciente ou seu responsável leia e assine um termo de consentimento livre e esclarecido, e que o estado de saúde do paciente seja avaliado, assim como se assegure que medicações que podem influenciar no resultado do procedimento não estejam sendo utilizadas. Ademais, deve-se certificar que todo e qualquer equipamento e medicações necessárias para assistência em caso de reações estejam disponíveis e de fácil acesso.
Nas alergias mediadas por IgE, o esquema habitual consiste em dividir as ofertas em quatro a seis doses crescentes, totalizando a porção habitual para a idade, com intervalos de 15 a 30 minutos entre elas. Maior fracionamento das doses não é recomendado por risco de dessensibilização e resultados falso negativos. Porém, pacientes com alto risco de reações podem iniciar com o consumo de 1% da dose total, e pacientes com baixo risco podem receber esquema de duas doses (10% e 90%). Há ainda o protocolo de baixa dose, no qual a dose total é bastante inferior àquela dos protocolos tradicionais. O TPO de baixa dose tem como objetivo liberar quantidades pequenas ou traços do alimento, melhorando assim a qualidade de vida do paciente285. Yanagida e cols. sugerem a quantidade de 2 mg de proteína do ovo cozido e 102 mg de proteína do leite aquecido como doses iniciais286.
O TPO nas alergias mediadas por IgE é considerado positivo quando o paciente apresenta pelo menos um dos seguintes sintomas:
- cutâneo: três ou mais urticas, angioedema ou rash eritematoso pruriginoso;
- respiratório: sibilos, tosse persistente, estridor, disfonia, afonia, desconforto respiratório;
- gastrintestinal: vômito, diarreia e/ou dor abdominal por mais de três minutos;
- hipotensão.
Ou se apresentar pelo menos dois dos seguintes sintomas:
- prurido cutâneo por mais de três minutos, coceira nos olhos ou nariz por mais de três minutos, rinorreia por mais de três minutos, diarreia275.
No caso da FPIES, acesso venoso periférico é indicado em pacientes com história de reações graves, uma vez que cerca de 15% dos pacientes podem evoluir com hipotensão. A dose de proteína ofertada é de 0,06 a 0,6 g de proteína por quilo de peso corporal, atingindo uma dose máxima de 3 g de proteína, 10 g do alimento total e 100 mL de líquido. O protocolo clássico preconiza a administração de três etapas com doses iguais, em intervalo de 30 minutos, e possibilidade de acrescentar uma porção habitual após duas horas, com observação clínica por pelo menos mais quatro horas. Dose inicial mais baixa ou tempo maior de observação devem ser considerados em pacientes com história de reações graves275.
Importante ressaltar que alguns autores apontam críticas para este protocolo clássico, pois a progressão de doses seria realizada antes do tempo habitual de início dos sintomas, que é de uma a quatro horas. Assim sendo, uma alternativa seria a oferta das doses em dias diferentes, com 48 horas de intervalo entre elas, sendo 25% da dose no primeiro dia, 50% da dose no terceiro dia e 100% da dose no quinto dia. Este esquema, aparentemente, oferece menor risco de reações graves, mas envolve dificuldades em relação ao tempo necessário e ao custo operacional287. O teste será considerado positivo se houver o surgimento de sintomas típicos de uma a quatro horas após a ingestão (Tabela 14). A presença de vômitos na ausência de sintomas cutâneos é considerada critério maior, enquanto a letargia, palidez, hipotensão, hipotermia, diarreia e neutrofilia são critérios menores. Salienta-se que o pronto tratamento com ondansetrona pode impedir o surgimento de critérios menores, portanto cada caso deve ser avaliado isoladamente192.
A resposta ao TPO na alergia mediada por IgE é mais facilmente reconhecida, pois os sintomas são específicos e Tempo de observação após o TPO e conclusão do testeimediatos, minutos a duas horas após a ingestão do alérgeno. Na FPIES, as manifestações ocorrem nas primeiras quatro horas do TPO. Nas alergias não mediadas por IgE, o intervalo de tempo entre a ingestão e os sintomas varia de algumas horas a alguns dias. Desta forma, nos fenótipos não mediados por IgE, o paciente deve manter seguimento por quatro semanas, mesmo que nos primeiros dias, após liberação do alérgeno, ele se mantenha assintomático, para conclusão final do teste. Após a reexposição, se houver recidiva das manifestações clínicas, o diagnóstico de AA fica confirmado.
TPO: avaliação de tolerância
Estabelecido o diagnóstico de AA, no seguimento do paciente deve-se avaliar o desenvolvimento de tolerância, pelo TPO, etapa para avaliação de tolerância. Onde fazer e como interpretar, são similares ao TPO para estabelecimento do diagnóstico. Existem algumas peculiaridades relacionadas à quando e como fazer.
Quando fazer
O momento ideal para realização da reexposição alimentar para avaliação da tolerância, depende do fenótipo clínico da AA e da gravidade do paciente.
A taxa de resolução da alergia mediada por IgE pode ser mais tardia do que da APLV não mediada por IgE. Para esses pacientes, deve-se avaliar, particularmente, os valores séricos de IgE específica ou tamanho das pápulas mensuradas no TCLI. Não existem valores únicos que possam ser aplicados universalmente, mas a redução de pelo menos 50% nos níveis séricos em um período de 12 meses, por outro lado, é descrito como marcador de bom prognóstico289,290. Transgressões assintomáticas da dieta também podem sinalizar a possibilidade de aquisição de tolerância.
Nas proctocolites alérgicas leves, com criança em aleitamento materno exclusivo e boa evolução após a eliminação do LV e derivados, pode-se considerar liberar a proteína do LV para a mãe nutriz após três meses de dieta de eliminação, devendo-se sempre individualizar a conduta de acordo com o paciente. De modo diferente, as crianças com enteropatia e desnutrição podem necessitar de um tempo maior para recuperação (um a dois anos de idade), da mesma forma que para o FPIES, o tempo mínimo de dieta de eliminação é de 12 a 18 meses após a última reação197,261,270,275.
Como fazer
Para as alergias mediadas por IgE e casos mais graves das manifestações tardias, como FPIES, o procedimento deve ser realizado como descrito para o TPO diagnóstico. Entretanto, visto que uma parte significativa de pacientes alérgicos ao LV e ovo conseguem tolerar as formas assadas desses alimentos, seu consumo regular permitiria a ampliação da dieta e, possivelmente, aceleraria a tolerância oral às formas in natura. A ausência de marcadores laboratoriais 100% fidedignos que possam diferenciar os pacientes capazes de tolerar esses alimentos implicam na necessidade de TPO (Tabela 15).
TPO com alimentos assados (bakeds)
Para as alergias mediadas por IgE, o TPO para o baked (assado) deve ser realizado em ambiente de assistência em saúde e com quantidade proteica adequada, para evitar subdoses que possam resultar em testes falso negativos. Recomenda-se uma quantidade de 1,3 g de proteína do LV e 2 g de proteína do ovo por porção, que deverão ser acrescidos a uma matriz (farinha de trigo) e levados ao forno por pelo menos 30 minutos, a 180 ºC291.
Reexposição escalonada domiciliar (Milk ladder)
Nos casos de APLV e alergia a ovo leve a moderada, a reintrodução pode ser realizada no domicílio, de acordo com as recomendações escalonadas de reintrodução da PLV (milk ladder, egg ladder), após dieta de eliminação terapêutica, uma prática cada vez mais utilizada internacionalmente. Em casos mediados por IgE, recomenda-se ambiente controlado.
Neste caso, o LV ou o ovo em alimentos assados é introduzido primeiro em pequenas quantidades, seguido por doses crescentes e formas progressivamente menos processadas termicamente. A progressão inicia-se por alimentos assados (bolos, muffins), seguidos por formas cozidas (crepiocas, purês/ovo cozido), depois com queijos e, finalmente, por preparados (sorvetes, clara em neve)292.293. As opções de preparo devem levar em consideração os hábitos familiares e o valor nutricional.
A progressão deve ser lenta e gradual. Não há tempo mínimo ou máximo durante o qual o escalonamento deve ser concluído ou quanto tempo cada passo deve levar, pois é ajustado conforme características individuais do paciente, como história, reações, idade, fenótipo clínico, entre outros fatores. A Tabela 15 resume os pré-requisitos para este tipo de (re)exposição alimentar. As Figuras 5 e 6 resumem o passo a passo para crianças menores e maiores de um ano, respectivamente, para o LV133.
Se a reintrodução do alérgeno, após a dieta de eliminação terapêutica, ocasionar sintomas, deve-se manter a dieta de eliminação por mais três a seis meses e, em seguida, fazer nova (re)exposição.
Diagnóstico de Alergia Alimentar em pacientes com Dermatite atópica
O diagnóstico das AA em pacientes com dermatite atópica exige cuidados extras. A anamnese, um importante instrumento diagnóstico, necessita de maior atenção, pois pode haver viés na informação coletada com uma tendência a culpabilidade de alimento na piora da dermatite. Os clássicos instrumentos para a pesquisa de IgE específica também podem ter sua eficácia comprometida. Considerando o teste de punctura, pode não haver área de pele sã disponível ou o paciente pode utilizar cronicamente anti-histamínicos, o que inviabiliza o teste. Nesse cenário, a IgE sérica específica pode ser uma alternativa, mas painéis devem ser desencorajados, uma vez que a desregulação imunológica da dermatite atópica pode levar a um excesso de IgEs específicas positivas sem qualquer correlação clínica284.
A abordagem diagnóstica inclui características clínicas do paciente, tais como início precoce da doença e manifestações moderadas ou graves, e em seguida, realiza-se a IgE específica para alimentos. Vale destacar que 80% das AAs em pacientes com dermatite atópica se relacionam ao LV, amendoim e ovo, mas há descrições do envolvimento de trigo também. Resultados negativos afastam a AA com um elevado grau de certeza (valor preditivo negativo dos testes de IgE específica é 90%). Nos pacientes com exames positivos recomenda-se a retirada do alimento por duas a quatro semanas e subsequente reexposição.
Deve-se destacar duas considerações: esse movimento deve ser feito em pacientes em um momento estável da doença, nenhuma medicação deve ser suspensa e a aferição da gravidade da dermatite deve ser feita utilizando-se os clássicos escores de gravidade como o SCORAD (SCORing Atopic Dermatitis) ou o EASI (Eczema Area and Severity Index). Variações expressivas do critério auxiliam no diagnóstico. O teste de contato atópico é um método não padronizado com resultados muito variáveis, não sendo recomendado como instrumento diagnóstico de AA em pacientes com dermatite atópica284,294. A exclusão do alimento por um diagnóstico inadequado de AA em pacientes com dermatite atópica aumenta o risco de ocorrência de manifestações clínicas mediadas por IgE por ocasião de sua reintrodução. O tempo de exclusão associado a esse risco varia entre cinco semanas a anos260.
Condução
Dietética
A abordagem da AA baseia-se nos seguintes pilares: exclusão dos alérgenos alimentares responsáveis pela reação alérgica, inclusão de alimentos nutricionalmente apropriados e seguros, e o tratamento de eventuais reações agudas126,177. Nesse contexto, a orientação nutricional tem como objetivos: evitar o desencadeamento dos sintomas da AA, prevenir distúrbios nutricionais e proporcionar à criança crescimento e desenvolvimento adequado294.
Exclusão dos alérgenos alimentares
A retirada dos alimentos alergênicos da alimentação constitui a base do tratamento dietético da AA e deve contemplar, na maioria dos casos, a total exclusão do alimento envolvido, inclusive os produtos dele derivados e de preparações que o contenham. Entretanto, o rigor da dieta de exclusão deve considerar as diversas particularidades dos alérgenos, dos mecanismos fisiopatológicos envolvidos (mediados ou não por IgE) e dos distintos fenótipos de AA, podendo ser flexibilizado em algumas situações. Deve-se considerar as diferenças nos limiares de reatividade clínica, conceitos como tolerância a traços industriais e domésticos, a alimentos submetidos a processamento térmico (cozidos/assados), a fim de se evitar exclusões desnecessárias, que impactam na qualidade de vida e no processo de aquisição de tolerância oral126,273,295.
O impacto da exclusão de um alimento alergênico na dieta de um paciente depende de vários fatores, como idade, estado nutricional prévio, representatividade do alérgeno na dieta, facilidade de acesso a substitutos alimentares adequados e seletividade alimentar. A orientação de dieta de exclusão, portanto, precisa ser individualizada. É importante a identificação específica dos alérgenos para cada caso, a fim de se manter a oferta alimentar qualitativa e quantitativamente adequada, evitando-se dietas desnecessárias e muito restritivas. Todo empenho deve ser feito no intuito de realizar as substituições alimentares visando garantir a oferta nutricional adequada, alcançando-se as suas necessidades que devem atender às atuais recomendações nutricionais, por faixas etárias e sexo, para os principais nutrientes296.
As dietas de eliminação de alimentos podem afetar a ingestão de macro e micronutrientes, especialmente em crianças, nas quais os déficits nutricionais podem impactar no crescimento e desenvolvimento. Uma vez que os principais alérgenos alimentares mudam conforme a faixa etária, o impacto geral da doença sobre a nutrição também é variável297. A exclusão de uma fruta, amendoim, castanhas ou crustáceos praticamente não determina impacto nutricional para um adulto, o que difere muito da exclusão de alérgenos como LV e ovo para crianças pequenas.
A educação nutricional do paciente e de sua família é fundamental para o sucesso do tratamento e vai além do reconhecimento e exclusão do alérgeno nos mais diversos cenários alimentares. Deve abranger esclarecimentos sobre as melhores escolhas nutricionais e estratégias de aceitação alimentar para os alimentos permitidos. Orientações sobre higiene ambiental e doméstica, assim como cuidados com manipulação inadvertida de alimentos contendo proteínas alergênicas devem ser reforçados. A depender do mecanismo e da gravidade do caso, há possibilidade de desencadeamento de reações pelo contato não oral - inalatório ou pela pele - durante o preparo de alimentos298. O trabalho em equipe multidisciplinar, com reavaliações periódicas, representa auxílio valioso no planejamento dietético, na adesão às recomendações e abordagem das dificuldades. Pretende-se, assim, evitar desnutrição, comprometimento estatural e outras carências177,297-299.
No Brasil, a regulação sobre rotulagem de alergênicos é feita pela RDC 26/2015 da Anvisa300. A norma se aplica aos alimentos, incluindo bebidas, ingredientes, aditivos alimentares e coadjuvantes de tecnologia embalados na ausência dos consumidores, inclusive aqueles destinados exclusivamente ao processamento industrial e os destinados aos serviços de alimentação. Os alérgenos de discriminação obrigatória nos rótulos são: trigo, centeio, cevada, aveia e suas estirpes hibridizadas, crustáceos, ovos, peixes, amendoim, soja, leite de todas as espécies de animais mamíferos, amêndoa, avelãs, castanha-de-caju, castanha-do-brasil ou castanha-do-pará, macadâmias, nozes, noz pecã, pistache, pinoli, castanhas e látex natural.
Caso não seja possível garantir a ausência de contato cruzado, que ocorre quando alimentos são produzidos pelo mesmo equipamento industrial empregado para elaborar outro alimento que contém o referido alérgeno, deve constar no rótulo a declaração "Alérgicos: pode conter (nomes comuns dos alimentos que causam alergias alimentares)". Essas informações devem estar agrupadas imediatamente após ou abaixo da lista de ingredientes, em caixa alta, negrito, cor contrastante com o fundo do rótulo e altura mínima de 2 mm300.
Os rótulos e os produtos podem ser alterados sem aviso prévio, e, portanto, recomenda-se a checagem dos rótulos a cada compra. Vale ressaltar que essa norma sobre rotulagem não se aplica a produtos preparados ou fracionados em padarias, lanchonetes ou restaurantes e similares, de produção artesanal ou alimentos comercializados sem embalagem. Outros produtos podem conter proteínas alergênicas, incluindo alimentos para animais, cosméticos, sabonetes, loções, protetores solares, sendo necessária a observação rigorosa da rotulagem. Grande parte destes produtos não estão incluídos entre os de rotulagem obrigatória de alérgenos, e, portanto, a busca pelo alérgeno deve ser feita pela composição de ingredientes do produto, individualmente. Segundo a RDC 768/2022, medicamentos devem conter o alerta "Atenção: este medicamento/vacina contém (inserir o nome do alimento alergênico, de acordo com o anexo I da RDC 26/2015 e suas atualizações)"300.
Mesmo os alimentos de uso rotineiro pela criança deverão ter seus rótulos lidos. Há fórmulas infantis regulares, por exemplo, que além do LV contêm alerta para a presença de soja, ovo e peixe em sua composição. Devido ao grande número de situações de risco possíveis, as famílias devem estar amplamente orientadas quanto a execução de um plano de ação em caso de uma reação alérgica177. Abaixo estão as orientações para necessidades específicas de exclusão dietética, por alérgeno, com enfoque no leite de vaca.
Dieta de eliminação para mãe nutriz
A dieta materna influencia diretamente a composição nutricional do leite materno, e proteínas e peptídeos da dieta materna podem ser transferidos para o leite materno em quantidades suficientes para evocar respostas imunológicas no bebê. Alérgenos alimentares (incluindo betalactoglobulina [LV], ovoalbumina, ovomucoide [ovo], gliadina [trigo] e Ara h 1 e Ara h 2 [amendoim]) já foram isolados de leite humano301,302. Apesar disso, nem todas as lactantes necessitam fazer dieta de eliminação.
Para os lactentes com AA que estão em aleitamento materno, a dieta de eliminação deve ser recomendada para a mãe nutriz quando o lactente manifestar reações com alérgenos veiculados pelo leite materno. Se os sintomas forem desencadeados apenas após ingestão do alimento diretamente pela criança, a exclusão do alimento da dieta materna não é recomendada. Se está indicada a exclusão de LV e derivados da dieta materna, deve-se recomendar a suplementação da nutriz com cálcio e vitamina D125,126,273,303.
É importante apoiar e incentivar a manutenção do aleitamento materno exclusivo até seis meses, com introdução da alimentação complementar em seguida.
Dieta de eliminação para lactentes e crianças
A orientação dietética visa a eliminação do alérgeno na dieta do paciente. Para cada alimento ou grupo de alimentos excluído, deve-se avaliar os riscos de deficiência de macro e micronutrientes.
O ovo é um alimento rico em proteínas, vitamina B12 e riboflavina, que pode ser substituído por outras fontes de proteína. Entretanto, o ovo é um ingrediente importante na culinária brasileira e, dessa forma, o impacto social de sua exclusão pode ser relevante, apesar de haver muitas alternativas substitutas do ovo para receitas. O trigo é um alimento de consumo amplo no país, especialmente em receitas e alimentos industrializados. Pode ser substituído por vários outros grãos. Destaca-se que os alimentos "sem glúten" também não contêm trigo, mas que "sem trigo" podem conter glúten (centeio e cevada). A soja é um alimento nutricionalmente denso, rico em proteínas e muitos micronutrientes, mas que não aparece em grandes quantidades na dieta brasileira, sendo facilmente substituída por outros alimentos. Estudos mostram que a grande maioria dos indivíduos com alergia à soja pode tolerar óleo de soja altamente refinado e lecitina de soja, amplamente utilizados pela indústria para diversos fins. As castanhas e o amendoim são alimentos que são mais facilmente substituídos304.
Para os lactentes e crianças com APLV, os riscos nutricionais são grandes. A dieta de eliminação das proteínas do LV, além das deficiências nutricionais, pode ocasionar distúrbios alimentares, alterações nas preferências gustativas, no desenvolvimento do paladar e na aceitação de alimentos, com repercussões ao longo de toda a vida305,306. Nestes casos, recomenda-se o uso de fórmulas infantis especiais, que serão detalhadas adiante, juntamente com a conduta dietética de seguimento nos casos de APLV. Ademais, a relactação deve ser considerada para os lactentes, com a exclusão de produtos lácteos pela mãe nutriz, caso necessário177.
Nos casos de AAs múltiplas, destaca-se o importante risco nutricional a que as crianças e adolescentes estão submetidos, sendo fundamental o monitoramento rigoroso sistemático do consumo alimentar e do estado nutricional297.
Dieta de inclusão para pacientes com APLV (fórmulas infantis)
A utilização de fórmulas infantis especiais para os lactentes com APLV deve ser considerada apenas na impossibilidade de manutenção do aleitamento materno (exclusivo ou complementado). As fórmulas infantis para APLV devem obedecer a dois princípios: serem hipoalergênicas ou não alergênicas e satisfazerem às necessidades nutricionais dos lactentes e da criança quanto a macro e micronutrientes. No Brasil, as fórmulas infantis atualmente disponíveis para crianças com APLV são classificadas em:
- fórmula de proteína extensamente hidrolisada, obtida do LV, com lactose, para crianças de 0 a 36 meses;
- fórmula de proteína extensamente hidrolisada, obtida do LV, sem lactose, para crianças de 0 a 36 meses;
- fórmula de proteína extensamente hidrolisada, obtida do LV, sem lactose, hipercalórica para crianças menores de um ano e normocalórica para crianças maiores de um ano;
- fórmula à base de aminoácidos, para crianças de 0 a 36 meses;
- fórmula à base de aminoácidos, para crianças de um a 10 anos;
- suplemento à base de aminoácidos para maiores de um ano;
- fórmula à base de proteína isolada de soja, para crianças de 0 a 12 meses;
- fórmula à base de proteína de soja para crianças de um a três anos.
As fórmulas extensamente hidrolisadas (FeHs) são compostas por peptídeos de aminoácidos com peso molecular < 3.000 Da, obtidos por hidrólise enzimática e/ou térmica ou por ultrafiltragem, e são consideradas hipoalergênicas, pois os peptídeos presentes podem ter resíduos de alergenicidade307,308. Esses produtos diferem pela fonte de proteína (LV - proteína do soro e/ou caseína) e pelo tamanho dos peptídeos. A eficácia e a segurança devem ser estabelecidas para cada fórmula hidrolisada, pois o fabricante, a fonte de proteína, o método e o grau de hidrólise podem ser diferentes309.
As FeHs avaliadas até o momento parecem ser bem toleradas pela maioria das crianças com APLV e os estudos publicados não permitem qualquer conclusão sobre uma fórmula ser superior a outra no tratamento da APLV310. A Academia Americana de Pediatria define que uma fórmula, para ter a denominação de "hipoalergênica", tem que ser tolerada por pelo menos 90% dos lactentes com APLV documentada307. A Autoridade Europeia para a Segurança dos Alimentos exige, para todos os hidrolisados recentemente comercializados, pelo menos um ensaio clínico randomizado que demonstre a não inferioridade no crescimento da criança em comparação com uma fórmula padrão311.
As fórmulas parcialmente hidrolisadas (FpH) são constituídas por oligopeptídeos com peso molecular < 5.000 Da e não são recomendadas para tratamento da APLV307.
As fórmulas de aminoácidos são consideradas não alergênicas e devem ser utilizadas em situações especiais da APLV126.
A decisão sobre qual fórmula utilizar é baseada nos sintomas, na gravidade do caso, na composição nutricional e na alergenicidade residual da fórmula308. Para os lactentes não amamentados, as fórmulas extensivamente hidrolisadas (FeH) são a primeira escolha para o tratamento da APLV, enquanto as fórmulas à base de aminoácidos (FAA) são reservadas para casos mais graves e/ou com impacto nutricional importante201. É preferível usar FeHs derivadas de proteína do LV que foram testadas em estudos randomizados e controlados174. As FeH que contêm lactose purificada são consideradas seguras e eficazes no tratamento da APLV, além de mais palatáveis para os lactentes. Entretanto, na presença de diarreia e assaduras, decorrentes da enteropatia, é possível que ocorra intolerância secundária à lactose e, nestes casos, recomenda-se as FeHs sem lactose, especialmente no início do tratamento126.
Se os lactentes com APLV não atingirem o controle total dos sintomas ou a recuperação nutricional completa com uso da FeH, deve-se mudar para FAA283.
As fórmulas infantis à base de soja contêm proteína isolada de soja, de melhor qualidade proteica. Também contêm fitato, alumínio e isoflavona fitoestrogênica em níveis não presentes nas fórmulas à base de LV, embora com teores significativamente reduzidos nas últimas décadas. O alumínio e os estrogênios estão presentes em níveis aumentados no leite materno de mães que consomem grandes quantidades de soja310. A avaliação global do impacto das fórmulas modernas de soja no desenvolvimento humano sugere que a sua utilização não seja prejudicial312.
A prevalência de sensibilização à soja diminui com a idade (36,8% no primeiro ano, 16,4% no segundo ano e 13,7% no terceiro ano de vida). O último consenso da ESPGHAN recomenda o uso da fórmula infantil à base de soja para tratamento do lactente com APLV se outras dietas de eliminação não forem possíveis devido a razões econômicas ou culturais, especialmente na alergia mediada por IgE, devido à menor associação com a APLV, quando comparado à não mediada por IgE. Uma das vantagens das fórmulas de soja é sua palatabilidade, considerada melhor que das FeHs126. Para os pacientes já em uso de fórmula de soja com boa tolerância, independente se APLV mediada ou não por IgE, não é necessária troca para FeH.
Como substitutos do LV, o leite de outros mamíferos (p. ex.: cabra e ovelha), fórmulas parcialmente hidrolisadas e fórmulas poliméricas isentas de lactose não devem ser prescritos, pois não são considerados hipoalergênicos e seguros. O LV modificado com caseína tipo A2 (só contém a beta-caseína A2) não é considerado hipoalergênico e não deve ser usado como alternativa alimentar para todas as crianças com APLV. Por sua vez, os leites de égua e de burra apresentam menor homologia proteica ao LV, podendo ser tolerados por alguns indivíduos, apesar de nutricionalmente não adaptados313.
Preparados e bebidas à base de soja, aveia, castanhas e outros vegetais não são substitutos apropriados para lactentes jovens com APLV. Os chamados leites vegetais podem ser utilizados no preparo de receitas e para consumo de crianças maiores, atentando-se sempre ao fato de não serem equivalentes nutricionalmente ao LV, especialmente nos teores de proteínas, calorias e cálcio, e que, portanto, serão necessários ajustes nutricionais na alimentação diária para que se atinjam as necessidades nutricionais. Bebidas à base de arroz são desaconselhadas para crianças menores de quatro anos e meio devido aos elevados teores de arsênico314.
Para as crianças maiores com APLV, que não atingem a tolerância e não recebem complementação com fórmula infantil, recomenda-se a suplementação com cálcio e vitamina D durante o período da dieta de exclusão. A dose suplementar de cálcio elementar pode variar de 500 mg/dia na infância até 1.000 mg/dia ou mais na adolescência305.
Todos estes conceitos, aplicados na prática clínica, garantem que as crianças com APLV recebam nutrição adequada, que possa garantir crescimento e desenvolvimento adequados, similares aos de crianças não alérgicas305.
Duração da dieta de exclusão
A duração da dieta de exclusão do alérgeno alimentar deve ser individualizada, pois depende de fatores como o alérgeno em si, a idade do paciente ao iniciar os sintomas, os mecanismos imunológicos envolvidos na alergia e os diferentes fenótipos da AA. Por exemplo, para as crianças alérgicas ao LV por mecanismo não mediado por IgE, espera-se que a maioria desenvolva tolerância clínica nos primeiros três anos. A tolerância clínica espontânea é mais rara para o amendoim, castanhas e frutos do mar, que geralmente persistem durante toda a vida em pelo menos 70% dos casos177.
Para os casos de APLV não mediada por IgE, a dieta de eliminação terapêutica é geralmente recomendada por pelo menos seis meses ou até a idade de nove a 12 meses (o que for alcançado primeiro). Estudo realizado no Brasil, relatou que 80% dos bebês com suspeita de proctocolite toleraram o LV até a idade média de 6,3 meses, sugerindo que, no caso de proctocolite alérgica induzida por proteína alimentar (FPIAP), tentativas de reintrodução após os seis meses de idade podem ser consideradas315.
Nos casos de proctocolites alérgicas leves, com a criança em aleitamento materno exclusivo e boa evolução após a eliminação do LV e derivados, pode-se considerar liberar a proteína do LV para a mãe nutriz após três meses de dieta de eliminação. As crianças com enteropatia e desnutrição podem necessitar de um tempo maior para recuperação (um a dois anos de idade), da mesma forma que para o FPIES o tempo mínimo de dieta de eliminação é de 12 a 18 meses, após a última reação126,288. A liberação da dieta deve ser orientada após o TPO.
A verificação do estado de tolerância oral pode ser realizada pela reexposição alimentar sob supervisão médica ou em domicílio, a depender de fatores como tipo de reação, gravidade e risco de conversão para reação mediada por IgE. Pacientes com alergias mediadas por IgE, FPIES e formas graves da alergia não mediadas por IgE devem fazer o TPO em ambiente de unidade de saúde, sob supervisão. Por outro lado, os pacientes com alergia não mediada por IgE (formas moderadas/leves) têm a possibilidade da reintrodução do alérgeno em domicílio, o que deve ser orientado de modo individualizado. Para todos os casos, o risco de sensibilização alérgica por IgE adquirida posteriormente deve ser aventado, especialmente para pacientes em dieta de exclusão muito prolongada, com dermatite atópica moderada ou grave e FPIES. Um grande estudo de coorte relatou que a proctocolite alérgica estava associada a risco aumentado de desenvolvimento de APLV mediada por IgE [com razão de chances ajustada (OR) 5,4 (IC 95%: 1,4-20,8)]273,316-318 .
No caso de APLV leve a moderada não mediada por IgE, a reintrodução do LV, após o período de dieta de eliminação terapêutica, pode ser realizada iniciando com pequenos volumes de LV, de acordo com as recomendações da "escada de leite" (milk ladder)192,319-322.
A ESPGHAN considera que os protocolos de introdução domiciliar são seguros na AA não mediada por IgE, pois à medida que o aquecimento altera a estrutura dos peptídeos, os pacientes podem tolerar o LV cozido, por exemplo. No entanto, adverte que o conceito de "assar" leite é questionável, tendo em vista que a ebulição de qualquer líquido a 100ºC normalmente significa que todo o volume atingiu a temperatura mais alta. Por outro lado, durante o cozimento, a temperatura central dos alimentos que contêm LV, por exemplo, muffins, geralmente não excede 80 ºC. A esse respeito, o LV fervido deve alterar mais a estrutura dos componentes alergênicos do que o cozimento126.
Mesmo que a reintrodução possa ser feita em casa nas APLV não mediadas por IgE leves e moderadas, a supervisão dos responsáveis é obrigatória. Antes dessa orientação, é fundamental revisar a história para certificar-se que não há reações imediatas, sensibilização e nem dermatite atópica importante, que aumentam o risco das reações imediatas. Se houver dúvidas, deve-se realizar a pesquisa de IgE específica, principalmente se a criança apresentar dermatite atópica. A reexposição domiciliar está contraindicada se o paciente apresentar quadro dermatológico grave, sinais de manifestações mediadas por IgE, FPIES e manifestações graves das AA ou AAs múltiplas83.
A escada da reintrodução para APLV não mediada por IgE (Figuras 5 e 6) é apenas uma sugestão prática que pode ser feita de diferentes maneiras e pode ser adequada para cada região do país de acordo com seus costumes, conforme as apresentadas pelo Departamento de Gastroenterologia Pediátrica da Sociedade Brasileira de Pediatria em 2022, para crianças menores de um ano de idade e maiores de um ano de idade, respectivamente, de acordo com o iMAP (internacional interpretation of Milk Allergy in Primary Care)192,287,323.
Nas alergias mediadas por IgE, a reintrodução para estabelecer tolerância deve ser orientada pela gravidade dos sintomas, IgE sérica específica e/ou teste cutâneo de puntura, segundo o WAO DRACMA Guideline Group (2023)273. O momento apropriado para a reintrodução do LV após a dieta de eliminação terapêutica permanece discutível. É importante frisar que para casos mediados por IgE moderados a graves essa estratégia impõe maior risco de reação e somente deve ser executada sob supervisão/orientação próxima de alergista em ambiente de saúde preparado para o manejo de reações graves273.
Introdução da alimentação complementar na criança alérgica
A introdução da alimentação complementar em crianças com APLV deve seguir os mesmos princípios do preconizado para crianças sem alergia, a partir do sexto mês de vida, conforme marcos do desenvolvimento, independentemente da dieta recebida (leite materno, fórmula ou ambos). Reforça-se que a introdução de alimentos contendo proteínas potencialmente alergênicas (p.ex. ovo bem cozido, peixes, carnes em geral, oleaginosas) deve ocorrer idealmente dentro dos primeiros 12 meses de vida, preferencialmente em vigência do aleitamento materno, com regularidade e respeitando-se a rotina da família126,324,325.
Para pacientes com diagnóstico de FPIES, as diretrizes atuais não recomendam atraso na introdução de alimentos complementares, podendo-se iniciar a oferta de frutas e vegetais, seguidos por carnes vermelhas e cereais, a partir dos seis meses de vida. Várias tabelas que classificam os alimentos conforme maior risco de reação tipo FPIES já foram disponibilizadas, mas ressalta-se que diferenças epidemiológicas geográficas devem ser consideradas. Em geral, a maioria dos pacientes apresenta FPIES a um único alimento (65% a 80%), e os alimentos mais comuns são LV, soja, ovo, peixe e frutas, com destaque para a banana. Quando a criança já tolera um alimento de um grupo, o risco de reatividade cruzada a outro alimento do grupo é bem menor (exemplo: se FPIES por soja, mas já tolera feijão, o risco de FPIES a outras leguminosas é mínimo). Pode ainda ocorrer o desencadeamento da doença muito tempo após a introdução alimentar, inclusive na vida adulta125,303,326-330.
Diante de um novo diagnóstico de AA durante a introdução alimentar, é importante a orientação médica evitando-se atrasar a exposição aos demais alimentos, mas respeitando o risco de novos episódios com alimentos passíveis de reatividade cruzada. Atenção especial deve ser dada aos casos mediados por IgE, principalmente com anafilaxia, associados a alimentos que têm elevado risco de reatividade cruzada (como castanha-de-caju e pistache, ou camarão e crustáceos, ou na síndrome látex-fruta). A ocorrência de AA múltipla é rara, e o pavor de sua ocorrência não deve atrasar a introdução alimentar, fato que pode inclusive aumentar esse risco, conforme já abordado325,329-333.
Aspectos gerais sobre o seguimento dietético
As maiores dificuldades na execução da dieta são a exclusão completa do(s) alérgeno(s), e a necessidade de proporcionar uma alimentação adequada que permita o crescimento e o desenvolvimento satisfatórios. Alguns estudos demonstram o risco de se ofertar uma dieta que pode comprometer o estado nutricional e causar carências nutricionais específicas, tais como menor ingestão de calorias, proteínas, lipídios, cálcio, fósforo, vitamina D e outros micronutrientes, assim como seu impacto sobre a neofobia alimentar177.
O aconselhamento dietético pode melhorar significativamente a ingestão nutricional e prevenir deficiências nutricionais e falhas de crescimento. Assim, crianças com AA, especialmente a múltiplos alimentos ou alergias a alimentos básicos da dieta, como o LV e ovo, devem ser encaminhadas para aconselhamento nutricional. Recomendar alternativas aos alimentos eliminados que sejam ricas em nutrientes no momento do diagnóstico, garantindo que os alimentos alternativos sejam aceitos e incorporados à dieta são medidas preventivas essenciais334-337.
O monitoramento da ingestão adequada de macro e micronutrientes, particularmente vitamina D e cálcio, é necessária em crianças em dieta de eliminação de LV, especialmente naquelas com mais de um ano de idade. Os riscos nutricionais são importantes sobretudo nas crianças com alergias múltiplas e precisam ser monitorados sistematicamente. Na prática, a substituição do LV não é tarefa simples, pois muitas vezes a família busca alternativas de menor custo, no entanto as bebidas denominadas de leites vegetais têm menor valor calórico-proteico e de menores valores de micronutrientes em relação às fórmulas hipoalergênicas338. Para as crianças menores, a alimentação complementar deve ser introduzida na mesma idade das crianças sem APLV e seguir as mesmas recomendações, exceto os laticínios126.
Revisão sistemática que incluiu cinco artigos com dados de prevalência de dificuldades alimentares em crianças com AA encontrou valores de 13,6% a 40%, sendo as prevalências mais altas associadas às AAs múltiplas339. Raitano e cols. reforçam que crianças com APLV podem ter dificuldades alimentares, e essa ocorrência não deve ser subestimada340. Na Polônia, estudo multicêntrico evidenciou 16% de dificuldades alimentares em crianças com APLV e maior comprometimento dos escores Z P/E e IMC/I e, portanto, maior risco de "má-nutrição" neste grupo do que nas crianças com APLV sem dificuldades alimentares341. No Brasil, Rodrigues e cols., comparando crianças com APLV submetidas a dieta de eliminação com crianças sem APLV em dieta livre, demonstraram frequência mais alta de pick-eating e escores de problemas alimentares mais altos no primeiro grupo. Crianças com comportamento pick-eating apresentaram valores mais baixos de escore Z Peso/Idade342. Por isso, é crucial monitorar regularmente o crescimento desses pacientes e aconselhar as substituições necessárias para prevenir as dificuldades alimentares343.
Tais distúrbios nutricionais refletem uma abordagem nutricional inadequada, por vezes pela falta de equipe multiprofissional envolvida no atendimento, dificuldades relacionadas à dinâmica familiar, falta de acesso às fórmulas, ou pelo contexto social e econômico. É importante para os pacientes e familiares encontrarem um equilíbrio entre a vigilância adequada e a sobrecarga sobre a rotina diária de cuidados com a dieta de exclusão. Embora estratégias para minimizar a probabilidade de ingestão acidental de alérgenos devam ser realizadas, cuidados excessivamente cautelosos podem criar um fardo desnecessário para as famílias. É papel do profissional de saúde apoiar os pacientes e familiares para aprender a lidar com a percepção de risco associado às AA, com o objetivo de procurar manter uma vida a mais próxima do normal possível, e de prevenir consequências negativas em longo prazo, como, por exemplo, alterações na percepção da imagem corporal, transtornos alimentares e dificuldades nos relacionamentos interpessoais na vida futura177,344-346.
Aspectos emocionais
Reconhece-se que a AA podem induzir sintomas de estresse pós-traumático, sendo mais comum em crianças com experiências de anafilaxia ou ansiedade mediante a uma exposição alimentar não previsível. A adesão estrita à dieta é fator estressante para criança e suas famílias. Há relatos de maior incidência de bullying em crianças com AA347. Em vários estudos internacionais, mais de 30% das crianças e adolescentes referiram ter sofrido bullying por terem AA, com referência à experiência de episódios múltiplos em até 26%348. Por afetar múltiplas facetas das vidas dos pacientes, a AA causa diminuição da qualidade de vida da criança e de seus familiares. Além da monitorização do crescimento, aconselhamento nutricional com médicos pediatras especialistas e nutricionistas, o suporte psicológico para ansiedade e depressão pode ser necessário348,349.
Resumo das recomendações para APLV
- A exclusão do LV e derivados exige a inclusão de alimentos adequados para a criança com APLV, sem os quais prejuízos importantes podem ocorrer ao longo de toda a vida, com repercussões inclusive na vida adulta.
- Deve-se insistir na manutenção do aleitamento materno e dar suporte para a mãe nutriz. O uso de fórmulas deve ser recomendado apenas para os lactentes que não estão em aleitamento materno.
- Para o tratamento da APLV em lactentes, são recomendadas as fórmulas hipoalergênicas (FeHs) ou não alergênicas (FAA), nutricionalmente adequadas, para garantir o crescimento e desenvolvimento dos lactentes e crianças.
- Para lactentes com APLV a primeira opção é a FeH, obtida das proteínas do LV.
- As FAA estão reservadas para os casos de maior gravidade e para aqueles que tiveram resposta ausente ou parcial com as FeHs.
- Se o lactente com APLV não apresentar quadro de diarreia e assaduras, decorrentes de enteropatia, a FeH deve preferencialmente conter lactose.
- Apesar de menos estudadas, as FHAs podem ser excepcionalmente utilizadas.
- As fórmulas com proteína isolada da soja constituem opção de tratamento, especialmente nos lactentes maiores de seis meses, com APLV mediada por IgE. Também podem ser consideradas por razões econômicas, culturais e/ou de palatabilidade.
- O tempo de dieta de eliminação da APLV não mediada por IgE na fase de tratamento, em geral, são seis meses ou até que a criança atinja 9 a 12 meses de idade, mas varia conforme os fenótipos da alergia alimentar, sendo mais curto nas proctocolites alérgicas e mais longo na FPIES.
- O tempo para aquisição de tolerância para os casos mediados por IgE é geralmente maior, e a reintrodução deve ser individualizada.
Vacinação e alergia alimentar
Algumas vacinas contêm pequenas quantidades de proteínas alimentares, fazendo com que pacientes com AA precisem ser orientados quanto à necessidade de cuidados durante a atualização do cartão vacinal. Além dos alérgenos alimentares, diversos outros componentes de vacinas são capazes de elicitar reações alérgicas, sendo o principal deles a gelatina.
As reações de hipersensibilidade do tipo I raramente ocorrem, mas pelo seu potencial de gravidade devem ser levadas em consideração ao se prescrever uma vacina350. Tipicamente, as reações podem ocorrer imediatamente ou em até quatro horas após a exposição ao alérgeno e podem se manifestar com sintomas cutâneos ou sistêmicos (anafilaxia)351.
Os principais alimentos que podem estar envolvidos em reações imediatas à vacina são ovo de galinha e leite de vaca. As vacinas fabricadas em cultivo de ovo de galinha, febre amarela e raiva, têm maior quantidade de proteína do ovo (ovoalbumina) na sua composição, enquanto a tríplice viral, que é cultivada em fibroblasto do embrião de galinha, contém menor quantidade e não é contraindicada para alérgicos a ovo352,353.
Em geral, as vacinas contra Influenza comercializadas atualmente contêm menos do que 1,2 µg/mL de proteína do ovo. Estudos mostraram boa tolerância a ela, mesmo em indivíduos com reação anafilática ao ovo. A recomendação atual é que pessoas com história de alergia grave (anafilaxia) ao ovo de galinha recebam a vacina influenza e permaneçam em observação por 30 a 60 minutos. Pacientes que apresentam reações alérgicas leves não precisam de nenhuma precaução adicional durante a vacinação para gripe351.
A vacina da febre amarela contém quantidades maiores de proteína do ovo. No Brasil, existem duas vacinas disponíveis, e as quantidades de ovoalbumina podem variar entre 2,43 e 4,42 μg/mL de acordo com o lote. Além disso, ela não é aquecida em nenhum momento de seu processo de fabricação, por isso mesmo o paciente que tolera o ovo cozido/frito pode apresentar reação à vacina354.
O questionamento sobre alergia grave após a ingestão ou contato com o ovo é considerado adequado para as pessoas com história de outras alergias graves que irão receber a vacina contra a Febre Amarela. Entretanto, para crianças sem qualquer história clínica compatível com alergia a ovo e que estejam em introdução da alimentação complementar, não existe nenhuma evidência sobre a necessidade de ingestão prévia do ovo à vacinação contra a Febre Amarela. Do mesmo modo, não há recomendação para realização de IgE específica para ovo em crianças sem história de alergia antes da realização da vacina351.
Caso o diagnóstico de alergia mediada por IgE ao ovo seja confirmado com critérios clínicos e laboratoriais pelo médico alergista, estudos sugerem a vacinação para Febre Amarela após testes cutâneo e intradérmico com a vacina, seguidos (em caso de positividade dos testes) de dessensibilização ou fracionamento da dose em ambiente apropriado para o tratamento de possível anafilaxia356. Existem vários protocolos descritos para avaliação de alergia à vacina da febre amarela e dessensibilização para a mesma357. Entretanto, recente estudo brasileiro concluiu que é seguro administrar a vacina em dose única dispensando a realização de teste prévio ou fracionamento de dose, desde que em ambiente preparado para o atendimento de reações alérgicas graves353. Recomendaram que, aqueles com antecedente de reação anafilática a o ovo, sejam observados por, no mínimo, 60 minutos após a vacinação353.
Existem duas vacinas contra a raiva disponíveis: uma vacina de células diploides humanas, que não contém ovo, e uma vacina de células embrionárias de galinha purificadas, que contém vestígios de proteína de ovo, incluindo ovoalbumina (Rabipur®, GlaxoSmithKline). Houve relatos de reações alérgicas e anafilaxia à vacina cultivada em ovo, tornando-a relativamente contraindicada para indivíduos com histórico de anafilaxia ao ovo. Nestes casos, deve-se avaliar cuidadosamente o risco e benefício de seu uso. Ressalta-se que a Imunoglobulina Humana contra a Raiva não contém proteína de ovo357.
Ainda em relação ao ovo, algumas formulações do anestésico Propofol contém lecitina de ovo, derivada da gema. Apesar disso, devido à baixa taxa de reatividade clínica, sem relato de reações graves, a sua administração é segura em pacientes adultos e pediátricos com alergia a ovo357.
Pacientes com APLV não devem receber a vacina tríplice viral do laboratório Sérum Institute of India Ltda., que pode conter alfa-lactoalbumina.
A vacina contra difteria, pertussis e tétano pode conter derivados de caseína. Recomenda-se avaliação individual de risco, e em casos de pacientes com formas graves de alergia e baixo limiar de reações, aplicar a vacina sob supervisão354.
Medicamentosa e alérgeno-específica
Plano de ação para reações adversas
Sabemos o quanto é difícil evitar a exposição acidental a um alérgeno alimentar, principalmente aqueles que são de uso frequente na culinária. Nos casos leves, pode haver remissão espontânea ou resolução apenas com uso de anti-histamínicos. Porém, algumas reações evoluirão de forma grave (anafilaxia). Não é possível prever a gravidade ou a evolução da reação alérgica, o que poderá depender de cofatores potencializadores, que incluem uso de medicamentos, infecções, período menstrual e exercício358.
As pessoas com alergia alimentar devem ter um plano de ação por escrito com orientações claras contendo as etapas a serem realizadas de acordo com a gravidade da reação359.
Seguem relacionadas abaixo, cinco razões para se ter um plano de ação na alergia alimentar.
1. Preparação para emergências: as alergias alimentares podem levar a reações graves e potencialmente fatais, como anafilaxia. Ter um plano de ação garante que todos os envolvidos estejam preparados em caso de reação. Ele fornece instruções claras sobre quais ações tomar, incluindo o uso de medicamentos de emergência, como autoinjetores de adrenalina.
2. Comunicação padronizada: um plano de ação serve como ferramenta de comunicação entre o indivíduo com alergia alimentar, seus cuidadores, professores, funcionários da escola e outro pessoal relevante. Ele fornece informações vitais sobre os alérgenos específicos, sintomas e medidas apropriadas a serem tomadas durante uma reação alérgica.
3. Reconhecimento e intervenção precoce: o plano de ação inclui uma lista de potenciais sintomas alérgicos, permitindo o reconhecimento precoce de uma reação alérgica. Ao identificar prontamente os sintomas, podem ser tomadas medidas apropriadas, evitando potencialmente o agravamento da reação.
4. Educação: um plano de ação ajuda a aumentar a conscientização e a compreensão entre os envolvidos. A educação sobre alergias alimentares é crucial para criar um ambiente seguro e promover a empatia e o apoio aos indivíduos com alergias.
5. Cuidados consistentes: ao ter um plano de ação documentado, o indivíduo com alergia alimentar pode receber cuidados consistentes em diferentes ambientes. O plano fornece uma referência para os cuidadores e garante que as precauções e intervenções apropriadas sejam seguidas.
O CID 11 define anafilaxia como reação de hipersensibilidade sistêmica grave, com ameaça à vida, com início rápido de alterações potencialmente fatais em vias aéreas, respiração ou circulação e geralmente associada às alterações em pele e mucosas360. O diagnóstico é clínico, não há marcadores definitivos, e não há um padrão evolutivo de sintomas. Em 2019, a WAO propôs modificações para simplificar o diagnóstico e englobar reações graves não classificadas como anafilaxia pelos critérios anteriores (Tabela 16)360.
A adrenalina, ou epinefrina, é o único medicamento capaz de intervir em todos os sintomas da anafilaxia. Porém, mesmo com o aumento da utilização dos dispositivos autoinjetores de adrenalina (AIA), as mortes por anafilaxia ainda persistem.
Utilizar um AIA para os casos de anafilaxia pode evitar fatalidade. Ainda após o uso da adrenalina, pode ser necessário uma avaliação em serviço de emergência para dar continuidade ao tratamento e observação, por no mínimo quatro horas, já que a anafilaxia pode ter um curso bifásico com melhora inicial, seguido por recorrência de sintomas graves361. No entanto, uma revisão recente sobre recomendações práticas na anafilaxia sugere que, se há resposta rápida à adrenalina, não haveria necessidade de ida à emergência, mas adverte que isso deve ser decidido pelo médico e compartilhado com o paciente361.
Até o momento, não há estudos validados que indiquem quando prescrever os autoinjetores de adrenalina, sendo, portanto, as indicações baseadas apenas na opinião de especialistas. Segundo a EAACI, recomendações absolutas incluem: episódios prévios de anafilaxia pelo alimento, coexistência de asma instável ou asma persistente moderada a grave em pacientes com mastocitose sistêmica362. Sugere-se que para pacientes de menor risco haja um processo de decisão compartilhada levando-se em conta custo, acesso a serviço de emergência e preferências dos pacientes.
A adrenalina intramuscular é segura e eficaz. Não há contraindicações absolutas ao seu emprego na anafilaxia. A via endovenosa da epinefrina necessita maior atenção, pois podem ocorrer reações adversas cardiovasculares e neurológicas quando a sua administração é muito rápida, ou se a dose estiver errada. A via intramuscular é, portanto, a mais segura, devendo ser utilizada o mais precocemente possível quando do início do quadro. Mesmo na população idosa e com comprometimento cardiovascular, a adrenalina intramuscular deverá ser imediatamente empregada, principalmente pelo fato desse grupo etário apresentar maior risco de morbiletalidade nas reações graves de natureza alérgica363. Mesmo na vigência de bloqueadores beta-adrenérgicos cardiosseletivos e inibidores da enzima de conversão da angiotensina (ECA), a adrenalina intramuscular deve ser utilizada na anafilaxia, mesmo havendo a possibilidade da redução de sua eficácia. A anafilaxia é uma reação de evolução rápida e potencialmente fatal. A razão risco/benefício favorece, portanto, a utilização da adrenalina intramuscular em todos os quadros de anafilaxia, independente das doenças de base ou medicamentos utilizados pelo paciente364.
As reações alérgicas alimentares podem ocorrer em qualquer lugar, sendo mais frequente no domicílio, seguido da escola no caso das crianças e restaurantes no caso dos adultos. Programas de treinamento para os acompanhantes, profissionais das escolas e restaurantes são fundamentais. Infelizmente, não existem políticas de saúde que obriguem aeroportos, restaurantes e escolas a estocarem adrenalina365.
Educar as pessoas envolvidas no preparo e identificação dos alérgenos alimentares em cardápios é fundamental, além da orientação no manejo das reações. Os alimentos são a maior causa de anafilaxia em aviões, sendo recomendado trazer alimentos seguros ao viajar. Os kits de adrenalina de emergência nos aviões nos EUA são 1:1000 e 1:10.000, devendo-se ser preparadas doses apropriadas usando agulha e seringa, o que pode dificultar e atrasar o tratamento. Portanto, é imperativo que os pacientes estejam sempre preparados com seu próprio AIA. Os pacientes devem notificar a tripulação de voo sobre qualquer reação alérgica para que a assistência durante o voo e o suporte médico em terra, se necessário, possam ser acessados366.
Recomendações recentes de especialistas apontam que em todos os casos de reação sistêmica imediata a alimentos e/ou anafilaxia deve ser indicado o AIA361. Além disso, as recomendações atuais sugerem que os pacientes com asma moderada ou grave e que apresentaram anafilaxia desencadeada por alimentos devam portar uma segunda dose de adrenalina autoinjetável361.
Até o momento, não há estudos robustos que definam fatores de risco para necessidade de doses múltiplas de adrenalina. A maioria dos especialistas defende que todos os pacientes devam ter duas doses disponíveis. A prescrição universal de pelo menos dois dispositivos permite a administração de uma segunda dose para casos persistentes, piora dos sintomas, reação bifásica ou ainda no caso de erro na administração e mau funcionamento do dispositivo366.
O aumento do custo com a prescrição de dois dispositivos se justifica, uma vez que 10% das reações requerem duas ou mais doses de epinefrina durante um episódio de anafilaxia367. Ademais, existe a probabilidade de atraso em conseguir assistência médica como, por exemplo, em áreas de difícil acesso ou durante viagens. Caso pacientes e cuidadores esqueçam de substituir o autoinjetor vencido ou não puderem fazê-lo por outros motivos, é preferível usar o dispositivo expirado a não usar dispositivo algum.
Estudos recentes mostraram que autoinjetores vencidos apresentam concentração de adrenalina (80% a 90%), muito além de suas datas de validade. Porém, as doses pediátricas podem degradar-se mais rapidamente após o vencimento da data de validade em comparação com as doses para adultos.368 Portanto, para justificar a prescrição de apenas um dispositivo, autoinjetores de "uso genérico" ou de "estoque" precisariam estar disponíveis em escolas e outros ambientes públicos, semelhante ao fornecimento comunitário de desfibriladores cardíacos, o que não ocorre na prática em nosso meio.
A dose recomendada de adrenalina para tratamento de anafilaxia é de 0,01 mg/kg de peso corporal da solução de 1:1000 (1 mg/mL), com uma dose máxima de 0,5 mg em adultos e 0,3 mg em crianças. A administração deve ser preferencialmente realizada por via intramuscular (IM) na região ântero-lateral da coxa, podendo ser repetida a cada 5 a 15 minutos conforme necessário. A Tabela 17 mostra as doses recomendadas de acordo com o peso369.
Recomenda-se que, quando for necessária uma dose adicional de adrenalina, após administração de 0,3 mg, que a dose subsequente seja de 0,5 mg. A técnica de administração do AIA é essencial, incluindo a necessidade de posicionar a agulha contra a coxa e manter a pressão por alguns segundos para garantir a aplicação completa da medicação369,370.
A literatura aponta que 2% a 3% das reações anafiláticas graves não respondem a duas doses de adrenalina. Neste caso, podemos estar falando de anafilaxia refratária. No entanto, alguns aspectos devem ser considerados nestes casos: verificar se houve aplicação correta da adrenalina; questionar se a aplicação foi feita logo no início da reação ou se tardiamente; se o AIA foi utilizado corretamente; local de aplicação; se o tempo de espera durante a pressão na pele foi suficiente; se a dose estava adequada; se estava na validade. Recomenda-se que fatores como dosagem, comprimento da agulha, custo e acesso e preferências de tratamento do paciente, devem ser levados em consideração ao prescrever um autoinjetor371.
Por exemplo, no caso do paciente obeso, pode ocorrer injeção subcutânea ao invés de intramuscular em função do tamanho da agulha, que pode ser insuficiente para alcançar a musculatura. Além disso, a dose fixa dos autoinjetores poderia ser insuficiente ou mesmo ser aplicada uma superdosagem, principalmente no caso das crianças. Apesar disso, para a grande maioria dos pacientes com anafilaxia, os autoinjetores são a opção mais segura e eficaz, e seu porte cotidiano deve ser estimulado por todos que estão sob risco de apresentar novos episódios371.
Quando a adrenalina não funciona é fundamental buscar tratamento médico de emergência, para iniciar infusão intravenosa (IV) de adrenalina em baixa dose, administração de fluidos suficientes e permitir que a adrenalina alcance nível tecidual. Outra possibilidade seria a refratariedade pelo uso de betabloqueadores, e neste caso pode ser indicado o uso de glucagon como terapia adjunta.
Além disso, recentemente o Comitê dos Medicamentos de Uso Humano (CHMP) da Agência Europeia de Medicamentos (EMA) recomendou a concessão de uma autorização de introdução no mercado da União Europeia (UE) para o Eurneffy, já aprovado nos Estados Unidos da América, a primeira adrenalina administrada por via nasal para o tratamento da anafilaxia. Existem outros laboratórios desenvolvendo formulações intranasais e sublinguais.
O plano de ação deve detalhar as informações clínicas, telefone e nome dos contatos em caso de emergência, além das orientações sobre os medicamentos e ação no caso das reações alérgicas. Deve ser revisto e treinado periodicamente pelo médico e paciente e/ou responsáveis durante a consulta (Figura 7).
Na urgência e emergência
Como citado anteriormente, a anafilaxia é uma reação alérgica aguda grave, potencialmente fatal e necessita de tratamento imediato e apropriado. Para que a intervenção seja imediata, os médicos que trabalham no pronto atendimento devem ser treinados e orientados para o reconhecimento precoce dos sinais e sintomas de anafilaxia, evitando dessa forma a progressão para anafilaxia fatal e mantendo-se alertas para a possibilidade de uma reação bifásica362.
Devido às dificuldades de realizar ensaios clínicos randomizados na abordagem da anafilaxia, as diretrizes são muito utilizadas porque baseiam-se nas melhores evidências de pesquisa disponíveis, em teoria e consenso de especialistas.
Artigo recentemente publicado cita uma lista de materiais e medicamentos necessários para o tratamento da anafilaxia e que é transcrita abaixo pela grande utilidade na prática clínica. Estes materiais e medicamentos devem estar disponíveis nas unidades de saúde372.
1. Estetoscópio, oxímetro de pulso e equipamento para monitorização contínua da pressão arterial e cardíaca e relógio.
2. Torniquetes, seringas de 1 mL, 10 mL, 20 mL; agulhas (tamanho 19, 21, 23 e 25) e intramusculares; cateteres (calibres 14, 16, 18, 20 e 22).
3. Adrenalina aquosa (1 mg/mL ou 1/1.000): dose de 0,01 mg/kg para máximo de 0,5 mg (adulto) e 0,3 mg (criança).
4. Equipamento para fornecimento de oxigênio (tanque de oxigênio).
5. Equipamento para administração de fluidos intravenosos.
6. Material de intubação: bolsa/válvula/máscara com reservatório (volume 700-1.000 mL (adulto), 100-700 mL (criança) e máscaras faciais descartáveis; cânulas orofaríngeas: 6 cm, 7 cm, 8 cm, 9 cm, 10 cm; máscaras de bolso, cânula nasal e máscara laríngea.
7. Anti-histamínicos IV (difenidramina: 25-50 mg, no adulto, e 1 mg/kg, máximo 50 mg, na criança).
8. Corticosteroides IV (hidrocortisona 200 mg, no adulto, máximo 100 mg, na criança ou metilprednisolona 50-100 mg, no adulto, e 1 mg/kg, máximo 50 mg, na criança).
9. Vasopressores IV (dopamina, noradrenalina).
10. Glucagon (1-5 mg no adulto, e 20-30 µg/kg, máximo 1 mg, na criança).
11. Desfibrilador.
12. Beta-adrenérgicos inalatórios: solução de salbutamol 2,5 mg/3 mL ou 5 mg/3 mL (adulto); (2,5 mg/3 mL, criança) administrado por nebulizador e máscara facial; salbutamol spray, espaçadores e máscaras.
13. Outros suprimentos: tubos de extensão, conectores em T, apoios para braços, protocolo de emergência escrito para tratamento de anafilaxia, fluxograma para registro de tempos e eventos, luvas.
14. Disponibilidade de oxigênio.
15. Material para punção e terapia venosa.
Adrenalina
O uso de adrenalina intramuscular (IM) é considerado como primeira linha de tratamento na anafilaxia. Deve ser administrada no músculo vasto lateral da coxa, nas seguintes doses: 0,01 mg/kg na concentração de 1:1.000 (máximo de 0,3 mg em crianças) e 0,3 mg ou 0,5 mg na concentração de 1:1.000 em adultos para qualquer episódio de anafilaxia373. Caso seja necessária, dependendo da resposta da dose inicial, pode ser repetida em 5 a 15 minutos374.
A infusão intravenosa deve ser administrada em via dedicada apenas aos pacientes que não respondem à injeção intramuscular (após três aplicações), sob monitoramento cuidadoso de ECG. Quando se faz uso de betabloqueadores, deve-se manter sempre uso de adrenalina como primeira conduta e, em caso de inefetividade, utilizar glucagon375.
Outras vias de administração de adrenalina estão sendo estudadas, como a via intranasal e formulações de adrenalina em filmes orodispersíveis (sublingual), sendo que este último ainda em fase III, mas ambos com resultados promissores376,377.
Posicionar o paciente
Posicionar o paciente corretamente é essencial no tratamento da anafilaxia. A posição horizontal, com ou sem pernas elevadas, maximiza o retorno venoso. Caso o paciente esteja desconfortável nessa posição, geralmente por acometimento das vias aéreas ou da respiração, o paciente pode ficar semi-inclinado com as pernas elevadas ou não378.
Não se deve alterar a postura de supino para posição em pé, pois pode haver problemas cardiovasculares graves, colapso e morte durante a anafilaxia, devido à redução do retorno venoso e consequente redução do enchimento miocárdico e perfusão379.
Volume
As diretrizes atuais recomendam administrar fluidos intravenosos precocemente com a primeira dose de adrenalina em pacientes com envolvimento cardiovascular, pois a adrenalina pode não ser eficaz em restaurar o volume circulatório. A solução fisiológica 0,9% é preferida dentre outras soluções na maioria das situações, sendo que os adultos devem receber 1 a 2 litros de solução salina normal em acesso venoso calibroso. As crianças devem receber solução salina em bolus de 10 a 20 mL/kg, por cinco a 10 minutos, e repetidos, conforme necessário. Pode ser administrada também em casos graves de anafilaxia com comprometimento respiratório importante e quando uma segunda dose de adrenalina intramuscular for necessária362.
Anti-histamínicos
Os anti-histamínicos têm início de ação lento e nunca são usados como tratamento de primeira linha da anafilaxia. São muito utilizados no alívio das reações cutâneas. Podem ser administrados no pronto atendimento pela via intravenosa, podendo ter efeito coadjuvante no tratamento, mas nunca no lugar da administração intramuscular de adrenalina380.
Corticosteroides
Apesar da administração frequente em casos de anafilaxia, há escassez de dados sobre o benefício clínico dos glicocorticoides, também devendo ser evitado o seu uso como tratamento de primeira linha. Nenhum estudo estabeleceu claramente seu benefício quando combinado com adrenalina e/ou anti-histamínicos, e como capaz de prevenir a reação bifásica381.
Beta-2 agonistas inalados
O uso dessa medicação na anafilaxia é extrapolado do seu emprego para tratar a asma aguda. Nos pacientes com sintomas respiratórios leves a moderados, sem indicação de oxigenoterapia, esses medicamentos podem ser administrados por meio de inalador dosimetrado. Caso os sintomas respiratórios intensifiquem ou já se apresentem com maior gravidade, os beta-2 agonistas devem ser administrados por nebulizador e com suplementação de oxigênio. Deve-se reavaliar o paciente periodicamente para identificar a progressão da gravidade do quadro e a necessidade do uso de adrenalina362.
A Figura 8 descreve passo a passo as etapas essenciais para o tratamento adequado da anafilaxia.
Período de observação
Ainda não se estabeleceu por quanto tempo um paciente com anafilaxia deve permanecer em observação em um serviço de emergência. Dood e cols. sugeriram períodos para observação após uma anafilaxia conforme descrição abaixo382.
Considerar alta rápida (após duas horas da observação da resolução de anafilaxia) se:
- boa resposta (dentro de cinco a 10 minutos) a uma única dose de adrenalina administrada dentro de 30 minutos do início de reação; E
- resolução completa dos sintomas; E
- o paciente já tem autoinjetor de adrenalina não utilizado e foi treinado como usar; E
- existe supervisão adequada após administração.
Considerar mínimo de seis horas de observação após a resolução de sintomas se:
- foram necessárias duas doses de adrenalina IM para tratar a reação; OU
- reação bifásica anterior.
Observar por pelo menos 12 horas após resolução dos sintomas se apresentar qualquer um dos itens abaixo:
- reação grave que precisou mais de duas doses de adrenalina;
- paciente com asma grave ou cuja reação envolveu grave comprometimento respiratório;
- possibilidade de absorção contínua de alérgeno, por exemplo medicamentos de liberação lenta;
- pacientes em áreas onde o acesso a atendimento de emergência é difícil.
Considerações
Quando há suspeita precoce de anafilaxia, seja por parte dos pacientes ou dos profissionais de saúde, estes devem ser orientados a iniciar tratamento imediato.
Outras intervenções importantes a serem lembradas:
- identificação do(s) gatilho(s);
- manter consultas de rotina com alergista-imunologista ou profissional de saúde especializado;
- rever com paciente o plano de ação por escrito;
- orientar paciente a sempre portar canetas de adrenalina, preferencialmente duas, e ensinar e orientar o uso correto do autoinjetor;
- gerenciar fatores de risco para fatalidade: por exemplo, asma e doenças cardiovasculares mal controladas;
- alerta de identificação médica;
- medidas de saúde pública, por exemplo, melhoria da rotulagem dos alimentos;
- sugerir a utilização de pulseiras ou braceletes com identificação de produtos aos quais é alérgico.
Imunoterapia
As AAs impõem um fardo substancial aos indivíduos afetados e às suas famílias, que passam ansiedade considerável relacionada ao risco de exposição acidental. Isto pode determinar modificações significativas no estilo de vida, incluindo restrições alimentares, vigilância constante na seleção de alimentos e limitação de atividades sociais. Esse impacto psicológico pode ser profundo, afetando a saúde mental e a vida tanto dos pacientes como dos cuidadores. Além disso, os pacientes que passaram por uma reação grave vivem com medo de uma reação potencialmente fatal383,384.
Tradicionalmente, o tratamento padrão das alergias alimentares sempre foi evitar rigorosamente o alérgeno e tratar as reações acidentais de emergência. No entanto, a restrição alimentar pode ser um grande desafio, além de não ser capaz de mudar a evolução natural da alergia.
A imunoterapia emergiu como uma abordagem promissora para atender a demanda por tratamentos eficazes que pudessem modificar o curso da doença, proporcionar proteção duradoura e, em última análise, melhorar a qualidade de vida dos indivíduos com alergias alimentares mediadas por IgE. Ao introduzir gradualmente pequenas quantidades controladas do alérgeno no paciente, a imunoterapia visa dessensibilizar o sistema imunológico, reduzindo assim a gravidade das reações alérgicas e, em alguns casos, induzindo tolerância em longo prazo385,386.
O conceito de imunoterapia remonta a mais de um século, originalmente desenvolvido para alérgenos inalantes, como o pólen. Ao longo dos anos, a imunoterapia evoluiu, estendendo-se às alergias a veneno de himenópteros e alérgenos alimentares387.
A aplicação da imunoterapia às AAs é mais recente. Os primeiros estudos concentraram-se na imunoterapia oral (OIT), e pesquisas subsequentes exploraram outras modalidades, como a imunoterapia sublingual (SLIT) e epicutânea (EPIT). Os avanços na compreensão da base imunológica das alergias e as melhorias nos protocolos clínicos aumentaram significativamente a segurança e a eficácia desses tratamentos387.
Como funciona a imunoterapia
A imunoterapia atua introduzindo o alérgeno no sistema imunológico de forma controlada, alterando gradativamente a resposta imunológica. Esse processo começa com doses extremamente pequenas do alérgeno, que são aumentadas gradativamente ao longo do tempo. As doses iniciais baixas têm como objetivo minimizar as reações adversas e ao mesmo tempo estimular o sistema imunológico a iniciar o processo de dessensibilização.
Dessensibilização e tolerância
A dessensibilização refere-se ao estado temporário alcançado durante a imunoterapia, onde o indivíduo pode tolerar quantidades maiores do alérgeno sem sofrer uma reação alérgica. Requer exposição contínua ao alérgeno para mantê-lo. A tolerância, por outro lado, é um estado mais estável e duradouro em que o indivíduo pode consumir o alérgeno com segurança mesmo após interromper a exposição regular, que é o objetivo final da imunoterapia388.
Mecanismo de ação da imunoterapia para alergia alimentar
Em linhas gerais, envolve a introdução gradual do alérgeno específico na dieta do paciente, em quantidades controladas e crescentes, com o objetivo de dessensibilizar o sistema imunológico e reduzir a gravidade das reações alérgicas. O objetivo final não é apenas controlar os sintomas, mas potencialmente alcançar tolerância em longo prazo ao alérgeno. É considerado um método eficaz para o tratamento de pacientes com AAs mediadas por IgE389.
Os mecanismos envolvidos no desenvolvimento da tolerância e modulação imunológica durante a imunoterapia para alergia alimentar não são totalmente compreendidos. O desenvolvimento de tolerância imunológica e alterações nas respostas das células T e B foram encontrados em pacientes durante a imunoterapia390,391. Foi observada mudança nas respostas imunes da polarização das células Th2 para Th1 com um aumento no INF-γ e uma diminuição nas citocinas Th2 relacionadas (IL-4, IL-13). Durante a imunoterapia, a exposição a altas doses contínuas de alérgenos alimentares leva à anergia e/ou deleção de Th2 e a um aumento nas células T reguladoras, o que resulta na supressão de respostas alérgicas a jusante. A imunoterapia atinge de forma incompleta subconjuntos de células imunológicas do tipo 2, o que é uma mudança transitória e não permanente392. Além disso, estudos mostram que a função e o número de células Treg aumentam390,393. No desenvolvimento da tolerância periférica, as células Treg têm um papel crítico, incluindo a ativação de subpopulações celulares específicas, tais como: células T reguladoras indutíveis (iTreg), células T reguladoras naturais (nTreg) e células Tr1 e células Th3 produtoras de TGF-β394. No entanto, o impacto da imunoterapia na diferenciação das subpopulações de Treg não é bem compreendido. Certos estudos mostraram uma associação entre aumento de Tregs e melhores resultados na imunoterapia395,396, enquanto outros não comprovaram o mesmo efeito392,397.
Observou-se supressão significativa nas células T auxiliares foliculares (Tfh) e transformação de células T reguladoras foliculares (Tfr) após a imunoterapia para alimentos. As células Tfr podem ter papéis importantes para o desenvolvimento da tolerância imunológica, o que resulta em uma diminuição significativa nas respostas Th2. A modificação da resposta imune mediada por Th2 parece ser essencial para alcançar a tolerância a um alérgeno alimentar específico, ou seja, na previsão da eficácia da imunoterapia.398 Na imunoterapia com ovo, altos níveis basais de células CD4 + Th2 específicas previram fortemente o fracasso do tratamento imunoterápico399. Em um estudo focado na imunoterapia para amendoim, a falha em suprimir a resposta Th2 foi associada à falha do tratamento392.
Toda forma de imunoterapia alimentar, ou seja, imunoterapia oral, sublingual e epicutânea, é caracterizada pela diminuição da ativação de basófilos e mastócitos400,401. A diminuição da ativação de basófilos e mastócitos é observada durante a fase de dessensibilização da imunoterapia, medida pela supressão da reatividade no teste cutâneo específico para alérgenos e do teste de ativação de basófilos402. A imunoterapia oral com amendoim (OIT) e a imunoterapia sublingual com leite (SLIT) mostraram reduções precoces, mas transitórias, na ativação de basófilos com perda de tolerância após a descontinuação da imunoterapia403,404.
Durante a fase de aumento da dosagem da imunoterapia, há um aumento inicial dos níveis de IgE específica (sIgE) ao alérgeno, que é uma consequência da proliferação de células B de memória específicas, seguido por uma diminuição gradual na sIgE ao alérgeno no final da terapia405. Alterações na resposta humoral durante a imunoterapia alimentar são manifestadas por um aumento na imunoglobulina G específica para proteínas alimentares, subclasse 4 (IgG4) e na imunoglobulina A específica (IgA)406,407. O aumento da IgA específica aos alimentos pode desempenhar um papel na indução da tolerância388. Supõe-se que níveis aumentados de IgG4 específico facilitem a dessensibilização por meio de sua ligação ao receptor inibitório de IgG (FcγRIIb)408, suprimindo assim as vias de sinalização de IgE409,410. A indução de IgG4 específica para alérgenos durante a imunoterapia parece ser resultado da produção de subpopulações de linfócitos T ou B reguladores de IL-10 em pacientes dessensibilizados390,411.
A modulação na resposta dos linfócitos T CD8+ também pode ser um preditor de resposta à OIT. No estudo POISED, a OIT com amendoim mostrou que os níveis basais de células T CD8 + virgens e IgE específica para amendoim e Ara h 2 estavam em correlação positiva com a eficácia do tratamento412.
Os mecanismos relacionados à modulação da resposta imune e ao desenvolvimento da tolerância durante a imunoterapia alimentar são descritos independentemente do método de exposição ao alérgeno. Existem certas diferenças na resposta imune inicial, dependendo se o alérgeno é introduzido por via oral, sublingual ou via epicutânea.
O conhecimento básico sobre os mecanismos da SLIT foi publicado em pesquisas relacionadas a investigações de imunoterapia com pólen de gramíneas em pacientes com rinite alérgica413. Os alérgenos entregues pela SLIT são apresentados por células de Langerhans orais ou células dendríticas mieloides na mucosa oral que migram para os gânglios linfáticos de drenagem oral, onde promovem células T reguladoras positivas para FOXP3 e a produção de citocinas tolerogênicas, incluindo IL-10 e TGF-β, e regulam negativamente as citocinas relacionadas a Th2 (IL-4, IL-13)414.
Durante a aplicação epicutânea, os alérgenos passam pela epiderme e são absorvidos pelas células epidérmicas de Langerhans ou os alérgenos podem ser capturados diretamente pelas células dendríticas dérmicas. As células epidérmicas de Langerhans ou células dendríticas dérmicas migram para os gânglios linfáticos que drenam a pele, onde podem ativar células T e outras células da imunidade adaptativa para induzir a troca Th2/Th1 e o desenvolvimento de tolerância imunológica415.
Embora numerosos estudos tenham sido publicados nos últimos anos sobre os mecanismos de ação da imunoterapia para alimentos, ainda não foram esclarecidas quais alterações importantes na resposta imune estão relacionadas com a eficácia do tratamento. Pesquisas adicionais são necessárias para identificar potenciais biomarcadores preditivos de sucesso e fracasso deste tratamento416.
Tipos de imunoterapia para alergias alimentares
Imunoterapia oral (OIT)
A imunoterapia oral (OIT) envolve a administração de doses gradualmente crescentes do alimento alergênico por via oral, com o objetivo de dessensibilizar o paciente ao alérgeno até que se atinja uma dose de manutenção pré-definida.
Eficácia e resultados
Estudos demonstraram que a OIT pode determinar uma dessensibilização significativa numa proporção substancial de indivíduos, permitindo-lhes tolerar maiores quantidades do alérgeno sem reações graves. Alguns pacientes podem atingir um estado de não responsividade sustentada, uma forma de tolerância em que podem consumir o alérgeno com segurança, mesmo após um período sem ingeri-lo. A eficácia da OIT varia dependendo do alérgeno e do indivíduo, mas as taxas de sucesso (dessensibilização) em ensaios clínicos variam de 60 a 80%417-419.
Efeitos adversos e condução
Os efeitos adversos mais comuns da OIT incluem sintomas gastrointestinais (por exemplo, dor abdominal, náusea), prurido oral e na garganta, mas também podem ocorrer reações sistêmicas, como anafilaxia. Para gerir esses riscos, a OIT deve ser realizada num ambiente médico controlado, especialmente durante as fases de aumento da dose. Os pacientes também recebem frequentemente medicamentos prescritos, como anti-histamínicos para atenuar reações leves e devem portar autoinjetores de adrenalina para uso de emergência, caso necessário417-419.
Imunoterapia sublingual (SLIT)
A imunoterapia sublingual (SLIT) envolve a colocação de pequenas doses do extrato do alérgeno alimentar sob a língua, onde é absorvido pela mucosa oral. Semelhante à OIT, a dosagem começa em níveis muito baixos e é aumentada gradualmente até atingir uma dose de manutenção. A SLIT é normalmente administrada diariamente e pode ser feita em casa após a dose inicial ser administrada sob supervisão médica. Existem protocolos que fazem um período inicial da SLIT seguido de transição para OIT420,421.
Eficácia e resultados
A SLIT demonstrou ser eficaz na dessensibilização de indivíduos a uma variedade de alérgenos alimentares, incluindo amendoim e avelã. Embora a SLIT geralmente proporcione uma dessensibilização mais lenta em comparação com a OIT, ela tem um perfil de segurança favorável e pode aumentar o limiar de tolerância a alérgenos. Os ensaios clínicos relataram vários graus de eficácia, muitas vezes ligeiramente inferiores aos da OIT, mas ainda oferecendo proteção significativa contra exposições acidentais414.
Efeitos adversos e condução
A SLIT é geralmente bem tolerada, sendo a maioria das reações adversas localizadas e leves. Isso inclui prurido oral, edema local e sintomas gastrointestinais leves. As reações sistêmicas são raras. Devido ao seu perfil de segurança favorável, a SLIT tem sido estudada em crianças e indivíduos com maior risco de reações graves. Recomenda-se acompanhamento regular com um alergista para monitorar o progresso e avaliar o limiar de resposta clínica414.
Imunoterapia epicutânea (EPIT)
A imunoterapia epicutânea (EPIT) envolve a administração do alérgeno através da pele por meio de um adesivo. O adesivo contém uma pequena quantidade do alérgeno alimentar e é aplicado na pele do paciente, normalmente na parte superior do braço ou nas costas. O alérgeno é absorvido pela pele, com a finalidade de modular a resposta imunológica ao longo do tempo. Os adesivos geralmente são usados por um período específico todos os dias e são substituídos diariamente ou a cada poucos dias, de acordo com o protocolo de tratamento422.
Eficácia e resultados
A EPIT mostrou-se promissora em ensaios clínicos, especialmente para alergias ao amendoim. O método oferece uma via alternativa de exposição a alérgenos que é menos reativa do que a ingestão oral. Alguns estudos demonstraram dessensibilização significativa e melhor proteção contra exposições acidentais em crianças e adultos. Embora os níveis de dessensibilização possam não ser tão elevados como os alcançados com a OIT, a EPIT oferece uma opção que pode ser mais conveniente e potencialmente mais segura para certos pacientes422.
Efeitos adversos e condução
Os efeitos adversos mais comuns da EPIT são reações cutâneas localizadas, como prurido, eritema, e eczema leve no local do adesivo. Estas reações são geralmente leves e controláveis. As reações sistêmicas são raras, tornando a EPIT uma opção bastante segura. O monitoramento e acompanhamento regulares, com alergista, são essenciais para garantir a eficácia e segurança da terapia422.
Abordagens de imunoterapia multialérgena
As pesquisas estão cada vez mais focadas na imunoterapia multialérgena, onde os pacientes são simultaneamente dessensibilizados para múltiplos alérgenos alimentares. Esta abordagem é particularmente benéfica para indivíduos com múltiplas alergias alimentares. Estudos preliminares sugerem que a OIT multialérgena pode ser eficaz, mas requer monitoramento cuidadoso e protocolos individualizados para controlar o risco aumentado de reações adversas423,424. O uso concomitante de imunobiológicos, notadamente o omalizumabe (OMA), tem permitido alcançar resultados mais robustos e mais seguros com a imunoterapia multialérgena425,426.
Resultados de longo prazo da Imunoterapia para alergia alimentar
Sustentabilidade da dessensibilização
A sustentabilidade da dessensibilização é um fator crítico na avaliação do sucesso em longo prazo da imunoterapia. Os estudos variam nas suas conclusões relativas à tolerância duradoura, mas muitos sugerem que são necessárias doses de manutenção contínuas do alérgeno para manter a dessensibilização. Por exemplo, em ensaios OIT, alguns pacientes demonstram tolerância sustentada após um período de restrição do alimento, enquanto outros necessitam de exposição contínua para manter os seus níveis de tolerância427,428.
Dados de segurança de longo prazo
Os dados de segurança em longo prazo são importantes para avaliar a relação risco-benefício da imunoterapia para alergia alimentar429. A maioria das reações adversas ocorre durante a fase de escalonamento da dose (indução), com um declínio significativo na incidência assim que as doses de manutenção são estabelecidas. Acompanhamentos de longo prazo indicam que eventos adversos graves são raros, ressaltando a relativa segurança da imunoterapia para alergia alimentar mediada por IgE, quando conduzidas sob supervisão médica especializada424,429,430.
Melhora na qualidade de vida
A melhoria na qualidade de vida (QV) é uma medida significativa do sucesso da imunoterapia. Estudos mostram consistentemente que a dessensibilização bem-sucedida por meio da imunoterapia pode promover benefícios psicológicos e práticos substanciais para os pacientes e suas famílias. Esses benefícios incluem redução da ansiedade em relação a exposições acidentais, maior liberdade alimentar e melhores interações sociais. Os pais de crianças submetidas à imunoterapia com sucesso relatam menos estresse e melhor qualidade de vida familiar em geral431.
Recomendações das diretrizes científicas para Imunoterapia para alergia alimentar
Recomendações relativas à prática de imunoterapia alérgeno-específica, principalmente OIT, para alergia alimentar mediada por IgE foram propostas em diferentes países158,419,432-434.
Recente guideline europeu formulou recomendações, incluindo imunoterapia alérgeno-específica, usando a abordagem GRADE (do inglês, Grading of Recommendations, Assessment, Development and Evaluations) no manejo de alergias alimentares mediadas por IgE baseadas em resultados de metanálise435 e consenso entre experts de todo mundo (Tabela 18)4.
A OIT é geralmente posicionada como uma opção eficaz para induzir a dessensibilização, ou seja, aumentar o limiar de reatividade ao alérgeno durante o tratamento. A OIT também pode induzir uma tolerância mais longa ao alérgeno com dois desfechos diferentes, "não responsividade sustentada" (SU- em inglês, sustained unresponsiveness) e tolerância oral. A SU é definida como a falta de reação clínica a um alérgeno alimentar após a descontinuação da terapia ativa, mas com algum nível de exposição contínua ao alérgeno necessário para manter o estado de SU, enquanto a tolerância oral descreve uma completa falta de reatividade sem a necessidade de continuação da exposição ao alimento. No entanto, os dados ainda são muito limitados, heterogêneos e a maioria dos estudos relata resultados de SU, mas não tolerância432-434. As diretrizes não descrevem critérios específicos para a seleção de pacientes aos quais a OIT deve ser oferecida. A noção de gravidade da alergia alimentar parece ser inadequada para determinar a elegibilidade para a OIT porque o risco de reações e a sua gravidade não são previsíveis e não se correlacionam com o impacto psicossocial da alergia alimentar nos pacientes e nas suas famílias434. As diretrizes enfatizam a importância de uma decisão compartilhada com o paciente e sua família antes de iniciar e durante a imunoterapia. A OIT é vista como um tratamento personalizado, adaptado ao contexto do paciente, considerando seus desejos e objetivos, hábitos alimentares, experiência e motivação436,437.
A OIT envolve restrições e riscos, portanto requer compromisso e forte adesão, e atualmente prevê manutenção por um período "indefinido". As recomendações especificam que os centros que praticam OIT devem ter experiência neste tipo de atendimento e ter infraestrutura que permita o acompanhamento regular e personalizado dos pacientes, a realização de testes de provocação oral e o manejo de reações anafiláticas. Também recomendam a realização de cada aumento de dose em centros sob supervisão médica. As diretrizes também concordam com as contraindicações da OIT, em particular asma não controlada, esofagite eosinofílica ativa, gravidez e neoplasia ativa438,439.
Recomendações de boas práticas em imunoterapia para alergia alimentar440
- Plano de tratamento individualizado: recomenda-se desenvolver planos de tratamento personalizados com base nas alergias específicas do paciente, no histórico médico, e na saúde geral.
- Consentimento Livre e Esclarecido: discutir minuciosamente os potenciais benefícios, riscos e expectativas da imunoterapia com os pacientes e seus cuidadores. Obter consentimento informado antes de iniciar o tratamento.
- Ambiente controlado: realizar o escalonamento inicial da dose (indução) e quaisquer procedimentos de alto risco em um ambiente médico controlado e equipado para lidar com anafilaxia e outras reações graves.
- Monitoramento regular: manter acompanhamento regular para monitorar o progresso, ajustar doses e gerenciar quaisquer efeitos adversos. Fornecer aos pacientes orientações claras sobre o que fazer em caso de reações em casa.
- Educação e apoio: educar o paciente e sua família sobre o reconhecimento e manejo de reações alérgicas. Oferecer apoio psicológico.
Seleção de pacientes para imunoterapia para alergia alimentar
Critérios para seleção440
Alergia confirmada: os candidatos devem ter um diagnóstico confirmado de alergia alimentar mediada por IgE através de uma combinação de história clínica, testes de IgE específicos, testes cutâneos e teste de provocação.
Considerações sobre a idade: a imunoterapia pode ser adequada tanto para crianças como para adultos, mas melhores resultados e menores taxas de reações adversas têm sido observados em populações pediátricas. A maioria dos Guidelines recomenda a partir dos 4 anos de idade441.
Reações prévias: avaliar a gravidade e a natureza das reações alérgicas anteriores. A imunoterapia pode ser mais apropriada para pacientes com histórico de reações graves, mas deve ser abordada com cautela.
Motivação e adesão: avaliar a disposição e a capacidade do paciente e da família de aderir ao cronograma e aos protocolos rigorosos exigidos pela imunoterapia.
Contraindicações e precauções440
Asma grave não controlada: pacientes com asma mal controlada apresentam risco aumentado de reações graves e devem ser estabilizados antes de iniciar a imunoterapia.
Esofagite eosinofílica ativa: a presença de EoE ativa é uma contraindicação para OIT, pois a terapia pode exacerbar a condição.
Doenças autoimunes e neoplasias: pacientes com doenças autoimunes ou neoplasias ativas necessitam de uma avaliação mais completa antes de serem submetidos à imunoterapia.
Gravidez: a imunoterapia geralmente não é iniciada durante a gravidez. No entanto, a terapia de manutenção pode ser continuada sob cautela.
Questões de adesão: indivíduos que possam ter dificuldades com a adesão necessária para uma terapia bem-sucedida, tais como aqueles com transtornos psicológicos ou sociais significativos, devem ser cuidadosamente avaliados.
Biológicos
A Imunoterapia Oral alérgeno-específica com alimentos (OIT) é um tratamento imunomodulador para aumentar o limiar de tolerância e reduzir o risco de reações, em caso de ingestão acidental do alimento alergênico. No entanto, além de trabalhoso e prolongado, esse procedimento está associado ao risco de reações alérgicas, eventualmente graves; o que impede que seja recomendado para a prática geral442.
Dentre as estratégias estudadas para aumentar a segurança e, consequentemente, a eficácia da OIT, o uso concomitante de imunobiológicos, especificamente o omalizumabe (OMA), tem sido a mais bem sucedida. O OMA é um anticorpo monoclonal humanizado que tem como alvo a IgE e foi licenciado para uso em asma refratária a corticosteroides inalatórios e urticária crônica espontânea.
O primeiro relato de associação do OMA com a OIT é de 2011, quando Nadeu demonstrou o êxito em dessensibilizar nove de 11 pacientes alérgicos às proteínas do leite de vaca (APLV) em apenas sete a 11 semanas. Mais rápido e seguro que os protocolos convencionalmente empregados443. Estudos recentes têm demonstrado que o OMA e outras terapias anti-IgE, aumentam o limiar de reatividade aos alimentos, tanto se administrados isoladamente, quanto se associados com a imunoterapia oral. Nesse caso, podem reduzir a incidência e a gravidade dos eventos adversos e diminuir o tempo necessário para o escalonamento das doses405,442-445.
Mecanismo de ação
O OMA liga-se aos anticorpos IgE, formando imunocomplexos IgE/anti-IgE, que impedem a interação desses anticorpos com os receptores FcεRI nos mastócitos e basófilos, inibindo assim a sua degranulação e a libertação de mediadores da resposta alérgica. O bloqueio das ações da IgE circulante também induz uma regulação negativa da expressão de FCεRI, limitando mais a possibilidade de ativação dessas células442,446.
Além de basófilos e mastócitos, o FcεRI também é expresso por células dendríticas (DCs), onde se acredita que desempenhe um papel na apresentação de alérgenos às células T. Especula-se que a ação do OMA também module negativamente e expressão de FcεRI nas DCs e, assim, module negativamente a apresentação de alérgenos por DCs e consequente diminuição na função TH2, levando a maior redução da resposta alérgica442,446.
Na OIT, a exposição a altas doses contínuas de alérgenos alimentares causa anergia e/ou deleção de Th2 e a um aumento nas células T reguladoras (Treg), o que leva à supressão das respostas alérgicas subsequentes390. Por outro lado, a resposta humoral durante a imunoterapia alimentar manifesta-se por uma diminuição gradual na sIgE405 e aumento da IgG4 específica para as proteínas alimentares, além de aumento na IgA específica406,407. Postula-se que o tratamento com a combinação anti-IgE + OIT possa acarretar a dessensibilização aos alérgenos por meio da regulação negativa da expressão de FcεRI em basófilos e mastócitos, redução nos níveis de sIgE e aumento nos níveis de IgG4442.
Evidências
Existem diversos estudos que referem a associação de OMA com OIT, alguns com evidências robustas, porém poucas publicações com outros biológicos. Apenas uma publicação com Etokimabe e uma com Talizumabe, além do registro de pesquisas em andamento: com Ligelizumabe para alergia a amendoim (clinical trials.org: NTC04984876, e NTC05678959) e Dupilumabe (clinical trials.org: NTC03682770, e NTC04148352) para alergia a amendoim e leite de vaca, respectivamente.
Com relação ao OMA, existem evidências de sua eficácia, tanto como agente isolado para aumento do limiar e redução dos sintomas de alergia a alimentos, quanto como adjuvante à OIT para alimentos.
Quais são as evidências de uso atual na OIT para alimentos?
1. Ensaios clínicos com OMA + OIT para dessensibilização a leite, amendoim, ovo e múltiplos alimentos.
Publicação recente mostrando revisão sistemática e metanálises para avaliar a eficácia e segurança de OMA ou OMA + OIT em pacientes com alergia alimentar, selecionou 36 estudos, considerados de boa qualidade, dos quais nove eram ensaios clínicos randomizados (RCTs), 19 eram ensaios clínicos controlados (CCTs) e oito eram estudos observacionais. Esses 36 estudos metodologicamente consistentes, envolviam alergia a leite, ovo, amendoim e múltiplos alimentos442.
2. Revisões sistemáticas e metanálises de estudos com OMA + OIT.
Duas revisões sistemáticas e metanálises envolvendo biológicos e OIT foram publicadas recentemente. Na primeira, citada anteriormente, foi analisado o efeito do OMA como monoterapia, e como adjuvante à OIT. Como monoterapia, metanálises comparando o efeito do uso de OMA com a condição da amostra antes do seu uso, mostraram que OMA aumentou o limiar de tolerância, para leite de vaca, ovo, trigo, amendoim, e leite assado (baked) nos pacientes alérgicos a esses alimentos, e aumentou a dose tolerada a múltiplos alimentos nos multialérgicos. Também melhorou a qualidade de vida442.
Quando associado à OIT, o OMA aumentou a dose tolerada a múltiplos alimentos, aumentou as doses atingidas na dessensibilização e na manutenção da OIT, aumentou os níveis de IgG4 específica para os respectivos alimentos, e melhorou a qualidade de vida, em comparação ao período antes do tratamento. Porém, com relação à segurança e efeitos adversos da OIT, não foram comprovadas vantagens da associação com o OMA442.
Metanálise comparou OMA + OIT versus placebo + OIT, tanto no desfecho primário (taxa de dessensibilização), quanto no secundário (SU/remissão ou dose mais alta). Foi observado um efeito positivo do OMA associado à OIT para alcançar a dessensibilização ao alimento alergênico, com alta significância (RR 2,17 [1,22, 3,85]), porém, para efeito de longo prazo (SU/remissão), os resultados foram menos precisos: RR 2,42 [0,90, 6,50]444.
3. Omalizumabe aumenta a eficácia da OIT a múltiplos alimentos e possibilita dessensibilização mais rápida e segura.
Estudo pioneiro, envolvendo 48 pacientes alérgicos a múltiplos alimentos (dois a cinco alimentos cada paciente), foram randomizados 3:1 para receber OMA + OIT para múltiplos alimentos (36 pacientes) ou Placebo + OIT para múltiplos alimentos (12 pacientes). O objetivo primário era passar num TPO duplo-cego placebo controlado para dois gramas dos alimentos aos quais eram alérgicos, ao fim de 36 semanas. Em média 80% dos pacientes do grupo ativo (OMA + OIT) passaram nos respectivos TPO contra cerca de 30% do grupo OMA + Placebo425.
4. Omalizumabe, como agente isolado, aumenta o limiar para reação alérgica a alimentos.
Estudo recente analisou 177 crianças e adolescentes alérgicos a 2 ou mais alimentos (um deles, obrigatoriamente, amendoim). Randomizados na proporção 2:1, para receber OMA ou placebo por 16 a 20 semanas, os pacientes foram submetidos a TPO com 600 mg de amendoim (desfecho primário) e TPOs com os demais alimentos aos quais eram respectivamente alérgicos (desfecho secundário), no fim do período. Dos que receberam OMA, 67% passaram no TPO com amendoim, em comparação com apenas 7% dos que receberam placebo (P < 0,001). Os resultados para os principais desfechos secundários também foram consistentes: leite, 66% vs. 10%; ovo, 68% vs. 0%; caju, 41% vs. 3% (P < 0,001 para todas as comparações). Esse estudo demonstrou que o tratamento com OMA, como monoterapia, é eficiente para aumentar o limiar de reação para os alérgenos alimentares comuns426.
Com base nesse estudo, a Food and Drug Administration (FDA), órgão norte americano equivalente à Anvisa no Brasil, aprovou o uso de OMA como uma opção de tratamento para reduzir o risco de reações alérgicas graves em crianças e adultos com a alergia grave a múltiplos alimentos447.
Esse estudo inclui três etapas (OUtMATCH study), mas apenas a primeira foi relatada aqui. A segunda etapa comparará o tratamento de longo prazo (52 semanas) com OMA associado à imunoterapia oral para múltiplas alergias alimentares, e a terceira etapa avaliará a introdução de alimentos alergênicos na dieta para consumo contínuo (mínimo, 52 semanas) em casa após a descontinuação do tratamento426.
Com base nas evidências acima descritas e diversas outras já publicadas nos últimos anos, o OMA passou a ser recomendado como adjuvante da OIT para alimentos por algumas guias e grupos de experts, realçando, assim, o importante papel que pode desempenhar na condução medicamentosa e alérgeno-específica da alergia alimentar444,448.
Outros: prebióticos, probióticos, simbióticos e vitaminas
O tratamento da alergia alimentar ainda se baseia principalmente na restrição dos alérgenos e no tratamento dos sintomas. Contudo, outras intervenções, destinadas a restaurar a tolerância oral, como a utilização de prebióticos, probióticos e vitaminas, têm sido estudadas. Essas abordagens podem desempenhar um papel auxiliar na modulação da resposta imunológica e na prevenção de doenças alérgicas5.
O papel do microbioma intestinal
Estudos recentes apontam que a composição e diversidade do microbioma intestinal desempenham papel fundamental na regulação da resposta imune, sendo uma interface crítica entre o ambiente e o sistema imunológico. A disbiose intestinal - um desequilíbrio na comunidade microbiana, que se torna disfuncional - tem sido associada ao aumento da incidência de AAs, sugerindo que a modulação desse ambiente pela suplementação de bióticos e vitaminas pode ser uma estratégia eficaz na abordagem e prevenção dessas condições449.
Recente coorte canadense (Estudo CHILD) acompanhou 1.115 crianças, do nascimento até os cinco anos de vida, fazendo análises clínicas e laboratoriais (IgE específica e microbiota fecal). Demonstrou que as crianças que desenvolveram alergias, aos cinco anos, incluindo AAs (n=136; 12%), apresentavam microbiota disfuncional, no primeiro ano de vida, provavelmente, às custas de maior uso de antibióticos450.
Probióticos e a modulação imunológica
Probióticos são definidos como microrganismos vivos que, quando administrados em quantidades adequadas, conferem benefícios à saúde do hospedeiro, especialmente pela modulação do sistema imunológico. Algumas bactérias, como as cepas de Lactobacillus e Bifidobacterium, dentre eles o B. breve M-16, têm mostrado eficácia na prevenção e tratamento de doenças alérgicas ao promoverem a indução de células T reguladoras (Tregs), essenciais para a manutenção da tolerância oral. Os probióticos também atuam na produção de imunoglobulina A (IgA) secretora, na estabilização de mastócitos e na diminuição da liberação de citocinas pró-inflamatórias, como a IL-4 e a IL-5, fundamentais para o desenvolvimento de reações alérgicas450.
No contexto da AA, alguns estudos demonstram que a suplementação de probióticos em gestantes e lactantes de risco, bem como em recém-nascidos, pode reduzir significativamente a prevalência de doenças alérgicas, como a dermatite atópica e a APLV. Um exemplo clássico é o estudo de Kalliomäki e cols., que demonstrou uma redução de até 50% na prevalência de eczema atópico em crianças cujas mães receberam probióticos durante a gestação e lactação451.
Apesar destes estudos, que recomendam probióticos na prevenção das alergias, sobretudo do eczema atópico, para o tratamento das alergias de maneira geral, os resultados são menos substanciais. Neste cenário, alguns estudos com melhor desenho metodológico fornecem evidências de que as cepas probióticas específicas podem ser eficazes no tratamento de um subgrupo de pacientes com eczema atópico, sobretudo naqueles em que existe AA associada, como a APLV. Fiocchi e cols. demonstraram que a utilização de fórmula infantil extensamente hidrolisada, acrescida de probiótico (Lactobacillus rhamnosus GG), durante um mês, foi suficiente para reduzir sintomas, de 26 para 15 no grupo que recebeu diretamente o probiótico, e de 26 para 11 nos que receberam indiretamente, via leite materno. Em nenhum dos grupos houve melhora dos sintomas gastrintestinais relativos à APLV. A sequência dessas pesquisas, com associação de Lactobacillus rhamnosus GG e Bifidobacterium lactis Bb-12, revelou novamente melhora do eczema associado à APLV, porém com a manutenção dos sintomas específicos da APLV452.
A patogênese da AA, assim como a fisiologia dos mecanismos de tolerância oral, é complexa e ainda não totalmente esclarecida, mas a utilização de Lactobacillus rhamnosus GG favoreceu a aquisição da tolerância oral pelas crianças alérgicas ao LV que realizaram dieta de exclusão associada à cepa probiótica. A aquisição de tolerância com a fórmula infantil, extensamente hidrolisada, acrescida de Lactobacillus rhamnosus GG, foi significativamente mais rápida que as fórmulas de aminoácidos, as fórmulas de soja e as fórmulas hidrolisadas de arroz399. Esse resultado sugere que o Lactobacillus rhamnosus GG, como parte da dieta, diminui o tempo necessário para controlar não apenas os sintomas da APLV, mas também para estimular a aquisição natural de tolerância. O Bifidobacterium breve M-16 tem se relacionado com redução de resposta alérgica em alguns estudos e com a modulação da microbiota453-456.
Prebióticos e a saúde imunológica
Prebióticos, por sua vez, são compostos alimentares da dieta, não digeríveis, que beneficiam a saúde do hospedeiro, ao promover o crescimento seletivo de bactérias benéficas no intestino, como os lactobacilos e bifidobactérias. Eles são fundamentais para a manutenção de um ambiente intestinal saudável, favorecendo a produção de ácidos graxos de cadeia curta (AGCC), como o butirato, que tem ação anti-inflamatória e contribui para a integridade da barreira intestinal451.
Fruto-oligossacarídeos (FOS), glico-oligossacarídeos, galactooligossacarídeos, inulina, isomalto-oligossacarídeos são exemplos de prebióticos que estimulam o crescimento de probióticos intestinais, como os lactobacilos e bifidobactérias. FOS são suplementos prebióticos que podem melhorar a resposta imunológica do hospedeiro, ativar a imunidade da mucosa, pela regulação da microbiota gastrintestinal, com o potencial terapêutico sobre doenças alérgicas475.
As pesquisas demonstram que a prevenção, com uso de prebióticos, pode diminuir até 6% a incidência de manifestações alérgicas, se o protocolo de prevenção for iniciado nos primeiros anos de vida da criança457.
Do ponto de vista prebiótico, não se pode esquecer o papel fundamental dos oligossacarídeos do leite humano (HMOs do inglês, Human Milk Oligosaccharides), que são considerados componentes nutricionais ideais para lactentes, pois podem aumentar a capacidade imunomoduladora. Os HMOs podem intervir no desenvolvimento de alergias ao modificar a microbiota intestinal e aumentar os níveis específicos de ácidos graxos de cadeia curta. Além disso, os HMOs podem melhorar a permeabilidade intestinal e regular direta ou indiretamente o equilíbrio entre as células T auxiliares e as células T reguladoras, ao intensificar as vias de sinalização inflamatória para combater a alergia alimentar458,459.
Papel das vitaminas na prevenção das alergias alimentares
Dentre as AAs, a APLV é uma das mais comuns na infância, especialmente nos primeiros anos de vida. Embora o tratamento padrão envolva a eliminação da proteína do LV da dieta, o papel das vitaminas na prevenção e tratamento da APLV tem sido cada vez mais investigado, já que certos micronutrientes, como as vitaminas, são fundamentais na modulação do sistema imunológico459,460.
Vitamina D
A vitamina D é amplamente reconhecida por seu papel na saúde óssea, mas também exerce funções importantes no sistema imunológico. Estudos sugerem que a deficiência de vitamina D pode estar associada a um maior risco de doenças alérgicas, incluindo APLV. Esta vitamina possui funções imunomoduladoras que afetam tanto a imunidade inata quanto a adaptativa. A deficiência de vitamina D pode contribuir para desequilíbrios imunológicos que facilitam o desenvolvimento de alergias alimentares. Além disso, a vitamina D pode impedir a exposição do sistema imunológico intestinal a alérgenos, ao manter a integridade da barreira mucosa e reduzir a incidência de AA330,461.
Evidências indicam que a suplementação adequada de vitamina D durante a gravidez e nos primeiros anos de vida pode reduzir o risco de AAs. Estudo observacional mostrou que mães com níveis suficientes dessa vitamina durante a gestação apresentaram menor probabilidade de ter filhos com AAs, incluindo APLV462,463. No entanto, revisão sistemática não foi capaz de confirmar estes benefícios155.
Contudo, a literatura científica revela dados contraditórios: alguns estudos sugerem que a baixa exposição à luz solar está associada a AAs, enquanto outros indicam que níveis elevados de vitamina D podem aumentar a sensibilização alérgica. Portanto, mais estudos clínicos randomizados são necessários para esclarecer seu papel na prevenção de alergias464,465.
Perspectivas futuras e recomendações atuais
Embora o uso de probióticos e prebióticos no tratamento da AA tenha demonstrado benefícios em alguns estudos clínicos e experimentais, ainda há questões a serem esclarecidas, como a escolha das cepas mais eficazes, as doses e a duração ideal do tratamento. Além disso, novas abordagens, como os posbióticos (preparação de microrganismos inanimados e/ou seus componentes que conferem benefício ao hospedeiro) e o transplante de microbiota fecal, estão sendo investigadas como possíveis terapias para restaurar o equilíbrio microbiano e prevenir ou tratar as AAs, sobretudo as formas mais graves.
Sobre as vitaminas, embora seja fundamental manter níveis adequados de vitaminas por uma alimentação adequada, não existem evidências conclusivas de que a suplementação de vitaminas, por si só, possa prevenir ou tratar a alergia alimentar.
Ainda não há recomendação sistemática que suporte a prescrição de pró, pré e simbióticos, vitaminas e outros suplementos tanto no tratamento quanto na prevenção de alergias alimentares156,466,467.
Cuidados na escola com a criança com alergia alimentar
A escola é um ecossistema em que convergem e interagem a família, o aluno e a comunidade escolar com múltiplas funções. As AA requerem critérios de informação que começam na matrícula, quando a família deve informar sua existência para que se organizem medidas de prevenção, proteção e inclusão desse aluno visto que as doenças alérgicas comprometem a qualidade de vida das crianças e as expõem a riscos. Estudantes com AA precisam de uma alimentação adequada às suas necessidades, seja na rede pública ou particular de ensino.
Crianças e adolescentes que têm AA podem e devem frequentar a escola. A segurança no ambiente escolar depende do trabalho em parceria da família com a escola para que possam acolher esse estudante. Quanto melhor o acolhimento de quem tem AA, menor o risco do aluno se sentir excluído e de acontecerem situações constrangedoras como bullying. É necessário então comunicar a escola, e o estudante estar sendo seguido por pediatra, alergista, gastroenterologista ou médico assistente e levar atestado semestral desse acompanhamento. A escola deve fazer as adaptações necessárias no cardápio após reunião da família com a coordenação e professores. Os colegas de convívio diário também devem ser informados. As mudanças alimentares devem ser criteriosas, com o aval do médico assistente e é importante observar o risco de contato cruzado. Assim como outras doenças, a escola deverá receber da família um mínimo de medicamentos que podem vir a serem usados conforme prescrição médica em casos especiais e ter em mãos telefones do SAMU e serviços de urgência468.
A escola é ambiente rico de oportunidades de socialização, formação de opinião e senso crítico. Deve valorizar a inclusão, conversando coletivamente sobre o assunto e os cuidados que devem ser tomados, desenvolvendo atividades educativas que estimulem o cuidado, a generosidade e a cooperação. Aulas de culinária sob supervisão de nutricionista, aprendendo a ler os rótulos dos alimentos e suas propriedades podem facilitar essa tarefa469. Atenção especial nas comemorações e aniversários incluindo a criança com os cuidados necessários, visto que as chances de ocorrerem contatos acidentais com alérgenos são maiores em ambientes coletivos. Os alimentos mais comumente relacionados à AA são LV, ovo, trigo, soja, camarão, amendoim, castanhas, peixes e frutos do mar470.
Existem legislações específicas disponíveis, conforme descrevemos a seguir.
Lei Nº 12.982, de 28 de Maio de 2014471
Alimentação escolar para estudantes com necessidades alimentares especiais.
Determina o provimento de alimentação escolar adequada aos alunos com condição de saúde específica, dando direito a cardápio especial para alunos com AA, diabetes, doença celíaca, intolerância à lactose e outras condições específicas. Esta Lei ratifica e fortalece as diretrizes do Programa Nacional de Alimentação Escolar (PNAE), determinadas pela Lei nº 11.947/2009.
RDC Nº 26, de 02 de Julho de 2015472
Rotulagem obrigatória dos principais alimentos alergênicos.
Dispõe sobre os requisitos para rotulagem obrigatória dos principais alimentos que causam AA. Se o produto comercializado for o alimento alergênico listado no Anexo da RDC nº 26, de 2015, ou contiver a adição deste alimento, deve ser declarada a advertência: ALÉRGICOS: CONTÉM (NOME COMUM DO ALIMENTO ALERGÊNICO). Quando o produto comercializado contiver a adição de um derivado de alimento alergênico (ex. farinha de trigo, iogurte, extrato de soja, caseína), deve ser veiculada a advertência: ALÉRGICOS: CONTÉM DERIVADOS DE (NOME COMUM DO ALIMENTO ALERGÊNICO). Nas situações em que o alimento tiver a adição tanto do alimento alergênico como de seus derivados, deve ser veiculada a advertência: ALÉRGICOS: CONTÉM (NOME COMUM DO ALIMENTO ALERGÊNICO) E DERIVADOS. Nos casos em que não for possível garantir a ausência de contato cruzado dos alimentos, ingredientes, aditivos alimentares ou coadjuvantes de tecnologia por alérgenos alimentares, deve constar no rótulo a declaração "ALÉRGICOS: PODE CONTER (NOMES COMUNS DOS ALIMENTOS QUE CAUSAM ALERGIAS ALIMENTARES)".
Lei Nº 13.722, de 4 de Outubro de 2018 - "Lei Lucas"473
Capacitação em primeiros socorros para funcionários de escola.
Torna obrigatória a capacitação anual em noções básicas de primeiros socorros de professores e funcionários de estabelecimentos de ensino públicos e privados de educação básica e de estabelecimentos de recreação infantil. Todos os funcionários que lidem diretamente com as crianças devem saber o que fazer em emergências, principalmente em casos de alergias graves e anafilaxia.
Na Tabela 19 são apresentadas algumas sugestões de medidas a serem adotadas para a segurança do paciente.
Crianças com AA devem estar conscientizadas quanto à sua saúde e seu comportamento, necessitam que seus pais desenvolvam recursos junto à escola e comunidade escolar para um bom desempenho e autoestima, tendo sempre a supervisão e orientação de seus médicos. Sugere-se que crianças e adolescentes portem sempre pulseiras ou dispositivos informando a que alimentos ou medicamentos são alérgicos.
Reavaliação do status alérgico
A resolução das alergias alimentares é um processo complexo e individualizado, variando conforme o alimento alergênico e as características específicas de cada paciente, bem como o mecanismo da reação. O processo de tolerância ainda não é completamente compreendido, envolvendo provavelmente múltiplos fatores.
No caso das reações mediadas por IgE, a queda nos níveis de IgE específica ao alimento é considerada o melhor preditor de desenvolvimento de tolerância clínica477,478. No entanto, é importante notar que alguns pacientes podem desenvolver tolerância mesmo com IgE específica elevada e teste cutâneo de leitura imediata positivo.
Um aspecto crucial na avaliação do paciente alérgico é a investigação de exposições acidentais ao alimento e suas diferentes apresentações e as possíveis reações decorrentes. Essas informações fornecem dados valiosos sobre o desenvolvimento de tolerância.
A reavaliação do paciente com alergia alimentar deve incluir:
- testes in vitro (IgE específica);
- teste cutâneo de leitura imediata (prick test); e
- anamnese detalhada, incluindo informações sobre exposições acidentais.
Geralmente, recomenda-se uma reavaliação anual. No entanto, a frequência pode ser ajustada conforme o caso, como exposto nos exemplos abaixo186.
- Crianças pequenas com alergia a frutas: reavaliação a cada 6 meses;
- Crianças mais velhas com alergias persistentes (amendoim) e testes alérgicos elevados: intervalos maiores entre reavaliações.
É importante ressaltar que nem o prick test nem a IgE específica são métodos infalíveis para determinar a tolerância a um alimento479,480:
- testes negativos não garantem perda de alergia;
- testes positivos podem persistir mesmo após o desenvolvimento de tolerância.
O teste de provocação sob supervisão médica é indicado nos casos graves mediados por IGE e nas formas da FPIES não mediada por IgE em ambiente com disponibilidade de material e medicações de urgência.
O monitoramento da alergia alimentar requer uma abordagem multifacetada, combinando a avaliação clínica e, quando necessário, testes laboratoriais e provocação oral. A interpretação cuidadosa desses dados é essencial para determinar o desenvolvimento de tolerância e ajustar o tratamento da alergia alimentar, que deve ser feito sempre de modo individualizado.
Referências
1. Jutel M, Agache I, Zemelka-Wiacek M, Akdis M, Chivato T, del Giacco S, et al. Nomenclature of allergic diseases and hypersensitivity reactions: Adapted to modern needs: An EAACI position paper. Allergy. 2023;78(11):2851-74.
2. De Martinis M, Sirufo MM, Suppa M, Ginaldi L. New perspectives in food allergy. Int J Mol Sci. 2020;21(4):1474.
3. Calvani M, Anania C, Caffarelli C, Martelli A, Giudice MM Del, Cravidi C, et al. Food allergy: An updated review on pathogenesis, diagnosis, prevention and management. Acta Biomed. 2020;91(11-S):e2020012.
4. Santos AF, Riggioni C, Agache I, Akdis CA, Akdis M, Alvarez-Perea A, et al. EAACI guidelines on the diagnosis of IgE-mediated food allergy. Allergy. 2023;78(12):3057-76.
5. Bartha I, Almulhem N, Santos AF. Feast for thought: A comprehensive review of food allergy 2021-2023. J Allergy Clin Immunol. 2024;153:576-94.
6. Sampath V, Abrams EM, Adlou B, Akdis C, Akdis M, Brough HA, et al. Food allergy across the globe. J Allergy Clin Immunol. 2021;148:1347-64.
7. Grabenhenrich L, Trendelenburg V, Bellach J, Yürek S, Reich A, Fiandor A, et al. Frequency of food allergy in school-aged children in eight European countries - The EuroPrevall-iFAAM birth cohort. Allergy. 2020;75(9):2294-308.
8. National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division; Food and Nutrition Board; Committee on Food Allergies: Global Burden, Causes, Treatment, Prevention, and Public Policy; Oria MP, Stallings VA, editors. Finding a path to safety in food allergy: assessment of the global burden, causes, prevention, management, and public policy. Washington (DC): National Academies Press (US); 2016 Nov 30, 560 p.
9. Loh W, Tang MLK. The epidemiology of food allergy in the global context. Int J Environ Res Public Health. 2018;15(9):2043.
10. Spolidoro GCI, Amera YT, Ali MM, Nyassi S, Lisik D, Ioannidou A, et al. Frequency of food allergy in Europe: An updated systematic review and meta-analysis. Allergy. 2023;78:351-68.
11. Sicherer SH, Sampson HA. Food allergy: A review and update on epidemiology, pathogenesis, diagnosis, prevention, and management. J Allergy Clin Immunol. 2018;141(1):41-58.
12. Vieira MC, Morais MB, Spolidoro JV, Toporovski MS, Cardoso AL, Araujo GT, et al. A survey on clinical presentation and nutritional status of infants with suspected cow' milk allergy. BMC Pediatr. 2010;10:25.
13. Gonçalves LCP, Guimarães TCP, Silva RM, Cheik MFA, de Ramos Nápolis AC, Barbosa e Silva G, et al. Prevalence of food allergy in infants and pre-schoolers in Brazil. Allergol Immunopathol (Madr). 2016;44(6):497-503.
14. Silva LA, Silva AFM, Ribeiro ÂC, Silva AO, Vieira FA, Segundo GRS. Adult Food Allergy Prevalence: Reducing Questionnaire Bias. Int Arch Allergy Immunol. 2017;171(3-4):261-4.
15. Correia J. Prevalência de alergia alimentar em pré-escolares de Limoeiro - PE. [Recife]: Faculdade de Medicina, Universidade Federal de Pernambuco; 2020. Dissertação de Mestrado - Saúde da Criança e do Adolescente. Disponível em: https://repositorio.ufpe.br/handle/123456789/38832 Acessado em setembro de 2024.
16. Bernd LAG, Fleig F, Alves MB, Bertozzo R, Coelho M, Correia J, et al. Rev bras alerg imunopatol. 2010;33(5):190-8.
17. Solé D, Ivancevich JC, Borges MS, Coelho MA, Rosário NA, Ardusso LRF, et al. Anaphylaxis in Latin America: A report of the online Latin American survey on anaphylaxis (OLASA). Clinics. 2011;66(6):943-7.
18. Nunes FA, Zanini F, Braga C de S, da Silva AL, Fernandes FR, Solé D, et al. Incidence, triggering factors, symptoms, and treatment of anaphylaxis in a pediatric hospital. World Allergy Organ J. 2022;15(9):100689.
19. Felix MMR, Solé D, Chong-Neto HJ, Goudouris ES, Watanabe AS, Rubini N de PM, et al. Epidemiologia da anafilaxia no Brasil: Registro Brasileiro de Anafilaxia (RBA) da Associação Brasileira de Alergia e Imunologia (ASBAI). Arq Asma Alergia Imunologia. 2024;8(1):35-42.
20. Peters RL, Guarnieri I, Tang MLK, Lowe AJ, Dharmage SC, Perrett KP, et al. The natural history of peanut and egg allergy in children up to age 6 years in the HealthNuts population-based longitudinal study. J Allergy Clin Immunol. 2022;150(3):657-665.e13.
21. Aranda CS, Cocco RR, Pierotti FF, Mallozi MC, Franco JM, Porto A, et al. Increased sensitization to several allergens over a 12-year period in Brazilian children. Pediatr Allergy Immunol. 2018;29(3):321-4.
22. Gupta RS, Warren CM, Smith BM, Jiang J, Blumenstock JA, Davis MM, et al. Prevalence and Severity of Food Allergies Among US Adults. JAMA Netw Open. 2019;2(1):e185630.
23. Strobel S, Mowat AM. Immune responses to dietary antigens: oral tolerance. Immunol Today. 1998;19(4):173-81.
24. Cela L, Brindisi G, Gravina A, Pastore F, Semeraro A, Bringheli I, et al. Molecular Mechanism and Clinical Effects of Probiotics in the Management of Cow's Milk Protein Allergy. Int J Mol Sci. 2023;24(12):9781.
25. Tordesillas L, Berin MC. Mechanisms of Oral Tolerance. Clin Rev Allergy Immunol. 2018;55(2):107-17.
26. Anvari S, Miller J, Yeh CY, Davis CM. IgE-Mediated Food Allergy. Clin Rev Allergy Immunol. 2019;57(2):244-60.
27. Locke A, Hung L, Upton JEM, O'Mahony L, Hoang J, Eiwegger T. An update on recent developments and highlights in food allergy. Allergy. 2023;78:2344-60.
28. Berin MC. Pathogenesis of IgE-mediated food allergy. Clin Exp Allergy. 2015;45(10):1483-96.
29. Torrente F, Murch S. Food allergic enteropathy. In: Kleinman RE, Goluet OJ, Mieli-Vergani G, Sanderson IR, Sherman PM, Shneider Benjamin L (ed), Walker's Pediatric gastrointestinal disease. New York, 2018; p:1354-86.
30. Black CJ, Drossman DA, Talley NJ, Ruddy J, Ford AC. Functional gastrointestinal disorders: advances in understanding and management. Lancet. 2020;396(10263):1664-74.
31. Cortez APB, Fisberg M, de Morais MB. Intestinal permeability and small intestine bacterial overgrowth in excess weight adolescents. Pediatr Obes. 2021;16(5):e12741.
32. Zhang S, Sicherer S, Berin MC, Agyemang A. Pathophysiology of Non-IgE-Mediated Food Allergy. Immunotargets Ther. 2021;10:43146.
33. Lozinsky AC, Morais MB de. Eosinophilic colitis in infants. J Pediatr (Rio J). 2014;90(1):16-21.
34. Kelly KJ, Lazenby AJ, Rowe PC, Yardley JH, Perman JA, Sampson HA. Eosinophilic esophagitis attributed to gastroesophageal reflux: Improvement with an amino acid-based formula. Gastroenterology. 1995;109(5):1503-12.
35. Molina-Infante J, Lucendo AJ. Dietary therapy for eosinophilic esophagitis. J Allergy Clin Immunol. 2018;142(1):41-7.
36. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: Updated consensus recommendations for children and adults. J Allergy Clin Immunol. 2011;128(1):3-20.
37. Straumann A, Bauer M, Fischer B, Blaser K, Simon HU. Idiopathic eosinophilic esophagitis is associated with a TH2-type allergic inflammatory response. J Allergy Clin Immunol. 2001;108(6):95461.
38. Blanchard C, Mingler MK, Vicario M, Abonia JP, Wu YY, Lu TX, et al. IL-13 involvement in eosinophilic esophagitis: Transcriptome analysis and reversibility with glucocorticoids. J Allergy Clin Immunol. 2007;120(6):1292-300.
39. Blanchard C, Stucke EM, Burwinkel K, Caldwell JM, Collins MH, Ahrens A, et al. Coordinate Interaction between IL-13 and Epithelial Differentiation Cluster Genes in Eosinophilic Esophagitis. J Immunology. 2010;184(7):4033-41.
40. Cianferoni A, Ruffner MA, Guzek R, Guan S, Brown-Whitehorn T, Muir A, et al. Elevated expression of activated TH2 cells and milk-specific TH2 cells in milk-induced eosinophilic esophagitis. Ann Allergy Asthma Immunol. 2018;120(2):177-183.e2.
41. Rothenberg ME, Wen T, Greenberg A, Alpan O, Enav B, Hirano I, et al. Intravenous anti-IL-13 mAb QAX576 for the treatment of eosinophilic esophagitis. J Allergy Clin Immunol. 2015;135(2):500-7.
42. Spergel JM, Rothenberg ME, Collins MH, Furuta GT, Markowitz JE, Fuchs G, et al. Reslizumab in children and adolescents with eosinophilic esophagitis: Results of a double-blind, randomized, placebo-controlled trial. J Allergy Clin Immunol. 2012;129(2):456-463.e3.
43. Straumann A, Conus S, Grzonka P, Kita H, Kephart G, Bussmann C, et al. Anti-interleukin-5 antibody treatment (mepolizumab) in active eosinophilic oesophagitis: a randomised, placebo-controlled, double-blind trial. Gut. 2010;59(01):21-30.
44. Hirano I, Collins M, Assouline-Dayan Y, Evans L, Gupta S, Schoepfer A, et al. A randomized, double blind, placebo-controlled trial of a novel recombinant, humanized, anti-interleukin-13 monoclonal antibody (RPC4046) in patients with active eosinophilic oesophagitis: results of the HEROES study. United Eur Gastroenterol J. 2016;2(Suppl 1):4.
45. Hirano I, Dellon ES, Hamilton JD, Collins MH, Peterson K, Chehade M, et al. Efficacy of Dupilumab in a Phase 2 Randomized Trial of Adults With Active Eosinophilic Esophagitis. Gastroenterology. 2020;158(1):111-122.e10.
46. Noti M, Wojno EDT, Kim BS, Siracusa MC, Giacomin PR, Nair MG, et al. Thymic stromal lymphopoietin-elicited basophil responses promote eosinophilic esophagitis. Nat Med. 2013;19(8):1005-13.
47. Clayton F, Fang JC, Gleich GJ, Lucendo AJ, Olalla JM, Vinson LA, et al. Eosinophilic Esophagitis in Adults Is Associated With IgG4 and Not Mediated by IgE. Gastroenterology. 2014;147(3):602-9.
48. Schuyler AJ, Wilson JM, Tripathi A, Commins SP, Ogbogu PU, Kruzsewski PG, et al. Specific IgG4 antibodies to cow's milk proteins in pediatric patients with eosinophilic esophagitis. J Allergy Clin Immunol. 2018;142(1):139-148.e12.
49. Mishra A, Schlotman J, Wang M, Rothenberg ME. Critical role for adaptive T cell immunity in experimental eosinophilic esophagitis in mice. J Leukoc Biol. 2007;81(4):916-24.
50. Jensen ET, Hoffman K, Shaheen NJ, Genta RM, Dellon ES. Esophageal Eosinophilia is Increased in Rural Areas With Low Population Density: Results From a National Pathology Database. Am J Gastroenterol. 2014;109(5):668-75.
51. Jensen ET, Kappelman MD, Kim HP, Ringel-Kulka T, Dellon ES. Early Life Exposures as Risk Factors for Pediatric Eosinophilic Esophagitis. J Pediatr Gastroenterol Nutr. 2013;57(1):67-71.
52. van Nimwegen FA, Penders J, Stobberingh EE, Postma DS, Koppelman GH, Kerkhof M, et al. Mode and place of delivery, gastrointestinal microbiota, and their influence on asthma and atopy. J Allergy Clin Immunol. 2011;128(5):948-955.e3.
53. Miftahussurur M, Nusi IA, Graham DY, Yamaoka Y. Helicobacter, Hygiene, Atopy, and Asthma. Front Microbiol. 2017;8:1034.
54. Dellon ES, Peery AF, Shaheen NJ, Morgan DR, Hurrell JM, Lash RH, et al. Inverse Association of Esophageal Eosinophilia With Helicobacter pylori Based on Analysis of a US Pathology Database. Gastroenterology. 2011;141(5):1586-92.
55. Molina-Infante J, Gutierrez-Junquera C, Savarino E, Penagini R, Modolell I, Bartolo O, et al. Helicobacter Pylori Infection Does Not Protect Against Eosinophilic Esophagitis: Results From a Large Multicenter Case-Control Study. Am J Gastroenterol. 2018;113(7):972-9.
56. Kottyan LC, Davis BP, Sherrill JD, Liu K, Rochman M, Kaufman K, et al. Genome-wide association analysis of eosinophilic esophagitis provides insight into the tissue specificity of this allergic disease. Nat Genet. 2014;46(8):895-900.
57. Warners MJ, van Rhijn BD, Verheij J, Smout AJPM, Bredenoord AJ. Disease activity in eosinophilic esophagitis is associated with impaired esophageal barrier integrity. Am J Phys Gastroint Liver Physiol. 2017;313(3):G230-8.
58. Cheng E, Souza RF, Spechler SJ. Eosinophilic Esophagitis. Gastroenterol Clin North Am. 2014;43(2):243-56.
59. Fritz J, Lerner D, Suchi M. Herpes Simplex Virus Esophagitis in Immunocompetent Children. J Pediatr Gastroenterol Nutr. 2018;66(4):609-13.
60. Capocelli KE, Fernando SD, Menard-Katcher C, Furuta GT, Masterson JC, Wartchow EP. Ultrastructural features of eosinophilic oesophagitis: impact of treatment on desmosomes. J Clin Pathol. 2015;68(1):51-6.
61. van Rhijn BD, Weijenborg PW, Verheij J, van den Bergh Weerman MA, Verseijden C, van den Wijngaard RMJGJ, et al. Proton Pump Inhibitors Partially Restore Mucosal Integrity in Patients With Proton Pump Inhibitor-Responsive Esophageal Eosinophilia but Not Eosinophilic Esophagitis. Clin Gastroenterol Hepatol. 2014;12(11):1815-1823.e2.
62. Sherrill JD, KC K, Wu D, Djukic Z, Caldwell JM, Stucke EM, et al. Desmoglein-1 regulates esophageal epithelial barrier function and immune responses in eosinophilic esophagitis. Mucosal Immunol. 2014;7(3):718-29.
63. Davis BP, Stucke EM, Khorki ME, Litosh VA, Rymer JK, Rochman M, et al. Eosinophilic esophagitis-linked calpain 14 is an IL-13-induced protease that mediates esophageal epithelial barrier impairment. JCI Insight. 2016;1(4):e86355.
64. Puxeddu I, Ribatti D, Crivellato E, Levi-Schaffer F. Mast cells and eosinophils: A novel link between inflammation and angiogenesis in allergic diseases. J Allergy Clin Immunol. 2005;116(3):531-6.
65. Gomes I, Mathur SK, Espenshade BM, Mori Y, Varga J, Ackerman SJ. Eosinophil-fibroblast interactions induce fibroblast IL-6 secretion and extracellular matrix gene expression: Implications in fibrogenesis. J Allergy Clin Immunol. 2005;116(4):796-804.
66. Nguyen N, Fernando SD, Biette KA, Hammer JA, Capocelli KE, Kitzenberg DA, et al. TGF-β1 alters esophageal epithelial barrier function by attenuation of claudin-7 in eosinophilic esophagitis. Mucosal Immunol. 2018;11(2):415-26.
67. Akiho H. Cytokine-induced alterations of gastrointestinal motility in gastrointestinal disorders. World J Gastrointest Pathophysiol. 2011;2(5):72.
68. Hu Y, Liu Z, Yu X, Pasricha PJ, Undem BJ, Yu S. Increased acid responsiveness in vagal sensory neurons in a guinea pig model of eosinophilic esophagitis. Am J Physiol Gastrointest Liver Physiol. 2014;307(2):G149-57.
69. Zhang S, Shoda T, Aceves SS, Arva NC, Chehade M, Collins MH, et al. Mast cell-pain connection in eosinophilic esophagitis. Allergy. 2022;77(6):1895-9.
70. Kulka M, Sheen CH, Tancowny BP, Grammer LC, Schleimer RP. Neuropeptides activate human mast cell degranulation and chemokine production. Immunology. 2008;123(3):398-410.
71. Kupari J, Häring M, Agirre E, Castelo-Branco G, Ernfors P. An Atlas of Vagal Sensory Neurons and Their Molecular Specialization. Cell Rep. 2019;27(8):2508-2523.e4.
72. Dellon ES, Rothenberg ME, Collins MH, Hirano I, Chehade M, Bredenoord AJ, et al. Dupilumab in Adults and Adolescents with Eosinophilic Esophagitis. N Eng J Med. 2022;387(25):2317-30.
73. Aalberse RC, Akkerdaas J, van Ree R. Cross-reactivity of IgE antibodies to allergens. Allergy. 2001;56:478-90.
74. Pascal M, Grishina G, Yang AC, Sánchez-García S, Lin J, Towle D, et al. Molecular diagnosis of shrimp allergy: Efficiency of several allergens to predict clinical reactivity. J Allergy Clin Immunol Pract. 2015;3(4):521-529.e10.
75. Matricardi PM, Kleine-tebbe J, Hoffmann J, Valenta R, Ollert M, Ree R Van, et al. EAACI Molecular Allergology User's Guide. Pediatr Allergy Immunol. 2016;27(Suppl 23):1-250.
76. Rosario-Filho NA, Jacob CM, Sole D, Condino-Neto A, Arruda LK, Costa-Carvalho B, et al. Pediatric allergy and immunology in Brazil. Pediatr Allergy Immunol. 2013;24(4):402-9.
77. American College of Allergy, Asthma, and Immunology. FDA considers new food allergen labeling. November 5, 2018. Disponível em: https://college.acaai.org/fda-considers-new-food-allergen-labeling/ Acessado em setembro de 2024.
78. Aalberse R, Koshte V, Clemens J. Immunoglobulin E antibodies that cross react with vegetable foods, pollen, and Hymenoptera venom. J Allergy Clin Immunol. 1981;68(5):356-64.
79. Platts-Mills TA, Hilger C, Jappe U, van Hage M, Gadermaier G, Spillner E, et al. Carbohydrate epitopes currently recognized as targets for IgE antibodies. Allergy. 2021;76(8):2383-94.
80. Platts-Mills TAE, Schuyler AJ, Tripathi A, Commins SP. Anaphylaxis to the Carbohydrate Side Chain Alpha-gal. Immunol Allergy Clin North Am. 2015;35(2):247-60.
81. van Ree R. Carbohydrate Epitopes and Their Relevance for the Diagnosis and Treatment of Allergic Diseases. Int Arch Allergy Immunol. 2002;129(3):189-97.
82. Platts-Mills TAE, Li R chi, Keshavarz B, Smith AR, Wilson JM. Diagnosis and Management of Patients with the α-Gal Syndrome. J Allergy Clin Immunol Pract. 2020;8(1):15-23.e1.
83. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 1 - Etiopatogenia, clínica e diagnóstico. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia. Arq Asma Alerg Imunol.2018;2(1):7-38.
84. Nicolaou N, Poorafshar M, Murray C, Simpson A, Winell H, Kerry G, et al. Allergy or tolerance in children sensitized to peanut: Prevalence and differentiation using component-resolved diagnostics. J Allergy Clin Immunol. 2010;125(1):191-197.e13.
85. Vieths S, Scheurer S, Ballmer-Weber B. Current Understanding of Cross-Reactivity of Food Allergens and Pollen. Ann N Y Acad Sci. 2002;964(1):47-68.
86. Sancho AI, Wangorsch A, Jensen BM, Watson A, Alexeev Y, Johnson PE, et al. Responsiveness of the major birch allergen Bet v 1 scaffold to the gastric environment: Impact on structure and allergenic activity. Mol Nutr Food Res. 2011;55(11):1690-9.
87. Skypala IJ, Asero R, Barber D, Cecchi L, Diaz Perales A, Hoffmann-Sommergruber K, et al. Non-specific lipid-transfer proteins: Allergen structure and function, cross-reactivity, sensitization, and epidemiology. Clin Transl Allergy. 2021;11(3):e12010.
88. Asero R. In patients with LTP syndrome food-specific IgE show a predictable hierarchical order. Eur Ann Allergy Clin Immunol. 2014;46(4):142-6.
89. Masthoff LJN, Mattsson L, Zuidmeer-Jongejan L, Lidholm J, Andersson K, Akkerdaas JH, et al. Sensitization to Cor a 9 and Cor a 14 is highly specific for a hazelnut allergy with objective symptoms in Dutch children and adults. J Allergy Clin Immunol. 2013;132(2):393-9.
90. Datema MR, Zuidmeer-Jongejan L, Asero R, Barreales L, Belohlavkova S, de Blay F, et al. Hazelnut allergy across Europe dissected molecularly: An EuroPrevall outpatient clinic survey. J Allergy Clin Immunol. 2015;136(2):382-91.
91. Datema MR, van Ree R, Asero R, Barreales L, Belohlavkova S, de Blay F, et al. Component-resolved diagnosis and beyond: Multivariable regression models to predict severity of hazelnut allergy. Allergy. 2018;73(3):549-59.
92. Lyons SA, Datema MR, Le TM, Asero R, Barreales L, Belohlavkova S, et al. Walnut Allergy Across Europe: Distribution of Allergen Sensitization Patterns and Prediction of Severity. J Allergy Clin Immunol Pract. 2021;9(1):225-235.e10.
93. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, van Hage M, Baena-Cagnani CE, et al. A WAO - ARIA - GA2LEN consensus document on molecular-based allergy diagnostics. World Allergy Organ J. 2013;6(1):17.
94. Cox AL, Eigenmann PA, Sicherer SH. Clinical Relevance of Cross-Reactivity in Food Allergy. J Allergy Clin Immunol Pract. 2021;9(1):82-99.
95. Johansson E, Mersha TB. Genetics of Food Allergy. Immunol Allergy Clin North Am. 2021;41(2):301-19.
96. Kanchan K, Clay S, Irizar H, Bunyavanich S, Mathias RA. Current insights into the genetics of food allergy. Journal of Allergy and Clinical Immunology. 2021;147(1):15-28.
97. Kostara M, Chondrou V, Sgourou A, Douros K, Tsabouri S. HLA Polymorphisms and Food Allergy Predisposition. J Pediatr Genet. 2020;9(2):77-86.
98. Sindher SB, Chin AR, Aghaeepour N, Prince L, Maecker H, Shaw GM, et al. Advances and potential of omics studies for understanding the development of food allergy. Front Allergy. 2023;4:1149008.
99. Chavanas S, Bodemer C, Rochat A, Hamel-Teillac D, Ali M, Irvine AD, et al. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome. Nat Genet. 2000;25(2):141-2.
100. Hannula-Jouppi K, Laasanen SL, Heikkilä H, Tuomiranta M, Tuomi ML, Hilvo S, et al. IgE allergen component-based profiling and atopic manifestations in patients with Netherton syndrome. J Allergy Clin Immunol. 2014;134(4):985-8.
101. Cañas JA, Núñez R, Cruz-Amaya A, Gómez F, Torres MJ, Palomares F, et al. Epigenetics in Food Allergy and Immunomodulation. Nutrients. 2021;13(12):4345.
102. Martin PE, Eckert JK, Koplin JJ, Lowe AJ, Gurrin LC, Dharmage SC, et al. Which infants with eczema are at risk of food allergy? Results from a population-based cohort. Clin Exp Allergy. 2015;45(1):255-64.
103. Yang L, Fu J, Zhou Y. Research Progress in Atopic March. Front Immunol. 2020;11:1907.
104. Tsuge M, Ikeda M, Matsumoto N, Yorifuji T, Tsukahara H. Current Insights into Atopic March. Children. 2021;8(11):1067.
105. Maiello N, Comberiati P, Giannetti A, Ricci G, Carello R, Galli E. New Directions in Understanding Atopic March Starting from Atopic Dermatitis. Children. 2022;9(4):450.
106. Hui-Beckman J, Kim BE, Leung DY. Origin of Allergy From In Utero Exposures to the Postnatal Environment. Allergy Asthma Immunol Res. 2022;14(1):8.
107. Zhao W, Ho H en, Bunyavanich S. The gut microbiome in food allergy. Ann Allergy Asthma Immunol. 2019;122(3):276-82.
108. Irizar H, Kanchan K, Mathias RA, Bunyavanich S. Advancing Food Allergy Through Omics Sciences. J Allergy Clin Immunol Pract. 2021;9(1):119-29.
109. Notarbartolo V, Carta M, Accomando S, Giuffrè M. The First 1000 Days of Life: How Changes in the Microbiota Can Influence Food Allergy Onset in Children. Nutrients. 2023;15(18):4014.
110. Peters RL, Mavoa S, Koplin JJ. An Overview of Environmental Risk Factors for Food Allergy. Int J Environ Res Public Health. 2022;19(2):722.
111. Moran TP. The External Exposome and Food Allergy. Curr Allergy Asthma Rep. 2020;20(8):37.
112. Bunyavanich S, Berin MC. Food allergy and the microbiome: Current understandings and future directions. J Allergy Clin Immunol. 2019;144(6):1468-77.
113. Di Costanzo M, De Paulis N, Capra ME, Biasucci G. Nutrition during Pregnancy and Lactation: Epigenetic Effects on Infants' Immune System in Food Allergy. Nutrients. 2022;14(9):1766.
114. Arzola-Martínez L, Ptaschinski C, Lukacs NW. Trained innate immunity, epigenetics, and food allergy. Front Allergy. 2023;4:1105588.
115. Poto R, Fusco W, Rinninella E, Cintoni M, Kaitsas F, Raoul P, et al. The Role of Gut Microbiota and Leaky Gut in the Pathogenesis of Food Allergy. Nutrients. 2023;16(1):92.
116. Schlechte J, Skalosky I, Geuking MB, McDonald B. Long-distance relationships - regulation of systemic host defense against infections by the gut microbiota. Mucosal Immunol. 2022;15(5):80918.
117. Lee ECK, Trogen B, Brady K, Ford LS, Wang J. The Natural History and Risk Factors for the Development of Food Allergies in Children and Adults. Curr Allergy Asthma Rep. 2024;24(3):121-31.
118. Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020;8(6):1854-64.
119. Jeong K, Lee S. Natural course of IgE-mediated food allergy in children. Clin Exp Pediatr. 2023;66(12):504-11.
120. Gupta RS, Warren CM, Smith BM, Jiang J, Blumenstock JA, Davis MM, et al. Prevalence and Severity of Food Allergies Among US Adults. JAMA Netw Open. 2019;2(1):e185630.
121. Giannetti A, Toschi Vespasiani G, Ricci G, Miniaci A, di Palmo E, Pession A. Cow's Milk Protein Allergy as a Model of Food Allergies. Nutrients. 2021;13(5):1525.
122. AL-Iede M, Sarhan L, Alshrouf MA, Said Y. Perspectives on Non-IgE-Mediated Gastrointestinal Food Allergy in Pediatrics: A Review of Current Evidence and Guidelines. J Asthma Allergy. 2023;16:279-91.
123. Cetinkaya PG, Kahveci M, Karaatmaca B, Esenboga S, Sahiner UM, Sekerel BE, et al. Predictors for late tolerance development in food protein-induced allergic proctocolitis. Allergy Asthma Proc. 2020;41(1):e11-8.
124. Meyer R, Chebar Lozinsky A, Fleischer DM, Vieira MC, Du Toit G, Vandenplas Y, et al. Diagnosis and management of Non-IgE gastrointestinal allergies in breastfed infants - An EAACI Position Paper. Allergy. 2020;75(1):14-32.
125. McWilliam V, Netting MJ, Volders E, Palmer DJ, Ansotegui I, Arasi S, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) guidelines update - X - Breastfeeding a baby with cow's milk allergy. World Allergy Organ J. 2023;16(11):100830.
126. Vandenplas Y, Broekaert I, Domellöf M, Indrio F, Lapillonne A, Pienar C, et al. An ESPGHAN Position Paper on the Diagnosis, Management, and Prevention of Cow's Milk Allergy. J Pediatr Gastroenterol Nutr. 2024;78(2):386-413.
127. Salvatore S, Folegatti A, Ferrigno C, Pensabene L, Agosti M, D'Auria E. To Diet or Not to Diet This Is the Question in Food-Protein-Induced Allergic Proctocolitis (FPIAP) - A Comprehensive Review of Current Recommendations. Nutrients. 2024;16(5):589.
128. Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020;8(6):1854-64.
129. Devonshire AL, Lin AA. Tackling Food Allergy in Infancy. Immunol Allergy Clin North Am. 2021;41(2):205-19.
130. Flom JD, Sicherer SH. Epidemiology of Cow's Milk Allergy. Nutrients. 2019;11(5):1051.
131. Çelebioglu E, Akarsu A, Sahiner ÜM. IgE-mediated food allergy throughout life. Turk J Med Sci. 2021;51(1):49-60.
132. Savage J, Sicherer S, Wood R. The Natural History of Food Allergy. J Allergy Clin Immunol Pract. 2016;4(2):196-203.
133. Nowak-Wegrzyn A, Fiocchi A. Rare, medium, or well done? The effect of heating and food matrix on food protein allergenicity. Curr Opin Allergy Clin Immunol. 2009;9:234-7.
134. Leonard SA, Caubet JC, Kim JS, Groetch M, Nowak-Wegrzyn A. Baked Milk- and Egg-Containing Diet in the Management of Milk and Egg Allergy. J Allergy Clin Immunol Pract. 2015;3(1):13-23.
135. McWilliam VL, Perrett KP, Dang T, Peters RL. Prevalence and natural history of tree nut allergy. Anna Allergy Asthma Immunol. 2020;124(5):466-72.
136. Tsabouri S, Priftis KN, Chaliasos N, Siamopoulou A. Modulation of gut microbiota downregulates the development of food allergy in infancy. Allergol Immunopathol (Madr). 2014;42(1):69-77.
137. Barker DJP. Developmental origins of chronic disease. Public Health. 2012;126(3):185-9.
138. Haahtela T. A biodiversity hypothesis. Allergy. 2019;74(8):144556.
139. Acevedo N, Alashkar Alhamwe B, Caraballo L, Ding M, Ferrante A, Garn H, et al. Perinatal and Early-Life Nutrition, Epigenetics, and Allergy. Nutrients. 2021;13(3):724.
140. Azad MB, Konya T, Guttman DS, Field CJ, Sears MR, HayGlass KT, et al. Infant gut microbiota and food sensitization: associations in the first year of life. Clin Exp Allergy. 2015;45(3):632-43.
141. Shu SA, Yuen AWT, Woo E, Chu KH, Kwan HS, Yang GX, et al. Microbiota and Food Allergy. Clin Rev Allergy Immunol. 2019;57(1):83-97.
142. Venter C, Agostoni C, Arshad SH, Ben-Abdallah M, Du Toit G, Fleischer DM, et al. Dietary factors during pregnancy and atopic outcomes in childhood: A systematic review from the European Academy of Allergy and Clinical Immunology. Pediatr Allergy Immunol. 2020;31(8):889-912.
143. Joshi PA, Smith J, Vale S, Campbell DE. The Australasian Society of Clinical Immunology and Allergy infant feeding for allergy prevention guidelines. Med J Aust. 2019;210(2):89-93.
144. Garcia-Larsen V, Ierodiakonou D, Jarrold K, Cunha S, Chivinge J, Robinson Z, et al. Diet during pregnancy and infancy and risk of allergic or autoimmune disease: A systematic review and meta-analysis. PLoS Med. 2018;15(2):e1002507.
145. Victora CG, Bahl R, Barros AJD, França GVA, Horton S, Krasevec J, et al. Breastfeeding in the 21st century: epidemiology, mechanisms, and lifelong effect. The Lancet. 2016;387(10017):475-90.
146. Venter C, Brown KR, Maslin K, Palmer DJ. Maternal dietary intake in pregnancy and lactation and allergic disease outcomes in offspring. Pediatric Allergy and Immunology. 2017;28(2):13543.
147. Kopp MV, Muche-Borowski C, Abou-Dakn M, Ahrens B, Beyer K, Blümchen K, et al. S3 Guideline Allergy Prevention. Allergol Select. 2022;6(01):61-97.
148. Venter C, Smith PK, Fleischer DM. Food allergy prevention: where are we in 2023? Asia Pac Allergy. 2023;13(1):15-27.
149. Ministério da Saúde. Universidade de São Paulo. Fascículo 5. Protocolo de uso do guia alimentar para a população brasileira na orientação alimentar da pessoa na adolescência - Brasília - DF 2022. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/protocolos_guia_alimentar_fasciculo5.pdf Acessado em setembro de 2024.
150. Sociedade Brasileira de Pediatria - Alimentação complementar para o lactente saudável: Ampliando as Escolhas com Evidências Aplicáveis e Sustentáveis Disponível em: https://www.sbp.com.br/fileadmin/user_upload/24579c-GPA_-_Alim_Compl_p_Lactente_Saudavel.pdf Acessado em setembro de 2024.
151. Sociedade Brasileira de Pediatria. Manual de alimentação: orientações para a alimentação do lactente e do adolescente, na escola, na gestante, na prevenção de doenças e segurança alimentar. 5º ed. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/24607c-ManAlim-OrientAlim_Lactente_ao_adl_na_escola-gest.pdf Acessado em setembro de 2024.
152. Fonseca ALM, Elaine P. Albernaz EP, Kaufmann CC, Neves IH, de Figueiredo VLM. Impact of breastfeeding on the intelligence quotient of eight-year-old children. J. Pediatr (Rio J.). 2013;89(4):346-53.
153. Ministério da Saúde. Guia alimentar para crianças brasileiras menores de 2 anos.pdf - Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-brasil/eu-quero-me-alimentar-melhor/Documentos/pdf/guia-alimentar-para-criancas-brasileiras-menores-de-2-anos.pdf/view Acessado em setembro de 2024.
154. Kim SY, Yi DY. Components of human breast milk: from macronutrient to microbiome and microRNA. Clin Exp Pediatr. 2020;63(8):301-9.
155. de Silva D, Halken S, Singh C, Muraro A, Angier E, Arasi S, et al. Preventing food allergy in infancy and childhood: Systematic review of randomised controlled trials. Pediatr Allergy Immunol. 2020;31(7):813-26.
156. Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, et al. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021;32(5):843-58.
157. Fleischer DM, Chan ES, Venter C, Spergel JM, Abrams EM, Stukus D, et al. A Consensus Approach to the Primary Prevention of Food Allergy Through Nutrition: Guidance from the American Academy of Allergy, Asthma, and Immunology; American College of Allergy, Asthma, and Immunology; and the Canadian Society for Allergy and Clinical Immunology. J Allergy Clin Immunol Pract. 2021;9(1):22-43.e4.
158. Ebisawa M, Ito K, Fujisawa T, Ebisawa M, Ito K, Fujisawa T, et al. Japanese guidelines for food allergy 2020. Allergol Intern. 2020;69(3):370-86.
159. Netting MJ, Campbell DE, Koplin JJ, Beck KM, McWilliam V, Dharmage SC, et al. An Australian Consensus on Infant Feeding Guidelines to Prevent Food Allergy: Outcomes From the Australian Infant Feeding Summit. J Allergy Clin Immunol Pract. 2017;5(6):1617-24.
160. Agostoni C, Decsi T, Fewtrell M, Goulet O, Kolacek S, Koletzko B, et al. Complementary Feeding: A Commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2008;46(1):99-110.
161. Sansotta N, Piacentini GL, Mazzei F, Minniti F, Boner AL, Peroni DG. Timing of introduction of solid food and risk of allergic disease development: Understanding the evidence. Allergol Immunopathol (Madr). 2013;41(5):337-45.
162. Ferraro V, Zanconato S, Carraro S. Timing of food introduction and the risk of food allergy. Nutrients. 2019;11(5):1-13.
163. Du Toit G, Roberts G, Sayre PH, Bahnson HT, Radulovic S, Santos AF, et al. Randomized Trial of Peanut Consumption in Infants at Risk for Peanut Allergy. N Engl J Med. 2015;372(9):803-13.
164. Perkin MR, Logan K, Marrs T, Radulovic S, Craven J, Flohr C, et al. Enquiring about Tolerance (EAT) study: Feasibility of an early allergenic food introduction regimen. J Allergy Clin Immunol. 2016;137(5):1477-1486.e8.
165. Wei-Liang Tan J, Valerio C, Barnes EH, Turner PJ, Van Asperen PA, Kakakios AM, et al. A randomized trial of egg introduction from 4 months of age in infants at risk for egg allergy. J Allergy Clin Immunol. 2017;139(5):1621-1628.e8.
166. Bellach J, Schwarz V, Ahrens B, Trendelenburg V, Aksünger Ö, Kalb B, et al. Randomized placebo-controlled trial of hen's egg consumption for primary prevention in infants. J Allergy Clin Immunol. 2017;139(5):1591-1599.e2.
167. Palmer DJ, Metcalfe J, Makrides M, Gold MS, Quinn P, West CE, et al. Early regular egg exposure in infants with eczema: A randomized controlled trial. J Allergy Clin Immunol. 2013;132(2):387-392 e1.
168. Palmer DJ, Sullivan TR, Gold MS, Prescott SL, Makrides M. Randomized controlled trial of early regular egg intake to prevent egg allergy. J Allergy Clin Immunol. 2017;139(5):1600-1607.e2.
169. Natsume O, Kabashima S, Nakazato J, Yamamoto-Hanada K, Narita M, Kondo M, et al. Two-step egg introduction for prevention of egg allergy in high-risk infants with eczema (PETIT): a randomised, double-blind, placebo-controlled trial. Lancet. 2017;389(10066):276-86.
170. Baker MG, Nowak-Wegrzyn A. Food allergy prevention: current evidence. Curr Opin Clin Nutr Metab Care. 2020;23(3):196-202.
171. Turner PJ, Feeney M, Meyer R, Perkin MR, Fox AT. Implementing primary prevention of food allergy in infants: New BSACI guidance published. Clin Exp Allergy. 2018;48(8):912-5.
172. Schroer B, Groetch M, Mack DP, Venter C. Practical Challenges and Considerations for Early Introduction of Potential Food Allergens for Prevention of Food Allergy. J Allergy Clin Immunol Pract. 2021;9(1):44-56.e1.
173. Kuper P, Hasenpusch C, Proebstl S, Matterne U, Hornung CJ, Grätsch E, et al. Timing of complementary feeding for early childhood allergy prevention: An overview of systematic reviews. Clin Exp Allergy. 2023;53(12):1243-55.
174. D'Auria E, Peroni DG, Sartorio MUA, Verduci E, Zuccotti GV, Venter C. The Role of Diet Diversity and Diet Indices on Allergy Outcomes. Front Pediatr. 2020;8(September):1-14.
175. Venter C, Maslin K, Holloway JW, Silveira LJ, Fleischer DM, Dean T, et al. Different Measures of Diet Diversity During Infancy and the Association with Childhood Food Allergy in a UK Birth Cohort Study. J Allergy Clin Immunol Pract. 2020;8(6):2017-26.
176. ENANI - 2024. Prevalência e práticas de aleitamento materno em crianças brasileiras menores de 2 anos. ENANI-2019. Disponível em: https://enani.nutricao.ufrj.br/wp-content/uploads/2023/10/Relatorio-4-ENANI-2019-Aleitamento-Materno.pdf Acessado em setembro de 2024.
177. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 2 - Diagnóstico, tratamento e prevenção. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia. Arquivos de Asma, Alergia e Imunologia. 2018;2(1):39-82.
178. Paparo L, Coppola S, Nocerino R, Pisapia L, Picariello G, Cortese M, et al. How dietary advanced glycation end products could facilitate the occurrence of food allergy. J Allergy Clin Immunol. 2024;153(3):742-58.
179. Gu Y, Guo X, Sun S, Che H. High-Fat Diet-Induced Obesity Aggravates Food Allergy by Intestinal Barrier Destruction and Inflammation. Int Arch Allergy Immunol. 2022;183(1):80-92.
180. Osborn DA, Sinn JK, Jones LJ. Infant formulas containing hydrolysed protein for prevention of allergic disease and food allergy. In: Sinn JK (Ed). Cochrane Database of Systematic Reviews. Chichester, UK: John Wiley & Sons, Ltd; 2017.
181. Binder AM, Cherry-Brown D, Biggerstaff BJ, Jones ES, Amelio CL, Beard CB, et al. Clinical and laboratory features of patients diagnosed with alpha-gal syndrome-2010-2019. Allergy. 2023;78(2):477-87.
182. Skypala IJ, Venter C, Meyer R, de Jong NW, Fox AT, Groetch M, et al. The development of a standardised diet history tool to support the diagnosis of food allergy. Clin Transl Allergy. 2015;5(1):7.
183. Nowak-Wegrzyn A, Berin MC, Mehr S. Food Protein-Induced Enterocolitis Syndrome. J Allergy Clin Immunol Pract. 2020;8(1):2435.
184. Zuberbier T, Abdul Latiff AH, Abuzakouk M, Aquilina S, Asero R, Baker D, et al. The international EAACI/GA2LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022;77(3):734-66.
185. Burks AW, Tang M, Sicherer S, Muraro A, Eigenmann PA, Ebisawa M, et al. ICON: Food allergy. J Allergy Clin Immunol. 2012;129(4):906-20.
186. Sampson HA, Aceves S, Bock SA, James J, Jones S, Lang D, et al. Food allergy: A practice parameter update - 2014. J Allergy Clin Immunol. 2014;134(5):1016-1025.e43.
187. Sharma HP, Bansil S, Uygungil B. Signs and Symptoms of Food Allergy and Food-Induced Anaphylaxis. Pediatr Clin North Am. 2015;62(6):1377-92.
188. Caffarelli C, Garrubba M, Greco C, Mastrorilli C, Povesi Dascola C. Asthma and Food Allergy in Children: Is There a Connection or Interaction? Front Pediatr. 2016:4:34.
189. Ho MHK, Wong WHS, Chang C. Clinical Spectrum of Food Allergies: a Comprehensive Review. Clin Rev Allergy Immunol. 2014;46(3):225-40.
190. Rudders SA, Banerji A, Clark S, Camargo CA. Age-Related Differences in the Clinical Presentation of Food-Induced Anaphylaxis. J Pediatr. 2011;158(2):326-8.
191. Calvani M, Anania C, Cuomo B, D'Auria E, Decimo F, Indirli GC, et al. Non-IgE- or Mixed IgE/Non-IgE-Mediated Gastrointestinal Food Allergies in the First Years of Life: Old and New Tools for Diagnosis. Nutrients. 2021;13(1):226.
192. Venter C, Brown T, Meyer R, Walsh J, Shah N, Nowak-Wegrzyn A, et al. Better recognition, diagnosis and management of non-IgE-mediated cow's milk allergy in infancy: iMAP - an international interpretation of the MAP (Milk Allergy in Primary Care) guideline. Clin Transl Allergy. 2017;7(1):26.
193. Fiocchi A, Schunemann H, Ansotegui I, Assa'ad A, Bahna S, Canani RB, et al. The global impact of the DRACMA guidelines cow's milk allergy clinical practice. World Allergy Org J. 2018;11:2.
194. Meyer R, Fox AT, Chebar Lozinsky A, Michaelis LJ, Shah N. Non-IgE-mediated gastrointestinal allergies-Do they have a place in a new model of the Allergic March. Pediatr Allergy Immunol. 2019;30(2):149-58.
195. Carvalho E, Targa FC, Silva LR. Alergia alimentar in: Gastroenterologia e Hepatologias Pediátricas: Diagnóstico e Tratamento. Barueri: Editora Manole; 2024. p.91-110.
196. Caubet JC, Szajewska H, Shamir R, Nowak-Wegrzyn A. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol. 2017;28(1):6-17.
197. Fox A, Brown T, Walsh J, Venter C, Meyer R, Nowak-Wegrzyn A, et al. An update to the Milk Allergy in Primary Care guideline. Clin Transl Allergy. 2019;9(1):40.
198. Koletzko S, Niggemann B, Arato A, Dias JA, Heuschkel R, Husby S, et al. Diagnostic Approach and Management of Cow's-Milk Protein Allergy in Infants and Children. J Pediatr Gastroenterol Nutr. 2012;55(2):221-9.
199. Biermé P, Nowak-Wegrzyn A, Caubet JC. Non-IgE-mediated gastrointestinal food allergies. Curr Opin Pediatr. 2017;29(6):697703.
200. Martin VM, Virkud Y V., Seay H, Hickey A, Ndahayo R, Rosow R, et al. Prospective Assessment of Pediatrician-Diagnosed Food Protein-Induced Allergic Proctocolitis by Gross or Occult Blood. J Allergy Clin Immunol Pract. 2020;8(5):1692-1699.e1.
201. D'Auria E, Salvatore S, Pozzi E, Mantegazza C, Sartorio MUA, Pensabene L, et al. Cow's Milk Allergy: Immunomodulation by Dietary Intervention. Nutrients. 2019;11(6):1399.
202. Heine RG. Allergic gastrointestinal motility disorders in infancy and early childhood. Pediatr Allergy Immunol. 2008;19(5):383-91.
203. Wood JD. Histamine, mast cells, and the enteric nervous system in the irritable bowel syndrome, enteritis, and food allergies. Gut. 2006;55(4):445-7.
204. Salvatore S, Vandenplas Y. Gastroesophageal Reflux and Cow Milk Allergy: Is There a Link? Pediatrics. 2002;110(5):972-84.
205. Salvatore S, Agosti M, Baldassarre ME, D'Auria E, Pensabene L, Nosetti L, et al. Cow's Milk Allergy or Gastroesophageal Reflux Disease - Can We Solve the Dilemma in Infants? Nutrients. 2021;13(2):297.
206. Morais MB de. Signs and symptoms associated with digestive tract development. J Pediatr (Rio J). 201;92(3):S46-56.
207. de Morais MB, Toporovski MS, Tofoli MHC, Barros KV, Silva LR, Ferreira CHT. Prevalence of Functional Gastrointestinal Disorders in Brazilian Infants Seen in Private Pediatric Practices and Their Associated Factors. J Pediatr Gastroenterol Nutr. 2022;75(1):1723.
208. Fritscher-Ravens A, Pflaum T, Mösinger M, Ruchay Z, Röcken C, Milla PJ, et al. Many Patients With Irritable Bowel Syndrome Have Atypical Food Allergies Not Associated With Immunoglobulin E. Gastroenterology. 2019;157(1):109-118.e5.
209. Borrelli O, Mancini V, Thapar N, Giorgio V, Elawad M, Hill S, et al. Cow's Milk Challenge Increases Weakly Acidic Reflux in Children with Cow's Milk Allergy and Gastroesophageal Reflux Disease. J Pediatr. 2012;161(3):476-481.e1.
210. Vandenplas Y, Rudolph CD, Di Lorenzo C, Hassall E, Liptak G, Mazur L, et al. Pediatric Gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition (NASPGHAN) and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN). J Pediatr Gastroenterol Nutr. 2009;49(4):498-547.
211. Rosen R, Vandenplas Y, Singendonk M, Cabana M, DiLorenzo C, Gottrand F, et al. Pediatric Gastroesophageal Reflux Clinical Practice Guidelines. J Pediatr Gastroenterol Nutr. 2018;66(3):51654.
212. Zeevenhooven J, Browne PD, L'Hoir MP, de Weerth C, Benninga MA. Infant colic: mechanisms and management. Nat Rev Gastroenterol Hepatol. 2018;15(8):479-96.
213. Connor F, Salvatore S, D'Auria E, Baldassarre ME, Acunzo M, Di Bella G, et al. Cows' Milk Allergy-Associated Constipation: When to Look for It? A Narrative Review. Nutrients. 2022;14(6):1317.
214. Morais MB. Constipação Intestinal. In: Silva LR, Solé D, Silva CA, Constantino CF, Liberal EF (Ed). Tratado de Pediatria. 5th ed. Barueri: Manole; 2022. p. 1335-43.
215. Saps M, Lu P, Bonilla S. Cow's-Milk Allergy Is a Risk Factor for the Development of FGIDs in Children. J Pediatr Gastroenterol Nutr. 2011;52(2):166-9.
216. Su KW, Shreffler WG, Yuan Q. Gastrointestinal immunopathology of food protein-induced enterocolitis syndrome and other non-immunoglobulin E-mediated food allergic diseases. Ann Allergy Asthma Immunol. 2021;126(5):516-23.
217. Buyuktiryaki B, Kulhas Celik I, Erdem SB, Capanoglu M, Civelek E, Guc BU, et al. Risk Factors Influencing Tolerance and Clinical Features of Food Protein-induced Allergic Proctocolitis. J Pediatr Gastroenterol Nutr. 2020;70(5):574-9.
218. Labrosse R, Graham F, Caubet JC. Non-IgE-mediated gastrointestinal food allergies in children: An update. Nutrients. 2020;12:1-28.
219. Arvola T, Ruuska T, Keränen J, Hyöty H, Salminen S, Isolauri E. Rectal Bleeding in Infancy: Clinical, Allergological, and Microbiological Examination. Pediatrics. 2006;117(4):e760-8.
220. Lemoine A, Lemale J, Aroulandom J, Tounian P. Rectal bleeding and cow's milk protein-induced allergic proctocolitis: A prospective study. Clin Exp Allergy. 2021;51(9):1242-5.
221. Meyer R, Chebar Lozinsky A, Fleischer DM, Vieira MC, Du Toit G, Vandenplas Y, et al. Diagnosis and management of Non-IgE gastrointestinal allergies in breastfed infants-An EAACI Position Paper. Allergy. 2020;75(1):14-32.
222. Vandenplas Y, Rudolph CD, Di Lorenzo C, Hassall E, Liptak G, Mazur L, et al. Pediatric gastroesophageal reflux clinical practice guidelines: joint recommendations of NASPGHAN and ESPGHAN. J Pediatr Gastroenterol Nutr. 2009;498-547.
223. de Morais MB, Spolidoro JV, Vieira MC, Cardoso AL, Clark O, Nishikawa A, et al. Amino acid formula as a new strategy for diagnosing cow's milk allergy in infants: is it cost-effective? J Med Econ. 2016;19(12):1207-14.
224. Vieira MC, Morais MB, Spolidoro JVN, Toporovski MS, Cardoso AL, Araujo GTB, et al. A survey on clinical presentation and nutritional status of infants with suspected cow' milk allergy. BMC Pediatr. 2010;10:25.
225. Berin MC. Advances in understanding immune mechanisms of food protein-induced enterocolitis syndrome. Ann Allergy Asthma Immunol. 2021;126: 478-81.
226. Borrelli O, Barbara G, Di Nardo G, Cremon C, Lucarelli S, Frediani T, et al. Neuroimmune Interaction and Anorectal Motility in Children With Food Allergy-Related Chronic Constipation. Am J Gastroenterol. 2009;104(2):454-63.
227. Bartnikas LM, Nowak-Wegrzyn A, Schultz F, Phipatanakul W, Bingemann TA. The evolution of food protein-induced enterocolitis syndrome. Ann Allergy Asthma Immunol. 2021;126(5):489-97.
228. Cianferoni A. Food protein-induced enterocolitis syndrome epidemiology. Ann Allergy Asthma Immunol. 2021;126(5):46977.
229. Nowak-Wegrzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017;139(4):1111-1126.e4.
230. Trogen B, Nowak-Wegrzyn A. Food protein-induced enterocolitis syndrome. Ann Allergy Asthma Immunol. 2021;126(5):447-8.
231. Kuan-Wen S, Shreffler WG, Yuan Q. Gastrointestinal immunopathology of food protein induced enterocolitis syndrome and other non-immunoglobulin E mediated food allergic diseases. Ann Allergy Asthma Immunol. 2021;126: 516-523.
232. Baldwin S, Werther R, Hargrove A, Anagnostou A, Mehr S. Food protein-induced enterocolitis syndrome to nuts. Ann Allergy Asthma Immunol. 2021;126(5):464-6.
233. Spergel JM. Nonimmunoglobulin E-Mediated Immune Reactions to Foods Ann Allergy Asthma Immunol. 2006;2(2):78.
234. Yu W, Freeland DMH, Nadeau KC. Food allergy: immune mechanisms, diagnosis and immunotherapy. Nat Rev Immunol. 2016;16(12):751-65.
235. Papapostolou N, Xepapadaki P, Gregoriou S, Makris M. Atopic Dermatitis and Food Allergy: A Complex Interplay What We Know and What We Would Like to Learn. J Clin Med. 2022;11(14):4232.
236. Eigenmann PA, Beyer K, Lack G, Muraro A, Ong PY, Sicherer SH, et al. Are avoidance diets still warranted in children with atopic dermatitis? Pediatr Allergy Immunol. 2020;31(1):19-26.
237. Bergmann MM, Caubet JC, Boguniewicz M, Eigenmann PA. Evaluation of Food Allergy in Patients with Atopic Dermatitis. J Allergy Clin Immunol Pract. 2013;1(1):22-8.
238. Breuer K, Heratizadeh A, Wulf A, Baumann U, Constien A, Tetau D, et al. Late eczematous reactions to food in children with atopic dermatitis. Clin Exp Allergy. 2004;34(5):817-24.
239. Werfel T, Breuer K. Role of food allergy in atopic dermatitis. Curr Opin Allergy Clin Immunol. 2004;4(5):379-85.
240. Attwood SEA, Smyrk TC, Demeester TR, Jones JB. Esophageal eosinophilia with dysphagia. Dig Dis Sci. 1993;38(1):109-16.
241. Blanchard C, Wang N, Rothenberg M. Eosinophilic esophagitis: Pathogenesis, genetics, and therapy. J Allergy Clin Immunol. 2006;118(5):1054-9.
242. Menard-Katcher C, Benitez AJ, Pan Z, Ahmed FN, Wilkins BJ, Capocelli KE, et al. Influence of Age and Eosinophilic Esophagitis on Esophageal Distensibility in a Pediatric Cohort. Am J Gastroenterol. 2017;112(9):1466-73.
243. Cianferoni A, Spergel J. Eosinophilic Esophagitis: A Comprehensive Review. Clin Rev Allergy Immunol. 2016;50(2):159-74.
244. Liacouras CA, Spergel J, Gober LM. Eosinophilic Esophagitis. Gastroenterol Clin North Am. 2014;43(2):219-29.
245. Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United Eur Gastroenterol J. 2017;5(3):335-58.
246. Santos MFO, Barros CP, Silva CHM da, Paro HBM da S. Translation and cultural adaptation of the Pediatric Eosinophilic Esophagitis Symptom Score (PEESS v2.0). J Pediatr (Rio J). 2018;94(6):64251.
247. Collins MH, Martin LJ, Alexander ES, Boyd JT, Sheridan R, He H, et al. Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring. Dis Esophagus. 2017;30(3):1-8.
248. Hirano I, Chan ES, Rank MA, Sharaf RN, Stollman NH, Stukus DR, et al. AGA Institute and the Joint Task Force on Allergy-Immunology Practice Parameters Clinical Guidelines for the Management of Eosinophilic Esophagitis. Gastroenterology. 2020;158(6):177686.
249. Papadopoulou A, Amil-Dias J, Auth MK, Chehade M, Collins MH, Gupta SK, et al. Joint ESPGHAN/NASPGHAN Guidelines on Childhood Eosinophilic Gastrointestinal Disorders Beyond Eosinophilic Esophagitis. J Pediatr Gastroenterol Nutr. 2024;78(1):122-52.
250. Pesek RD, Reed CC, Collins MH, Muir AB, Fulkerson PC, Menard-Katcher C, et al. Association Between Endoscopic and Histologic Findings in a Multicenter Retrospective Cohort of Patients with Non-esophageal Eosinophilic Gastrointestinal Disorders. Dig Dis Sci. 2020;65(7):2024-35.
251. Shetty V, Daniel KE, Kesavan A. Hematemesis as Initial Presentation in a 10-Week-Old Infant with Eosinophilic Gastroenteritis. Case Rep Pediatr. 2017;2017:1-3.
252. Gonsalves N. Eosinophilic Gastrointestinal Disorders. Clin Rev Allergy Immunol. 2019;57(2):272-85.
253. Pesek RD, Reed CC, Muir AB, Fulkerson PC, Menard-Katcher C, Falk GW, et al. Increasing Rates of Diagnosis, Substantial Co-Occurrence, and Variable Treatment Patterns of Eosinophilic Gastritis, Gastroenteritis, and Colitis Based on 10-Year Data Across a Multicenter Consortium. Am J Gastroenterol. 2019;114(6):98494.
254. Grzybowska-Chlebowczyk U, Horowska-Ziaja S, Kajor M, Wiecek S, Chlebowczyk W, Wos H. Eosinophilic colitis in children. Adv Dermatol Allergol. 2017;1:52-9.
255. Santos LNC. Differential diagnosis in food allergy. Rev. alerg. Méx. 2023;70(4): doi: 10.29262/ram.v70i4.1312.
256. Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, et al. EAACI Food Allergy and Anaphylaxis Guidelines: Diagnosis and management of food allergy. Allergy. 2014;69(8):1008-25.
257. Dramburg S, Hilger C, Santos AF, de las Vecillas L, Aalberse RC, Acevedo N, et al. Molecular Allergology User's Guide 2.0. Pediatr Allergy Immunol. 2023;34(S28).
258. Ito K, Tagami K. Distinct differences in analytical performance of two commercially available assays for specific IgE to egg white and house dust mite allergens. Clin Mol Allergy. 2021;19(1):13.
259. Roca M, Donat E, Rodriguez Varela A, Carvajal E, Cano F, Armisen A, et al. Fecal Calprotectin and Eosinophil-Derived Neurotoxin in Children with Non-IgE-Mediated Cow's Milk Protein Allergy. J Clin Med. 2021;10(8):1595.
260. Ramírez-Marín HA, Singh AM, Ong PY, Silverberg JI. Food allergy testing in atopic dermatitis. JAAD Int. 2022;9:50-6.
261. Carvalho E, Targa CF, Rodrigues LS. Alergia alimentar. In Silva LR, Solé D, Diva CA, Constantino CF, Liberal EF (Ed). Tratado de Pediatria. 5º edição. Barueri: Manole; 2021.
262. Zain-Alabedeen S, Kamel N, Amin M, Vernon-Roberts A, Day AS, Khashana A. Fecal Calprotectin and Cow's Milk-Related-Symptoms Score in Children with Cow's Milk Protein Allergy. Pediatr Gastroenterol Hepatol Nutr. 2023;26(1):43.
263. Zhang Z, Wang W, Zhang X, Pan J, Chen X. Fecal Calprotectin in Children with Cow's Milk Protein Allergy: A Systematic Review and Meta-Analysis. Int Arch Allergy Immunol. 2022;183(11):118997.
264. Lyons SA, Knulst AC, Burney PGJ, Fernandez-Rivas M, Ballmer-Weber BK, Barreales L, et al. Predicting food allergy: The value of patient history reinforced. Allergy. 2021;76(5):1454-62.
265. Lieberman J, Muraro A, Blaiss M. How to diagnose IgE-mediated food allergy. Arch Dis Child Educ Pract Ed. 2024;109(5):247251.
266. Ferris K, Cowan M, Williams C, McAteer S, Glancy C, Callaghan S. How to interpret skin prick tests and serum-specific IgE in children and young people with food allergy. Arch Dis Child Educ Pract Ed. 2022;107(3):207-11.
267. Lendvai-Emmert D, Emmert V, Makai A, Fusz K, Prémusz V, Eklics K, et al. Fecal calprotectin levels in pediatric cow's milk protein allergy. Front Pediatr. 2022;10:945212.
268. Koninckx CR, Donat E, Benninga MA, Broekaert IJ, Gottrand F, Kolho K, et al. The Use of Fecal Calprotectin Testing in Paediatric Disorders. J Pediatr Gastroenterol Nutr. 2021;72(4):617-40.
269. Sethi TJ, Kemeny DM, Tobin S, Lessof MH, Lambourn E, Bradley A. How reliable are commercial allergy tests? Lancet. 1987;329(8524):92-4.
270. Niggemann B, Grüber C. Unproven diagnostic procedures in IgE-mediated allergic diseases. Vol. 59, Allergy. 2004;59:806-8.
271. Garrow JS. Kinesiology and food allergy. BMJ. 1988;296(6636):1573-4.
272. Lewith GT, Kenyon JN, Broomfield J, Prescott P, Goddard J, Holgate ST. Is electrodermal testing as effective as skin prick tests for diagnosing allergies? A double blind, randomised block design study. BMJ. 2001;322(7279):131-4.
273. Meyer R, Venter C, Bognanni A, Szajewska H, Shamir R, Nowak-Wegrzyn A, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) Guideline update - VII - Milk elimination and reintroduction in the diagnostic process of cow's milk allergy. World Allergy Organ J. 2023;16(7):100785.
274. Cox AL, Nowak-Wegrzyn A. Innovation in Food Challenge Tests for Food Allergy. Curr Allergy Asthma Rep. 2018;18(12):1-12.
275. Bird JA, Leonard S, Groetch M, Assa'ad A, Cianferoni A, Clark A, et al. Conducting an Oral Food Challenge: An Update to the 2009 Adverse Reactions to Foods Committee Work Group Report. J Allergy Clin Immunol Pract. 2020;8(1):75-90.e17.
276. Guler N, Cokugras FC, Sapan N, et al. Diagnosis and management of cow's milk protein allergy in Turkey: Region-specific recommendations by an expert-panel. Allergol Immunopathol (Madr). 2020;48:202-10.
277. Lo Vecchio A, Vandenplas Y, Benninga M, Broekaert I, Falconer J, Gottrand F, et al. An international consensus report on a new algorithm for the management of infant diarrhoea. Acta Paediatr. 2016;105(8).
278. Meyer R, Groetch M, Venter C. When Should Infants with Cow's Milk Protein Allergy Use an Amino Acid Formula? A Practical Guide. J Allergy Clin Immunol Pract. 2018;6(2):383-99.
279. Ribes-Koninckx C, Amil-Dias J, Espin B, Molina M, Segarra O, Diaz-Martin JJ. The use of amino acid formulas in pediatric patients with allergy to cow's milk proteins: Recommendations from a group of experts. Front Pediatr. 2023;11:1110380.
280. Vandenplas Y, Dupont C, Al-Dekhail W, Hashmi HAA, Khalil AF, El-Hodhod MA-A, et al. Exploring the advantages of a hydrolysed rice formula in the dietary management of infants with cow's milk allergy in the Middle East, North Africa, and Pakistan Region. Nutrients. 2021;13:3429.
281. Bocquet A, Dupont C, Chouraqui JP, Darmaun D, Feillet F, Frelut ML, et al.; Committee on Nutrition of the French Society of Pediatrics (CNSFP). Efficacy and safety of hydrolyzed rice-protein formulas for the treatment of cow's milk protein allergy. Arch Pediatr. 2019;26:238-46.
282. Meyer R, Carey MP, Turner PJ, Meharg AA. Low inorganic arsenic in hydrolysed rice formula used for cow's milk protein allergy. Pediatr Allergy Immunol. 2018;29:561-3.
283. Hojsak I, Braegger C, Bronsky J, Campoy C, Colomb V, Decsi T, et al. Arsenic in rice: A cause for concern. J Pediatr Gastroenterol Nutr. 2015;60:142-5.
284. Sociedade Brasileira de Pediatria. Departamento de Gastroenterologia. Alergia alimentar não-IgE mediada: formas leves e moderadas. Guia prático de atualização. 2022, SBP, Rio de Janeiro. 25 f. ISBN: 978-85-88520-36-3. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/23562e-GPA_Diretriz_-_AlergiaAlim_nao-IgE_mediada-_LevesModeradas.pdf Acesso em agosto de 2024.
285. Turner PJ, d'Art YM, Duca B, Chastell SA, Marco-Martin G, Vera-Berrios RN et al. Single-dose oral challenges to validate eliciting doses in children with cow's milk allergy. Pediatr Allergy Immunol. 2021;32(5):1056-65.
286. Yanagida N, Okada Y, Sato S, Ebisawa M. New approach for food allergy management using low-dose oral food challenges and low-dose oral immunotherapies. Allergol Int. 2016;65(2):135-40.
287. Infante S, Marco-Martín G, Zubeldia JM, Fuentes-Aparicio V, Alvarez-Perea A, Cabrera-Freitag P, et al. Oral Food Challenge in Food Protein-Induced Enterocolitis Syndrome by Fish: Is There Any Room for Improvement? Int Arch Allergy Immunol. 2019;179(3):215-20.
288. Nowak-Wegrzyn A, Chehade M, Groetch ME, et al. International consensus guidelines for the diagnosis and management of food protein induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol 2017; 139:1111-26.e4.
289. Foong RX, Santos AF. Biomarkers of diagnosis and resolution of food allergy. Pediatr Allergy Immunol. 2021;32(2):223-33.
290. Sociedade Brasileira de Pediatria. Carvalho E. Alergia alimentar. Pronap ciclo XXIV, 2022 [Internet]. Disponível em: https://www.sbp.com.br/sbp-servicos/ead-educacao-a-distancia/pronap/pronap-ciclo-xxiv/ Acesso em setembro de 2024.
291. Upton JEM, Wong D, Nowak-Wegrzyn A. Baked milk and egg diets revisited. Ann Allergy Asthma Immunol. 2024;132(3):328-336.e5.
292. Leech SC, Ewan PW, Skypala IJ, Brathwaite N, Erlewyn-Lajeunesse M, Heath S, et al. BSACI 2021 guideline for the management of egg allergy. Clin Exp Allergy. 2021;51(10):126278.
293. Hicks A, Fleischer D, Venter C. The future of cow's milk allergy - milk ladders in IgE-mediated food allergy. Front Nutr. 2024;11:1371772.
294. Zieger RS, Sampson HA, Bock SA, Burks Jr AW, Harden K, Noone S, et al. Soy allergy in infants and children with IgE- associated cow's milk allergy. J Pediatrics. 1999;134:614-22.
295. Domínguez O, Plaza AM, Alvaro M. Relationship Between Atopic Dermatitis and Food Allergy. Curr Pediatr Rev. 2019;16(2):11522.
296. Nutrients recommendations and Database: Dietary Reference Intakes (DRI). National Institues of Health. Office of Dietary Supplements. Disponível em: https://ods.od.nih.gov/HealthInformation/nutrientrecommendations.aspx#dri Acessado em novembro de 2024.
297. Fernandes F, Capelo A, Melo AC. Manual Prático de Alergia e Imunologia. 1st ed. Rio de Janeiro: Atheneu; 2023. 412 p.
298. Franco JM, Rubini N, Oliveira L. Alergia Alimentar - Série Alergia e Imunologia da ASBAI. Rio de Janeiro: Atheneu; 2022. 380p.
299. Gargano D, Appanna R, Santonicola A, De Bartolomeis F, Stellato C, Cianferoni A, et al. Food allergy and intolerance: a narrative review on nutritional concerns. Nutrients. 2021;13(5):1638.
300. Agência Nacional de Vigilância Sanitária - Normas regulatórias da Agência Nacional de Vigilância Sanitária. Disponível em: https://antigo.anvisa.gov.br/documents/10181/3426605/IN_200_2022_.pdf/d242f446-f9b6-437a-b61b-a5dd7a09d5f2 Acessado em novembro de 2024.
301. de Jong NW, Wichers HJ. Update on Nutrition and Food Allergy. Nutrients. 2022;14(10):2137.
302. ANVISA. Resolução ANVISA/DCNo26 de 02/07/2015. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2015/rdc0026_26_06_2015.pdf. Acesso em setembro de 2024.
303. Bhatia J, Greer F. Use of soy protein-based formulas in infant feeding. Pediatrics. 2008;121:1062-8.
304. Netting MJ, Allen KJ. Reconciling breast-feeding and early food introduction guidelines in the prevention and management of food allergy. J Allergy Clin Immunol. 2019;144(2):397-400.e1.
305. Schocker F, Jappe U. Breastfeeding: Maternally Transferred Allergens in Breast Milk: Protective or Sensitizing? Mol Nutr Food Res. 2022;66(15):e2200066.
306. Remington BC, Westerhout J, Meima MY, Blom WM, Kruizinga AG, Wheeler MW, et al. Updated population minimal eliciting dose distributions for use in risk assessment of 14 priority food allergens. Food Chem Toxicol. 2020;139:111259.
307. American Academy of Pediatrics. Committee on Nutrition. Hypoallergenic infant formulae Pediatrics 2000;106(2 Pt 1):346-9.
308. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA); Turck D, Bresson JM, Burlingame B, et al. Scientific and technical guidance for the preparation and presentation of an application for authorisation of an infant and/or follow-on formula manufactured from protein hydrolysates. EFSA J. 2017;15(5):4779.
309. Nutten S, Maynard F, Järvi A, Rytz A, Simons PJ, Heine RG, et al. Peptide size profile and residual immunogenic milk protein or peptide content in extensively hydrolyzed infant formulas. Allergy. 2020;75:1446-9.
310. Strózyk A, Horvath A, Meyer R, Szajewska H. Efficacy and safety of hydrolyzed formulas for cow's milk allergy management: A systematic review of randomized controlled trials. Clin Exp Allergy. 2020;50:766-79.
311. Nutten S, Schuh S, Dutter T, Heine RG, Kuslys M. Design, quality, safety and efficacy of extensively hydrolysed formula for management of cow's milk protein allergy: What are the challenges? Adv Food Nutr Res. 2020;93:147-204.
312. Rodrigues VCC, Cezar TM, Abreu CLM, Sanudo A, Morais MB. A real-world cross-sectional study evaluating the role of an oral amino acid-based supplement in nutrient intake by preschoolers on a cow's milk elimination diet. Allergol Immunopathol (Madr). 20241;52(3):42-52.
313. Järvinen KM, Chatchatee P. Mammalian milk allergy: clinical suspicion, cross-reactivities and diagnosis. Curr Opin Allergy Clin Immunol. 2009;9:251-8.
314. Vandenplas Y, De Mulder N, De Greef E, Huysentruyt K. Plant-based formulas and liquid feedings for infants and toddlers. Nutrients. 2021;13:4026.
315. Munhoz Aguirre CP, Vasconcelos PSV, Siqueira Caldas JP, Lomazi EA, Bellomo-Brandão MA.Induced protocolitis: oral food challenge should be done to confirm the diagnosis of cow's milk allergy in neonates? Arq Gastroenterol. 2022;59:365-369.
316. Tran KL, Wisner EL, Jeha GM, Wall LA. Development of IgE-mediated food allergies in children with history of food protein-induced allergic proctocolitis: a series of five cases. Front Allergy. 2024;5:1354106.
317. Martin VM, Virkud YV, Seay H, Hickey A, Ndahayo R, Rosow R, et al. Prospective assessment of pediatrician-diagnosed food protein-induced allergic proctocolitis by gross or occult blood. J Allergy Clin Immunol Pract. 2020;8:1692-1699.e1.
318. Martin VM, Virkud YV, Phadke NA, Su KW, Seay H, Atkins MR, et al. Increased IgE mediated food Allergy with food protein-induced allergic proctocolitis. Pediatrics. 2020;146:e20200202.
319. Athanasopoulou P, Deligianni E, Dean T, Dewey A, Venter C. Use of baked milk challenges and milk ladders in clinical practice: a worldwide survey of healthcare professionals. Clin Exp Allergy. 2017;47:430-434.
320. Nowak-Wegrzyn A, Bloom KA, Sicherer SH, Shreffler WG, Noone S, Wanich N, et al. Tolerance to extensively heated milk in children with cow's milk allergy. J Allergy Clin Immunol. 2008; 122:342-347 e1-2.
321. Meyer R, De Koker C, Dziubak R, Godwin H, Reeve K, Chebar-Lozinsky A, et al. The challenge of home allergen re-introductions using the ladder approach in children with non-IgE mediated gastrointestinal food allergy. Front Allergy. 2021;2:721686.
322. Venter C, Meyer R, Ebisawa M, Athanasopoulou P, Mack DP. Food allergen ladders: a need for standardization. Pediatr Allergy Immunol. 2022;33, e13714.
323. Venter C, Brown T, Shah N, Walsh J, Foz A. Diagnosis and management of non-IgE mediated cow's milk allergy in infancy: a UK primary care practical guideline. Clin Transl Allergy. 2013;3:23.
324. Vassilopoulou E, Feketea G, Pagkalos I, Rallis D, Milani GP, Agostoni C, et al. Complementary Feeding Practices: Recommendations of Pediatricians for Infants with and without Allergy Risk. Nutrients. 2024;16(2):239.
325. Ierodiakonou D, Garcia-Larsen V, Logan A, Groome A, Cunha S, Chivinge J, et al. Timing of allergenic food introduction to the infant diet and risk of allergic or autoimmune disease a systematic review and meta-analysis. JAMA. 2016;316:1181-92.
326. Agyemang A, Nowak-Wegrzyn A. Food Protein-Induced Enterocolitis Syndrome: a Comprehensive Review. Vol. 57, Clin Rev Allergy Immunol. 2019;57:261-71.
327. Akashi M. Food Protein-induced Enterocolitis Syndrome. Keio J Med. 2023;72(1):1-10.
328. Groetch M, Baker MG, Durban R, Meyer R, Venter C, Muraro A. The practical dietary management of food protein-induced enterocolitis syndrome. Ann Allergy Clin Immunol. 2021;127:2835.
329. Mulé A, Prattico C, Al Ali A, Mulé P, Ben-Shoshan M. Diagnostic and Management Strategies of Food Protein-Induced Enterocolitis Syndrome: Current Perspectives. Pediatric Health Med Ther. 2023;14:337-45.
330. Argiz L, Infante S, Machinena A, Bracamonte T, Echeverria L, Prieto A, et al. Children with acute food protein-induced enterocolitis syndrome from Spain and Italy usually tolerate all other food groups. Clin Exp Allergy. 2021;51:1238-41.
331. Franco JM, de-Oliveira LCL, Castro APBM, Pomiecinski F, Reali ACR, Yang AC, et al. Introduction of food in the first year of life and food allergy prevention: what is the evidence? Arq Asma Alerg Imunol. 2022;6(1):49-57.
332. Adam T, Divaret-Chauveau A, Roduit C, Adel-Patient K, Deschildre A, Raherison C, et al. Complementary feeding practices are related to the risk of food allergy in the ELFE cohort. Allergy. 2023;78(9):2456-66.
333. Jung M. Overcoming Maternal Worries: A Journey to Prevent Infants From Food Allergies by Enhancing Dietary Variety and Boosting Gut Health. Allergy Asthma Immunol. Res. 2024;16:126-9.
334. Meyer R, Wright K, Vieira MC, Chong KW, Chatchatee P, Vlieg-Boerstra BJ, et al. International survey on growth indices andimpacting factors in children with food allergies. J Hum Nutr Diet. 2019;32:175.
335. Berry MJ, Adams J, Voutilainen H, Feustel PJ, Celestin J, Järvinen KM. Impact of elimination diets on growth andnutritional status in children with multiple food allergies. Pediatr Allergy Immunol. 2015;26:133.
336. Berni Canani R, Leone L, D'Auria E, Riva E, Nocerino R, Ruotolo S, et al. The effects of dietary counseling on childrenwith food allergy: a prospective, multicenter intervention study. J Acad Nutr Diet. 2014;114:1432.
337. Groerch M, Sicherer SH, TePas E. Management of food allergy: Nutritional issues. UpToDate. 2024. Disponível em: https://www.uptodate.com/contents/management-of-food-allergy-nutritional-issues. Acessado em outubro de 2024.
338. Maslin K, Venter C, MacKenzie H, Vlieg-Boerstra B, Dean T, Sommer I. Comparison of nutrient intake in adolescents and adults with and without food allergies. J Hum Nutr Diet. 2018;31(2):209-1.
339. Hill AS, Nurmatov U, DunnGalvin A, Reese I, Vieira MC, Rommel N, et al. Feeding difficulties in children with food allergies: An EAACI Task Force Report. Pediatr Allergy Immunol. 2024;35:e14119.
340. Raitano V, Pecoraro L, Sboarina A, Brugnara M, Piacentini G, Pietrobelli A. Children with cow milk allergy could have feeding difficulties that must not be underestimated. Minerva Pediatr (Torino). 2024 Jan 19. doi: 10.23736/S2724-5276.23.07454-2.
341. Dziechciarz P, Strózyk A, Horvath A, Cudowska B, Jedynak-Wasowicz U, Mól N, et al. Nutritional status and feeding difficulties in children up to 2 years of age with cow's milk allergy. J Pediatr Gastroenterol Nutr. 2024 Jan 30. doi: 10.1002/jpn3.12139.
342. Rodrigues VCC, Speridião PDGL, Sanudo A, Morais MB. Feeding difficulties in children fed a cows' milk elimination diet. Br J Nutr. 2022;128(6):1190-9.
343. LingJen W, ShuChi M, MingI L, TsengChen S, BorLuen C, ChengHui L. Clinical Manifestations of Pediatric Food Allergy: a Contemporary Review. Clin Rev Allergy Immunol. 2022;62:18099.
344. Polloni L, Schiff S, Ferruzza E, Lazzarotto F, Bonaguro R, Toniolo A, et al. Food allergy and attitudes to close interpersonal relationships: an exploratory study on attachment. Pediatr Allergy Immunol. 2017;28(5):458-63.
345. Shaker MS, Schwartz J, Ferguson M. An update on the impact of food allergy on anxiety and quality of life. Curr Opin Pediatr. 2017;29(4):497-502.
346. Shanahan L, Zucker N, Copeland WE, Costello EJ, Angold A. Are children and adolescents with food allergies at increased risk for psychopathology? J Psychosom Res. 2014;77(6):468-73.
347. Annunziato RA, Rubes M, Ambrose MA, Mullarkey C, Shemesh E, Sicherer SH Longitudinal evaluation of food allergy related bullying. J Allergy Clin Immunol Pract. 2014;2(5):639-641.
348. Fong AT, Katelaris CH, Wainstein B (2017) Bullying and quality of life in children and adolescents with food allergy. J Paediatr Child Health. 53:630-5.
349. Thornqvist V, Middelveld R, Wai HM, Ballardini N, Nilsson E, Stromquist J, et al. Health-related quality of life worsens by school age amongst children with food allergy. Clin Transl Allergy. 2019;7(9):10.
350. Dreskin SC, Halsey NA, Kelso JMJM, Wood RA, Hummell DS, Edwards KM, et al. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016;9(1):32.
351. Marinho AKBB, Antunes AA, Guimarães BNA, Gerhardt CMB, Valente CFC, Anagusko CLY, et al. Reações de hipersensibilidade a vacinas. Arq Asma Alerg Imunol. 2023;7(1):3-22.
352. McNeil MM, DeStefano F. Vaccine-associated hypersensitivity. J Allergy Clin Immunol. 2018;141(2):463-72.
353. Tanos Lopes FT, Romanelli MCR, de Oliveira IL, Abrantes MM, Rocha W. Safe administration of yellow fever vaccine in patients with suspected egg allergy. J Allergy Clin Immunol Glob. 2023;2(3):100089.
354. Marinho AKBB, Ouricuri AL, Valente CFC, Fernandes FR, Saciloto G, Diniz L de C, et al. Vacina contra a febre amarela: reações adversas e populações de risco. Arq Asma, Alerg Imunol. 2017;1(3):24556.
355. SBIM/ASBAI. Guia de Imunização SBIm/ASBAI - Asma, Alergia e Imunodeficiências 2020-2021. 2020. Disponível em: https://sbim.org.br/images/guias/guia-sbim-asbai-miolo-201013b-web.pdf. Acessado em outubro de 2024.
356. Leech SC, Ewan PW, Skypala IJ, Brathwaite N, Erlewyn-Lajeunesse M, Heath S, et al. BSACI 2021 guideline for the management of egg allergy. Clin Exp Allergy. 2021;51(10):126278.
357. Cançado BLB, Aranda CS, Mallozi MC, Weckx LY, Solé D. Egg allergy and yellow fever vaccination. J Pediatr (Rio J). 2024;100(1):60-6.
358. Muñoz-Cano R, Pascal M, Araujo G, Goikoetxea MJ, Valero AL. Mechanisms, Cofactors, and Augmenting Factors Involved in Anaphylaxis. Front Immunol. 2017; 26:8:1193.
359. Slapnicar C, Lebovic G, McParland A, Dozois M, Vadas P. Reproducibility of Symptom Sequences Across Episodes of Recurrent Anaphylaxis. J Allergy Clin Immunol Pract. 2022;10(2):534-8.
360. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
361. Golden DBK, Wang J, Waserman S, Akin C, Campbell RL. Anaphylaxis: A 2023 practice parameter update. J Ann Allergy Asthma Immunol. 2024;132(2):124-76.
362. Muraro A, Worm M, Alviani C, Cardona V, DunnGalvin A, Garvey LH, et al. EAACI guidelines: Anaphylaxis (2021 update). Allergy. 2022;77(2):357-77.
363. Lieberman JA, Wang J. Epinephrine in anaphylaxis: too little, too late. Curr Opin Allergy Clin Immunol. 2020;20(5):452-458.
364. Prince BT, Mikhail I, Stukus DR. Underuse of epinephrine for the treatment of anaphylaxis: missed opportunities. J Asthma Allergy. 2018;11:143-51.
365. Murakami Y, Iwami T, Kitamura T, Nishiyama C, Nishiuchi T, Utstein Osaka Project, et al. Outcomes of out-of-hospital cardiac arrest by public location in the public-access defibrillation era. J Am Heart Assoc. 2014; 22;3(2):e000533.
366. Rudders SA, Banerji A, Corel B, Clark S, Camargo CA Jr. Multicenter study of repeat epinephrine treatments for food-related anaphylaxis. Pediatrics. 2010;125:e711-8.110.
367. Patel N, Chong KW, Yip AYG, Ierodiakonou D, Bartra J, Boyle RJ, Turner PJ. Use of multiple epinephrine doses in anaphylaxis: A systematic review and meta-analysis. J Allergy Clin Immunol. 2021;148(5):1307-15.
368. Kassel L, Jones C, Turin R, Daly M, Mengesha A. Enantiomeric degradation of epinephrine in autoinjector products. J Allergy Clin Immunol Pract. 2022;10 (9):2463-2465.e1.
369. Duvauchelle T, Robert P, Donazzolo Y, Loyau S, Orlandini B, Lehert P, Lecomte JM, Schwartz JC. Bioavailability and cardiovascular effects of adrenaline administered by Anapen 500 μg auto-injector in healthy volunteers. Br J Clin Pharmacol. 2023;89(3):10129.
370. Waserman S, Turner PJ. Who Needs Epinephrine? Anaphylaxis, Autoinjectors, and Parachutes. J Allergy Clin Immunol Pract. 2023;11(4):1036-46.
371. Song TT, Lieberman P. Epinephrine auto-injector needle length: what is the ideal length? Curr Opin Allergy Clin Immunol. 2016;16(4):361-5.
372. Antolín-Amérigo D, Vidal-Albareda C, González de Olano D, de la Hoz-Caballer B. Current update on anaphylaxis: anaphylaxis management in recent guidelines. Eur Ann Allergy Clin Immunol. 2024;56(2):51-64.
373. Lieberman P, Nicklas RA, Randolph C, Oppenheimer J, Bernstein D, Bernstein J, et al. Anaphylaxis-a practice parameter update 2015. Ann Allergy Asthma Immunol. 2015;115(5):341-84.
374. Simons FER, Ardusso LRF, Bil MB, El-Gamal YM, Ledford DK, Ring J, et al. World Allergy Organization anaphylaxis guidelines: Summary. J Allergy Clin Immunol. 2011;127(3):587-93.e1-22.
375. Simons FE, Sampson HA. Anaphylaxis: Unique aspects of clinical diagnosis and management in infants (birth to age 2 years). J Allergy Clin Immunol. 2015;135(5):1125-31.
376. Rawas-Qalaji M, Rachid O, Mendez BA, Losada A, Simons FER, Simons KJ. Adrenaline (epinephrine) microcrystal sublingual tablet formulation: Enhanced absorption in a preclinical model. J Pharm Pharmacol. 2015;67(1):20-5.
377. ARS Pharma. ARS Pharmaceuticals announces FDA fast track designation for ARS-1 intranasal epinephrine spray. News release [Internet]. February 19, 2019. Disponível em: https://ars-pharma.com/2019/02/19/ars-pharmaceuticals-announces-fda-fast-track-designation-for-ars-1-intranasal-epinephrine-spray/. Acessado em Agosto 2024.
378. Whyte AF, Soar J, Dodd A, Hughes A, Sargant N, Turner PJ. Emergency treatment of anaphylaxis: concise clinical guidance. Clin Med. 2022;22(4):332-9.
379. Pumphrey RSH. Fatal posture in anaphylactic shock. J Allergy Clin Immunol. 2003;112:451-2.
380. Gabrielli S, Clarke A, Morris J, Eisman H, Gravel J, Enarson P, et al. Evaluation of Prehospital Management in a Canadian Emergency Department Anaphylaxis Cohort. J Allergy Clin Immunol Pract. 2019;7(7):2232-2238.e3.
381. Shaker MS, Wallace D V., Golden DBK, Oppenheimer J, Bernstein JA, Campbell RL, et al. Anaphylaxis-a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020;145(4):1082-123.
382. Dodd A, Hughes A, Sargant N, Whyte AF, Soar J, Turner PJ. Evidence update for the treatment of anaphylaxis. Resuscitation. 2021;163:86-96.
383. Warren CM, Jiang J, Gupta RS. Epidemiology and Burden of Food Allergy. Curr Allergy Asthma Rep. 2020;20(2):6.
384. Mikkelsen A, Mehlig K, Borres MP, Oxelmark L, Björkelund C, Lissner L. Monitoring the impact of cow's milk allergy on children and their families with the FLIP questionnaire - a six-month follow-up study. Pediatr Allergy Immunol. 2015;26(5):409-15.
385. Peters RL, Dang TD, Allen KJ. Specific oral tolerance induction in childhood. Pediatr Allergy Immunol.2016;27:784-94.
386. Keet CA, Seopaul S, Knorr S, Narisety S, Skripak J, Wood RA. Long-term follow-up of oral immunotherapy for cow's milk allergy. J Allergy Clin Immunol.2013;132:737-9.
387. Durham SR, Shamji MH. Allergen immunotherapy: past, present and future. Nat Rev Immunol 2023;23:317-28.
388. Muraro A, Silva D, Halken S, Worm M, Khaleva E, Arasi S, et al. Managing food allergy: GA2LEN guideline 2022. World Allergy Organ J. 2022;15:100687.
389. Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy and immune tolerance to allergens. World Allergy Organ J. 2015;8:17.
390. Kulis MD, Patil SU, Wambre E, Vickery BP. Immune mechanisms of oral immunotherapy. J Allergy Clin Immunol. 2018;141:491-8.
391. Schoos AM, Bullens D, Chawes BL, Costa J, De Vlieger L, DunnGalvin A, et al. Immunological Outcomes of Allergen-Specific Immunotherapy in Food Allergy. Front Immunol. 2020;11:56898.
392. Monian B, Tu AA, Ruiter B, Morgan DM, Petrossian PM, Smith NP, et al. Peanut Oral Immunotherapy Suppresses Clonally Distinct Subsets of T Helper Cells. SSRN Electron J. 2020;132:e150634.
393. Wawrzyniak M, O'Mahony L, Akdis M. Role of regulatory cells in oral tolerance. Allergy Asthma Immunol Res. 2017;9:107-15.
394. Baloh CH, Huffaker MF, Laidlaw T. Biomarkers and mechanisms of tolerance induction in food allergic patients drive new therapeutic approaches. Front Immunol. 2022;13:972103.
395. Ponsonby AL, Collier F, O'Hely M, Tang MLK, Ranganathan S, Gray L, et al. Household size, T regulatory cell development, and early allergic disease: A birth cohort study. Pediatr Allergy Immunol. 2022;33:e13810.
396. Syed A, Garcia MA, Lyu SC, Bucayu R, Kohli A, Ishida S, et al. Peanut oral immunotherapy results in increased antigen-induced regulatory T-cell function and hypomethylation of forkhead box protein 3 (FOXP3). J Allergy Clin Immunol. 2014;133:500-10.
397. Vardar Acar N, Cavkaytar Ö, Arik Yilmaz E, Büyüktiryaki AB, Uysal Soyer Ö, Sahiner ÜM, et al. Rare occurrence of common filaggrin mutations in Turkish children with food allergy and atopic dermatitis. Turk J Med Sci. 2020;50:1865-71.
398. Bajzik V, DeBerg HA, Garabatos N, Rust BJ, Obrien KK, Nguyen QA, et al. Oral desensitization therapy for peanut allergy induces dynamic changes in peanut-specific immune responses. Allergy. 2022;77:2534-48.
399. Berin MC, Agashe C, Burks AW, Chiang D, Davidson WF, Dawson P, et al. Allergen-specific T cells and clinical features of food allergy: Lessons from CoFAR immunotherapy cohorts. J. Allergy Clin Immunol. 2022;149:1373-1382.e12.
400. Tsai M, Mukai K, Chinthrajah RS, Nadeau KC, Galli SJ. Sustained successful peanut oral immunotherapy associated with low basophil activation and peanut-specific IgE. J Allergy Clin Immunol. 2020;145:885-896.e6.
401. Kulis M, Yue X, Guo R, Zhang H, Orgel K, Ye P, et al. High- and low-dose oral immunotherapy similarly suppress pro-allergic cytokines and basophil activation in young children. Clin Exp Allergy. 2019;49:180-9.
402. Takasato Y, Kurashima Y, Kiuchi M, Hirahara K, Murasaki S, Arai F, et al. Orally desensitized mast cells form a regulatory network with Treg cells for the control of food allergy. Mucosal Immunol. 2021;14:640-51.
403. Patil SU, Steinbrecher J, Calatroni A, Smith N, Ma A, Ruiter B, et al. Early decrease in basophil sensitivity to Ara h 2 precedes sustained unresponsiveness after peanut oral immunotherapy. J Allergy Clin Immunol. 2019;144:1310-1319.e4.
404. Gorelik M, Narisety SD, Guerrerio AL, Chichester KL, Keet CA, Bieneman AP, et al. Suppression of the immunologic response to peanut during immunotherapy is often transient. J Allergy Clin Immunol. 2015;135:1283-92.
405. Patil SU, Ogunniyi AO, Calatroni A, Tadigotla VR, Ruiter B, Ma A, et al. Peanut oral immunotherapy transiently expands circulating Ara h 2-specific B cells with a homologous repertoire in unrelated subjects. J Allergy Clin Immunol. 2015;136:125-134.e12.
406. Vickery BP, Scurlock AM, Kulis M, Steele PH, Kamilaris J, Berglund JP, et al. Sustained unresponsiveness to peanut in subjects who have completed peanut oral immunotherapy. J Allergy Clin Immunol. 2014;133:468-75.
407. Kulis M, Saba K, Kim EH, Bird JA, Kamilaris N, Vickery BP, et al. Increased peanut-specific IgA levels in saliva correlate with food challenge outcomes after peanut sublingual immunotherapy. J Allergy Clin Immunol. 2012;129:1159-62.
408. Pier J, Liu EG, Eisenbarth S, Järvinen KM. The role of immunoglobulin A in oral tolerance and food allergy. Ann Allergy Asthma Immunol. 2021;126:467-8.
409. Kulis M, Smeekens J, Larson D, Qin T, Burks AW. Peanut-Specific IgA and IgG4 in Saliva are Modulated by Peanut OIT. J Allergy Clin Immunol. 2020;145:AB181.
410. Santos AF, James LK, Kwok M, McKendry RT, Anagnostou K, Clark AT, et al. Peanut oral immunotherapy induces blocking antibodies but does not change the functional characteristics of peanut specific IgE. J Allergy Clin Immunol. 2020;145:4403 e5.
411. van de Veen W, Stanic B, Yaman G, Wawrzyniak M, Söllner S, Akdis DG, et al. IgG4 production is confined to human IL-10-producing regulatory B cells that suppress antigen-specific immune responses. J Allergy Clin Immunol. 2013;131:120412.
412. Chinthrajah RS, Purington N, Andorf S, Long A, O'Laughlin KL, Lyu SC, et al. Sustained outcomes in oral immunotherapy for peanut allergy (POISED study): A large, randomised, double-blind, placebo-controlled, phase 2 study. Lancet. 2019;394:437-1449.
413. Allam JP, Würtzen PA, Reinartz M, Winter J, Vrtala S, Chen KW, et al. Phl p 5 resorption in human oral mucosa leads to dose-dependent and time-dependent allergen binding by oral mucosal Langerhans cells, attenuates their maturation and enhances their migratory and TGF-β1 and IL-10-producing properties. J Allergy Clin Immunol. 2010;126:638-645.e1.
414. Schworer SA, Kim EH. Sublingual immunotherapy for food allergy and its future directions. Immunotherapy. 2020;12:921-31.
415. Scheurer S, Toda M. Epicutaneous immunotherapy. Allergol Immunopathol. 2017;45:25-9.
416. Sampath V, Sindher SB, Alvarez Pinzon AM, Nadeau KC. Can Food Allergy be Cured? What are the Future Prospects? Allergy. 2020;75:1316-26.
417. Pouessel G, Lezmi G. Oral immunotherapy for food allergy: Translation from studies to clinical practice? World Allergy Organ J. 2023;16(2):100747.
418. Loh W, Tang MLK. Debates in Allergy Medicine: oral immunotherapy shortens the duration of milk and egg allergy - the con argument. World Allergy Organ J. 2018;15;11(1):12.
419. Martorell A, Alonso E, Echeverría L, Escudero C, García-Rodríguez R, Blasco C, et al. Oral immunotherapy for food allergy: a Spanish guideline. Immunotherapy egg and milk Spanish guide (ITEMS guide). Part I: cow milk and egg oral immunotherapy: introduction, methodology, rationale, current state, indications, contraindications, and oral immunotherapy build-up phase. J Investig Allergol Clin Immunol. 2017;27(4):225-37.
420. Soller L, Williams BA, Mak R, Wong T, Erdle SC, Chomyn A, et al. Safety and Effectiveness of Bypassing Oral Immunotherapy Buildup With an Initial Phase of Sublingual Immunotherapy for Higher-Risk Food Allergy. J Allergy Clin Immunol Pract. 2024;12(5):1283-1296.e2.
421. Scurlock AM. Oral and Sublingual Immunotherapy for Treatment of IgE-Mediated Food Allergy. Clin Rev Allergy Immunol. 2018;55(2):139-152.
422. Hervé PL, Dioszeghy V, Matthews K, Bee KJ, Campbell DE, Sampson HA. Recent advances in epicutaneous immunotherapy and potential applications in food allergy. Front Allergy. 2023;4:1290003.
423. Eapen AA, Lavery WJ, Siddiqui JS, Lierl MB. Oral immunotherapy for multiple foods in a pediatric allergy clinic setting. Ann Allergy Asthma Immunol. 2019;123(6):573-581.e3.
424. Larson E, Keyes S, Silvers S. Single versus multi-allergen oral immunotherapy for treatment of food allergy: a retrospective cohort study. Ann Allergy Asthma Immunol. 2022;129(5):S58.
425. Andorf S, Purington N, Block WM, Long AJ, Tupa D, Brittain E, et al. Anti-IgE treatment with oral immunotherapy in multifood allergic participants: a double blind, randomised, controlled trial. Lancet Gastroenterol Hepatol. 2018;3:85-94.
426. Wood RA, Togias A, Sicherer SH, Shreffler WG, Kim EH, Jones SM, et al. Omalizumab for the treatment of multiple food allergies. N Engl J Med. 2024;390:889-99.
427. Yamashita K, Nakamura T, Imai T, Honda A, Okada Y, Maeda M, Kamiya T. Optimal period for achieving sustained unresponsiveness in peanut oral immunotherapy. Asia Pac Allergy. 2023;13(3):97104.
428. Gernez Y, Nowak-Wegrzyn A. Immunotherapy for Food Allergy: Are We There Yet? J Allergy Clin Immunol Pract. 2017;5(2):25072.
429. Bird JA, Nilsson C, Brown K, Pham T, Tilles S, du Toit G, Assa'ad A. Long-term safety and immunologic outcomes of daily oral immunotherapy for peanut allergy. J Allergy Clin Immunol Glob. 2023;2(3):100120.
430. Thomander T, Toppila-Salmi S, Palosuo K, Voutilainen H, Kukkonen K, Pallasaho P, Kauppi P. Long-term clinical outcome of oral immunotherapy in adults with milk, peanut, and egg allergy: A pilot study. J Allergy Clin Immunol Pract. 2024;12(3):776-778 e2.
431. Epstein-Rigbi N, Goldberg MR, Levy MB, Nachshon L, Elizur A. Quality of life of food-allergic patients before, during, and after oral immunotherapy. J Allergy Clin Immunol Pract. 2019;7(2):42936 e2.
432. Pajno GB, Bernardini R, Peroni D, Arasi S, Martelli A, Landi M, et al. Allergen-specific Immunotherapy panel of the Italian Society of Pediatric Allergy and Immunology (SIAIP). Clinical practice recommendations for allergen-specific immunotherapy in children: the Italian consensus report. Ital J Pediatr. 2017;43(1):13.
433. Pajno GB, Fernandez-Rivas M, Arasi S, Roberts G, Akdis CA, Alvaro-Lozano M, et al. EAACI allergen immunotherapy guidelines group. EAACI guidelines on allergen immunotherapy: IgE-mediated food allergy. Allergy. 2018;73(4):799-815.
434. Bégin P, Chan ES, Kim H, Wagner M, Cellier MS, Favron-Godbout C, et al. CSACI guidelines for the ethical, evidence-based and patient-oriented clinical practice of oral immunotherapy in IgE-mediated food allergy. Allergy Asthma Clin Immunol. 2020;16:20.
435. Riggioni C, Oton T, Carmona L, Du Toit G, Skypala I, Santos AF, et al. Immunotherapy and biologics in the management of IgE-mediated food allergy: Systematic review and meta-analyses of efficacy and safety. Allergy. 2024;79(8):2097-127.
436. Pepper AN, Assa'ad A, Blaiss M, Brown E, Chinthrajah S, Ciaccio C, et al. Consensus report from the food allergy research & education (FARE) 2019 oral immunotherapy for food allergy summit. J Allergy Clin Immunol. 2020;146(2):244-9.
437. Herbert L, Marchisotto MJ, Vickery B. Patients' perspectives and needs on novel food allergy treatments in the United States. Curr Treat Options Allergy. 2021;8(1):9-20.
438. Perrett KP, Sindher SB, Begin P, Shanks J, Elizur A. Advances, practical implementation, and unmet needs regarding oral immunotherapy for food allergy. J Allergy Clin Immunol Pract. 2022;10(1):19-33.
439. Leonard SA, Laubach S, Wang J. Integrating oral immunotherapy into clinical practice. J Allergy Clin Immunol. 2021;147(1):1-13.
440. Mack DP, Dribin TE, Turner PJ, Wasserman RL, Hanna MA, Shaker M, et al. Preparing Patients for Oral Immunotherapy (PPOINT): International Delphi consensus for procedural preparation and consent. J Allergy Clin Immunol. 2024;153(6):1621-33.
441. Upton JEM, Correa N, Eiwegger T. Oral immunotherapy for food allergy: What's age got to do with it? Allergy. 2023;78(3):6268.
442. Zuberbier T, Wood RA, Bindslev-Jensen C, Fiocchi A, Chinthrajah RS, Worm M, et al. Omalizumab in IgE-mediated food allergy: a systematic review and meta-analysis. J Allergy Clin Immunol Pract. 2023;11:1134-46.
443. Nadeau KC, Schneider LC, Hoyte L, Borras I, Umetsu DT. J Allergy Clin Immunol. 2011;127(6):1622-4.
444. Riggioni C, Oton T, Carmona L, Du Toit G, Skypala I, Santos AF, et al. Immunotherapy and biologics in the management of IgE-mediated food allergy: Systematic review and meta-analyses of efficacy and safety. Allergy. 2024;79(8):2097-127.
445. Dantzer JA, Kim EH, Chinthrajah RS, Wood RA. Treatment for food allergy: current status and unmet needs. J Allergy Clin Immunol 2023;151:1-14.
446. Manohar M, Nadeau KC. The potential of anti-IgE in food allergy therapy. Curr Treat Options Allergy. 2014;1:145-56.
447. Varma D. FDA Approves Omalizumab for Multiple Food Allergy. Medscape, Wednesday, November 20, 2024 [Internet]. Disponível em: https://www.medscape.com/viewarticle/fda-approves-omalizumab-multiple-food-allergy-2024a10003sf?form=fpf Acessado em novembro de 2024.
448. Brozek JL, Firminoc RT, Bognannia A, Arasi S, Ansotegui I, Assa'ad AH, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) Guideline update - XIV - Recommendations on CMA immunotherapy. World Allergy Organ J. 2022;15:100646.
449. Bunyavanich S, Berin MC. Food allergy and the microbiome: Current understandings and future directions. J Allergy Clin Immunol, 2019;144(6):1468-77.
450. Hoskinson C, Dai DLY, Del Bel KL, Becker AB, Moraes TJ, Mandhane PJ, et al. Delayed gut microbiota maturation in the first year of life is a hallmark of pediatric allergic disease. Nat Commun. 2023;14:4785.
451. Barreto BAP, Moura PN. Probióticos na prevenção e no tratamento das doenças alérgicas. In: Solé D, Rosário-Filho NA, Rubini NPM. Compêndio de Alergia e Imunologia Clínica: do básico à prática clínica. Associação Brasileira de Alergia e Imunologia - ASBAI. 1º ed. São Paulo: Editora dos Editores; 2022.
452. Bognanni A, Fiocchi A, Arasi S, Chu DK, Ansotegui I, Assa'ad AH, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) guideline update - XII - Recommendations on milk formula supplements with and without probiotics for infants and toddlers with CMA. World Allergy Organ J. 2024;17(4):100888.
453. Inoue Y, Iwabuchi N, Xiao JZ, Yaeshima T, Iwatsuki K. Suppressive effects of bifidobacterium breve strain M-16V on T-helper type 2 immune responses in a murine model. Biol Pharm Bull. 2009;32(4):760-3.
454. Hougge K, Vriesema AJ, Wijering SC, Knippels LM, Folkerts G, Nijkamp FP, et al. Oral treatment with probiotics reduces allergic symptoms in ovalbumin-sensitized mice: a bacterial strain comparative study.Int Arch Allergy Immunol. 2010;151(2):10717.
455. Hattori K, Yamamoto A, Sasai M, Taniuchi S, Kojima T, Kobayashi Y, Iwamoto H, Namba K, Yaeshima T. Effects of administration of bifidobacteria on fecal microflora and clinical symptoms in infants with atopic dermatitis. Arerugi. 2003;52(1):20-30.
456. Solé D, Barreto BAP. O microbioma e as doenças alérgicas. In: Ferreira CHT, Barreto BAP, Tofoli MHC, Silva LR, Solé D, Constantino CF. Microbioma e Pediatria - na saúde e na doença. 1º ed. Barueri (SP): Manole; 2024.
457. Chen Y, Wen Y, Zhao R, Zhu Y, Chen Z, Zhao C, Mu W. Human milk oligosaccharides in preventing food allergy: A review through gut microbiota and immune regulation. Int J Biol Macromol. 2024;278(2):134868.
458. Warner JO, Warner JA. The Foetal Origins of Allergy and Potential Nutritional Interventions to Prevent Disease. Nutrients. 2022;14:1590.
459. Venter C, Smith PK, Fleischer DM. Food allergy prevention: Where are we in 2023? Asia Pacific Allergy. 2023;13(1):15-27.
460. Manti S, Galleta F, Bencivenga CL, Bettini I, Klain A, D'Addi E, Mari F, et al. Food Allergy Risk: A Comprehensive Review of Maternal Interventions for Food Allergy Prevention. Nutrients. 2024;16(1087):1-13.
461. Rueter K, Siafarikas A, Palmer DJ, Prescott SL. Pre and Postnatal Vitamin D Status and Allergy Outcomes in Early Childhood. Biomedicines. 2022;10:933.
462. Briceno-Noriega D, Savelkoul HFJ. Vitamin D and Allergy Susceptibility during Gestation and Early Life. Nutrients. 2021;13:1015.
463. Giannetti A, Bernardini C, Cangemi J, Gallucci M, Monsetti R, Ricci G. Role of Vitamin D in Prevention of Food Allergy in Infants. Front Pediatr. 2022;8:447.
464. Wang S, Yan P, Yu L, Tian F, Chen W, Zhai Q. Effects of Early Diet on the Prevalence of Allergic Disease in Children: A Systematic Review and Meta-Analysis. Adv Nutr. 2024;15:100128.
465. Cantorna MT, Snyder L, Arora J. Vitamin A and vitamin D regulate the microbial complexity, barrier function, and the mucosal immune responses to ensure intestinal homeostasis. Crit Rev Biochem Mol Biol. 2019;54(2):184-92.
466. di Mauro G, Bernardini R, Barberi S, Capuano A, Correra A, Gian Luigi De' Angelis GL, et al. Prevention of food and airway allergy: consensus of the Italian Society of Preventive and Social Paediatrics, the Italian Society of Paediatric Allergy and Immunology, and Italian Society of Pediatrics. World Allergy Organ J. 2016;9:28.
467. Vandenplas Y, Meyer R, Chouraqui J-P, Dupont C, Fiocchi A, Salvatore S, et al. The role of milk feeds and other dietary supplementary interventions in preventing allergic disease in infants: Fact or fiction? Clin Nutr. 2021;40(2):358-71.
468. Andrade DCM, Brum AKR. E-book: Cuidado seguro de crianças e adolescentes com alergia alimentar no ambiente escolar. Niterói-RJ, 2021. 125p Disponível em: https://educapes.capes.gov.br/bitstream/capes/597227/2/E-book%20Cuidado%20Seguro%20da%20crian%C3%A7a%20com%20alergia%20alimentar%20no%20
ambiente%20escolar.pdf. Acessado em outubro de 2024.
469. Centers for Disease Control and Prevention. Voluntary Guidelines for Managing Food Allergies in Schools and Early Care and Education Programs [Internet]. 2013. Disponível em: www.cdc.gov/healthyyouth/foodallergies/. Acessado em outubro de 2024.
470. Alergia Alimentar Brasil [Internet]. Disponível em: https://alergiaalimentarbrasil.com.br/dia-a-dia/na-escola/. Acessado em outubro de 2024.
471. Brasil. Lei Nº 12.982, de 28 de maio de 2014. Disponível em: https://www.planalto.gov.br/ccivil_03/_ato2011-2014/2014/lei/l12982.htm. Acessado em outubro de 2024.
472. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC Nº 26, de 02 de julho de 2015. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2015/rdc0026_26_06_2015.pdf. Acessado em outubro de 2024.
473. Brasil. Lei nº 13.722, de 4 de outubro de 2018- "Lei Lucas". Disponível em: https://legis.senado.leg.br/norma/30228750#:~:text=Torna%20obrigat%C3%B3ria%20a%20capacita%C3%A7%
C3%A3o%20em,de%20estabelecimentos%20de%20recrea%C3%A7%C3%A3o%20infantil.&text=Sobre%20a%
20vig%C3%AAncia%20desta%20lei,8%C2%BA. Acessado em outubro de 2024.
474. Alergia Alimentar Brasil. Disponível em: https://alergiaalimentarbrasil.com.br/dia-a-dia/na-escola/. Acesado em novembro de 2024.
475. ASBAI - Dicas importantes que ajudam a deixar o ambiente escolar seguro para a criança [Internet]. Disponível em: https://asbai.org.br/o-que-as-escolas-precisam-saber-para-receber-uma-crianca-com-alergia-alimentar/. Acessado em novembro de 2024.
476. Wood RA, Sicherer SH, Vickery BP, Jones SM, Liu AH, Fleischer DM, et al. The natural history of milk allergy in an observational cohort. J Allergy Clin Immunol. 2013;131-805.
477. Peters RL, Allen KJ, Dharmage SC, Koplin JJ, Dang T, Tilbrook KP, et al. Natural history of peanut allergy and predictors of resolution in the first 4 years of life, A populational based assessment. J Allergy Clin Immnuol. 2015;135:1257.
478. Perry TT, Matsui EC, Kay Conover-Walker M, Wood RA. The relationship of allergen-specific IgE levels and oral food challenge outcome. J Allergy Clin Immunol. 2004;114:44.
479. Hill DJ, Firer MA, Ball G, Hosking CS. Natural history of cow's milk allergy in children; immunological outcome over 2 years. Clin Exp Allergy. 1993;23:124.
480. Sampson HA, Arasi S, Bahnson HT, Ballmer-Weber B, Beyer K, Bindslev-Jensen C, et al. AAAAI-EAACI PRACTALL: Standardizing oral food challenges-2024 Update. Pediatr Allergy Immunol. 2024;35(11):e14276.