Número Atual: Julho-Setembro 2023 - Volume 7 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Biomarcadores na urticária crônica: qual o seu papel?
Biomarkers of chronic urticaria: what are their role?
Rossy Moreira Bastos-Junior1; Gabriela Andrade Dias2; Sérgio Duarte Dortas-Junior1; Fabio Chigres Kuschnir2; Solange Oliveira Rodrigues Valle1
1. Hospital Universitário Clementino Fraga Filho - HUCFF-UFRJ, Imunologia - Rio de Janeiro, RJ, Brasil
2. Hospital Universitário Pedro Ernesto - HUPE-UERJ, Imunologia - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Rossy Moreira Bastos-Junior
E-mail: dr.rossymbastos@uol.com.br
Submetido em: 09/06/2023
Aceito em: 16/09/2023.
RESUMO
A urticária é uma doença com comprometimento universal, e debilitante para a maioria dos pacientes. Caracteriza-se pela ocorrência de episódios de urticas, angioedema ou ambos, determinados pela ativação de mastócitos e outras células inflamatórias com a liberação de vários mediadores. Apresenta etiologia complexa com fenótipos e terapias bem específicas. A urticária crônica possui evolução recorrente e imprevisível, podendo estender-se por anos. Caracteristicamente possui maior prevalência no sexo feminino, com pico de ocorrência entre 20 e 40 anos. A doença pode ser diferenciada pela gravidade, impacto na qualidade de vida do paciente e resposta terapêutica. Biomarcador é uma característica clínica ou laboratorial mensurável de algum estado ou condição biológica, o qual pode influenciar ou prever a incidência de desfecho ou doença. O objetivo deste artigo é realizar uma revisão dos principais biomarcadores promissores e com melhor evidência relacionados à duração, atividade da doença e resposta terapêutica.
Descritores: Urticária crônica, angioedema, biomarcadores, autoimunidade.
Introdução
A urticária crônica (UC) é uma doença cutânea comum e com impacto negativo em vários aspectos da vida dos pacientes. A UC é caracterizada pela ocorrência de urticas e/ou angioedema, por período igual ou superior a seis semanas. Pode ser classificada em urticária crônica espontânea (UCE), quando não existe um desencadeante específico, e urticária crônica induzida (UCInd), na qual os sintomas são induzidos por estímulos específicos1,2.
O aparecimento das lesões ocorre pela ativação de mastócitos e outras células inflamatórias, como basófilos e eosinófilos com liberação de seus mediadores3. A UC possui evolução recorrente e imprevisível, podendo estender-se por anos, com cerca de 20% dos pacientes permanecendo com sintomas após 5 anos de evolução. Apresenta maior prevalência no sexo feminino, com pico de ocorrência entre 20 e 40 anos. A doença pode ser diferenciada pela gravidade, impacto na qualidade de vida do paciente e evolução clínica1,3.
Na última década foram realizadas inúmeras pesquisas com o objetivo de elucidar os mecanismos envolvidos no desenvolvimento da UC, assim como para a identificação de biomarcadores4. Biomarcador é uma característica clínica ou laboratorial mensurável de algum estado ou condição biológica, que permite conhecer, por exemplo, o estado de uma doença ou a resposta a um fármaco5.
A principal dificuldade no estabelecimento de biomarcadores para UC encontra-se na heterogeneidade da apresentação clínica e na complexidade da sua patogênese. Há várias formas de ativação mastocitária, com participação de inúmeras células e moléculas, levando a diferentes endótipos e fenótipos. O melhor conhecimento sobre esses endótipos através dos biomarcadores auxiliará na compreensão da evolução da UC e na pesquisa de alvos para novas terapias6.
O objetivo deste artigo é revisar os principais biomarcadores promissores e com melhor evidência relacionados à atividade da doença, à resposta terapêutica e à evolução natural da UC.
Metodologia
Foram realizadas buscas por artigos originais, revisões, diretrizes e consensos nas bases de dados Science Direct, PubMed, Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS), utilizando os termos: chronic urticaria, biomarkers, duration, prediction, prognosis, treatment, nos últimos 20 anos.
Biomarcadores
Na UC os biomarcadores são úteis na avaliação da gravidade, duração da doença e resposta ao tratamento.
Gravidade e duração de doença
Diversos biomarcadores de gravidade da doença foram estudados, dentre eles a exacerbação por anti-inflamatórios não esteroidais (AINEs), expressão aumentada de CD203c em basófilos, basopenia, eosinopenia, teste do soro autólogo (TSA), proteína C-reativa (PCR), velocidade de hemossedimentação (VHS), D-dímero, volume plaquetário médio (VPM), vitamina D, IL-6, IL-18 IL-17, IL-23, TNF-α, LCN2 e fragmento de protrombina 1+2 (F1+2). Contudo a associação com evidência mais forte foi demonstrada com D-dímero, PCR, F1+2, VPM e IL-6 3,7 (Figura 1).
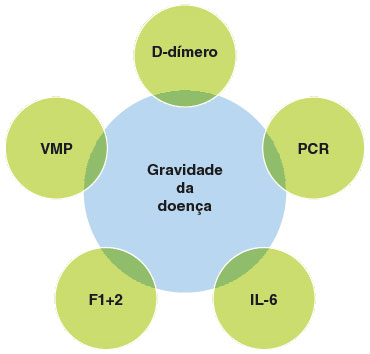
Figura 1
Biomarcadores de gravidade da urticária crônica
PCR = proteína C-reativa, VMP = volume médio das plaquetas, IL-6 = interleucina 6, F1+2 = fragmento de protrombina 1 e 2.
Fatores como gravidade da doença, presença de angioedema, idade, exacerbação por AINEs, associação com UCInd, presença de autoanticorpos tireoidianos, níveis aumentados de IL-6, expressão do receptor de alta afinidade (FcεRI) em basófilos e TSA positivo foram avaliados para predição da duração da doença, porém com resultados conflitantes. Há fracas evidências de que a presença dos autoanticorpos tireoidianos está relacionada a doença de maior duração3-5.
Alguns estudos demonstraram que a cascata da coagulação pode ser ativada em pacientes com UCE8,9. Marcadores plasmáticos da geração de trombina e fibrinólise, como o D-dímero e F1+2, estão elevados em pacientes com UCE, sugerindo que na ativação de células endoteliais são liberados fatores teciduais com consequente ativação da cascata de coagulação extrínseca e fibrinólise secundária. A trombina gerada pode aumentar a permeabilidade vascular e induzir degranulação de mastócitos. Contudo, na UCE não existem alterações da hemostasia ou maior frequência de eventos trombóticos8,9.
Os níveis de F1+2 e de D-dímero correlacionam-se com a atividade da doença. Os níveis médios de F1+2 estavam mais elevados nos pacientes com UCE do que nos controles (2,54 [DP 2,57] nmol/L vs 0,87 [0,26] nmol/L; p < 0,001); sendo a urticária com atividade moderada ou grave em 9 de 11 (82%) e 9 de 26 (35%) dos pacientes com níveis elevados ou normais de F1+2, respectivamente (p < 0,025). Os níveis plasmáticos médios de D-dímero foram mais elevados nos doentes do que nos controles (329 [188] ng/mL vs. 236 [81] ng/mL; p < 0,01); sendo a urticária com atividade moderada ou grave em 6 de 8 (75%) e 11 de 29 (38%) dos pacientes com níveis plasmáticos de D-dímero elevados ou normais, respectivamente (p < 0,00)10.
Em um estudo retrospectivo que avaliou a relação do D-dímero, PCR e produtos da degradação da fibrina em 82 pacientes com UCE foi encontrado que níveis elevados desses marcadores estavam relacionados à maior atividade da UC e, por outro lado a queda destes foi observada em pacientes controlados11. Em outro estudo realizado em 141 pacientes foi encontrada também associação do D-dímero com a atividade da doença, o que não foi observado para PCR, fibrinogênio, VMP e número de plaquetas12.
Outro estudo coreano, retrospectivo, avaliou se D-dímero, PCR e IgE total estavam associados à atividade da doença em pacientes adultos com UCE (n = 48) ou urticária aguda (n = 46). Um nível maior de D-dímero foi observado entre os pacientes com UA (1,3 g/L) em comparação com os pacientes com UCE (0,7 g/L), e os níveis de D-dímero correlacionaram-se significativamente com o Urticaria Activity Score (UAS) (r = 0,30; p < 0,001) e UC (r = 0,37; p < 0,05). Entretanto, não foi observada correlação significativa entre atividade da doença com PCR ou IgE total13.
Em um estudo egípcio, foi observado que os níveis plasmáticos de D-dímero e FVIIa foram significativamente maiores entre os pacientes com UCE (n = 30) ativa do que nos pacientes controle (n = 30). Os níveis de D-dímero estavam mais baixos nos pacientes com gravidade grau 1, e mais altos entre aqueles com gravidade grau 4. Os níveis de fator VIIa não diferiram significativamente de acordo com os graus de gravidade da doença. Após a remissão completa da doença, houve uma queda significativa nos níveis de D-dímero e FVIIa dos pacientes14.
No Brasil, em 55 pacientes com UCE foram avaliados níveis de D-dímero e PCR e teste do soro autólogo (TSA) e UAS. Os níveis médios de D-dímero foram de 0,85 ± 0,324 mg/L. A análise estatística mostrou uma relação forte e positiva entre UAS e D-dímero, onde níveis séricos elevados de D-dímero (> 0,5 mg/mL) foram observados em 22 pacientes; 18 pacientes (81,81%) foram classificados como tendo UCE com escore de atividade elevado. Foi observado que 32,7% dos pacientes necessitaram três ou mais medicamentos para alcançar a remissão da UCE durante o acompanhamento15.
A PCR é produzida pelo fígado, sendo um marcador sérico sensível para inflamação. Encontra-se elevada em várias doenças, incluindo infecções, doenças neoplásicas, autoimunes, cardiovasculares e gastrointestinais. Quando comparada ao VHS, é considerada um melhor marcador de inflamação, pois é menos afetada por outros fatores, como tamanho, forma e número de glóbulos vermelhos, sexo feminino e gravidez. A PCR tem se mostrado útil na determinação da atividade da doença, prognóstico ou eficácia do tratamento7,16.
O papel da inflamação tem sido demonstrado em estudos com pacientes com urticária crônica. Vários biomarcadores inflamatórios têm demonstrado papel importante na atividade e na resposta ao tratamento da UCE, em especial a PCR. Níveis aumentados de PCR foram encontrados em pacientes com UC e foram associados a outros marcadores inflamatórios (leucocitose, neutrofilia e níveis elevados de IL-6, C3, C4), maior gravidade da urticária, prejuízo à qualidade de vida e TSA positivo7,17,18.
Foi realizado estudo retrospectivo, em dois centros, com 1.253 pacientes com UCE. O objetivo foi avaliar a prevalência e relevância de níveis elevados de PCR. Um terço (418) dos pacientes apresentava níveis elevados de PCR, os quais foram associados à positividade no TSA (p = 0,009) e hipertensão arterial (p = 0,005), mas não com outras possíveis causas ou comorbidades da UCE. A PCR se correlacionou com a atividade da urticária (p < 0,001), comprometimento da qualidade de vida (p = 0,026) e marcadores inflamatórios e de coagulação (p < 0,001)7.
Grzanka e cols. demostraram que níveis de IL-17 e PCR foram significativamente maiores em pacientes com UCE em comparação com indivíduos saudáveis. Também, houve diferença significativa nos níveis de IL-17 e PCR entre os pacientes com UCE com sintomas leves, moderados-graves e indivíduos saudáveis, sendo os níveis de PCR respectivamente: (mediana e intervalo de quartis/min-máx): 1,4 (20,92-23,55/19,28-48,60) versus 9.8 (20,92-24,08/18,85-62,73) versus 0,4 (0,20-0,40/0,10-0,60) mg/L, p < 0,001. A PCR não se correlacionou significativamente com a IL-1719.
Dois outros estudos encontram níveis de PCR aumentados em pacientes com TSA positivo (5,81 ± 4,70 e 5,31 ± 2,74) em relação aos que apresentam TSA negativo (2,89 ± 4,85 e 2,53 ± 1,27) e aos pacientes do grupo controle (2,76 ± 4,52 e 2,34 ± 1,38); assim como correlação entre atividade da doença e níveis de PCR20,21. Magen e cols. também avaliaram o VPM, pois alguns estudos indicaram que o VPM se correlaciona com a função plaquetária. Plaquetas grandes são mais reativas, e a presença de grandes plaquetas no sangue é um indicador in vivo da atividade plaquetária. Foi encontrada correlação positiva significativa entre o escore de gravidade da UC e VPM em pacientes com TSA positivo (r 0,44; p = 0,001), mas não em pacientes com TSA negativo21.
Dentre os mediadores pró-inflamatórios, a IL-6 é biomarcador promissor na UCE, devido ao seu papel na promoção da resposta inflamatória. Níveis elevados de IL-6 foram detectados na UCE, com correlação positiva com os níveis de PCR, e também em pacientes em fase ativa da UCE e com doença moderada a grave18,22,23. Entretanto, em um estudo que avaliou os níveis de IL-18 e IL-6 em pacientes com UCE e controles saudáveis não foi observada diferença estatisticamente significativa entre os grupos, diferentemente de outros estudos que mostraram níveis mais elevados dessas citocinas que se correlacionaram com a atividade da doença24.
O TSA é um teste não específico que avalia a presença de autorreatividade, isto é, a presença de fatores endógenos pró-inflamatórios ou indutores de pápulas, incluindo autoanticorpos, que são gatilhos para degranulação de mastócitos e basófilos. A positividade deste teste está correlacionada com a presença de anticorpos IgG anti-FcεRI e IgG anti-IgE, responsáveis pela urticária crônica autoimune (UCAI) do tipo IIb, cujos critérios diagnósticos são (a) presença de um teste biológico positivo in vitro que demonstra a funcionalidade dos autoanticorpos (TLHB ou expressão de um marcador de ativação de basófilos, como CD63 ou CD203c através de citometria de fluxo); e (b) autorreatividade positiva (TSA positivo) que demonstra a relevância in vivo da degranulação de mastócitos e o aumento da permeabilidade capilar; e (c) um ensaio imunológico positivo para autoanticorpos contra receptores FcεRIα (Western blot ou ELISA), que demonstra a especificidade dos autoanticorpos25.
O TSA positivo foi associado a maior atividade da doença, duração maior e basopenia15,26,27, entretanto são necessários mais estudos. Em uma revisão sistemática sobre parâmetros associados à duração e gravidade da urticária foram encontrados oito artigos demonstrando associação entre positividade do TSA e gravidade da UC, e oito que não a demonstraram28.
O aumento da expressão de FcεR1α com expressão de CD203c regulado positivamente em basófilos periféricos é observada em pacientes com urticária crônica. Com o objetivo de investigar se o aumento da ativação de basófilos está associada à atividade da doença, foi avaliada a expressão de CD203c em basófilos de 82 pacientes com UC e 21 controles normais. A expressão média de CD203c foi significativamente maior em pacientes com UC do que em controles saudáveis controles (57,5% vs. 11,6%, p < 0,001). A expressão de CD203c basófilo em pacientes com UC grave foi significativamente maior do que na UC não grave (66,5% ± 23,3% vs. 54,0% ± 23,3%, p = 0,033)29.
Doença autoimune da tireoide é frequentemente observada em pacientes com UCE, assim como a presença de anticorpos antitireoidianos. A dosagem de IgG anti-TPO é recomendada nas diretrizes internacionais de urticária para avaliação da autoimunidade do tipo IIb1. A presença de IgG anti-TPO não foi relacionada à gravidade da urticária, mas alguns estudos a associaram à duração da doença. Uma avaliação retrospectiva encontrou que 12% dos pacientes com UCE apresentavam IgG anti-TPO, e que esses pacientes apresentaram doença mais prolongada quando comparados aos que não apresentavam IgG anti-TPO. Entretanto, não foi observada diferença quanto à gravidade da doença. Ainda neste estudo foi observado que 70% dos pacientes apresentam TSA e TPA positivos, e ambos foram associados com a gravidade da doença30. Em 2004, Toubi identificou que TSA e anticorpos antitireoidianos foram positivos em 28% e 12% dos pacientes com UCE avaliados, sendo a doença mais duradoura nestes pacientes quando comparados àqueles com TSA e IgG anti-TPO negativos. Contudo, não foi observada associação com a gravidade da urticária31.
Resposta ao tratamento
Os anti-histamínicos não sedantes em doses padrão ou altas são recomendados como tratamento de primeira e segunda linha para UCE. No entanto, até 50% dos pacientes são refratários a altas doses de anti-histamínicos e requerem outros medicamentos, como omalizumabe e ciclosporina para alcançarem o controle completo dos sintomas1. Prever a eficácia do tratamento antes de prescrevê-lo é fundamental para alcançar a remissão ou se não possível, melhorar controle da doença, evitando desperdício e perda de tempo em um esquema terapêutico sem eficácia. No entanto, a validação de biomarcadores com essa finalidade ainda não foi bem definida. Estudos com PCR, D-dímero, IgE total, expressão de CD203c e FceRI em basófilos, IL-31, TSA e teste de liberação de histamina de basófilos (TLHB), entre outros, foram desenvolvidos3.
A atividade elevada da doença avaliada com o uso do UAS7, PCR e D-dímero aumentados parecem ser bons preditores para refratariedade a anti-histamínicos (anti-H1) (Figura 2). Níveis baixos de IgE total são fortemente relacionados a resposta ruim ou ausente a omalizumabe, e a resposta boa à ciclosporina é predita pelo TLHB, conforme demonstrado em uma revisão sistemática32.
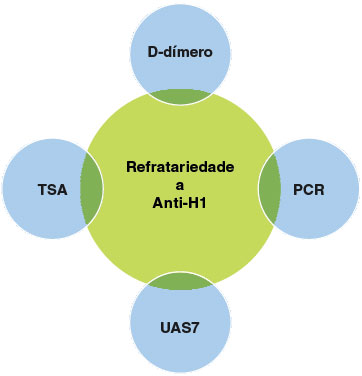
Figura 2
Biomarcadores de refratariedade a anti-histamínicos
TSA = teste do soro autólogo, PCR = proteína C-reativa, UAS7 = Urticaria activity score 7.
Refratariedade a anti-histamínicos
Alguns biomarcadores clínicos foram relacionados à refratariedade a anti-H1, como a presença de comorbidades como asma atópica, rinite, rinossinusite, doenças da tireoide e hipertensão arterial. No entanto, a evidência dessa correlação ainda é fraca33,34.
Um estudo retrospectivo com 549 pacientes com UC encontrou que mais de 75% dos pacientes eram refratários a anti-H1, e que o UAS7 basal foi o único parâmetro capaz de prever a refratariedade, sendo que cerca de 90% dos pacientes com UAS7 > 16 necessitaram de tratamento com omalizumabe ou ciclosporina35. Outro estudo retrospectivo com 385 pacientes com UCE demonstrou que pacientes refratários a anti-H1 eram caracterizados por maior incidência de angioedema, de UCInd concomitante, TSA positivo e UAS basal maior, sendo 5,28 no grupo refratário, e 3,32 nos que respondem a anti-H1. Também se observou níveis mais altos de proteína C-reativa36. Foi confirmado o achado em uma amostra com 1.253 pacientes com UCE, na qual os níveis elevados de PCR também foram correlacionados à refratariedade a anti-H1.
Ao avaliar-se biomarcadores de resposta à levocetirizina em 84 pacientes com UC, foi observado que entre os respondedores, 7,1%, 9,5%, 12%, 31% e 47,6% apresentaram níveis elevados de D-dímero, fibrinogênio, VHS, PCR e IgE total, respectivamente; e nos não respondedores, 54,8%, 26,2%, 35,7%, 54,8% e 23,8%, respectivamente37.
Montjoye e cols., em um estudo prospectivo com 95 pacientes com UCE, encontraram níveis de PCR elevados em pacientes não responsivos a anti-H1 (p < 0,0001) e em doenças mais graves (p = 0,033). Os níveis plasmáticos de D-dímero foram também maiores em pacientes não responsivos (p = 0,008) e em pacientes com doença autoimune concomitante e/ou com autoanticorpos (p = 0,016). A contagem de basófilos no sangue foi menor em pacientes não respondedores aos anti-H1 (p = 0,023), em pacientes com doença mais grave (p = 0,023), com TSA positivo (p = 0,001) e com doença autoimune (p = 0,057)38.
A ativação da coagulação na fisiopatologia da UC tem sido estudada. O fator tecidual é expresso em eosinófilos presentes no infiltrado inflamatório na urticária, e a trombina é capaz de degranular mastócitos. Então a elevação nos níveis plasmáticos do D-dímero, um marcador de fibrinólise pode ser um biomarcador potencial de refratariedade a anti-H137-39. Asero encontrou níveis de D-dímero elevados em 0 de 41 pacientes (0%) com resposta ''excelente'' à cetirizina, 3 de 14 (21%) com resposta ''boa'', 3 de 5 (60%) com resposta ''parcial'', 18 de 23 (78%) com resposta "ruim", e 7 de 8 (88%) dos não respondedores39.
O papel do TSA como biomarcador de refratariedade a anti-H1 ainda é controverso. Embora alguns estudos tenham demonstrado essa correlação36,40, outros não a encontraram41. Ye encontrou que o TSA pode ser um bom marcador de boa resposta ao tratamento27. Chanprapaph e cols. observaram correlação com o TPA, mas não com o TSA30 (Figura 2).
Resposta ao omalizumabe
O omalizumabe é um anticorpo monoclonal humanizado anti-IgE, indicado no tratamento da UCE refratária a anti-H1 que demonstrou boa eficácia e segurança nos estudos clínicos e de vida real1. A resposta ao omalizumabe pode ser classificada de acordo com o tempo de ocorrência em rápida, lenta ou ausente após seis meses de tratamento ou pelo tipo em completa (UAS7: 0), boa (UAS7: 1-6), parcial (UAS7: 7-15) ou ausente (UAS7 > 16), como proposto por Arnau42. Ainda após a descontinuidade do tratamento, uma parte dos pacientes apresenta recidiva. que no estudo OPTIMA ocorreu em 50%43. Determinar biomarcadores dos perfis de resposta inicial e recidiva é necessário na discussão na indicação do tratamento com o paciente e alinhamento das expectativas44 (Figura 3).

Figura 3
Biomarcadores de resposta ao omalizumabe
TSA = teste do soro autólogo, TLHB = teste de liberação de histamina dos basófilos, FceRI = receptor de alta afinidade para IgE, PCR = proteína C-reativa, IL-31 = interleucina 31, UAS7 = Urticaria Activity Score 7.
Níveis séricos baixos de IgE total foram associados a pior resposta terapêutica ao omalizumabe. Straesser e cols. avaliaram os níveis séricos de IgE de pacientes com UCE de acordo com quatro quartis. Verificou-se que a razão de chance para resposta ao omalizumabe foi de 13,8 para aqueles com níveis séricos de IgE no 75º percentil (> 168,0 UI/mL) do que para aqueles no 25º percentil (< 15,2 UI/mL, p < 0,001)5. Dados semelhantes foram relatados por Marzano e cols. em estudo com 470 pacientes, onde foram encontrados níveis médios de IgE total de 131,6 KUA/l entre os respondedores, e de 42,1 KUA/l entre os não respondedores (p < 0,0001)46.
Níveis de IgE total basal acima de 43,0 UI/mL e aumento de duas vezes ou mais na quarta semana de tratamento com omalizumabe foram correlacionados com a melhora da UCE na décima segunda semana de tratamento47. Além disso, os níveis basais IgE total parecem correlacionar-se com o tempo de recidiva de UCE após a descontinuação do tratamento com omalizumabe. Quanto mais altos os níveis de IgE, menor o tempo necessário para recidiva dos sintomas da UCE após a suspensão do omalizumabe48. Cugno e cols. demonstraram que não apenas a IgE, mas também os níveis basais de D-dímero, são mais altos nos respondedores do que nos não respondedores ao omalizumabe na UCE49. Em relação ao D-dímero, esse achado não foi encontrado por Marzano e cols.46. Asero e cols. avaliaram os níveis de D-dímero antes e três semanas após a aplicação de omalizumabe e não observaram diferença entre respondedores e não respondedores em relação ao D-dímero basal. Entretanto, entre os respondedores houve queda significativa na segunda dosagem, indicando que o D-dímero pode ser um bom marcador de efetividade50. Outros marcadores, como a queda dos níveis de IL-31 e PCR e aumento dos níveis de basófilos, também foram apontados como marcadores de efetividade38,51. A IL-31 é produzida principalmente por linfócitos Th2 ativados e mastócitos da pele, desempenha um papel importante na indução de inflamação crônica da pele, principalmente do prurido. Foram encontrados níveis elevados em paciente com UCE, porém, sem relação com a gravidade51.
Marcadores de autoimunidade do tipo IIb como TSA, teste de liberação de histamina de basófilos (TLHB) e teste de ativação de basófilos (BAT) positivos e basopenia têm sido relacionados à ausência de resposta ou resposta tardia ao omalizumabe52.
TSA e TLHB são utilizados no diagnóstico da UC autoimune e avaliam a presença de fatores autorreativos no soro e a funcionalidade dos autoanticorpos, respectivamente. A positividade de ambos foi associada à resposta lenta ao omalizumabe, mas a evidência ainda é inconsistente. No estudo de Gericke, a análise do perfil de respondedores ao omalizumabe mostrou que a maioria dos pacientes TLHB-positivos respondeu apenas após a segunda injeção, com um tempo médio de resposta de 29 dias, enquanto os pacientes TLHB-negativos tiveram um tempo médio de resposta de 2 dias. Apenas 1 dos 39 respondedores rápidos tinha TLHB positivo, enquanto 8 dos 17 respondedores lentos foram positivos para TLHB (p < 0,0001). Em relação ao TSA, 12 dos 33 respondedores rápidos e 10 dos 13 lentos mostraram um resultado positivo (p < 0,012)53.
Outro marcador que tem sido alvo de vários estudos é a expressão de FceRI em basófilos. Deza e cols. descreveram que os níveis de expressão de FceRI em basófilos antes do tratamento com omalizumabe eram significativamente maiores em respondedores do que em não respondedores. Demonstraram também que, após o início do omalizumabe, haveria uma redução significativa de quase 90% na expressão de basófilos FceRI cerca de 1 mês após a primeira dose, com a redução sendo menor em não respondedores do que em respondedores, assim como a velocidade de resposta que apresentava mesmo perfil de resposta54,55.
A expressão de alguns receptores de superfície dos basófilos tem sido relacionada à gravidade da doença. Ye e cols. evidenciaram que a expressão de basófilo CD203c foi mais alta nos pacientes com UCE grave, sugerindo que a quantificação da ativação de basófilos detectados por citometria de fluxo a expressão de CD203c pode ser usada como preditor potencial de gravidade da UCE29. Também estudada como marcador de resposta ao omalizumabe e de atividade da doença, a regulação positiva do CD203c estava presente em 18/41 indivíduos (43,9%), tendo o omalizumabe se mostrado eficaz em 29/41 (71%) dos pacientes com UC. Dos 18 indivíduos que demonstraram atividade de regulação positiva de CD203c, apenas 9 (50%) tiveram melhora clínica com omalizumabe. Entretanto, dos 23 sem atividade de regulação positiva, 20 (87%) tiveram uma resposta clínica satisfatória (p = 0,02). Portanto, ter um resultado negativo na expressão destes marcadores prediz uma probabilidade maior de responder ao omalizumabe56.
O UAS7 é uma ferramenta que avalia a atividade da doença por 7 dias, e é utilizada para avaliação da gravidade da doença na vida prática e em estudos clínicos e também na avaliação de resposta ao tratamento. Em estudo que o avaliou como preditor de recaída após a suspensão do omalizumabe, foi demonstrado que pacientes com UAS7 inicial alto e resposta tardia apresentam recidiva rápida57 (Figura 3).
Resposta à ciclosporina
Quando o paciente não é responsivo ao tratamento com omalizumabe, o tratamento indicado é a ciclosporina, um imunossupressor que tem efeito moderado na inibição da liberação dos mediadores dos mastócitos. Em contraste com outras drogas imunossupressoras com ação citotóxica, não suprime a medula óssea e não apresenta risco conhecido de teratogenicidade em humanos. Sua eficácia em combinação com anti-histamínico H1 de 2ª geração foi demonstrada em ensaios clínicos, mas seu uso está na terceira linha devido a uma maior incidência de efeitos adversos, que, no entanto, são menores do que no uso em longo prazo de corticosteroides10.
De acordo com uma revisão sistemática, há forte evidência de que o TLHB, assim como a presença de baixos níveis de IgE total, sejam preditores de uma boa resposta à ciclosporina32. Em um ensaio clínico randomizado, Grattan e cols. demonstraram positividade do TLHB basal em 72% dos respondedores à ciclosporina em comparação com 11% dos não respondedores58. Em outros dois estudos, foi mostrado que a positividade do TLHB é um preditor de remissão pelo tratamento com ciclosporina59,60, entretanto o TSA parece não ser um bom biomarcador58.
Níveis de IgE sérico foram significativamente mais baixos em respondedores à ciclosporina (43,0 UI/mL) quando comparados aos não respondedores (148,5 UI/mL), p < 0,001, com correlação negativa com a diminuição do UAS7 aos 3 meses de tratamento61. Endo e cols. demonstraram que níveis baixos de IgE total basal foram associados a UAS7 baixo após o tratamento com ciclosporina62.
Asero demonstrou que os níveis de D-dímero mostraram alta correlação negativa significativa com a resposta à ciclosporina (p < 0,017); com 10 de 11 (91%) pacientes com níveis plasmáticos normais de D-dímero versus 7 de 18 (39%) pacientes com níveis plasmáticos elevados de D-dímero com resposta completamente bem-sucedida ao tratamento63.
Fica claro que a UC é uma doença heterogênea com diversos fenótipos, características clínicas possíveis, fatores associados e diferente evolução clínica, como também diferentes graus de resposta às terapias administradas. É de grande relevância identificar os biomarcadores capazes de classificar os pacientes de acordo com seu fenótipo, possivelmente identificando mecanismos imunológicos subjacentes para estratificar os pacientes de acordo com sua gravidade e prognóstico, e para identificar os melhores respondedores a qualquer terapia, particularmente a produtos biológicos. Destacamos a importância do uso de biomarcadores acessíveis na prática clínica como PCR, D-dímero, anti-TPO, IgE total e UAS7. No entanto, são necessários mais estudos prospectivos para confirmar esses preditores e identificar outros.
Referências
1. Zuberbier T, Abdul Latiff AH, Abuzakouk M, Aquilina S, Asero R, Baker D, et al. The international EAACI/GA2LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022;77(3):734-66.
2. Junior SDD, Azizi GG, Sousa ACM, Lupi O, França AT, Valle SOR. Urticárias crônicas induzidas: atualização do tema. Arq Asma Alerg Imunol. 2020;4(3):305-16.
3. Kolkhir P, André F, Church MK, Maurer M, Metz M. Potential blood biomarkers in chronic spontaneous urticaria. Clin Exp Allergy. 2017 Jan;47(1):19-36.
4. Puxeddu I, Petrelli F, Angelotti F, Croia C, Migliorini P. Biomarkers In Chronic Spontaneous Urticaria: Current Targets And Clinical Implications. J Asthma Allergy. 2019 Sep 20;12:285-95.
5. Ensina LF, Cusato-Ensina AP, Cardona R. Advances in the pathogenesis representing definite outcomes in chronic urticaria. Curr Opin Allergy Clin Immunol. 2019;19(3):193-7.
6. Sánchez-Borges M, Ansotegui IJ, Baiardini I, Bernstein J, Canonica GW, Ebisawa M, et al. The challenges of chronic urticaria part 1: Epidemiology, immunopathogenesis, comorbidities, quality of life, and management. World Allergy Organ J. 2021 Jun 1;14(6):100533.
7. Kolkhir P, Altrichter S, Hawro T, Maurer M. C-reactive protein is linked to disease activity, impact, and response to treatment in patients with chronic spontaneous urticaria. Allergy. 2018 Apr;73(4):940-8.
8. Asero R, Tedeschi A, Marzano AV, Cugno M. Chronic urticaria: a focus on pathogenesis. F1000Res. 2017 Jul 11; 6:1095.
9. Wang D, Tang H, Shen Y, Wang F, Lin J, Xu J. Activation of the Blood Coagulation System in Patients with Chronic Spontaneous Urticaria. Clin Lab. 2015;61(9):1283-8.
10. Asero R, Tedeschi A, Coppola R, Griffini S, Paparella P, Riboldi P, et al. Activation of the tissue factor pathway of blood coagulation in patients with chronic urticaria. J Allergy Clin Immunol. 2007 Mar;119(3):705-10.
11. Takahagi S, Mihara S, Iwamoto K, Morioke S, Okabe T, Kameyoshi Y, et al. Coagulation/fibrinolysis and inflammation markers are associated with disease activity in patients with chronic urticaria. Allergy. 2010 May;65(5):649-56.
12. Obtułowicz A, Migacz-Gruszka K, Pirowska M, Basta-Klonowska K, Wojas-Pelc A. Participation of the coagulation system and fibrinolysis as well as selected biomarkers in pathogenesis of chronic urticaria with various activity degree. Postepy Dermatol Alergol. 2020 Aug;37(4):608-12.
13. Baek YS, Jeon J, Kim JH, Oh CH. Severity of acute and chronic urticaria correlates with D-dimer level, but not C-reactive protein or total IgE. Clin Exp Dermatol. 2014 Oct;39(7):795-800.
14. Farres MN, Refaat M, Melek NA, Ahmed EE, Shamseldine MG, Arafa NA. Activation of coagulation in chronic urticaria in relation to disease severity and activity. Allergol Immunopathol (Madr). 2015 Mar-Apr;43(2):162-7.
15. Criado RF, Bensi CG, Criado PR, Henriques MT, de Espindola BAR, Machado Filho CD. Evaluation of serum levels of C-reactive protein, D-Dimer and Autologous Serum Skin Test in patients with Chronic Spontaneous Urticaria in a Brazilian tertiary center: a cross-sectional study. An Bras Dermatol. 2021 Mar-Apr;96(2):148-54.
16. Harrison M. Erythrocyte sedimentation rate and C-reactive protein. Aust Prescr. 2015 Jun;38(3):93-4.
17. Kasperska-Zajac A, Grzanka A, Machura E, Misiolek M, Mazur B, Jochem J. Increased serum complement C3 and C4 concentrations and their relation to severity of chronic spontaneous urticaria and CRP concentration. J Inflamm (Lond). 2013 May 24;10(1):22.
18. Kasperska-Zajac A, Sztylc J, Machura E, Jop G. Plasma IL-6 concentration correlates with clinical disease activity and serum C-reactive protein concentration in chronic urticaria patients. Clin Exp Allergy. 2011 Oct;41(10):1386-91.
19. Grzanka A, Damasiewicz-Bodzek A, Kasperska-Zajac A. The relationship between circulating concentrations of interleukin 17 and C reactive protein in chronic spontaneous urticaria. Allergy Asthma Clin Immunol. 2017 May 10; 13:25.
20. Aleem S, Masood Q, Hassan I. Correlation of C-reactive protein levels with severity of chronic urticaria. Indian J Dermatol. 2014 Nov;59(6):636. doi: 10.4103/0019-5154.143607.
21. Magen E, Mishal J, Zeldin Y, Feldman V, Kidon M, Schlesinger M, et al. Increased mean platelet volume and C-reactive protein levels in patients with chronic urticaria with a positive autologous serum skin test. Am J Med Sci. 2010 Jun;339(6):504-8.
22. Kasperska-Zajac A, Grzanka A, Damasiewicz-Bodzek A. IL-6 Transsignaling in Patients with Chronic Spontaneous Urticaria. PLoS One. 2015 Dec 23;10(12):e0145751.
23. Ucmak D, Akkurt M, Toprak G, Yesilova Y, Turan E, Yıldız I. Determination of dermatology life quality index, and serum C-reactive protein and plasma interleukin-6 levels in patients with chronic urticaria. Postepy Dermatol Alergol. 2013 Jun;30(3):146-51.
24. Rasool R, Ashiq I, Shera IA, Yousuf Q, Shah ZA. Study of serum interleukin (IL) 18 and IL-6 levels in relation with the clinical disease severity in chronic idiopathic urticaria patients of Kashmir (North India). Asia Pac Allergy. 2014 Oct;4(4):206-11.
25. Konstantinou GN, Asero R, Ferrer M, Knol EF, Maurer M, Raap U, et al. EAACI taskforce position paper: evidence for autoimmune urticaria and proposal for defining diagnostic criteria. Allergy. 2013 Jan;68(1):27-36.
26. Deza G, Ricketti PA, Giménez-Arnau AM, Casale TB. Emerging Biomarkers and Therapeutic Pipelines for Chronic Spontaneous Urticaria. J Allergy Clin Immunol Pract. 2018 Jul-Aug;6(4):1108-17.
27. Ye YM, Park JW, Kim SH, Ban GY, Kim JH, Shin YS, et al. PRANA Group. Prognostic Factors for Chronic Spontaneous Urticaria: A 6-Month Prospective Observational Study. Allergy Asthma Immunol Res. 2016 Mar;8(2):115-23.
28. Rabelo-Filardi R, Daltro-Oliveira R, Campos RA. Parameters associated with chronic spontaneous urticaria duration and severity: a systematic review. Int Arch Allergy Immunol. 2013;161(3):197-204.
29. Ye YM, Yang EM, Yoo HS, Shin YS, Kim SH, Park HS. Increased level of basophil CD203c expression predicts severe chronic urticaria. J Korean Med Sci. 2014 Jan;29(1):43-7. doi: 10.3346/jkms.2014.29.1.43.
30. Chanprapaph K, Iamsumang W, Wattanakrai P, Vachiramon V. Thyroid Autoimmunity and Autoimmunity in Chronic Spontaneous Urticaria Linked to Disease Severity, Therapeutic Response, and Time to Remission in Patients with Chronic Spontaneous Urticaria. Biomed Res Int. 2018 Nov 1; 2018: 9856843.
31. Toubi E, Kessel A, Avshovich N, Bamberger E, Sabo E, Nusem D, et al. Clinical and laboratory parameters in predicting chronic urticaria duration: a prospective study of 139 patients. Allergy. 2004 Aug;59(8):869-73.
32. Fok JS, Kolkhir P, Church MK, Maurer M. Predictors of treatment response in chronic spontaneous urticaria. Allergy. 2021 Oct;76(10):2965-81.
33. Sánchez Borges M, Tassinari S, Flores A. Características epidemiológicas en pacientes con urticaria crónica espontánea resistente al tratamiento con antihistamínicos [Epidemiologic features in patients with antihistamine-resistant chronic urticaria]. Rev Alerg Mex. 2015 Oct-Dec;62(4):279-86. Spanish.
34. Lee HC, Hong JB, Chu CY. Chronic idiopathic urticaria in Taiwan: a clinical study of demographics, aggravating factors, laboratory findings, serum autoreactivity and treatment response. J Formos Med Assoc. 2011 Mar;110(3):175-82.
35. Curto-Barredo L, Archilla LR, Vives GR, Pujol RM, Giménez-Arnau AM. Clinical Features of Chronic Spontaneous Urticaria that Predict Disease Prognosis and Refractoriness to Standard Treatment. Acta Derm Venereol. 2018 Jul 11;98(7):641-7.
36. Magen E, Mishal J, Zeldin Y, Schlesinger M. Clinical and laboratory features of antihistamine-resistant chronic idiopathic urticaria. Allergy Asthma Proc. 2011 Nov-Dec;32(6):460-6.
37. Kolkhir P, Pogorelov D, Olisova O. CRP, D-dimer, fibrinogen and ESR as predictive markers of response to standard doses of levocetirizine in patients with chronic spontaneous urticaria. Eur Ann Allergy Clin Immunol. 2017 Jul;49(4):189-92.
38. de Montjoye L, Darrigade AS, Giménez-Arnau A, Herman A, Dumoutier L, Baeck M. Correlations between disease activity, autoimmunity and biological parameters in patients with chronic spontaneous urticaria. Eur Ann Allergy Clin Immunol. 2021 Mar;53(2):55-66.
39. Asero R. D-dimer: a biomarker for antihistamine-resistant chronic urticaria. J Allergy Clin Immunol. 2013 Oct;132(4):983-6.
40. Staubach P, Onnen K, Vonend A, Metz M, Siebenhaar F, Tschentscher I, et al. Autologous whole blood injections to patients with chronic urticaria and a positive autologous serum skin test: a placebo-controlled trial. Dermatology. 2006;212(2):150-9.
41. Bélot V, Desbois I, Martin L, Valat C, Lorette G, Machet L. Evaluation de l'utilité du test au sérum autologue dans l'urticaire chronique idiopathique: étude rétrospective chez 74 patients [Assessment of the usefulness of autologous serum skin testing in chronic urticaria: a retrospective single-centre study of 74 patients]. Ann Dermatol Venereol. 2010 Jun-Jul;137(6-7):444-50. French.
42. Giménez Arnau AM, Valero Santiago A, Bartra Tomás J, Jáuregui Presa I, Labrador Horrillo M, Miquel Miquel FJ, et al. Therapeutic Strategy According to Differences in Response to Omalizumab in Patients With Chronic Spontaneous Urticaria. J Investig Allergol Clin Immunol. 2019;29(5):338-48.
43. Sussman G, Hébert J, Gulliver W, Lynde C, Yang WH, Papp K, et al. Omalizumab Re-Treatment and Step-Up in Patients with Chronic Spontaneous Urticaria: OPTIMA Trial. J Allergy Clin Immunol Pract. 2020 Jul-Aug;8(7):2372-8.e5.
44. Folci M, Heffler E, Canonica GW, Furlan R, Brunetta E. Cutting Edge: Biomarkers for Chronic Spontaneous Urticaria. J Immunol Res. 2018 Nov 21;2018:5615109.
45. Straesser MD, Oliver E, Palacios T, Kyin T, Patrie J, Borish L, et all. Serum IgE as an immunological marker to predict response to omalizumab treatment in symptomatic chronic urticaria. J Allergy Clin Immunol Pract. 2018 Jul-Aug;6(4):1386-1388.e1.
46. Marzano AV, Genovese G, Casazza G, Fierro MT, Dapavo P, Crimi N, et al. Predictors of response to omalizumab and relapse in chronic spontaneous urticaria: a study of 470 patients. J Eur Acad Dermatol Venereol. 2019 May;33(5):918-24.
47. Ertas R, Ozyurt K, Atasoy M, Hawro T, Maurer M. The clinical response to omalizumab in chronic spontaneous urticaria patients is linked to and predicted by IgE levels and their change. Allergy. 2018 Mar;73(3):705-12.
48. Ertas R, Ozyurt K, Ozlu E, Ulas Y, Avci A, Atasoy M, et al. Increased IgE levels are linked to faster relapse in patients with omalizumab-discontinued chronic spontaneous urticaria. J Allergy Clin Immunol. 2017 Dec;140(6):1749-51.
49. Cugno M, Genovese G, Ferrucci S, Casazza G, Asero R, Marzano AV. IgE and D-dimer baseline levels are higher in responders than nonresponders to omalizumab in chronic spontaneous urticaria. Br J Dermatol. 2018 Sep;179(3):776-7.
50. Asero R, Marzano AV, Ferrucci S, Cugno M. D-Dimer Plasma Levels Parallel the Clinical Response to Omalizumab in Patients with Severe Chronic Spontaneous Urticaria. Int Arch Allergy Immunol. 2017;172(1):40-4.
51. Altrichter S, Hawro T, Hänel K, Czaja K, Lüscher B, Maurer M, et al. Successful omalizumab treatment in chronic spontaneous urticaria is associated with lowering of serum IL-31 levels. J Eur Acad Dermatol Venereol. 2016 Mar;30(3):454-5.
52. Asero R, Cugno M. Biomarkers of chronic spontaneous urticaria and their clinical implications. Expert Rev Clin Immunol. 2021 Mar;17(3):247-54.
53. Gericke J, Metz M, Ohanyan T, Weller K, Altrichter S, Skov PS, et al. Serum autoreactivity predicts time to response to omalizumab therapy in chronic spontaneous urticaria. J Allergy Clin Immunol. 2017 Mar;139(3):1059-61.e1.
54. Deza G, Bertolín-Colilla M, Sánchez S, Soto D, Pujol RM, Gimeno R, et al. Basophil FceRI expression is linked to time to omalizumab response in chronic spontaneous urticaria. J Allergy Clin Immunol. 2018 Jun;141(6):2313-6.e1.
55. Deza G, Bertolín-Colilla M, Pujol RM, Curto-Barredo L, Soto D, García M, et al. Basophil FceRI Expression in Chronic Spontaneous Urticaria: A Potential Immunological Predictor of Response to Omalizumab Therapy. Acta Derm Venereol. 2017 Jun 9;97(6):698-704.
56. Palacios T, Stillman L, Borish L, Lawrence M. Lack of basophil CD203c-upregulating activity as an immunological marker to predict response to treatment with omalizumab in patients with symptomatic chronic urticaria. J Allergy Clin Immunol Pract. 2016 May-Jun;4(3):529-30.
57. Ferrer M, Giménez-Arnau A, Saldana D, Janssens N, Balp MM, Khalil S, et al. Predicting Chronic Spontaneous Urticaria Symptom Return After Omalizumab Treatment Discontinuation: Exploratory Analysis. J Allergy Clin Immunol Pract. 2018 Jul-Aug;6(4):1191-1197.e5. doi: 10.1016/j.jaip.2018.04.003. Epub 2018 Apr 12. Erratum in: J Allergy Clin Immunol Pract. 2018 Sep-Oct;6(5):1810.
58. Grattan CE, O'Donnell BF, Francis DM, Niimi N, Barlow RJ, Seed PT, et al. Randomized double-blind study of cyclosporine in chronic 'idiopathic' urticaria. Br J Dermatol. 2000 Aug;143(2):365-72.
59. Hollander SM, Joo SS, Wedner HJ. Factors that predict the success of cyclosporine treatment for chronic urticaria. Ann Allergy Asthma Immunol. 2011 Dec;107(6):523-8.
60. Iqbal K, Bhargava K, Skov PS, Falkencrone S, Grattan CE. A positive serum basophil histamine release assay is a marker for cyclosporine-responsiveness in patients with chronic spontaneous urticaria. Clin Transl Allergy. 2012 Oct 1;2(1):19.
61. Santiago L, Ferreira B, Ramos L, Gonçalo M. IgE levels are negatively correlated with clinical response to cyclosporine in chronic spontaneous urticaria. Br J Dermatol. 2019 Jan;180(1):199-200.
62. Endo T, Toyoshima S, Kanegae K, Izaki S, Nishimori N, Ito M, et al. Identification of biomarkers for predicting the response to cyclosporine A therapy in patients with chronic spontaneous urticaria. Allergol Int. 2019 Apr;68(2):270-3.
63. Asero R. Plasma D-dimer levels and clinical response to cyclosporine in severe chronic spontaneous urticaria. J Allergy Clin Immunol. 2015 May;135(5):1401-3.



