Número Atual: Julho-Setembro 2022 - Volume 6 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Reações adversas aos anticorpos monoclonais para doenças alérgicas
Adverse reactions to monoclonal antibodies in allergic diseases
Sérgio Duarte Dortas-Junior1,2; Aldo José Fernandes Costa3; Marta de Fátima Rodrigues da Cunha Guidacci4; Filipe W. Sarinho5,6; Faradiba Sarquis Serpa7; Eduardo Costa Silva8,9; João Negreiros Tebyriça10; Nelson Augusto Rosario-Filho11; Norma de Paula M. Rubini10; Régis de Albuquerque Campos12
DOI: 10.5935/2526-5393.20220036
1. Hospital Universitário Clementino Fraga Filho, Serviço de Imunologia - Rio de Janeiro, RJ, Brasil
2. Faculdade de Medicina de Petrópolis - UNIFASE - Petrópolis, RJ, Brasil
3. Hospital Helena Moura - Recife, PE, Brasil
4. Hospital de Base do Distrito Federal - Brasília, DF, Brasil
5. Centro de Pesquisas em Alergia e Imunologia HC-UFPE - Recife, PE, Brasil
6. Faculdade de Medicina de Olinda - Olinda, PE, Brasil
7. Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória - Vitória, ES, Brasil
8. Universidade do Estado do Rio de Janeiro - Rio de Janeiro, RJ, Brasil
9. Instituto UNIMED-Rio - Rio de Janeiro, RJ, Brasil
10. Universidade Federal do Estado do Rio de Janeiro (UNIRIO), Escola de Medicina e Cirurgia - Rio de Janeiro, RJ, Brasil
11. Universidade Federal do Paraná (UFPR), Serviço de Alergia e Imunologia Pediátrica - Curitiba, PR, Brasil
12. Universidade Federal da Bahia, Faculdade de Medicina, Departamento de Medicina Interna e Apoio Diagnóstico, PPG em Ciências da Saúde - Salvador, BA, Brasil
Endereço para correspondência:
Sérgio Duarte Dortas-Junior
E-mail: sdortasjr@gmail.com
Submetido em: 26/04/2022
Aceito em: 18/06/2022
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
A utilização de agentes imunobiológicos em alergia e imunologia tem sido cada vez mais frequente nos últimos anos, emergindo como potencialmente eficazes para o tratamento de doenças alérgicas e de hipersensibilidade. O uso de imunobiológicos em doenças alérgicas está recomendado nas formas graves onde a eficácia, segurança e custo-efetividade estão comprovados. O objetivo deste artigo é sintetizar os efeitos adversos mais comuns ou significativos, incluindo as reações de hipersensibilidade aos principais anticorpos monoclonais aprovados para o tratamento de doenças alérgicas licenciados e comercializados no Brasil até o momento.
Descritores: Anticorpos monoclonais, asma, efeitos colaterais e reações adversas relacionados a medicamentos, dermatite atópica, urticária.
INTRODUÇÃO
A utilização de agentes imunobiológicos em alergia e imunologia tem sido cada vez mais frequente nos últimos anos, emergindo como potencialmente eficazes para o tratamento de doenças alérgicas e de hipersensibilidade1. No Brasil, os principais imunobiológicos empregados na prática clínica do alergista e imunologista são as imunoglobulinas humanas policlonais (endovenosa e subcutânea), utilizadas na terapia de reposição dos erros inatos da imunidade ou em doenças autoimunes e inflamatórias, e os anticorpos monoclonais. O uso de anticorpos monoclonais é mais recente, e a perspectiva é de ampliação da sua utilização nos próximos anos em função da disponibilização para o tratamento da asma no Sistema Único de Saúde (SUS), e da inclusão no Rol de Procedimentos da Agência Nacional de Saúde (ANS). Quatro principais classes de anticorpos monoclonais estão aprovadas até o momento para uso em doenças alérgicas: anti-IgE (omalizumabe), anti-IL-5 (mepolizumabe), anti-IL-5R (benralizumabe) e anti-IL-4R/IL-13R (dupilumabe)1.
O uso de imunobiológicos em doenças alérgicas está recomendado nas formas graves, onde a eficácia, segurança e custo-efetividade estão comprovadas. Cerca de 30% dos pacientes com asma grave depende de altas doses de corticosteroide inalatório e uso frequente de beta-2 agonistas, muitas vezes com cursos frequentes ou uso contínuo de corticosteroides orais para manter o controle da asma, apesar dos efeitos colaterais consequentes2.
Devido ao impacto da asma grave, essa condição foi a primeira doença de natureza alérgica a ter disponível um medicamento imunobiológico, e atualmente é a condição com maior número de opções de terapia biológica3,4. Posteriormente, outras condições como urticária, dermatite atópica e rinossinusite crônica com pólipo nasal passaram a ter essa classe de medicamentos no seu arsenal terapêutico4,5.
O objetivo deste artigo é sintetizar os efeitos adversos mais comuns ou significativos, incluindo as reações de hipersensibilidade aos principais anticorpos monoclonais aprovados para o tratamento de doenças alérgicas licenciados e comercializados no Brasil até o momento1.
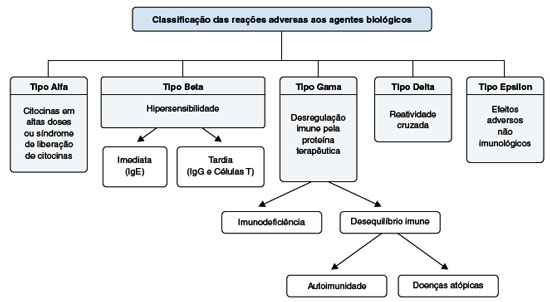
CLASSIFICAÇÃO DAS REAÇÕES ADVERSAS AOS AGENTES BIOLÓGICOS
Os imunobiológicos apresentam diferenças em relação aos fármacos tradicionais em termos de estrutura química, modo de ação, metabolismo e imunorreagenicidade. Esses fármacos são proteínas complexas obtidas a partir de culturas de bactérias, fungos, insetos, plantas ou células de mamíferos, por meio de técnicas de engenharia genética. Os eventos adversos induzidos pelos xenobióticos (fármacos tradicionais) são principalmente relacionados aos efeitos farmacológicos, enquanto os efeitos adversos dos agentes imunobiológicos estão frequentemente relacionados ao alvo e consequências biológicas de suas ações6.
Considerando essas diferenças, Pichler propôs uma classificação especial para as reações adversas aos imunobiológicos (Figura 1). As reações adversas aos agentes imunobiológicos são classificadas em cinco grupos: (1) Tipo alfa - induzidas pela liberação de citocinas, cujas as principais manifestações são febre, astenia, artralgia, cefaleia, mialgia, sintomas gastrintestinais e erupção cutânea mimetizando síndrome de Sweet; (2) Tipo beta - envolvendo reações de hipersensibilidade imediatas e tardias relacionadas à imunogenicidade dos imunobiológicos, mais frequentes com os anticorpos quiméricos, mas que também pode ocorrer com os anticorpos humanizados e totalmente humanos através de anticorpos anti-idiotipo; (3) Tipo gama - estão relacionadas à desregulação imunológica, incluindo imunossupressão e autoimunidade; (4) Tipo delta - são decorrentes da coexpressão do antígeno alvo em células do processo patológico e em células de tecidos normais; (5) Tipo épsilon - estão relacionadas a novas e inesperadas funções não imunológicas dos imunobiológicos reveladas no uso em humanos, como por exemplo os distúrbios neuropsiquiátricos associados ao Interferon-alfa e complicações cardíacas dos agentes anti-TNF-alfa7.
OMALIZUMABE
Omalizumabe foi o primeiro imunobiológico aprovado para o tratamento da asma alérgica moderada a grave, com níveis de IgE total entre 30-1.500 IU/mL e sensibilização IgE específica a aeroalérgenos. Inicialmente foi aprovado para pacientes com idade acima de 12 anos e, posteriormente, para crianças a partir dos 6 anos. É um anticorpo monoclonal humanizado recombinante (mAbe) que tem como alvo a IgE sérica livre, consequentemente, impede sua ligação aos mastócitos e basófilos e a liberação de mediadores inflamatórios. Por fim, este mecanismo leva à regulação negativa de receptores de alta afinidade para IgE (FceRI) nessas células e inibição da reação alérgica. Posteriormente, o omalizumabe foi aprovado para o uso em pacientes com diagnóstico de urticária crônica espontânea (UCE) com idade acima de 12 anos e, mais recentemente, foi aprovado para o tratamento da polipose nasal grave em pacientes com mais de 18 anos de idade, com níveis de IgE total entre 30-1.500 IU/mL, independente da presença de sensibilização para aeroalérgenos8.
As reações adversas mais frequentemente relatadas foram reação no local da injeção em 45%, infecção respiratória em 20%, sinusite em 16%, dor de cabeça em 15%, e faringite em 11%9.
Dados de 35 estudos de fase 1 a 3 mostraram um aumento aparente em malignidades em usuários de omalizumabe (0,5% vs. 0,2% nos controles)10. A maior parte eram tumores sólidos, exceto por um caso de linfoma não Hodgkin recorrente. Dos 25 casos de malignidade, quatro pareciam estar presentes antes do início do omalizumabe, e todos, exceto por um caso (carcinoma basocelular), foram diagnosticados nos primeiros dois anos de uso do biológico. Uma avaliação subsequente, em 2012, de 32 ensaios clínicos não mostrou nenhuma associação entre omalizumabe e o risco de malignidade, o que foi confirmado posteriormente pelo estudo EXCELS (Evaluating Clinical Effectiveness and Long-term Safety in Patients)11.
A literatura existente estima o risco do desenvolvimento de anafilaxia devido ao omalizumabe como 0,09%, a maioria (77%) durante as primeiras 2 horas após a administração das 3 primeiras doses12. A confirmação pode ser realizada a partir de testes cutâneos com o medicamento diluído em solução salina e, se negativo, teste intradérmico com concentração de 1: 100.000 (ou 1,2 µg/mL) pode ser realizado para avaliação de hipersensibilidade13. Raramente, a dessensibilização pode ser necessária14. Outra possibilidade é a sensibilização a outras substâncias que compõem o medicamento, como o polissorbato usado para aumentar a solubilidade da droga15. Alguns autores sugeriram que anticorpos contra omalizumabe preexistentes ou recentemente desenvolvidos poderiam ser responsáveis pelas reações. Entretanto, no estudo de farmacovigilância pós-comercialização usando um novo método para detectar anticorpos IgE para omalizumabe não mostrou correlação aparente entre anafilaxia ou reatividade no teste cutâneo ou a presença de anticorpos do isotipo IgE para omalizumabe16.
Estudos clínicos, assim como estudos da vida real na área da população pediátrica, mostraram perfil de segurança geral aceitável. As reações adversas mais frequentes foram nasofaringite, dor de cabeça, febre, dor em abdome superior, faringite estreptocócica, otite média, gastroenterite viral, picadas por artrópode e epistaxe. Uma metanálise previamente publicada de três estudos controlados randomizados indicou que a frequência de eventos adversos foi semelhante entre omalizumabe (76,3%) e placebo (74,2%), assim como a frequência de eventos adversos graves (5,2 e 5,6%, respectivamente). Não houve evidência de um aumento do risco de anafilaxia, urticária, reações de hipersensibilidade ou doenças malignas16,17.
Um ensaio clínico de omalizumabe para urticária crônica espontânea incluiu mais de 1.000 pacientes e não observou nenhuma morte ou eventos adversos graves significativos relacionados ao medicamento. Os eventos adversos mais comuns após a administração subcutânea foram reações no local da injeção, seguido por infecções do trato respiratório superior e dores de cabeça18.
Em 2018, uma metanálise de 67 estudos de vida real, sobre a eficácia de omalizumabe, descreveu uma média geral de 4% (1-7%) de eventos adversos contra 2,9-8% nos ensaios clínicos19.
Nos estudos replicados, POLYP1 e POLYP2, para o uso de omalizumabe em rinossinusite crônica com pólipo nasal (RSCcPN), 50,4% dos pacientes apresentou pelo menos um evento adverso. A maioria dos eventos em ambos os estudos foi de leve a moderada intensidade, sendo os mais comuns a cefaleia, nasofaringite e reação no local da injeção. Três casos graves foram relatados em pacientes em uso de omalizumabe (2,2% [um caso de picada de cobra, uma fratura de mão e um caso de exacerbação/agravamento da asma])20.
MEPOLIZUMABE
Mepolizumabe é um anticorpo monoclonal IgG1 humanizado que se liga diretamente à IL5. Desta maneira, evita a ligação desta citocina à cadeia alfa do receptor de IL-5 em eosinófilos e basófilos, levando à redução do número de eosinófilos e, consequentemente, da inflamação eosinofílica nas vias respiratórias21. Está aprovado para o tratamento da asma grave de crianças a partir dos 6 anos de idade (40 mg/4 semanas), de adolescentes (≥ 12 anos) e de adultos (100 mg/4 semanas)22.
As reações adversas associadas ao uso do mepolizumabe descritas nos estudos pivotais foram cefaleia em 29%, piora da asma em 27%, bronquite em 21%, e reação no local da injeção em 12%. Dois indivíduos desenvolveram Herpes zoster grave, e por esse motivo a US Food & Drug Administration recomenda a vacinação de pacientes acima de 50 anos com indicação do uso deste medicamento. Recentemente, Li e cols., em um estudo retrospectivo sobre anafilaxia por imunobiológicos utilizados para a resposta tipo 2, identificaram 102 casos causados por mepolizumabe. Sessenta e nove pacientes receberam mepolizumabe para tratamento de asma grave, 1 para pneumonia eosinofílica crônica, e em 32 com indicação desconhecida. Destes, 2 (2%) evoluíram para óbito, e 31 (30%) necessitaram de hospitalização21,23-25.
O mepolizumabe mostrou ser bem tolerado na faixa etária pediátrica. No entanto, houve um relato de um caso de linfadenite necrotizante histiocítica e outro caso de infecção por varicela após a exposição ao mepolizumabe, ambos em pacientes com 12 anos de idade26,27.
BENRALIZUMABE
Benralizumabe foi o segundo anti-IL-5 aprovado no Brasil para asma eosinofílica grave em pacientes com 18 anos ou mais. É um anticorpo monoclonal humanizado (IgG1κ) que tem como alvo a subunidade alfa do receptor de IL5, resultando em apoptose de eosinófilos e basófilos via citotoxicidade dependente de anticorpos e menor formação dessas células28.
É administrado por via subcutânea em uma dose de 30 mg a cada 4 semanas nas primeiras 3 doses e, posteriormente, a cada 8 semanas21,29.
Nos ensaios clínicos, o percentual de pacientes que tiveram algum evento adverso com benralizumabe foi na faixa de 65%-75%. Os eventos adversos mais comumente relatados foram nasofaringite (12-21%) e piora da asma (11-13%). Reações de hipersensibilidade (anafilaxia, angioedema, urticária) ocorreram em aproximadamente 3% dos indivíduos. Li e cols. encontraram o registro de 63 casos de anafilaxia por benralizumabe, com um risco de hospitalização prolongada maior que para os outros imunobiológicos, com relato de necessidade de internação em 27 (42,86%) pacientes. Para os outros biológicos, a proporção foi as seguinte: omalizumabe (28,92%), mepolizumabe (29,81%) e dupilumabe (40,32%)25,30.
No estudo multicêntrico de extensão de fase 3 foram incluídos pacientes dos estudos pivotais, SIROCCO e CALIMA, que receberam benralizumabe 30 mg a cada 4 ou 8 semanas, além dos que haviam recebido placebo nestes estudos. Estes últimos foram reatribuídos, aleatoriamente, em uma proporção de 1:1, para receber benralizumabe 30 mg a cada 4 ou 8 semanas. Neste estudo de dois anos de avaliação, denominado BORA, os eventos adversos graves mais comuns foram exacerbações da asma (3-4%) e pneumonia (< 1 a 1%)31.
Apesar da preocupação com os riscos de supressão da imunidade anti-helmíntica pelos imunobiológicos com alvo na IL-5, até o momento não há relato de casos que desenvolveram infecções parasitárias durante ou após os ensaios de tais produtos32. Entretanto, consideramos prudente a avaliação para infestação helmíntica em pacientes com indicação de biológicos anti-IL-5.
DUPILUMABE
Dupilumabe é o primeiro agente imunobiológico totalmente humano desenvolvido para doenças alérgicas e tem como alvo o receptor alfa da IL-4, que inibe a sinalização de IL4 e IL-1321. Este anticorpo monoclonal foi aprovado para dermatite atópica (DA) moderada a grave (crianças > 6 anos, adolescentes e adultos), asma grave eosinofílica (≥ 6 anos) e RSCcPN (≥ 18 anos). A dose é variável, dependendo da indicação3.
Em estudo de fase 3, envolvendo 1.902 pacientes asmáticos, incluindo adolescentes e adultos com a duração de 52 semanas, o dupilumabe demonstrou um bom perfil de segurança.
As reações mais comuns, quando comparado com placebo, foram reação no local da injeção (14-18% vs. 6%), dor orofaríngea (2% vs. 1%) e eosinofilia (4,1% vs. 0,6%)34. Outro estudo observou eosinofilia em até 14% vs. 1% com placebo35. A eosinofilia transitória pode atingir ≥ 3.000 células/µL e acredita-se que seja resultante da inibição da migração destas células para os tecidos32,34. Consequências desta hipereosinofilia foram raras: dois pacientes apresentaram pneumonia eosinofílica, além de outros dois com vasculite compatível com poliangeíte com granulomatose eosinofílica30. Atualmente, não existem recomendações sobre o monitoramento da eosinofilia em pacientes em uso de dupilumabe.
O dupilumabe foi avaliado em crianças com asma grave e idade entre 6 e 11 anos. A frequência de eventos adversos durante as 52 semanas de estudo foi semelhante entre os grupos de teste e placebo. Eventos adversos graves foram relatados em 13 pacientes (4,8%) no grupo dupilumabe, e em 6 (4,5%) no grupo placebo. Eosinofilia ocorreu em 5,9% e 0,7% dos pacientes no dupilumabe e placebo, respectivamente. A maioria dos episódios de eosinofilia foi achado laboratorial autolimitado sem quaisquer sintomas associados. A frequência de conjuntivite foi baixa em ambos os grupos; um caso de ceratite foi relatado em cada grupo36.
A patogênese da conjuntivite associada ao dupilumabe ainda não está totalmente elucidada. Uma associação entre distúrbios oculares pré-existentes relacionados à DA pode ser responsável pelo aumento da incidência de conjuntivite em pacientes tratados com dupilumabe, porém não foi identificado nos estudos em outras doenças do tipo 2. Uma possível explicação seria o aumento da expressão de IFNγ, citocina de perfil Th1, a qual causaria disfunção secretória e perda de células caliciformes conjuntivais, agravada pela inibição de IL-13 pelo dupilumabe37.
Outras complicações oculares ocorreram em 1-10% dos pacientes na forma de blefarite, prurido ocular, ceratite e olho seco. Infecção por herpes simplex orofacial também foi relatada em 1-10% dos pacientes. Reações de hipersensibilidade, principalmente urticária generalizada, ocorreram em 0,1-1%. Muito raramente, ocorreu o desenvolvimento de doença do soro (< 0,01%)30.
Quanto à anafilaxia, um estudo publicado recentemente identificou 62 pacientes que apresentaram anafilaxia por dupilumabe, a maior parte em uso para DA (23, 37%) e asma grave (19; 30,6%). Os outros receberam dupilumabe para as seguintes indicações: 2 (3,2%) para Doença Respiratória Exacerbada por Anti-inflamatórios; 1 (1,6%) para RSCcPN; e em 1 (1,6%) a indicação era desconhecida25.
Nos estudos de fase 3 com dupilumabe para RSCcPN, os eventos adversos foram raros. No estudo por 24 semanas, LYBERTY NP SINUS-24, os eventos mais comuns foram a nasofaringite, piora da RSCcPN, cefaleia, agravamento da asma, epistaxe e eritema no local de aplicação. No estudo LYBERTY NP SINUS-52, que avaliou o uso de dupilumabe por 52 semanas, os eventos adversos mais frequentes foram tosse, bronquite, artralgia, overdose acidental e reações no local da injeção38.
Recentemente, uma revisão sistemática foi realizada para avaliar a associação do uso de dupilumabe e o desenvolvimento ou piora de sintomas de psoríase. Vinte e seis estudos com 47 pacientes atenderam aos critérios de inclusão no estudo. Todos os pacientes eram adultos (faixa etária, 24-92 anos) e a maioria (43, 91%) recebeu a prescrição de dupilumabe para DA. Os outros receberam dupilumabe para asma (1); alopecia areata (1) e outras dermatites (2). O intervalo entre o início do dupilumabe até o desenvolvimento/piora da psoríase foi de 3,7 meses. A psoríase levou à descontinuação do dupilumabe em 16 dos 33 pacientes (48%) para os quais a descontinuação versus continuação foi relatada. O mecanismo imunológico exato pelo qual o dupilumabe induz o desenvolvimento de psoríase em certos pacientes permanece desconhecido. Acredita-se que seja devido ao fato dos níveis de IL-4 estarem elevados na DA, e que esta citocina regule negativamente os linfócitos T-helper 1 e T-helper 17, ambos aumentados em pacientes com psoríase. Ao bloquear a sinalização de IL-4, dupilumabe pode impedir essa inibição, permitindo que a inflamação psoriática ocorra. Esta explicação é consistente com a já conhecida observação de que a coexistência de psoríase e DA no mesmo paciente é menos comum do que seria esperado com base na prevalência das duas doenças39.
CONSIDERAÇÕES FINAIS
O aumento da prevalência de asma e doenças alérgicas resultou na necessidade da pesquisa de novos tratamentos para melhor controle de sintomas, melhora da qualidade de vida e redução de crises graves e hospitalizações. Os avanços no conhecimento dos mecanismos patogênicos permitiram a identificação de diferentes endotipos e fenótipos, bem como novos alvos terapêuticos envolvidos na inflamação alérgica. A disponibilidade de imunobiológicos eficazes no controle destas doenças é de extrema importância, mas a segurança do paciente é sempre um objetivo primordial.
Os principais eventos adversos dos imunobiológicos que atuam sobre a resposta tipo 2 são, na sua maioria, leves, como reação no local da aplicação, infecção respiratória e cefaleia. Os mecanismos de ação desses imunobiológicos têm baixo potencial para imunossupressão, com bons perfis de segurança no que diz respeito às infecções. Salientamos que não há maior frequência ou gravidade, estatisticamente relevante quando comparado ao placebo, com relação a infecções respiratórias, inclusive por SARS-CoV-2, entre indivíduos em uso dos imunobiológicos aqui descritos.
Um pequeno risco de anafilaxia também tem sido descrito, por esse motivo ressaltamos a importância da realização da aplicação destes medicamentos em ambiente de hospital-dia, com supervisão médica.
No futuro, o desenvolvimento de biomarcadores poderá auxiliar a prever o risco de eventos adversos, especialmente reações imediatas, para as quais protocolos de investigação e dessensibilização precisam ser aprimorados e padronizados. Deste modo, consideramos importante o monitoramento clínico e laboratorial de eventos adversos (por exemplo: eosinopenia ou eosinofilia).
Por fim, cabe ressaltar que o uso de imunossupressores, eventualmente utilizados no tratamento de doenças alérgicas, está associado a eventos adversos. Com o advento da medicina de precisão, os imunobiológicos serão cada vez mais incorporados à prática do alergista e imunologista. Essas drogas causam reações de hipersensibilidade, mas que, felizmente, em sua maioria não são de maior gravidade.
REFERÊNCIAS
1. Solé D, Sano F, Rosário NA, Antilla M, Aranda C, Chong-Neto H et al. Guia prático de atualização: medicamentos biológicos no tratamento da asma, doenças alérgicas e imunodeficiências. Arq Asma Alergia Imunol. 2019;3:207-49.
2. Sullivan PW, Ghushchyan VH, Globe G, Schatz M. Oral corticosteroid exposure and adverse effects in asthmatic patients. J Allergy Clin Immunol. 2018;141(1):110-116.e7.
3. Wandalsen GF, Sano F, Falcão ACAM, Machado AS, Serpa FS, Rizzo JÂ, et al. Guia para o manejo da asma grave 2019 - Associação Brasileira de Alergia e Imunologia. Arq Asma Alerg Imunol. 2019;3(4):337-62.
4. Abuzakouk M, Ghorab OKHA, Wahla AS, Zoumot Z, Nasir M, Grandon D, et al. Efficacy and Safety of Biologic Agents in Chronic Urticaria, Asthma and Atopic Dermatitis - A Real-life Experience. Open Respir Med J. 2020 Dec 31;14:99-106.
5. Giavina-Bianchi P, Arruda LK, Aun MV, Campos RA, Chong-Neto HJ, Constantino-Silva RN, et al. Diretrizes brasileiras para o diagnóstico e tratamento do angioedema hereditário - 2017. Arq Asma Alerg Imunol. 2017;1(1):23-48.
6. Aubin F, Carbonnel F, Wending D. The complexity of adverse side-effects to biological agents. J Crohns Colitis. 2013;7:257-62.
7. Pichler WJ. Adverse side-effects to biological agents. Allergy. 2006 Aug;61(8):912-20.
8. bula Xolair® (Internet). Disponível em: https://portal.novartis.com.br/upload/imgconteudos/2130.pdf.
9. Hendeles L, Sorkness CA. Anti-immunoglobulin E therapy with omalizumab for asthma. Ann Pharmacother. 2007 Sep;41(9):1397-410.
10. Corren J, Casale TB, Lanier B, Buhl R, Holgate S, Jimenez P. Safety and tolerability of omalizumab. Clin Exp Allergy. 2009 Jun;39(6):788-97.
11. Busse W, Buhl R, Fernandez Vidaurre C, Blogg M, Zhu J, Eisner MD, et al. Omalizumab and the risk of malignancy: results from a pooled analysis. J Allergy Clin Immunol. 2012 Apr;129(4):983-9.e6.
12. Barakat L, Torres MJ, Phillips EJ, Caminati M, Chang YS, Caimmi D, et al. Biological treatments in allergy: prescribing patterns and management of hypersensitivity reactions. J Allergy Clin Immunol Pract. 2021 Mar;9(3):1396-1399.e2.
13. Lieberman P, Rahmaoui A, Wong DA. The safety and interpretability of skin tests with omalizumab. Ann Allergy Asthma Immunol. 2010 Dec;105(6):493-5.
14. Owens G, Petrov A. Successful desensitization of three patients with hypersensitivity reactions to omalizumab. Curr Drug Saf. 2011;6(5):339-42.
15. Price KS, Hamilton RG. Anaphylactoid reactions in two patients after omalizumab administration after successful long-term therapy. Allergy Asthma Proc. 2007 May-Jun;28(3):313-9.
16. Baker DL, Nakamura GR, Lowman HB, Fischer SK. Evaluation of IgE Antibodies to Omalizumab (Xolair®) and Their Potential Correlation to Anaphylaxis. AAPS J. 2016 Jan;18(1):115-23.
17. Rodrigo GJ, Neffen H. Systematic review on the use of omalizumab for the treatment of asthmatic children and adolescents. Pediatr Allergy Immunol. 2015;26:551-6.
18. Urgert MC, van den Elzen MT, Knulst AC, Fedorowicz Z, van Zuuren EJ. Omalizumab in patients with chronic spontaneous urticaria: a systematic review and GRADE assessment. Br J Dermatol. 2015;173(2):404-15.
19. Tharp MD, Bernstein JA, Kavati A, Ortiz B, MacDonald K, Denhaerynck K, et al. Benefits and Harms of Omalizumab Treatment in Adolescent and Adult Patients With Chronic Idiopathic (Spontaneous) Urticaria: A Meta-analysis of "Real-world" Evidence. JAMA Dermatol. 2019 Jan 1;155(1):29-38.
20. Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, et al. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020 Sep;146(3):595-605.
21. Krings JG, McGregor MC, Bacharier LB, Castro M. Biologics for Severe Asthma: Treatment-Specific Effects Are Important in Choosing a Specific Agent. J Allergy Clin Immunol Pract. 2019 May-Jun;7(5):1379-92.
22. bula Nucala® (Internet). Disponível em: https://br.gsk.com/media/6289/l1307_nucala_po_lio_inj_gds11.pdf.
23. Lugogo N, Domingo C, Chanez P, Leigh R, Gilson MJ, Price RG, et al. Long-term Efficacy and Safety of Mepolizumab in Patients with Severe Eosinophilic Asthma: A Multi-center, Open-label, Phase IIIb Study. Clin Ther. 2016 Sep;38(9):2058-2070.e1.
24. Khatri S, Moore W, Gibson PG, Leigh R, Bourdin A, Maspero J, et al. Assessment of the long-term safety of mepolizumab and durability of clinical response in patients with severe eosinophilic asthma. J Allergy Clin Immunol. 2019 May;143(5):1742-1751.e7.
25. Li L, Wang Z, Cui L, Xu Y, Guan K, Zhao B. Anaphylactic risk related to omalizumab, benralizumab, reslizumab, mepolizumab, and dupilumab. Clin Transl Allergy. 2021 Jun 3;11(4):e12038.
26. Agache I, Beltran J, Akdis C, Akdis M, Canelo-Aybar C, Canonica GW, et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI Guidelines - recommendations on the use of biologicals in severe asthma. Allergy. 2020 May;75(5):1023-42.
27. Logan J, Harinstein L. Pediatric postmarketing pharmacovigilance review of mepolizumab: Food and Drug Administration; 2017.
28. Saco TV, Pepper AN, Lockey RF. Benralizumab for the treatment of asthma. Expert Rev Clin Immunol. 2017 May;13(5):405-13.
29. bula Fasenra® (Internet). Disponível em: https://www.astrazeneca.com.br/content/dam/az-br/Medicine/InfoFasenra/Fasenra_Bula_Profissional%20-%20FSN003.pdf
30. Jackson K, Bahna SL. Hypersensitivity and adverse reactions to biologics for asthma and allergic diseases. Expert Rev Clin Immunol. 2020 Mar;16(3):311-9.
31. Busse WW, Bleecker ER, FitzGerald JM, et al. Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med. 2019 Jan;7(1):46-59.
32. Patel SS, Casale TB, Cardet JC. Biological therapies for eosinophilic asthma. Expert Opin Biol Ther. 2018 Jul;18(7):747-54.
33. bula Dupixent® (Internet). Disponível em: http://200.199.142.163:8002/FOTOS_TRATADAS_SITE_14-03-2016/bulas/75769.pdf
34. Castro M, Corren J, Pavord ID, Maspero J, Wenzel S, Rabe KF, et al. Dupilumab Efficacy and Safety in Moderate-to-Severe Uncontrolled Asthma. N Engl J Med. 2018 Jun 28;378(26):2486-96.
35. Rabe KF, Nair P, Brusselle G, Maspero JF, Castro M, Sher L, et al. Efficacy and Safety of Dupilumab in Glucocorticoid-Dependent Severe Asthma. N Engl J Med. 2018 Jun 28;378(26):2475-85.
36. Bacharier LB, Maspero JF, Katelaris CH, Fiocchi, AG, Gagnon R, de Mir I, et al. Dupilumab in Children with Uncontrolled Moderate-to-Severe Asthma. N Engl J Med. 2021;385:2230-40.
37. Utine CA, Li G, Asbell P, Pflugfelder S, Akpek E. Ocular surface disease associated with dupilumab treatment for atopic diseases. Ocul Surf. 2021 Jan;19:151-6.
38. Bachert C, Han JK, Desrosiers M, Hellings PW, Amin N, Lee SE, et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): results from two multicentre, randomised, double-blind, placebo-controlled, parallel-group phase 3 trials. Lancet. 2019 Nov 2;394(10209):1638-1650. doi: 10.1016/S0140-6736(19)31881-1. Epub 2019 Sep 19. Erratum in: Lancet. 2019 Nov 2;394(10209):1618.
39. Brumfiel CM, Patel MH, Zirwas MJ. Development of psoriasis during treatment with dupilumab: A systematic review. J Am Acad Dermatol. 2022 Mar;86(3):708-9.