Número Atual: Janeiro-Março 2022 - Volume 6 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Infecções graves por SARS-CoV-2 com uso de tocilizumabe
Severe infections by SARS-CoV-2 with the use of tocilizumab
Albervania Reis Paulino1; Anne Caroline Matos dos Santos2; Rubenrhaone Alberto Paulino2; João Salviano Rosa Neto2; Matheus Alves Jordão2; Pedro Stefano Françoso2; Cecilia Guimarães Barcelos3; Renan Almeida e Silva4; Webert Fernando Reis5
DOI: 10.5935/2526-5393.20220007
1. Instituto de Pesquisa e Ensino Médico, Pós-Graduação em Alergia e Imunologia - Belo Horizonte, MG, Brasil
2. Centro Universitário Atenas, Medicina - Paracatu, MG, Brasil
3. Universidade Estadual de Goiás, Medicina - Itumbiara, GO, Brasil
4. Universidade Federal dos Vales Jequitinhonha e Mucuri, Medicina - Diamantina, MG, Brasil
5. Maranata Serviços Médicos, Pesquisa em Saúde - São Bernardo do Campo, SP, Brasil
Endereço para correspondência:
Rubenrhaone Alberto Paulino
E-mail: rhaonepaulino@gmail.com
Submetido em: 28/08/2021
Aceito em: 18/12/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
O SARS-CoV-2 é causador da doença infecciosa COVID-19. A infecção estimula o sistema imunológico a produzir citocinas pró-inflamatórias. A principal citocina envolvida é a IL-6, e está ligada à gravidade da doença. Devido à associação dos altos níveis de IL-6 com a mortalidade na COVID-19, investiga-se sobre o uso de tocilizumabe (TCZ), um anticorpo monoclonal humanizado antirreceptor de IL-6 humana. O objetivo desta revisão sistemática é avaliar a eficácia do uso do TCZ em pacientes com COVID-19 grave. As buscas foram feitas através das bases de dados Science Direct e PubMed em setembro de 2021. Foram incluídos os ensaios clínicos randomizados com pacientes em um único estágio de COVID-19, casos graves e sem restrição de idade, os quais receberam o TCZ como medicação de intervenção combinado a tratamentos protocolados por cada hospital e associado a corticosteroides. A análise desses estudos demonstrou resultados significantes sobre o uso de TCZ em casos severos de COVID-19. O uso de TCZ associado a glicocorticoides levou a uma redução no índice de mortalidade e de submissão a ventilações mecânicas e a uma melhora expressiva em relação à escala "WHO-endorsed 7-point ordinal scale". Entretanto, não houve melhora relevante quanto ao uso do TCZ de maneira isolada.
Descritores: COVID-19; anticorpos monoclonais; Síndrome de Resposta Inflamatória Sistêmica.
INTRODUÇÃO
O novo coronavírus (SARS-CoV-2) é causador da doença infecciosa COVID-19, que se iniciou na cidade de Wuhan, China, em novembro de 2019 e se espalhou por todo o mundo1.
Até o momento há o registro de sete tipos de coronavírus, dos quais quatro estão relacionados a resfriados comuns, que infectam somente o trato respiratório superior. Já os outros três (SARS-CoV, MARS-CoV e SARS-CoV-2) são responsáveis por infecções mais agressivas, afetando o trato respiratório inferior e podendo evoluir para a síndrome do desconforto respiratório agudo (SDRA), extremamente grave1.
O SARS-CoV-2 é um vírus de RNA pertencente ao grupo ß-coronavírus, que age diretamente nos receptores de ACE-2 dos humanos. Para que isso ocorra, uma proteína pico (proteína S) se projeta como um envelope viral que se liga ao receptor ACE-2, fazendo com que o genoma viral entre na célula e inicie, dessa forma, a infecção COVID-19. O fato de os receptores ACE-2 estarem presentes principalmente nas células epiteliais alveolares explica a ação mais agressiva do vírus no trato respiratório inferior. No entanto, tais receptores também são expressos na superfície de células do coração, endotélio vascular, trato gastrointestinal e rins1.
A partir do início da infecção, o sistema imunológico inato é ativado e começa a produzir e liberar citocinas pró-inflamatórias, como IL-6, IL-1ß, IL-8, TNF-a e outras quimiocinas, que aumentam as respostas inflamatórias. No caso da COVID-19, as respostas inflamatórias são exacerbadas, causando o que se chama de tempestade de citocinas. Essa resposta inflamatória excessiva provoca diversas anormalidades no organismo humano, como anormalidades de coagulação, desenvolvimento de oxidação excessiva, transição de permeabilidade mitocondrial e falha do sistema imunológico. Essa condição causa distúrbios do sistema nervoso central, insuficiência renal, insuficiência hepática e, finalmente, insuficiência de múltiplos órgãos1.
Estudos do perfil imunológico de pacientes com COVID-19 grave demonstram que há um número elevado de linfócitos T e monócitos ativados. Essas células de defesa são responsáveis por sintetizar citocinas pró-inflamatórias, como a interleucina 6 (IL-6), fator de necrose tumoral-a (TNF-a) e interleucina-12 (IL-12). As pesquisas evidenciam que, nessa patogênese, a principal citocina envolvida é a IL-6, a qual está diretamente ligada à gravidade e ao prognóstico da doença, pois provoca uma tempestade de citocinas e respostas inflamatórias graves nos pulmões e em outros órgãos e tecidos2.
O receptor de IL-6 possui duas apresentações: receptor de IL-6 ligado à membrana (mIL-6R), e receptor de IL-6 solúvel (sIL-6R). Há ligação da IL-6 com sIL-6R para formação de um complexo, o qual se acopla à proteína transmembrana gp130 para que ocorra a transdução de sinal e a função pró-inflamatória seja realizada2. A IL-6 ligada ao seu receptor, ao gerar essa tempestade de citocinas, pode agravar o distúrbio imunológico e, assim, impedir o processo de hematose, o que possibilita a ocorrência de uma vasta gama de disfunções, desde uma insuficiência respiratória a uma falha cardiovascular e à disfunção de vários órgãos, contribuindo, então, para a mortalidade de pacientes graves com COVID-193.
Essa tempestade pode ser controlada através de anticorpos monoclonais que agem sobre a via da IL-6, já que conseguem se ligar ao sIL-6R e ao mIL-6R, impedindo, assim, essa transdução de sinal2. Devido a essa associação dos altos níveis de IL-6 com a gravidade e mortalidade na COVID-19, investiga-se sobre o uso de tocilizumabe (TCZ), que é um anticorpo monoclonal humanizado antirreceptor de IL-6 humana da subclasse das imunoglobulinas (Ig) IgG1, usado no tratamento de artrite reumatoide, artrite idiopática juvenil e arterite de células gigantes4. Esse medicamento se liga aos receptores da IL-6 e bloqueia a sinalização intracelular permeada pelos complexos sIL-6R e mIL-6R2, havendo, assim, a possibilidade de redução da tempestade de citocinas e, consequentemente, do estado hiperinflamatório.
O objetivo desse estudo é avaliar a eficácia do uso do tocilizumabe no tratamento de pacientes com COVID-19 grave.
MÉTODO
Foram realizadas estratégias de busca para estudos publicados do tipo ensaios clínicos randomizados para tal revisão narrativa. Os mesmos investigavam a eficácia do uso do anticorpo monoclonal tocilizumabe como terapia para casos graves de COVID-19, ou seja, uso como terapia adicional à terapia convencional de centros médicos. As buscas foram feitas através de pesquisas nas seguintes bases de dados: Science Direct e PubMed em setembro de 2021, sem haver nenhuma restrição de datas ou de idiomas. A estratégia de busca usada foi: ("Coronavirus Infections" OR "COVID-19") AND (Tocilizumab) AND ("Randomized Controlled Trial" OR "Ensaio Clínico Controlado Randomizado").
Foram considerados como uso de tocilizumabe nesta revisão aqueles trabalhos que usaram o medicamento sem associação a nenhum outro tratamento, a não ser o preconizado pelo próprio centro médico, ou com associação a corticosteroides, em pacientes em casos graves de infecção por Coronavírus.
Foram incluídos neste trabalho publicações de ensaios clínicos randomizados de casos graves de pacientes em um único estágio de COVID-19 e sem restrição de idade, os quais receberam o tocilizumabe como medicação de intervenção, combinado a tratamentos protocolados por cada hospital e também associado a corticosteroides, em alguns trabalhos.
Os desfechos de interesse foram a escala WHO-endorsed 7-point ordinal scale e Razão de Pao2/Fio2.
Seleção dos estudos
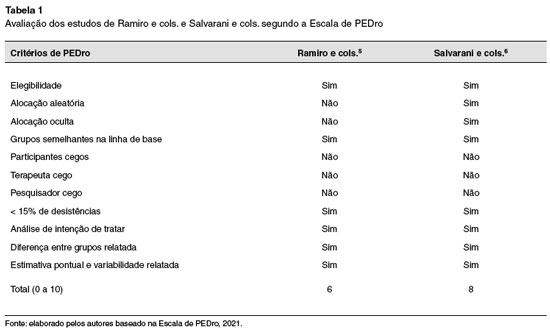
A priori, as buscas através da estratégia de busca encontraram 413 trabalhos, no dia 7 de maio de 2021. Foi feita a leitura dos títulos e resumos por revisores independentes (RAP e ACM) e, desses, foram retiradas as duplicatas. Então a partir da leitura dos títulos e resumos restaram 90 artigos. Após a leitura dos artigos completos e aplicação dos critérios de inclusão e exclusão, entraram nesta revisão narrativa 2 artigos, ambos ensaios clínicos randomizados (ECR). Os critérios de inclusão estão relacionados a pessoas com infecção ativa pelo Coronavírus em estado grave, com uso de tocilizumabe, associado ou não a corticoides e medicamentos instituídos pela instituição hospitalar, contanto que não haja antivirais no tratamento. Outro critério de inclusão foram ECR's. Foram considerados como critérios de exclusão: uso de antivirais, relatos de caso, revisões bibliográficas, opiniões de experts e estudos retrospectivos, prospectivos que não ECR's. A avaliação dos artigos segundo a Escala PEDro está descrita na Tabela 1.
RESULTADOS
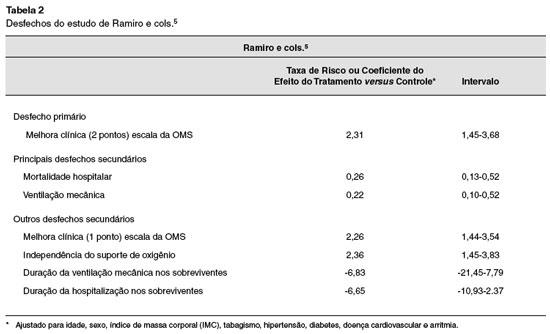
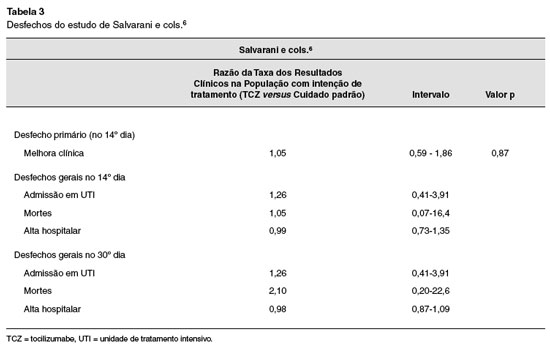
Na estratégia de busca foram identificadas 413 referências. Após a remoção das duplicatas, análise dos títulos e resumos, aplicação dos critérios de inclusão e exclusão, restaram 11 artigos em potencial para o estudo. Dos 11 em potencial, 9 foram excluídos. Os principais critérios de exclusão desses estudos em potencial foram não ser ECR e o uso de antivirais. Todos os resultados dos estudos foram obtidos através do uso do tocilizumabe. Os desfechos encontrados estão descritos nas Tabelas 2 e 3.
Todos os estudos retratados foram publicados entre julho de 2020 e janeiro de 2021. Incluiu-se nesta revisão pessoas de ambos os sexos, sem restrição de idade e todos com diagnóstico de COVID-19 por testes PCR ou pela tomografia computadorizada de área pulmonar. Vale ressaltar que todos os indivíduos dos estudos estavam em estado grave.
Foram selecionados dois ECR's. O primeiro foi realizado por Ramiro e cols.5, que selecionou uma amostra de 172 pacientes e a separou em um grupo intervenção e um grupo controle, ambos com 86 pessoas com idade média de 67 anos. Ambos os grupos receberam algum tipo de tratamento. O grupo de controle recebeu tratamento imediato com metilprednisolona (MP) 250 mg por via intravenosa no dia 1, seguido por MP 80 mg por via intravenosa nos dias 2-5, com opção para uma extensão de 2 dias se considerado necessário e seguro, além de receber Ceftriaxona 2 g por dia, durante sete dias e cloroquina 300 mg a cada 12 horas, após uma dose de ataque de 600 mg. Já o grupo intervenção recebeu tocilizumabe (TCZ) entre o dia 2 e o dia 5 (TCZ em dose única, 8 mg/kg de peso corporal por via intravenosa, máx. 800 mg).
Por sua vez, no outro ECR, segundo Salvarani e cols.6, foi selecionada uma amostra de 126 pacientes, 60 destinados para o grupo que receberia o anticorpo monoclonal e outros 60 que seriam o grupo controle. A média da idade destes pacientes era de 60 anos, e tanto o grupo controle como o grupo intervenção receberam tratamento. O grupo intervenção recebeu tocilizumabe intravenoso dentro de 8 horas da randomização (8 mg/kg até um máximo de 800 mg), seguido por uma segunda dose após 12 horas. O grupo controle por sua vez recebeu cuidados de suporte, que foram guiados pelos protocolos de cada centro hospitalar. Vale ressaltar que todos os pacientes foram acompanhados por 14 dias de acordo com o protocolo de estudo e mais 30 dias para análise de desfechos secundários.
Ramiro e cols.5 objetivaram avaliar um curso intensivo de glicocorticoides com ou sem tocilizumabe para analisar se há aceleração de melhora clínica em pacientes com síndrome de tempestade de citocinas (CSS) associada à COVID-19, tendo usado como desfecho a escala WHO-endorsed 7-point ordinal scale. Tal estudo de Ramiro e cols.5 também buscou avaliar o índice de mortalidade e de necessidade de ventilação.
O estudo de Salvarani e cols.6 objetivou avaliar o efeito da administração precoce de tocilizumabe versus terapia padrão na prevenção da piora clínica em pacientes hospitalizados com pneumonia por COVID-19, através da razão de PaO2/FiO2, e através dos desfechos secundários que são mortalidade e alta hospitalar.
Ao final da avaliação dos trabalhos selecionados, foram obtidos resultados relevantes sobre o uso do tocilizumabe em relação à COVID-19 em casos severos. Percebeu-se que no estudo de Ramiro e cols.5 houve melhora significativa com o uso de glicocorticoides e tocilizumabe associados, diminuindo o índice de mortalidade, submissões a ventilações mecânicas e, com isso, apresentando uma melhora significativa em relação ao desfecho primário.
No entanto, o trabalho realizado por Salvarani6, não evidenciou melhora significativa. Não houve diferenças significativas nos desfechos se comparados os grupos controle e o submetido ao tratamento com tocilizumabe.
DISCUSSÃO
O novo coronavírus (SARS-CoV-2) age nos receptores de ACE-2, os quais estão presentes majoritariamente nas células epiteliais alveolares. Tal fato aumenta a ação do vírus no trato respiratório inferior, porém é possível encontrar esses receptores na superfície de células do coração, endotélio vascular, trato gastrointestinal e rins1. O fenótipo dessa infecção decorre desde a ausência de sintoma até uma pneumonia grave, levando à síndrome do desconforto respiratório (SDRA)7.
A tempestade de citocinas acontece com frequência nos casos mais graves de COVID-19. Tal fato está atrelado à gênese de imunofenótipos de células T aberrantes associadas a um perfil secretor desregulado de pró-inflamatórios, citocinas e quimiocinas. O SARS-CoV-2 pode influenciar os linfócitos T CD4+ em direção a uma linhagem TH1 patogênica, o que leva à hiperprodução de IL-6 e GM-CSF. Essas citocinas contribuem na ativação de CD14+ monócitos CD16, que secretam interleucina-6 (IL-6) e podem se deslocar para o pulmão, onde eventualmente há a diferenciação em macrófagos alveolares ou células dendríticas7.
A IL-6, ao ligar-se ao seu receptor (IL-6R) faz a sinalização cis clássica, ação que afeta as funções das células T e B, macrófagos, células natural killer e neutrófilos. A interleucina também contribui para a patogênese da tempestade de citocinas. Já quando há a interação com sIL-6R ocorre a transinalização, que tem um efetivo papel na tempestade de citocinas, pois estimula a produção da própria IL-6, IL-8, MCP-1 e fator de crescimento endotelial (VEGF). Também regula a favor da expressão da molécula de adesão E-caderina, a qual, junto com VEGF, intervém no aumento acentuado da vascularização, permeabilidade e vazamento, fato de relevância para gerar danificações aos pulmões. Quando a sinalização da IL-6 é mediada por células dendríticas que expressam IL-6R, há a transapresentação, que compromete as células T, levando-as a um imunofenótipo apto a destruir tecidos7.
Partindo desse pressuposto, uma estratégia terapêutica interessante para amenizar os efeitos perigosos da tempestade de citocinas associadas à COVID-19 é a inibição de IL-6. No mercado farmacêutico existe um anticorpo monoclonal humanizado aprovado para o tratamento da artrite reumatoide, o tocilizumabe. Seu efeito farmacológico interage com o epítopo de ligação da IL-6, impedindo assim a fixação da IL-6, fato que impede a cis-sinalização, transinalização e transapresentação. Portanto, o tocilizumabe tem propriedades anti-inflamatórias. Wang e cols.11 concluiram que o tocilizumabe pode melhorar a oxigenação, os sintomas e reduzir o agravamento da doença com um perfil de efeitos colaterais aceitáveis. Tleyjeh e cols.8 concluiram que evidências cumulativas de alta certeza mostraram que o tocilizumabe reduziu o risco de ventilação mecânica em pacientes hospitalizados com COVID-19 grave.
Ramiro e cols.5 mostraram efeito benéfico em relação ao uso de tocilizumabe associado a glicocorticoides, pois tal uso em conjunto geraria diminuição de fatores pró-inflamatórios gerais e específicos, ocasionando assim diminuição da CSS e gerando, como consequência, diminuição da mortalidade e diminuição de submissões a intervenções mecânicas. Nesse sentido, o uso do tocilizumabe associado à metilprednisolona gera efeito benéfico.
Contudo, segundo Salvarani e cols.6, não houve melhora significativa do desfecho, que é a razão de Pao2/Fio2, mostrando assim que o uso isolado de tocilizumabe não gera melhoras significativas, pelo fato de inibir de forma isolada específica. Isto é, pela ação do medicamento percebe-se a necessidade do uso associado a outros medicamentos, pois, de fato, o SARS-CoV-2 atua sobre a IL-6, mas também afeta outras citocinas pró-inflamatórias. Por esse fato o tocilizumabe isolado não gera a melhora esperada.
Através da análise dos desfechos e dos resultados obtidos, constata-se que o tocilizumabe pode fornecer certa melhora, mas tal resultado não é obtido se usado de forma isolada. Outrossim, compreendeu-se que o uso de um medicamento de efeito inibitório generalizado intenso de resposta inflamatória, associado a um fármaco de efeito inibitório específico ao IL-6, neste caso o tocilizumabe, gera efeitos de melhora significativos, como diminuição de mortalidade, diminuição de intervenções para uso de ventilação mecânica e mudança da WHO-endorsed 7-point ordinal scale favorável à melhora.
CONCLUSÃO
O uso do tocilizumabe em pacientes com COVID-19 resulta em uma melhora do quadro inflamatório devido ao seu efeito inibitório sobre a via IL-6, reduzindo assim a tempestade de citocinas, que é uma das principais causas de agravamento da COVID-19. Entretanto, por atuar apenas na via IL-6, o uso do tocilizumabe de forma isolada não ofereceu melhoras significativas nos quadros clínicos graves dos pacientes com COVID-19. Aqueles que receberam uma associação de tocilizumabe e medicamentos que possuem efeitos inibitórios generalizados sobre a resposta inflamatória tiveram uma diminuição da mortalidade e da necessidade de uma intervenção mecânica. Assim, conclui-se que o uso do tocilizumabe associado a outros fármacos que também interferem na resposta inflamatória pode contribuir para uma melhora do quadro clínico de pacientes com COVID-19 grave.
AGRADECIMENTOS
Agradecemos de maneira especial à preceptora Albervânia Reis Paulino, pela ajuda e disposição ao produzir tal trabalho com intuito de gerar evidência científica em um assunto recente e que demanda pesquisas para que sejam findadas as dúvidas remanescentes quanto ao mesmo.
REFERÊNCIAS
1. Yokota S, Miyamae T, Kuroiwa Y, Nishioka K. Novel Coronavirus Disease 2019 (COVID-19) and Cytokine Storms for More Effective Treatments from an Inflammatory Pathophysiology. J Clin Med. 2021;10(4):801.
2 . Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci USA. 2020;117(20):10970-5.
3. Gokhale Y, Mehta R, Karnik N, Kulkarni U, Gokhale S. Tocilizumab improves survival in patients with persistent hypoxia in severe COVID-19 pneumonia. EClinicalMedicine. 2020;24:100467.
4. Cardona-Pascual I, Berlana D, Martinez-Valle F, Campany-Herrero D, Montoro-Ronsano JB. Effect of tocilizumab versus standard of care in adults hospitalized with moderate-severe COVID-19 pneumonia. Med Clin (Barc). 2021 May 6:S0025-7753(21)00210-4.
5. Ramiro S, Mostard RLM, Magro-Checa C, van Dongen CMP, Dormans T, Buijs J, et al. Historically controlled comparison of glucocorticoids with or without tocilizumab versus supportive care only in patients with COVID-19-associated cytokine storm syndrome: results of the CHIC study. Ann Rheum Dis. 2020;79(9):1143-51.
6. Salvarani C, Dolci G, Massari M, Merlo DF, Cavuto S, Savoldi L, et al.; RCT-TCZ-COVID-19 Study Group. Effect of Tocilizumab vs Standard Care on Clinical Worsening in Patients Hospitalized with COVID-19 Pneumonia: A Randomized Clinical Trial. JAMA Intern Med. 2021 Jan 1;181(1):24-31.
7. Pelaia C, Calabrese C, Garofalo E, Bruni A, Vatrella A, Pelaia G. Therapeutic Role of Tocilizumab in SARS-CoV-2-Induced Cytokine Storm: Rationale and Current Evidence. Int J Mol Sci. 2021 Mar 17;22(6):3059.
8. Tleyjeh IM, Kashour Z, Damlaj M, Riaz M, Tlayjeh H, Altannir M, et al. Efficacy and safety of tocilizumab in COVID-19 patients: a living systematic review and meta-analysis. Clin Microbiol Infect. 2021 Feb;27(2):215-27.
9. Uzunian A. Coronavirus SARS-CoV-2 and Covid-19. J Bras Patol Med Lab. 2020;56:1-4.
10. Zhai P, Ding Y, Wu X, Long J, Zhong Y, Li Y. The epidemiology, diagnosis and treatment of COVID-19. Int J Antimicrob Agents. 2020 May;55(5):105955.
11. Wang D, Fu B, Peng Z, Yang D, Han M, Li M, et al. Tocilizumab in patients with moderate or severe COVID-19: a randomized, controlled, open-label, multicenter trial. Front Med. 2021 Jun;15(3):486-94.
12. Soin AS, Kumar K, Choudhary NS, Sharma P, Mehta Y, Kataria S, et al. Tocilizumab plus standard care versus standard care in patients in India with moderate to severe COVID-19-associated cytokine release syndrome (COVINTOC): an open-label, multicentre, randomised, controlled, phase 3 trial. Lancet Respir Med. 2021 May;9(5):511-21.
13. REMAP-CAP Investigators, Gordon AC, Mouncey PR, Al-Beidh F, Rowan KM, Nichol AD, Arabi YM, et al. Interleukin-6 Receptor Antagonists in Critically Ill Patients with Covid-19. N Engl J Med. 2021 Apr 22;384(16):1491-502.
14. Almaghlouth NK, Anyiam FE, Shah S, Haq S, Attia MJ, Guevara R, et al. the use of single therapy with tocilizumab versus combination therapy with remdesivir and tocilizumab in SARS-CoV-2 patients in El Paso, Texas. Cureus. 2021 Jul 13;13(7):e16351.
15. Atal S, Fatima Z. IL-6 Inhibitors in the Treatment of Serious COVID-19: A Promising Therapy? Pharmaceut Med. 2020 Aug;34(4):223-31