Número Atual: Janeiro-Março 2021 - Volume 5 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Evolução da infecção por COVID-19 em um grupo de pacientes com erros inatos da imunidade
Evolution of a Brazilian group of patients with inborn errors of immunity with COVID-19
Katharina Ruth Pagotto-Betzler1; Alex Isidório Prado2; Priscila Rios Macedo2; Ana Carolina Cerqueira Salzano2; Ekaterini Simões Goudoris3; Leonardo Oliveira Mendonça2
1. Faculdade de Medicina de Graz, Departamento de Medicina Interna - Graz, Styria, Áustria
2. Hospital 9 de Julho, Departamento de Doenças Raras e da Imunidade - São Paulo, SP, Brasil
3. Faculdade de Medicina da UFRJ, Instituto de Puericultura e Pediatria Martagão Gesteira (IPPMG) - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Leonardo Oliveira Mendonça
E-mail: leonardo.mendonca@hc.fm.usp.br
Submetido em: 20/01/2021
Aceito em: 26/02/2021
RESUMO
INTRODUÇÃO: O novo coronavírus causou uma pandemia e desafio na saúde pública em todo o mundo. Até hoje muitos mecanismos do vírus no hospedeiro foram desvendados, cujo conhecimento é essencial para entender a evolução clínica e desenvolver uma estratégia de terapia adequada para a infecção com COVID-19. Contudo, pouco se sabe da infecção por COVID-19 em pacientes com erros inatos da imunidade (EII), principalmente em pacientes com síndromes autoinflamatórias.
OBJETIVO: Descrever a evolução de pacientes com erros inatos da imunidade acometidos por SARS-CoV-2 em um centro de referência em doenças raras e da imunidade no Brasil.
MATERIAL E MÉTODOS: Foram analisados retrospectivamente dados clínicos, radiológicos, patológicos e laboratoriais de pacientes com erros inatos da imunidade infectados por SARS-CoV-2 de março a dezembro de 2020.
RESULTADOS: Ao total, dados de 13 pacientes com diversos EII foram coletados para descrever tanto a evolução da doença quanto para buscar mais conhecimento sobre o tratamento desses pacientes. Em nenhum paciente a síndrome da angústia respiratória aguda foi observada, e também não foi observado nenhum óbito. A grande maioria dos pacientes teve evolução com síndrome gripal. Observou-se, em um paciente com CAPS-NLRP3, rash cutâneo vasculítico responsivo ao uso de anti-IL1.
CONCLUSÃO: Neste pequeno grupo de pacientes com erros inatos da imunidade e com infecção por SARS-CoV-2, o risco de fatalidade foi menor do que observado na literatura. Especialmente, o fato de que a maioria apresenta maior predisposição a inflamação do que infecção deve ser levada em conta na análise dos dados finais. Reportamos pela primeira vez a presença de urticária vasculítica em paciente com CAPS, que habitualmente apresentam-se com urticária neutrofílica. Tal achado ressalta a capacidade de injúria vascular do vírus, mesmo em indivíduos predispostos geneticamente.
Descritores: SARS-CoV-2, COVID-19, erros inatos da imunidade, síndromes autoinflamatórias.
INTRODUÇÃO
Desde o surgimento do novo coronavírus em dezembro 2019 na cidade Wuhan, na China, cerca de 70 milhões de pessoas já foram infectadas mundialmente e mais de 1,5 milhões de pessoas tiveram evolução fatal1. O vírus pertence à família Coronaviridae, foi denominado de SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus e produz a doença chamada COVID-19, com grave quadro respiratório2. Em meados de março de 2020, a Organização Mundial de Saúde (OMS) declarou situação de pandemia do novo vírus1. Atualmente, diversas apresentações clínicas, modalidades terapêuticas e o comportamento do vírus no hospedeiro são conhecidos2. Além disso, diversas vacinas para prevenção da disseminação foram desenvolvidas3, contudo, o conhecimento do vírus em pacientes com erros inatos da imunidade (EII) é pouco conhecido, tanto no Brasil, quanto mundialmente4-7.
O status imunológico do hospedeiro e a interação com o SARS-CoV-2 é fundamental para discriminar a evolução tanto clínica quanto imunológica. Enquanto que, de um lado o sistema imune adaptativo é essencial para a eliminação do vírus, o sistema imune inato parece contribuir para a gravidade da evolução clínica8. A liberação excessiva de IL-6 (correlação com níveis séricos de proteína C-reativa - PCR) por macrófagos de pacientes infectados parece estar relacionada diretamente com a apresentação de Síndrome de Ativação Macrofágica (SAM), observada em boa parte dos pacientes com a forma grave da COVID-199,10. A presença de linfócitos com função citotóxica TCD8+ exibe padrões de exaustão celular, o que consequentemente está associada a pobre resposta mediada por células T e, consequentemente, dificuldade de clareamento viral8,11.
Este trabalho propõe-se a descrever a evolução da infecção por SARS-CoV-2 em pacientes com EII em seguimento no Serviços de Doenças Raras e da Imunidade do Hospital 9 de Julho em São Paulo, Brasil.
PACIENTES E MÉTODOS
Foram extraídos de prontuário médico, retrospectivamente (março de 2020 a dezembro de 2020), dados de pacientes em seguimento no Serviço de Doenças Raras e da Imunidade do Hospital 9 de Julho, em São Paulo, Brasil. Foram coletados os seguintes dados: dados demográficos; diagnóstico etiológico em seguimento; terapias crônicas em uso no momento do diagnóstico; razões para interação hospitalar; forma de apresentação clínica, terapêutica utilizada e evolução da infecção por COVID-19; positividade do método diagnóstico. Análises estatísticas descritivas foram feitas utilizando o software Graphpad Prysma Versão 7.0. Resultados são expressos em média, mínima, máxima e desvio padrão. O estudo foi aprovado pelo Comitê de Ética em Pesquisa (CAAE - 31264220.0.2004.5455) e todos os pacientes assinaram termo de consentimento livre e esclarecido (TCLE).
RESULTADOS
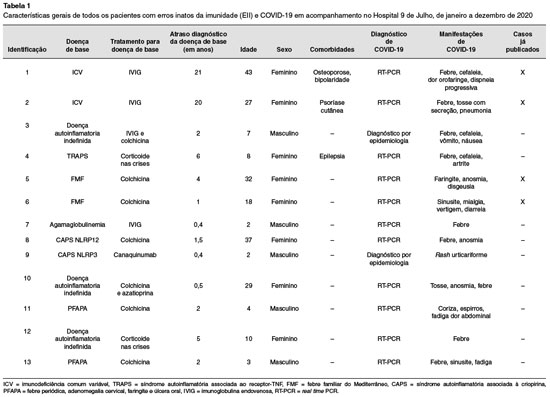
Ao total, dados de 13 pacientes com EII foram coletados para descrever a evolução da infecção por SARS-CoV-2 (Tabela 1), sendo a maioria (61%) do sexo feminino e adultos (64%) (Figura 1). Observa-se que a maioria dos pacientes com EII apresentava predisposição à inflamação (77%). A maioria (77%) dos pacientes se encontrava em uso de terapias crônicas, sendo a colchicina a droga usada pela maioria deles. Uma pequena parcela (30%) estava em uso de imunoglobulina humana e anti IL-1 (7%). Apenas 30% necessitaram hospitalização pela infecção por SARS-CoV-2, e a maioria (69%) teve evolução com síndrome gripal. De forma global, não se observou evolução para síndrome respiratória grave nem óbito. A grande maioria (85%) recebeu diagnóstico de infecção pelo SARS-CoV-2 por RT-PCR (real time polymerase chain reaction), enquanto que somente 15% (todos crianças) foram diagnósticados por meio de dados clínicos. Nos casos nos quais o RT-PCR foi negativo, todos os familiares apresentaram pesquisa por RT-PCR positiva para SARS-CoV-2 e apresentaram sintomas e/ou sinais compatíveis com infecção aguda por SARS-CoV-2.
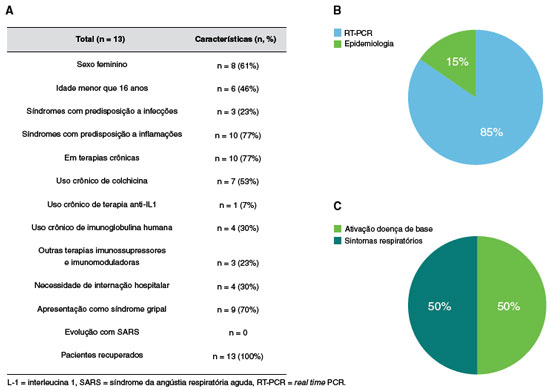
Figura 1
Características clínicas e demográficas de pacientes com erros inatos da imunidade e infectados por COVID-19. A) Tabela descritiva dos dados clínicos e demográficos dos pacientes infectados. B) Pacientes com diagnóstico por RT-PCR e aqueles cujo diagnóstico foi baseado em epidemiologia. C) Razões da necessidade de internação hospitalar
Dentre os pacientes que necessitaram internação hospitalar, metade pertencia ao sexo feminino e metade era menor de 16 anos de idade, sendo a mesma proporção (50%) com predisposição a infecção e inflamação. A maioria (75%) dos pacientes hospitalizados estava recebendo reposição regular de imunoglobulina humana. Apenas dois pacientes apresentaram alterações tomográficas características da COVID-19, ambos com Imunodeficiência Comum Variável (ICV), com bronquiectasias pulmonares, do sexo feminino e sem e diagnóstico genético. Uma paciente com ICV já tinha diagnóstico prévio de psoríase cutânea e piora deste quadro cutâneo foi observada após a infecção por SARS-CoV-2. Um paciente com CAPS-NLRP3 apresentou rash cutâneo urticariforme, contudo, com histopatologia compatível com urticária vasculítica. Outro paciente, com diagnóstico de síndrome autoinflamatória indefinida, apresentou leucopenia com RT-PCR positivo para SARS-CoV-2. Ambos os pacientes necessitaram de internação hospitalar para monitorização clínica.
Durante a hospitalização, cloroquina foi utilizada em 50% dos pacientes (n = 2), sendo que uma paciente apresentou evento adverso desta droga (alargamento do intervalo QT), com necessidade de suspensão da mesma. Anticoagulante foi utilizado em 50% dos pacientes (n = 2), ambos com ICV. Nenhum paciente necessitou dose adicional de imunoglobulina humana. As duas pacientes com ICV que necessitaram hospitalização fizeram uso de dose já programada da imunoglobulina humana, divididas em dois dias. Somente um paciente com CAPS-NLRP3 requereu dose extra de anti-IL1 (canaquinumabe) para controle do rash vasculítico, com sucesso. A maioria dos pacientes recebeu corticoide oral durante a internação, com sucesso no controle dos sintomas e sem nenhum evento adverso (Figura 2). Todos os pacientes não hospitalizados tiveram seu quadro clínico controlado apenas com medicamentos sintomáticos.
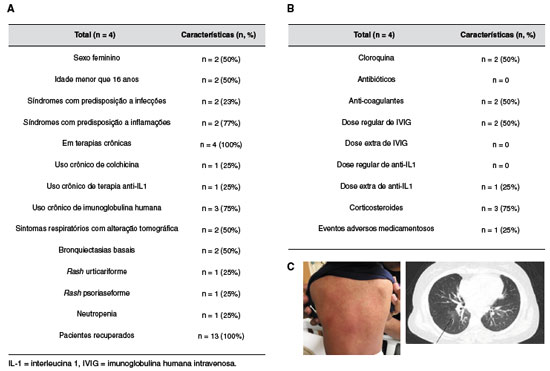
Figura 2
Características clínicas e demográficas de pacientes com erros inatos da imunidade e infectados por COVID-19 que requereram internação hospitalar. A) Tabela descritiva dos dados clínicos e demográficos dos pacientes infectados. B) Medicamentos utilizados durante a internação. C) Rash urticariforme observado em paciente com CAPS-NLRP3. D) Alteração tomográfica observada em paciente com CVID e COVID-19
DISCUSSÃO
A taxa de hospitalização e de fatalidade em pacientes com EII tem variabilidade na literatura4-7. Ao menos três trabalhos já reportaram diferenças nestes valores. Choen e cols., em 2020, analisando um grupo de 10 pacientes com ICV, observaram 10% de necessidade de hospitalização (n = 1/10) e nenhuma morte pôde ser observada naquele grupo5. Por outro lado, Meyets e cols., em 2020, em análise global de pacientes com diversos EII, observaram necessidade de hospitalização de 63% (n = 59/94) e fatalidade de 10% (n = 9/94)4. Ainda, Shields e cols., em 2020, numa coorte de pacientes com EII em todo o Reino Unido, observaram necessidade de hospitalização de 50% (n = 34/67) e fatalidade de 17% (n = 12/67)7. Deve-se ressaltar que todos os pacientes que tiveram necessidade de hospitalização e aqueles que evoluíram com eventos fatais, tanto no grupo descrito por Meyts quanto por Shields, tinham diversas comorbidades já conhecidas, como fatores de risco para desfechos negativos na infecção por SARS-CoV-24,7. Neste grupo de pacientes observamos menor necessidade hospitalização 30% (n = 4/13) e nenhuma fatalidade (Figura 2). A principal razão por tal diferença no nosso grupo deve-se ao fato de a grande maioria (77%) dos pacientes possuírem susceptibilidade a inflamação, serem jovens, e com ausência de comorbidades.
A relação entre COVID-19 e doenças autoinflamatórias ainda foi pouco discutido. Haslak e cols., em 2019, relataram 7 pacientes com síndromes autoinflamatórias e COVID-19, sendo 85% (n = 6/7) febre familiar do Mediterrâneo, e 15% (n = 1/7) PFAPA, sendo que somente 15% (n = 1/7) requereu hospitalização e nenhum óbito foi observado6. Meyets e cols. em 2020, também relataram 11 pacientes com diversas síndromes autoinflamatórias (n = 7) e imunodesregulatórias (n = 4), sendo que a necessidade de hospitalização global neste grupo foi de 54% (n = 6/11) e fatalidade de 9% (n = 1/11)4. Contudo, no grupo analisado por Meyets e cols., em 2020, de todos os pacientes que requereram internação hospitalar, a maioria (83%; n = 5/6) possuía diagnóstico de síndromes imunodesregulatórias, e o único óbito observado também possuía o mesmo diagnóstico sindrômico4. Shields e cols., em 2020, no Reino Unido, relataram três pacientes com síndromes autoinflamatórias diversas, sendo que nenhum paciente requereu internação e nenhum evento fatal foi observado7. Como observado na nossa casuística, cuja grande maioria dos pacientes era de síndromes com predisposição a inflamação, a necessidade de internação hospitalar foi de 28% (n = 2/7), e nenhum evento fatal foi observado, o que encontra-se próximo ao das demais casuísticas.
Até o momento, diversas drogas já foram consideradas em pacientes que requerem internação por COVID-19, com resultados variados entre elas, e nenhuma eficaz existe12,13. Somente um trabalho até o momento discorreu sobre o tratamento para SARS-CoV-2 em pacientes com EII, sendo as drogas já relatadas e aqui utilizadas, foram: hidroxicloroquina, corticoides sistêmicos, anticoagulante e medicamentos biológicos4. O uso de biológicos no tratamento de formas graves da SARS-CoV-2 já foi amplamente reportado, sendo os mais considerados anti-IL6 (tocilizumabe), anti-IL1 (anakinra), interferons (α e β) e inibidores de jak-quinase (baracitinibe)14. O uso de canaquinumabe ainda está em fase 3 pelo clinical trials (NCT04362813), contudo, neste estudo esta droga será utilizada para tratamento de manifestações pulmonares. Aqui, relatamos pela primeira vez, o uso de canaquinumabe para tratamento de rash vasculítico com sucesso em um paciente com Síndrome Autoinflamatória Associada à Criopirina (CAPS), já em uso crônico da mesma.
Este trabalho apresenta ao menos duas limitações, que são o baixo número de pacientes analisados e o fato de tratar-se de análise retrospectiva. Vale ressaltar que dois pacientes com febre familiar do Mediterrâneo e dois pacientes com ICV já foram previamente reportados por Meyets e cols., em 2020.
CONCLUSÃO
A principal observação foi que a necessidade de hospitalização e os eventos fatais em pacientes com EII varia nas coortes já descritas. Essa variabilidade parece que não depende exclusivamente da doença de base, mas sim do status da performance do indivíduo (múltiplas comorbidades ou drogas para tratamento).
Em comparação a pacientes com predisposição a infecções, os pacientes com predisposição a inflamações parecem ter evolução da infecção por SARS-CoV-2 mais leve. Contudo, parece que o comportamento da infecção por SARS-CoV-2 em pacientes com doenças imunodesregulatórias tem evolução mais grave, seja pelo grau de imunosupressão da doença, ou secundário aos medicamentos usados. Por último, os pacientes com CAPS que se apresentem com rash vasculítico parecem ter uma boa resposta ao canaquinumabe.
REFERÊNCIAS
1. Organização Mundial da Saúde [Internet]. Disponível em: https://covid19.who.int .
2. Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review. JAMA. 2020;324(8):782-93. doi: 10.1001/jama.2020.12839.
3. Kaur SP, Gupta V. COVID-19 Vaccine: A comprehensive status report. Virus Res. 2020;288:198114. doi: 10.1016/j.virusres.2020.198114.
4. Meyts I, Bucciol G, Quinti I, Neven B, Fischer A, Seoane E, et al. Coronavirus disease 2019 in patients with inborn errors of immunity: An international study. J Allergy Clin Immunol. 2020 Sep 24:S0091-6749(20)31320-8. doi: 10.1016/j.jaci.2020.09.010.
5. Cohen B, Rubinstein R, Gans MD, Deng L, Eisenberg R, Rubinstein A. COVID-19 Infection in Ten Common Variable Immunodeficiency Patients in New York City. J Allergy Clin Immunol Pract. 2020;9(1):504-7.e1. doi: 10.1016/j.jaip.2020.11.006.
6. Haslak F, Yildiz M, Adrovic A, Sahin S, Koker O, Aliyeva A, et al. Management of childhood-onset autoinflammatory diseases during the COVID-19 pandemic. Rheumatol Int. 2020 Sep;40(9):1423-31. doi: 10.1007/s00296-020-04645-x.
7. Shields AM, Burns SO, Savic S, Richter AG; UK PIN COVID-19 consortium. COVID-19 in patients with primary and secondary immunodeficiency: the United Kingdom experience. J Allergy Clin Immunol. 2020 Dec 15:S0091-6749(20)32406-4. doi: 10.1016/j.jaci.2020.12.620.
8. Paces J, Strizova Z, Smrz D, Cerny J. COVID-19 and the immune system. Physiol Res. 2020 Jul 16;69(3):379-88. doi: 10.33549/physiolres.934492.
9. Liu F, Li L, Xu M, Wu J, Luo D, Zhu Y, et al. Prognostic value of interleukin-6, C-reactive protein, and procalcitonin in patients with COVID-19. J Clin Virol. 2020 Jun;127:104370. doi: 10.1016/j.jcv.2020.104370.
10. McGonagle D, Sharif K, O'Regan A, Bridgewood C. The Role of Cytokines including Interleukin-6 in COVID-19 induced Pneumonia and Macrophage Activation Syndrome-Like Disease. Autoimmun Rev. 2020 Jun;19(6):102537. doi: 10.1016/j.autrev.2020.102537.
11. Diao B, Wang C, Tan Y, Chen X, Liu Y, Ning L, et al. Reduction and Functional Exhaustion of T Cells in Patients With Coronavirus Disease 2019 (COVID-19). Front Immunol. 2020 May 1;11:827. doi: 10.3389/fimmu.2020.00827.
12. Bartoletti M, Marconi L, Scudeller L, Pancaldi L, Tedeschi S, Giannella M; PREDICO Study Group, et al. Efficacy of corticosteroid treatment for hospitalized patients with severe COVID-19: a multicentre study. Clin Microbiol Infect. 2021 Jan;27(1):105-111. doi: 10.1016/j.cmi.2020.09.014.
13. Ying W, Qian Y, Kun Z. Drugs supply and pharmaceutical care management practices at a designated hospital during the COVID-19 epidemic. Res Social Adm Pharm. 2021 Jan;17(1):1978-83. doi: 10.1016/j.sapharm.2020.04.001.
14. Rizk JG, Kalantar-Zadeh K, Mehra MR, Lavie CJ, Rizk Y, Forthal DN. Pharmaco-Immunomodulatory Therapy in COVID-19. Drugs. 2020 Sep;80(13):1267-92. doi: 10.1007/s40265-020-01367-z.