Número Atual: Julho-Setembro 2020 - Volume 4 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Hiperplasia gengival durante uso de ciclosporina
Gingival hyperplasia during cyclosporine use
Gustavo Giovanni Ojeda Soley; Alex Isidoro Prado; Grazielly Fatima Pereira; Ariana Campos Yang; Fábio Fernandes Morato Castro
DOI: 10.5935/2526-5393.20200058
Hospital das Clínicas da Universidade de São Paulo, Imunologia e Alergia - São Paulo, SP, Brasil
Endereço para correspondência:
Gustavo Giovanni Ojeda Soley
E-mail: giova_ojeda@hotmail.com
Submetido em: 13/07/2020
Aceito em: 03/09/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
Paciente do sexo masculino, com 24 anos, portador de dermatite atópica desde o primeiro ano de vida. Começou a evoluir com forma grave da dermatite atópica aos 17 anos, e devido à refratariedade clínica ao tratamento convencional tópico, foi encaminhado para serviço de referência. Após otimizar os cuidados com uso de emolientes, corticoides tópicos e cursos de antibioticoterapia, manteve persistência de eczema generalizado, com SCORAD oscilando entre 40 e 50 no período de 4 meses. Dessa forma, optou-se por terapia sistêmica, sendo iniciado o uso de ciclosporina oral na dose de 200 mg. A resposta terapêutica com a ciclosporina foi percebida após 4 semanas, sendo refletida na redução do escore de gravidade (SCORAD=10). Durante o seguimento, além da melhora clínica, eram monitorados potenciais eventos adversos. O paciente fez uso da ciclosporina durante 5 anos sem apresentar eventos adversos, com necessidade de aumento de dose para 300 mg/dia dois anos após início da medi-cação.Porém, neste quinto ano de uso da ciclosporina, o paciente apresentou hipertrofia gengival importante. Assim, optou-se por reduzir a dose de ciclosporina de 300 para 200 mg/dia. Nenhum outro sinal ou sintoma foi observado, e os exames laboratoriais também não mostraram qualquer toxicidade. O paciente se mostrou resistente à redução da medicação, pois o temor de piora das lesões de pele o aflige muito. Orientamos sobre a necessidade de melhorar a higiene bucal de forma disciplinada, e agendamos reavaliação clínica mensal. Além disso, foi encaminhado para avaliação odontológica.
Descritores: Ciclosporina, hiperplasia gengival, dermatite atópica.
INTRODUÇÃO
A dermatite atópica (DA) é uma entidade clínica que cursa com lesões eczematosas e prurido de caráter crônico-recidivante e comprometiment biopsicossocial importante. Embora seja mais prevalente na faixa etária pediátrica, acomete de 1 a 10% dos adultos1. Por acometer a pele em graus variáveis, a aparência e trazer como um dos principais sintomas o prurido (muitas vezes constante e incontrolável), frequentemente o paciente apresenta alterações comportamentais, distúrbios de sono e comprometimento da rotina pessoal e familiar2. A restauração da barreira cutânea é um pilar central no tratamento desta condição, independente da gravidade da apresentação. O uso de corticosteroides tópicos em agudizações do eczema são frequentemente prescritos em conjunto da terapia de manutenção, que contempla inibidores da calcineurina tópicos, como o tacrolimus. A escolha da terapia tópica precisa ser ajustada e adequada às necessidades individuais, observadas durante a evolução clínica. A identificação de fatores desencadeantes e a educação sobre a doença constituem abordagens importantes para a boa evolução. Entretanto, uma parcela dos casos apresenta fenótipo grave da doença, tendo demanda de terapia anti-inflamatória sistêmica pela refratariedade clínica, e pouca resposta aos tratamentos tópicos1.
A ciclosporina, uma terapia sistêmica anti-inflamatória, é um inibidor de calcineurina com função imunossupressora nas células T e nas citocinas inflamatórias como IL2 e IFNg. Este fármaco tem sido utilizado quase que universalmente na prevenção da rejeição de transplantes de orgãos, desde 1978. Seu uso expandiu-se no tratamento de diversas doenças de etiologia autoimune, como psoríase, líquen plano, pênfigo bolhoso, esclerose múltipla, lúpus eritematoso sistêmico, miastenia gravis, uveítes, glomerulopatias e doenças alérgicas, como urticária crônica espontânea e dermatite atópica, a partir de 19923.
O uso das terapias sistêmicas permite o controle clínico de muitos pacientes, mas traz consigo o risco de efeitos colaterais importantes, que podem limitar seu uso. Sabe-se que a administração da ciclosporina, por efeito dose-dependente, demanda cuidados diferenciados nos pacientes com DA: necessidade de controle dos níveis pressóricos, controle do lipidograma, função renal ou hepática e até efeitos que demandam intervenção cirúrgica, como a hiperplasia gengival (HG)4. Seu mecanismo envolve hiperativação de fibroblastos e redução do controle da produção de matriz extracelular localmente. Este efeito, pouco visto pelos médicos imunologistas, deve ser prontamente reconhecido para tomada de conduta, devendo-se levar em conta fatores como idade, uso de medicações concomitantes e higiene bucal5.
A seguir descrevemos relato de paciente com HG.
OBJETIVO
Relatar caso de paciente com dermatite atópica grave em uso de ciclosporina há 5 anos e desenvolvimento de hiperplasia gengival.
MÉTODO
Para realização deste trabalho foi realizado revisão de prontuário, entrevista com paciente e registro fotográfico, além de revisão de dados de literatura atual.
RELATO DE CASO
Paciente masculino, atualmente com 24 anos, iniciou acompanhamento em um hospital terciário no setor de Imunologia Clínica e Alergia, no ano 2013, por quadro dermatite atópica (DA) grave. Apresentava antecedente de asma alérgica intermitente, com última crise aos 13 anos, sem necessidade de medicação contínua, além de rinoconjuntivite alérgica persistente moderada/grave, sensibilizado para Dermatophagoides pteronyssinus e Blomia tropicalis.
A DA iniciou com um ano de vida, com sintomas clássicos: prurido e eczema recorrente em localizações típicas, sendo acompanhado por dermatologista. Por apresentar eosinofilia e aumento de IgE (19.600 UI/mL - VR até 100 UI/mL) foi encaminhado para serviço de referência em alergia.
EVOLUÇÃO DURANTE ACOMPANHAMENTO
Paciente com má adesão ao tratamento tópico com hidratação e corticosteroides, evoluiu com agravamento clínico, com múltiplas infecções secundárias de pele, que melhoravam apenas com uso de antibiótico oral. Apresentou episódio de erupção variceliforme de kaposi, tratado com aciclovir por 14 dias. Foi reforçado aderência, após as orientações enfatizadas por vezes, o paciente realizou o tratamento corretamente, porém evoluiu com piora das lesões. Foi iniciada ciclosporina A no ano 2014, com 200 mg/dia, com boa resposta (Tabela 1). Dois anos após (2016), por piora do eczema, a dose foi aumentada para 300 mg/dia. Durante o tratamento manteve normalidade da função renal e lipidograma, sem aumento dos níveis pressóricos, sua ciclosporinemia não atingiu níveis que aumentassem o risco de toxicidade (Tabela 2).
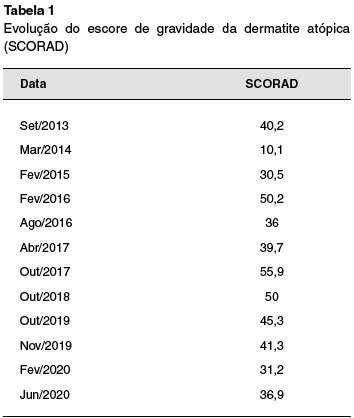
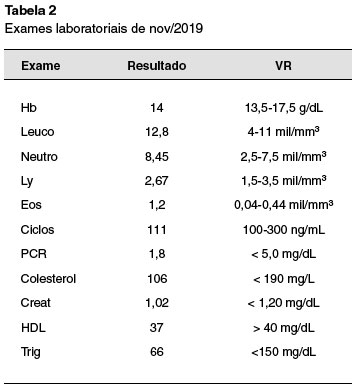
Apresentava eosinofilia persistente e foi medicado com albendazol, emolientes, tacrolimus pomada em face, e betametasona creme nas lesões ativas do corpo e também, budesonida spray nasal, pois apresentava quadro de rinoconjuntivite alérgica persistente moderada/grave. As lesões de DA eram acompanhadas de prurido constante e refratário às medidas anti-inflamatórias tópicas, de hidratação cutânea, e também não respondiam aos anti-histamínicos, desta forma, foi optado pela prescrição de gabapentina, na dose de 600 mg/dia, em agosto de 2019, para controle de um dos pilares do tratamento da DA, o prurido.
No quinto ano de tratamento com ciclosporina A, o paciente queixou-se de hipertrofia gengival (Figura 1). Assim, optou-se por reduzir a dose de Ciclosporina de 300 para 200 mg/dia. Nenhum outro sinal ou sintoma foi observado, e os exames laboratoriais também não mostraram qualquer toxicidade. O paciente se mostrou resistente à redução da medicação, pois o temor de piorar as lesões de pele o aflige. Orientamos sobre a necessidade de melhorar a higiene bucal de forma disciplinada e agendamos reavaliação clínica mensal. Além disso, foi encaminhado para avaliação odontológica.
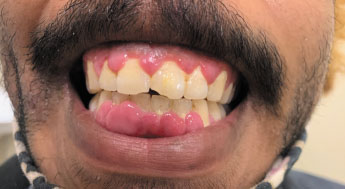
Figura 1
Hiperplasia gengival
DISCUSSÃO
As formas graves de DA frequentemente demandam o uso de terapias sistêmicas imunossupressoras que atuam diretamente na inflamação cutânea e na redução de citocinas pró-inflamatórias. O uso de azatioprina, metotrexato, micofenonato de mofetila, apesar de recorrente na prática clínica, é feito de forma off-label. Já a ciclosporina tem sua validação para terapia de curto prazo em pacientes com DA refratária ao uso de medicações tópicas6. Um estudo realizado em 2014, com 334 pacientes com DA, comparou a eficácia no uso dos imunossupressores, demonstrando que a ciclosporina poderia ser a primeira escolha, com resultados contundentes no controle da doença, entretanto, seus efeitos colaterais motivam muitas vezes a descontinuação da droga7.
A medicação pode ser administrada por via oral, intramuscular ou intravenosa, em doses variadas conforme a indicação. A dose inicial para DA é de 3-5 mg/kg/dia, dividida em duas tomadas, com monitoração dos níveis terapêuticos a partir da sexta semana, com possibilidade de redução para 2,5-3 mg/kg/dia na chamada fase de manutenção, com duração total de até 1 ano8.
Apesar de sua eficácia, relatada em torno de 55%, a ciclosporina tem sido associada a vários efeitos adversos. Muitos deles são dose-dependente e potencialmente reversíveis quando da diminuição ou suspensão do medicamento. Os seus principais efeitos colaterais são nefrotoxicidade, hepatoxicidade, hipertensão, perda de massa óssea, e alterações metabólicas como hiperglicemia, hipercolesterolemia, e elevação de apoB-100, podendo aumentar em até 60% nos pacientes pós-transplantados de órgãos sólidos, que fazem uso de doses maiores do que os utilizados para doenças alérgicas9.
Em termos odontológicos, o efeito colateral mais descrito da ciclosporina é o desenvolvimento de hiperplasia gengival (HG), geralmente após 6 meses de uso.Tal efeito foi visto pela primeira vez em 1983 por Seymour e cols., com descrição de aumento papilar da porção queratinizada gengival, posteriormente acometendo coroa dentária, trazendo prejuízos estéticos e até funcionais na mastigação do paciente10.
Sua fisiopatologia está ligada ao aumento de fibroblastos locais e produção exagerada de matriz extracelular com glicosaminoglicanas. O processo depende também da redução de produção local de metaloproteinases responsáveis pela formação de colagenases, culminando em descontrole desta homeostase. Alguns fatores podem contribuir para a piora da HG, como associação de medicações, má higiene oral com inflamação gerada pela placa bacteriana, idade, alterações periodontais ou mesmo genéticas10-11.
Outras medicações, como anticonvulsivantes (fenitoína, valproato de sódio, fenobarbital e outros), bloqueadores de canais de cálcio (diidropiridínicos e não diidropiridínicos) também podem estar associadas ao desenvolvimento de HG, a incidência deste evento adverso varia muito conforme o critério utilizado (13%-85%), e o sinergismo de medicações pode potencializar o efeito, como no uso de ciclosporina e nifedipino12.
Como forma preventiva, o paciente candidato ao uso da ciclosporina deve passar por orientação do profissional de saúde e idealmente ser acompanhado a cada 3-6 meses por um odontologista, a fim de manter adequada a saúde bucal. A manutenção do tratamento deve incluir: evitar placas bacterianas e orientar higiene constante, considerando que tal fator é fundamental para acelerar o desenvolvimento da HG13.
Em termos de tratamento, a redução da droga causadora pode melhorar a condição do paciente, mas se o acometimento gengival for superior à um terço do dente, a suspensão está indicada quando possível, afinal, pacientes que demandam imunossupressão crônica como transplantados devem ter uma avaliação do risco versus benefício. Caso a recomendação seja seguida, a literatura mostra melhora em até 8 semanas sem maiores prejuízos estéticos ou anatômicos14-15.
Quando a HG é leve, o controle local já pode ser suficiente para evitar progressão do quadro sem intervenções cirúrgicas13. Em casos moderados ou graves, a gengivectomia interna ou externa está indicada pela avaliação de um profissional da área, e deve ser individualizada considerando a estética, a alteração na mastigação e desfechos pós operatórios, bem como, complicações associadas15-16. Desta forma, conhecer os possíveis efeitos colaterais das medicações prescritas é obrigação do profissional solicitante, e saber como evitá-las ou mesmo tratá-las faz parte do acompanhamento de todo paciente com doença crônica, para evitarmos as iatrogenias.
REFERÊNCIAS
1. Megna M, Napolitano M, Patruno C, Villani A, Balato A, Monfrecola G, et al. Systemic treatment of adult atopic dermatitis: a review. Dermatol Ther (Heidelb). 2017;7(1):1-23.
2. Silverberg JI, Simpson EL. Association between severe eczema in children and multiple comorbid conditions and increased health careutilization. Pediatr Allergy Immunol. 2013;24(5):476-86.
3. Castro MAP.Inibidores de calcineurina no tratamento das dermatoses alérgicas. J Pediatr (Rio J). 2006;82(5 Supl):S166-72.
4. Simon D, Wollenberg A, Harald R, Simon H-E. Atopic Dermatitis: Collegium Internationale Allergologicum (CIA) Update 2019. Int Arch Allergy Immunol. 2019;178:207-18.
5. Ponnaiyan D, Jegadeesan V. Cyclosporine A: Novel concepts in its role in drug-induced gingival overgrowth. Dent Res J (Isfahan). 2015; 2(6):499-506.
6. Simon D, Bieber T. Systemic therapy for atopic dermatitis. Allergy.2014;69(1):46-55.
7. Garritsen FM, Roekevisch E, van der Schaft J, Deinum J, Spuls PI, de Bruin-Weller MS.Ten years experience with oral immunosuppressive treatment in adult patients with atopic dermatitis in two academic centes. J Eur Acad Dermatol Venereol. 2015;29(10):1905-12.
8. Aliaga GLC, Anagusko CLY, Gomes LS, Mamede LQ, Moraes P, Cunha PS, et al. Efeitos adversos do uso de ciclosporina em pacientes com dermatite atópica grave. Arq Asma Alerg Imunol. 2020;4(1):99-102.
9. Herink M, Ito MK. Medication Induced Changes in Lipid and Lipoproteins. In: Feingold KR, Anawalt B, Boyce A, et al., eds. Endotext.South Dartmouth (MA):MDText.com, Inc.; May 10, 2018. PMID: 26561699.
10. O'Valle F, Mesa F, Aneiros J, Gómez-Morales M, Lucena MA, Ramírez C, et al. Gingival overgrowth induced by nifedipine and cyclosporin A.Clinical and morphometric study with image analysis. J Clin Periodontol. 1995;22(8):591-7.
11. Samudrala P, Chava K V, Chandana T, Suresh R. Drug-induced gingival overgrowth: A critical insight into case reports from over two decades. J Indian Soc Periodontol. 2016; 20(5):496-502.
12. Tungare S, Paranjpe AG. Drug Induced Gingival Overgrowth. 2020 Oct 5. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. PMID: 30860753.
13. Hall EE. Prevention and treatment considerations in patients with drug-induced gingival enlargement. Curr Opin Periodontol. 1997;4:59-63.
14. Tyldesley WR, Rotter E. Gingival hyperplasia induced by cyclosporin-A. Br Dent J. 1984;157(9):305-9.
15. Grover V, Kapoor A, Marya CM. Amlodipine induced gingival hyperplasia. J Oral Health Commun Dent. 2007;1:19-22.
16. Taylor BA.Management of drug-induced gingival enlargement.Aust Prescr. 2003;26:11-3.



