Número Atual: Julho-Setembro 2020 - Volume 4 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Importância do gênero em doenças alérgicas
Gender importance in allergic diseases
Cristine Secco Rosário1; Cristina Alves Cardozo2; Herberto Jose Chong-Neto1; Nelson Augusto Rosario1
DOI: 10.5935/2526-5393.20200048
1. Universidade Federal do Paraná, Serviço de Alergia e Imunologia - Curitiba, PR, Brasil
2. Universidade Positivo, Pediatria - Curitiba, PR, Brasil
Endereço para correspondência:
Cristine Secco Rosário
E-mail: cristinerosario@hotmail.com
Submetido em: 05/06/2020
Aceito em: 18/08/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
As diferenças entre o sexo biológico, identidade de gênero e seu impacto na saúde podem ter implicações significativas para a prevenção, rastreamento, diagnóstico e tratamento de diversas doenças, inclusive as alérgicas. A medicina de precisão pode levar a novas classificações para as doenças, baseadas nos mecanismos moleculares. Já a medicina personalizada tem um significado mais amplo, levando em consideração o indivíduo a ser tratado. Embora a alergia seja mais prevalente em meninos na infância, isto muda rapidamente durante o desenvolvimento sexual das meninas, levando à predominância feminina vitalícia nas doenças alérgicas. Isso pode ser explicado pela influência dos hormônios sexuais, diferentes estilos de vida adotados por homens e mulheres, diferenças imunológicas, variações na microbiota, qualidade da alimentação, tipo de profissão, adesão ao tratamento, entre outros. Aspectos relacionados ao gênero devem se tornar parâmetros essenciais em alergologia para a estratificação diagnóstica e terapêutica, associados aos aspectos moleculares, genéticos e epigenéticos.Para o sucesso do tratamento é importante conhecer o indivíduo a ser tratado, levando em consideração seus aspectos biológicos, psicológicos, socioeconômicos e práticos, realizando uma abordagem personalizada.
Descritores: Gênero e saúde, alergia e imunologia, epidemiologia.
INTRODUÇÃO
As diferenças entre o sexo biológico, identidade de gênero e seu impacto na saúde podem ter implicações significativas para a prevenção, rastreamento, diagnóstico e tratamento de diversas doenças, inclusive as alérgicas. Gênero e sexo são multidimensionais, interativos, entrelaçados e, às vezes, são difíceis de separa; portanto, o uso das duas palavras (gênero e sexo) pode ajudar a entender o contexto social, cultural e biológico1.
Os conceitos de medicina de gênero, medicina personalizada e medicina de precisão estão intimamente relacionados e são muito importantes tanto para a pesquisa clínica, quanto para a prática diária. Esses conceitos muitas vezes são permutáveis e podem se sobrepor, embora tenham pequenas diferenças. A medicina de precisão pode levar a novas classificações para as doenças, baseadas nos mecanismos moleculares. Já a medicina personalizada tem um significado mais amplo, levando em consideração o indivíduo a ser tratado. O grande desafio é incorporar os princípios da medicina personalizada na prática clínica diária, especialmente nos casos mais graves, em que o controle da doença é difícil2,3.
A tecnologia possibilitou o conhecimento de mecanismos moleculares subjacentes às doenças alérgicas, o que contribuiu para o descobrimento e melhor definição de alvos terapêuticos. Assim, pode-se modificar o curso natural das doenças alérgicas, em vez de simplesmente controlar os sintomas. A melhor caracterização clínica, molecular e genética das doenças alérgicas (biomarcadores, fenótipos, endotipos) vem possibilitando a expansão do campo de pesquisa em terapias, inclusive com imunobiológicos4,5.
Uma perspectiva que ganha importância junto à medicina de precisão é o conhecimento da micro-biota, com suas variações intra e interindividuais, que tornam-se alvo terapêutico e podem alterar as respostas imunológicas6.
Designou-se o termo "microgenderome" para especificar as distinções na composição da micro-biota (bactérias, fungos e vírus) entre os gêneros, porém, este pode não ser apropriado, uma vez que os principais fatores que influenciam a composição da microbiota são biológicos, e não sociais. Pesquisas em animais e humanos mostram que essas distinções começam a aparecer após a puberdade, o que, em parte, pode ter relação com as variações nos hormônios sexuais. A resposta imunológica à microbiota varia entre os gêneros, o que leva a diferenças no sistema imunológico inato (produção de interleucina [IL] 10 e TGF-β, estimulação de células linfoides inatas tipo 3, produção local de peptídeos antimicrobianos e neuropeptídeos) e adaptativo (diferenciação de linfócitos T helper 1, 2 e 17; indução de linfócitos T reguladores; estimulação do desenvolvimento de células B e produção de imunoglobulina [Ig] A). Uma microbiota saudável e normal permite a manutenção da homeostase imunológica. A relação entre micro-biota, hormônios, metabolismo e imunidade é multidirecional, sendo que a disbiose pode desequilibrar a interação entre esses fatores, e o desequilíbrio sistêmico pode levar à disbiose7.
Estudos têm reconhecido a influência do microbioma da primeira infância no desenvolvimento da saúde e de doenças durante a vida. Fatores genéticos e ambientais estão envolvidos na regulação da composição e do potencial funcional do microbioma. A microbiota humana é composta por 10 a 100 trilhões de células microbianas e seu catálogo genômico, o microbioma, é composto por 3,3 milhões de genes não redundantes, destacando o grande potencial funcional da microbiota. O microbioma humano é considerado um "segundo genoma", que interage ativamente com o genoma derivado do esperma e do óvulo, resultando em modificações epigenéticas de longo alcance8.
A resposta imunológica a antígenos próprios e externos (de fungos, vírus, bactérias, parasitas e alérgenos) difere em relação ao sexo, por exemplo: 80% das doenças autoimunes ocorrem em mulheres, mulheres com infecção aguda pelo vírus da imunodeficiência humana têm 40% menos RNA viral no sangue, homens apresentam risco duas vezes maior de morte por câncer e a resposta à vacina sazonal para Influenza é pelo menos duas vezes mais forte em mulheres. Os mecanismos imunológicos sofrem variações durante o curso da vida. Quanto à imunidade inata, na infância, meninos têm maior inflamação e mais células natural killer (NK). Após a puberdade, as mulheres têm maior inflamação e as células NK mantêm-se em maior proporção em homens. Os homens idosos apresentam mais inflamação, e as mulheres têm níveis maiores de IL-10 e células NK. Já na imunidade adaptativa, na infância os meninos têm níveis mais altos de IgA e IgM e maior quantidade de linfócitos T reguladores (Treg). Após a puberdade, as mulheres têm maior número de linfócitos T CD4+ e linfócitos B, níveis mais altos de imunoglobulinas e maior ativação e proliferação de células T, enquanto os homens têm maior número de linfócitos T CD8+ e Treg, o que se mantém nos idosos9.
Para otimizar a prática clínica é necessário conhecer, além dos mecanismos moleculares e biomarcadores, os fenótipos das doenças alérgicas, bem como a diferença na distribuição delas entre os sexos. Isso é reconhecido como um elemento inovador, pois há evidências científicas de que homens e mulheres não apenas têm diferentes manifestações clínicas para a mesma doença, mas apresentam respostas terapêuticas distintas. Estas podem ser influenciadas por fatores biológicos (hormonais, orgânicos) e socioculturais (adesão ao tratamento, trabalho, poder aquisitivo)10.
Aspectos relacionados ao gênero devem se tornar parâmetros essenciais em alergologia para a estratificação diagnóstica e terapêutica, associados aos aspectos moleculares, genéticos e epigenéticos. Doenças alérgicas altamente prevalentes como asma, alergia alimentar, dermatite atópica (DA), rinite alérgica (RA) e conjuntivite alérgica (CA) têm evidentes distinções na distribuição entre homens e mulheres10.
ASPECTOS EPIDEMIOLÓGICOS
Durante a infância (0-10 anos), a prevalência da RA é maior em meninos do que em meninas. Ao contrário, na adolescência (11-17 anos) a prevalência é maior nas meninas. No entanto, em adultos (18-79 anos), não há diferença na prevalência entre os sexos. O mesmo padrão ocorre, ainda mais pronunciado, quando há coexistência de asma e RA11.
A exposição e sensibilização a alérgenos intradomiciliares é fator de risco para desenvolvimento de doenças alérgicas. No Brasil, diversos estudos têm demonstrado que a sensibilização a ácaros da poeira e baratas é dominante nos pacientes com asma e/ ou RA. Isso pode ser explicado pelo alto grau de exposição aos alérgenos dos ácaros nos lares. A maior parte das casas dos pacientes alérgicos aos ácaros com asma e/ou RA no Brasil apresentou concentrações de alérgenos superiores a 10 μg/g de poeira em pelo menos um local12.
Uma análise recente realizada em 4.520 adolescentes de 13-14 anos mostrou que as meninas têm maior prevalência de RA quando comparadas aos meninos, mas também de RCA, asma, conjuntivite alérgica (CA) e dermatite atópica (DA) (Figura 1A). Contudo, a sensibilização alergênica aos testes cutâneos é maior em meninos do que em meninas (Figura 1B). Foi observado que monossensibilização é mais frequente em meninas, enquanto polissensibilização é mais comum em meninos13. Em outros estudos, o padrão de sensibilização alérgica encontrado foi semelhante, tendo os meninos maiores índices de positividade no teste cutâneo alérgico (TCA) do que as meninas (50,1% versus 37,1%14; 57% versus 45%15). Em São Paulo, foram avaliados 996 adolescentes da mesma idade e 41,2% dos meninos tinham TCA positivo para pelo menos um alérgeno, enquanto 58,6% das meninas apresentaram sensibilização (OR = 1,21; IC 95% = 0,94-1,56; p = 0,16)16.
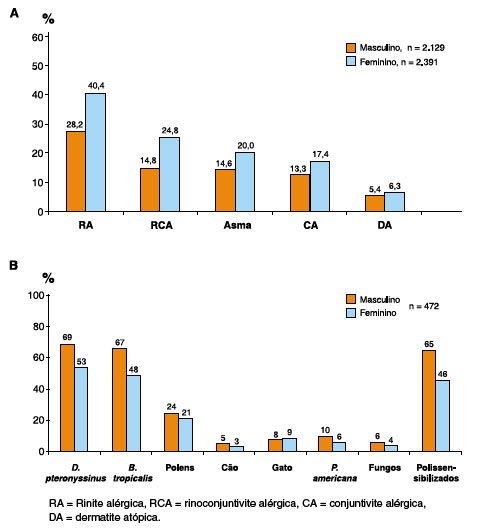
Figura 1
Doenças alérgicas e sensibilização alérgica em adolescentes de acordo com osexo. A: Prevalência das doenças alérgicas de acordo com o sexo (n = 4.520),estudo realizado em adolescentes de 13-14 anos de Curitiba. B: Padrão desensibilização alérgica aos testes cutâneos de acordo com o sexo (n = 472)
Adaptado de Rosario CS.13
Outro inquérito epidemiológico observou que todos os sintomas de alergia ocular pesquisados, como prurido ocular, lacrimação, sensibilidade à luz e sensação de areia nos olhos foram significativamente mais prevalentes em adolescentes do sexo feminino17. Há carência de dados internacionais sobre a prevalência de alergia ocular como entidade independente. Uma vez que grande parte dos pacientes apresenta sintomas oculares associados, muitos dos dados referentes à epidemiologia das alergias oculares são provenientes de estudos em RA. Diferentes termos utilizados, tais como rinoconjuntivite e febre do feno, dificultam a avaliação de dados epidemiológicos com relação aos sintomas oculares18.
Pesquisas atuais mostram uma tendência à mudança na prevalência dos sintomas de RCA e CA em relação ao sexo, em que na infância são mais frequentes nos meninos e, após a puberdade, nas meninas11,19.
O impacto do sexo na asma varia consideravelmente da infância para a adolescência e idade adulta20. Durante a infância, ser do sexo masculino é um fator de risco para asma devido ao menor diâmetro e maior tônus das vias aéreas, e os meninos apresentarem menores fluxos pulmonares durante o primeiro ano de vida. Na faixa etária de 6 a 7 anos, o risco de asma foi 2,4 vezes maior no sexo masculino21. Na adolescência, essa tendência se inverte. Rinite alérgica em adolescentes obesas pode ser um fator de risco para sibilância22. Padrões semelhantes foram observados nos trópicos, em que há um predomínio nos meninos que se equilibra gradualmente durante a infância e a melhora dos sintomas é comum, porém, menos provável se dois fenótipos alérgicos coexistem (por exemplo, asma e DA)23.
Além das diferenças hormonais, os sexos também diferem quanto ao desenvolvimento e a função pulmonar. No sexo masculino há relativa lentidão no desenvolvimento das vias aéreas quando comparado com o aumento dos volumes pulmonares. Já no sexo feminino, o crescimento das vias aéreas e o aumento do volume pulmonar são proporcionais, consequentemente com maiores fluxos aéreos, o que é uma vantagem principalmente na sibilância desencadeada por infecções virais24. Na puberdade essas diferenças se revertem com a aceleração de todos os índices de função pulmonar no sexo masculino25,26.
Em Santa Maria,RS, foi observado predomínio de asma ativa, asma de maior gravidade, broncoespasmo induzido por exercício e tosse noturna entre as mulheres27. Em Cuiabá,MT, também houve associação entre sexo feminino e asma28.
A prevalência de asma muda de acordo como sexo, da infância (predominância masculina) à adolescência e vida adulta (predominância feminina), porém, esta distribuição na RA e CA ainda não está clara. Há evidências de que para RA também ocorre esta mudança29,30.
Em pacientes com RCA, os meninos apresentam mais inflamação conjuntival do que as meninas31. Em estudo brasileiro, identificou-se que a razão entre pacientes masculinos e femininos para a prevalência de RCA e asma coexistentes foi de 1,65 (IC 95% = 1,52-1,78) em crianças; 0,61 (0,51-0,72) em adolescentes; e 1,03 (0,79-1,35) em adultos16. Estes estudos reportaram predominância do sexo masculino na associação entre asma e RA na infância e no sexo feminino na adolescência.
A dermatite atópica (DA) é uma doença inflamatória crônica da pele altamente prevalente na infância e envolve diversos mecanismos imunológicos e genéticos que interagem entre si. Dados mundiais sobre a prevalência da DA foram obtidos pelo International Study of Asthma and Allergies in Childhood (ISAAC), em que foram avaliados 187.943 escolares (6 e 7 anos de idade) e 302.159 adolescentes (13 e 14 anos) de 153 centros localizados em 56 países, com resultados variáveis, oscilando de 1,5% no Irã a 20,9% na Suécia para os escolares, e entre 1,3% na China e 19,4% na Etiópia para os adolescentes32. Na América Latina e no Brasil os valores foram intermediários33. Em São Paulo, observou-se prevalência do eczema em meninas adolescentes maior do que em meninos (OR = 1,9; IC 95% = 1,4-2,6; p < 0,05)15. Quanto ao sexo, acredita-se que a DA tenha distribuição equivalente nas crianças, porém, seja mais frequente nas mulheres quando adultas28.
No geral, a pele das meninas é mais hidratada e responde melhor a emolientes. Meninos usam hidratante e medicações tópicas menos frequentemente do que meninas, o que pode interferir no controle dos sintomas, mas as meninas tendem a utilizar mais cosméticos e tecidos sintéticos, o que pode prejudicar a integridade da barreira cutânea34.
O estudo MeDALL (Mechanisms of the Development of Allergy) mostrou maior prevalência de asma, rinite e multimorbidade respiratória em meninos antes da puberdade, e prevalência equilibrada após a puberdade35. Multimorbidade é a presença de uma ou mais doenças ou condições clínicas coexistentes com uma doença primária ou os efeitos dessas doenças adicionais. Quando o órgão primário não é conhecido, o termo multimorbidade deve ser utilizado em vez de comorbidade. Nas doenças alérgicas, o termo deve ser multimorbidade. Esse termo foi desenvolvido a partir de um projeto iniciado pela Academia Europeia de Alergia e Imunologia Clínica que visava avaliar as comorbidades da RA, uma vez que raramente esta é observada isoladamente e deve ser considerada no contexto de doença alérgica sistêmica associada a várias condições clínicas, como asma, otite crônica serosa, sinusite, hipertrofia linfoide com apneia do sono, alterações no sono e consequentes efeitos comportamentais e educacionais36,37.
A urticária crônica é mais prevalente em mulheres de meia idade, com possíveis diferenças na frequência de algumas urticárias induzidas38. Anafilaxia por todas as causas tem sido reportada com maior frequência em mulheres adultas do que em homens, e essa predominância aparece após a puberdade. No entanto, não há diferenças entre os sexos na anafilaxia fatal39. A gestação influencia o curso da asma e da DA, no entanto, um número igual de mulheres tem os sintomas de asma e DA piores, mantidos e melhores durante a gestação. O curso das doenças alérgicas varia imprevisivelmente durante a gestação, enquanto terapias de reposição hormonal em mulheres após a menopausa podem ter influência favorável no curso da asma40.
POSSÍVEIS EXPLICAÇÕES
No primeiro ano de vida, as taxas de sensibilização alérgica (produção de IgE específica) são significativamente maiores em indivíduos do sexo masculino, assim como os níveis séricos de IgE total. Nessa faixa etária, níveis séricos de IgE total parecem sofrer forte influência genética e podem não predizer níveis de IgE total no mesmo indivíduo mais tardiamente,33 embora espere-se que os níveis de IgE total aumentem com a idade41. Apesar de as taxas de sensibilização alérgica aumentarem com a idade nas meninas, os níveis aumentados de IgE e a prevalência de sensibilização nos meninos mantêm-se até a adolescência. Após a puberdade, acredita-se que os níveis séricos de IgE total e IgE alérgeno-específica em homens permaneçam maiores ou comparáveis aos das mulheres. Na fase adulta, níveis de IgE diminuem em ambos os sexos. Além das mudanças ocorridas durante a vida, os níveis de IgE também sofrem influência dos ciclos menstruais, sugerindo participação de hormônios sexuais na regulação dos níveis de IgE42.
Experimentos em roedores confirmam efeitos do estrogênio na ativação de mastócitos e na sensibilização alérgica, enquanto a progesterona pode suprimir a liberação de histamina, mas potencializar a indução IgE. A dehidroepiandrosterona pode antagonizar a produção de citocinas Th2, mas os efeitos da testosterona e outros hormônios andrógenos não são bem estabelecidos40.
Outros processos que sofrem a influência de hormônios sexuais, inibidora ou estimulante, são: expressão de receptores de reconhecimento de patógenos; ativação de células linfoides inatas; formação, maturação e migração tecidual de células dendríticas; apresentação de alérgenos, desenvolvimento e diferenciação de células T; produção de citocinas (interleucinas 6, 8, 10, 12); desgranulação de mastócitos dependente e não dependente de IgE; desenvolvimento e resposta das células B; e resposta a infecções42.
Hormônios sexuais também estão presentes no leite materno, e meninos e meninas respondem de maneira distinta a eles. A composição do leite materno pode diferir entre lactantes que tiveram filhos meninos e meninas. Um estudo mostrou que meninas amamentadas com leite com altas concentrações de leptina e insulina estavam mais propensas a desenvolver possível asma com 3 anos de idade, sugerindo um possível papel no desenvolvimento da asma para os hormônios, considerando diferenças de gênero43.
Homens e mulheres têm diferentes estilos de vida, quanto à escolha de profissões específicas, ao tipo de esportes que praticam, ao uso de medicações hormonais e à qualidade da alimentação. As células imunológicas (linfócitos, monócitos, eosinófilos e mastócitos) expressam receptores hormonais e podem, portanto, ser altamente influenciadas por hormônios endógenos e exógenos, os quais sofrem flutuações nas mulheres1.
Embora na infância mais meninos apresentem asma, isto muda rapidamente durante o desenvolvimento sexual das meninas, levando à predominância feminina vitalícia nas doenças alérgicas. Um aspecto de sexo, por exemplo, é que a obesidade colabora para o desenvolvimento de asma nas meninas e não nos meninos da mesma idade. A testosterona aparenta ter papel protetor, enquanto o estrogênio agrava a asma. Este fenômeno acompanha as mulheres durante a vida, começando com a menarca, continuando com o uso de contraceptivos orais, gestação e, finalmente, com a terapia de reposição hormonal. Além disso, as mulheres estão mais expostas a toxinas ambientais, como fumaça de tabaco. Os efeitos do sexo na asma são documentados na epidemiologia, fisiopatologia e aumento de sintomas. Como resultado, medicações alternativas para asma são mais prescritas para pacientes asmáticas44.
As terapias de substituição hormonal são indispensáveis na vida das mulheres modernas, em termos de planejamento familiar, fertilização in vitro e estratégias antienvelhecimento. A substituição hormonal é utilizada não apenas para permanecer jovem, mas também para evitar diminuições nos níveis de hormônios, que são fatores de risco para osteoporose. Esta suplementação exógena de hormônios não-fisiológica parece ser gatilho para hipersensibilidades, que são caracterizadas por sintomas irregulares: enxaqueca, dores articulares, eczema, dispneia e dermatite "acne-like" foram descritos45.
Além disso, reações imunomediadas são causas de abortos de repetição. Estas conexões são raramente consideradas hoje em dia, pois não há interação e intercâmbio funcionais entre alergistas e ginecologistas45.
Em relação ao ambiente de trabalho, o qual é essencialmente determinado pelo ambiente e cultura, há exposição a alérgenos ocupacionais. Os tópicos relacionados ao sexo incluem empregos de meio período, dois ou mais empregos, cuidados com crianças e idosos e "profissões femininas", como enfermagem, indústria têxtil, produção alimentícia e cabeleireiros. Estas atividades profissionais prejudicam a barreira cutânea, levando a risco de sensibilização a alérgenos ambientais e de contato, especialmente nas mãos45.
Portanto, pode-se concluir que o tipo de profissão claramente determina o alérgeno relevante. Por exemplo, mulheres são mais frequentemente afetadas por doenças ocupacionais de pele e procuram atendimento médico mais precocemente do que os homens. Há uma conexão entre doenças pulmonares obstrutivas, dentre elas alveolite alérgica extrínseca, que tipicamente é causada por alérgenos diferentes em mulheres e homens. Entre os desencadeantes de hipersensibilidade ocupacional, encontram-se pelo de animais e a maior parte dos cuidadores de animais é composta por mulheres. Estas alergias ocupacionais frequentemente causam dias de ausência no trabalho e, eventualmente, a mudanças na profissão. O tempo perdido para que seja realizado o treinamento para uma nova profissão é um problema econômico para o indivíduo afetado e para a sociedade45. A pele humana possui uma rica comunidade de microrganismos e há grandes variações de sua composição de acordo com a idade, sítio e período de análise. Diferentemente da microbiota intestinal, a população de bactérias na pele é composta por poucas espécies, incluindo Staphylococcus spp., e os gêneros Corynebacterium e Propionibacterium, que representam mais de 60% das bactérias da pele. A distribuição destas bactérias na pele é influenciada pelo grau de hidratação, via de parto, poluição, exposição à radiação ultravioleta, hormônios sexuais, dieta, entre outros. Não só a pele, mas todo o corpo humano é colonizado por uma grande diversidade de microrganismos. Esse vasto ecossistema microbiano interage intimamente com seu hospedeiro humano, desempenhando funções metabólicas essenciais, como fermentação de polissacarídeos e biossíntese de vitaminas que afetam múltiplos aspectos da fisiologia do hospedeiro, inclusive, a ativação e o desenvolvimento do sistema imunológico. Por isso, compreender esta complexa interface que envolve a microbiota (microrganismos e seus subprodutos), receptores e células especializadas é fundamental para o entendimento dos mecanismos de tolerância ou desequilíbrio imunológico, os quais estão respectivamente ligados ao estado fisiológico de saúde ou aos processos fisiopatológicos de diversas doenças, sobretudo aquelas de mecanismo imunológico9.
CONCLUSÃO
As doenças alérgicas são mais prevalentes nos meninos na infância e nas meninas após a puberdade. Para o sucesso do tratamento, é importante conhecer o indivíduo a ser tratado, levando em consideração seus aspectos biológicos, psicológicos, socioeconômicos e práticos, realizando uma abordagem personalizada. Estes conhecimentos podem facilitar a identificação de pacientes respondedores a tratamentos específicos, bem como o controle de outras situações que possam levar ao aparecimento de sintomas. Indivíduos do gênero masculino e feminino apresentam padrões distintos de distribuição das doenças alérgicas durante a vida, com influência dos hormônios sexuais, e respondem de maneiras diferentes ao tratamento.
REFERÊNCIAS
1. Franconi F, Campesi I, Colombo D, Antonini P. Sex-Gender variable: methodological recommendations for increasing scientific value of clinical studies. Cells. 2019;8(5):476. doi: 10.3390/cells8050476.
2. Canonica GW, Ferrando M, Baiardini I, Puggioni F, Racca F, Passalacqua G, et al. Asthma: personalized and precision medicine. Curr Opin Allergy Clin Immunol. 2018;18:51-8. doi: 10.1097/ ACI.0000000000000416.
3. Heffler E, Canonica GW, Diamant Z, Fonseca J, Malinovschi A. Personalized approach to severe asthma. Biomed Res Int. 2018;2018:2465172. doi: 10.1155/2018/2465172.
4. Roth-Walter F, Adcock IA, Benito-Villalvilla C, Bianchini R, Bjermer L, Caramori G, et al. Comparing biologicals and small molecule drug therapies for chronic respiratory diseases: An EAACI Taskforce on Immunopharmacology position paper. Allergy. 2019;74:432_48. doi: 10.1111/all.13642.
5. Solé D, Sano F, Rosário NA, Antila MA, Aranda CS, Chong Neto HJ, et al. Guia prático de atualização: medicamentos biológicos no tratamento da asma, doenças alérgicas e imunodeficiências. Arq Asma Alerg Imunol. 2019;3(3):207-58. http://dx.doi.org/10.5935/2526-5393.20190035.
6. Kuntz TM, Gilbert JA. Introducing the microbiome into precision medicine. Trends Pharmacol Sci. 2017;38:81_91. doi: 10.1016/j. tips.2016.10.001.
7. Vemuri R, Sylvia KE, Klein SL, Forster SC, Plebanski M, Eri R, et al. The microgenderome revealed: sex differences in bidirectional interactions between the microbiota, hormones, immunity and disease susceptibility. Semin Immunopathol. 2019;41:265_75.https://doi.org/10.1007/s00281-018-0716-7.
8. Chong-Neto HJ, Pastorino AC, Melo ACCDB, Medeiros D, Kuschnir FC, Alonso MLO, et al. A microbiota intestinal e sua interface com o sistema imunológico. Arq Asma Alerg Imunol. 2019;3(4):406-20. http://dx.doi.org/10.5935/2526-5393.20190055.
9. Klein SL, Flanagan KL. Sex diferences in immune responses. Nat Rev Immunol. 2016;16(10):626-38. doi: 10.1038/nri.2016.90.
10. De Martinis M, Sirufo MM, Suppa M, Di Silvestre D, Ginaldi L. Sex and gender aspects for patient stratification in allergy prevention and treatment. Int J Mol Sci. 2020;21(4):1535. https://doi.org/10.1016/j.jaip.2018.08.008.
11. Frohlich M, Pinart Gilberga M, Keller T, Reich A, Cabieses B, Hohmann C, et al. Is there a sex-shift in prevalence of allergic rhinitis and comorbid asthma from childhood to adulthood? A meta-analysis. Clin Transl Allergy. 2017;7:44. doi: 10.1186/s13601-017-0176-5.
12. Rosario-Filho NA, Jacob CM, Sole D, Condino-Neto A, Arruda LK, Costa-Carvalho B, et al. Pediatric allergy and immunology in Brazil. Pediatr Allergy Immunol. 2013;24(4):402-9. https://doi.org/10.1111/pai.12069.
13. Rosario CS. Fatores associados à conjuntivite alérgica em adolescents de Curitiba, Paraná [dissertação]. Curitiba (PR): Universidade Federal do Paraná; 2018. Disponível em: https://hdl.handle.net/1884/65989.
14. Sears MR, Burrows B, Flannery EM, Herbison GP, Holdaway MD. Atopy in childhood. I. Gender and allergen related risks for development of hay fever and asthma. Clin Exp Allergy. 1993;23(11):941-8. doi: 10.1111/j.1365-2222.1993.tb00279.x.
15. Pastorino AC. Estudo da prevalência de asma e doenças alérgicas, da sensibilização a aeroalérgenos e da exposição aos fatores de risco em escolares de 13-14 anos na região oeste da cidade de São Paulo [tese]. São Paulo: Faculdade de Medicina da Universidade de São Paulo; 2005. Disponível em: https://www.teses.usp.br/teses/disponiveis/5/5141/tde-22032006-225713/publico/TESEPASTORINO.pdf;
16. Pastorino AC, Kuschnir FC, Arruda LK, Casagrande RR, de Souza RG, Silveira HH, et al. Sensitisation to aeroallergens in Brazilian adolescents living at the periphery of large subtropical urban centres. Allergol Immunopathol (Madr). 2008;36(1):9-16. doi: 10.1157/13115665
17. Geraldini M, Chong Neto HJ, Riedi CA, Rosário NA. Epidemiologia da alergia ocular e comorbidades em adolescentes. J Pediatr (Rio J). 2013;89(4)354-60. https://doi.org/10.1016/j.jped.2013.01.001.
18. Rosario N, Bielory L. Epidemiology of allergic conjunctivitis. Curr Opin Allergy Clin Immunol. 2011;11:471-6. doi: 10.1097/ ACI.0b013e32834a9676.
19. Keller T, Hohmann C, Standi M, Wijga AH, Gehring U, Melén E, et al. The sex-shift in single disease and multimorbid asthma and rhinitis during puberty - a study by MeDALL. Allergy. 2018;73(3):602-14. doi: 10.1111/all.13312.
20. Mandhane PJ, Greene JM, Cowan JO, Taylor DR, Sears MR. Sex differences in factors associated with childhood - and adolescentonset wheeze. Am J Respir Crit Care Med. 2005;172(1):45-54. doi: 10.1164/rccm.200412-1738OC.
21. Casagrande RRD, Pastorino AC, Souza RGL, Leone C, Solé D, Jacob CMA. Asthma prevalence and risk factors in schoolchildren of the city of São Paulo, Brazil. Rev Saude Publica. 2008; 42(3):517_23. doi: 10.1590/s0034-89102008000300018.
22. Kalm-Stephens P, Nordvall L, Janson C, Neuman A, Malinovschi A, Alving K. Different baseline characteristics are associated with incident wheeze in female and male adolescents. Acta Paediatr. 2020 Mar 18. doi: 10.1111/apa.15263 [epub ahead of print].
23. Caraballo L, Zakzuk J, Lee BW, Acevedo N, Soh JY, Sánchez-Borges M, et al. Particularities of allergy in the Tropics. World Allergy Organ J. 2016;9(20):1-44. doi: 10.1186/s40413-016-0110-7.
24. Horner CC, Strunk RC. Age-related changes in the asthmatic phenotype in children. Curr Opin Pediatr. 2007;19(3):295-9. doi: 10.1097/MOP.0b013e32809913a2.
25. Almqvist C, Worm M, Leynaert B, working group of GA2LEN WP 2.5 Gender. Impact of gender on asthma in childhood and adolescence: a GA2LEN review. Allergy. 2008;63(1):47-57. doi: 10.1111/j.1398- 9995.2007.01524.x.
26. Koper I, Hufnagl K, Ehmann R. Gender aspects and influence of hormones on bronchial asthma - Secondary publication and update. World Allergy Organ J. 2017;10(46):1-7. doi: 10.1186/s40413-017- 0177-9.
27. Cassol VE, Solé D, Menna-Barreto SS, Teche SP, Rizzato TM, Maldonado M, et al. Prevalência de asma em adolescentes urbanos de Santa Maria, RS. Projeto ISAAC - International Study of Asthma and Allergies in Childhood. J Bras Pneumol. 2005;31(3):191-6. https://doi.org/10.1590/S1806-37132005000300003.
28. Jucá SCBMP, Takano OA, Moraes LSL, Guimarães LV. Prevalência e fatores de risco para asma em adolescents de 13 a 14 anos do Município de Cuiabá, Mato Grosso, Brasil. Cad Saúde Pública. 2012;28(4):689-97. doi: https://doi.org/10.1590/S0102- 311X2012000400008.
29. Pinart M, Keller T, Reich A, Fröhlich M, Cabieses B, Hohmann C, et al. Sex-related allergic rhinitis prevalence switch from childhood to adulthood: a systematic review and meta-analysis. Int Arch Allergy Immunol. 2017;172(4):224-35. doi: 10.1159/000464324.
30. Kurukulaaratchy RJ, Karmaus W, Arshad SH. Gender and Atopy influences on the natural history of rhinitis. Curr Opin Allergy Clin Immunol. 2012;12(1):7-12. doi: 10.1097/ACI.0b013e32834ecc4e.
31. Gelardi M, Leo ME, Quaranta VN, Iannuzzi L, Tripodi S, Quaranta N, et al. Clinical characteristics associated with conjunctival inflammation in allergic rhinoconjunctivitis. J Allergy Clin Immunol Pract. 2015;3:387-91. doi: 10.1016/j.jaip.2015.01.006.
32. Williams H, Stewart A, von Mutius E, Cookson W, Anderson HR, and the International Study of Asthma and Allergies in Childhood (ISAAC) Phase One and Three Study Groups. Is eczema really on the increase worldwide? J Allergy Clin Immunol. 2008;121:947_54. doi: 10.1016/j.jaci.2007.11.004.
33. Solé D, Rosário Filho NA, Sarinho ES, Camelo-Nunes IC, Barreto BAP, Medeiros ML, et al. Prevalence of asthma and allergic diseases in adolescents: nine-year follow-up study (2003-2012). J Pediatr (Rio J). 2015;91(1):30-5. http://dx.doi.org/10.1016/j.jped.2014.05.002.
34. Ballardini N, Kull I, Söderhäll C, Lilja G, Wickman M, Wahlgren CF. Eczema severity in preadolescent children and its relation to sex, filaggrin mutations, asthma, rhinitis, aggravating factors and topical treatment: a report from the BAMSE birth cohort. Br J Dermatol. 2013;168(3):588-94. doi: 10.1111/bjd.12196.
35. Hohmann C, Keller T, Gehring U, Wijga A, Standi M, Kull I, et al. Sexspecific incidence of asthma, rhinitis and respiratory multimorbidity before and after puberty onset: individual participant meta-analysis of five birth cohorts collaborating in MeDALL. BMJ Open Respir Res. 2019. doi:10.1136/ bmjresp-2019-000460.
36. Anto JM, Bousquet J, Akdis M, Auffray C, Keil T, Momass I, et al. Mechanisms of the Development of Allergy (MeDALL): Introducing noval concepts in allergy phenotypes. J Allergy Clin Immunol. 2017;139:388-99. http://dx.doi.org/10.1016/j.jaci.2016.12.940.
37. Cingi C, Gevaert P, Mösges R, Rondon C, Hox V, Rudenko M, et al. Multi_morbidities of allergic rhinitis in adults: European Academy of Allergy and Clinical Immunology Task Force Report. Clin Transl Allergy. 2017;7:17. doi:10.1186/s13601-017-0153-z.
38. Cassano N, Colombo D, Bellia G, Zagni E, Vena GA. Genderrelated differences in chronic urticaria. G Ital Dermatol Venereol. 2016;151:544_52.
39. Turner PJ, Jerschow E, Umasunthar T, Lin R, Campbell DE, Boyle RJ. Fatal Anaphylaxis: mortality rate and risk factors. J Allergy Clin Immunol Pract. 2017;5:1169_78. doi: 10.1016/j.jaip.2017.06.031.
40. Chen W, Mempel M, Schober W, Behrendt H, Ring J. Gender difference, sex hormones, and immediate type hypersensitivity reactions. Allergy. 2008;63:1418-27. doi: 10.1111/j.1398- 9995.2008.01880.x.
41. Rosario CS, Cequinel TF, Rossette D, Silva AG, Pires IAT, Lazanha LFF, et al. Níveis séricos de IgE total em pacientes asmáticos. J Paran Pediatr. 2017;18(3):61-4.
42. Leffler J, Stumbles PA, Strickland DH. Immunological processes driving ige sensitisation and disease development in males and females. Int J Mol Sci. 2018;19:1554. doi: 10.3390/ijms19061554.
43. Chan D, Becker AB, Moraes TJ, Mandhane PJ, Sears MR, Turvey SE, et al. Sex-specific association of human milk hormones and asthma in the CHILD cohort. Pediatr Allergy Immunol. 2020 Jul;31(5):570_3. doi: 10.1111/pai.13219. Epub 2020 Mar 2. PMID: 31954068.
44. Untersmayr E, Jensen AN, Walch K. Sex hormone allergy: clinical aspects, causes and therapeutic strategies - Update and secondary publication. World Allergy Organ J. 2017;10(45):1-6. doi: 10.1186/ s40413-017-0176-x.
45. Jensen-Jarolim E. Gender effects in allergology - Secondary publications and update. World Allergy Organ J. 2017;10(47):1-3. doi 10.1186/s40413-017-0178-8.



