Número Atual: Janeiro-Março 2020 - Volume 4 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Fatores associados aos sintomas de doenças atópicas em crianças de 6-7 anos em um município da Região Sul do Brasil
Factors associated with the symptoms of atopic diseases in children aged 6-7 years in a municipality in southern Brazil
Julia Carvalho Kozelinski1; Karoliny dos-Santos2; Bruna Becker da-Silva2; Jefferson Traebert2; Aline Daiane Schlindwein2
1. Universidade do Sul de Santa Catarina, Curso de Medicina - Palhoça, SC, Brasil
2. Universidade do Sul de Santa Catarina, Programa de Pós-Graduação em Ciências da Saúde - Palhoça, SC, Brasil
Endereço para correspondência:
Aline Daiane Schlindwein
E-mail: alineds10@yahoo.com.br
Submetido em: 10/02/2020
Aceito em: 10/03/2020
Estudo realizado com o apoio da Fundação de Amparo à Pesquisa e Inovação do Estado de Santa Catarina - chamada pública FAPESC Nº 09/2015, processo n° 2016TR222, e desenvolvido no âmbito do Programa de Pós-Graduação em Ciências da Saúde da Universidade do Sul de Santa Catarina, Palhoça/SC, Brasil.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: Considerando que os mecanismos pelos quais as doenças atópicas têm aumentado em frequência e gravidade não são inteiramente conhecidos, o presente estudo tem por objetivo analisar os fatores associados aos sintomas das doenças atópicas em crianças de 6-7 anos.
MÉTODO: Estudo observacional do tipo caso-controle realizado com crianças de 6-7 anos em uma cidade do Sul do Brasil. Questionários foram aplicados às mães das crianças, e os sintomas de doenças atópicas foram triados pelo questionário do International Study of Asthma and Allergy in Childhood (ISAAC).
RESULTADOS: Participaram do estudo 255 crianças (85 casos e 170 controles). Os fatores associados às doenças atópicas foram: história familiar de asma (OR: 4,61; IC95% 2,63-0,73), rinite (OR: 3,46; IC95% 1,90-3,26) e eczema (OR: 3,42; IC95% 1,91-6,14), corrimento vaginal na gestação (OR: 4,25; IC95% 2,31-7,84), icterícia neonatal (OR: 2,38; IC95% 1,21-4,68), infecções respiratórias dos tratos superior e inferior (OR: 3,75; IC95% 2,13-3,62; OR: 3,68; IC95% 2,00-6,76, respectivamente), refluxo gastroesofágico (OR: 3,83; IC95% 1,87-7,82), além do tabagismo domiciliar (OR: 2,00; IC95% 1,10-3,64), mofo/umidade no quarto (OR = 3,34; IC95% 1,82-6,12) e animais em casa (OR: 1,77 IC95% 1,04-3,02).
CONCLUSÃO: Casos de atopia estão associados a história familiar, infecções gestacionais maternas e neonatal, além de variáveis ambientais como o tabagismo e mofo.
Descritores: Fator de risco, asma, rinite alérgica, dermatite atópica.
INTRODUÇÃO
O termo atopia se refere a uma predisposição genética pessoal ou familiar que leva à produção de anticorpos chamados de imunoglobulina E (IgE) em resposta ao contato com alérgenos ambientais, tendo como resultado a apresentação de uma síndrome clínica, a tríade atópica, que inclui a asma, a rinite e a dermatite atópica1. A história natural das doenças atópicas é a progressão sequencial dos sintomas clínicos, definida assim como "marcha atópica"1.
Estima-se que 300 milhões de indivíduos sofram de asma atualmente no mundo. A tendência é que em 2025 esse número chegue a 400 milhões2. A rinite alérgica apresenta uma prevalência global de 400 milhões de pessoas, afetando 10-30% dos adultos, e 40% das crianças. Já a dermatite atópica apresentou um aumento de duas a três vezes em países industrializados durante as últimas três décadas, com uma prevalência durante a vida de 15-30% em crianças, e 2-10% em adultos2.
Há evidências de que mais de 30% das crianças com dermatite atópica desenvolverão asma, e aproximadamente 66% irão desenvolver rinite alérgica3, sugerindo a possibilidade de que um defeito na integridade da barreira epitelial, que faz parte do sistema imune inato, possa contribuir para o aparecimento da dermatite e progressão da marcha atópica4.
Embora nenhum fator de risco individual tenha sido suficiente para elucidar essa alteração na prevalência de doenças atópicas, a hipótese da higiene tem sido proposta como um fator contribuinte5. Essa hipótese sugere que a exposição reduzida a certos produtos de doenças infecciosas (como endotoxinas bacterianas) que levariam a estimulação de uma resposta imune do tipo Th1 (linfócito T helper tipo 1), desvia para a estimulação de uma resposta imune do tipo Th2 (linfócito T helper tipo 2), resultando em uma predisposição a doenças alérgicas6.
Os principais fatores de risco ambientais considerados até hoje estão relacionados à história pessoal e familiar de doenças alérgicas. Porém, observa-se também como importante fator de risco ao desenvolvimento da tríade atópica a exposição a aeroalérgenos (ácaros, fungos, proteínas de animais, pólens)6,7-10. Além disso, fatores como a idade gestacional, o abuso de tabaco na gestação, fatores socioeconômicos e ambientais mostraram relação com estas doenças6,8,10,11.
Considerando que os mecanismos pelos quais as doenças atópicas têm aumentado em frequência e gravidade não são inteiramente conhecidos, o presente estudo tem por objetivo analisar fatores associados às doenças atópicas em uma população de crianças de 6-7 anos de idade, em um município da Região Sul do Brasil.
MÉTODOS
Caracteriza-se por um estudo observacional do tipo caso-controle aninhado a uma coorte retrospectiva12, com crianças aos 6-7 anos de idade da cidade de Palhoça, SC. Este estudo foi composto por uma amostra proveniente de participantes da Coorte Brasil Sul13, a qual incluiu em seu estudo crianças nascidas em 2009, residentes e matriculadas em escolas públicas ou privadas do município12.
No município 1.900 crianças incluíram-se nos critérios do estudo. Entretanto, somente 1.270 crianças participaram do estudo, cujos pais ou responsáveis legais assinaram termo de consentimento livre e esclarecido (TCLE). Aqueles que autorizaram a participação da criança na pesquisa receberam uma visita domiciliar de agentes comunitários de saúde, que contemplou um questionário estruturado e previamente testado em um estudo piloto12 acerca do período gestacional e os primeiros dois anos de vida da criança, bem como do período atual da criança.
Os sintomas de doenças atópicas foram triados com aplicação do questionário do protocolo Internacional Study of Asthma and Allergy in Childhood (ISAAC), o qual é composto por três módulos (asma, rinite e eczema). O questionário foi validado no Brasil por Solé et al.13.
Foram considerados casos de doenças atópicas todos aqueles que responderam afirmativamente às seguintes questões retiradas do questionário ISAAC: "Alguma vez na vida seu filho teve sibilos (chiado no peito)?", "Alguma vez na vida seu filho teve problema com espirros ou coriza (corrimento nasal), quando não estava resfriado ou gripado?" ou "Alguma vez na vida seu filho teve manchas com coceira na pele (eczema), que apareciam e desapareciam por pelo menos 6 meses?". Foram excluídos do grupo de casos indivíduos que responderam afirmativamente a apenas uma das questões. Os controles selecionados foram crianças com respostas negativas às três perguntas.
O período de coleta dos questionários foi de abril de 2016 a abril de 2017. A coleta ocorreu nas residências das crianças, sendo realizada por uma equipe de pesquisadores assistidos por agentes comunitários de saúde do município de Palhoça, as quais passaram por um processo de capacitação para evitar possíveis vieses na hora da coleta. Considerou-se perda, crianças cujas mães ou o principal cuidador não foram encontrados em casa após três visitas, incluindo uma, no fim de semana, assim como aqueles que recusaram a assinar o TCLE. Foram excluídas crianças cujos questionários tivessem incompletos ou com erros no preenchimento12.
O tamanho da amostra para o presente estudo foi calculado considerando-se uma diferença de 20,8% na proporção de expostos entre os casos, e de 7,81% entre os controles, com nível de significância de 5%, poder do teste de 80%, dois controles por caso, teste de hipótese bicaudal e resultou em uma amostra mínima de 81 casos e 162 controles. Utilizou-se uma amostra final de 85 casos e 170 controles. A seleção dos questionários deu-se por meio da amostragem probabilística aleatória.
As variáveis dependentes analisadas foram a presença de sintomas de doenças atópicas avaliada como sim ou não, para cada uma das três doenças. As variáveis independentes selecionadas foram referentes às condições socioeconômicas e demográficas, história familiar, caracterização gestacional, história pregressa, caracterização ambiental e exposição a alérgenos inalantes.
Os dados foram tabulados utilizando o software Windows Excel, e posteriormente analisados por meio do programa IBM SPSS Statistics version 18.0. Chicago: SPSS Inc. A distribuição das variáveis independentes, dos casos e controles, foi apresentada em frequência absoluta e relativa. As associações entre exposições e desfecho foram analisadas pelo teste do qui-quadrado ou prova exata de Fisher, sendo representados odds ratio (OR) e respectivo intervalo de confiança (IC 95%). O nível de significância adotado foi de 5%.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa envolvendo Seres Humanos da Universidade do Sul de Santa Catarina sob CAAE 38240114.0.0000.5369.
RESULTADOS
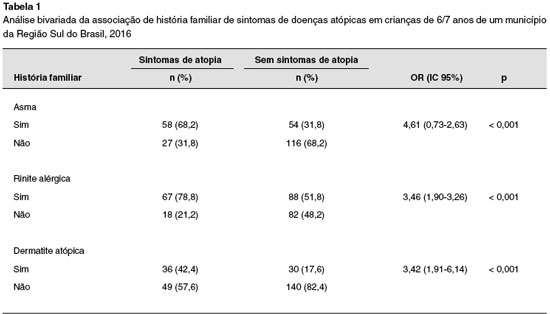
Foram analisados 255 escolares do município de Palhoça, SC. Na comparação entre as crianças que foram classificadas com sintomas de atopia e as crianças sem sintomas de atopia, a história familiar apresentou significância estatística em todas as três doenças (p < 0,001) (Tabela 1).
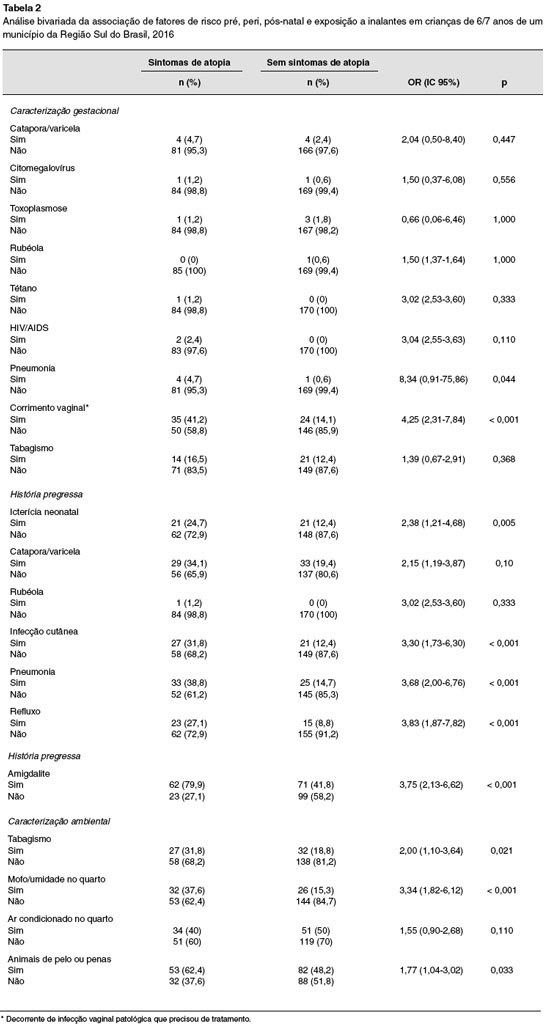
As crianças de mães que tiveram pneumonia ou corrimento vaginal patológico que precisou de tratamento durante a gestação apresentou maior chance de ter sintomas de doenças atópicas (p = 0,044; p < 0,001). O corrimento vaginal aumentou em quatro vezes a chance de ter sintomas de doenças atópicas (OR = 4,25; IC 95% 2,31-7,84). Os dados de associação entre os fatores gestacionais entre sintomas atópicos e não atópicos estão descritos na Tabela 2.
A história pessoal de infecções cutâneas, pneumonia, refluxo e amigdalite até os dois anos de vida aumentou em três vezes a chance de desenvolvimento de sintomas de doenças atópicas (p < 0,001). Não houve significância estatística entre sintomas de doenças atópicas e ocorrência de catapora e rubéola até os 2 anos de vida (Tabela 2).
O tabagismo domiciliar aumentou em duas vezes as chances de sintomas de doenças atópicas (OR = 2,00; IC 95% 1,10-3,64). Houve também associação significativa para as doenças a presença de mofo/umidade no teto ou parede dos quartos (p < 0,001), que levou ao aumento de três vezes na chance de seu desenvolvimento (Tabela 2).
DISCUSSÃO
Um dos principais fatores de risco para o desenvolvimento de sintomas de doenças atópicas encontrado no presente estudo foi a história familiar. Embora a variável não tenha sido avaliada independente dos fatores ambientais, ter um dos pais com história de asma foi significativamente associado a maiores chances de desenvolver sintomas de doenças atópicas. Estudos atuais demonstram que embora importantes, isoladamente os fatores genéticos tanto para doenças alérgicas respiratórias como para dermatite atópica são improváveis causas para o aumento da incidência de atopia14. Apesar disso, Kantor e Silverberg afirmam que interação entre a predisposição genética e fatores ambientais são apontados como os principais determinantes para a doença15.
A infecção materna no estudo foi associada a um aumento na chance de desenvolvimento de sintomas de atopia. A ocorrência de infecções urogenitais, avaliada por questão sobre a presença de corrimento vaginal durante a gravidez que necessitou de tratamento, elevou em quatro vezes a chance de sintomas de doenças atópicas, enquanto que infecções de vias aéreas inferiores durante a gestação associou-se a uma chance oito vezes maior. O estudo de Cesar et al., realizado com gestantes no município de Rio Grande, RS, avaliou a presença de corrimento vaginal patológico e que precisou de tratamento. Entre as gestantes avaliadas, 40% apresentaram corrimento vaginal. Os autores mencionam que esta patologia é motivo frequente de consulta médica durante o período gestacional, e que as principais complicações estão associadas à prematuridade, baixo peso ao nascer, pneumonia neonatal ou desenvolvimento de outras doenças infecciosas na criança16.
Zhu et al., em uma metanálise, reuniram dez estudos publicados envolvendo a associação entre a infecção materna durante a gestação e o risco de asma ou dermatite atópica em seus filhos. A infecção materna foi associada a um risco 1,55 maior para as-ma, e 1,36 maior para dermatite. A associação entre formas específicas de infecção e asma mostrou um aumento de 1,49 vezes para infecções respiratórias, e 1,39 vezes para infecções urogenitais17. Outro fator de risco estudado por Zhao et al. foi o uso de antibiótico materno associado à asma e rinite alérgica18. A significância estatística da ocorrência de infecções maternas encontradas no estudo pode estar ligada tanto à estimulação do sistema imune pela própria infecção, bem como pelo consequente uso de antibióticos.
Com relação à história pessoal, crianças que apresentaram história de pneumonia até os dois anos de vida obtiveram uma chance 3,6 vezes maior de desenvolver sintomas de atopia. Um estudo de coorte em Taiwan mostrou um risco de 3,35 para o desenvolvimento de asma em crianças que apresentaram infecção por Mycoplasma pneumoniae quando pré-escolares18. Estudos têm demonstrado que infecções com vírus sincicial respiratório podem aumentar o risco para as três doenças19,20. O estudo sobre Origem da Asma na Infância (Costa) mostrou que respostas das citocinas às infecções virais no início da vida alteram o desenvolvimento de sintomas de asma no primeiro ano de vida em crianças com alto risco de doenças atópicas, além de afirmar que existem mecanismos imunológicos distintos para o desenvolvimento de sintomas de asma, quando comparado com o desenvolvimento de dermatite atópica e sensibilização alérgica21.
No presente estudo, a ocorrência de episódios de amigdalite também levou a um aumento para o risco de desenvolvimento de sintomas de atopia. Kvaerner et al. encontraram evidências de uma predisposição comum entre infecções respiratórias de vias aéreas superiores e doenças atópicas, principalmente a rinite alérgica, por aumentar as moléculas de adesão e permitir a colonização por rinovírus, predispondo às infecções22. No presente estudo, a ocorrência de infecções na pele no início da vida também esteve associada ao risco de sintomas de doenças atópicas aos 6-7 anos de idade. Esses achados possivelmente sinalizam que a ocorrência precoce de infecções cutâneas já é em decorrência da dermatite atópica, e posteriormente se associam a outras doenças atópicas (como sugerido pela marcha atópica). Além disso, em pacientes com dermatite atópica está bem estabelecido o aumento da colonização da pele com Staphylococcus 23, o que poderia aumentar os casos de infecção na pele.
Dentre os escolares avaliados, 16,8% tiveram história de icterícia neonatal, e sua presença foi significativamente associada ao desenvolvimento de sintomas de doenças atópicas. Um estudo de coorte que investigou a incidência de doenças alérgicas em crianças com icterícia neonatal demonstrou maior risco de doenças alérgicas, principalmente para rinite e dermatite atópica24. O estudo aponta uma chance 2,38 vezes maior ao desenvolvimento de doenças atópicas e sua associação pode estar ligada à necessidade de fototerapia, decorrente do aumento nos níveis de bilirrubina sérica que afetam o desenvolvimento da resposta imune Th1 e Th2, predispondo às doenças alérgicas, como demonstra estudo realizado por Maverakis et al.25.
No presente estudo, crianças cujos pais mencionaram a presença de refluxo até os dois anos apresentaram uma maior chance no desenvolvimento de sintomas de atopia. A principal associação entre doença do refluxo e doença atópica é a asma. Os mecanismos que levam a essa associação foram estudados por Walker, em 201426, e são descritos tanto como não imunológicos, decorrentes da hiperinsuflação torácica do asmático, resultando em falha da junção esofagogástrica, hipersensibilidade vagal levando à broncoconstrição e relaxamento da junção esofagogástrica, como imunológicos, uma vez que os pacientes asmáticos apresentam mais sintomas de refluxo, e indivíduos atópicos, inclusive aqueles que têm rinite alérgica não associada à asma, apresentam anormalidades na mucosa esofágica sugerindo uma base alérgica para a associação, já que o trato gastrointestinal e a mucosa esofágica apresentam similaridades no tecido linfoide de sua mucosa, que podem induzir diferenciação celular das células T27.
Relacionado ao ambiente, este estudo mostrou que 37,6% dos participantes do estudo possuem condições de mofo e de umidade no quarto, e que 40% possuem ar-condicionado no quarto. A redução nos níveis de mofo tem resultados benéficos no controle de sintomas de asma, fato confirmado em ações de revisão de ambientes domésticos visando intervenções destinadas à melhoria de resultados relacionados à asma, concluindo-se que existem provas suficientes para recomendar uma abordagem combinada para remover itens mofados e eliminar vazamentos e fontes de umidade em casas para ajudar na redução de sintomas de asma27. Uma revisão sistemática publicada no ano de 2011 que incluiu 61 estudos confirmou um aumento no risco do desenvolvimento de doenças alérgicas respiratórias em crianças expostas a mofo, sendo maior a incidência daquelas em que relataram mofo visível do que os identificados em esporos27. A chance de desenvolvimento de doenças atópicas em crianças expostas a mofo no quarto foi de 3,34 vezes maior, dados que concordam com a literatura e que sugerem uma abordagem ambiental para o controle dos sintomas das doenças.
No presente estudo, 62,4% das crianças com sintomas de atopia possuíam animais de pelo ou penas em casa. De acordo com Ahluwalia e Matsui, os alérgenos relacionados a animais de estimação podem ser encontrados em quase todas as casas, no entanto, em casas sem animais as concentrações são 10-1000 vezes menores28. Um estudo de coorte publicado em 2008, que acompanhou crianças do nascimento aos 3 anos para determinar os efeitos da exposição de animais no desenvolvimento da resposta imune e na atopia durante a infância, encontrou resultados de diminuição nas incidências de dermatite atópica e sibilância em 3 anos para crianças que foram expostas a cachorros antes do nascimento. Por outro lado, as taxas foram mais altas em crianças cujos cães foram adotados após o nascimento. Esses dados sugerem que a exposição neonatal durante o período de desenvolvimento imune é importante para o desfecho de atopia29. O desenvolvimento de doenças atópicas em crianças expostas a animais de pelo ou penas em casa no estudo não faz diferença quanto à época em que o animal foi adotado, mas demonstra que há uma chance 1,77 vezes para a atopia, sugerindo um desfecho final para as doenças.
O estudo realizado identificou que o tabagismo esteve presente previamente e após o nascimento da criança, em 13,7% dos casos analisados, e que se manteve ainda presente em 23,1%, na moradia dessas crianças. Foi associado a um risco 2 vezes maior para o desenvolvimento de sintomas de atopia. Um estudo realizado por Thacher et al.11 buscou verificar se a exposição passiva de crianças à fumaça de cigarro na infância contribui para desenvolvimento de sensibilização alérgica em crianças e adolescentes até aos 16 anos de idade. Os resultados indicaram que esta exposição parece aumentar o risco de sensibilização para alérgenos alimentares, bem como eczema em combinação com sensibilização11. Sabe-se que as primeiras linhas de defesa dos pulmões são o epitélio respiratório e o músculo liso, ambos suscetíveis à atividade tóxica direta dos produtos químicos na fumaça do tabaco. A fumaça do cigarro aumenta a permeabilidade do epitélio e enfraquece a depuração mucociliar, facilitando a penetração de alérgenos através do epitélio, aumentando a liberação de histamina e a secreção da citocina proalérgica, linfopoietina do estômago tímico no tecido pulmonar, considerado crítico no desenvolvimento de respostas atópicas30.
Uma das limitações do presente estudo envolve a análise dos casos e controles em relação ao diagnóstico do desfecho final, o qual é fornecido pelo próprio respondente em questionários, por isso chamado de diagnóstico sintomatológico. Dessa forma, envolve a habilidade da população estudada em compreender e fornecer informações adequadas, que podem variar de acordo com a cultura regional, percepção de sintomas e compreensão da doença. Apesar disso, o questionário ISAAC foi validado para a população brasileira e tem sido mundialmente utilizado em pesquisas de base populacional. Sendo assim, o estudo permite o conhecimento da atual situação das doenças e reconhecimento das causas associadas em toda a população municipal da faixa etária em tempo coerente, oferecendo suporte ao município para implementação de medidas de prevenção e políticas públicas eficazes para o controle sintomatológico, especialmente devido ao notado aumento na prevalência das doenças no cenário atual.
Por fim, conclui-se que os principais fatores de risco encontrados no estudo relacionados às doenças atópicas foram a história familiar, as infecções uroginecológicas e respiratórias durante a gestação, bem como icterícia neonatal, história de pneumonia, infecções cutâneas e refluxo nos dois primeiros anos de vida. Os fatores ambientais relacionados às doenças atópicas foram o tabagismo e a presença de mofo/umidade. Os resultados obtidos no presente estudo permitem uma visão mais abrangente sobre os mecanismos e as variáveis genéticas e ambientais associados ao desenvolvimento e aumento global na incidência das doenças.
REFERÊNCIAS
1. Thomsen SF. Epidemniology and natural history of atopic deseases. Eur Clin Respir J. 2015; 2 (24642): 1-6. DOI: http://dx.doi.org/10.3402/ecrj.v2.24642
2. Bieber T, Leung D, El Gamal Y, Ivancevich JC. Atopic eczema. In: Pawankar R, Holgate ST, Canonica GW, Lockey RF, Blaiss MS (eds.). WAO White Book on Allergy: Update 2013. Wisconsin: WAO; 2013. p. 44-7.
3. Spergel J. Epidemiology of atopic dermatitis and atopic march in children. Immunol Allergy Clin North Am. 2010;30(3):269-80. DOI: http://dx.doi.org/10.1016/j.iac.2010.06.003.
4. Zheng T, Yu J, Oh MH, Zhu Z. The Atopic march: progression from atopic dermatitis to allergic rhinitis and asthma. Allergy, Asthma Immunol Res. 2011;3(2):67-73. DOI: http://dx.doi.org/10.4168/aair.2011.3.2.67
5. Okada K, Kuhn C, Feillet H, Bach JF. The 'hygiene hypothesis' for autoimmune and allergic diseases: an update. Clin Exp Immunol. 2010;160:1-9.
6. Hill DA, Spergel JM. The atopic march: critical evidence and clinical relevance. Ann Allergy Asthma Immunol. 2018;120(2):131-7.
7. Toskala E, Kennedy D. Asthma risk factors. Int Forum Allergy Rhinol. 2015;5(S1):S1. DOI: http://dx.doi.org/10.1002/alr.21557.
8. Wegienka G, Zoratti E, Johnson C. The role of the early-life environment in the development of allergic disease. Immunol Allergy Clin North Am. 2015;35(1):1-17. DOI: http://dx.doi.org/10.1016/j.iac.2014.09.002.
9. Illi S, Weber J, Zutavern A, Genuneit J, Schierl R, Strunz-Lehner C, et al. Perinatal influences on the development of asthma and atopy in childhood. Ann Allergy Asthma Immunol. 2014;112(2):132-39.
10. Lynch S, Wood R, Boushey H, Bacharier L, Bloomberg G, Kattan M et al. Effects of early-life exposure to allergens and bacteria on recurrent wheeze and atopy in urban children. J Allergy Clin Immunol. 2014;134(3):593-601.e12.
11. Thacher J.D, Gruzieva O, Pershagen G, Neuman A, Van Hage M, Wickman M, et al. Parental smoking and development of allergic sensitization from birth to adolescence. Allergy. 2016;71(2):239-48. DOI: http://dx.doi.org/10.1111/all.12792.
12. Traebert J, Lunardelli SE, Martins LGT, Santos K, Nunes RD, Lunardelli AN, et al. Methodological description and preliminary results of a cohort study on the influence of the first 1,000 days of life on the children's future health. Anais da Academia Brasileira de Ciencias. 2018;90(3):3105-14. DOI: http://dx.doi.org/10.1590/0001-3765201820170937.
13. Solé D, Vanna AT, Yamada E, Rizzo MC, Naspitz CK. International Study of Asthma and Allergies in Childhood (ISAAC) written questionnaire: validation of the asthma component among Brazilian children. J Investig Allergol Clin Immunol. 1998;8(6):376-82.
14. Silverberg JI, Hanifin JM. Adult eczema prevalence and associations with asthma and other health and demographic factors: a US population-based study. J Allergy Clin Immunol. 2013;132(5):1132-8. DOI: http://dx.doi.org/10.1016/j.jaci.2013.08.031.
15. Kantor R, Silverberg J. Environmental risk factors and their role in the management of atopic dermatitis. Expert Rev Clin Immunol. 2016;13(1):15-26. DOI: http://dx.doi.org/10.1080/1744666X.2016.1212660.
16. Cesar JA, Mendoza-Sassi RA, González-Chica DA, Menezes EHM, Günther B, Pohlmann M, et al . Prevalência e fatores associados à percepção de ocorrência de corrimento vaginal patológico entre gestantes. Cad Saúde Pública. 2009;25(12):2705-14. DOI: http://dx.doi.org/10.1590/S0102-311X2009001200017.
17. Zhu T, Zhang L, Qu Y, Mu D. Meta-analysis of antenatal infection and risk of asthma and eczema. Open Med. 2016;95(35):1-7. DOI: http://dx.doi.org/10.1097/MD.0000000000004671
18. Zhao D, Su H, Cheng J, Wang X, Xie M, Li K, et al. Prenatal antibiotic use and risk of childhood wheeze/asthma: a meta-analysis. Pediatr Allergy Immunol 2015;26:756-64.x DOI: http://dx.doi.org/10.1111/pai.12436.
19. Yeh JJ, Wang YC, Hsu WH, Kao CH. Incident asthma and mycoplasma pneumoniae: a nationwide cohort study. J Allergy Clin Immunol. 2016;137(4):1017-23. DOI: http://dx.doi.org/10.1016/j. jaci.2015.09.032.
20. Silverberg JI, Kleiman E, Silverberg NB, Durkin HG, Joks R, Smith‐Norowitz TA. Chickenpox in childhood is associated with decreased atopic disorders, IgE, allergic sensitization, and leukocyte subsets. Pediatr Allergy Immunol. 2012;23:50-8. DOI: http://dx.doi. org/10.1111/j.1399-3038.2011.01224.x.
21. Lemanske RF Jr. The childhood origins of asthma (COAST) study. Pediatr Allergy Immunol 2002;13(s15):38-43. DOI: https://doi.org/10.1034/j.1399-3038.13.s.15.8.x
22. Kvaerner KJ, Tambs K, Harris JR, Mair IW, Magnus P. Otitis media: relationship to tonsillitis, sinusitis and atopic diseases. Int J Pediatr Otorhinolaryngol. 1996;35(2):127-4. DOI: https://doi.org/10.1016/0165-5876(95)01299-0.
23. Geoghegan JA, Irvine AD, Foster TJ. Staphylococcus aureus and atopic dermatites: a complex and evolving relationship. Trends Microbiol. 2018;26(6):484-97. DOI: http://dx.doi.org/10.1016/j.tim.2017.11.008.
24. Wei CC, Lin CL, Shen TC, Kao CH. Neonatal jaundice and risks of childhood allergic diseases: a population based cohort study. Pediatr Res. 2015;78(2):223-30. DOI: http://dx.doi.org/10.1038/pr.2015.89.
25. Maverakis E, Miyamura Y, Bowen MP, Correa G, Ono Y, Goodarzi H. Light, including ultraviolet. J Autoimmun. 2010;34:247-57. DOI: http://dx.doi.org/10.1016/j.jaut.2009.11.011.
26. Walker MM, Powell N, Talley NJ. Atopy and the gastrointestinal tract - a review of a common association in unexplained gastrointestinal disease. Expert Rev Gastroenterol Hepatol. 2014;8(3):289-99. DOI: http://dx.doi.org/10.1586/17474124.2014.881716.
27. Tischer C, Chen C-M, Heinrich J. Association between domestic mould and mould components, and asthma and allergy in children: a systematic review. Eur Respir J. 2011;38:812-24. DOI: http://dx.doi.org/10.1183/09031936.00184010.
28. Ahuwalia SK, Matsui EC. The indoor environment and its effects on childhood asthma. Curr Opin Allergy and Clin Immunol. 2011;11(2):137-43. DOI: http://dx.doi.org/10.1097/ACI.0b013e3283445921.
29. Bufford JD, Reardonw CL, Liz Z, Robergw KA, DaSilva D, Eggleston P.A, et al. Effects of dog ownership in early childhood on immune development and atopic diseases. Clin Exper Allergy. 2008;38:1635-43. DOI: http://dx.doi.org/10.1111/j.1365-2222.2008.03018.x.
30. Ciaccio CE, Gentile D. Effects of tobacco smoke exposure in childhood on atopic diseases. Curr Allergy Asthma Rep. 2013;13(6):687-92. DOI: http://dx.doi.org/10.1007/s11882-013-0389-1.