Número Atual: Outubro-Dezembro 2019 - Volume 3 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Uso de corticoide inalado e sua implicação no nível de eosinófilos periféricos
Inhaled corticosteroid use and its implications for peripheral blood eosinophil levels
Grazielly de Fatima Pereira; Priscila de Abreu Franco; Larissa de Queiroz Mamede; Lais Souza Gomes; Iandra Leite Perez; Amanda Brolio de Souza; Allyne Moura Fé E. S. Araujo; Jorge Kalil; Pedro Giavina-Bianchi; Rosana Câmara Agondi
DOI: 10.5935/2526-5393.20190062
Serviço de Imunologia Clínica e Alergia do Hospital de Clínicas da Faculdade de Medicina da Universidade de São Paulo - São Paulo, SP, Brasil
Endereço para correspondência:
Rosana Câmara Agondi
E-mail: ragondi@gmail.com
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 16/12/2019
Aceito em: 23/12/2019
RESUMO
INTRODUÇÃO: Um dos efeitos do corticoide sistêmico é a redução do número e da ação dos eosinófilos. O objetivo deste estudo foi avaliar a ação do corticoide inalatório (CI) sobre os eosinófilos periféricos (EoP).
MÉTODOS: Trata-se de um estudo retrospectivo de prontuários eletrônicos de pacientes adultos com asma grave, steps 4 e 5 da GINA 2019, acompanhados em um centro terciário de referência. Os pacientes em uso recente ou atual de corticoide oral foram excluídos. Foram avaliados dados demográficos, dose de budesonida inalada, sensibilização a aeroalérgenos, IgE total, cortisol sérico e EoP, no período de 2010 a 2019.
RESULTADOS: Foram avaliados 58 pacientes, sendo 81,0% do sexo feminino, com médias de idade de 61,0 anos, de início da asma aos 17,4 anos e de tempo de doença de 43,6 anos. A média de CI foi de 1682,8 µg/dia, e a média de IgE sérica total do grupo foi de 398,9 UI/mL. A IgE específica para aeroalérgenos estava positiva em 40 pacientes (69%), sendo 85% destes pacientes sensibilizados para ácaros. A média do cortisol sérico foi de 5,6 µg/dL, e dos EoP de 252,1 cel/mm3. Neste estudo não foi observada correlação entre a dose de CI e o cortisol sérico. Entretanto, 41,4% dos pacientes apresentaram EoP < 150 cel/mm3, e houve uma correlação inversa significante entre as doses de CI e os níveis de EoP, (p = 0,011 r2 = 0,11), ou seja, quanto maior a dose de CI, menor o nível de EoP.
CONCLUSÕES: A GINA 2019 recomenda o uso de anticorpos monoclonais (mAbs), no step 5, direcionados pelo fenótipo de asma. Alguns destes mAbs incluem como critério de tratamento os EoP acima de 150 ou 300 cel/mm3. Neste estudo, o CI em doses elevadas estava relacionado a níveis mais baixos de EoP, portanto, alguns pacientes em uso de doses elevadas de CI poderiam apresentar EoP reduzida pelo uso de CI, interferindo na recomendação de alguns mAbs.
Descritores: Corticoide inalado, eosinófilos periféricos, asma, cortisol sérico, anticorpos monoclonais.
INTRODUÇÃO
A asma é uma doença heterogênea, geralmente caracterizada por inflamação crônica das vias aéreas. É definida pela história de sintomas respiratórios, como sibilância, dispneia, opressão torácica e tosse, que variam ao longo do tempo e em intensidade, juntamente com uma limitação variável ao fluxo expiratório. A limitação do fluxo de ar pode, posteriormente, se tornar persistente1.
É uma doença respiratória crônica comum que afeta de 1 a 18% da população em diferentes países1. Calcula-se que entre 10 a 20% dos pacientes com asma apresentem sintomas persistentes graves, apesar de um plano terapêutico adequado2-4.
A presença de eosinófilos na inflamação brôn-quica da asma é reconhecida há muitos anos, sendo a asma eosinofílica um fenótipo comum que geralmente responde à terapia com corticosteroides. A inflamação eosinofílica das vias aéreas parece estar intimamente relacionada ao risco de exacerbações graves e perda do controle da asma. Pacientes asmáticos com contagem de eosinófilos periféricos (EoP) maior que 400 cel/mm3 apresentam exacerbações mais graves, e têm pior controle da doença5. Altos níveis de eosinófilos no escarro estão associados à maior frequência de asma não controlada, asma mais grave e exacerbações mais frequentes6. A asma eosinofílica alérgica representa 60% dos casos de asma, e a asma eosinofílica não alérgica, 25 a 30%7.
O corticoide inalado (CI) é o principal medicamento anti-inflamatório utilizado no tratamento de manutenção e profilático, tanto em adultos como em crianças. Pacientes com asma grave (steps 4 e 5 da GINA) muitas vezes necessitam, para o controle da doença, de doses elevadas de corticoide inalado (CI) por longos períodos de tempo8-10.
O tratamento de manutenção com CI reduz a frequência e gravidade das exacerbações, o número de hospitalizações e de atendimentos nos serviços de emergência, melhora a qualidade de vida, a função pulmonar e a hiper-responsividade brônquica, e diminui a broncoconstricção induzida pelo exercício11.
O controle dos sintomas e a melhora da função pulmonar podem ocorrer após uma a duas semanas de tratamento, enquanto que para reversão da hiper-responsividade brônquica, o paciente pode necessitar de meses ou anos de utilização de CI. A suspensão do tratamento com CI pode levar à deterioração do estado de controle da asma12-14.
Os efeitos colaterais sistêmicos dos CI são habitualmente observados com utilização de doses altas por tempo prolongado, e são eles: perda de massa óssea, inibição do eixo hipotálamo-hipófise-adrenal, e déficit de crescimento. Candidíase oral, disfonia e tosse crônica por irritação das vias aéreas superiores podem ser observadas com qualquer dose, e são reduzidas se a recomendação de higiene oral após o uso da medicação for seguida. Outro efeito do corticoide sistêmico é a redução do número e da ação dos eosinófilos15-18.
Em pacientes no step 5 da GINA, podem ser indicadas as terapias com anticorpos monoclonais, baseando-se no fenótipo da asma, associado às medicações inalatórias para conseguir melhor controle da doença1.
O objetivo principal deste estudo foi avaliar a ação do corticoide inalado sobre os eosinófilos periféricos (EoP).
MÉTODOS
Foi realizada para este estudo uma análise retrospectiva de prontuários eletrônicos de pacientes adultos com diagnóstico de asma grave steps 4 e 5 da GINA 2019, acompanhados em centro terciário de referência.
Os pacientes em uso de corticoide oral atual ou nos últimos três meses foram excluídos. Foram avaliados os dados demográficos, a dose de budesonida inalada ou dose correspondente à budesonida, a sensibilização a aeroalérgenos, a IgE total (valores normais: até 100 UI/mL), o cortisol sérico (valores normais: 5,4 a 17 µg/dL) e eosinófilos periféricos (EoP) (valores normais: 0 a 500 cel/mm3), no período de 2010 a 2019.
O cortisol sérico foi mensurado para se avaliar a possível inibição do eixo hipotálamo-hipófise nos pacientes eu uso de CI em doses elevadas. Apenas os pacientes que possuíam cortisol sérico dosado foram incluídos. A dose de budesonida inalada diária foi avaliada na mesma data que o hemograma havia sido realizado, para avaliação da EoP.
Foi analisada a correlação entre CI e cortisol sérico, e entre CI e o nível de EoP.
Análise estatística
As características dos pacientes e dos exames laboratoriais foram avaliadas por um método descritivo. Para a correlação entre os valores da dose de CI e cortisol e da dose de CI e EoP foi realizado o método de Pearson. O valor de p < 0,05 foi considerado estatisticamente significativo.
RESULTADOS
Foram avaliados 58 pacientes asmáticos graves, nos steps 4 e 5 da GINA, que haviam sido submetidos a dosagem de EoP e cortisol sérico. Destes pacientes, 47 (81,0%) eram do gênero feminino. A média de idade era de 61,0 anos (DP 12,1 anos), e média de tempo de asma de 43,6 anos (DP 16,4 anos). Estes dados podem ser observados na Tabela 1.
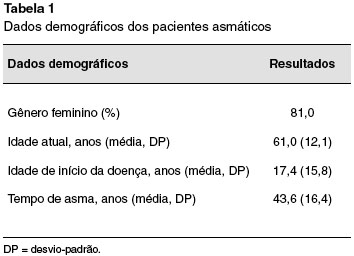
Todos os pacientes haviam realizado a dosagem de cortisol sérico, na vigência de CI, porém sem o uso atual ou recente de corticoide sistêmico. Todos os pacientes incluídos neste estudo mantinham a dose de CI estável por mais de 3 meses quando o hemograma foi avaliado juntamente com a média da dose de budesonida.
A média da dose de CI (correspondente à de budesonida) era de 1537,9 (variação de 800-2400) µg/dia. A mediana de IgE sérica total do grupo foi de 216,0 UI/mL (variação de 6,8-3085 UI/mL), e a IgE específica para aeroalérgenos estava presente em 40 pacientes (69,0%), e, destes, 85% eram sensibilizados para ácaros da poeira doméstica. A média do cortisol sérico foi de 5,6 µg/dL (DP 4,9 µg/dL) e dos EoP de 222,2 cel/mm3 (DP 175,8 cel/mm3). As características laboratoriais de todos os pacientes e a frequência de IgE específica para aeroalérgenos dos asmáticos estão na Tabela 2 e na Figura 1.
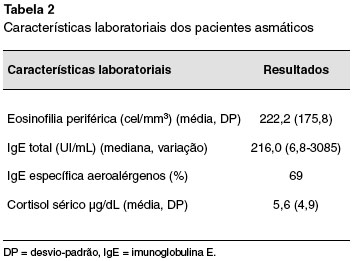
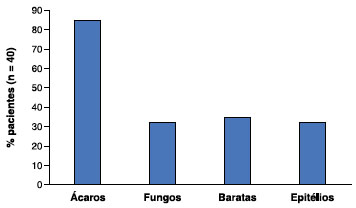
Figura 1 Frequência de positividade de IgE específica conforme o grupo de aeroalérgenos, para os pacientes com asma alérgica (n = 40, 69% dos pacientes)
Os pacientes com asma foram classificados conforme a dose de CI utilizada no momento da dosagem de EoP, correspondente à dose de budesonida inalada, sendo divididos segundo os seguintes grupos: 800, 1200, 1600, 2000 e 2400 µg/d. Estes dados podem ser observados na Figura 2. Do mesmo modo, os pacientes com asma foram classificados conforme o nível de EoP, com variação de 0 a 750 cel/mm3 (Figura 3).
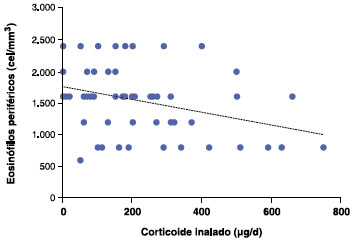
Figura 2 Classificação dos pacientes asmáticos conforme a dose de corticoide inalatório (CI) (µg/d)
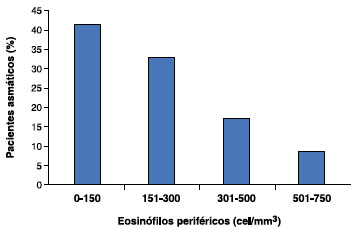
Figura 3 Classificação dos pacientes asmáticos conforme a eosinofilia periférica
Neste estudo não foi observada correlação entre a dose de CI e o cortisol sérico. Entretanto, 41,4% dos pacientes apresentaram EoP < 150 cel/mm3, e houve uma correlação inversa significante entre as doses de CI e os níveis de EoP (p = 0,011; r2 = 0,11), ou seja, quanto maior a dose de CI, menor o nível de EoP, como mostrado na Figura 4.

Figura 4 Correlação entre dose de corticoide inalatório e eosinofilia periférica (correlação de Pearson r2 = 0,11; p = 0,011)
DISCUSSÃO
Este estudo avaliou a correlação entre os níveis de eosinófilos periféricos e a dose de CI utilizada por um grupo de pacientes com asma grave acompanhado em um serviço terciário de Imunologia Clínica e Alergia. Foram incluídos 58 pacientes, sendo a maioria mulheres com história de asma de longa data.
Avaliamos apenas pacientes com asma grave, alérgicos ou não, em uso de CI ≥ 800 µg/dia, associado ao broncodilatador de longa duração. A dose de CI utilizada em maior frequência foi de 1600 µg/d (40% dos pacientes). Neste estudo, encontramos uma boa correlação negativa entre EoP e CI.
Yii ACA e cols.19 observaram que o nível de EoP, coletado quando um paciente chega a um pronto-socorro por crise grave de asma, se correlacionava com a gravidade da insuficiência respiratória, além de prever o risco de exacerbações subsequentes. O aumento do nível de EoP estava significativamente associado à diminuição do pH arterial e ao aumento da PCO2 arterial.
Conforme consensos internacionais, o tratamento para asma grave (refratária ao tratamento), step 5 pela GINA1, inclui a adição de imunobiológicos ao tratamento convencional, corticoide inalado associado ao broncodilatador de longa duração. O imunobiológico utilizado há mais tempo no tratamento da asma grave tem como alvo a IgE total. Para o uso do omalizumabe, um anticorpo monoclonal anti-IgE, se faz necessário que o paciente tenha um diagnóstico de asma alérgica grave, além de níveis de IgE total entre 30 e 1500 UI/mL, e peso corporal entre 20 e 150 kg, parâmetros que serão utilizados para o cálculo da dose da anti-IgE, porém, esta indicação é independente do nível sérico de eosinófilos20.
Entretanto, novos medicamentos imunobiológicos surgiram como opção terapêutica para os pacientes com asma grave. Dentre eles, medicamentos que apresentam como alvos as citocinas e seus receptores em vias finais de inflamação, em especial IL-4, IL-5 e IL-13. Também o TSLP e a IL-33 têm recentemente sido estudados como alvos terapêuticos21.
Alguns anticorpos monoclonais incluem como critério de tratamento níveis de EoP entre 150 ou 300 cel/mm322-23. Nosso estudo observou que mais de 40% dos pacientes apresentavam um valor de EoP inferior a 150 cel/mm3. Fato este que pode estar relacionado ao uso de altas doses de CI. Além disso, nosso estudo encontrou uma correlação inversa, estatisticamente significante, entre os níveis de EoP e a dose de CI utilizada pelo paciente na época da realização do exame.
Devido às altas doses do CI usado na grande maioria dos pacientes dos steps 4 e 5, algumas vezes, inclusive mais altas do que a recomendação habitual, os níveis de eosinófilos séricos podem estar diminuídos; interferindo na recomendação de alguns mAbs, e excluindo assim, o uso de uma terapêutica promissora, que possibilita maior controle dos sintomas, redução do risco de exacerbações, e melhora da qualidade de vida.
REFERÊNCIAS
1. 2019 GINA Pocket guide for Asthma Management and Prevention, Global Initiative for Asthma, 2019. Disponível em: https://ginasthma.org/gina-reports/. Acesso em: abril/2019.
2. Moore WC, Peters SP. Severe asthma: an overview. J Allergy Clin Immunol. 2006;117:487-94.
3. Global Initiative for Asthma. Global strategy for asthma management and prevention. NHI publication 2005. National Institutes of Health/National Heart, Lung and Blood Institute [Internet]. Disponível em: www.ginasthma.org.
4. Wenzel S, Szefler SJ. Managing severe asthma. J Allergy Clin Immunol. 2006;117:508-11.
5. Price D, Rigazio A, Campbell JD, Bleecker ER, Corrigan CJ, Thomas M, et al. Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study. Lancet Respir Med. 2015;3:849-58.
6. Demarche SF, Schleich FN, Paulus VA, Henket MA, van Hees TJ, Louis RE. Asthma control and sputum eosinophils: a longitudinal study in daily practice. J Allergy Clin Immunol Pract. 2017;5:1335-43.
7. Matucci A, Vultaggio A, Maggi E, Kasujee I. Is IgE or eosinophils the key player in allergic asthma pathogenesis? Are we asking the right question? Respir Res. 2018 Jun 8;19(1):113.
8. Bateman ED, Reddel HK, O'Byrne PM, Barnes PJ, Zhong N, Keen C, et al. As-needed budesonide-formoterol versus maintenance budesonide in mild asthma. N Engl J Med. 2018;378:1877-87.
9. O'Byrne PM, FitzGerald JM, Bateman ED, Barnes PJ, Zhong N, Keen C, et al. Inhaled combined budesonide-formoterol as needed in mild asthma. N Engl J Med. 2018;378:1865-76.
10. Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON,et al. Mepolizumab for severe eosinophilic asthma (DREAM): A multicentre, double-blind, placebo-controlled trial. Lancet. 2012;380:651-9.
11. Szefler S, Weiss S, Tonascia J, Akinson NF, Bender B, Cherniack R, et al. Long-term effects of budesonide or nedocromil in children with asthma. The Childhood Asthma Management Program Research Group. N Engl J Med. 2000;343:1054-63.
12. Pauwels RA, Lofdahl CG, Postma DS, Tattersfield AE, O'Byrne P, Barnes PJ, et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma. Formoterol and Corticosteroids Establishing Therapy (FACET) International Study Group. N Engl J Med. 1997;337:1405-11. Erratum in: N Engl J Med. 1998;338:139.
13. Suissa S, Ernst P, Benayoun S, Baltzan M, Cai B. Low-dose inhaled corticosteroids and the prevention of death from asthma. N Engl J Med. 2000;343:332-6.
14. Waalkens HJ, Van Essen-Zandvliet EE, Hughes MD, Gerritsen J, Duiverman EJ, Knol K, et al. Cessation of long-term treatment with inhaled corticosteroid (budesonide) in children with asthma results in deterioration. The Dutch CNSLD Study Group. Am Rev Respir Dis. 1993;148:1252-7.
15. Powell H, Gibson PG. Inhaled corticosteroid doses in asthma: an evidence-based approach. Med J Aust. 2003;178:223-5.
16. Szefler SJ, Martin RJ, King TS, Boushey HA, Cherniack RM, Chinchilli VM; Asthma Clinical Research Network of the National Heart Lung, and Blood Institute. Significant variability in response to inhaled corticosteroids for persistent asthma. J Allergy Clin Immunol. 2002;109:410-8.
17. Lipworth BJ, Kaliner MA, LaForce CF, Baker JW, Kaiser HB, Amin D, et al. Effect of ciclesonide and fluticasone on hypothalamic-pituitary-adrenal axis function in adults with mild-to-moderate persistent asthma. Ann Allergy Asthma Immunol. 2005;94:465-72.
18. Malone R, LaForce C, Nimmagadda S, Schoaf L, House K, Ellsworth A, et al. The safety of twice-daily treatment with fluticasone propionate and salmeterol in pediatric patients with persistent asthma. Ann Allergy Asthma Immunol. 2005;95:66-71.
19. Yii ACA, Tay TR, Puah SH, Lim HF, Li A, Lau P, et al. Blood eosinophil count correlates with severity of respiratory failure in life-threatening asthma and predicts risk of subsequent exacerbations. Clin Exp Allergy. 2019;49:1578-86.
20. Pelaia G, Canonica WG, Matucci A, Paolini R, Triggiani M, Paggiaro P. Targeted therapy in severe asthma today: focus on immunoglobulin E. Drug Design Develop Ther. 2017;11:1979-87.
21. Solé D, Sano F, Rosário NA, Antila MA, Aranda CS, Chong-Neto HJ, et al. Guia prático de atualização: medicamentos biológicos no tratamento da asma, doenças alérgicas e imunodeficiências. Arq Asma Alerg Imunol. 2019;3(3):207-58.
22. Giannetti MP, Cardet JC. Interleukin-5 Antagonists Usher in a New Generation of Asthma Therapy. Curr Allergy Asthma Rep. 2016;16:80.
23. Manka LA, Wechsler ME. New biologics for allergic diseases. Expert Rev Clin Immunol. 2018;14(4):285-96.



