Número Atual: Outubro-Dezembro 2019 - Volume 3 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Maria Anita C. Spindola
- Dirceu Solé
- Marcelo Aun
- Liana Maria Tôrres de Araújo Azi
- Luiz A. G. Bernd
- Daniela Bianchi
- Albertina V. Capelo
- Debora Cumino
- Alex E. Lacerda
- Luciana Lima
- Edelton F. Morato
- Rogean Nunes
- Norma P. M. Rubini
- Jane da Silva
- Maria Angela Tardelli
- Alessandra S. Watanabe
- Erick Curi
- Flávio Sano
ARTIGO ESPECIAL
Atualização sobre reações de hipersensibilidade perioperatória: Documento conjunto da Sociedade Brasileira de Anestesiologia e Associação Brasileira de Alergia e Imunologia – Parte I: Tratamento e orientação pós-crise
Update on perioperative hypersensitivity reactions: Joint document from the Brazilian Society of Anesthesiology and Brazilian Association of Allergy and Immunology - Part I: Post-event management and guidance
Maria Anita C. Spindola1; Dirceu Solé2; Marcelo Aun2; Liana Maria Tôrres de Araújo Azi1; Luiz A. G. Bernd2; Daniela Bianchi1; Albertina V. Capelo2; Debora Cumino1; Alex E. Lacerda2; Luciana Lima1; Edelton F. Morato1; Rogean Nunes1; Norma P. M. Rubini2; Jane da Silva2; Maria Angela Tardelli1; Alessandra S. Watanabe2; Erick Curi1; Flávio Sano2
DOI: 10.5935/2526-5393.20190051
1. Sociedade Brasileira de Anestesiologia - SBA
2. Associação Brasileira de Alergia e Imunologia - ASBAI
Endereço para correspondência:
Liana Maria Tôrres de Araujo Azi
E-mail: liana.araujo@ufba.br
Submetido em: 03/12/2019
Aceito em: 15/12/2019.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Especialistas da Associação Brasileira de Alergia e Imunologia (ASBAI) e da Sociedade Brasileira de Anestesiologia (SBA), interessados no tema anafilaxia perioperatória, reuniram-se com o objetivo de intensificar a colaboração entre as duas sociedades no estudo desse tema e elaborar um documento conjunto que possa guiar ambos os especialistas. O objetivo desta série de dois artigos foi mostrar as evidências mais recentes alicerçadas na visão colaborativa entre as sociedades. Este primeiro artigo versará sobre as definições mais atuais, formas de tratamento e as orientações após a crise no perioperatório. No próximo artigo serão discutidos os principais agentes causais e a condução da investigação com testes apropriados.
Descritores: Alergia e imunologia, hipersensibilidade, anafilaxia, período perioperatório.
INTRODUÇÃO
As reações de hipersensibilidade no período perioperatório são motivo de grande preocupação para os anestesiologistas. Todos os dias, a cada procedimento sob anestesia, são administrados, sequencialmente, diversos agentes que podem desencadear reações alérgicas de maior ou menor gravidade. É difícil traçar uma estimativa de incidência desses eventos devido à heterogeneidade dos estudos e variedade de medicações utilizadas entre os países. Acredita-se que a incidência de reações de hipersensibilidade perioperatórias variem entre 1:353 e 1:18.600 procedimentos1,2.
A mortalidade é mais alta do que em anafilaxias por outras causas, e varia de 3 a 9%3. No Brasil, um estudo transversal obtido por resposta a um questionário (embora sem posterior investigação) apontou incidência de anafilaxia maior de 7:10.000 anestesias, maior que a citada anteriormente na literatura4. O maior fator de risco para uma reação de hipersensibilidade perioperatória é uma reação anterior, não corretamente investigada5,6. Para conduzir essa investigação, a interação entre anestesiologistas, alergistas e imunologistas é de primordial importância.
Poucos países apresentam abordagem organizada para diagnóstico, tratamento e investigação de reações suspeitas de alergia no período perioperatório, com a publicação de orientações conjuntas que possam guiar ambas as especialidades7,8.
MÉTODO
Foi realizada pesquisa na base de dados PubMed, nos idiomas inglês, francês, espanhol e italiano, nos últimos 20 anos, com a combinação dos termos "perioperatório", "anafilaxia", "manuseio", "tratamento", "protocolos", "anestesia", "alergia" e "hipersensibilidade". Os artigos foram selecionados de acordo com a sua relevância e atualidade clínica.
NOMECLATURA
A nomenclatura em Medicina é alterada ao longo do tempo, de acordo com a aquisição de nova realidade científica8. A questão do emprego de nomenclatura correta para pesquisa e planejamento de ações globais de saúde é de enorme relevância, ainda mais em se tratando de reações de hipersensibilidade a drogas, um problema de saúde em expansão em todo o mundo.
Assim, a Organização Mundial de Saúde (OMS), na sua Classificação Internacional de Doenças, OMS CID-11 já trará avanços como o uso pioneiro da subseção de hipersensibilidade a drogas9. Esse cuidado poderá traduzir-se em melhor registro até mesmo de casos fatais10.
A nomenclatura utilizada nesse trabalho está de acordo com a nomenclatura revisada de alergia11. Termos obsoletos (como, por exemplo, anafilactoide) devem ser abandonados por não estarem em harmonia com a classificação e novos conceitos de mecanismos12. Dessa forma, os conceitos utilizados neste artigo obedecem as definições propostas por Johansson e cols.11, de 2004:
– hipersensibilidade: sinais ou sintomas reprodutíveis, iniciados por exposição a um estímulo definido, em doses toleradas por indivíduos normais;
– alergia: reação de hipersensibilidade desencadeada por mecanismo imunológico específico;
– anafilaxia: reação de hipersensibilidade grave, sistêmica ou generalizada, com risco à vida.
O termo "alergia" só deve ser empregado se um mecanismo IgE ou IgG mediado, ou imuno-complexo relacionado ao complemento puder ser comprovado. Embora possa parecer paradoxal, pode-se empregar a expressão anafilaxia não alérgica para os casos em que esses mecanismo não puderam ser comprobados11.
ASPECTOS CLÍNICOS E CLASSIFICAÇÃO DA GRAVIDADE
I - Adultos
A diversidade de apresentações clínicas de hipersensibilidade perioperatória são resultado dos diferentes mecanismos patofisiológicos nela envolvidos, imunológicos ou não imunológicos, aliados às comorbidades e às doenças que determinaram a cirurgia. A variabilidade desses arranjos constitui-se um desafio para o anestesiologista que está atendendo o paciente.
Em virtude das questões éticas que impedem a indução de anafilaxia em humanos, da variabilidade e da liberação em conjunto dos mediadores da anafilaxia, é muito difícil especificar os efeitos de cada mediador em particular7,12.
A partir de alguns efeitos de seus principais mediadores até agora conhecidos, porém, pode-se esperar sinais e sintomas da anafilaxia. Há evidências de que a histamina, leucotrienos e fator ativador de plaquetas (PAF) estejam envolvidos na vasodilatação, extravasamento capilar e broncoespasmo12.
O diagnóstico presuntivo de uma reação de hipersensibilidade é clínico, baseado no aparecimento de manifestações primariamente afetando os sistemas cardiovascular, respiratório e tegumentar. A apresentação particular dependerá do arranjo entre a ação farmacológica decorrente das várias substâncias em sequência, a liberação de mediadores e a condição prévia do paciente.
A escala clínica, apresentada em 1977 no estudo sobre coloides13 foi adaptado pela Société Française d'Anesthesie et Réanimation (SFAR) e permanece como um guia valioso para classificar a gravidade da reação de acordo com a intensidade do quadro14-16.
No período perioperatório, os sinais cardiovasculares e respiratórios podem ser rapidamente progressivos17. O colapso cardiovascular pode ser a única manifestação, e a parada cardiorrespiratória, o evento inicial18. A ausência de sinais cutâneos (eritema generalizado, urticária) não descarta o diagnóstico3, e podem aparecer apenas quando a perfusão for restabelecida7. Quando houver hipotensão ou taquicardia como sinais isolados, inesperados e que não respondem ao tratamento habitual, deve-se suspeitar de possível reação de hipersensibilidade. Pacientes com doença cardíaca pré-existente ou em uso de betabloqueadores estão mais propensos a desenvolver hipotensão grave ou choque15. A bradicardia também pode ocorrer19. O início da bradicardia pode estar relacionado a extravasamento vascular rápido com subsequente hipovolemia e reflexo de Bezold-Jarish20.
Associados a reações de hipersensibilidade imediata podem ocorrer eventos coronarianos agudos, denominados angina alérgica ou síndrome de Kounis, decorrentes da liberação de mediadores pelos mastócitos cardíacos21,22.
Embora o broncoespasmo seja mais comum em pacientes com hiper-reatividade de vias aéreas de base, como asma, doença pulmonar obstrutiva crônica ou obesidade7, em relato de série de pacientes com história de asma e anafilaxia intraoperatória, os resultados da regressão logística permitiram sugerir que o broncoespasmo durante a anestesia deve ser atribuído também à anafilaxia, e não exclusivamente à história de asma do paciente. Além disso, verificou-se também que não era a incidência de broncoespasmo que estava aumentada, mas sim a gravidade das reações23.
No início de um quadro de hipersensibilidade, é muito difícil predizer a velocidade de progressão ou a intensidade da reação24. Por essa razão, o diagnóstico precoce presuntivo na vigência de hipotensão e broncoespasmo não responsivos às medidas habituais ou de parada cardíaca inesperada para aquele quadro ou momento cirúrgico, deve ser considerado25,26, e o raciocínio para o diagnóstico diferencial iniciado.
Podemos dizer que as reações IgE-mediadas são associadas à maior gravidade, mas, isoladamente, não é possível definir se uma reação foi mediada por IgE ou não baseados na gravidade inicial24.
As reações Grau III e IV (Tabela 1), multissistêmicas, preenchem os critérios de anafilaxia, de risco à vida e, muito provavelmente, são mediadas por IgE15,27.
Diagnóstico diferencial
O diagnóstico diferencial com condições não relacionadas à hipersensibilidade pode ser dificultado por fatores listados na Tabela 228.
Dentre as várias condições que podem confundir-se com hipersensibilidade, algumas estão listadas na Tabela 3. Além disso, a relação temporal pode fornecer alguns indícios sobre o(s) agente(s) desencadeante(s)29-31 (Tabela 4).
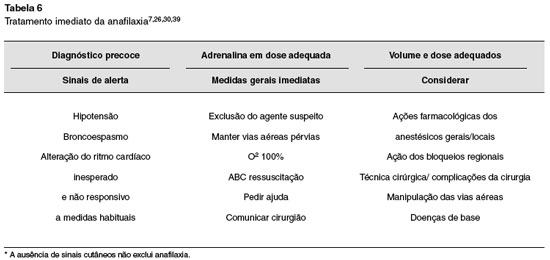
Tratamento imediato (em anestesia)
Os pilares do tratamento de uma reação de hipersensibilidade imediata são: reconhecimento precoce; adrenalina em doses adequadas e reposição adequada do volume intravascular 7. O diagnóstico é presuntivo, baseado em sinais clínicos, como já citado. Independentemente do mecanismo, se IgE dependente ou não, no início de um quadro de anafilaxia são difíceis de prever a velocidade de progressão e a gravidade do quadro. A fatalidade pode ocorrer em minutos7,24, razão pela qual não se deve esperar pelo comprometimento multissistêmico para iniciar o tratamento32.
Adrenalina
A adrenalina é a única medicação que reduz hospitalização e morte em caso de reação anafilática33. Cogita-se que a supressão da liberação de mediadores pelos mastócitos e basófilos, um de seus efeitos beta-adrenérgicos, explicaria sua indicação precisa32. Quanto ao uso de adrenalina em pacientes com doença cardiovascular, faz-se necessário recordar que o coração é órgão-alvo na anafilaxia. Os mastócitos estão presentes no miocárdio e na íntima das artérias coronarianas. A liberação de histamina, leucotrienos e prostaglandinas pode ocasionar espasmo coronariano, sendo possível a ocorrência de infarto de miocárdio, arritmias ou ambos33, mesmo que a adrenalina não tenha sido administrada34. Assim, não há contraindicação absoluta ao uso de adrenalina em anafilaxia em qualquer situação35.
A parada cardiorrespiratória ocorre em até 5 minutos nos casos de anafilaxia iatrogênica36, portanto não se deve aguardar o agravamento do quadro para iniciar o tratamento. Mesmo sendo os anestesistas especialistas habituados ao uso diário de adrenalina intravenosa (IV) e em infusão, o uso de adrenalina intramuscular (IM) é recomendado por consensos sobre anafilaxia perioperatória, enquanto se espera o preparo da diluição, da monitorização, ou caso tenha ocorrido perda do acesso venoso7,26.
É importante lembrar que iniciar o tratamento com adrenalina IM alia rapidez e segurança, com menor risco de sobredose37 e esses são fatores importantes para o desfecho, visto que em grandes séries sobre fatalidades em anafilaxia, somente 23% dos pacientes que foram a óbito haviam recebido adrenalina antes da parada cardíaca38. A experiência prévia em repetir doses de vasopressor para tratar hipotensão e o fenômeno de negação da crise ao negar a necessidade de adrenalina podem explicar a relutância e o retardo na adminstração da adrenalina39, mas não justificá-la.
O local para aplicação da adrenalina é na coxa, no terço médio do músculo vasto lateral26.
Qualquer que seja a via empregada, a dose de adrenalina deve ser expressa em microgramas e não em razão (1:1000), fator que tem sido identificado como fonte de erro na administração de medicamentos32,39,40.
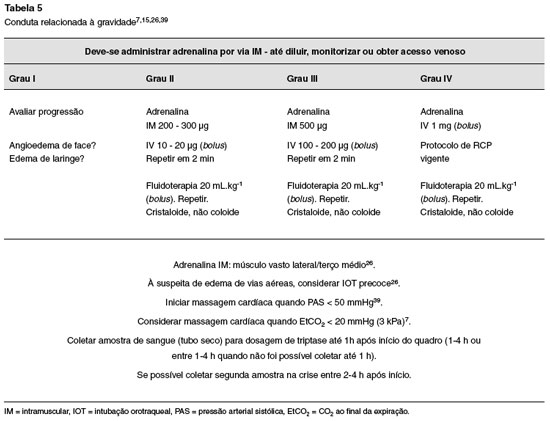
O tratamento das reações de hipersensibilidade imediata no período perioperatório está sumarizado nas Tabelas 5 e 6.
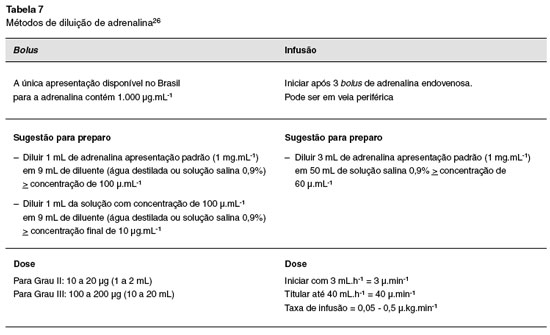
Há diversos métodos para diluição correta de adrenalina; o seu conhecimento deve fazer parte dos protocolos de treinamento para anafilaxia perioperatória7. A única apresentação disponível no Brasil para a adrenalina contém 1000 µg.mL-1.
Algumas publicações recentes, realizadas por grupos nacionais26,30 ou multinacionais7,25 recomendam um "kit anafilaxia", contendo folhetos/cartões com as informações descritas a seguir.
– Algoritmos simples para tratamento.
– Diagnóstico diferencial.
– Esquemas de doses, vias e diluição de adrenalina (Tabela 7) e outros vasopressores.
– Instruções para obtenção de amostras sanguíneas (tipo de tubo, instruções de como e para onde encaminhá-las).
– Ficha para anotação das medicações/medidas tomadas, entre outras. Algumas orientações desse consenso foram elaboradas nos moldes dessas recomendações acima, e algumas delas devem ser enfatizadas:
1) no grau I SFAR não há indicação imediata do uso de adrenalina. Deve-se permanecer alerta, pois na suspeita de agravamento, o tratamento precoce deve ser instituído26;
2) são sinais de agravamento, para adultos26:
– pressão arterial sistólica (PAS) < 60 mmHg26. Recomenda-se iniciar compressão cardíaca com PAS < 50 mmHg7,39;
– taqui ou bradiarritmias com risco à vida;
– saturação de oxigênio < 90%;
– grande dificuldade para insuflação pulmonar;
– pressão inspiratória > 40 cm H2O;
– EtCO2 baixo. É considerado uma estimativa de baixo débito cardíaco baixo e tem sido utilizado como preditor de gravidade de anafilaxia41. Sugere-se iniciar massagem cardíaca de imediato7;
– edema de vias aéreas. Caso haja suspeita, considerar intubação traqueal precoce26;
3) administração intravenosa de volume. A reposição agressiva de volume é um passo essencial para assegurar fluxo sanguíneo adequado aos órgãos vitais26. Na anafilaxia grave, a má distribuição e a hipovolemia culminam com redução do retorno venoso e falência circulatória12. Recomenda-se 20 mL.kg-1, repetindo-se caso necessário20,26. A recomendação da administração rápida de 500 mL de cristaloide para reações Grau II e 1000 mL para Grau III, devendo ser repetida em caso de resposta inadequada, é citada por vários autores7,15,25,26,30,39;
4) para o Grau IV, seguir o protocolo de reanimação vigente;
5) observação importante deve ser feita em relação ao posicionamento do paciente, que deve ser colocado em posição supina tão logo quanto possível quando manobras de reanimação são necessárias26, com elevação dos membros inferiores15.
Anafilaxia refratária
Não há uma caracterização definida para refratariedade, mas passados 10 minutos de tratamento com doses adequadas de adrenalina e volume sem a resposta esperada, está indicada a reavaliação e provável adição de estratégias42,43.
Além de inclusão de outras opções terapêuticas e de manuseio, a revisão do diagnóstico diferencial e a verificação se houve descontinuação do possível antígeno, são essenciais26,30. Em alguns dos casos descritos, agentes como gelatinas e cateter venoso central impregnado por clorexidina não foram retirados, e, em outros, uma segunda dose do antígeno ainda foi administrado39.
Deve-se estar atento aos fatores de risco para reações fatais. Achado significativo foi a associação de idade aumentada, estado físico segundo a American Society of Anaesthesiology (ASA), obesidade mórbida, doença arterial coronariana e uso de betabloqueadores ou de inibidores da enzima conversora de angiotensina39. Outro estudo chama a atenção para asma e malignidade na história médica. A alta taxa de malignidade em pacientes com anafilaxia refratária pode ser fator de confusão. Esse fator pode ser pelo uso de quimioterápicos ou por ocorrência de malignidade em pacientes mais idosos, por serem menos propensos fisiologicamente a compensar um choque anafilático44. Esses grupos necessitam maiores níveis de alerta.
Na Tabela 8 são apresentadas outras opções para o tratamento no caso de anafilaxia refratária7,26,30.
Nos casos de anafilaxia refratária, outras medidas, além da medicação, são indicadas:
1. estabelecer uma linha arterial, tanto para auxiliar na monitorização como para permitir coleta de amostras sanguíneas3,26;
2. ecografia transtorácica ou transesofágica, quando disponíveis, para melhor avaliação de função ventricular26;
3. quando disponível no ambiente cirúrgico, a circulação extracorpórea pode ser usada como parte do processo de ressuscitação7,26,39,45;
4. o sugamadex, anteriormente apresentado como uma alternativa miraculosa no tratamento de anafilaxias não só ao rocurônio, até o momento não apresenta evidências que justifiquem seu emprego no tratamento de anafilaxia7,39,46,47.
Particularidades nas gestantes
A anafilaxia é incomum durante a gestação (aproximadamente 3 para cada 100.000 nascimentos, em estudos dos Estados Unidos e do Reino Unido)48. Os principais agentes envolvidos são os antibióticos betalactâmicos, o látex e os bloqueadores neuromusculares39. Importante destacar que, no cenário obstétrico, muitas outras causas podem ocasionar hipotensão profunda e dificultar o diagnóstico. O reconhecimento precoce e o rápido início do tratamento são fundamentais49.
As principais condutas envolvem:
– deslocamento manual do útero para a esquerda, objetivando a descompressão aorto-cava é a medida fundamental. Deve ser mantida enquanto se aplica massagem cardíaca50;
– embora a fenilefrina seja o vasopressor recomendado para utilização em hipotensão devida ao bloqueio regional51, na anafilaxia a adrenalina é a droga recomendada, em doses de acordo com a escala de gravidade14,26,39,48;
– o impacto na circulação uteroplacentária será curto em função da curta meia-vida da adrenalina52, e a sobrevivência fetal é maximizada pela ressuscitação materna48.
– iniciar rapidamente a reposição com cristaloides; grandes volumes podem ser necessários48;
– estabelecer via aérea e ventilá-la com FiO2 a 100% para compensar o aumento de consumo48. Estar ciente das particularidades da via aérea na gestante53;
– cesariana de emergência deve ser considerada após 5 minutos de falência circulatória, a despeito dos esforços para reanimação14;
– cesariana post-mortem deve ser indicada após 4 minutos de parada cardiorrespiratória materna48,54,55.
II - Crianças
Particularidades
Os desafios para o diagnóstico de anafilaxia perioperatória em crianças são semelhantes aos do adulto. O início dos sintomas pode ser retardado se o antígeno estiver em cateter revestido ou se a via de exposição for a pele; a perfusão periférica reduzida pode tornar ausentes as manifestações cutâneas, e campos cirúrgicos podem dificultar o exame e o acesso à via aérea56.
Estudo retrospectivo recente sobre anafilaxia perioperatória em crianças reuniu 29 casos, ocorridos durante 10 anos no Reino Unido, França e Estados Unidos. O colapso cardiovascular foi o primeiro sinal em 59% dos casos, seguido por taquicardia e broncoespasmo. Em 55% dos casos houve envolvimento em múltiplos sistemas, e em quatro casos, parada cardiorrespiratória58. Na coorte pediátrica do NAP6 do Royal College of Anaesthetists39, estudo realizado para caracterizar a incidência, fatores de risco, tratamento, resultados clínicos e investigação de anafilaxia perioperatória, foram relatados 11 casos de anafilaxia em crianças abaixo de 16 anos. Nestes, broncoespasmo e/ou alta pressão de vias aéreas foram os sinais iniciais identificados em 64 dos casos39. Esses achados contrastam com o estudo de Khaleva e cols.57, no qual a autora chama a atenção para o fato de que seus achados (em população com média de idade de 11 anos) foram similares aos dos pacientes adultos do NAP6 no que concerne a hipotensão como sinal mais frequente. O menor valor de pressão arterial registrado foi < 50 mmHg57,59. Nenhuma parada cardiorrespiratória ou morte ocorreu na coorte pediátrica do NAP659. Contrariamente ao proposto para os adultos39 não foi estabelecido nenhum valor de pressão arterial abaixo do qual a ressuscitação cardiorrespiratória deveria ser iniciada antes da ocorrência de parada cardíaca59.
Para a classificação de gravidade das reações, a escala de Ring e Messner (modificada da utilizada para os adultos14,15) tem sido utilizada57,60. Dos casos pediátricos evidenciados em um estudo francês61, as manifestações mais graves, com sintomas cardiovasculares e broncoespasmo, ocorreram nas reações IgE mediadas (Grau III), enquanto que as não mediadas, em sua grande maioria, foram classificadas como Grau I. Nesse mesmo estudo (realizado entre 1997 e 2004)61, quanto aos agentes implicados, o látex ocupava o primeiro lugar. Em dois estudos publicados recentemente e bloqueadores neuromusculares e antibióticos ocupam as primeiras posições57,59.
Tratamento imediato (durante anestesia)
O manejo das suspeitas de reações alérgicas perioperatórias envolve três etapas principais: diagnóstico oportuno, dosagem apropriada de epinefrina e reposição adequada de volume intravascular (Tabela 9).
As diretrizes de alergia perioperatória são consistentes quanto às seguintes recomendações: reações Grau I não requerem tratamento com epinefrina7,26.
Em todas as reações alérgicas recomenda-se a abordagem sistemática (ABCD): pedir ajuda; monitorar, manter a via aérea pérvia, realizar intubação precoce quando há risco de edema; verificar a respiração, administrar oxigênio a 100% e instituir ventilação mecânica controlada na vigência de insuficiência respiratória; manter circulação e drogas: administrar adrenalina inicialmente por via IM até que se puncione um acesso venoso e até que se dilua adrenalina para administração IV, não retardando sua utilização7,26. Interromper a cirurgia, remover possíveis gatilhos, reduzir anestésicos inalatórios e elevar os membros inferiores no quadro de hipotensão, são medidas importantes7,26.
Programas para implementar o conhecimento e o treinamento nas doses corretas de adrenalina para o manuseio dos casos de anafilaxia pediátrica devem ser estimulados62.
Como nos adultos, o manejo da anafilaxia perioperatória em crianças é guiado pela apresentação clínica (Tabela 5). A fluidoterapia com cristaloides (20 mL.kg-1), repetida conforme necessário, é recomendada, aquecido se possível. As recomendações atuais estão apresentadas na Tabela 57,26.
A adrenalina é a medicação de escolha como primeira linha de tratamento para quadros de anafilaxia. Pode salvar vidas quando administrado o mais rapidamente possível, e assim que a anafilaxia for diagnosticada. Além de seu efeito vasoconstrictor, ela previne ou reduz o edema das vias aéreas (edema laríngeo), a hipotensão e o choque. É um importante broncodilatador e apresenta efeitos inotrópicos e cronotrópicos63.
As crianças respondem de maneira uniforme à adrenalina. Sua administração por via intramuscular na porção lateral da coxa pode reduzir o tempo de hospitalização, assim como a morbimortalidade, por ser uma via que permite a rápida administração e independe de acesso prévio. Além disso, quando administrada por via intramuscular, seu pico de ação é atingido mais rapidamente que quando administrada por via subcutânea, e não está associada a efeitos adversos graves nas crianças, sendo considerada dez vezes mais seguro que quando administrado por via endovenosa37. Vários outros medicamentos (noradrenalina, vasopressina e glucagon) são recomendados como tratamento nos casos onde a anafilaxia é refratária à epinefrina, a exemplo dos adultos26.
Caso solução coloidosmótica seja indicada, o preferido é hidroxietilamido, por ser menos provável que desencadeie reações alérgicas. Não há evidências que recomendem fluidos contendo gelatina, o que é endossado pelo NAP659.
Broncoespasmo, como parte de uma reação anafilática, deve ser tratado com epinefrina seguindo os critérios mencionados anteriormente (intramuscular inicialmente e intravenosa somente após sua adequada diluição)37,64.
Tratamentos secundários para anafilaxia não foram estabelecidos em crianças. Embora seu papel na anafilaxia permaneça pouco claro, os corticosteroides são benéficos no manejo de outras doenças alérgicas65. Eles podem ser úteis nos casos em que há uma reação prolongada (dexametasona 0,1 a 0,4 mg.Kg-1, máximo 12 mg, e hidrocortisona 2 a 4 mg.Kg-1, máximo 200 mg)7,26.
Não há evidência clara de que bloqueadores H1 ou H2 (difenidramina ou ranitidina) alterem os desfechos anafiláticos em crianças. Não se recomenda o uso IV ou IM desses fármacos. Considerar o uso oral para tratamento sintomático do angioedema, urticária e prurido, em crianças não sedadas e capazes de ingerir o fármaco7,26.
A decisão de prosseguir ou interromper a cirurgia será determinada pela urgência cirúrgica, o grau de anafilaxia, a resposta ao tratamento e os sintomas de comorbidades subjacentes26.
Conduta pós-crise
– Administrar corticosteroides e anti-histamínicos.
– Coletar amostras para dosagem de triptase.
– Ponderar sobre continuar ou suspender o procedimento.
– Transferir o paciente para a unidade recomendada.
– Na alta, oferecer orientações escritas.
– Referenciar para um Serviço de Alergia.
As drogas administradas pós-crise não substituem as drogas de primeira linha como adrenalina, porém podem ser usadas em reações leves (Grau I)30.
Após a estabilização, os corticosteroides podem ser administrados como parte da terapêutica secundária26,30 após adequada ressuscitação12. Sua principal indicação na anafilaxia tinha como objetivo prevenir reações de fase tardia, ou bifásicas. Todavia, considerando os potenciais efeitos adversos dos corticosteroides e a falta de evidências convincentes de sua atuação na redução ou prevenção da reação bifásica, outros autores, em recente revisão sistemática de 31 estudos, não recomendam seu uso rotineiro em anafilaxia, embora os consensos de anafilaxia ainda recomendem os corticosteroides66.
Os anti-histamínicos podem ser utilizados, pois não foi demonstrado prejuízo com seu uso, apesar de não modificarem o desfecho7,39.
COLETA DE TRIPASE
A triptase é uma serina protease, produzida primariamente por mastócitos, e em menor extensão por basófilos e progenitores mieloides. Ela existe em quatro isoformas, porém somente os tipos alfa e beta (que é o principal) contribuem para seu valor sérico total67. Dados recentes do estudo NAP6 mostram que a coleta da triptase o mais precocemente possível, notadamente nos primeiros 15 minutos após a reação, logo após estabilização do paciente, são as associadas a maiores níveis de pico68. A recomendação mais recente reafirma a obtenção da primeira amostra em até 1 hora após o início da reação. É recomendado, também, a coleta de uma segunda amostra entre 2-4 horas pós-reação. Caso não seja possível obter as duas amostras, uma única amostra obtida dentro de 1-4 horas é conduta adequada7. A amostra de base para comparação deverá ser coletada 24 horas após a reação, ou mais tardiamente, no momento da realização dos testes cutâneos.
Para a interpretação dos resultados, foi recentemente validado o algoritmo que, além de ser consenso internacional, é também o mais efetivo. Em seus cálculos, os níveis da triptase, após a reação, devem ser maiores que [(1,2 x triptase basal) + 2] µg.L-1, podendo assim discriminar, no cenário perioperatório, entre evento anafilático e não anafilático69,70.
Amostras post-mortem podem ser utilizadas devida a alta estabilidade da triptase71.
Decisão para continuar o procedimento
Durante o episódio de anafilaxia pode ser difícil prever a velocidade de progressão, a gravidade e a duração da reação, bem como a recidiva da mesma após seu controle24. Porém, quando essa reação ocorre no início ou durante uma cirurgia, estabilizado o paciente após o tratamento efetuado, o grande dilema está em optar por continuar, abreviar ou suspender o procedimento proposto.
Essa é uma decisão individualizada, considerando-se alguns fatores72, tais como:
– estado físico (ASA) do paciente;
– urgência do procedimento (câncer versus cirurgia estética);
– gravidade da reação;
– rapidez da resposta ao tratamento.
É ainda importante ponderar se:
– o momento cirúrgico permite a interrupção, ou se finalizar o procedimento será menos impactante fisiologicamente para o paciente;
– a posição cirúrgica permite manobras de reanimação;
– a reação de hipersensibilidade poderá exacerbar complicações do procedimento (por exemplo, edema de alças em cirurgia para anastomose intestinal)73, ou, se em caso de cirurgia com grande sangramento antecipado, este poderá ser aumentado pela ativação de outras vias em decorrência de anafilaxia74.
Para aqueles pacientes cuja reação de hipersensibilidade foi de difícil estabilização, requerendo doses altas de adrenalina e/ou infusão prolongada de vasopressores, a suspensão da cirurgia parece clara.
As referências sobre o tema são escassas. Protocolos sobre anafilaxia em geral não abordavam esse tema. Em uma das publicações do NAP639, e no mais recente consenso internacional sobre conduta em suspeita de reações alérgicas perioperatórias7, os autores reportam-se ao estudo de Sadleir e cols.73 que, mesmo sendo observacional e com cirurgias de apenas três especialidades (vascular, otorrinolaringologia e neurocirurgia), classificou como indicadores de gravidade as doses de adrenalina necessárias à resolução do quadro, a admissão em unidade de terapia intensiva para ventilação mecânica e a duração dessa, além das sequelas relacionadas à hipersensibilidade, ou seja, aquelas não esperadas para o mesmo procedimento não complicado. O estudo de Sadleir e cols.73 observou que:
– nas reações de hipersensibilidade imediata Graus SFAR I e II, de risco baixo, após a resolução, do quadro, a cirurgia foi completada;
– no Grau III não foram encontradas diferenças significativas quanto a sequelas relacionadas à hipersensibilidade entre o grupo cuja cirurgia foi realizada (após terem o quadro resolvido) com aquele na qual ela foi interrompida;
– nos pacientes Grau IV, o procedimento foi completado apenas quando submetidos à cirurgia de urgência. Esta orientação é ratificada por outros autores7,39.
Também há riscos ao se postergar a cirurgia, pois o paciente não está isento de nova reação73, e o retardo para realização de nova cirurgia (avaliação do paciente se dará após 4-6 semanas do evento) pode ser prejudicial em caso de cirurgias oncológicas, por exemplo73,74.
Qualquer que seja a decisão a ser tomada, a mesma deverá ser amplamente discutida entre as equipes cirúrgica e anestésica, avaliando-se os riscos e benefícios para o paciente75. Para os casos genuinamente urgentes, que necessitem de cirurgia antes da realização da investigação, novamente uma ampla discussão entre as equipes anestésica e cirúrgica, avaliando relação risco-benefício e uma série de orientações detalhadas com o objetivo de minimizar o risco, deve ser realizada.
REGISTRO EM PRONTUÁRIO
A resolução 2174/2017 do Conselho Federal de Medicina76, que dispõe sobre a prática do ato anestésico, tem como objetivo aprimorar a segurança do procedimento anestésico e garantir a segurança do paciente. Ela estabelece, em seu art. 1ª, item III, a documentação mínima dos procedimentos anestésicos, relacionados à prescrição, evolução clínica e tratamento pré, intra e pós-anestésicos. Em seus Anexos II e III, a resolução detalha informações a serem registradas, desde as sobre alergias a fármacos e látex até o registro numérico dos dados vitais, soluções e fármacos administrados, além da descrição sucinta de intercorrências e eventos adversos associados ou não à anestesia com suas respectivas condutas. Esses registros estendem-se também ao período de recuperação pós-anestésica76. É importante que esta resolução, obrigatória para a prática anestésica, seja de conhecimento do alergista, que poderá solicitar maiores detalhes ao receber o paciente. O registro adequado no prontuário, não restrito à ficha de anestesia, é o primeiro passo para a avaliação posterior. Os principais dados que merecem registro são:
– o intervalo de tempo entre a última ou últimas drogas aplicadas e o aparecimento dos sintomas;
– a descrição detalhada dos sinais da reação;
– o tratamento necessário para a resolução do quadro;
– o tempo para a recuperação;
– as condições relacionadas ao paciente e não contempladas na ficha de anestesia.
Quanto a materiais específicos utilizados nas diversas especialidades cirúrgicas e que não fazem parte da ficha de anestesia, deverão ser listados na descrição cirúrgica, folha de gastos, para posterior análise em caso de evento adverso. Os anestesistas de cada especialidade cirúrgica podem auxiliar, conhecendo e registrando na ficha de anestesia substâncias como antibióticos presentes no cimento ósseo77 ou ainda aqueles de uso intracameral78. O registro adequado dessas substâncias, aplicadas por diferentes vias, é muitas vezes negligenciado. Esses componentes, porém, são elementos importantes quando da investigação de uma reação de hipersensibilidade. Uma maneira de reunir as informações sobre a reação e transmiti-las de forma padronizada ao alergista, é o formulário apresentado por Laguna e cols.30 que seria parte integrante do "kit de anafilaxia", já sugerido anteriormente7,26,39.
AÇÕES APÓS O TRATAMENTO
Após o tratamento e registro no prontuário das medidas tomadas, as providências posteriores são as descritas a seguir.
1. Conferir a coleta de material para exames biológicos
Como já visto anteriormente, a investigação durante a fase aguda consiste na coleta de sangue (em tubo seco) para dosagem da triptase. Esse é, no momento, o único exame a ser solicitado durante a crise, para posterior quantificação. Podem ser colhidas até duas amostras, no máximo nas primeiras 4 horas do início da reação18,79,80. Em média, são colhidos 4 mL para adultos, porém, para crianças, 0,5 mL são suficientes. Idealmente, as amostras devem ser centrifugadas e congeladas a -20 ªC, antes de serem enviadas ao laboratório de referência81. Outros exames (histamina, metil-histamina na urina) não são utilizados na prática devido a dificuldades na coleta e baixa sensibilidade30.
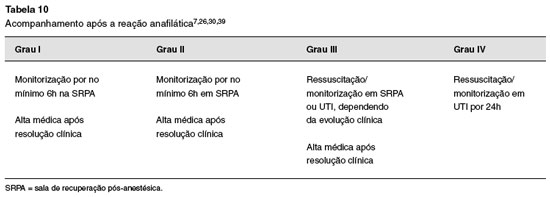
2. Definir para qual unidade o paciente será transferido
Pacientes que apresentaram reações leves (Grau I) ou moderadas (Grau II), cuja resolução com medicação foi rápida, ainda assim requerem um mínimo de 6 horas de observação26,82. A maioria dos pacientes com Grau III, particularmente aqueles com ressuscitação prolongada ou por necessidade da manutenção de vasopressores, e os pacientes Grau IV, requerem internação na Unidade de Terapia Intensiva7,39,82,83. A Tabela 10 resume o acompanhamento após uma reação.
3. Providenciar informação escrita a ser entregue ao paciente e/ou familiares
A comunicação ao paciente, quando recuperado, e aos seus familiares e/ou responsáveis é de vital importância para evitar a repetição desse evento adverso. De acordo com Harper e cols.39, a comunicação foi considerada falha, sendo que em 14% dos casos não foi dada nenhuma informação, e em 27% essa foi realizada apenas de forma oral. Esse fato ocorre comumente com os pacientes encaminhados ao Núcleo de Avaliação de Reações a Drogas da Universidade Federal de Santa Catarina, onde alguns dos autores exercem suas atividades28.
A informação escrita a ser oferecida pelo anestesista que assistiu ao paciente deverá informar o quadro clínico, medidas terapêuticas adotadas e seu resultado, e lista de substâncias a serem evitadas até a avaliação pelo alergista7,26,30,39. A investigação da reação, ocorrida em um cenário complexo como o perioperatório, requer algo muito além do conhecimento sobre valores negativos e positivos para os testes, podendo afetar a segurança das recomendações resultantes84. A Tabela 11 dispõe a conduta no momento da alta do paciente.

4. Encaminhar a um Serviço de Alergia para avaliação após reação
Indica-se a avaliação em clínicas especializadas, com a colaboração entre anestesistas e alergista7,15,25,26. A avaliação pelo alergista não pode ser substituída pelos algoritmos utilizados em farmacovigilância, uma vez que estes são baseados principalmente na história, e não são específicos para reações de hipersensibilidade85. A presunção da culpa de determinado medicamento não é uma forma confiável de excluir agentes. Muitos pacientes são indevidamente expostos ao risco, pela exclusão do agente incorreto e, ao mesmo tempo, privados de medicamentos necessários. Verificou-se que em 73% dos casos de um estudo não houve correspondência entre a substância apontada e o agente efetivamente implicado84,85.
As informações devem ser claras sobre os medicamentos que foram utilizados durante a reação (nome da substância, nome comercial) e que devem ser testados, evitando que um paciente que recebeu certo bloqueador neuromuscular (atracúrio) tenha os testes cutâneos realizados com outro (vecurônio, por exemplo)59.
Um formulario padrão para comunicação poderá ser empregado30.
Estabelecer uma interação entre alergistas e anestesiologistas para uma investigação realizada em conjunto é primordial.
A resolução de um quadro de anafilaxia só é encerrada quando a investigação for completada e alternativas seguras a um novo procedimento forem oferecidas86,87.
No Brasil, a indicação em cada Regional das respectivas sociedades SBA e ASBAI, de especialistas em Anafilaxia Perioperatória, é um objetivo a ser buscado.
REFERÊNCIAS
1. Kemps HI, Cook TM, Thomas M, Harper NJN. UK anaesthetists' perspectives and experiences of severe perioperative anaphylaxis: NAP6 baseline survey. Br J Anaesth. 2017;119:132-9.
2. Mertes PM, Volcheck GW, Garvey LH, Takazawa T, Platt PR, Guttormsen AB, et al. Epidemiology of perioperative anaphylaxis. Presse Med. 2016;45:758-67.
3. Mertes PM, Lambert M, Guéabt-Rodriguez RM, Aimone-Gastin I, Mouton-Faivre C, Moneret-Vautrin DA, et al. Perioperative anaphylaxis. Immunol Allergy Clin N Am. 2009:29:429-51.
4. Garro LS, Aun MV, Soares IS, Ribeiro MR, Motta AA, Kalil J, et al. Specific questionnaire detects a high incidence of intra-operative hypersensitivity reactions. Clinics. 2018;113:1202-12.
5. Dewachter P, Kopac P, Laguna JJ, Mertes PM, Sabato V, Volcheck GW, et al. Anaesthetic management of patients with pre-existing allergic conditions: a narrative review. Br J Anaesth. 2019;123:e65-e81.
6. Volcheck GW, Hepner DL. Identification and management of perioperative anaphylaxis. J Allergy Clin Immunol Pract. 2019;7:2134-42.
7. Garvey LH, Dewachter P, Hepner DL, Mertes PM, Voltolini S, Clarke R, et al. Management of suspected immediate perioperative allergic reactions: an international overview and consensus recommendations. Br J Anaesth. 2019;123:e50-e64.
8. Sabato V, Platt P, Garcez T, Cooke P. Suspected perioperative allergic reactions: nomenclature and terminology. Br J Anaesth. 2019:123:e13-e15.
9. Tanno LK, Torres MJ, Castells M, Demoly P, on behalf of the Joint Allergy Academies. What can we learn in drug allergy management from World Health Organization's international classifications? Allergy. 2018;73:987-92.
10. Tanno LK, Simons FE, Annesi-Maesano I, Calderon MA, Aymé S, Demoly P, et al. Fatal anaphylaxis registries data support changes in the WHO anaphylaxis mortality coding rules. Orphanet J Rare Dis. 2017;12(1):8.
11. Johansson SGO, Bieber T, Dahl R, Friedmann PS, Lanier BQ, Lockey R, et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol. 2004;113:832-6.
12. Ebo DG, Clarke RC, Mertes PM, Platt PR, Sabato V, Sadleir PHM. et al. Molecular mechanisms and pathophysiology of perioperative hypersensitivity and anaphylaxis: a narrative review. Br J Anaesth. 2019;123:e38-e49.
13. Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substitutes. Lancet. 1977;1(8009):466-9.
14. Société Française d'Anesthesie et de Réanimation. Société Française d'Allergologie. Reducing the risk of the anaphylaxis during anaesthesia. Short text. Ann Fr Anesth Reanim. 2011;30:212-22.
15. Mertes PM, Malinovsky JM, Jouffroy L; Working Group of the SFAR and SFA, Aberer W, Tereehorst I, et al. Reducing the risk of anaphylaxis during anesthesia: 2011 update guidelines for clinical practice. J Investig Allergol Clin Immunol. 2011;21:442-53.
16. Hopkins PM, Cooke PJ, Clarke RC, Guttormsen AB, Platt PR, Dewachter P, et al. Consensus clinical scoring for suspected perioperative immediate hypersensitivity reactions. Br J Anaesth. 2019;123:e29-e37.
17. Joint Task Force on Practice Parameters; American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. The diagnosis and management of anaphylaxis: an updated practical parameter. J Allergy Clin immunol.2005;115(3 Suppl 2):S483-523.
18. Dewachter P, Mouton-Faivre C, Emala CW. Anaphylaxis and anesthesia: controversies and new insights. Anesthesiology. 2009;111:1141-50.
19. Brown SGA. Cardiovascular aspects of anaphylaxis: implications for treatment and diagnosis. Curr OpinAllerg Clin Immunol. 2005:5:359-64.
20. Clarke R, Sadleir P, Van Niekerk AW, Platt P. Quantification of volume loss and haemodynamic changes of Gelofusine-induced anaphylaxis during cardiopulmonar by-pass. Anaesth Intensive Care. 2011;39:492-5.
21. Kounis NG. Kounis syndrome (allergic angina and allergic myocardial infarction): a natural paradigma? Int J Cardiol. 2006;110:7-14.
22. Franco Hernandez JA, García Hernandez A, Lahoz Rodríguez D. Kounis syndrome secondary to an allergic reaction to metamizole. Rev Esp Anestesiol Reanim. 2012;59:217-9.
23. Gouel-Chéron A, Neukirch C, Aubier B, Montravers P, Nicaise P, Chollet-Martin S, et al. Anaphylactic bronchospasm during general anesthesia is not related to asthma. Allergy. 2015;70:453-6.
24. Simmons FE, Ardusso LR, Bilò MB, Cardona V, Ebisawa M, El-Gamal YM, et al. World Allergy Organization anaphylaxis guidelines: summary. J Allergy Clin Immunol. 2011;127(3):587-93.
25. Kroigaard M, Garvey LH, Gillberg L, Johansson SGO, Mosbech H, Florvaag E, et al. Scandinavian Clinical Practice Guidelines on the diagnosis, management and follow-up of anaphylaxis during anaesthesia. Acta Anesthesiol Scand. 2007;51:655-70.
26. Kolawole H, Marshall SD, Crilly H, Kerridge R, Roessler S. Australian and New Zealand Anaesthetic Allergy Group/Australian and New Zealand College of Anaesthetists Perioperative Anaphylaxis Management Guidelines. Anaesth Intensive Care. 2017;45:151-8.
27. Dewachter P, Mouton-Faivre C, Hepner DL. Perioperative Anaphylaxis: what should be known? Curr Allergy Asthma Rep. 2015;15:21.
28. Spindola MAC, da Silva J. Anafilaxia e anestesia. In: Sociedade Brasileira de Anestesiologia. Nunes RR, Bagatini A, Duarte LTD (orgs.). PROANESTESIA - Programa de Atualização em Anestesiologia: Ciclo 1 (Sistema de Educação Continuada a Distância, vol. 3). Porto Alegre: Artmed Panamericana; 2018. p. 9-49.
29. Ewan PW, Dugué P, Mirakian R, Dixon TA, Harper JN, Nasser SM. BSACI guidelines for the investigation of suspected anaphylaxis during general anesthesia. Clin Exp Allergy. 2009;40:15-31.
30. Laguna JJ, Archilla J, Doña I, Corominas M, Gastaminza G, Mayorga C, et al. Practical guidelines for perioperative hypersensitivity reactions. J Investig Allergol Immunol. 2018;28:216-32.
31. Volcheck GW, Mertes PM. Local and general anesthetics immediate hypersensitivity reactions. Immunol Allergy Clin N Am. 2014;34:525-46.
32. Kemp SF, Lockey RF, Simmons FE, World allergy Organization ad hoc Committee on Epinephrine in Anaphylaxis. Epinephrine: the drug of choice for anaphylaxis: a statement of the World Allergy Organization. Allergy. 2008;63:1061-70.
33. Simmons FE. Anaphylaxis: recent advances in assessment and treatment. J Allergy Clin Immunol. 2009;124:625-36.
34. Mueller UR. Cardiovascular disease and anaphylaxis. Curr Opin Allergy. 2007;337-41.
35. Lieberman P, Nicklas RA, Randolph C, Oppenheimer J, Bernstein D, Bernstein J, et al. Anaphylaxis - a practice parameter update 2015. Ann Allergy Asthma Immunol. 2015;115:341-84.
36. Pumphrey RS. Lessons for management from a study of fatal reactions. Clin Exp Allergy. 2000;30:1114-50.
37. Campbell RL, Bellolio F, Knutson BD, Fedko MG, Nestler DM, Hess EP. Higher risk of cardiovascular complications and overdose after administration of intravenous bolus epinephrine compared with intramuscular epinephrine. J Allergy Clin Immunol Pract. 2014;3:76-80.
38. Xu YS, Kastner M, Harada L, Xu A, Salter J, Waserman S. Anaphylaxis-related deaths in Ontario: a retrospective review of cases from 1986 to 2011. Allergy Asthma Clin Immunol. 2014;10:38.
39. Harper NJN, Cook TM, Garcez T, Farmer L, Floss K, Marinho S, et al. Anaesthesia, surgery, and life-threatening allergic reactions: management and outcomes in the 6th National Audit Project (NAP6). Br J Anaesth. 2018;121:172-88.
40. Kanwar M, Irvin CB, Frank JJ, Weber K, Rosman H. Confusion about epinephrine dosing leading to iatrogenic overdose: a life-threatening problem with a potential solution. Ann Emerg Med. 2010;55:341-4.
41. Gouel-Cheron A, de Chaisemartin L, Jonsson F, Nicaise-Roland P, Granger V, Sabhov A, et al. Low end-tidal CO2 as a marker of a real-time severity marker of intra-anaesthetic acute hypersensitivity reactions. Br J Anaesth. 2017;119:908-17.
42. Garvey LH, Belhage B, Kroigaard M, Husum B, Malling HJ, Mosbech H. Treatment with epinephrine (adrenaline in suspected anaphylaxis during anesthesia in Denmark. Anesthesiology. 2011;115:111-6.
43. Francuzick W, Dolle-Bierke S, Knop M, Hofmeier KS, Cichocka-Jaroz E, Garcia BE, et al. Refractory Anaphylaxis: Data From the European Anaphylaxis Registry. Front Immunol. 2019;10:2482.
44. Turner P, Jerschow E, Umasunthar T, Lin R, Campbell DE, Boy RJ. Fatal anaphylaxis: mortality rate and risk factors. J Allergy Clin Immunol Pract. 2017;5:1169-78.
45. Weiss GM, Fandrick AD, Sidebotham D. Successful rescue of an adult with refractory anaphylactic shock and abdominal compartment syndrome with venoarterial extracorporeal membrane oxygenation and bedside laparotomy. Semin Cardiothor Vasc Anesthesia. 2015;19:66-70.
46. Clarke RC, Sadleir PH, Platt PR. The role of sugammadex in the development and modification of an allergic response to rocuronium: evidence from a cutaneous model. Anaesthesia. 2012;67:266-73.
47. Platt PR, Clarke RC, Jonson GH, Sadleir PH. Efficacy of sugammadex in rocuronium-induced or antibiotic-induced anaphylaxis. A case-control study. Anaesthesia. 2015;70:1264-7.
48. Hepner DL, Castells M, Mouton-Faivre C, Dewachter P. Anaphylaxis in the clinical setting of obstetric anesthesia: a literature review. Anesth Analg. 2013;117:1357-67.
49. McCall SJ, Bunch KJ, Brocklehurst P, Hinshaw K, Kurinczuk JJ, Lucas DN, et al. The incidence characteristics, managements and outcomes of anaphylaxis in pregnancy: a population-based descriptive study. BJOG. 2018;125:965-71.
50. Lavonas EJ, Drennan IR, Gabrielli A, Heffner AC, Hoyte CO, Orkin AM, et al. Part 10: special circumstances of resuscitation 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015;132[suppl 2]:S501-S518.
51. Kinsella SM, Carvalho B, Dyer RA, Fernando R, McDonnell N, Mercier FJ, et al. International consensus statement on the management of hypotension with vasopressor during cesarean section under spinal anesthesia. Anaesthesia. 2018;73:71-92.
52. Hood D, Dewan D, James F. Maternal and fetal effects of epinephrine in gravid ewes. Anesthesiology.1986; 64-610-3.
53. Mushambi MC, Jaladi S. Airway management and training in obstetric anaesthesia. Curr Opin Anaesthesiol. 2016;29:261-7.
54. Simmons FER, Schatz M. Anaphylaxis during pregnancy. J Allergy Clin Immunol. 2012;130:597-605.
55. Lipman S, Cohen S, Einav S, Jeejeebhoy F, Mhyre JM, Morrison LJ, et al. The Society of Obstetric Anesthesia and perinatology Consensus Statement on the management of cardiac arrest in pregnancy. Anesth Analg. 2014;118:1003-16.
56. Stepanovic B, Sommerfield D, Lucas M, von Ungern-Sternberg BS. An update on allergy and anaphylaxis in pediatric anesthesia. Paediatr Anaesth. 2019;29(9):892-900.
57. Khaleva E, Franz A, Garvey LH, Jay N, Ylescupidez A, Bahnson HT, et al. Perioperative anaphylaxis in children: etioloogy, time sequence, and patterns of clinical reactivity. Pediatr Allergy Immunol. 2020 Jan;31(1):85-94.
58. Harper NJN, Cook TM, Garcez T, Farmer L, Floss K, Marinho S, et al. Anaesthesia, surgery, and life-threatening allergic reactions: epidemiology and clinical features of perioperative anaphylaxis in the 6th National Audit Project. Br J Anaesth. 2018;121:159-71.
59. Thomas M, Harper N, Cook T. Paediatric anaesthesia. In: Anaesthesia, surgery and life-threatening allergic reactions: from the Report and findings of the 6th National Audit Project, Royal College of Anaesthetists. 2018:216-221.
60. Michavila Gomez AV, Belver Gonzalez MT, Alvarez NC, Giner Munoz MT, Hernando Sastre V, Porto Arceo JA, et al. Perioperative anaphylactic reactions: Review and procedure protocol in paediatrics. Allergol Immunopathol (Madr). 2015;43:203-14.
61. Mertes PM, Alla F, Trechot P, Auroy Y, Jougla E. Anaphylaxis during anesthesia in France: an 8- year national survey. J Allergy Clin Immunol. 2011;128:366-73.
62. Kerton M, Jones A, Gough C, Hardy R, Kelly FE. Paediatric anaphylaxis management: training staff to draw up the correct dose of epinephrine. Br J Anaesth. 2018;120:881-2.
63. Sicherer SH, Simons ES. Epinephrine for first-aid management of anaphylaxis. Pediatrics. 2017;139:e20164006.
64. Muraro A, Roberts G, Clark A, Bilò MB, Brockow K, Fernández Rivas M, et al. The management of anaphylaxis in childhood: position paper of the European academy of allergology and clinical immunology. Allergy. 2007;62:857-71.
65. Liu MC, Proud D, Lichtenstein LM, Hubbard WC, Bochner BS, Stealey BA, et al. Effects of prednisone on the cellular responses and release of cytokines and mediators after segmental allergen challenge of asthmatic subjects. J Allergy Clin Immunol. 2001;108:e29-e38.
66. Alqurashi W, Ellis AK. Do corticosteroids prevent biphasic anaphylaxis? J Allergy Clin Immunol. 2017;5:1194-205.
67. Vitte J. Human mast cell tryptase in biology and medicine. Mol Immunol. 2015;63(1):18-24.
68. Egner W, Cook TM, Garcez T, Marinho S, Kemp H, Lucas DN, et al. Specialist perioperative allergy clinic services in the UK 2018: Results from the Royal College of Anaesthetists Sixth National Audit Project (NAP6) investigation of perioperative anaphylaxis. Clin Exp Allergy. 2018;48:846-61.
69. Vitte J, Amadei L, Gouitaa M, Mezouar S, Zieleskiewicz L, Albanese J, et al. Paired acute‐baseline serum tryptase levels in perioperative anaphylaxis: an observational study. Allergy. 2019;74:1157-65.
70. Baretto RL, Beck, S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: a perioperative perspective. Allergy. 2017;72(12):2031-4.
71. Laroche D, Gomis P, Gallimidi E, Laroche D, Gomis P, Gallimidi E. Diagnostic value of histamine and tryptase concentrations in severe anaphylaxis with shock or cardiac arrest during anesthesia. Anesthesiology. 2014;121:272-9.
72. Garvey LH. Practical aspects of perioperative anaphylaxis. Trends Anaesth Crit Care. 2013;3:320-6.
73. Sadleir PHM, Clarke RC, Platt PR. Consequences of proceeding surgery after resuscitation from intra-operative anaphylaxis. Anaesthesia. 2018;73:32-9.
74. Guilarte M, Sala-Cunill A, Luengo O, Labrador-Horrillo M, Cardona V. The mast cell, contact, and coagulation system connection in anaphylaxis. Frontiers in Immunol. 2017;8:846.
75. Garvey LH. Perioperative hypersensitivity reactions: diagnosis, treatment and evaluation. Curr Treat Options Allergy. 2016;3:113-28.
76. Conselho Federal de Medicina. Resolução 2.174, de 14 de dezembro de 2017. Dispõe sobre a prática do ato anestésico e revoga a Resolução CFM 1.806/2006. Diário Oficial da União. Publicado em 27/02/2018. Edição 39, Seção 1; p.75-84.
77. Christiansen IS, Pederson P, Kroigaard M, Mosbech H, Garvey LH. Anaphylaxis to intravenous gentamicin with suspected sensitization through gentamicina-loaded bone cement. J Allergy Clin Immunol Pract. 2016;4:1258.
78. Moissiev E, Levinger E. Anaphylactic reaction following intracameral cefuroxime injection during cataract surgery. J Cataract Refract Surg. 2013;39:1432-4.
79. Egner W, Sargur R, Shrimpton A, York M, Green K. A 17-year experience in perioperative anaphylaxis 1998-2015: harmonizing optimal detection of mast cell mediator release. Clin Exp Allergy. 2016;46(11):1465-73.
80. Beck SC, Wilding T, Buka RJ, Baretto RL, Huissoon AP, Krishna MT. Biomarkers in human anaphylaxis: a critical appraisal of current evidence and perspectives. Front Immunol. 2019;10:1-11.
81. Soar J, Pumphrey R, Cant A, Clarke S, Corbett A, Dawson P, et al. Emergency treatment of anaphylactic reactions - Guidelines for healthcare providers. Resuscitation. 2008;77:157-69.
82. Muraro A, Roberts G, Worm M, Biló MB, Brockow K, Fernandez-Rivas M, et al. Anaphylaxis: Guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014;69:1026-45.
83. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International consensus on drug allergy. Allergy. 2014;69:420-37.
84. Benahmed S, Picot MC, Dumas F, Demoly P. Accuracy of a Pharmacovigilance Algorithm in Diagnosing Drug Hypersensitivity Reactions. Arch Int Med 2005;165(13):1500-5.
85. Kroigaard M, Garvey LH, Menné T, Husum B. Allergic reactions in anaesthesia: are suspected causes confirmed on subsequent testing? Br J Anaesth. 2005;95:486-71.
86. Guyer AC, Saff RR, Conroy M, Blumenthal KG, Camargo CA, Long AA, et al. Comprehensive allergy evaluation is useful in the subsequent care of patients with drug hypersensitivity reactions during anesthesia. J Allergy Clin Immunol Pract. 2015;3:94-100.
87. Chiriac AM, Tacquarad C, Fadhel NB, Pellerin C, Malinovsky JM, Mertes PM, et al. Safety of subsequent general anesthesia in patients allergic to neuromuscular blocking agents: value of allergy skin tests. Br J Anaesth. 2018;120:1437-40.
88. Harper N, Cook T. Anaesthesia, surgery and life-threatening allergic reactions - Summary of main findings. Br J Anaesth. 2018;121:183-91.
89. Garvey LH, Ebo DG, Mertes PM, Dewachter P, Garcez T, Kopac P, et al. An EAACI position paper on the investigation of perioperative immediate hypersensitivity reactions. Allergy. 2019;74(10):1872-84.
90. Cabañes N, Igea JM, de la Hoz B, Agustin P, Blanco C, Dominguez J, et al. Latex allergy: position paper. J Investig Allergol Clin Immunol. 2012; 22:313-30.
91. Brasil. Ministério da Saúde/Agência Nacional de Vigilância Sanitária/Diretoria Colegiada. Resolução RDC nº 37, de 26 de agosto de 2015. Dispõe sobre a padronização de frases de declaração de conteúdo de látex de borracha natural em rótulos de dispositivos médicos. Diário Oficial da União. Edição 164: Seção 1; p. 46.
92. Marinho S. Perioperative anaphylaxis - Time for a NAP6! Clin Exp Allergy. 2018;48:1252-54.
93. Cabrini L, Baiardo Redealli M, Ball L, Filippini M, Fominskiy E, Pintaud M, et al. Awake fiberoptic intubation protocols in the operating room for anticipated difficult airway: a systematic review and meta-analysis of randomized controlled trials. Anesth Analg. 2019;128:971-80.
94. Madhere M, Vangura D, Saidov A. Dexmedetomidine as sole agent for awake fiberoptic intubation in a patient with local anesthetic allergy. J Anaesth. 2011;25:592-4.
95. Mertes PM, De Blay F, Dong S. Risque allergique en anesthésie. Presse Med. 2013;42(3):269-79.
96. Sadleir PHM, Clarke RC, Bunning DL, Platt PR. Anaphylaxis to neuromuscular blocking drugs: incidence and cross-reactivity in Western Australia from 2002 to 2011. Br J Anaesth. 2013;110:981-7.
97. Opstrup MS, Poulsen LK, Malling HJ, Jensen BM, Garvey LH. Dynamics of specific IgE in chlorhexidine allergic patients with and without accidental re‐exposure. Clin Exp Allergy. 2016;46:1090-8.
98. Mullins RJ. The relationship between red meat allergy and sensitization to gelatin and galactose-alpha-1,3-galactose. J Allergy Clin Immunol. 2012;125:1334-42.
99. Ebo DG, Fischer MM, Hagendorens MM, Bridts CH, Stevens WJ. Anaphylaxis during anaesthesia: diagnostic approach. Allergy. 2007;62:471-87.
100. Bhole MV, Manson AL, Seneviratne SL, Misbah SA. IgE-mediate allergy to local anaesthetic: separating fact from perception: a UK perspective. Br J Anaesth. 2012;108:903-11.
101. Akhavan BJ, Osborn UA, Mathew R. Anaphylactic reaction to ethylene oxide in a hemodialysis patient. SAGE Open Med Case Rep. 2019; 7:2050313X19838744.
102. Opstrup MS, Mosbech H, Garvey LH. Allergic sensitization to ethyelene oxide in patients with suspected allergic reactions during surgery and anesthesia. J Investig Allergol Clin Immunol. 2010;20:69-70.
103. Garvey LH. Old, new and hidden causes of perioperative hypersensitivity. Curr Pharm Des. 2016;22:6814-24.
104. Bache S, Petersen JT, Garvey LH. Anaphylaxis to ethylene oxide - a rare and overlooked phenomenon? Acta Anaesthesiol Scand. 2011;55:1279-82.
105. Listyo A, Hofmaeier KS, Bandschapp O, Erb T, Hasler CC, Bircher AJ. Severe anaphylactic shock due to ethylene oxide in a patient with myelomeningocele: successful exposure prevention and pretreatment with omalizumab. Anesth Analg Case Rep. 2014;2:3-6.
APÊNDICE
No cenário ideal, todo o paciente após uma reação de hipersensibilidade seria adequadamente investigado, com abordagem multidisciplinar como proposto pelo NAP6, incluindo discutir estratégias para próxima anestesia88. Essa avaliação deveria ser realizada em 4 a 6 semanas após o evento, sob pena de resultado falso-negativo. Porém, outras situações diferentes da ideal podem ocorrer, como as listadas abaixo.
– Reintervenção de urgência em paciente que sofreu anafilaxia e com dados da ficha de anestesia.
– Cirurgia de urgência em paciente com história de reação de hipersensibilidade perioperatória não investigada, e sobre a qual não há registro.
– Paciente que sofreu reação suspeita de hipersensibilidade perioperatória anterior, da qual não há registros disponíveis.
Como regras gerais nas situações de genuína urgência sem investigação, deve-se tomar as medidas descritas a seguir.
– Evitar agentes administrados ou aos quais o paciente foi exposto até 60 minutos antes do evento7.
– Evitar substâncias administradas por todas as outras vias de exposição intramuscular, subcutânea, raquidiana, peridural e outros locais de exposição até 2 horas após o início do quadro89 que também devem ser lembradas como possíveis agentes e excluídas.
– Excluir látex (ambiente e dispositivos médicos). No Brasil, para dispositivos médicos, a Resolução da Diretoria Colegiada RDC 37/2015 trata da informação sobre o conteúdo de látex e risco de alergia em produtos médicos90. Listar antes todos os materiais e equipamentos e conferir, retirando da sala aqueles com látex. Manter as precauções também no pós-operatório (sala de recuperação pós-anestésica, unidade de internação e de terapia intensiva)91.
– Realizar a cirurgia no primeiro horário da manhã30,91.
– Com relação aos antibióticos, deve-se excluir todos os de mesma classe daqueles utilizados no evento suspeito39. Discutir com a Comissão de Infecção Hospitalar (CCIH) de cada unidade. A administração do agente escolhido deve ser feita no centro cirúrgico antes da indução anestésica, com o paciente acordado e monitorizado para facilitar a identificação do agente implicado92. Também a reanimação cardiovascular será facilitada sem a interferência dos anestésicos na função cardiovascular15.
– Com relação aos agentes para indução de anestesia geral, caso tenha sido usado propofol e anestesia geral seja necessária, halogenados, tiopental, etomidato (formulação não lipídica) e cetamina são agentes indicados39.
– Intubação traqueal: se for necessário excluir os bloqueadores neuromusculares, remifentanil, sulfato de magnésio e anestesia tópica serão úteis. Substituir remifentanil por alfentanil se aquele foi utilizado anteriormente39. Considerar também dexmedetomidina para intubação acordada88,93, inclusive em casos de alergia a anestésicos locais94.
– Caso bloqueadores neuromusculares tenham sido administrados durante o período, devem ser excluídos pela alta taxa de reatividade cruzada, exceto se for absolutamente impossível prescindir de seu uso. Lembrar que a reatividade cruzada é mais frequente entre os bloqueadores aminoesteroides do que entre os derivados benzilisoquinolínicos95, e que o pancurônio (que tem uma estrutura inflexível) parece ser menos provável de apresentar reatividade cruzada com outros aminoesteroides. Para pacientes que sofreram anafilaxia com rocurônio e vecurônio, cisatracúrio foi o agente que apresentou a mais baixa taxa de reatividade cruzada aos mesmos96.
– Caso a clorexidina tenha sido utilizada anteriormente, pesquisar a presença em gel de uso uretral, catéteres revestidos para punção venosa central, soluções oftálmicas e lenços antissépticos97.
– Lembrar que algumas preparações de coloides para reposição volêmica (IV) podem conter alfa-gal98, e estão proibidos nos pacientes com síndrome alfa-gal5.
– Observar uso de contrastes radiológicos e corantes para linfangiografia.
– Estar atento a drogas liberadoras de histamina, como morfina e codeína (fanantrênicos). Estas são diferentes dos derivados fenilpiperidenos, pois estes últimos não estão associados à liberação de histamina99. Atracúrio também é liberador de histamina por ação direta31.
– Lembrar que, embora muito raramente, anestésicos locais podem causar reação alérgica, ou seja, IgE mediada. Reações aos anestésicos locais correspondem a menos de 1% das reações atribuídas aos anestésicos100.
– O óxido de etileno é um gás utilizado para esterilizar a maioria dos dispositivos médicos. Embora as reações sejam raras no cenário perioperatório, parece haver um risco aumentado de sensibilização em pacientes com mielomeningocele e shunts ventriculoperitoniais89, e há relatos também em pacientes submetidos a hemodiálise101. O teste para diagnóstico é a pesquisa de IgE específica102, mas não está disponível no Brasil. É muito difícil evitar o uso de óxido de etileno; a substituição de materiais que possam ser esterilizados a vapor e condutas para minimizar a exposição quando possível é recomendável103,104. O pré-tratamento com omalizumabe foi relatado105.