Número Atual: Abril-Junho 2025 - Volume 9 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Sergio Duarte Dortas-Junior
- Norma de Paula M. Rubini
- Filipe Wanick Sarinho
- Aldo José Fernandes Costa
- Eduardo Costa Silva
- Fabrício Prado Monteiro
- Marta de Fátima Rodrigues da Cunha Guidacci
- Martti Anton Antila
- Ekaterini Simões Goudoris
- Fabio Chigres Kuschnir
- João Negreiros Tebyriça
- Nelson Augusto Rosario-Filho
Artigo de Revisão
Imunobiológicos em doenças alérgicas - desafios e novos rumos
Biologics in allergic diseases - challenges and new directions
Sergio Duarte Dortas-Junior1,2,3; Norma de Paula M. Rubini3,4; Filipe Wanick Sarinho3,5; Aldo José Fernandes Costa3,6; Eduardo Costa Silva3,7; Fabrício Prado Monteiro3,8; Marta de Fátima Rodrigues da Cunha Guidacci3,9; Martti Anton Antila3,10; Ekaterini Simões Goudoris11,12; Fabio Chigres Kuschnir13,14; João Negreiros Tebyriça3,15; Nelson Augusto Rosario-Filho3,16
1. Hospital Universitário Clementino Fraga Filho (HUCFF-UFRJ), Serviço de Imunologia - Rio de Janeiro, RJ, Brasil
2. Faculdade de Medicina de Petrópolis (FMP/UNIFASE), Departamento de Clínica Médica - Petrópolis, RJ, Brasil
3. Associação Brasileira de Alergia e Imunologia (ASBAI), Departamento Científico de Imunobiológicos - São Paulo, SP, Brasil
4. Escola de Medicina e Cirurgia da Universidade Federal do Estado do Rio de Janeiro (UNIRIO), Professora Titular Emérita de Alergia e Imunologia -Rio de Janeiro, RJ, Brasil
5. Universidade Federal de Pernambuco (UFPE) - Centro de Pesquisa em Alergia e Imunologia (HC-UFPE), Professor Assistente - Recife, PE, Brasil
6. Universidade Federal de Pernambuco (UFPE), Doutor em Nutrição - Recife, PE, Brasil
7. Universidade do Estado do Rio de Janeiro (UERJ), Doutor em Medicina - Rio de Janeiro, RJ, Brasil
8. Faculdade de Medicina da Universidade Vila Velha (UVV), Professor Assistente de Imunologia e Genética - Vila Velha, ES, Brasil
9. Secretaria de Saúde do Distrito Federal, Médica - Brasília, DF, Brasil
10. Pontifícia Universidade Católica de São Paulo, Médico Preceptor dos Programas de Residência Médica em Dermatologia, Pediatria e Otorrinolaringologia -São Paulo, SP, Brasil
11. Faculdade de Medicina da Universidade Federal do Rio de Janeiro (UFRJ), Departamento de Pediatria - Rio de Janeiro, RJ, Brasil. ASBAI, Diretora Científica 2023-2024 - São Paulo, SP, Brasil
12. Associação Brasileira de Alergia e Imunologia (ASBAI), Diretora Científica - São Paulo, SP, Brasil
13. Faculdade de Ciências Médicas da Universidade do Estado do Rio de Janeiro (UERJ), Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
14. Associação Brasileira de Alergia e Imunologia (ASBAI), Presidente 2023-2024 - São Paulo, SP, Brasil
15. Universidade Federal do Estado do Rio de Janeiro (UNIRIO), Professor Livre Docente em Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
16. Universidade Federal do Paraná (UFPR), Professor Titular de Pediatria - Curitiba, PR, Brasil
Endereço para correspondência:
Sergio Duarte Dortas-Junior
E-mail: sdortasjr@medicina.ufrj.br /sdortasjr@gmail.com
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 24/11/2024
aceito em: 21/12/2024.
RESUMO
O desenvolvimento e a disponibilização do primeiro anticorpo monoclonal para o tratamento da asma, ocorrido há duas décadas, deu início a uma nova era no tratamento das doenças alérgicas. Desde então, novas terapias foram experimentadas com sucesso utilizando-se anticorpos monoclonais direcionados contra as principais citocinas envolvidas nas reações alérgicas tipo 2 ou os seus receptores, possibilitando o controle de diversas desordens imunoalérgicas como asma, dermatite atópica, esofagite eosino-fílica, granulomatose eosinofílica com poliangeíte, rinossinusite crônica com pólipos nasais, síndromes hipereosinofílicas e urticá-ria crônica espontânea. Os avanços científicos, ao mesmo tempo que trazem respostas, levantam novas questões. O presente artigo procura discutir e aprofundar estas questões como, por exemplo, o uso combinado de imunobiológicos, o conceito de remissão clínica, a potencial influência sobre a marcha atópica e as possibilidades terapêuticas que se descortinam com os ensaios clínicos de novos biológicos para as doenças imunoalérgicas.
Descritores: Anticorpos monoclonais, imunoterapia, imunoterapia sublingual, indução de remissão, remissão espontânea.
Introdução
O desenvolvimento e a disponibilização do primeiro anticorpo monoclonal anti-IgE para o tratamento da asma - omalizumabe, ocorrido há duas décadas, deu início a uma nova era no tratamento das doenças alérgicas1.
Os primeiros ensaios clínicos com o omalizumabe, um anticorpo monoclonal direcionado para a fração Fc da Imunoglobulina E (anti-IgE), demonstraram resultados surpreendentes no controle da asma e rinite alérgica, principalmente em pacientes com asma grave em tratamento com corticosteroides inalatórios em altas doses, associados a um segundo/terceiro controlador, ou mesmo em pacientes dependentes de corticosteroides orais2.
O entusiasmo com essa nova forma de terapia foi, inicialmente, tão grande que muitos chegaram a conjecturar que o problema da terapia da asma e de outras doenças IgE mediadas tinha chegado a um fim. Porém, como logo se viu adiante, a terapia com anti-IgE era apenas o começo de uma nova era, a era da medicina de precisão nas doenças alérgicas3,4.
Desde então, novas terapias foram experimentadas, com sucesso, utilizando-se anticorpos mono-clonais direcionados contra as principais citocinas envolvidas nas reações alérgicas tipo 2 ou os seus receptores, possibilitando o controle de diversas desordens imunoalérgicas como asma, dermatite atópica (DA), esofagite eosinofílica (EoE, do inglês eosinophilic esophagitis), granulomatose eosinofílica com poliangeíte (GEPA), rinossinusite crônica com pólipos nasais (RSCcPN), síndromes hipereosinofílicas (SHE) e urticária crônica espontânea (UCE)3,4.
Recentemente, a Associação Brasileira de Alergia e Imunologia (ASBAI) publicou um Guia Prático para o uso de imunobiológicos abrangendo mecanismo de ação, indicações e contraindicações dos fármacos autorizados para uso em doenças alérgicas no Brasil: omalizumabe, mepolizumabe, benralizumabe, dupilumabe e tezepelumabe4. Entretanto, na prática médica, os avanços científicos, ao mesmo tempo em que trazem respostas, levantam novas questões. O presente artigo procura discutir e aprofundar estas questões como, por exemplo, o uso combinado de imunobiológicos, o conceito de remissão clínica, a potencial influência sobre a marcha atópica e as possibilidades terapêuticas que se descortinam com os ensaios clínicos de novos biológicos para as doenças imunoalérgicas.
Imunobiológicos em combinação com imunoterapia
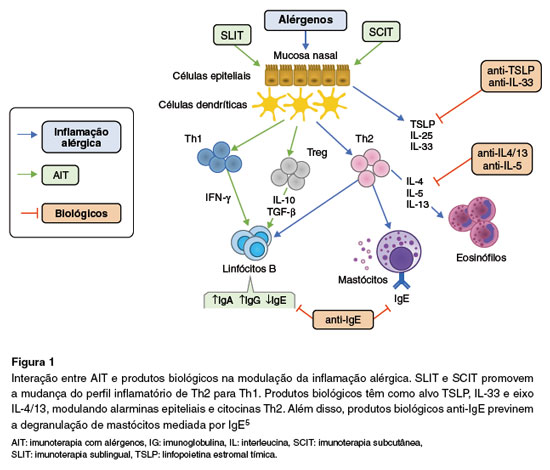
A imunoterapia com alérgenos (AIT, do inglês allergen immunotherapy) é um tratamento para doenças alérgicas que visa induzir a tolerância imunológica. Embora com eficácia comprovada, a imunoterapia é associada a potenciais riscos de eventos adversos, com destaque para a anafilaxia.
A combinação com imunobiológicos é considerada uma abordagem promissora para aumento da segurança do tratamento. Evidências emergentes sugerem que essa combinação pode também aumentar a eficácia da AIT no tratamento de rinite alérgica, asma e hipersensibilidade ao veneno de insetos5.
Racional para uso de imunobiológicos como adjuvante na AIT
O uso de imunobiológicos baseia-se na imuno-modulação da resposta inflamatória tipo 2, reduzindo essa resposta e permitindo que os pacientes tolerem doses maiores de alérgenos com maior segurança durante a dessensibilização5.
ANTI-IgE
O omalizumabe, um anticorpo monoclonal anti-IgE, impede a ligação da IgE livre aos receptores FceRI em mastócitos e basófilos, reduzindo a ativação dessas células e a subsequente liberação de mediadores inflamatórios como histamina e leucotrienos, responsáveis por reações alérgicas imediatas, como a anafilaxia. Adicionalmente, ao diminuir os níveis de IgE circulante, o omalizumabe reduz a expressão dos receptores FceRI, diminuindo a ativação celular quando ocorre exposição ao alérgeno6. O omalizumabe está licenciado pela Food and Drug Administration (FDA) para tratamento da asma moderada e grave, urticária crônica espontânea, rinossinusite crônica com pólipos nasais e alergia alimentar a múltiplos alimentos7. No Brasil, está aprovado para todas estas indicações, exceto a alergia alimentar4.
Anti-receptor de IL-4/IL-13
O dupilumabe é um anticorpo monoclonal que se liga à cadeia alfa do receptor de interleucina-4 (IL-4), que também está presente no receptor de interleucina-13 (IL-13) e, desse modo, bloqueia ambos os receptores, relacionados à produção de citocinas-chave na via inflamatória tipo 2. Com esse bloqueio, o dupilumabe reduz clinicamente a inflamação tipo 2 e pode minimizar a gravidade das reações alérgicas8.Adicionalmente, pode haver um impacto positivo na modulação imunológica em longo prazo, promovendo uma maior tolerância ao alérgeno sem a necessidade de doses frequentes durante a manutenção9,10. É uma medicação atualmente aprovada pela FDA para dermatite atópica, asma grave, rinossinusite crônica com pólipo nasal, esofagite eosinofílica, prurigo nodular e DPOC eosinofílica11. No Brasil, também está aprovado para todas estas indicações4.
Anti-IL5 /Anti-IL5R
O mepolizumabe é um anticorpo monoclonal IgG1/k humanizado que se liga com alta afinidade à interleucina-5 (IL-5) humana e previne a interação dessa citocina com a subunidade alfa do receptor de IL-5 (IL-5R)6.
O benralizumabe é um anticorpo monoclonal IgG1/k humanizado, afucosilado, que se liga à su-bunidade alfa do IL-5R, impedindo a conformação do receptor e a ligação à IL-5. Além do bloqueio da ligação da IL-5 com o receptor, o benralizumabe interage com o receptor de células natural killer (NK), via sua porção Fc, induzindo a morte de eosinófilos residentes e circulantes por citotoxidade mediada por células dependente de anticorpos (ADCC, do inglês antibody-dependent cellular cytotoxicity)6.
A IL-5 é uma importante citocina da resposta tipo 2, essencial para a maturação de eosinófilos na medula óssea e sua liberação para o sangue e, portanto, sendo fundamental na inflamação eosinofílica. Essa citocina parece ainda modular o desenvolvimento e o funcionamento de basófilos e mastócitos, aumentando a liberação de mediadores por meio da ligação ao IL-5R. Dessa forma, ao inibir a IL-5, é possível minimizar as reações desencadeadas especialmente pela liberação de grânulos de eosinófilos, basófilos e mastócitos6.
Anti-TSLP
Tezepelumabe é um anticorpo monoclonal humano (IgG2À) que se liga especificamente à linfopoeitina do estroma tímico (TSLP, do inglês thymic stromal lymphopoietin) inibindo a sua ligação ao complexo receptor de TSLP em diferentes células-alvo. A TSLP é uma citocina da imunidade inata pertencente ao grupo das alarminas, que atua como ativador de vias celulares e moleculares que promovem inflamação das vias aéreas. A TSLP interfere nas funções de várias células imunoinflamatórias e estruturais que coexpressam o receptor de TSLP. Juntamente com outras alarminas, como interleucina-25 (IL-25) e interleucina-33 (IL-33), a TSLP prolonga a sobrevivência de células linfoides inatas do tipo 2 (ILC2) e estimula estas células a produzirem grandes quantidades de IL-5, interleucina-9 (IL-9) e interleucina-13 (IL-13)(6) (Figura 1).
Combinação da imunoterapia para aeroalérgenos e imunobiológicos
A AIT com aeroalérgenos oferece uma abordagem modificadora no tratamento de doenças alérgicas, como a rinite e a asma alérgica. Ao contrário dos medicamentos tradicionais que fornecem alívio temporário dos sintomas, a AIT visa alterar a resposta do sistema imunológico aos alérgenos por meio da administração de doses crescentes de extratos de alérgenos diluídos, por um período recomendado de 3 a 5 anos.
Esse procedimento pode ser realizado tanto por via subcutânea (SCIT) ou sublingual (SLIT), sendo dividido em duas fases: a fase de indução, que utiliza doses crescentes e padronizadas de alérgenos específicos, e a fase de manutenção, com doses fixas de aeroalérgenos. As diretrizes internacionais recomendam que a duração da AIT deve ser de, no mínimo, 3 anos para garantir benefícios duradouros em longo prazo12.
A combinação de AIT com imunobiológicos direcionados ao bloqueio da resposta T2 pode melhorar a eficácia e a segurança em curto prazo da imunoterapia. Há evidências cada vez mais robustas da eficácia dessa combinação, especialmente para o omalizumabe13.
Embora essa abordagem pareça ser promissora, ainda é considerada uma indicação sob investigação, com estudos em andamento visando verificar os benefícios em longo prazo, como seu potencial para promover tolerância clínica e imunológica duradoura.
Omalizumabe
O uso de omalizumabe como adjuvante à AIT com aeroalérgenos parece ser especialmente útil para a redução de reações adversas sistêmicas durante a fase de indução da SCIT. Entretanto, é possível que também possa aumentar a eficácia da imunoterapia. Estudos duplo-cego placebo-controlados sugerem que a combinação de SCIT com aerolérgenos e omalizumabe diminui a necessidade de medicação de resgate, reduz os sintomas de rinite e asma e melhora a qualidade de vida, quando comparada ao placebo14-18.
Em esquemas acelerados, como rush e cluster, existem evidências de que o omalizumabe aumenta a segurança, promovendo redução significativa na taxa de reações adversas sistêmicas17-19.
A Tabela 1 sumariza as principais evidências disponíveis sobre a investigação do omalizumabe em associação à AIT com aeroalérgenos14-19.
Dupilumabe
Nos últimos anos, o papel do dupilumabe em associação com a AIT com aeroalérgenos tem sido objeto de investigação. Em estudo duplo-cego placebo-controlado com pacientes com rinite alérgica em uso de SCIT com pólen de gramíneas associada ao dupilumabe, foi observada melhora significativa no teste de provocação nasal com o alérgeno e na pontuação total de sintomas nasais após 16 semanas de terapia, em comparação com o grupo de pacientes em uso de SCIT isoladamente. A combinação melhorou significativamente a resposta ao alérgeno, propiciou redução de eventos adversos e maior tolerância ao tratamento, com menor necessidade de uso de adrenalina para o tratamento de reações adversas e uma maior proporção de pacientes atingindo a dosagem de manutenção. Além disso, o uso de dupilumabe como adjuvante da SCIT reduziu significativamente os níveis séricos de IgE específica (sIgE) para pólen de gramíneas, ao mesmo tempo em que aumentou os níveis séricos de imunoglobulina G específica e imu-noglobulina IgG4 específica (sIgG4) para o mesmo alérgeno. Houve, portanto, um aumento da relação sIg4/sIgE em comparação com a SCIT isolada, o que pode explicar a melhora na tolerância à progressão da SCIT20.
Estudo observacional avaliando a utilização de SLIT em associação com o dupilumabe também apontou benefícios dessa associação. Hoshino e cols. avaliaram 47 pacientes com asma e rinite alérgica com sensibilização a ácaros, em um período de 48 semanas, em uso de SLIT com ácaros associada ao dupilumabe, e observaram melhora no controle da asma, aumento da qualidade de vida tanto para asma quanto na rinite, elevação do volume expiratório forçado no primeiro segundo (VEF1) e redução da fração exalada do óxido nítrico (FeNO)8.
Tezepelumabe
A utilização do tezepelumabe em conjunto à AIT está atualmente sob investigação, e os resultados preliminares parecem ser promissores.
Um ensaio clínico recente avaliou a combinação de imunoterapia subcutânea para epitélio de gato com tezepelumabe intravenoso em pacientes com rinite alérgica. Na análise comparativa entre o grupo de pacientes recebendo somente SCIT e o grupo recebendo a combinação de SCIT com tezepelumabe, os resultados mostraram que a terapia combinada foi mais eficaz na redução do escore total de sintomas nasais durante o teste de provocação nasal com epitélio de gato, com efeitos mantidos após um ano de tratamento21.
Assim, a combinação de tezepelumabe com a SCIT convencional pode, potencialmente, gerar maior eficácia em comparação com a SCIT isoladamente e resultar em maior tolerância em longo prazo.
Combinação de imunoterapia para veneno de himenópteros (VIT, do inglês venom immunotherapy) e imunobiológicos
As reações alérgicas a venenos de himenópteros podem variar desde manifestações locais até reações sistêmicas graves, como a anafilaxia. Estima-se que entre 0,3% e 7,5% dos adultos possam experimentar alguma reação sistêmica após picadas desses insetos22.
A dessensibilização por meio da VIT pode alcançar taxas de sucesso de até 96%, dependendo da espécie do inseto (abelhas, vespas ou formigas) e do veneno utilizado23.
Os imunobiológicos têm sido explorados como uma opção adjuvante na VIT, especialmente nos pacientes com alergias graves e reações anafiláticas recorrentes, onde o tratamento convencional pode se relacionar a maior risco de reações adversas graves. Essa combinação tem permitido que os pacientes atinjam e mantenham doses de VIT que, de outra forma, seriam intoleráveis24. As evidências, no entanto, se compõem, em sua grande maioria, de relatos de caso ou estudos retrospectivos.
O uso do omalizumabe como adjuvante na VIT tem sido documentado em pacientes que apresentam reações anafiláticas graves durante a imunoterapia com venenos, especialmente em indivíduos com histórico de múltiplas reações sistêmicas23.
Uma série comparativa de 10 casos demonstrou que a combinação de omalizumabe com uma dose de manutenção elevada de veneno (200-300 pg) resultou em uma tolerância duradoura à VIT em pacientes que anteriormente apresentaram reações adversas graves. Todos os 10 pacientes do grupo que recebeu omalizumabe toleraram o término da fase de indução, enquanto que, no grupo controle (5 pacientes), a VIT teve que ser interrompida permanentemente devido a repetidas reações sistêmicas25.
Recentemente, foram publicadas as diretrizes do American College of Allergy, Asthma & Immunology (ACAAI) em que o uso de omalizumabe é recomen-dado para reduzir o risco de anafilaxia durante a VIT em casos selecionados, especialmente em pacientes com mastocitose26.
Combinação de imunoterapia oral para alimentos (OIT, do inglês oral immunotherapy) e imunobiológicos
A alergia alimentar afeta entre 4% a 8% das crianças e 3% a 4% dos adultos, podendo se manifestar com reações alérgicas graves, como a anafilaxia. Embora a tolerância espontânea possa ocorrer em até 80% dos casos, alguns pacientes evoluem com quadros graves e persistentes27.
A OIT é uma terapia recentemente incorporada à prática clínica, capaz de induzir tolerância em casos persistentes de alergia alimentar, incluindo aqueles com reações anafiláticas, oferecendo uma alternativa potencialmente mais segura em comparação às dietas de exclusão. No entanto, estudo de revisão sistemática com metanálise concluiu que a OIT, apesar de eficaz e segura, aumenta consideravelmente o risco de reações anafiláticas28. Assim, abordagens mais seguras, como o uso de imunobiológicos como adjuvantes, têm sido estudadas.
Um estudo piloto investigou os benefícios do uso de omalizumabe em associação à OIT em 13 pacientes com alergia a amendoim IgE-mediada com alto risco para reações anafiláticas. Os resultados indicaram os benefícios da associação do omalizumabe à OIT, principalmente com relação à possibilidade de atingir a dose de manutenção em um maior percentual de pacientes29.
Wood e cols. conduziram o primeiro estudo duplo-cego controlado e randomizado avaliando a associação de omalizumabe com imunoterapia oral para leite de vaca. Após 32 meses, foi demonstrada tolerância mantida ao alimento em 48% do grupo em uso de OIT + omalizumabe versus 35% no grupo em uso somente de OIT, sem diferença estatística significativa entre os grupos (p = 0,42). Contudo, houve diferença significativa com relação à taxa de eventos adversos requerendo tratamento, sendo observadas taxas de ocorrência de 2,1% no grupo OIT + omalizumabe e 16,1% no grupo de OIT isolada (p = 0,0005)30. Esses dados confirmam o papel do omalizumabe em aumentar a segurança da OIT.
Um estudo de fase 2 investigou os benefícios do uso combinado do omalizumabe com OIT em pacientes com múltiplas alergias alimentares. O desfecho primário estabelecido foi a proporção de participantes que passaram em testes de provocação duplo-cegos controlados com placebo para pelo menos dois dos alimentos causadores de alergia, utilizados na OIT. No grupo em uso da combinação OIT e omalizumabe houve uma maior proporção de pacientes atingindo o desfecho primário (83%) quando comparado ao grupo OIT + placebo (33%) [p = 0,004)]. Não ocorreu nenhum evento adverso grave ao longo do estudo e não foram observadas diferenças estatísticas significantes em relação à taxa global de eventos adversos entre os dois braços do estudo. Os autores concluíram que em pacientes alérgicos a múltiplos alimentos, o omalizumabe foi capaz de melhorar a eficácia da imunoterapia oral multialimentar, permitindo uma dessensibilização rápida e segura31.
Em fevereiro de 2024, o omalizumabe foi aprovado pela FDA para o tratamento de alergia alimentar, com base em dados do ensaio clínico de Fase 3 "Omalizumabe como monoterapia e como terapia adjuvante em crianças e adultos com múltiplas alergias alimentares (OUtMATCH)", no qual foi avaliada a eficácia desse imunobiológico em pacientes com alergia a amendoim, associada à alergia a pelo menos dois outros alérgenos alimentares7,32. Esse estudo envolveu três estágios, mas somente os resultados do estágio 1 - omalizumabe versus placebo foram publicados até o presente momento. Nessa etapa do estudo, foram avaliados 177 pacientes, na faixa etária de 1 a 17 anos, sendo 118 participantes no grupo omalizumabe e 59 no grupo placebo, sendo estabelecido como desfecho primário a ingestão de pelo menos 600 mg de amendoim sem sintomas que limitassem essa dose. Foi observado que no grupo omalizumabe 67% dos pacientes atingiram o desfecho primário, enquanto apenas 4% do grupo placebo alcançaram o mesmo resultado33.
Outros ensaios clínicos estão em andamento e devem demonstrar com maior nível de evidências os benefícios de omalizumabe como adjuvante na OIT com relação à eficácia e à segurança. Na Tabela 2 estão sumarizados os principais estudos investigando o papel adjuvante do omalizumabe na OIT29-33.
Uso combinado de biológicos
Uso combinado de biológicos em doenças alérgicas
As indicações para terapia biológica de doenças alérgicas estão em expansão. À medida que isso ocorre, os pacientes podem se beneficiar de diferentes produtos para uma mesma condição como a asma grave, ou para condições distintas, como por exemplo, urticária crônica espontânea (UCE) concomitante à dermatite atópica (DA), esofagite eosinofílica ou asma não alérgica.
Apesar de vários relatos de casos isolados, os estudos de séries de casos investigando essa abordagem são limitados. Apenas um ensaio clínico recente investigou o tratamento da asma com o uso combinado de dupilumabe (anti-IL-4R) e itepekimabe (anti-IL-33), e não identificou um maior risco de efeitos adversos ou mesmo eficácia adicional34-38.
Uma série de casos descreveu 25 pacientes tratados com uma variedade de combinações de biológicos, 15 dos quais estavam em uso de uma combinação de biológicos aprovados para asma (anti-IL-5 + Anti-IgE, Anti- IgE + anti-IL-4/IL-13 e anti-IL-5 + anti-IL-4/IL-13). A duração da terapia combinada, nesse estudo, variou de 3 a 49 meses, e não houve relatos de efeitos adversos que limitassem o tratamento39.
Recentemente, Pitlick & Pongdee, em uma série de casos, descreveram 25 pacientes que estavam utilizando uma combinação de biológicos que incluíam: omalizumabe + mepolizumabe, omalizumabe + dupi-lumabe, omalizumabe + benralizumabe, mepolizuma-be + dupilumabe, e omalizumabe + mepolizumabe + dupilumabe. A duração média do tratamento com uma combinação de biológicos foi de 17,5 meses (intervalo de 1 a 60 meses). Nenhum paciente apresentou anafilaxia ou outra reação alérgica em qualquer momento durante o uso de múltiplos biológicos. Não houve relato de malignidades, insuficiência renal ou hepática, pneumonia ou disfunção imunológica após a terapia combinada, e nenhuma paciente engravidou durante a terapia40.
Outras publicações descreveram pacientes com asma grave ou aspergilose broncopulmonar alérgica (ABPA) tratados com omalizumabe associado à me-polizumabe, benralizumabe ou dupilumabe. Foram identificados quatro pacientes utilizando terapias combinadas anti-IgE e anti-IL5 após falha na terapia com monoclonal único. Três atenderam aos critérios diagnósticos para ABPA. Os autores concluem que a terapia combinada anti-IgE e anti-IL5 deve ser considerada em pacientes com asma grave ou ABPA que continuam a necessitar de corticoides sistêmicos ou apresentam exacerbações frequentes, apesar da única terapia biológica41.
Yang e cols. realizaram um estudo em pacientes com dermatite atópica em que aqueles com doença refratária ou resposta insuficiente ao dupilumabe foram divididos em grupos para receber tratamento combinado com inibidores da JAK (iJAK) ou imunos-supressores. Os autores concluíram que a associação dupilumabe + iJAK foi significativamente efetiva, sem a ocorrência de efeitos adversos significativos42.
Apesar do pequeno número de publicações sobre o tema, os dados existentes fornecem segurança preliminar para que médicos que tratam pacientes com doenças alérgicas graves considerem o tratamento combinado de biológicos e pequenas moléculas. Entretanto, estudos longitudinais prospectivos são necessários para determinar a eficácia e definir qual é a população ideal de pacientes que poderá se beneficiar dessa terapia combinada.
Uso combinado de biológicos em doenças alérgicas e inflamatórias/autoimunes
O uso combinado de medicamentos no tratamento de doenças alérgicas, inflamatórias e autoimunes tem se mostrado uma abordagem eficaz e promissora para a prática clínica, dado que essas condições muitas vezes compartilham mecanismos patogênicos subjacentes, como mecanismos de hipersensibilidade e vias inflamatórias.
O manejo combinado de doenças alérgicas e desordens inflamatórias/autoimunes requer uma abordagem colaborativa, envolvendo múltiplas especialidades médicas. A integração de terapias tradicionais com inovações terapêuticas, como agentes biológicos, tem melhorado significativamente os resultados de muitos pacientes que apresentam diferentes doenças imunomediadas.
É essencial a elaboração de um plano de tratamento personalizado, com o envolvimento de equipe multidisciplinar (alergista e imunologista, dermatologista, reumatologista, gastroenterologista, etc.); bem como o monitoramento cuidadoso ao longo do tratamento, em função do potencial aumento do risco de infecções e outros eventos adversos. Igualmente importante é a avaliação da eficácia sustentada das terapias concomitantes, considerando os custos elevados das terapias biológicas.
A associação de doenças com participação da inflamação tipo 2 e condições como psoríase, artrite psoriática, artrite reumatoide, lúpus e doença inflamatória intestinal pode representar um desafio terapêutico. Embora seja raro, alguns pacientes apresentam duas dessas doenças inflamatórias sistêmicas simultaneamente. Para estes pacientes, a terapia combinada com medicamentos biológicos pode oferecer uma solução.
São raros os relatos na literatura sobre o uso concomitante do omalizumabe com outros medicamentos biológicos. Um relato de caso descreveu um paciente tratado com guselkumabe (anti-IL-23a) para psoríase e omalizumabe para UCE durante 21 meses, sem nenhum efeito adverso relevante ou interações medicamentosas43. Outro relato documentou um paciente que desenvolveu UCE durante o uso de adalimumabe para artrite psoriática e utilizou omalizumabe concomitantemente por 24 semanas. Nesse paciente, o omalizumabe foi interrompido devido ao controle completo da UCE após 24 semanas44. Recentemente, um estudo avaliou o uso combinado de omalizumabe com outros quatro diferentes biológicos indicados para tratamento de psoríase ou hidradenite supurativa (adalimumabe, ustequinumabe, secuquinumabe e ixequizumabe) em 31 pacientes. Não foram observados eventos adversos graves em relação a essas combinações, apenas 1 paciente apresentou diarreia após 9 meses do uso da combinação omalizumabe + secuquinumabe, que se resolveu após a interrupção do secuquinumabe45.
Um estudo recentemente publicado descreveu, em 12 pacientes com dermatite atópica, a associação de um inibidor do eixo Th2 (dupilumabe ou traloquinuma-be) com um inibidor do eixo IL-23/Th17 (guselkumabe, risankizumabe ou tildrakizumabe), ou inibidores de IL-12/IL-23 (ustequinumabe) para o tratamento de psoríase (oito pacientes), artrite psoriática (quatro pacientes) e doença inflamatória intestinal (cinco pacientes). A duração média da terapia combinada foi de 560 dias. Entre os participantes, 75% (n = 9) mostrou melhora clínica da dermatite atópica. Nos demais casos, um paciente não apresentou resposta ao tratamento, outro apresentou piora da artrite após o início do dupilumabe, e um terceiro evoluiu com perda da resposta após boa resposta inicial. A maioria dos pacientes recebeu terapia combinada prescrita para tratar simultaneamente psoríase/artrite psoriática e dermatite atópica (n = 8). Os eventos adversos observados foram irritação ocular e conjuntivite em 17% (n = 2) dos pacientes46.
Remissão
A remissão é um termo utilizado na área da saúde para descrever a redução ou ausência dos sintomas/sinais de uma doença, associada à redução/supres-são de mecanismos patológicos subjacentes. Quando um paciente está em remissão, os sinais e sintomas de sua doença estão controlados ou ausentes, e ele está em um estado de saúde estável. A remissão não necessariamente significa cura, mas sim que a doença não se encontra em atividade. Portanto, a remissão da doença é definida como um estado ou período com baixa ou nenhuma atividade da doença, podendo ocorrer de forma espontânea ou ser alcançada por meio de tratamento47.
O conceito de remissão vem sendo utilizado há muito tempo em determinadas malignidades, em especial as hematopoiéticas, nas quais o tratamento pode induzir a remissão total da doença, mesmo após a suspensão do mesmo, à semelhança de doenças inflamatórias crônicas como a artrite reumatoide, lúpus eritematoso sistêmico, doença de Crohn e reto-colite ulcerativa, em que o tratamento pode alcançar e manter um estado de remissão48.
Com o advento de novas terapias-alvo com potencial modificador de doença para o tratamento da asma nas duas últimas décadas, o termo remissão tem sido sugerido como um objetivo a ser alcançado, além dos objetivos habituais de controle de sintomas e redução de risco futuro47,49.
A remissão, definida como controle completo dos sintomas e biomarcadores da doença é um objetivo terapêutico emergente no manejo de várias condições crônicas. A aplicação recente desse conceito no manejo das doenças inflamatórias das vias aéreas promoveu o conceito de remissão clínica, usando uma abordagem de "tratar ao alvo" (treat-to-target) ou tratamento direcionado50,51.
Remissão na asma
Alguns pacientes com asma podem se tornar assintomáticos espontaneamente e entrar em um estado prolongado livre de sintomas, mantendo ou não o processo fisiopatológico subjacente. Embora a remissão espontânea na asma na população pediátrica seja um fenômeno relativamente comum, a remissão em adultos com asma é menos frequente e a sua ocorrência, com o tratamento, é um conceito relativamente novo e em discussão48,52,53.
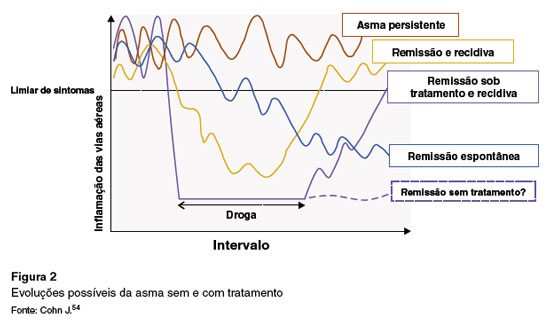
O uso de imunobiológicos que atuam em diferentes pontos da imunopatogênese da asma, assim como os macrolídeos em casos selecionados de asma grave, trouxeram a possibilidade de indução de remissão da doença. Devido à grande variabilidade de expressões fenotípicas da asma, sua remissão pode ser interpretada em diferentes contextos clínicos: remissão espontânea sem tratamento, como parte da história natural da doença; remissão durante o tratamento; remissão durante e persistindo mesmo após a interrupção do tratamento; e remissão com relapso da doença, que pode ocorrer em qualquer um dos cenários anteriores. A Figura 2 ilustra as diferentes possibilidades evolutivas da asma54.
Estudos anteriores utilizaram uma ampla gama de critérios para definir remissão, considerando períodos livres de sintomas que variaram de 6 meses a 3 anos, sendo a média geralmente de 1 ano. A duração mínima de 12 meses parece ser razoável, pois engloba a sazonalidade da atividade da doença. A taxa de remissão variou de 20 a 70% na asma de início precoce e variou de 2% a 17% para asma de início na idade adulta, atingindo até 29,7% para adultos com asma incluídos nos estudos, independentemente da idade de início da doença. Os fatores associados a remissão foram: menor gravidade da doença, melhor função pulmonar, idade mais jovem, início da asma em idade mais precoce, menor duração da doença, menor hiper-responsividade brônquica (HRB), menor número de comorbidades, e ausência ou suspensão do tabagismo53. Em uma coorte da Tasmânia com mais de oito mil participantes, a HRB e o fator de necrose tumoral-a (TNF-a, do inglês tumor necrosis factor-a) aumentado no sangue durante a remissão espontânea foram associados a um risco aumentado de recidiva da asma52.
Em 2020, uma Força Tarefa de especialistas propôs, pela primeira vez, critérios para definir a remissão na asma (Figura 2). Esses critérios foram divididos em remissão clínica e remissão completa, ambas podendo ocorrer com e sem tratamento47.
Ainda não está bem definido qual o melhor instrumento para avaliação de sintomas de asma a ser utilizado para definir a remissão, visto que o Asthma Control Questionnaire (ACQ) e o Asthma Control Test (ACT) foram validados para a avaliação do controle de sintomas em indivíduos sintomáticos, e não para indivíduos em remissão. Sugere-se usar cut-offs de ACQ < 0,75 ou ACT > 20, mas há diferentes limites usados nos estudos, variando de 0 a 1 para o ACQ e de 20 a 25 para o ACT. Por ora, essa variação de critérios permanecerá enquanto não houver um instrumento específico validado para esse objetivo (Tabela 3).
Alguns autores propõem incluir a ausência de uso de beta-agonistas para alívio de sintomas como critério para a remissão clínica. Para a remissão completa, sugerem a definição de limiares específicos de biomarcadores que indiquem a resolução da inflamação, tais como: eosinófilos sanguíneos < 300/mm3, eosinófilos no escarro < 3%, e FeNO < 40 partes por bilhão (ppb)48. Esses biomarcadores são relevantes apenas para a asma com padrão de inflamação tipo 2, enquanto que para a asma não tipo 2 ainda não existem marcadores definidos para remissão completa, sendo a redução da hiper-responsividade brônquica um possível parâmetro mensurável para este fenotipo inflamatorio.
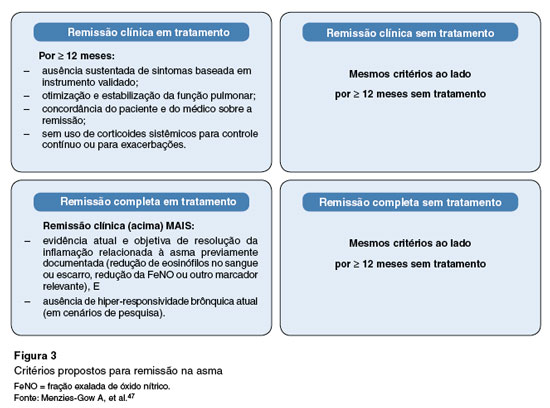
Em 2023, um consenso de especialistas da American Academy of Allergy, Asthma and Immunology e do American College of Allergy, Asthma and Immunology a (respectivamente, AAAAI e ACAAI), em conjunto com especialistas da American Thoracic Society (ATS) propôs uma definição inicial com seis critérios para remissão da asma em tratamento (Figura 3). Todos os critérios devem ser atendidos durante um período mínimo de 12 meses e podem ser aplicados aos pacientes que recebem terapia com biológicos para asma55. A aplicação desses critérios requer o uso de três ferramentas diferentes para avaliação de risco e controle da doença, o que não é habitual em nosso meio. Além disso, admite-se o uso de medicação de alívio até uma vez por mês, o que é questionável, pois não atenderia a um critério estrito de remissão de doença.
Recentemente, diferentes estudos de mundo real foram publicados avaliando a resposta aos imunobiológicos na asma. Sposato e cols., ao definirem remissão clínica como o controle dos sintomas de asma (ACT > 20), ausência de exacerbações, interrupção do uso de corticoide oral e um VEF1% > 80%, observaram essa condição em 21,8%, 23,6%, 35,8% e 23,5% dos pacientes tratados, respectivamente com omalizumabe, mepolizumabe, benralizumabe e dupilumabe56.
Pacientes tratados com omalizumabe, com idade avançada, índice de massa corporal (IMC) mais elevado, idade tardia de início da asma, presença de sinusite/polipose nasal, hipertensão/presença de car-diopatia crônica e um maior número de exacerbações estiveram associados à falha em atingir a remissão da asma. Pior função pulmonar e maior número de exacerbações estiveram associadas à falha de alcançar remissão clínica com mepolizumabe, e maior IMC e a presença de rinite estiveram associados à falha em atingir remissão nos pacientes que usaram benralizumabe. Maiores níveis da FeNO estiveram associados à remissão com mepolizumabe e benra-lizumabe. O número reduzido de pacientes em uso de dupilumabe nesse estudo permitiu evidenciar diferenças significativas em relação a esses fatores. No registro de asma grave da Alemanha, que incluiu 443 pacientes adultos em tratamento, dos quais 210 utilizavam imunobiológicos, observou-se que 58% foram tratados com medicamentos direcionados à via da IL-5 (benralizumabe, mepolizumabe, reslizumabe), 15,7% com omalizumabe e 26,6% com dupilumabe. A remissão clínica, definida como controle adequado de sintomas (ACT > 20), ausência de uso de corticoides sistêmicos e ausência de exacerbações por 12 meses ou mais, foi atingida por 17,2% dos pacientes tratados sem biológicos e por 37,6% daqueles em tratamento com biológicos57.
Em conclusão, com o advento de terapias com potencial modificador de doença, ainda que limitadas ao aspecto inflamatório da asma e não às alterações estruturais associadas ao remodelamento brônqui-co, a remissão na asma passou a ser um objetivo possível do tratamento, além do simples controle de sintomas e estabilização funcional. São necessários mais estudos envolvendo o uso dos imunobiológicos e da azitromicina na asma grave, com maior número de pacientes, para o estabelecimento de critérios uniformizados de remissão clínica, funcional e completa. Adicionalmente, é fundamental avaliar o potencial real dessas terapias na busca da remissão, identificar quais os fatores ou características tratáveis indicam a maior probabilidade de sucesso com diferentes medicamentos, assim como determinar os fatores de risco de recidiva após ser atingida a remissão.
Remissão na Rinossinusite Crônica com Pólipos Nasais
A remissão na Rinossinusite Crônica com Pólipos Nasais (RSCcPN) é definida como o controle sustentado por > 12 meses, associado à ausência de doença ativa, preferencialmente avaliada por endoscopia nasal. A remissão pode ser atingida com ou sem tratamento, na ausência do uso de corticosteroides sistêmicos e cirurgia (nos últimos 12 meses). Em um estado de remissão, os pacientes não apresentam exacerbações e, portanto, não precisam de corticos-teroides sistêmicos e/ou cirurgia de resgate para os pólipos nasais58.
Um consenso canadense propôs, anteriormente, a combinação da avaliação dos sintomas e da en-doscopia nasal para definir o sucesso após a cirurgia endoscópica nasal, com resultados considerados "ótimos" quando ocorresse ausência de sintomas combinada à aparência normal da mucosa sinusal na endoscopia nasal59.
Os ensaios clínicos randomizados (ECR) com biológicos em pacientes com RSCcPN, embora não tivessem como objetivo a remissão, forneceram algumas ideias sobre conceitos e ferramentas que poderiam ser úteis para defini-la. Os ECRs (por exemplo: benralizumabe no OSTRO; dupilumabe no SINUS-24 e SINUS-52; mepolizumabe no SYNAPSE e oma-lizumabe no POLYP-1 e POLYP-2) usaram vários desfechos para definir resposta clínica. Todos esses estudos adotaram como objetivo primário a mudança do escore de pólipo nasal (NPS) inicial combinado à redução da gravidade da congestão nasal (NCS) ou da Escala Visual Analógica (EVA) de obstrução nasal. Os objetivos secundários incluíram melhora nos sintomas, qualidade de vida, medida pelo SNOT-22, pontuação do Lund-Mackay pela tomografia computadorizada (TC), pico inspiratório nasal e a necessidade de cirurgia ou terapia sistêmica60-64.
O consenso de especialistas EPOS2020/EUFOREA considerou para a definição de remissão não somente o relato do paciente sobre o controle dos sintomas, mas também a avaliação do médico. Por esse motivo, a ausência de sinais de doença ativa, preferencialmente avaliados por endoscopia nasal, é considerado um objetivo importante a ser alcançado. A presença de secreções nasais, edema, degeneração polipoide e pólipos nasais podem ser considerados sinais de doença ativa, embora sejam necessárias mais pesquisas nessa área, em particular para identificar sinais específicos que podem prever a perda de controle da RSCcPN58.
Além da definição de remissão na RSCcPN, o termo "cura" tem sido proposto quando a remissão é sustentada, sem tratamento, por pelo menos 5 anos58. Enfim, mais pesquisas, incluindo a identificação de biomarcadores específicos, são necessárias para discriminar a polipose nasal ativa da inativa.
Remissão na dermatite atópica
A história natural da dermatite atópica (DA) compreende diferentes trajetórias, podendo ser subdividida nos seguintes padrões principais: (1) início precoce transitório, (2) início precoce persistente e (3) início tardio persistente. A remissão pode ocorrer espontaneamente, principalmente em pacientes pediátricos. A análise da coorte GUSTO (do inglês, Growing Up in Singapore Towards Healthy Outcomes), envolvendo o seguimento de 1.152 pacientes dos três meses de vida aos oito anos, avaliou a prevalência e história natural da DA estimando ser de 43% dos pacientes pediátricos a frequência do fenótipo com início precoce transitório65.
Ainda não existe uma proposta estabelecida de definição de remissão da DA em tratamento ou após suspensão do tratamento com biológicos, e os dados disponíveis são oriundos, em sua maioria, de estudos de extensão. Blauvelt e cols. investigaram a taxa de remissão clínica em tratamento e após a suspensão do tratamento com dupilumabe em adolescentes, em estudo de extensão de 52 semanas, incluindo 102 pacientes, e utilizaram como critério de remissão clínica a pele sem lesões ou quase sem lesões por 12 semanas. Foi observado que na faixa etária de 12 a 17 anos, 29,4% dos pacientes atingiram remissão sustentada em terapia e tiveram a medicação suspensa. Dentre estes, 43,3% mantiveram a remissão sem terapia e 56,7% tiveram que reiniciar o dupiluma-be, ao longo de um acompanhamento com mediana de duração de 18 semanas66.
Um estudo avaliando a taxa de remissão clínica da DA em 254 pacientes de 6 a 11 anos ao longo de 52 semanas, utilizando critério de remissão clínica similar ao descrito acima, documentou que 28,7% atingiram a remissão sustentada em tratamento com o dupilumabe e, dentre estes, 60,3% mantiveram a remissão clínica após a suspensão do tratamento por um período com mediana de 15,7 semanas67. Esses dados apontam para a maior possibilidade de remissão sustentada após a interrupção do tratamento em crianças quando comparadas aos adolescentes. Em ambos os estudos, o período utilizado para a definição de remissão clínica foi de 12 semanas, que é muito curto, especialmente considerando que a DA evolui com a alternância de períodos de melhora e exacerbação na maioria dos pacientes. Além disso, o período de observação para a remissão clínica após a interrupção do tratamento, variável entre 15 e 18 semanas, também não parece adequado para inferir a taxa de remissão sem tratamento.
Miyamoto e cols. conduziram um estudo avaliando a taxa de remissão clínica mantida em 109 pacientes adolescentes e adultos com DA após a suspensão do tratamento com dupilumabe. Foi utilizado como critério de remissão doença controlada por seis meses em uso de terapia tópica proativa, sendo documentada taxa de 20% de remissão clínica mantida por um tempo médio de 40 semanas. Foi observado que os níveis de dupilumabe decresceram lentamente, com eliminação completa em 8 a 10 semanas. Os autores avaliaram comparativamente as características basais dos pacientes com remissão sustentada versus os pacientes com recorrência da DA, e o único parâmetro que apresentou diferença significativa foi a menor faixa etária do grupo com remissão sustentada68.
Um estudo de mundo real realizado no Japão investigou a taxa de remissão clínica durante o tratamento com dupilumabe e sua manutenção após a suspensão do biológico em pacientes adultos tratados por até cinco anos. Foram analisados 58 pacientes, dos quais 25 (43%) atingiram um controle significativo da DA em um período mínimo de 12 meses de tratamento e descontinuaram a terapia. Entre estes, 18 (31%) tiveram que retornar ao uso de dupilumabe devido à exacerbação da doença e apenas 7 (12%) mantiveram a remissão clínica após a suspensão do tratamento. Os autores realizaram análise comparativa entre o grupo de pacientes com remissão mantida após a suspensão do dupilumabe e o grupo que necessitou reiniciar o medicamento devido à exacerbação da DA. Observou-se que os pacientes que mantiveram a remissão após a descontinuação do dupilumabe apresentavam, no período pré-tratamento, menores escores no patient-oriented eczema measure (POEM) e na escala analógica visual (EVA) do prurido, menores níveis séricos de thymus and activation- regulated chemokine (TARC) e maior tempo de tratamento (média de 2 anos) no momento da descontinuação da terapia, quando comparados ao grupo que apresentou exacerbação após a interrupção da terapia biológica (média de 1 ano)69.
Os dados disponíveis ainda são preliminares e não permitem conclusões, sendo necessário o estabelecimento de critérios para a definição de remissão clínica na DA. Igualmente importante é a investigação de biomarcadores de atividade inflamatória da doença aplicáveis na resposta ao tratamento e também como preditores de remissão clínica sustentada.
Influência dos biológicos na marcha atópica
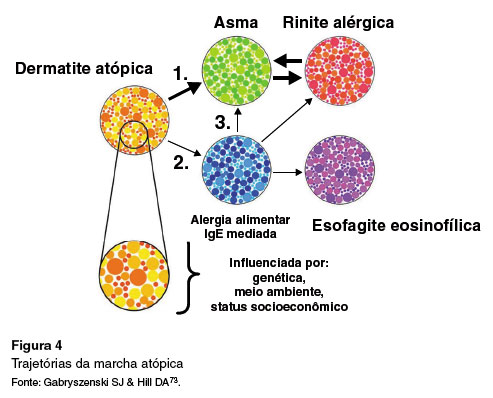
O conceito de marcha atópica foi proposto em 2003 considerando o eixo de desregulação imunoló-gica comum às doenças atópicas, o risco de desenvolvimento de alergia respiratória em pacientes com DA e a sequência típica de progressão das manifestações de atopia - dermatite atópica, asma e rinite alérgica70. Posteriormente, foi incorporada na marcha atópica a alergia alimentar mediada por IgE, que ocorre frequentemente em seguimento à dermatite atópica71. Recentemente, foi proposta a inclusão da EoE na marcha atópica, devido à sua forte associação com as doenças atópicas e a mudança do nome para "marcha alérgica". A EoE seria, na maioria dos casos, a última manifestação a ocorrer72.
A marcha alérgica nem sempre segue o padrão clássico inicialmente proposto e existe a possibilidade de múltiplas trajetórias para o desenvolvimento de duas ou mais manifestações clínicas de atopia sequenciais ou concomitantes, em função da herança genética, influência de fatores ambientais desde a vida intrauterina e condições socioeconómicas, conforme apresentado na Figura 473. Embora possam existir diferentes trajetórias, na maioria dos casos, a DA é a primeira manifestação. Foi postulado que a inflamação tipo 2 e as alterações de barreira cutânea presentes nos pacientes com DA favoreçam a sensibilização cutânea aos alérgenos alimentares e inaláveis74.
O racional para o uso dos biológicos no tratamento de doenças alérgicas visa, entre outros benefícios, prevenir o desenvolvimento de comorbidades atópicas. Esse efeito é explicado pela atuação dos biológicos em diversos pontos da inflamação tipo 2, incluindo a redução da produção de alarminas em resposta aos estímulos ambientais (tezepelumabe), redução da sensibilização IgE específica para alimentos e aeroalérgenos (dupilumabe) e a restauração da barreira cutânea na DA (dupilumabe)75-77.
Considerando que, na quase totalidade dos casos, a primeira manifestação de atopia é a DA e que o dupilumabe está licenciado a partir de seis meses de vida com eficácia comprovada em várias comor-bidades atópicas, esse biológico seria, teoricamente, o de maior potencial para interferir com a marcha alérgica.
Um estudo de coorte populacional retrospectivo (TriNet Collaborative Network US) investigou a redução do risco de desenvolvimento de asma e rinite alérgica em pacientes pediátricos (< 18 anos) com DA em uso de dupilumabe, sem alergia respiratória no início da terapia. Participaram 2.190 pacientes no grupo em uso de dupilumabe e 2.192 pacientes no grupo controle em terapia convencional para DA, ao longo de três anos. Foram observadas taxas de redução de 40% para asma e 31% para rinite alérgica no grupo em tratamento com dupilumabe quando comparado ao grupo controle. Além disso, dentre os pacientes que desenvolveram asma e/ou rinite alérgica, foi constatada menor gravidade de sintomas e menor uso de terapia de manutenção e resgate, indicando um papel modificador na gravidade da alergia respiratória78.
Uma metanálise incluindo 12 estudos clínicos e avaliando 3.525 pacientes acima de 12 anos com DA (grupo dupilumabe = 2.296 e grupo controle = 1.229) avaliou o risco de redução do desenvolvimento de novas doenças alérgicas e também o melhor controle de comorbidades atópicas ao longo de 52 semanas. A terapia com dupilumabe reduziu o risco global de incidência de novas doenças alérgicas em 37% dos pacientes. Foi observado também melhor controle das doenças alérgicas concomitantes e redução significativa dos níveis de IgE sérica nos pacientes em tratamento com dupilumabe quando comparados ao grupo controle79.
Um estudo prospectivo conduzido na Holanda (Dutch Bioday Registry) avaliou o impacto do dupi-lumabe no controle de comorbidades atópicas em pacientes em tratamento para DA. Nos pacientes com histórico de alergia alimentar foi documentada redução variável entre 70,5% a 82,5% nos níveis de IgE específica para alérgenos alimentares (amendoim, avelã, amêndoa e castanha de caju), e redução de 60% nos sintomas alérgicos após a ingestão acidental desses alimentos. Naqueles pacientes que apresentavam rinite alérgica e/ou asma também foi observada redução significativa dos níveis de IgE específica para aeroalérgenos, na faixa de 61,3% a 89,1%80.
O omalizumabe bloqueia a IgE circulante e a sinalização via receptor de IgE, inibindo a resposta alérgica imediata e tardia e tem a sua eficácia estabelecida na asma. Além disso, atua reduzindo as exacerbações de asma durante a estação viral e aumenta a liberação de interferon-a (IFN-a) em resposta à infecção por rinovírus, o que pode resultar em efeito protetor adicional no risco de desenvolvimento de asma, uma vez que esse agente é um dos principais gatilhos para o desenvolvimento de asma persistente na infância81. Além disso, o omalizumabe é eficaz na redução do limiar de reatividade clínica a alérgenos alimentares e foi licenciado recentemente pela FDA para o tratamento de pacientes (> 1 ano de idade) com alergia alimentar mediada por IgE a múltiplos alimentos, indicando potencial para a prevenção da alergia alimentar7,33. Atualmente, está em curso o estudo Prevention of Asthma in High-Risk Kids (PARK), cujo objetivo é investigar a prevenção do desenvolvimento e redução do risco de gravidade da asma em crianças de 2 a 3 anos de idade, com elevado risco para o desenvolvimento de alergia82.
Novos biológicos
Apesar de todos os avanços obtidos com o uso de imunobiológicos em pacientes com doenças alérgicas graves, ainda persistem lacunas e necessidades não atendidas. A heterogeneidade das doenças alérgicas torna difícil a padronização do tratamento para todos os indivíduos. A personalização das terapias, baseada nos fenótipos e endótipos, é essencial para aumentar a eficácia do tratamento. Existem pacientes que não atendem aos critérios de utilização para os biológicos disponíveis, outros que não respondem ou respondem parcialmente à terapia biológica atual, e aqueles com fenótipos mistos, com superposição de vias inflamatórias envolvidas. Além disso, podem ocorrer reações adversas, incluindo o desenvolvimento de anticorpos anti-droga (ADA, do inglês anti-drug antibody). O desenvolvimento de terapias inovadoras é essencial e está em constante avanço, à medida que novas pesquisas continuam a lançar luz sobre as vias inflamatórias envolvidas no processo alérgico, potenciais novos alvos terapêuticos são identificados6,83-85.
Dentre os novos biológicos recém-disponibiliza-dos, destaca-se o lebriquizumabe (anti-IL-13) para o tratamento de pacientes com dermatite atópica moderada a grave, com idade > 12 anos, que foi licenciado recentemente em nosso país. O lebriquizumabe é um anticorpo monoclonal que se liga à IL-13 solúvel, impedindo a formação do complexo de sinalização IL-13Ra1/IL-4Ra. Os estudos pivotais demonstraram eficácia na avaliação global do investigador (IGA), com percentuais de 43,1% (ADvocate1) e 33,2% (ADvocate2) de pacientes atingindo IGA 0/1 e na resposta ao Eczema Area and Severity Index (EASI), com resposta EASI-75 em 58,8% dos pacientes no ADvocate1 e 52,1% no ADvocate 2, em 16 semanas de tratamento. O evento adverso mais comum (> 5%) foi a conjuntivite, observada em 7,4% (ADvocate1) e 7,5% (ADvocate2)86.
Com relação aos principais biológicos em investigação, temos novos biológicos para antigos alvos, como anti-IL-5 (depemoquimabe) e anti-IL-13 (cende-quimabe); e biológicos para novos alvos, como anti-IL-31R (nemolizumabe), anti-IL-33 (etoquimabe, itepe-quimabe e tozoraquimabe), anti-OX40 (rocatinlimabe, telazorlimabe) e anti-OX40L (amlitelimabe)6,83.
O nemolizumabe antagoniza o receptor de IL-31 (IL-31RA), que é um importante alvo terapêutico e anti-inflamatório na DA. A IL-31 foi identificada como uma das citocinas mais importantes na gênese do prurido e seus níveis séricos correlacionam-se com a gravidade da DA. O IL-31R está expresso nas terminações nervosas das fibras C, queratinócitos e neurônios no corno dorsal da medula espinhal. Além disso, está envolvida na ruptura da barreira epidérmica na DA, promove o alongamento e a ramificação das fibras nervosas e ativa os neurônios pruriceptivos, que liberam neuropeptídeos. Esses neuropeptídeos aumentam a inflamação local na pele atraindo células Th2. O nemolizumabe foi aprovado para pacientes > 13 anos no Japão. Os ensaios clínicos com nemo-lizumabe mostraram uma redução de 66% no prurido e 78% do EASI. O principal evento adverso relatado foi a nasofaringite (33,9%). Outros estudos de fase III estão em andamento, além de estudos de fase II em crianças (2-11 anos) com DA moderada a grave87.
A via OX40 representa um alvo promissor para a intervenções terapêuticas na dermatite atópica e na asma brônquica. O OX-40, uma molécula coestimuladora, é expressa de forma significativa em células T ativadas em pacientes com essas condições clínicas. A interação do OX40 com o ligante de OX40 (OX40L) leva à diferenciação Th2 e promove a expansão clonal, sobrevida e produção de células T de memória6. Ensaios clínicos em fase II com anticorpos que têm como alvo o OX40, como rocatinlimabe e telazorli-mabe, e também com o anticorpo que visa o OX40L, amlitelimabe, mostraram resultados encorajadores em pacientes com dermatite atópica moderada a grave, além de asma brônquica moderada a grave88. Esses achados sugerem que a modulação da via OX40 pode oferecer uma estratégia nova e eficaz para o manejo destas condições.
Considerações finais
Os imunobiológicos representam uma das mais significativas inovações no tratamento de doenças alérgicas. Revolucionaram o tratamento de diversas doenças imunoalérgicas, como a asma, a dermatite atópica, a esofagite eosinofílica, a rinossinusite crônica com pólipos nasais e a urticária crônica. A utilização dos imunobiológicos no mundo real consolidou a efetividade e segurança dessa classe de medicamentos na terapia de doenças alérgicas graves e modificou substancialmente a qualidade de vida dos pacientes e seus familiares.
Essa modalidade terapêutica está em permanente expansão, buscando oferecer soluções mais eficazes e abrangentes para um número crescente de pacientes com condições imunoalérgicas. Novos desafios foram surgindo, tais como o uso combinado de imuno-biológicos, o conceito de remissão clínica em terapia biológica, a potencial influência sobre a marcha atópica, as vantagens de associação de biológicos com a imunoterapia específica para alérgenos, bem como a expansão de indicações e ampliação de faixa etária para uso. A condução de ensaios clínicos em crianças é um desafio que necessita ser enfrentado por centros de pesquisa e indústria farmacêutica, para a expansão dos seus benefícios para a população pediátrica. Por outro lado, em algumas doenças alérgicas existe mais de uma opção de biológico, e o desafio é a escolha criteriosa, com base na medicina personalizada e no processo de decisão compartilhada. Além disso, o alto custo da terapia biológica limita o acesso de uma parcela significativa da população, especialmente em países de renda média e baixa.
Continuamente são publicados estudos com a identificação de novos alvos terapêuticos e o desenvolvimento de novos biológicos. Embora não seja o escopo dessa revisão, além dos imunobiológicos, as pequenas moléculas também representaram um avanço importante no tratamento de dermatite atópica moderada a grave. Atualmente, novas classes de moléculas estão em investigação, como os compostos chamados nanobody, um exemplo é o lunsekimig, que é um composto biespecífico, que tem como alvo a inibição de TSLP e IL-1389. Felizmente, a ciência está sempre em desenvolvimento e novas opções eficazes e seguras para o tratamento de doenças alérgicas serão disponibilizadas em um futuro próximo. É fundamental que o especialista em Alergia e Imunologia acompanhe e se atualize nos avanços da especialidade.
Referências
1. Fahy JV, Fleming HE, Wong HH, Liu JT, Su JQ, Reimann J, et al. The effect of an anti-IgE monoclonal antibody on the early- and late-phase responses to allergen inhalation in asthmatic subjects. Am J Respir Crit Care Med. 1997;155:1828-34.
2. Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Della Cioppa G, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001;108:184-90.
3. Morita H, Matsumoto K, Saito H. Biologics for allergic and immunologic diseases. J Allergy Clin Immunol. 2022;150:766-77.
4. Sarinho FW, Rubini NPM, Costa AJF, Silva ECF, Monteiro FP, Serpa FS, et al. Guia prático para o uso de imunobiológicos em doenças alérgicas - ASBAI. Arq Asma Alerg Imunol. 2023;7(4):339-66.
5. Olivieri B, Günaydin FE, Corren J, Senna G, Durham SR. The combination of allergen immunotherapy and biologics for inhalant allergies: Exploring the synergy. Ann Allergy Asthma Immunol. 2024 Jun 17:S1081-1206.
6. Eggel A, Pennington LF, Jardertyzk TS. Therapeutic monoclonal antibodies in allergy: Targeting IgE, cytokine, and alarmin pathways. Immunol Rev. 2024;00:1-25. doi: 10.1111/imr.13380.
7. Xolair®. Bula [Internet]. Disponível em: https://www.gene.com/download/pdf/xolair_prescribing.pdf. Acessado em: 05/11/2024.
8. Hoshino M, Akitsu K, Kubota K, Ohtawa J. Efficacy of a house dust mite sublingual immunotherapy tablet as add-on dupilumab in asthma with rhinitis. Allergol Int. 2022;71(4):490-7.
9. Study in Pediatric Subjects with Peanut Allergy to Evaluate Efficacy and Safety of Dupilumab as Adjunct to AR101 (Peanut Oral Immunotherapy) [Internet]. Disponível em: https://www.clinicaltrials.gov/study/NCT03682770. Acessado em: 13/10/2024.
10. Clinical Study Using Biologics to Improve Multi OIT Outcomes (COMBINE) [Internet]. Disponível em: https://www.clinicaltrials. gov/study/NCT03679676. Acessado em: 13/10/2024.
11. Dupixent®. Bula [Internet].. Disponível em: https://www.regeneron.com/downloads/dupixent_fpi.pdf. Acessado em: 05/11/2024.
12. Durham SR, Penagos M. Sublingual or subcutaneousimmunotherapy for allergic rhinitis? J Allergy Clin Immunol. 2016;137:339-49.
13. Carlucci P, Spataro F, Daddato MF, Paoletti G, Di Bona D. Biologic drugs and allergen immunotherapy: potential allies. Explor Asthma Allergy. 2023;1:126-41. doi: 10.37349/eaa.2023.00014
14. Kamin W, Kopp MV, Erdnuess F, Schauer U, Zielen S, Wahn U. Safety of anti-IgE treatment with omalizumab in children with seasonal allergic rhinitis undergoing specific immunotherapy simultaneously. Pediatr Allergy Immunol. 2010 Feb;21(1 Pt 2):e160-5.
15. Kopp MV, Hamelmann E, Zielen S, Kamin W, Bergmann KC, Sieder C, et al.; DUAL study group. Combination of omalizumab and specific immunotherapy is superior to immunotherapy in patients with seasonal allergic rhinoconjunctivitis and co-morbid seasonal allergic asthma. Clin Exp Allergy. 2009;39:271-9.
16. Kopp MV, Hamelmann E, Bendiks M, Zielen S, Kamin W, Bergmann KC, et al.; DUAL study group. Transient impact of omalizumab in pollen allergic patients undergoing specific immunotherapy. Pediatr Allergy Immunol. 2013;24:427-33.
17. Casale TB, Busse WW, Kline JN, Ballas ZK, Moss MH, Townley RG, et al. Omalizumab pretreatment decreases acute reactions after rush immunotherapy for ragweed-induced seasonal allergic rhinitis. J Allergy Clin Immunol. 2006;117:134-40.
18. Massanari M, Nelson H, Casale T, Busse W, Kianifard F, Geba GP, et al. Effect of pretreatment with omalizumab on the tolerability of specific immunotherapy in allergic asthma. J Allergy Clin Immunol. 2010;125:383-9.
19. Valdesoiro-Navarrete L, Leon ME, Rodríguez M, Indiveri M, Ayats R, Larramona H, et al. Combination therapy of specific aeroallergens immunotherapy and omalizumab, in children with severe asthma. Allergol Immunopathol (Madr). 2022;50(2):1-6.;21(1Pt 2):e160-e165.
20. Corren J, Saini SS, Gagnon R, Moss MH, Sussman G, Jacobs J, et al. Short-term subcutaneous allergyimmunotherapy and dupilumab are well tolerated in allergic rhinitis: a randomized trial. J Asthma Allergy. 2021;14:1045-63.
21. Corren J, Larson D , Altman MC, Segnitz RM, Avila PC, Greenberger PA, et al. Effects of combination treatment with tezepelumab and allergen immunotherapy on nasal responses to allergen: A randomized controlled trial. J Allergy Clin Immunol. 2023;151:192-201.
22. Paçaci Çetin G, Yilmaz I, Türk M, Arslan B, Bahçecioglu SN. Venom immunotherapy and difficulties encountered before and during immunotherapy: Double sensitization, systemic reactions, treatment with omalizumab, and high dose VIT. Turk J Med Sci. 2022;52(4):1223-34. doi: 10.55730/1300-0144.5427.
23. Yilmaz I, Bahçecio lu SN, Türk M. Combination of omalizumab and bee venom immunotherapy: does it work? Asia Pac Allergy. 2018;8(1):e2. doi: 10.5415/apallergy.2018.8e2.
24. Ridolo E, Pellicelli I, Kihlgren P, Nizi MC, Pucciarini F, Senna G, et al. Immunotherapy and biologicals for the treatment of allergy to hymenoptera stings. Expert Opin Biol Ther. 2019;19:919-25.
25. Stretz E, Oppel EM, Rawer HC, Chatelain R, Mastnik S, Przybilla B, et al. Overcoming severe adverse reactions to venomimmunotherapy using anti-IgE antibodies in combination with a high maintenance dose. Clin Exp Allergy. 2017;47:1631-9.
26. Golden DBK, Wang J, Waserman S, Akin C, Campbell RL, Ellis AK, et al. Anaphylaxis: A 2023 practice parameter update. Ann Allergy Asthma Immunol. 2023; S1081-1206.
27. Warren CM, Jiang J, Gupta RS. Epidemiology and Burden of Food Allergy. Curr Allergy Asthma Rep. 2020 Feb 14;20(2):6. doi: 10.1007/s11882-020-0898-7.
28. Chu DK, Wood RA, French S, Fiocchi A, Jordana M, Waserman S, et al. Oral immunotherapy for peanut allergy (PACE): a systematic review and meta-analysis of efficacy and safety. Lancet. 2019;393:2222-32.
29. Schneider LC, Rachid R, Le Bovidge, Blood E, Mittal M, Umetsu. A pilot study of omalizumab to facilitate rapid oral desensitization in high-risk peanut-allergic patients. J Allergy Clin Immunol. 2013;132:1368.
30. Wood RA, Kim JS, Lindblad R, Nadeau K, Henning AK, Dawson P, et al. A randomized, double-blind, placebo-controlled study of omalizumab combined with oral immunotherapy for the treatment of cow's milk allergy. J Allergy Clin Immunol. 2016;137:1103.5.
31. Andorf S, Purington N, Block WM, Long AJ, Tupa D, Brittain E, et al. Anti-IgE treatment with oral immunotherapy in multifood allergic participants: a double-blind, randomised, controlled trial. Lancet Gastroenterol Hepatol. 2018 Feb;3(2):85-94.
32. Wood RA, Chinthrajah RS, Spergel AKR, Babineau DC, Sicherer SH, Kim EH, et al. Protocol design and synopsis: Omalizumab as Monotherapy and as Adjunct Therapy to Multiallergen OIT in Children and Adults with Food Allergy (OUtMATCH). J Allergy Clin Immunol Global. 2022;1:225-32.
33. Wood RA, Togias A, Sicherer SH, Shreffler WG, Kim EH, Jones SM, et al. Omalizumab for the Treatment of Multiple Food Allergies. N Engl J Med. 2024;390:889-99.
34. Domingo C, Pomares X, Moron A, Sogo A. Dual monoclonal antibody therapy for a severe asthma patient. Front Pharmacol. 2020;11:587621.
35. Eggert L, Chinthrajah RS. Switching and combining biologics in severe asthma: experience from a large academic teaching center. Am J Respir Crit Care Med. 2019;199:A1309.
36. Fox HM, Rotolo SM. Combination anti-IgE and anti-IL5 therapy in a pediatric patient with severe persistent asthma. J Pediatr Pharmacol Therapeut. 2021;26(3):306-10.
37. Lommatzsch M, Suhling H, Korn S, Bergmann KC, Schreiber J, Bahmer T, et al. Safety of combining biologics in severe asthma: Asthma-related and unrelated combinations. Allergy. 2022;77:2839-43.
38. Ortega G, Tongchinsumb P, Carr T. Combination biologic therapy for severe persistent asthma. Ann Allergy Asthma Immunol. 2019;123:309-11.
39. Thomes R, Darveaux J. Combination biologic therapy in severe asthma: a case series. Ann Allergy Asthma Immunol. 2018;121:S91.
40. Pitlick MM, Pongdee T. Combining Biologics Targeting Eosinophils (IL-5/IL-5R), IgE, and IL-4/IL-13 in Allergic and Inflammatory Diseases. World Allergy Organ J. 2022;13;15(11):100707.
41. Patel J, Ayars AG, Rampur L, Bronson S, Altman MC. Combination anti-IgE and anti-IL5 therapies in patients with severe persistent asthma and allergic bronchopulmonary aspergillosis (ABPA). J Allergy Clin Immunol. 2018;141:AB 234.
42. Yang N, Chen L, Shao J, Jiang F, Liu J, Li Z. Dupilumab with concomitant Janus kinase inhibitor: a novel treatment strategy for atopic dermatitis with poor response to dupilumab. Br J Dermatol. 2022;187:828-30.
43. Benko M, Hrvatin Stancic B, Lunder T. TwoTrack Biologic Therapy for Concurrent Chronic Spontaneous Urticaria and Psoriasis Vulgaris in One Patient. Actas Dermosifiliogr. 2022 Nov-Dec;113(10):T995-T996.
44. Diluvio L,Vollono L, Zangrilli A, Manfreda V, Prete MD, Massaro A, et al. Omalizumab and adalimumab: a winning couple. Immunotherapy. 2020;12(18):1287-92.
45. Koç Yildirim S, Erbagci E, Hapa A. Omalizumab treatment in combination with any other biologics: Is it really a safe duo? Australas J Dermatol. 2023;64(2):229-33.
46. Hren MG, Guenin S, Khattri S. Use of dual biologic therapy targeting the Th2 and Th17 axes simultaneously to treat patients with atopic dermatitis and concomitant psoriasis, psoriatic arthritis, or inflammatory bowel disease. J Am Acad Dermatol. 2024 Jul;91(1):138-40.
47. Menzies-Gow A, Bafadhel M, Busse WW, Casale TB, Kocks JWH, Pavord ID, et al. An expert consensus framework for asthma remission as a treatment goal. J Allergy Clin Immunol. 2020;145:757-65.
48. Thomas D, McDonald VM, Pavord ID, Gibson PG. Asthma remission: what is it and how can it be achieved? Eur Respir J. 2022;60:2102583.
49. GINA 2024. Global Strategy for Asthma Management and Prevention [Internet]. Disponível em: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS. pdf. Acessado em: 31/08/2024.
50. Jones G, Nash P, Hall S. Advances in rheumatoid arthritis. Med J Aust. 2017;206(5):221-4.
51. Smolen JS, Breedveld FC, Burmester GR, Bykerk V, Dougados M, Emery P, et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis. 2016 Jan;75(1):3-15. doi: 10.1136/annrheumdis-2015-207524.
52. Tan DJ, Lodge CJ, Walters EH, Lowe AJ, Bui DS, Bowatte G, et al. Biomarkers of asthma relapse and lung function decline in adults with spontaneous asthma remission: A population-based cohort study. Allergy. 2023;78:957-67.
53. Carpaij AO, Burgess JK, Huib AM, Kerstjens HAM, Nawijn MC, van den Berge M. A review on the pathophysiology of asthma remission. Pharmacol Ther. 2019:201:8-24. doi: 10.1016/j. pharmthera.2019.05.002.
54. Cohn J. Can asthma biologics change the course of disease and induce drug-free remission? J Allergy Clin Immunol. 2022;150(1):59-61.
55. Blaiss M, Oppenheimer J, Corbett M, Bacharier L, Bernstein J, Carr T, et al. Consensus of an American College of Allergy, Asthma, and Immunology, American Academy of Allergy, Asthma, and Immunology, and American Thoracic Society workgroup on definition of clinical remission in asthma on treatment. Ann Allergy Asthma Immunol. 2023;131:782-5.
56. Sposato B, Bianchi F, Ricci A, Scalese M. Clinical Asthma Remission Obtained with Biologics in Real Life: Patients' Prevalence and Characteristics. J Pers Med. 2023 Jun 20;13(6):1020. doi: 10.3390/jpm13061020.
57. Milger K, Suhling H, Skowasch D, Holtdirk A, Kneidinger N, Behr J, et al. Response to biologics and clinical remission in the adult German Asthma Net Severe Asthma Registry Cohort. J Allergy Clin Immunol Pract. 2023;11:2701-12. doi: 10.1016/j.jaip.2023.05.047.
58. Fokkens WJ, De Corso E, Backer V, Bernal-Sprekelsen M, Bjermer L, von Buchwald C, et al. EPOS2020/EUFOREA expert opinion on defining disease states and therapeutic goals in CRSwNP Rhinology. 2024 Jun 1;62:287-98.
59. Saydy N, Moubayed SP, Bussières M, Janjua A, Kilty S, Lavigne F, et al. What is the optimal outcome after endoscopic sinus surgery in the treatment of chronic rhinosinusitis? A consultation of Canadian experts. J Otolaryngol Head Neck Surg. 2021;50:36.
60. Bachert C, Han JK, Desrosiers MY, Gevaert P, Heffler E, Hopkins C, et al. Efficacy and safety of benralizumab in chronic rhinosinusitis with nasal polyps: A randomized, placebo-controlled trial. J Allergy Clin Immunol. 2022;149(4):1309-17 e12.
61. Bachert C, Han JK, Desrosiers M, Hellings PW, Amin N, Lee SE, et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): Results from two multicentre, randomised, double-blind, placebo-controlled, parallel-group phase 3 trials. Lancet. 2019;394(10209):1638-50.
62. Han JK, Bachert C, Fokkens W, Desrosiers M, Wagenmann M, Lee SE, et al. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE): A randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2021;9(10):1141-53.
63. Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, et al. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020 Sep;146(3):595-605.
64. Caminati M, De Corso E, Ottaviano G, Pipolo C, Schiappoli M, Seccia V, et al. Remission in Type 2 inflammatory diseases: current evidence, unmet needs, and suggestions for defining remission in chronic rhinosinusitis with nasal polyps. Curr Allergy Asthma Rep. 2024 Jan;24(1):11-23.
65. Suaini NHA, Yap GC, Bui DPT, Loo EXL, Goh AEN, Teoh OH, et al. Atopic dermatitis trajectories to age 8 years in the GUSTO cohort. Clin Exp Allergy. 2021 Sep;51(9):1195-206.
66. Blauvelt A, Guttman Yassky E, Paller AS, Simpson EL, Cork MJ, Weisman J, et al. Long Term Efficacy and Safety of Dupilumab in Adolescents with Moderate to Severe Atopic Dermatitis: Results Through Week 52 from a Phase III Open Label Extension Trial (LIBERTY AD PED OLE). Am J Dermatol. 2022;23:365-83.
67. Cork M, Diamant T, Eichenfield LF, Arkwright PD, Chen Z, Thomas RB, et al. Dupilumab safety and efficacy in a phase III open label extension trial in children 6-11 years of age with severe atopic dermatitis. Dermatol Ther. 2023;13:2.697-2.719.
68. Miyamoto S, Imai Y, Natsuaki M, Yamanishi K, Kanazawa N. Longterm remission of atopic dermatitis after discontinuation of dupilumab. Acta Dermatol. 2022;102: adv00731.
69. Watanabe A, Kamata M, Okada Y, Susuki S, Ito M, Uchida H, et al. Possibility of maintaining remission with topical therapy alone after withdrawal of dupilumab in Japanese patients with atopic dermatitis and their characteristics in the real world. Exp Dermatol. 2024;33:e15175.
70. Spergel J, Paller AS. Atopic dermatitis and the atopic march. J Allergy Clin Immunol. 2003;112(Suppl):S118-27.
71. Busse WW.The atopic march: fact or folklore? Ann Allergy Asthma Immunol. 2018;120(2):116-8.
72. Hill DA, Grundmeier RW, Ramos M, Spergel JM. Eosinophilic esophagitis Is a late manifestation of the allergic march. J Allergy Clin Immunol Pract. 2018;6:1528-33.
73. Gabryszewski SJ, Hill DA. One march, many paths: Insights into allergic march trajectories. Ann Allergy Asthma Immunol. 2021;127:293-300.
74. Canani RB, Caminati M, Caruci L, Eguiluz-Gracia I. Skin, gut, and lung barrier: Physiological interface and target of intervention for preventing and treating allergic diseases. Allergy. 2024;79:1485-500.
75. van der Rijst LP, van Royen-Kerkhof A, Pasmans SGMA, Schappin R, de Bruin-Weller MS, de Graaf M. Biologicals for pediatric patients with atopic dermatitis: practical challenges and knowledge gaps. J Dermatolog Treat. 2023 Dec;34(1):2254567.
76. Spekhorst LS, van der Rijst LP, Graaf M, van Megen M, Zuithoff NPA, Knultz AC, et al. Dupilumab has a profound effect on specific-IgE levels of several food allergens in atopic dermatitis patients. Allergy. 2023;78:875-8.
77. Guttman-Yasky E, Bissonnette R, Ungar B, Suarez-Fari M, Ardeleanu M, Esaki H, et al. Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis J Allergy Clin Immunol. 2019;143:155-72.
78. Lin TL, Fan YH, Fan KS, Juan CK, Chen YJ, Wu CY. Reduced atopic march riskin pediatric atopic dermatitis patients prescribed dupilumab versus conventionalimmunomodulatory therapy: A population-based cohort study. J Am Acad Dermatol. 2024;91(3):466-73.
79. Geba GP, Li D, Xu M, Mohammadi K, Attre R, Ardeleanu M, et al. Attenuating the atopic march: Meta-analysis of the dupilumab atopic dermatitis database for incident allergic events. J Allergy Clin Immunol. 2023;151:756-66.
80. Van der Rijst LP, Hilbrands MS, Zuithoff NPA, Bruin Weller MS, Knulst AC, Le TM, et al. Dupilumab induces a significant decrease of food specificimmunoglobulin Elevels in pediatric atopic dermatitis patients. Clin Transl Allergy. 2024;e12381.
81. Spergel JM, Du Toit G, Davis CM. Might biologics serve tointerrupt the atopic march? J Allergy Clin Immunol. 2023 Mar;151(3):590-4.
82. Phipatanakul W, Mauger DT, Guilbert TW, Bacharier LB, Durrani S, Jackson DJ, et al; PARK Study Team. Preventing asthma in high risk kids (PARK) with omalizumab: Design, rationale, methods, lessons learned and adaptation. Contemp Clin Trials. 2021 Jan;100:106228.
83. Atanasio A, Orengo JM, Sleeman MA, Neil Stahl N. BiologicalTherapy for Allergic Diseases: Peculiarities, Prospects and Challenges. Front. Allergy. 2022;3:1019255. doi: 10.3389/falgy.2022.1019255.
84. Mingomataj EC, Ibrahim T, Rizvi SA. Biological therapy for allergic diseases: peculiarities, prospects, and challenges. Front Allergy. 2024;5:1440549. doi: 10.3389/falgy.2024.1440549.
85. Russo D, Di Filippo P, Di Pillo S, Chiarelli F, Attanasi M. New Indications of biological drugs in allergic andimmunological disorders: beyond asthma, urticaria, and atopic dermatitis. Biomedicines. 2023;17;11:236. doi: 10.3390/biomedicines11020236.11(2).
86. Silverberg JI, Guttman-Yassky E, Thaçi D, Irvine AD, Gold LS, Blauvet A, et al. TwoPhase 3 trials of lebriquizumabe for moderate-to-severe atopic dermatitis. N Engl J Med. 2023;388:1080-91.
87. Müller S, Maintz L, Bieber T. Treatment of atopic dermatitis: recently approved drugs and advanced clinical development programs. Allergy. 2024;79:1501-15.
88. Croft M, Esfandiari E, Chong C, Hsu H, Kabashima K, Kricorian G, et al. OX40 in the Pathogenesis of Atopic Dermatitis-A New Therapeutic Target. Am J Clin Dermatol. 2024 May;25(3):447-61.
89. Dieteren A, Bontinck L, Conickx L, Vigan M, Dervaux N, Gassiot M, et al. A first-in-human, single and multiple dose study of lunsekimig, a novel anti-TSLP/anti-IL-13 NANOBODY® compound, in healthy volunteers. Clin Transl Sci. 2024;17:e13864.