Número Atual: Abril-Junho 2025 - Volume 9 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Avanços no tratamento da Síndrome da Bronquiolite Obliterante pós-transplante de células-tronco hematopoiéticas - uma revisão de escopo
Advances in the treatment of bronchiolitis obliterans syndrome after hematopoietic stem cell transplantation: a scoping review
Gabriela Spessatto; Isabela Grazia de Campos; Guilherme da Silva Martins; Bruno Hernandes David João; Juliana Gonçalves Primon; Thalita Gonçalves Picciani; Herberto José Chong-Neto1; Nelson Augusto Rosário-Filho; Débora Carla Chong-Silva
Complexo do Hospital de Clínicas, Universidade Federal do Paraná, Departamento de Pediatria - Curitiba, PR, Brasil
Endereço para correspondência:
Débora Carla Chong-Silva
E-mail: debchong@uol.com.br / debora.chong@ufpr.br
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 31/10/2024
aceito em: 21/12/2024.
RESUMO
O Transplante de Células-Tronco Hematopoiéticas (TCTH) é o tratamento de escolha para uma variedade de doenças neoplá-sicas e não neoplásicas em crianças. No entanto, complicações respiratórias no pós-transplante são comuns e resultam em aumento dos índices de morbidade e mortalidade. A Doença Enxerto Contra Hospedeiro (DECH) está entre as principais complicações na fase tardia, sendo a síndrome da bronquiolite obliterante (BOs), a síndrome clínica mais frequente. Caracteriza-se pelo padrão obstrutivo e de caráter progressivo, ocasionado pela obliteração da pequena via aérea. É uma condição desafiadora, uma vez que não existe tratamento específico com eficácia comprovada, além da escassez de dados na população pediátrica. O objetivo deste artigo é revisar estudos que apontam a efetividade dos tratamentos existentes para esta condição, nas diferentes modalidades, desde as terapias convencionais até as abordagens mais atuais, buscando informar os médicos assistentes envolvidos no atendimento deste grupo de pacientes. O manejo preciso e eficaz da BOs é fundamental para interromper o comprometimento da função pulmonar em médio e longo prazo, favorecendo uma maior sobrevida para os pacientes no pós-TCTH.
Descritores: Bronquiolite obliterante, transplante, tratamento, complicações pulmonares.
Introdução
O Transplante de Células-Tronco Hematopoiéticas (TCTH) representa uma opção terapêutica curativa para diversas doenças, incluindo as neoplasias hematológicas, erros inatos da imunidade e doenças não neoplásicas. Entre as complicações decorrentes desse procedimento, a Doença Enxerto Contra Hospedeiro (DECH) pulmonar, pode resultar em complicações significativas, contribuindo para a mor-bimortalidade pós-transplante1,2.
As complicações pulmonares chegam a afetar 25-50% dos receptores de TCTH, apresentando-se com manifestações agudas aquelas que ocorrem nos primeiros 120 dias após o procedimento, ou de forma subaguda/crônica, quando ocorrem em torno de 6 meses após o transplante. As complicações agudas estão associadas a uma elevada taxa de mortalidade, sendo as infecções virais, fúngicas e as complicações não infecciosas, como edema pulmonar, hemorragia alveolar difusa e a síndrome da pneumonia idiopáti-ca, as mais comuns. As complicações subagudas/crônicas possuem um curso mais insidioso, incluindo a DECH crônica de pulmão, caracterizada por duas síndromes distintas, Síndrome da Bronquiolite Obliterante (BOS, do inglês Bronchiolitis Obliterans Syndrome), com um padrão funcional obstrutivo, e a Bronquiolite Obliterante com Pneumonia Organizada (BOOP), cujo padrão é restritivo1.
A BOS é a manifestação pulmonar da DECH e caracteriza-se por obstrução das vias respiratórias, por meio de um processo inflamatório fibroprolife-rativo. Ocorre deposição de colágeno na camada subepitelial causando fibrose parcial ou completa e deposição de linfócitos associado a hiperplasia ou metaplasia do epitélio escamoso, levando à obliteração das pequenas vias aéreas3.
O processo fisiopatológico é complexo e multifa-torial. Ocorre lesão do epitélio bronquiolar do hospedeiro por mecanismos imunes e não imunes. Os macrófagos e neutrófilos desempenham um papel importante, resultando em liberação de mediadores inflamatórios, quimiotáticos e pro-fibróticos. Estudos que avaliaram lavado broncoalveolar de pacientes com BOS identificaram aumento de neutrófilos, elevações de interleucina 8, interleucina 1ra, fator de crescimento transformador beta (TGF-p), proteína quimiotática de monócitos-1 (MCP-1) e fator de necrose tumoral alfa (TNF-a)4.
A doença é geralmente assintomática, ocorrendo de forma insidiosa nos primeiros dois anos após o TCTH. O diagnóstico é suspeitado quando ocorre um declínio progressivo da função pulmonar, na ausência de outras etiologias5. Os critérios utilizados são os recomendados pelo National Institutes of Health Consensus (NIH), modificados em 2014: VEF1 < 75% ou abaixo do quinto percentil do previsto ou com queda de > 10% nos últimos 2 anos; relação VEF1/CVF < 0,70 ou abaixo do quinto percentil do previsto; evidência de aprisionamento aéreo em tomografia com espessamento brônquico ou bronquiectasias ou por aumento do volume residual > 120% do previsto em provas de função pulmonar; e ausência de infecção do trato respiratório. Porém, a biópsia com análise histológica permanece sendo o padrão ouro para confirmação6.
Apesar das modificações, esses critérios podem falhar em identificar o declínio precoce da função pulmonar, dada a utilização de um ponto de corte absoluto para o VEF1. Assim, o NIH recomenda a realização de provas de função pulmonar a cada 3 meses nos primeiros 2 anos após o TCTH, principalmente nos pacientes de alto risco, como os portadores de DECH extrapulmonar7,8.
Os fatores de risco relacionados à ocorrência de BOS são: diminuição dos níveis séricos de IgG, ocorrência anterior de DECH aguda, idade avançada do receptor ou do doador, menor relação VEF1/CVF pré-transplante, infecções virais respiratórias nos primeiros 100 dias pós TCTH, uso de bussulfan ou alta intensidade do condicionamento, doador feminino para receptor masculino e episódio anterior de pneumonite intersticial1. História de doença pulmonar pré-transplante e seropositividade para citomegalo-vírus também estão relacionados com aumento do risco de BOS9.
É uma condição particularmente desafiadora, uma vez que até o momento, nenhuma combinação de agentes terapêuticos estudados foi completamente eficaz, além disso, muitos pacientes podem permanecer assintomáticos por longos períodos apesar de já apresentarem obstrução moderada a grave nas provas de função pulmonar. Sua ocorrência está associada a um comprometimento significativo da qualidade de vida e aumento da mortalidade após o TCTH1,6,10.
Objetivos e método
Para atender nosso principal questionamento: abordagem terapêutica da BOS pós TCTH em adultos e crianças, optamos por realizar uma revisão de escopo, buscando sintetizar os estudos relevantes sobre o tema, por meio busca ampla na literatura, em bases de dados eletrônicos, utilizando as palavras-chaves bronchiolitis obliterans, transplantation, treatment, pulmonary complications. As etapas da pesquisa atenderam as descritas no método Joanna Briggs Institute11.
A Tabela 1 apresenta detalhes desta revisão, como as perguntas norteadoras, os objetivos, critérios de inclusão e exclusão, fonte de evidências, características e instrumento de extração de resultados, garantindo mais rigorosidade e transparência à revisão11.
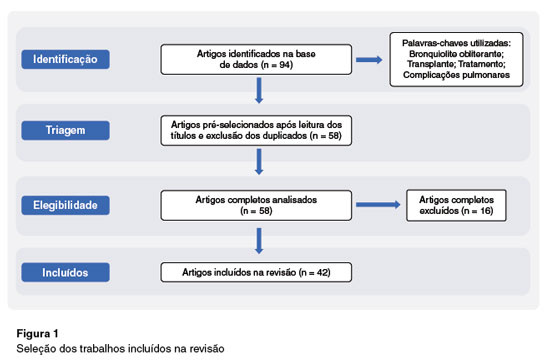
A Figura 1 mostra a seleção dos artigos, com o quantitativo final dos trabalhos selecionados para a revisão.
Resultados
Terapias de primeira linha
Corticoterapia
Partindo da teoria da ocorrência de uma desregu-lação imune relacionada à DECH e, possivelmente, também à BOS, a imunossupressão com corticoste-roides sistêmicos se apresenta como uma abordagem terapêutica utilizada nestes casos. O uso de altas doses e por longos períodos de corticosteroides foi a abordagem mais tradicional e descrita utilizada para DECH e algumas complicações agudas após o transplante, como síndrome da pneumonia idiopática e hemorragia alveolar difusa, porém seu efeito é limitado na BOS e associado a efeitos colaterais12.
Um estudo conduzido por Ratjen e cols. (2005) buscou avaliar a eficácia da terapia com corticoste-roides, na forma de pulso de metilprednisolona, em crianças submetidas ao TCTH e que desenvolveram BOS como complicação. A pesquisa abrangeu um total de 9 pacientes. No protocolo adotado, a metil-prednisolona foi administrada ao longo de três dias, na dosagem de 10 mg/kg/dia. Esse esquema de tratamento tinha a flexibilidade de ser repetido mensalmente, caso os sintomas persistissem, por até um máximo de 6 ciclos. Além do pulso de corticoide, todos os pacientes receberam budesonida inalatória como um fármaco adicional em tratamento contínuo13.
Os resultados obtidos a partir deste estudo revelaram um aumento significativo na saturação de oxigênio nos participantes, com uma normalização desse parâmetro ao término do tratamento. Notavelmente, sete dos nove pacientes mantiveram estabilidade clínica, evidenciando a ausência de deterioração na função pulmonar durante o período de acompanha-mento13. No entanto, apesar dos aspectos positivos observados, é fundamental salientar a principal limitação metodológica do estudo, que é a falta do grupo controle, impossibilitando a conclusão mais assertiva da eficácia do esquema terapêutico. O estudo de Ratjen, embora tenha fornecido insights valiosos, deve ser interpretado com cautela.
O tratamento prolongado com altas doses de pred-nisona está associado a diversas complicações e alto risco de morbidade. Os pacientes podem apresentar ganho de peso, hipertensão, infecções, osteoporose, intolerância à glicose e alteração de crescimento nas crianças. Diante disso, estudos surgiram na tentativa de associar medicações ao esquema de corticoste-roides visando melhor eficácia e menos toxicidade do uso crônico dos corticosteroides14.
As atuais recomendações das duas maiores sociedades científicas mundiais sobre a BOS pós-TCTH, a European Society for Blood and Marrow Transplantation, de 202015 e o National Institutes of Health (Wokshop), de 20216, não impõem escolhas aos especialistas. Ambas comentam sobre a cortico-terapia sistêmica de baixa dose associada a outros fármacos (FAM, etanercept, entre outros) e se mostram preocupadas com o desenvolvimento de terapias que possam, de forma efetiva, reduzir ou interromper o desenvolvimento o comprometimento funcional na BOS pós-TCTH6,15.
Azitromicina
A azitromicina é frequentemente utilizada no tratamento da síndrome da bronquiolite obliterante (BOS) devido ao seu efeito profilático e imunomodulador, podendo interromper ou reverter o declínio da função pulmonar em alguns pacientes16.
O estudo conduzido por Lam e cols., em 2011, comparou pacientes que utilizaram azitromicina com um grupo placebo durante 12 semanas, analisando questionário de sintomas e espirometria pré-tratamento e com 1, 2 ,3 e 4 meses (a última avaliação realizada 1 mês após término do tratamento). Foram incluídos 10 pacientes que receberam azitromicina e 12 pacientes no grupo controle. O estudo não encontrou alterações significativas nos escores de sintomas respiratórios e nas medições de VEF1 entre os grupos17. No entanto, um estudo realizado por Khalid e cols., de 2005, avaliou 8 pacientes com BOS pós-TCTH que utilizaram azitromicina em dias alternados por 12 semanas, comparando testes de função pulmonar pré e pós-tratamento, bem como questionário de sintomas respiratórios. Todos os pacientes toleraram bem o tratamento, 7 pacientes apresentaram melhora significativa da CVF e do VEF1 após o tratamento, uma taxa de resposta de 87%. O aumento médio dos parâmetros foi de 21,57% na CVF (p < 0,052) e de 20,58% no VEF1 (p < 0,067)18.
Em 2017, iniciou-se uma reflexão sobre o uso contínuo da azitromicina, mesmo os estudos sendo, na maioria, promissores. Bergeron e cols., em 2017, no estudo denominado Allozithro, interrompido precocemente, observaram o aumento de recidiva de doença hematológica e diminuição da sobrevida no grupo dos pacientes que utilizavam azitromicina19. Em resposta a este estudo, a FDA (Food and Drug Administration) e a EMA (Agência Europeia de Medicamentos) emitiram nota de alerta sobre o assunto, bem como a Anvisa, que também se posicionou recomendando a não prescrição do uso off label em longo prazo da azitromicina para a profilaxia da bronquiolite obliterante em pacientes após o transplante de células-tronco hematopoiéticas.
Da mesma forma, outro estudo realizado por Cheng e cols., em 2020, investigou o uso da azitromi-cina em 227 pacientes com BOS e sua relação com risco de câncer (recidiva da mesma doença ou outra neoplasia), independentemente do tempo decorrido desde o TCTH20. O estudo mostrou que a exposição à azitromicina após diagnóstico de BOS foi associado a um aumento na incidência de neoplasias, mas não com o risco de recidiva da malignidade original20. O estudo também mostrou que os pacientes que fizeram uso da azitromicina apresentaram menor risco de morte livre de neoplasias (por outras causas). Acredita-se que os efeitos adversos ocasionados pela azitromicina possam estar relacionados ao seu efeito inibitório sobre vários tipos de células, alterando as vias inflamatórias e o sistema imunológico20.
Reforçando os últimos estudos, o Consenso da Sociedade Europeia de Transplante de Sangue e de Medula (2020) enfatizou a não recomendação do uso prolongado de azitromicina para os pacientes com BOS pelo risco de recidiva da doença hematológica15.
Esses achados ressaltam a importância de uma avaliação cuidadosa dos benefícios e riscos do uso desse medicamento no contexto da BOS pós-TCTH, incluindo a avaliação do fenótipo da BOS como parte desse processo, a fim de avaliar sua possível eficácia.
Terapia FAM
A combinação dos fármacos Fluticasona, Azitromicina e Montelucaste, deu o nome à Terapia FAM. Até os dias atuais é empregada em muitos dos centros que atendem pacientes com BOS pós-TCTH. Norman e cols., em 2011, buscando avaliar a efetividade de uma terapia alternativa ao uso de imunossupressores sistêmicos, utilizaram terapia FAM, diante de suas propriedades anti-inflamatórias e/ou antifibróticas21. Um grupo de 8 pacientes foi acompanhado ao longo de 6 meses, recebendo a terapia FAM isoladamente ou em conjunto com corticosteroides sistêmicos, comparando a 14 controles que utilizaram corticoterapia somente. Ambos os grupos tiveram a dose de corticoide reduzida conforme protocolo de redução gradual da instituição. A maioria dos pacientes manteve função pulmonar estável durante esse período, não havendo diferença entre os grupos. Os resultados demonstraram uma rápida redução nas doses de prednisona nos pacientes tratados com a terapia FAM, além de uma menor dose média cumulativa de corticoide neste grupo21. Apesar dos bons resultados, o estudo teve limitações, principalmente pelo número pequeno de pacientes, natureza retrospectiva e não controlado, além de parte dos pacientes do grupo FAM (3 casos) não terem recebido uso de corticosteroides, o que pode ter gerado confundimen-to na análise dos dados.
Williams e cols., em 2016, avaliaram 36 pacientes adultos nos primeiros 6 meses após o diagnóstico de BOS e que utilizaram prednisona na dose de 1 mg/kg/dia por duas semanas em associação à terapia FAM22. Os pacientes receberam a terapia de fluti-casona inalatória (220 a 440 pg duas vezes ao dia), montelucaste (5 a 10 mg ao dia) e azitromicina (5 mg/kg até o máximo de 250 mg em dias alternados). Após 15 dias houve a redução gradual da corticoterapia sistêmica na dose de 0,25 mg/kg/dia por semana. Dos 36 pacientes, 6 (17%) não responderam e 23 (63%) obtiveram alguma resposta (3 com melhora > 10% do VEF1 pré, 7 com melhora > 5% do VEF1 pré, 5 mantiveram o VEF1 e 8 tiveram perdas de 1 a 10% do VEF1). Quanto à retirada de corticoide, 48% dos pacientes conseguiram a redução de 50% do corticoi-de em 3 meses, e 71% conseguiram reduzir 50% do corticoide em 6 meses. Esses achados indicam que terapia FAM foi bem tolerada, permitindo redução da corticoterapia sistêmica e associada a menor declínio da função pulmonar22.
Os dois trabalhos descritos acima demonstraram boa tolerabilidade desse esquema terapêutico e sua importância na redução da exposição ao uso crônico de corticosteroides. No entanto, para melhores resultados e para a indicação do uso clínico no manejo desses pacientes, idealmente cada medicação deve ser estudada independentemente em ensaios clínicos separados, além de ser necessário estudos com maior número de participantes.
Combinação de Budesonida + Formoterol Inalatório
Um estudo realizado por Bergeron e cols., em 2015, avaliou a eficácia e tolerância do uso de for-moterol com budesonida inalada como tratamento alternativo para BOS pós-TCTH. O estudo foi duplo-cego, randomizado e controlado por placebo, realizado com 32 pacientes que foram divididos em dois grupos (grupo que recebeu formoterol+budesonida e grupo placebo, durante 6 meses)23. O desfecho primário foi a alteração do VEF1 após um mês de tratamento em relação ao valor basal. Os pacientes que receberam formoterol+budesonida tiveram aumento médio de 260 mL de VEF1 x 5 mL de aumento no grupo placebo (p = 0,012)23. Além disso, a diferença do valor do VEF1 quando comparado ao valor basal foi maior no grupo que utilizou a medicação, com diferença mediana do VEF1 basal e após 1 mês de tratamento de 1240 mL (p= 0,0001), mantendo-se o efeito nos 13 pacientes que completaram 6 meses de tratamento. A dose administrada foi de budesonida 800 pg + formoterol 24 pg duas vezes ao dia por 1 mês, e, após ajustado para dose de manutenção, budesonida 400 pg + formoterol 12 pg, duas vezes ao dia, por 6 meses23.
Este estudo duplo-cego, randomizado e controlado por placebo, mostra resultados promissores com melhora significativa do VEF1 no grupo que utilizou a associação formoterol+budesonida. Considerando a eficácia desta medicação, sua segurança e disponibilidade em consegui-la, com um custo acessível, é uma opção promissora e acima de tudo poupadora de corticoterapia sistêmica, que deve considerada no manejo dos pacientes portadores desta doença.
Budesonida + Formoterol, Montelucaste e N-acetilcisteína
Seguindo com o intuito principal da redução do uso de corticoterapia sistêmica, mais associações foram estudadas no tratamento da BOS. Kim e cols., em 2016, avaliaram a combinação de formoterol, budeso-nida, montelucaste e N-acetilcisteína24. Nesse estudo, 61 pacientes diagnosticados com BOS receberam esses fármacos combinados e foram reavaliados após 3 meses. Testes de função pulmonar e escores de sintomas respiratórios foram aplicados antes e após a terapia para comparação. Os resultados mostraram taxa de resposta de 82%, média de aumento do VEF1 de 220 mL (p < 0,001) e diminuição do volume residual em 200 mL (p = 0,005)24. Sendo assim, o estudo concluiu que a terapia com formoterol, budesonida, mon-telucaste e N-acetilcisteína apresentou melhora da função pulmonar e dos sintomas respiratórios, além da ausência de efeitos adversos significativos24.
Budesonida + Formoterol e Tiotrópio
Uma opção de tratamento que vem sendo estudada é o uso de brometo de tiotrópio inalado. O tiotrópio é um anticolinérgico de ação prolongada administrado em dispositivo próprio que ocasiona tênue névoa, causando broncodilatação. Em estudo publicado em 2023, Lim Ju e cols. avaliaram se a adição de brometo de tiotrópio inalado ao esquema de formoterol+budesonida ocasionaria melhora da função pulmonar nos pacientes com BOS pós-TCTH25. O estudo incluiu 86 pacientes com diagnóstico de BOS pós-TMO conforme os critérios modificados do NIH (2014), que utilizavam formoterol+budesonida e após receberam a adição de tiotrópio ao esquema, com pelo menos 2 meses de uso. Foram comparados exames de função pulmonar antes e após a adição do tiotrópio. Houve aumento significativo do VEF1: valor absoluto de 1,47 para 1,53 (p = 0,023) e porcentagem do predito de 45% para 46,8% (p = 0,031). Ainda, 41,7% dos pacientes tiveram aumento de mais de 100 mL no VEF1 e melhora nos valores da difusão de monóxido de carbono25. Um escore para avaliação dos sintomas respiratórios foi aplicado, porém não houve diferença significativa. Como conclusão, o estudo mostrou que a adição de tiotrópio à combinação formoterol+budesonida melhorou significativamente a função pulmonar, mas não os sintomas respiratórios na BOS pós-TCTH25.
Considerando que a bronquiolite obliterante é uma doença com obstrução irreversível da via aérea, é esperado que o efeito dos broncodilatadores sejam menos eficazes do que em outras doenças da via aérea, nas quais a reversibilidade é um pouco preservada. Entretanto, o estudo acima traz uma importante reflexão sobre o efeito dos broncodilatadores nesta doença, pois a adição do tiotrópio melhorou a função pulmonar em pacientes que já estavam recebendo um esquema com broncodilatador. Talvez o efeito possa ser explicado pelos estudos em pacientes portadores de Doença Pulmonar Obstrutiva Crônica (DPOC), em que a combinação de um beta-agonista de ação prolongada com um antimuscarínico de ação prolongada trouxe melhora mais acentuada da broncodilatação do que seu uso isolado25,26.
Apesar das limitações, como natureza retrospectiva, ausência de grupo controle e avaliação de curto prazo da medicação, é um estudo que chama atenção pelo efeito positivo causado por um antimuscarínico de ação prolongada (tiotrópio), e que, levando em conta sua segurança e experiência com outras doenças, pode sim ser considerado como tentativa de tratamento para estes pacientes.
Terapias de segunda linha/alternativas
Fotoferese extracorpórea
A fotoferese extracorpórea (ECP) tem demonstrado efetividade no tratamento da doença do enxerto contra hospedeiro (DECH) em estudos clínicos. No entanto, seu uso no contexto da BOS ainda é incerto. Lucid e cols., em 2011, em um estudo prospectivo, investigaram o uso da fototerapia extracorpórea em 9 pacientes com BOS sintomática e refratária ao tratamento convencional (azitromicina, corticoides inalatórios e montelucaste)27. Os resultados demonstraram que a adição da ECP ao regime de tratamento da BOS resultou em uma melhora mais rápida dos sintomas e das provas de função pulmonar, onde 67% dos pacientes responderam ao tratamento e 2 dos 3 pacientes que não se qualificaram como respondedores ainda apresentaram melhora dos sintomas e mantiveram o VEF1 estável ou em diminuição. Esses achados sugerem que a fototerapia extracorpórea pode ser uma opção terapêutica eficaz para pacientes com BOS refratária ao tratamento convencional27.
Apesar da fotoferese extracorpórea ser uma terapia celular que tem demonstrado eficácia e segurança em doenças autoimunes, incluindo a DECH, é um procedimento que poucas instituições de saúde conseguem realizar. É necessário equipamento específico para realização da exposição extracorpórea por aférese, equipe especializada e treinada para realização, além de alto custo envolvido28.
Moduladores de citocinas (Inibidores de TNF-a e rituximabe)
Inibidores de TNF-a (Etanercept e Infliximabe)
Insights sobre o papel das citocinas pró-inflamatórias na patogênese da doença, levaram à investigação do inibidor de fator de necrose tumoral alfa (TNF-a) como possível tratamento a ser utilizado. O estudo de Yanik e cols., em 2012, avaliou 34 pacientes com DECH pulmonar crônica entre 8 e 65 anos de idade, sendo que 25 apresentavam distúrbio obstrutivo e 9 tinham distúrbio restritivo. Foi administrado etanercept, uma proteína dimérica de ligação ao TNF-a, na dose de 0,4 mg/kg/dose, via subcutânea, duas vezes na semana, por 4 a 12 semanas, sendo mantido o uso de corticoide (33 dos 34 participantes estavam em uso). O estudo demonstrou taxa de resposta de 32% e taxa de sobrevida em 5 anos de 61% para todos os pacientes e de 90% para aqueles que responderam à terapia. Ainda, o uso do etanercept foi bem tolerado, sem ocorrência de complicações infecciosas. Apesar de algumas limitações do estudo, como não ter havido grupo controle para comparação, o perfil de toxicidade do etanercep apoia o desenvolvimento de ensaios maiores e randomizados para investigar de forma mais aprofundada seu papel no tratamento dos pacientes com DECH pulmonar29. O infliximabe, um anticorpo monoclonal que inibe a TNF-a, tem sido estudado como uma opção de tratamento para BOS, uma vez que o TNF-a desempenha um papel importante na inflamação. Fullmer e cols., em 2005, relataram o caso de uma criança de 8 anos, com BOS diagnosticada 5 meses após o TCTH, e que fez uso de infliximabe após falha de terapia com corticosteroides. Foi administrado infliximabe na dose de 10 mg/kg, duas vezes na semana em 4 doses, depois semanalmente por 4 doses, e depois reduzido para uma vez a cada duas semanas por 2 meses. Um mês após término do tratamento, houve resposta à terapia, com a cessação da tosse, resolução da doença pulmonar obstrutiva por meio de espirometria e melhora nos achados da tomografia computadorizada de tórax. O uso do infliximabe e de outras terapias imunossu-pressoras visa reduzir a progressão da inflamação e melhorar a função pulmonar, mas ainda há necessidade de mais pesquisas para confirmar sua eficácia em casos específicos de BOS após transplante30.
Rituximabe
Embora tradicionalmente a DECH seja tradicionalmente considerada impulsionada por células T alorreativas derivadas do doador, há evidências crescentes implicando as células B na patogênese da DECH crônica. O rituximabe, um anticorpo monoclonal anti-CD20, é usado para suprimir a função das células B e tem sido estudado no tratamento da BOS pós-TCTH31.
Brownback e cols., em 2017, avaliaram as provas de função pulmonar de pacientes com BOS pós-TCTH refratária a corticosteroides buscando determinar o efeito do rituximabe na dosagem de corticosteroides nesses pacientes e se a combinação com outras modalidades de tratamento poderia melhorar a resposta clínica. Treze pacientes, de 19 a 65 anos, foram avaliados durante 12 meses após tratamento com rituximabe. Houve uma melhora na taxa de declínio da função pulmonar, passando de -5,12 mL/mês antes da infusão de rituximabe para -0,31 mL/mês após 3 meses e para -2,27 mL/mês 12 meses depois. Sete dos 13 pacientes tiveram um aumento no VEF1 após o tratamento com rituximabe. Além disso, a dose média diária de prednisona diminuiu de 27 mg antes do tratamento com rituximabe para 11 mg 12 meses após o tratamento. Não houve complicações associadas às infusões de rituximabe. Cinco dos 13 pacientes morreram, sendo 4 em decorrência das complicações da DECH e 1 por recidiva da doença31.
Todos os pacientes estavam utilizando corticos-teroides inalatórios, azitromicina e montelucaste. Os pacientes que apresentaram melhora no VEF1 estavam recebendo fotoferese extracorpórea concomitante, e a maioria também estava sendo tratada com ruxolitinibe. Isso pode representar uma sinergia de terapias combinadas, levando a uma melhora na função pulmonar em pacientes com BOS pós-TCTH. Seu papel na imunossupressão e na modulação da DECH o torna uma opção interessante no manejo de complicações pulmonares após o TCTH, sendo uma terapia segura e que pode complementar os regimes de tratamento atuais para BOS31.
Células-tronco mesenquimais
Em vista da complexidade no tratamento da BOS, têm sido conduzidos estudos adicionais buscando abordagens terapêuticas eficazes e seguras. Um desses estudos avalia a eficácia do uso de células-tronco mesenquimais, conforme demonstrado por Chen e cols., em 201929. Nesse estudo de coorte prospectiva e multicêntrico, 81 pacientes com BOS receberam infusões de células-tronco mesenquimais em combinação com prednisona e azitromicina ou isoladamente. Os resultados revelaram melhorias significativas no VEF1 e uma redução na dose de corticosteroides. Além disso, a terapia com células-tronco mesenquimais mostrou-se mais eficaz do que o tratamento apenas com esteroides e azitromicina, com uma taxa de resposta de 71% no grupo que recebeu a nova terapêutica, em comparação a 44% no grupo que não a recebeu32.
As células-tronco mesenquimais possuem efeito imunomodulador sobre a imunidade adaptativa e inata, podendo ser uma terapia promissora no contexto da BOS32. Este estudo mostrou resultados interessantes, porém possui limitações. O desenho do estudo não realizou randomização com cegamento e grupo placebo e os resultados foram avaliados com três meses de terapia, não sendo considerada a resposta duradoura após este período. Como consequência, os resultados devem ser interpretados com cautela, e os efeitos das células-tronco mesenquimais mais bem avaliados em estudos randomizados maiores, e com desfecho de longo prazo.
Ciclosporina inalatória
Um estudo de fase 2 avaliou ciclosporina inalada em 20 pacientes com diagnóstico de BOS, na faixa etária de 14 a 71 anos. A resposta ao tratamento foi avaliada com testes de função pulmonar com 18 semanas de uso da ciclosporina. Citologia e mediadores inflamatórios do lavado broncoalveolar foram avaliados no início do estudo e após 18 semanas. O estudo foi concluído com 11 pacientes, pois nove interromperam o tratamento devido a efeitos colaterais (tosse e broncoespasmo), piora do VEF1 ou recidiva de doença primária. Entre os que completaram o estudo, 4 apresentaram melhora no VEF1 (aumento de 10% em relação ao basal), 5 apresentaram doença estável (aumento do VEF1 ou queda inferior a 10% do basal) e 2 não responderam. O lavado broncoalveolar mostrou predomínio de neutrófilos no início e fim do tratamento, havendo aumento de metaloproteinase 9 e redução da proteína PD-L1 nas 18 semanas33.
O estudo demonstrou que a ciclosporina inalada levou à melhora ou estabilização das provas de função pulmonar e/ou diminuição da imunossupressão sistêmica em 9 dos 11 pacientes que concluíram o estudo. Porém, foi um estudo com pouco pacientes, sem grupo controle, além de ter havido um número significativo de efeitos colaterais associados à medicação33.
Terapias biológicas (imatinibe e belimumabe)
Imatinibe
O mesilato de imatinibe, um antineoplásico inibidor da tirosina quinase, foi recentemente estudado para doença do enxerto contra hospedeiro. Faraci e cols., em 2020, avaliaram 26 casos de bronquiolite obliterante em uma série de 293 crianças submetidas ao transplante de medula óssea. O estudo, observacional e retrospectivo, avaliou pacientes que receberam ima-tinibe e os que não utilizaram a medicação, num total de 13 pacientes em cada grupo. A dose administrada foi de 100-300 mg/dia, com média de 100 mg. A medicação foi bem tolerada e não houve efeitos colaterais. Além do imatinibe, os pacientes estavam em uso de outras medicações, como azitromicina, montelucaste, metilprednisolona (50% dos pacientes), ciclosporina (em 53,8%), tacrolimus (em 15,4%) e ciclosporina com metilprednisolona (15,4%)34.
A sobrevida estimada em 1 ano foi de 71,9% (IC 95%, 47,6±86,49) no grupo que não recebeu imatinibe, e 83,3% (IC 95%, 27,3±97,5) no grupo que fez uso da medicação. Após 4 anos, teve diminuição da sobrevida no grupo sem imatinibe, mas permaneceu estável no grupo que fez uso, 42,6% e 83,3%, respectivamente, além de menor mortalidade no grupo que recebeu a medicação 70,7% x 84,6% (p < 0,001). A função pulmonar dos pacientes foi acompanhada, observando-se uma melhora no VEF1 ao longo do tempo no grupo que utilizou imatinibe e redução do parâmetro no grupo sem a medicação34.
Apesar dos resultados positivos observados na sobrevida no grupo de pacientes que fez uso de imatinibe, foi um estudo retrospectivo e observacional, com pequeno grupo de pacientes participantes, sendo necessários mais estudos prospectivos para confirmar estes resultados.
Belimumabe
O fator ativador de células B (BAFF), um membro da família do fator de necrose tumoral, tem sido amplamente revisado desde sua descoberta em 1999, particularmente no campo da autoimunidade, no qual desempenha um papel crucial. Foi identificado que pacientes portadores de DECH crônica possuem níveis aumentados de BAFF no soro, sugerindo fortemente um papel das células B na patogênese da DECH. Concentrações elevadas de BAFF no soro, em combinação com números de células CD19+ CD21lo, são utilizadas com sucesso para avaliar o risco de BOS em receptores de TCTH35,36.
O belimumabe é um anticorpo monoclonal totalmente humano IgG1-l recombinante que inibe a ligação do BAFF aos seus receptores nas células B, inibindo a sobrevivência das células B alorreati-vas. Possui eficácia bem estabelecida em doenças autoimunes como o lúpus eritematoso sistêmico e nefrite lúpica ativa, mas estudos estão sendo realizados para avaliar seu uso em outras condições relacionadas à disfunção das células B, como a BOS pós-TCTH35,36.
Um estudo de fase I, de centro único, conduzido por Pusic e cols., em 2021, avaliou se o direcionamento ao BAFF precocemente após o TCTH alogê-nico teria um efeito favorável sobre a incidência ou a gravidade da DECH crônica. Os pacientes incluídos eram adultos em remissão completa e testaram negativo para doença residual mínima 30 dias após o transplante. Os pacientes receberam belimumabe na dose de 10 mg/kg a cada 2 semanas por 3 doses, seguidas por mais 4 doses em intervalos mensais. O início do tratamento começou de 50 a 80 dias após o transplante. Os pacientes que receberam pelo menos uma dose foram avaliados quanto à segurança, e aqueles que receberam pelo menos duas doses para avaliação de eficácia. Oito dos 9 pacientes receberam com sucesso todas as 7 doses planejadas de belimu-mabe. Após mais de 20 meses de acompanhamento, 5 estão vivos sem evidência de DECH crônica. Dois pacientes desenvolveram DECH de moderada a severa na pele, olhos, boca e fígado, e dois pacientes apresentaram recidiva de doença, porém possuíam malignidades de alto risco. Nenhum evento adverso igual ou superior ao grau 3 foi relatado. Também não houve infecções significativas ou mielossupressão37. Esse estudo descreve pela primeira vez o uso do belimumabe para profilaxia da DECH crônica, e os resultados foram encorajadores, uma vez que foi bem tolerado e não houve aumento de infecções graves. No entanto, estudos com mais pacientes serão necessários para avaliar mais a fundo o impacto do belimumabe na incidência de DECH37.
Terapias antifibróticas (nintedanibe e pirfenidona)
Tang e cols., em 2020, descreveram um relato de caso de um paciente de 18 anos que iniciou com sintomas de tosse e dispneia cerca de 1 ano após o TCTH. A tomografia apresentava bronquiectasias, es-pessamento de septos e acometimento intersticial. Os testes de função pulmonar demonstraram CVF 36,9%, VEF1 38,7% e volume residual de 125% do previsto. Havia utilizado montelucaste, azitromicina, formoterol com budesonida inalada, bem como metilprednisolo-na, sem melhora. Como o nintedanibe é um inibidor intracelular de tirosina quinase, com efeito em fator de crescimento endotelial vascular e de fibroblastos, inferiu-se uma possibilidade de seu uso nas BOS pós-TCTH, dado que este medicamento também é aprovado para fibrose pulmonar idiopática. A tosse e dispneia melhoraram após 2 semanas de tratamento, e, com 1 mês de uso, foi observada melhora na função pulmonar e nos achados de tomografia38.
Na mesma linha de tratamento, a pirfenidona, com suas propriedades anti-inflamatórias e antifibróticas, age atenuando a síntese de colágeno estimulada pelo TGF-p reduzindo a proliferação de fibroblastos. Matthaiou e cols., em 2022, em estudo de fase 1, não randomizado, avaliaram a tolerabilidade ao uso da pirfenidona e os testes de função pulmonar durante um ano em pacientes com diagnóstico de BOS pós-TCTH. Foram avaliados 22 pacientes, dos quais 13 (59%) toleraram a medicação. Houve um aumento de 7% na média anual do VEF1 e uma melhora na capacidade física e dispneia relatada pelos pacientes39.
Neste estudo de fase I, o tratamento com pirfenidona foi seguro. A estabilização nas provas de função pulmonar e as melhorias nos desfechos relatados pelos pacientes sugerem o potencial da pirfenidona para o tratamento da BOS e apoiam a realização de um ensaio clínico randomizado controlado para avaliar a eficácia da pirfenidona na BOS pós-TCTH39.
Transplante pulmonar
Em um contexto de uma doença pulmonar grave, com alta morbimortalidade e baixa resposta terapêutica, o transplante pulmonar emerge como uma opção terapêutica viável. Um relato de caso de Sano e cols., de 2005, descreve paciente do sexo feminino, com 29 anos de idade, que desenvolveu BOS pós-TCTH e que foi refratária a inúmeros tratamentos empregados (ciclosporina, prednisona, metotrexato, tacrolimus, oxigenoterapia domiciliar)40. Diante da deterioração clínica, pneumotórax espontâneo e evolução para franca insuficiência respiratória, optou-se pelo transplante de pulmão de um doador vivo. Após 38 meses do transplante, quando o relato foi descrito, a paciente encontrava-se em bom estado de saúde, sem sinais de rejeição aguda, infecção ou BOS40.
Outro relato de caso, descrito por Rabitsch e cols. em 2001 documentou o caso de uma paciente de 37 anos que desenvolveu BOS com refratariedade ao tratamento com corticosteroides, fototerapia extracorpórea e ciclosporina41. Após um ano do TCTH, a mesma foi submetida a um transplante pulmonar. Após 23 meses do transplante, quando o relato foi descrito, não apresenta sinais de rejeição e os exames de função pulmonar estão dentro da faixa de normalidade41.
Relatos de casos isolados, com resultados satisfatórios, proporcionando melhorias na qualidade de vida e na sobrevida de pacientes com BOS avançada pós-TCTH, apontam esta modalidade de tratamento como uma alternativa terapêutica para pacientes graves. No entanto, é fundamental ressaltar que são necessários estudos adicionais para avaliar de forma mais abrangente a eficácia desse procedimento, ressaltando que é uma intervenção complexa, associada a riscos e cujas indicações são muito específicas, requerendo uma cuidadosa seleção de pacientes.
Terapias em estudo
Um estudo de fase 1b/2 está avaliando o uso da medicação oral Alvelestat (MPH966), um inibidor da elastase de neutrófilos via oral, para tratamento de pacientes portadores de DECH e BOS pós-TCTH42.
Além das opções medicamentosas voltadas para a BOS, é importante o manejo adequado das comorbidades, fatores precipitantes de exacerbações, controle e tratamento de infecções, tratamento imunossupressivo relacionado ao transplante e reabilitação pulmonar9.
O acompanhamento nutricional individualizado, com aporte adequado de macro e micronutrien-tes, principalmente nos pacientes com perda de peso, também é essencial na evolução da doença pulmonar5.
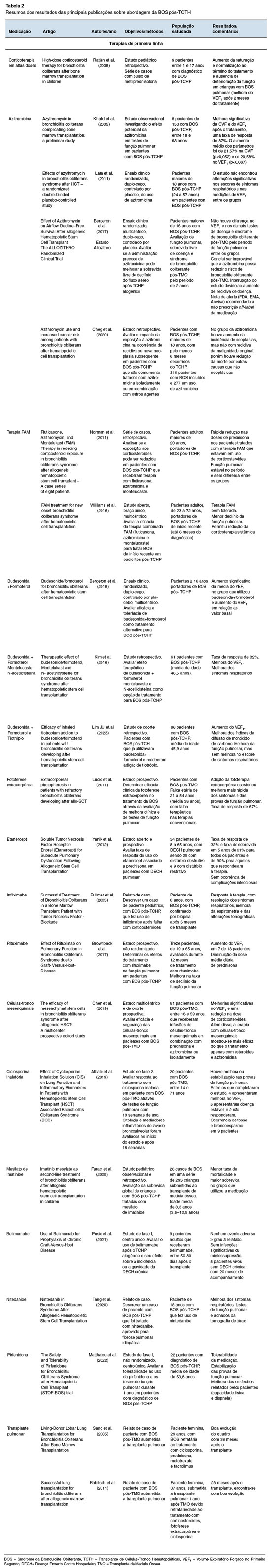
Os resultados dos principais trabalhos comentados foram resumidos na Tabela 2.
Conclusão
Complicações pulmonares, como a síndrome da bronquiolite obliterante (BOS), são frequentes após o transplante de medula óssea e importante causa de morbidade e mortalidade em adultos e crianças. Detectar a doença precocemente e instituir um tratamento adequado são fatores determinantes para o prognóstico desses pacientes.
Respostas individuais e variadas são esperadas, e a busca incessante dos autores por fármacos isolados ou em combinações que possam poupar estes pacientes do uso prolongado e de altas doses de corticosteroides sistêmicos é nobre e justifica-se, especialmente, na população pediátrica.
O tratamento da síndrome da bronquiolite obliterante pós-TCTH representa um desafio para especialistas no mundo todo. Estudos que compreendam profundamente a inflamação bronquiolar e demais fatores envolvidos na BOS pós-TCTH são necessá-rios para o melhor entendimento da fisiopatologia da doença, e podem ser o ponto de partida na escolha do tratamento eficaz e de precisão.
Referências
1. Yoshihara S,Yanik G, Cooke KR, Mineishi S. Bronchiolitis obliterans syndrome (BOS), bronchiolitis obliterans organizing pneumonia (BOOP), and otherlate-onset noninfectious pulmonary complications following allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2007 Jul;13(7):749-59.
2. Chong-Silva DC, Schneider PM, Jardim TAP, Nichele S, Loth G, Riedi CA, et al. Pulmonary complications after hematopoietic stem cell transplantation in children: a functional and tomographic evaluation. J Bras Pneumol. 2022 Sep 26;48(5):e20220134.
3. Afessa B, Abdulai RM, Kremers WK, Hogan WJ, Litzow MR, Peters SG. Risk factors and outcome of pulmonary complications after autologous hematopoietic stem cell transplant. Chest. 2012 Feb;141(2):442-50.
4. Elssner A, Jaumann F, Dobmann S, Behr J, Schwaiblmair M, Reichenspurner H, et al. Elevated levels of interleukin-8 and transforming growth factor-beta in bronchoalveolar lavage fluid from patients with bronchiolitis obliterans syndrome: proinflammatory role of bronchial epithelial cells. Munich Lung Transplant Group. Transplantation. 2000 Jul 27;70(2):362-7.
5. Williams KM. How I treat bronchiolitis obliterans syndrome after hematopoietic stem cell transplantation. Blood. 2017 Jan;129(4):448-55.
6. Tamburro RF, Cooke KR, Davies SM, Goldfarb S, Hagood JS, Srinivasan A, et al.; Pulmonary Complications of Pediatric Hematopoietic Stem Cell Transplantation Workshop Participants. Pulmonary Complications of Pediatric Hematopoietic Cell Transplantation. A National Institutes of Health Workshop Summary. Ann Am Thorac Soc. 2021 Mar;18(3):381-94.
7. Bergeron A, Cheng GS. Bronchiolitis Obliterans Syndrome and Other Late Pulmonary Complications After Allogeneic Hematopoietic Stem Cell Transplantation. Clin Chest Med. 2017 Dec;38(4):607-21.
8. Kavaliunaite E, Aurora P. Diagnosing and managing bronchio-litis obliterans in children. Expert Rev Respir Med. 2019;13(5):481-8.
9. Glanville AR, Benden C, Bergeron A, Cheng GS, Gottlieb J, Lease ED, et al. Bronchiolitis obliterans syndrome after lung or haematopoietic stem cell transplantation: current management and future directions. ERJ Open Res. 2022 Jul 25;8(3):00185-2022.
10. Cavallaro D, Guerrieri M, Cattelan S, Fabbri G, Croce S, Armati M, et al., Tuscany Transplant Group, Bergantini L. Markers of Bronchiolitis Obliterans Syndrome after Lung Transplant: Between Old Knowledge and Future Perspective. Biomedicines. 2022 Dec 17;10(12):3277.
11. Aromataris E, Lockwood C, Porritt K, Pilla B, Jordan Z, eds. JBI Manual for Evidence Synthesis. JBI; 2024. Disponível em: https://synthesismanual.jbi.global. doi: 10.46658/JBIMES-24-01.
12. Norman BC, Jacobsohn DA, Williams KM, Au BK, Au MA, Lee SJ, et al. Fluticasone, azithromycin and montelukast therapy in reducing corticosteroid exposure in bronchiolitis obliterans syndrome after allogeneic hematopoietic SCT : a case series of eight patients. Bone Marrow Transplant. 2011 Oct;46(10):1369-73.
13. Ratjen F, Rjabko O, Kremens B. High-dose corticosteroid therapy for bronchiolitis obliterans after bone marrow transplantation in children. Bone Marrow Transplant. 2005 Jul;36(2):135-8.
14. Koc S, Leisenring W, Flowers ME, Anasetti C, Deeg HJ, Nash RA, et al. Therapy for chronic graft-versus-host disease: arandomized trial comparing cyclosporine plus prednisone versus prednisone alone. Blood. 2002 Jul 1;100(1):48-51.
15. Penack O, Marchetti M, Ruutu T, Aljurf M, Bacigalupo A, Bonifazi F, et al. Prophylaxis and management of graft versus host disease after stem-cell transplantation for haematological malignancies: updated consensus recommendations of the European Society for Blood and Marrow Transplantation. Lancet Haematol. 2020 Feb;7(2):e157-e167.
16. Verleden GM, Vanaudenaerde BM, Dupont LJ, Van Raemdonck DE. Azithromycin reduces airway neutrophilia and interleukin-8 in patients with bronchiolitis obliterans syndrome. Am J Respir Crit Care Med. 2006 Sep 1;174(5):566-70.
17. Lam DC, Lam B, Wong MK, Lu C, Au WY, Tse EW, et al. Effects of azithromycin in bronchiolitis obliterans syndrome after hematopoietic SCT--a randomized double-blinded placebo-controlled study. Bone Marrow Transplant. 2011 Dec;46(12):1551-6.
18. Khalid M, Al Saghir A, Saleemi S, Al Dammas S, Zeitouni M, Al Mobeireek A, et al. Azithromycin in bronchiolitis obliterans complicating bone marrow transplantation: a preliminary study. Eur Respir J. 2005 Mar;25(3):490-3.
19. Bergeron A, Chevret S, Granata A, Chevallier P, Vincent L, Huynh A, et al.; ALLOZITHRO Study Investigators. Effect of Azithromycin on Airflow Decline-Free Survival After Allogeneic Hematopoietic Stem Cell Transplant: The ALLOZITHRO Randomized Clinical Trial. JAMA. 2017 Aug 8;318(6):557-66.
20. Cheng GS, Bondeelle L, Gooley T, He Q, Jamani K, Krakow EF, et al. Azithromycin Use and Increased Cancer Risk among Patients with Bronchiolitis Obliterans after Hematopoietic Cell Transplantation. Biol Blood Marrow Transplant. 2020 Feb;26(2):392-400.
21. Norman BC, Jacobsohn DA, Williams KM, Au BK, Au MA, Lee SJ, et al. Fluticasone, azithromycin and montelukast therapy in reducing corticosteroid exposure in bronchiolitis obliterans syndrome after allogeneic hematopoietic SCT : a case series of eight patients. Bone Marrow Transplant. 2011 Oct;46(10):1369-73.
22. Williams KM, Cheng GS, Pusic I, Jagasia M, Burns L, Ho VT, et al. Fluticasone, Azithromycin, and Montelukast Treatment for New-Onset Bronchiolitis Obliterans Syndrome after Hematopoietic Cell Transplantation. Biol Blood Marrow Transplant. 2016 Apr;22(4):710-6.
23. Bergeron A, Chevret S, Chagnon K, Godet C, Bergot E, Peffault de Latour R, et al. Budesonide/Formoterol for bronchiolitis obliterans after hematopoietic stem cell transplantation. Am J Respir Crit Care Med. 2015 Jun 1;191(11):1242-9.
24. Kim SW, Rhee CK, Kim YJ, Lee S, Kim HJ, Lee JW. Therapeutic effect of budesonide/formoterol, montelukast and N-acetylcysteine for bronchiolitis obliterans syndrome after hematopoietic stem cell transplantation. Respir Res. 2016 May 26;17(1):63.
25. Lim JU, Park S, Yoon JH, Lee SE, Cho BS, Kim YJ, et al. Efficacy of inhaled tiotropium add-on to budesonide/formoterol in patients with bronchiolitis obliterans developing after hematopoietic stem cell transplantation. Respir Med. 2023 Nov;218:107410.
26. Rhee CK, Yoshisue H, Lad R. Fixed-Dose Combinations of Long-Acting Bronchodilators for the Management of COPD: Global and Asian Perspectives. Adv Ther. 2019 Mar;36(3):495-519.
27. Lucid CE, Savani BN, Engelhardt BG, Shah P, Clifton C, Greenhut SL, et al. Extracorporeal photopheresis in patients with refractory bronchiolitis obliterans developing after allo-SCT. Bone Marrow Transplant. 2011 Mar;46(3):426-9.
28. Asensi Cantó P, Sanz Caballer J, Solves Alcaína P, de la Rubia Comos J, Gómez Seguí I. Extracorporeal Photopheresis in Graft-versus-Host Disease. Transplant Cell Ther. 2023 Sep;29(9):556-66.
29. Yanik GA, Mineishi S, Levine JE, Kitko CL, White ES, Vander Lugt MT, et al. Soluble tumor necrosis factor receptor: enbrel (etanercept) for subacute pulmonary dysfunction following allogeneic stem cell transplantation. Biol Blood Marrow Transplant. 2012 Jul;18(7):1044-54.
30. Fullmer JJ, Fan LL, Dishop MK, Rodgers C, Krance R. Successful treatment of bronchiolitis obliterans in a bone marrow transplant patient with tumor necrosis factor-alpha blockade. Pediatrics. 2005 Sep;116(3):767-70. doi: 10.1542/peds.2005-0806. PMID: 16140721.
31. Brownback KR, Thomas LA, McGuirk JP, Ganguly S, Streiler C, Abhyankar S. Effect of Rituximab on Pulmonary Function in Bronchiolitis Obliterans Syndrome due to Graft-Versus-Host-Disease. Lung. 2017 Dec;195(6):781-8. doi: 10.1007/s00408-017-0051-0. Epub 2017 Sep 11. PMID: 28894914.
32. Chen S, Zhao K, Lin R, Wang S, Fan Z, Huang F, et al. The efficacy of mesenchymal stem cells in bronchiolitis obliterans syndrome after allogeneic HSCT: A multicenter prospective cohort study. EBioMedicine. 2019 Nov;49:213-22.
33. Athale J, Gormley NJ, Reger R, Alsaaty A, Reda D, Worthy T, et al. Effect of Cyclosporine Inhalation Solution (CIS) on Lung Function and Inflammatory Biomarkers in Patients with Hematopoietic Stem Cell Transplant (HSCT) Associated Bronchiolitis Obliterans Syndrome (BOS). Blood. 2019;134 (Supplement 1):4552.
34. Faraci M, Ricci E, Bagnasco F, Pierri F, Giardino S, Girosi D, et al. Imatinib melylate as second-line treatment of bronchiolitis obliterans after allogenic hematopoietic stem cell transplantation in children. Pediatr Pulmonol. 2020 Mar;55(3):631-7.
35. Vincent FB, Saulep-Easton D, Figgett WA, Fairfax KA, Mackay F The BAFF/APRIL system: emerging functions beyond B cell biology and autoimmunity. Cytokine Growth Factor Rev. 2013 Jun;24(3):203-15. doi: 10.1016/j.cytogfr.2013.04.003.
36. Jeon Y, Lim JY, Im KI, Kim N, Cho SG. BAFF blockade attenuates acute graft-versus-host disease directly via the dual regulation of T- and B-cell homeostasis. Front Immunol. 2022 Dec 6;13:995149. doi: 10.3389/fimmu.2022.995149.
37. Pusic I, Johanns T, Sarantopoulos S, Westervelt P, Cashen A, Uy G, et al. Use of belimumab for prophylaxis of chronic graft-versus-host disease. Presented at: 2022 Tandem Meetings Transplantation & Cellular Therapy Meetings of ACTCT and CIBMTR; April 23-26, 2022; Salt Lake City, UT. Abstract 34.
38. Tang W,Yu T, Dong T, LiuT, Ji J. Nintedanib in Bronchiolitis Obliterans Syndrome After Allogeneic Hematopoietic Stem Cell Transplantation. Chest. 2020 Sep;158(3):e89-e91.
39. Matthaiou EI, Sharifi H, O'Donnell C, Chiu W, Owyang C, Chatterjee P, et al. The safety and tolerability of pirfenidone for bronchiolitis obliterans syndrome after hematopoietic cell transplant (STOP-BOS) trial. Bone Marrow Transplant. 2022 Aug;57(8):1319-1326. doi: 10.1038/s41409-022-01716-4.
40. Sano Y, Date H, Nagahiro I, Aoe M, Shimizu N. Living-donor lobar lung transplantation for bronchiolitis obliterans after bone marrow transplantation. Ann Thorac Surg. 2005 Mar;79(3):1051-2.
41. Rabitsch W, Deviatko E, Keil F, Herold C, Dekan G, Greinix HT, et al. Successful lung transplantation for bronchiolitis obliterans after allogeneic marrow transplantation. Transplantation. 2001 May 15;71(9):1341-3.
42. A Phase 1b/2 Study of alvelestat (MPH966), an Oral Neutrophil Elastase Inhibitor, in Bronchiolitis Obliterans Syndrome after Allogeneic Hematopoietic Stem Cell Transplantation.