Número Atual: Abril-Junho 2025 - Volume 9 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Claudia França Cavalcante Valente
- Ana Karolina Barreto Berselli Marinho
- Ekaterini Simões Goudoris
- Anete Sevciovic Grumach
- Fátima Rodrigues Fernandes
- Claudia Leiko Yonekura Anagusko
- Clarissa Morais Bussato Gerhardt
- Gisele Feitosa Zuvanov Casado
- Angelica Varela Rondon
- Monica Araujo Álvares Silva
- Ronney Corrêa Mendes
- Antonio Paulo Costa Penido
- Lorena de Castro Diniz
- Bianca Noleto Ayres Guimarães
- Ana Paula Neves Burian
- Renato de Ávila Kfouri
- Fabio Chigres Kuschnir
- Mônica Levi
ARTIGO ESPECIAL
Vacinação em pacientes com erros inatos da imunidade ou em uso de imunossupressores ou imunobiológicos: recomendações conjuntas da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Imunizações
Vaccination in patients with inborn errors of immunity or receiving immunosuppressive or biologic therapy: joint recommendations of the Brazilian Association of Allergy and Immunology and the Brazilian Immunization Society
Claudia França Cavalcante Valente1,2,3; Ana Karolina Barreto Berselli Marinho1,4; Ekaterini Simões Goudoris5,6; Anete Sevciovic Grumach6,7; Fátima Rodrigues Fernandes1,8; Claudia Leiko Yonekura Anagusko1,4; Clarissa Morais Bussato Gerhardt1,4; Gisele Feitosa Zuvanov Casado1,9; Angelica Varela Rondon1,10; Monica Araujo Álvares Silva1,2; Ronney Corrêa Mendes1,11; Antonio Paulo Costa Penido1,12; Lorena de Castro Diniz1,13; Bianca Noleto Ayres Guimarães1,14; Ana Paula Neves Burian3,15; Renato de Ávila Kfouri3,16; Fabio Chigres Kuschnir17,18; Mônica Levi3,19
1. Associação Brasileira de Alergia e Imunologia (ASBAI), Departamento Científico Imunizações - São Paulo, SP, Brasil
2. Hospital da Criança de Brasília, Serviço de Alergia e Imunologia - Brasília, DF, Brasil
3. Membro da Comissão Técnica para Revisão dos Calendários Vacinais da Sociedade Brasileira de Imunizações (SBIm) - São Paulo, SP, Brasil
4. Universidade de São Paulo - Hospital das Clínicas, Serviço de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
5. Departamento de Pediatria da Faculdade de Medicina da UFRJ, Serviço de Imunologia Clínica e Alergia do IPPMG - Rio de Janeiro, RJ, Brasil
6. ASBAI, Departamento Científico de Erros Inatos da Imunidade - São Paulo, SP, Brasil
7. Centro Universitário Saúde ABC, Faculdade de Medicina, Serviço de Referência de Doenças Raras, Imunologia Clínica - Santo André, SP, Brasil
8. Hospital Infantil Sabará, Fundação José Luiz Egydio Setúbal, Instituto PENSI - São Paulo, SP, Brasil
9. Secretaria Estadual de Saúde, Membro permanente Titular do Comitê Estadual de Farmacovigilância de Vacinas e outros imunobiológicos (CEFAVI) -Maceió, AL, Brasil
10. Fundação Oswaldo Cruz, Centro de Referência de Imunobiológicos Especiais (CRIE) - Rio de Janeiro, RJ, Brasil
11. Alervac, Clínica de Vacinação - São Luís, MA, Brasil
12. Hospital Felício Rocho, Coordenador do Centro de Alergia e Imunologia e Centro de Imunizações - Belo Horizonte, MG, Brasil
13. CRIE - Gioânia, GO, Brasil
14. Secretaria Municipal de Saúde, Hospital Municipal Rocha Maia, CRIE - Rio de Janeiro, RJ, Brasil
15. CRIE - Espírito Santo, ES, Brasil
16. Vice-presidente da SBIm - São Paulo, SP, Brasil
17. Universidade do Estado do Rio de Janeiro (UERJ), Faculdade de Ciências Médicas, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
18. Presidente da ASBAI - São Paulo, SP, Brasil
19. Presidente da SBIm - São Paulo, SP, Brasil
Endereço para correspondência:
Claudia França Cavalcante Valente
E-mail: claudiafcvalente@gmail.com
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 04/12/2024
aceito em: 23/12/2024.
RESUMO
Pacientes com erros inatos da imunidade ou em uso de imunossupressores ou imunobiológicos estão sob maior risco de infecções graves, incluindo aquelas preveníveis por vacinas. A imunização adequada é uma estratégia essencial para mitigar esse risco, e deve ser adaptada conforme a doença subjacente e o grau de imunossupressão de cada paciente. Este artigo revisa as evidências científicas disponíveis e melhores práticas relacionadas à vacinação de pacientes imunocomprometidos, oferecendo orientações para otimizar a imunização nessa população, com foco em recomendações adaptadas ao contexto brasileiro. As recomendações são organizadas com base nos tipos de erros inatos da imunidade e tratamentos imunossupressores ou imunobiológicos utilizados. A implementação dessas orientações pode melhorar significativamente a qualidade do cuidado a esses pacientes, reduzindo a carga de doenças infecciosas preveníveis.
Descritores: Imunossupressão, imunodeficiência, imunidade, imunocomprometimento, vacinação, vacinas.
Introdução
Pacientes com erros inatos da imunidade ou em uso de medicações imunossupressoras1 estão sob maior risco de infecções, incluindo aquelas preve-níveis por vacinas, demonstrando tanto uma maior taxa de ataque quanto um risco elevado de desenvolver complicações ou formas graves de diversas doenças2,3.
A prevenção de infecções através da vacinação contra patógenos comuns é uma estratégia fundamental no manejo desse grupo de pacientes4. Desta forma, são necessárias estratégias de vacinação aprimoradas, que incluem não apenas o uso de vacinas adicionais1, mas também, em alguns casos, a precaução com algumas vacinas, principalmente as de vírus vivos5-8.
Embora indivíduos imunocomprometidos necessitem de recomendação de vacinas baseadas em suas condições específicas, geralmente as coberturas vacinais nesse grupo são mais baixas do que na população em geral9,10. Nesse contexto, este documento objetiva revisar as evidências disponíveis e oferecer recomendações que possam aumentar as coberturas vacinais e minimizar os riscos de infecções graves em pacientes com erros inatos da imunidade ou em uso de imunossupressores ou imunobiológicos.
Metodologia
As evidências e recomendações apresentadas neste trabalho foram baseadas em dados publicados até o momento e adaptadas ao contexto brasileiro. Uma revisão não sistemática da literatura foi conduzida entre junho e julho de 2024, utilizando a base de dados MEDLINE para identificar artigos que abordassem diferentes aspectos relacionados à imunização em pacientes imunocomprometidos. Tais aspectos incluem a imunização de pacientes com erros inatos da imunidade, incluindo aqueles com deficiências predominantemente de anticorpos, desregulação imune, doenças autoinflamatórias, imunodeficiências combinadas, além de doenças associadas a defeitos da imunidade inata. Adicionalmente, a revisão incluiu artigos sobre a imunização em pacientes em uso de imunobiológicos, imunossupressores e pequenas moléculas.
As evidências coletadas foram discutidas durante o "I Fórum de Imunização do Paciente Alérgico e Imunodeprimido", realizado em 09 de agosto de 2024, na cidade de São Paulo. As recomendações foram adotadas ou ajustadas por consenso entre os especialistas participantes, todos membros da Associação Brasileira de Alergia e Imunologia (ASBAI) e da Sociedade Brasileira de Imunizações (SBIm).
Princípios gerais
Princípio geral n° 1: as vacinas utilizam diferentes plataformas
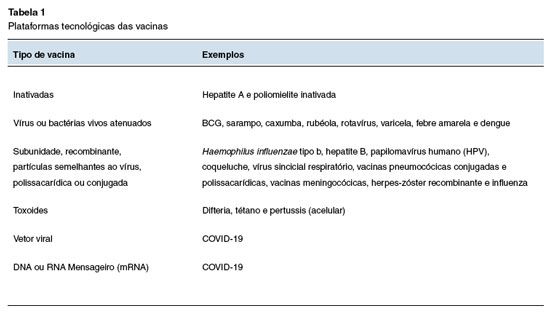
Existem seis plataformas principais de vacinas (Tabela 1): (1) vacinas inativadas; (2) vacinas de vírus ou bactérias vivas atenuadas; (3) vacinas baseadas em componentes do patógeno (como vacinas de subunidade, recombinantes, polissacarídicas, conjugadas ou de partícula semelhantes ao vírus); (4) vacinas de toxoides; (5) vacinas de vetor viral; e (6) vacinas formuladas com ácidos nucleicos (DNA ou RNA mensageiro).
Princípio geral n° 2: as vacinas inativadas podem ser administradas com segurança nos imunocomprometidos
Vacinas inativadas podem geralmente ser administradas a pessoas imunocomprometidas, se indicadas, pois os antígenos presentes na vacina não podem se replicar e não há aumento no risco de eventos adversos associados à vacina. No entanto, a magnitude e a duração da imunidade induzida pela vacina são frequentemente reduzidas11. Em casos complexos, é recomendável encaminhar o paciente a um médico com expertise em imunização e/ou imunodeficiência.
Principio geral n° 3: vacinas de vírus ou bactérias vivas são contraindicadas para a maioria dos pacientes com imunossupressão grave
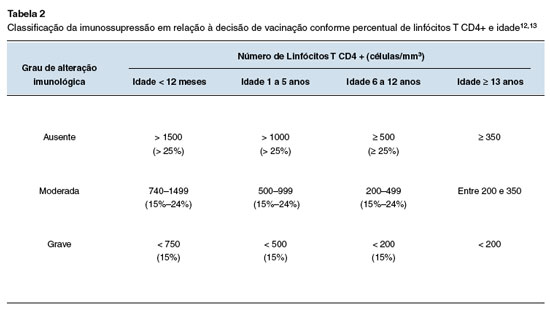
Pessoas com imunossupressão grave (Tabela 2) ou com estado imunológico incerto, em geral, não devem receber vacinas de vírus ou bactérias vivos. Em pessoas menos gravemente imunocomprometidas ou em indivíduos com comprometimento específico ou limitado do sistema imunológico, os benefícios da vacinação com vacinas vivas recomendadas rotineiramente podem superar os riscos, conforme detalhado nas seções que seguem.
A avaliação individualizada dos pacientes deve considerar o grau e o tipo de imunossupressão, assim como as comorbidades e fatores pessoais que podem influenciar a resposta vacinal. Além disso, deve-se considerar a situação epidemiológica local e a exposição ao risco. Por exemplo, se o paciente reside em uma área com alta incidência de uma doença prevenível por vacina, a imunização pode ser fortemente recomendada, mesmo com algumas limitações imunológicas, desde que os benefícios justifiquem a administração.
Princípio geral n° 4: a imunização passiva deve ser usada para reduzir o risco pós-infecção
A imunização passiva deverá ser utilizada, sempre que possível, para reduzir o risco de adoeci-mento e complicações por doenças infecciosas em pacientes imunocomprometidos que tenham tido exposição significativa à doença. Exemplos incluem a imunoglobulina hiperimune antitetânica, antirrábica, antivaricela-zóster e anti-hepatite B.
A seguir, discutem-se as estratégias de vacinação em grupos específicos de pacientes imunocomprometidos.
Erros inatos da imunidade
Os erros inatos da imunidade são classificados de acordo com o componente do sistema imunoló-gico que está primariamente comprometido. Para este documento, os erros inatos da imunidade foram organizados em cinco grupos principais, que serão abordados com recomendações específicas de vacinação:
- Deficiências predominantemente de anticorpos;
- Doenças por desregulação imune;
- Doenças autoinflamatórias;
- Imunodeficiências combinadas (de células T e B);
- Defeitos da imunidade inata.
Além de ser fundamental para a proteção contra doenças infecciosas, a resposta vacinal dos pacientes pode ser utilizada como uma ferramenta diagnóstica para os erros inatos da imunidade. A resposta de anticorpos pós-vacinação, especialmente contra toxoides tetânico e diftérico, Haemophilus influenzae tipo b e Streptococospneumoniae, é frequentemente empregada para avaliar a funcionalidade do sistema imune14,15. Adicionalmente, a detecção de anticorpos contra hepatite A, hepatite B, vírus influenza e iso-hemaglutininas pode auxiliar na identificação de disfunções das imunoglobulinas15. No entanto, é relevante ressaltar que o uso de vacinas para fins diagnósticos não é o foco principal da imunização em indivíduos imunocomprometidos. Portanto, neste documento, o uso de vacinas para fins diagnósticos não será abordado.
Defeitos predominantemente de anticorpos
Pacientes com deficiências predominantemente de anticorpos (células B) apresentam uma maior suscetibilidade a infecções bacterianas, que ocorrem principalmente nos primeiros anos ou após a terceira década de vida. A maioria das infecções é causada por bactérias encapsuladas, como Streptococcus pneumoniae, Haemophilus influenzae tipo b e Neisseria meningitidis16. Portanto, nesse grupo, são indicadas as vacinas contra Streptococos pneumoniae, Haemophilus influenzae tipo b e Neisseria meningitidis. Em pacientes com defeitos predominantemente na produção de anticorpos, a imunização continua sendo a única possibilidade de transferir proteção contra a gripe sazonal. Portanto, a vacina anual contra a influenza também é recomendada para esse grupo de pacientes, mesmo que estejam recebendo terapia com imunoglobulina17-19.
Deficiência predominantemente de anticorpos graves
Deficiências predominantemente de anticorpos graves incluem a imunodeficiência comum variável e a agamaglobulinemia. Essas condições estão associadas a respostas de anticorpos mais gravemente comprometidas, e esses pacientes quase sempre recebem terapia de reposição de imunoglobulina, a qual fornece passivamente anticorpos protetores para muitos patógenos20. A vacina influenza inativada é uma exceção porque (1) as preparações de imu-noglobulina podem não conter anticorpos contra as cepas circulantes e (2) a vacina pode induzir alguma imunidade celular benéfica17,18.
Vacinas vivas, como a tríplice viral (sarampo, caxumba, rubéola) ou varicela, são contraindicadas em pacientes com deficiências graves de anticorpos, seja pelo maior risco de desenvolvimento de doença devido à resposta deficiente de anticorpos ou pela neutralização da vacina pela imunoglobulina terapêutica21. No entanto, em cenários de risco epidemiológico elevado, como surtos de sarampo ou varicela, pode-se considerar a administração dessas vacinas mesmo em pacientes com deficiências graves de anticorpos, desde que seja avaliada a resposta celular. Se a resposta celular estiver preservada, vacinas como a tríplice viral (sarampo, caxumba, rubéola) ou a tetra viral (sarampo, caxumba, rubéola e varicela) podem ser consideradas. A decisão deve ser tomada de forma individualizada, levando em conta o estado imunológico do paciente e o potencial de exposição a essas infecções.
Outras vacinas de vírus vivos, como as vacinas contra febre amarela e dengue, são contraindicadas em pacientes com deficiências predominantemente de anticorpos com fenótipos graves.
Deficiência predominantemente de anticorpos leves
As deficiências predominantemente de anticorpos com fenótipos leves incluem a deficiência seletiva de IgA, a deficiência específica de anticorpos com imu-noglobulinas normais, e a deficiência de subclasses de IgG. Embora a resposta de anticorpos às vacinas possa ser reduzida nestes pacientes, eles frequentemente ainda possuem alguma resposta protetora e podem ser vacinados com segurança com agentes vivos e inativados, com poucas exceções.
Em pacientes com deficiências leves de anticorpos ou outros distúrbios, como ataxia-telangiectasia, a resposta à vacina pneumocócica de polissacarídeos puros é pobre, mas as vacinas conjugadas são imu-nogênicas e devem ser administradas22.
Doenças por desregulação imunológica
Pacientes com desregulação da imunidade adap-tativa, como aqueles que apresentam linfocitose hemofagocítica familiar, síndrome linfoproliferativa autoimune e suas variantes, frequentemente manifestam complicações hematológicas, como citopenias e neutropenia. Já os pacientes com susceptibilidade ao vírus Epstein-Barr, doenças inflamatórias intestinais e endocrinopatias (como APECED, IPEX e suas variantes) podem desenvolver hipogamaglobulinemia23.
Embora não existam evidências para todas as doenças desse grupo, é essencial que a vacinação desses pacientes seja avaliada de forma individualizada, considerando a diversidade e gravidade das manifestações clínicas. Em situações de neutropenia ou hipogamaglobulinemia, é fundamental seguir diretrizes específicas de imunização. Vacinas inati-vadas e recombinantes, como aquelas que protegem contra Streptococcus pneumoniae, Haemophilus influenzae tipo b, Neisseria meningitidis e influenza, são geralmente seguras e fortemente recomendadas para prevenir infecções graves em pacientes com APECED e IPEX24,25, situações que podem cursar com hipogamaglobulinemia.
Quanto às vacinas vivas atenuadas, os dados são insuficientes para uma recomendação clara. A decisão de utilizá-las deve ser feita caso a caso, considerando o uso de medicações imunossupressoras e o estado imunológico do paciente.
A vacinação de conviventes desses pacientes deve ser incentivada, pois fornece uma proteção indireta que pode ajudar a reduzir a exposição a infecções.
Doenças autoinflamatórias (monogênicas)
Pacientes com doenças autoinflamatórias mo-nogênicas geralmente não apresentam deficiência imunológica significativa. Contudo, em alguns casos raros, como na mielodisplasia associada à deficiência de adenosina deaminase 2 e na síndrome de anemia sideroblástica com imunodeficiência de células B, febre periódica e atraso no desenvolvimento (SIFD), pode haver comprometimento imunológico26'27.
De forma geral, não há contraindicações específicas para vacinas nesses pacientes, exceto quando estão sob tratamento com imunossupressores. Nesses casos, a administração de vacinas vivas atenuadas deve ser cuidadosamente avaliada, e a preferência deve ser dada às vacinas inativadas ou recombinantes, sempre que possível.
As vacinas especialmente recomendadas para esse grupo incluem aquelas contra Streptococcus pneumoniae, Haemophilus influenzae tipo b, Neisseria meningitidis e influenza. A vacinação de conviventes também é altamente recomendada para proteção indireta desses pacientes.
Imunodeficiências humoral e celular combinadas
Pacientes com imunodeficiências combinadas apresentam comprometimento da imunidade celular (células T) e humoral (células B)28. As imunodeficiências combinadas T e B podem ser divididas em dois grupos: defeitos completos e defeitos parciais.
Imunodeficiências combinadas T e B - Defeitos completos
As imunodeficiências combinadas com defeitos completos incluem a imunodeficiência combinada grave (SCID) e a síndrome de DiGeorge completa. Todas as vacinas vivas atenuadas, virais ou bacterianas, podem causar complicações graves nestes pacientes, e por isso, todas as vacinas vivas são contraindicadas nesses distúrbios29. A administração das vacinas contra Streptococcus pneumoniae e Haemophilus influenzae tipo b é altamente recomendada para pacientes com imunodeficiências combinadas completas, assim como a indicação de anticorpo monoclonal para vírus sincicial respiratório28,29. As demais vacinas inativadas não apresentam risco de dano, porém provavelmente não são eficazes e, devido ao benefício incerto, por vezes não são administradas nesses pacientes29.
Imunodeficiências combinadas T e B - Defeitos parciais
Imunodeficiências combinadas parciais incluem a síndrome de Wiskott-Aldrich, ataxia-telangiectasia e a síndrome de DiGeorge parcial. As vacinas vivas atenuadas são geralmente contraindicadas nesses distúrbios29. A vacinação em casos menos graves (a maioria dos pacientes) deve ser considerada caso a caso. De acordo com a resposta imunológica, classificação da imunossupressão conforme percentual de linfócitos T CD4+ por idade (Tabela 2) e situação de risco epidemiológico, algumas vacinas vivas atenuadas podem ser consideradas quanto à decisão de vacinação (Tabela 3).
Nas imunodeficiências combinadas parciais, as vacinas inativadas podem ser eficazes em alguns casos e podem ser administradas. A administração das vacinas contra o Haemophilus influenzae tipo b, Streptococcus pneumoniae, Neisseria meningitidis, hepatite A e B, DTPa ou DTPw, poliomielite (inati-vada), influenza, HPV, herpes-zóster (recombinante) e COVID-19 é fortemente recomendada para este grupo de pacientes29.
A Tabela 3 resume as recomendações de vacinação para pacientes com imunodeficiências combinadas.
Defeitos da imunidade inata
Os defeitos da imunidade inata incluem um grupo diverso de doenças genéticas que afetam o sistema imunológico e sua capacidade de responder adequadamente a infecções. Algumas das doenças mais comuns classificadas como defeitos da imunidade inata são os distúrbios fagocíticos, as deficiências de complemento, as deficiências de receptores do tipo toll e as deficiências de células natural killers.
Estes distúrbios apresentam variações na gravidade e no impacto sobre a capacidade do organismo em responder adequadamente a infecções. A avaliação diagnóstica precoce é crucial para a implementação de intervenções terapêuticas eficazes, que podem incluir profilaxia com antimicrobianos, antifúngicos ou, em casos mais graves, a realização de transplante de células-tronco hematopoiéticas para reconstituição imunológica. De maneira geral, não há estudos clínicos específicos para avaliar a imunização de pacientes com defeitos da imunidade inata. As recomendações têm como base as complicações clínicas.
Distúrbios fagocíticos
A neutropenia é classificada como leve (contagem absoluta de neutrófilos entre 1000 de 1500/pL), moderada (entre 500 e 1000/pL) e grave (abaixo de 500/pL)30. As neutropenias leve ou moderada não estão associadas a uma resposta comprometida aos antígenos vacinais ou a um risco aumentado de eventos adversos. A menos que existam outros fenó-tipos ou morbidades relevantes associados, a política de vacinação para esses casos não deve diferir da população geral31.
Todas as vacinas inativadas podem ser aplicadas com segurança em pacientes com neutropenia grave. O uso de algumas vacinas específicas também é altamente recomendado devido ao maior risco de infecções em crianças com essa patologia. Entre elas, destacam-se as vacinas contra o Streptococcus pneumoniae e Neisseria meningitidis. A vacina contra a gripe sazonal e hepatite B também são importantes, pois podem prevenir infecções adquiridas em ambiente hospitalar13,30,32,33.
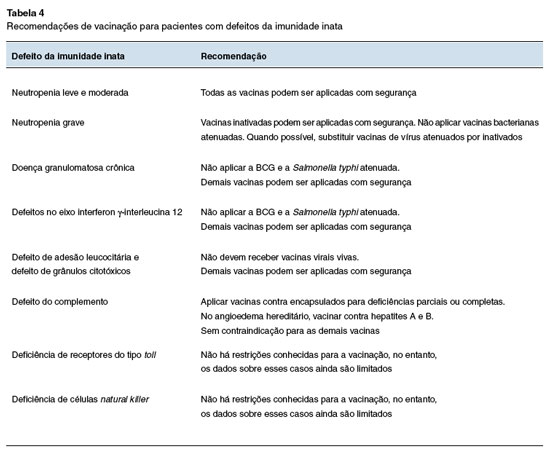
Vacinas bacterianas vivas, como a BCG, são contraindicadas em neutropenia grave devido ao risco de complicações31. No entanto, em muitos países, recém-nascidos são vacinados com BCG nos primeiros dias de vida, antes de qualquer suspeita de neutropenia grave. Embora haja poucos relatos de complicações da BCG em lactentes que mais tarde foram diagnosticados com esta doença, a contraindicação é extrapolada a partir de achados de pacientes com defeitos de células fagocíticas, considerando a eficácia limitada da vacina13,30,32,33. A vacina BCG também é contraindicada para pacientes com doença granulomatosa crônica e defeitos no eixo interferon y-interleucina 12, condições que afetam a funcionalidade das células fagocíticas, devido ao maior risco de complicações graves após a vacinação.
Vacinas de vírus vivos não são contraindicadas em pacientes com neutropenia grave, mas é fundamental avaliar a imunidade celular e/ou adaptativa antes da administração. Uma prática segura é excluir formalmente a presença de imunodeficiência celular e/ou de anticorpos significativa nesses pacientes antes da aplicação de vacinas com vírus vivos31.
Pacientes com defeitos de adesão leucocitária e defeitos de grânulos citotóxicos podem apresentar deficiência nas respostas virais32,34,35 e, portanto, não devem receber vacinas virais vivas.
Deficiências de complemento
Pacientes com deficiências de complemento têm imunidade celular e humoral intactas e podem receber todas as vacinas vivas e inativadas. É especialmente importante vacinar esses pacientes (incluindo aqueles com deficiência de complemento parcial) contra germes encapsulados como a Neisseria meningitidis, Streptococcus pneumoniae e Haemophilus influenzae tipo b33,36,37. Seguem abaixo os esquemas recomendados para as vacinas meningocócicas.
Vacina meningocócica ACWY
- Menores de 1 ano de idade: duas doses aos 3 e 5 meses de idade, reforço entre 12 e 15 meses de idade, aos 5 anos de idade, e reforços a cada 5 anos.
- Maiores de 1 ano de idade, adolescentes e adultos: duas doses com 2 meses de intervalo e reforços a cada 5 anos.
Vacina meningocócica B
- Crianças até 23 meses de idade: duas doses + reforço.
- Crianças a partir de 24 meses de idade: duas doses.
- Adolescentes e adultos: duas doses com intervalo de 1 a 6 meses (a depender da vacina utilizada).
- Para todas as idades até 50 anos de idade (para > 50 anos o uso é off label): reforço 1 ano após o esquema básico e depois a cada 2 a 3 anos.
No angioedema hereditário, uma doença genética rara que envolve a deficiência ou disfunção do inibidor da C1 esterase, uma proteína que regula o sistema complemento, fibrinolítico, de coagulação e cinina-bradicinina, também recomenda-se a aplicação das vacinas de hepatite A e B em todos pacientes38. Para esse grupo de pacientes, as demais vacinas devem seguir o esquema de vacinação de rotina.
Deficiências de receptores do tipo toll e de células natural killers
Atualmente, não existem estudos que orientem ou contraindiquem a imunização em pacientes com essas deficiências. Assim, a vacinação pode seguir o esquema de rotina.
A Tabela 4 resume as recomendações de vacinação para pacientes com defeitos da imunidade inata.
Pacientes candidatos ou em uso de imunossupressores ou imunobiológicos
Como parte do arsenal terapêutico contra várias doenças imunomediadas, um número crescente de indivíduos está recebendo agentes imunossupressores, como corticosteroides, 6-mercaptopurina, azatioprina, metotrexato, ciclosporina, tacrolimus, micofenolato de mofetil. Pequenas moléculas como os inibidores da JAK e imunobiológicos como os anticorpos mono-clonais também são utilizados por muitos pacientes com doenças imunomediadas. Embora importantes no controle de doenças, esses tratamentos podem aumentar o risco de infecções comuns e oportunis-tas39-42. Além disso, medicamentos imunossupresso-res podem afetar negativamente as respostas vacinais em determinadas populações43,44.
Imunossupressores não biológicos
Para pacientes candidatos ao uso ou em uso de imunossupressores não biológicos, a vacinação deve seguir algumas diretrizes específicas para garantir a eficácia e segurança da imunização. O objetivo é minimizar o risco de infecções preveníveis, considerando o comprometimento imunológico causado pelo tratamento.
Vacinas inativadas são geralmente seguras e recomendadas para pacientes em uso de imunossu-pressores. O ideal é que essas vacinas sejam administradas pelo menos duas semanas antes do início da imunossupressão, para permitir uma resposta imune adequada.
Quando é necessário iniciar rapidamente a imu-nossupressão, pode não ser possível completar o esquema vacinal antes do início do tratamento.
Nesses casos, vacinas inativadas podem ser administradas durante a imunossupressão, desde que a primeira dose tenha sido aplicada antes do início do tratamento. Estudos indicam que, em pacientes sob imunossupressão não biológica, a eficácia da vacina contra influenza permanece significativa, com 79% dos pacientes atingindo títulos protetores, em comparação a 98% no grupo controle45. Além disso, eventos adversos graves pós-vacinação não são mais frequentes em pacientes recebendo terapias imunossupressoras não biológicas, o que reforça a segurança da imunização com vacinas inativadas nesse grupo de pacientes44. No entanto, o momento ideal para a vacinação pode variar de acordo com o planejamento terapêutico. Se houver previsão de redução da dose do imunossupressor, pode ser mais eficaz adiar a vacinação para esse período, quando a resposta imunológica poderá ser mais robusta.
Vacinas vivas atenuadas, como a tríplice viral (sarampo, caxumba e rubéola), vacina varicela, febre amarela e a dengue, devem ser administradas com cautela. O ideal é que sejam aplicadas 4 semanas antes do início da imunossupressão, mas, se não houver essa possibilidade, um intervalo mínimo de 2 semanas pode ser considerado, visto que a maioria das vacinas gera viremia em até 2 semanas. Para pacientes que já estão sob tratamento com imunos-supressores, essas vacinas são geralmente contraindicadas devido ao risco de infecção a partir do próprio agente vacinal. Contudo, em situações de alta exposição epidemiológica, uma avaliação individual deve ser feita para considerar os riscos e benefícios.
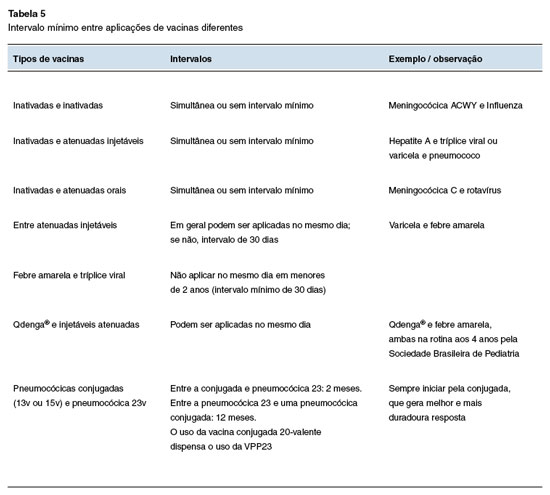
No esquema de planejamento vacinal, recomendase priorizar a vacinação contra influenza (anual; de alta dose se paciente acima de 60 anos), vírus sincicial respiratório (VSR), pneumocócica conjugada 13,15 ou 20 valente seguida de pneumocócica polissacarídica 23 valente (se o paciente recebeu PCV 13 ou PCV 15) e herpes-zóster recombinante para pacientes com mais de 18 anos (duas doses com intervalo de 4 semanas). Vacinas com componente vivos, como a febre amarela, tríplice viral e dengue (duas doses com intervalo de 3 meses), devem ser avaliadas considerando contexto epidemiológico atual. A Tabela 5 detalha as informações sobre o intervalo mínimo entre aplicações de vacinas diferentes.
Após a interrupção do uso de imunossupressores, é necessário respeitar os intervalos de segurança antes de administrar vacinas vivas atenuadas, conforme descrito abaixo.
- Ciclosporina: 3 meses.
- Glicocorticoides em doses maiores que 2 mg/kg por dia por mais de 2 semanas, em crianças; ou mais de 20 mg/dia por mais de 2 semanas em adultos: 1 mês.
- Metotrexato: > 20 mg/semana ou > 0,4 mg/kg/semana: 4 semanas de intervalo. Em dosagem menor, considerar não usar intervalo mínimo.
Para crianças nascidas de mães que utilizaram imunomoduladores ou imunobiológicos durante os dois últimos trimestres da gestação, recomenda-se adiar a vacina BCG para entre 6 e 12 meses a contar da última dose de medicação durante a gestação, devido ao possível impacto no sistema imunológico do recém-nascido. A vacina rotavírus, no entanto, não está contraindicada nesse grupo. Em relação à dose zero de sarampo (tríplice ou dupla viral) e à administração da vacina contra febre amarela aos 9 meses, não há dados suficientes na literatura para fornecer uma resposta definitiva sobre a segurança da aplicação em crianças nascidas de mães que utilizaram imunomo-duladores ou imunobiológicos durante os dois últimos trimestres da gestação. Assim, essas decisões devem ser avaliadas individualmente, considerando o estado imunológico da criança e o risco epidemiológico.
Vacinas atenuadas e inativadas podem ser administradas com segurança em bebês amamentados por mães que utilizam corticoterapia imunossupressora com metotrexato e ciclosporina. No entanto, recomenda-se cautela ao aplicar vacinas atenuadas em bebês amamentados por mães em uso de ciclofosfamida, devido ao maior potencial de imunossupressão44.
É fundamental garantir que conviventes de pacientes em uso de imunossupressores estejam com suas vacinas em dia, principalmente aquelas contra influenza, COVID-19, varicela (para suscetíveis), tríplice viral e dTpa.
Anticorpos monoclonais
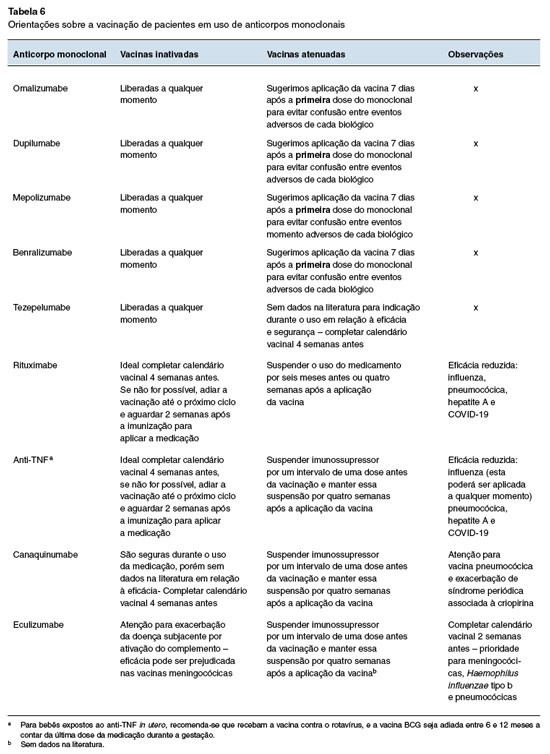
A aplicação de anticorpos monoclonais e estratégias de imunização requer análise integrada de parâmetros de eficácia clínica e perfil de segurança. Enquanto os anticorpos monoclonais oferecem uma abordagem direcionada para o tratamento de condições específicas, a imunização desempenha um papel crucial na prevenção de doenças infecciosas. No entanto, fatores como a resposta imune individual, possíveis efeitos adversos, duração da proteção e riscos associados precisam ser cuidadosamente avaliados em cada caso (Tabela 6).
Os anticorpos monoclonais constituem uma classe de medicamentos biológicos inovadores, desenvolvidos para intervir de forma específica em alvos precisos do sistema imunológico. Alguns destes anticorpos monoclonais têm como objetivo modular a resposta imune mediada por células T-helper do tipo 2 (Th2), que desempenham um papel crucial na fisiopatologia de diversas doenças alérgicas e inflamatórias46.
A resposta Th2 é intensificada pela ação de cito-cinas como IL-4, IL-5 e IL-13, as quais promovem a ativação dos eosinófilos, estimulam a produção de IgE e desencadeiam uma resposta alérgica característica. Esses medicamentos pertencem à classe das imuno-globulinas G (IgG) e exercem sua ação terapêutica ao bloquear diretamente essas citocinas inflamatórias, sendo eficazes em doenças como asma, doença pulmonar obstrutiva crônica, rinossinusite crônica com polipose nasal, dermatite atópica, prurigo nodular, esofagite eosinofílica, granulomatose eosinofílica com poliangiite e síndrome hipereosinofílica46,47.
Os biológicos têm se mostrado fundamentais no manejo de condições inflamatórias mediadas pela resposta Th2, proporcionando uma abordagem terapêutica mais direcionada e efetiva. Exemplos incluem anti-IL-4/IL-13 como o dupilumabe, anti-IL-5 como mepolizumabe, anti-IL-5R (anti-receptor alfa de IL-5) como benralizumabe, e anti-IgE como o omalizumabe. Além dos anticorpos monoclonais voltados para a via Th2, foram desenvolvidos também medicamentos que bloqueiam a IL-1, como o canaquinumabe (anti-IL-1 beta). Tal medicamento é utilizado no tratamento de doenças autoinflamatórias e reumáticas, cujo processo fisiopatológico envolve a superprodução de IL-148.
Outro exemplo importante são os anticorpos monoclonais que têm como alvo a linfopoietina es-tromal tímica (TSLP), como o tezepelumabe, que atua nas respostas inflamatórias iniciais, sendo particularmente eficaz no tratamento da asma gra-ve49. Outros imunobiológicos, como o infliximabe e adalimumabe, bloqueiam o fator de necrose tumoral (anti-TNF), sendo utilizados no tratamento de artrite reumatoide e doenças inflamatórias intestinais50,51. Já o rituximabe se liga à proteína CD20 presente nas células B, induzindo sua lise por meio de mecanismos imunológicos, como citotoxicidade dependente de anticorpos e apoptose. Essa depleção de células B reduz a produção de anticorpos, sendo eficaz no tratamento de doenças autoimunes e hematológicas, como a artrite reumatoide e linfomas.
O eculizumabe é um anticorpo monoclonal utilizado no tratamento de doenças autoimunes e raras relacionadas ao sistema complemento, inibindo a proteína C5 e impedindo sua ativação, o que evita a formação do complexo de ataque à membrana e a consequente inflamação e dano celular. Ele é indicado para condições como hemoglobinúria paroxística noturna, onde reduz a destruição prematura das células sanguíneas, e síndrome hemolítico urêmica atípica, que causa danos renais e anemia devido à ativação descontrolada do sistema complemento52.
Vacinas inativadas
As vacinas inativadas (como as vacinas de mRNA, vacinas conjugadas, toxoides e vacinas de vetor viral não patogênico), podem ser administradas com segurança e eficácia nos pacientes que fazem uso de anti-IL-4, IL-5, IL-13 e anti-IgE.
Em relação às demais vacinas inativadas, temos algumas considerações em relação à segurança. A imunização com a vacina pneumocócica em pacientes tratados com canaquinumabe (Anti-IL-1 beta) apresenta dados conflitantes sobre exacerbações de doenças e eventos adversos. Um estudo mostrou que os pacientes com síndrome periódica associada à criopirina tratados com canacinumabe reagiram mais frequentemente e mais gravemente após a dose da vacina pneumocócica em comparação com outras vacinas inativadas53. Nesse estudo, 12 dos 18 pacientes que receberam a vacina desenvolveram reações vacinais (febre, inchaço, eritema, dor), geralmente dentro de algumas horas após a vacinação. Essas reações duraram até três semanas, e mais importante, a vacinação pneumocócica exacerbou a doença em dois pacientes. Logo, deve-se equilibrar os benefícios potenciais da imunização com a vacina pneumocócica por questões de segurança. O estudo sugere priorizar as vacinas pneumocócicas conjugadas em relação à vacina polissacarídica 23-valente (VPP23)53.
Sugerimos também atenção em relação à eficácia das vacinas inativadas nos pacientes em uso de ritu-ximabe e anti-TNF. Pacientes que utilizam anti-TNF apresentam respostas imunológicas reduzidas a algumas vacinas, como as contra influenza, pneumocócica, hepatite A e COVID-1954-56. Assim, deve-se priorizar a atualização do calendário vacinal pelo menos 4 semanas antes do início do tratamento com rituxumabe ou com anti-TNF. Caso isso não seja possível, sugerimos adiar a vacinação até o próximo ciclo e adiar a administração do medicamento para duas semanas após a imunização para garantir melhor eficácia da vacina. Em pacientes que utilizam anti-TNF, a vacina contra influenza poderá ser administrada a qualquer momento durante o uso da medicação, tendo em vista a sazonalidade da doença57.
Pacientes que utilizam eculizumabe, devido ao mecanismo de ação do medicamento, apresentam maior suscetibilidade à infecção por Neisseria meningitidis. Por isso, é recomendada a vacinação contra Neisseria meningitidis, abrangendo os sorotipos A, C, Y, W e B, pelo menos 2 semanas antes do início da terapia58. Se o tratamento for iniciado antes desse prazo, deve-se administrar antibióticos profiláticos até 2 semanas após a vacinação58. Os pacientes com idade inferior a 18 anos também devem ser vacinados contra o Haemophilus influenzae tipo b e Streptococcus pneumoniae, e necessitam seguir rigorosamente as recomendações nacionais de vacinação para cada faixa etária. Em pacientes que utilizam eculizumabe, a vacina pode ativar o complemento58. Portanto, os pacientes devem ser monitorados para sinais de exacerbação da doença subjacente (hemólise na he-moglobinúria paroxística noturna ou microangiopatia trombótica na síndrome hemolítico urêmica atípica). Além disso, a vacinação pode não garantir proteção completa contra Neisseria meningitidis, portanto, é fundamental o monitoramento rigoroso para detecção precoce de sinais de infecção, com tratamento imediato caso necessário58.
Vacinas atenuadas
As vacinas atenuadas podem ser administradas com segurança em pacientes em uso de anticorpos monoclonais que têm como alvo a resposta imune das células Th259. Em relação à segurança e eficácia, não há contraindicação para a imunização de pacientes que fazem uso de anti-IL-4, IL-5 e IL-13, além de anti-IgE60-64. Nesse grupo, a vacinação deve ser realizada, preferencialmente, quatro semanas antes do início do tratamento. Caso esse intervalo não possa ser respeitado, recomenda-se que seja observado o maior espaço de tempo possível entre a vacinação e a primeira aplicação do anticorpo monoclonal (com um mínimo de 7 dias), com o objetivo de identificar, por correlação temporal, se uma eventual reação adversa foi causada pela vacina ou pelo anticorpo monoclonal, tendo em vista que as reações adversas aos anticorpos monoclonais são raras, porém costumam ocorrer na primeira dose.
O tezepelumabe tem como alvo a TSLP, uma citocina que atua nas respostas inflamatórias iniciais e desempenha um papel chave na ativação e amplificação de diversas vias imunológicas. Ao inibir essa sinalização inflamatória desde o início, o teze-pelumabe impacta diversas células e mediadores envolvidos na resposta imune. Como consequência, o efeito imunossupressor do tezepelumabe pode afetar a capacidade de resposta do sistema imunológico ao antígeno vacinal. Esse bloqueio precoce dificulta a avaliação dos riscos e benefícios da administração de vacinas atenuadas em pacientes sob tratamento com anti-TSLP, uma vez que dados robustos e conclusivos sobre a segurança e eficácia da imunização nessa situação ainda são limitados. Assim, é recomendável evitar a administração de vacinas atenuadas em pacientes que estejam utilizando o tezepelumabe. Em vez disso, sugere-se que a atualização do calendário vacinal seja realizada pelo menos quatro semanas antes do início do tratamento com o anticorpo monoclonal, para garantir que o sistema imunológico tenha uma resposta adequada à vacinação.
Para pacientes em tratamento com canacinumabe e anti-TNF, as Diretrizes de 2022 do American College of Rheumatology para Vacinação em Pacientes com Doenças Reumáticas e Musculoesqueléticas orientam, de forma individualizada, a interrupção temporária da medicação imunossupressora para a administração de vacinas atenuadas. Recomenda-se suspender o uso do imunossupressor por um período equivalente ao intervalo de uma dose antes da vacinação e manter essa suspensão por quatro semanas após a aplicação de vacinas de vírus atenuado57. Sugerimos também que tal orientação se estenda ao eculizumabe apesar da falta de evidências na literatura médica.
No caso de crianças em uso de canaquinumabe para tratamento de distúrbios autoinflamatórios ou artrite idiopática juvenil sistêmica, a interrupção do biológico pode representar um alto risco de agravamento da doença. Nesses casos, se a vacinação com vírus vivos atenuados for indispensável, é possível considerar um intervalo menor de suspensão do imunossupressor57.
Para bebês expostos ao anti-TNF in utero, recomenda-se que recebam a vacina contra o rotavírus nos primeiros seis meses de vida57.
Já em relação ao rituximabe, a orientação é suspender o uso do medicamento por seis meses antes e quatro semanas após a administração de vacinas atenuadas57.
Em relação à revacinação de pacientes que concluíram o tratamento com anticorpos monoclonais, não há evidências conclusivas que sustentem essa prática como uma recomendação padrão. A decisão sobre a necessidade de revacinação deve ser feita de forma individualizada, considerando as condições clínicas de cada paciente e a eficácia da resposta imune após o tratamento.
Inibidores da Janus quinase
A família Janus quinase (JAK) é composta por quatro proteínas da classe tirosina quinase: JAK1, JAK2, JAK3 e TIK2. Estas proteínas desempenham um papel crucial no sistema imunológico, particularmente na imunidade adaptativa e na hematopoiese. Elas estão envolvidas em processos como resposta inflamatória, maturação de leucócitos, reconhecimento de patógenos e ativação de citocinas65. Os inibidores da JAK são pequenas moléculas sintéticas, administradas por via oral, que bloqueiam a sinalização mediada por citocinas em células-alvo, modulando a resposta inflamatória em várias doenças66. Alguns atuam em múltiplas JAKs, como o tofacitinibe, enquanto outros, como o upadacitinibe, são seletivos.
Atualmente, não há dados que indiquem risco de reativação de patógenos após a administração de vacinas inativadas em pacientes que utilizam inibidores de JAK63. Portanto, pacientes desse grupo podem seguir o calendário vacinal recomendado de acordo com a idade e a condição clínica do indivíduo. Vacinas inativadas devem ser administradas, idealmente, pelo menos 14 dias antes do início da terapia com inibidores da JAK, embora possam ser aplicadas durante o tratamento, caso necessário. A vacinação simultânea é possível e recomendada, quando indicada.
Vacinas com componentes vivos atenuados são contraindicadas durante o curso do tratamento com inibidores da JAK devido ao risco de complicações63. Se houver intenção de administrar uma vacina viva atenuada por falta de vacinação prévia ou ausência de evidência de imunidade, ela deve ser aplicada, em geral, de 14 a 30 dias antes do início da terapia, ou, pelo menos, 3 meses após a sua interrupção63,67. Caso haja necessidade de administração de vacinas atenuadas durante o tratamento com inibidores da JAK, recomenda-se suspender a medicação por 1 a 2 semanas antes da vacinação e retomar o uso após 4 semanas57. Em casos de progressão rápida da doença de base, pode-se considerar o retorno à terapia após duas semanas.
Entre as vacinas mais importantes a serem consideradas nesse grupo de pacientes estão as relacionadas a seguir.
- Vacina recombinante contra herpes-zóster: para pacientes com mais de 18 anos; 2 doses com intervalo de 1 a 2 meses entre elas. Administrar antes do início do tratamento com inibidores da JAK, preferencialmente.
- Vacinas pneumocócicas: vacinar com a vacina pneumocócica conjugada (VPC)13 ou 15 e após 2 meses administrar a vacina pneumocó-cica polissacarídica (VPP) 23-valente. A vacina VPC20 é indicada em dose única. Para indivíduos que já receberam a VPP 23 e não foram anteriormente vacinados com VPC13 ou VPC15, recomenda-se um intervalo de 12 meses para a aplicação de VPC13 ou VPC15, e de cinco anos para a aplicação da segunda dose da VPP23, caso necessário. Estudos demonstram que a resposta imune à vacinação pneumocócica pode variar de acordo com o tipo de inibidor de JAK utilizado. Pacientes em uso de upadacitinibe e baricitinibe apresentam uma resposta imune satisfatória após a vacinação com VPC13 e VPP2368,69. No entanto, em pacientes em uso de tofacitinibe, a resposta imune após a vacinação com a VPP23 não é satisfatória, mesmo com a suspensão da medicação por 2 semanas. Contudo, a resposta à vacinação com a VPC13 conjugada foi satisfatória70.
- Vacina influenza: recomenda-se a aplicação da vacina para indivíduos acima de 6 meses (ou vacina de alta concentração para indivíduos com mais 60 anos). Pode-se considerar uma segunda dose das vacinas trivalente ou quadrivalente a partir de três meses após a administração da dose anual.
- Vacina HPV: alguns inibidores da JAK têm sido associados a um maior risco de desenvolvimento de câncer71. Por isso, recomenda-se que adolescentes e adultos imunocomprometidos de até 45 anos recebam a vacina HPV, em um esquema de 3 doses. O uso da vacina HPV monovalente (HPV9) é preferível pelo seu maior espectro de proteção, e a revacinação deve ser considerada para aqueles que foram previamente imunizados com as vacinas HPV2 ou HPV4.
- Vacina COVID-19: recomenda-se a administração de três doses da vacina monovalente com intervalo de 4 semanas entre a primeira e a segunda dose, e 8 semanas entre a segunda e terceira dose (esquema primário de pacientes imunocompro-metidos). Pacientes adolescentes e adultos que já receberam todas as doses iniciais recomendadas devem manter um esquema de reforço semestral utilizando as vacinas de Mrna disponíveis.
- Vacina hepatite B: pacientes em uso de inibidores da JAK requerem atenção especial em relação à vacinação contra hepatite B devido aos potenciais efeitos hepatotóxicos desses medicamentos e ao maior risco de complicações graves da hepatite B durante o tratamento. Idealmente, esses pacientes devem completar o esquema de 3 doses da vacina antes do início da terapia com inibidores da JAK72. Se não houver tempo para completar o esquema vacinal antes do início do tratamento, é essencial realizar uma triagem para hepatite B, especialmente para verificar a presença de infecção ativa. Caso a infecção ativa seja detectada, o uso de inibidores da JAK é contraindicado, dado o risco de agravamento da doença hepática e o desenvolvimento de complicações.
Para garantir a segurança dos pacientes em uso de inibidores da JAK, é fundamental que seus conviventes recebam todas as vacinas recomendadas de acordo com sua faixa etária.
Considerações sobre o uso das vacinas contra BCG e herpes-zóster em pessoas imunocomprometidas
BCG
A vacina BCG é utilizada para prevenir formas graves de tuberculose, como a meningite tuberculosa e a tuberculose miliar. Entretanto, por conter bacilos vivos atenuados da Mycobacterium bovis, sua aplicação em pacientes com erros inatos da imunidade e outras condições de imunossupressão exige cautela. As contraindicações da BCG incluem imunodeficiências primárias ou adquiridas, neoplasias malignas, uso prolongado de corticoides sistêmicos em doses elevadas (por > 2 semanas), recém-nascidos cujas mães utilizaram imunomoduladores ou imunobio-lógicos nos últimos dois trimestres de gestação e gestantes73. Em indivíduos imunocomprometidos, a BCG pode desencadear reações adversas graves, desde reações locais até infecções disseminadas potencialmente fatais74.
Estudos recentes reforçam a necessidade de uma abordagem cuidadosa da vacinação BCG em pacientes imunocomprometidos. Em uma revisão sistemática, Fekrvand e cols. identificaram 46 diferentes tipos de erros inatos da imunidade associados a eventos adversos à BCG, com SCID sendo a mais comum e com maior mortalidade associada75. Um estudo retrospectivo brasileiro relatou complicações em até 65% dos pacientes com SCID imunizados com a BCG antes do diagnóstico, com alta taxa de mortalidade associada76.
Pacientes com doença granulomatosa crônica e síndromes de suscetibilidade mendeliana a mi-cobactérias (MSMD) também apresentam um risco aumentado de complicações locais e disseminadas pela BCG. Em um estudo retrospectivo envolvendo 134 crianças chinesas com reações disseminadas à BCG, 48,6% dos casos foram posteriormente diagnosticados com doença granulomatosa crônica, 26,1% com MSMD e 16% com SCID77. Em Recife - PE, um estudo com 53 pacientes que tiveram reações adversas à BCG encontrou que 16,8% desses apresentavam erros inatos da imunidade. A maioria (90%) teve reações locorregionais, mas entre os casos de reações disseminadas, todos foram diagnosticados com algum tipo de erro inato da imunidade, incluindo quatro com doença granulomatosa crônica, três com MSMD e dois com SCID78.
Em pacientes com suspeita de erro inato da imunidade, a recomendação atual é adiar a aplicação da BCG até que testes diagnósticos específicos possam confirmar ou descartar a doença. Esses testes incluem, dependendo da idade e da disponibilidade de recursos, a realização de hemograma, dosagem de imunoglobulinas, imunofenotipagem de linfócitos, avaliação de TREC/KREC (se não foram realizados na triagem neonatal) e teste da dihidro-rodamina (DHR)75. A linfadenopatia axilar regional deve ser considerada um sinal de alerta para erros inatos da imunidade, assim como história familiar de complicação à BCG14.
Para pacientes diagnosticados com SCID e que receberam a vacina BCG ao nascer, a profilaxia com antimicrobianos como isoniazida tem sido utilizada até que o paciente possa ser submetido a um transplante de células-tronco hematopoiéticas. O esquema tríplice com rifampicina, isoniazida e etambutol também pode ser utilizado, embora esteja associado com possível toxicidade76. Em casos de infecção disseminada pela BCG, a European Society for Immunodeficiencies recomenda um regime terapêutico com múltiplos medicamentos antituberculosos (esquema com ri-fampicina, etambutol, isoniazida e claritromicina) até a completa resolução da infecção. Após essa fase, sugere-se a manutenção de duas medicações anti-micobacterianas até a completa reconstituição imu-nológica pós-transplante de células-tronco. Havendo toxicidade, medicamentos como levofloxacino são indicados79.
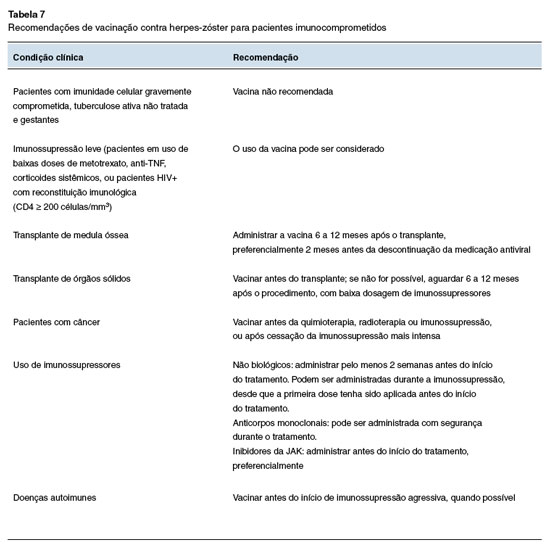
Herpes-zóster recombinante
Pessoas imunocomprometidas apresentam um risco significativamente elevado de desenvolver herpes-zóster, além de uma maior probabilidade de complicações graves quando comparados a adultos imunocompetentes da mesma faixa etária80-82. A vacina herpes-zóster (recombinante) é um imunizante recombinante inativado que utiliza a proteína do vírus (glicoproteína recombinante E) e não o vírus vivo. Por esse motivo, é considerada segura para a população imunossuprimida.
Para maiores de 50 anos de idade a eficácia do imunizante nos estudos pivotais foi de mais de 90% na prevenção do episódio agudo83. Em pacientes imunocomprometidos, foi reportado uma eficácia de 68,2% em pacientes transplantados de medula óssea84, e de 87,2% em pacientes com tumores malignos hematológicos85.
A vacina herpes-zóster recombinante é recomendada a partir dos 18 anos para imunocomprometidos, sendo administrada em duas doses, com intervalo de 2 meses entre elas. Quando possível, recomenda-se administrar a vacina antes do início do tratamento com imunossupressores, podendo-se usar o intervalo mínimo de um mês em situações pré-imunossupressão. Se não houver disponibilidade de tempo, a vacinação deve ocorrer no melhor momento para o paciente, idealmente quando a imunossupressão mais intensa tiver cessado.
Para pacientes que já tiveram a doença, o ideal é aguardar 6 meses para a vacinação.
As recomendações de vacinação contra herpes-zóster para pacientes imunocomprometidos estão dispostas na Tabela 7.
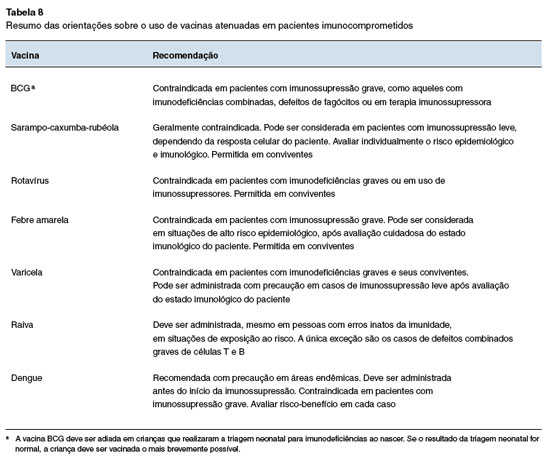
Resumo das recomendações
As Tabelas 8 e 9 detalham as principais recomendações de vacinação para pacientes imunocompro-metidos. A Tabela 7 foca nas orientações sobre o uso de vacinas inativadas, que são geralmente seguras para esse grupo de pacientes. A Tabela 8 trata das vacinas vivas atenuadas, enfatizando as contraindi-cações e as situações específicas em que podem ser administradas sob acompanhamento rigoroso, como no caso da vacina contra febre amarela e varicela.
Conclusão
A imunização de pacientes imunocomprometidos requer uma abordagem cuidadosa e estruturada que garanta a proteção adequada contra infecções. O primeiro passo é que os profissionais de saúde assumam a responsabilidade de avaliar e manter o status vacinal, tanto dos pacientes quanto de seus conviventes, uma vez que a proteção do círculo próximo pode ser crucial para prevenir infecções nesta população.
É essencial conhecer detalhadamente o histórico do paciente, incluindo suas condições imunossupres-soras e tratamentos em andamento, para orientar a escolha das vacinas, considerando as indicações e contraindicações específicas. Os pacientes imunocomprometidos devem ser encaminhados no SUS, aos Centros de Referência de Imunobiológicos Especiais (CRIE) ou a uma unidade privada de imunização portando relatório de seu médico especialista em Imunologia.
Otimizar o momento da vacinação é outro fator importante. Em geral, vacinas de vírus vivos devem ser administradas idealmente quatro semanas antes da imunossupressão, enquanto as vacinas inativadas, pelo menos duas semanas antes.
Por fim, é imprescindível que os profissionais de saúde identifiquem e superem as barreiras que possam impedir a adesão à vacinação. Isso inclui abordar preocupações e hesitações dos pacientes em relação às vacinas, além de remover obstáculos no nível do sistema de saúde que possam dificultar o acesso à imunização.
Agradecimentos
Os autores agradecem a Morgana Moretti pela assistência na redação deste manuscrito.
Referências
1. See KC. Vaccination for the prevention of infection among immunocompromised patients: a concise review of recent systematic reviews. Vaccines. 2022;10(5):800. doi:10.3390/vaccines10050800.
2. Bin-Hussain I. Infections in the Immunocompromised Host.Textbook of Clinical Pediatrics. 2012:847-52. doi: 10.1007/978-3-642-02202-9_68.
3. Antinori A, Bausch-Jurken M. The Burden of COVID-19 in the immunocompromised patient:implications for vaccination and needs for the future. J Infect Dis. 2023;228(Suppl 1):S4. doi:10.1093/infdis/jiad181.
4. Lopez A, Mariette X, Bachelez H, Belot A, Bonnotte B, Hachulla E, et al. Vaccination recommendations for the adultimmunosuppressed patient: A systematic review and comprehensive field synopsis. J Autoimmun. 2017 Jun;80:10-27. doi: 10.1016/j.jaut.2017.03.011.
5. Neven B, Pérot P, Bruneau J, Pasquet M, Ramirez M, Diana JS, et al. Cutaneous and Visceral Chronic Granulomatous Disease Triggered by a RubellaVirus Vaccine Strain in Children With Primary Immunodeficiencies. Clin Infect Dis. 2017 Jan 1;64(1):83-86. doi: 10.1093/cid/ciw675.
6. Perelygina L, Plotkin S, Russo P, Hautala T, Bonilla F, Ochs HD, et al. Rubella persistence in epidermal keratinocytes and granuloma M2 macrophages in patients with primary immunodeficiencies. J Allergy Clin Immunol. 2016 Nov;138(5):1436-9.e11. doi: 10.1016/j. jaci.2016.06.030.
7. Sarmiento JD, Villada F, Orrego JC, Franco JL, Trujillo-Vargas CM. Adverse events following immunization in patients with primary immunodeficiencies. Vaccine. 2016;34(13):1611-6. doi:10.1016/j. vaccine.2016.01.047.
8. Morillo-Gutierrez B, Worth A, Valappil M, Gaspar HB, Gennery AR. Chronic infection with rotavirus vaccine strains in UK children with severe combined immunodeficiency. Pediatr Infect Dis J. 2015;34(9):1040-1. doi:10.1097/INF.0000000000000788.
9. Loubet P, Kernéis S, Groh M, Loulergue P, Blanche P, Verger P, et al. Attitude, knowledge and factors associated with influenza and pneumococcal vaccine uptake in a large cohort of patients with secondary immune deficiency. Vaccine. 2015 Jul 17;33(31):3703-8. doi: 10.1016/j.vaccine.2015.06.012.
10. Furer V, Rondaan C, Heijstek MW, Agmon-Levin N, van Assen S, Bijl M, et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis. 2020 Jan;79(1):39-52. doi: 10.1136/annrheumdis-2019-215882.
11. Bemben NM, Berg ML. Efficacy of inactivated vaccines in patients treated with immunosuppressive drug therapy. Pharmacotherapy. 2022;42(4):334-42. doi:10.1002/phar.2671.
12. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde e Ambiente, Departamento de Imunizações e Doenças Imunopreveníveis. Manual dos Centros de Referência para Imunobiológicos Especiais. 6a ed. Brasília: Ministério da Saúde; 2023.
13. Medical Advisory Committee of the Immune Deficiency Foundation; Shearer WT, Fleisher TA, Buckley RH, Ballas Z, Ballow M, Blaese RM, et al. Recommendations for live viral and bacterial vaccines in immunodeficient patients and their close contacts. J Allergy Clin Immunol. 2014 Apr;133(4):961-6. doi: 10.1016/j.jaci.2013.11.0.
14. Bonilla FA. Update: Vaccines in primary immunodeficiency. J Allergy Clin Immunol. 2018;141(2):474-81. doi:10.1016/j. jaci.2017.12.980.
15. Lee TK, Gereige JD, Maglione PJ. State-of-the-art diagnostic evaluation of common variable immunodeficiency. Ann Allergy Asthma Immunol. 2021 Jul;127(1):19-27. doi: 10.1016/j. anai.2021.03.005.
16. Conley ME, Dobbs AK, Farmer DM, Kilic S, Paris K, Grigoriadou S, et al. Primary B cell immunodeficiencies: comparisons and contrasts. Annu Rev Immunol. 2009;27:199-227. doi: 10.1146/annurev.immunol.021908.132649.
17. Hanitsch LG, Lobel M, Mieves JF, Bauer S, Babel N, Schweiger B, et al. Cellular and humoral influenza-specific immune response upon vaccination in patients with common variable immunodeficiency and unclassified antibody deficiency. Vaccine. 2016 May 5;34(21):2417-23. doi: 10.1016/j.vaccine.2016.03.091.
18. Junker AK, Bonilla FA, Sullivan KE. How to flee the flu. Clin Immunol. 2004 Sep;112(3):219-20. doi: 10.1016/j.clim.2004.03.013.
19. Mieves JF, Wittke K, Freitag H, Volk HD, Scheibenbogen C, Hanitsch LG. InfluenzaVaccination in patients with common variable immunodeficiency (CVID). Curr Allergy Asthma Rep. 2017;17(11):78. doi:10.1007/s11882-017-0749-3.
20. Aguilar C, Malphettes M, Donadieu J, Chandesris O, Coignard-Biehler H, Catherinot E, et al. Prevention of infections during primary immunodeficiency. Clin Infect Dis. 2014 Nov 15;59(10):1462-70. doi: 10.1093/cid/ciu646.
21. Pavlov DN, Van Zyl WB, Kruger M, Blignaut L, Grabow WOK, Ehlers MM. Poliovirus vaccine strains detected in stool specimens of immunodeficient children in South Africa. Diagn Microbiol Infect Dis. 2006;54(1):23-30. doi:10.1016/j.diagmicrobio.2005.08.011.
22. Centers for Disease Control and Prevention. Licensure of a 13-valent pneumococcal conjugate vaccine (PCV13) and recommendations for use among children - Advisory Committee on Immunization Practices (ACIP), 2010. MMWR Morb Mortal Wkly Rep. 2010;59:258-61.
23. Azizi G, Pouyani MR, Abolhassani H, Sharifi L, Dizaji MZ, Mohammadi J, et al. Cellular and molecular mechanisms of immune dysregulation and autoimmunity. Cell Immunol. 2016 Dec;310:14-26. doi: 10.1016/j.cellimm.2016.08.012.
24. Jones A. Immunological disorders in infants and children. 5a ed. Arch Dis Child. 2005;90(5):549. doi:10.1136/adc.2004.061770.
25. Associazione Italiana di Ematologia ed Oncologia Pediatrica (AIEOP). Sindrome IPEX (Immunodysregulation, Polyendocrinopathy, Enteropathy, X-linked). Raccomandazioni diagnostiche e terapeutiche [Internet]. 2009; p.9-10. Disponível em: https://www.aieop.org/web/wp-content/uploads/2018/02/IPEX-raccomandazioni-2009.pdf.
26. Jesus AA, Oliveira JB, Hilário MOE, Terreri MTRA, Fujihira E, WataseM, et al. Síndromes autoinflamatórias hereditárias na faixa etária pediátrica. J Pediatr (Rio J). 2010;86(5):353-66. doi:10.1590/S0021-75572010000500003.
27. Mendonça LO, Azzolini RK, Assis JP, Franco A, Kalil J, Castro FM, et al. Uma nova classe de doenças: doenças autoinflamatórias. Arq Asma Alerg Imunol. 2017;1(3):263-71. doi:10.5935/2526-5393.20170037.
28. Aranda CS, Guimarães RR, Pimentel MGP. Combined immunodeficiencies. J Pediatr (Rio J). 2021;97:39-48. doi:10.1016/j. jped.2020.10.014.
29. Sobh A, Bonilla FA. Vaccination in primary immunodeficiency disorders. J Allergy Clin Immunol Pract. 2016;4(6):1066-75. doi:10.1016/j.jaip.2016.09.012.
30. Donadieu J, Fenneteau O, Beaupain B, Mahlaoui N, Chantelot CB. Congenital neutropenia: diagnosis, molecular bases and patient management. Orphanet J Rare Dis. 2011;6:26. doi:10.1186/1750-1172-6-26.
31. Janczar S, Zalewska-Szewczyk B, B bol-Pokora K, Pa nik J, Zeman K, Mtynarski W. Vaccination in children with chronic severe neutropenia - review of recommendations and a practical approach. Cent-Eur J Immunol. 2020;45(2):202-5. doi:10.5114/ceji.2020.97910.
32. Rubin LG, Levin MJ, Ljungman P, Davies EG, Avery R, Tomblyn M, et al.; Infectious Diseases Society of America. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis. 2014 Feb;58(3):309-18. doi: 10.1093/cid/cit816. doi:10.1093/cid/cit816.
33. Eibl MM, Wolf HM. Vaccination in patients with primary immune deficiency, secondary immune deficiency and autoimmunity with immune regulatory abnormalities. Immunotherapy. 2015;7(12):1273-92. doi:10.2217/IMT.15.74.
34. Anikeeva N, Somersalo K, Sims TN, Thomas VK, Dustin ML, SykulevY. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proc Natl Acad Sci USA. 2005;102(18):6437-42. doi:10.1073/pnas.0502467102.
35. Kohl S, Springer TA, Schmalstieg FC, Loo LS, Anderson DC. Defective natural killer cytotoxicity and polymorphonuclear leukocyte antibody-dependent cellular cytotoxicity in patients with LFA-1/OKM-1 deficiency. J Immunol. 1984 Dec;133(6):2972-8.
36. Blazina S, Debeljak M, Kosnik M, Sim i S, Stopinsek S, Markelj G, et al. Functional Complement Analysis Can Predict Genetic Testing Results and Long-Term Outcome in Patients With Complement Deficiencies. Front Immunol. 2018 Mar 21;9:500. doi: 10.3389/fimmu.2018.00500.
37. Brodszki N, Frazer-Abel A, Grumach AS, Kirschfink M, Litzman J, Perez E, et al. European Society for I mmunodeficiencies (ESID) and European Reference Network on Rare Primary Immunodeficiency, Autoinflammatory and Autoimmune Diseases (ERN RITA) Complement Guideline: Deficiencies, Diagnosis, and Management. J Clin Immunol. 2020 May;40(4):576-91. doi: 10.1007/s10875-020-00754-1.
38. Maurer M, Magerl M, Betschel S, Aberer W, Ansotegui IJ, Aygoren-Pürsün E, et al. The international WAO/EAACI guideline for the management of hereditary angioedema-The 2021 revision and update. Allergy. 2022 Jul;77(7):1961-90. doi: 10.1111/all.15214.
39. Dávila-Seijo P, Dauden E, Descalzo MA, Carretero G, Carrascosa JM, Vanaclocha F, et al.; BIOBADADERM Study Group. Infections in Moderate to Severe Psoriasis Patients Treated with Biological Drugs Compared to Classic Systemic Drugs: Findings from the BIOBADADERM Registry. J Invest Dermatol. 2017 Feb;137(2):313-21. doi: 10.1016/j.jid.2016.08.034.
40. Boerbooms AM, Kerstens PJ, van Loenhout JW, Mulder J, van de Putte LB. Infections during low-dose methotrexate treatment in rheumatoid arthritis. Semin Arthritis Rheum. 1995;24(6):411-21. doi:10.1016/s0049-0172(95)80009-3.
41. McLean-Tooke A, Aldridge C, Waugh S, Spickett GP, Kay L. Methotrexate, rheumatoid arthritis and infection risk: what is the evidence? Rheumatol Oxf Engl. 2009;48(8):867-71. doi:10.1093/rheumatology/kep101.
42. He J, Li Z. Dilemma of immunosuppression and infection risk in systemiclupus erythematosus. Rheumatol Oxf Engl. 2023;62(Suppl 1):i22-i29. doi:10.1093/rheumatology/keac678.
43. Agarwal N, Ollington K, Kaneshiro M, Frenck R, Melmed GY. Are immunosuppressive medications associated with decreased responses to routine immunizations? A systematic review. Vaccine. 2012 Feb 14;30(8):1413-24. doi: 10.1016/j.vaccine.2011.11.109.
44. Papp KA, Haraoui B, Kumar D, Marshall JK, Bissonnette R, Bitton A, et al. Vaccination Guidelines for Patients with Immune-Mediated Disorders on Immunosuppressive Therapies-Executive Summary. J Can Assoc Gastroenterol. 2019 Dec;2(4):149-52. doi: 10.1093/jcag/gwy069.
45. Adler S, Krivine A, Weix J, Rozenberg F, Launay O, Huesler J, et al. Protective effect of A/H1N1 vaccination in immune-mediated disease - a prospectively controlled vaccination study. Rheumatology (Oxford). 2012 Apr;51(4):695-700. doi: 10.1093/rheumatology/ker389.
46. Brasil. Agência Nacional de Vigilância Sanitária - Anvisa. Bula Nucala® [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/medicamentos/1064523?numeroProcesso=2535148695320 1534. Acessado em: 08/11/2024.
47. Brasil. Anvisa - Agência Nacional de Vigilância Sanitária. Bula Dupixent® [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/medicamentos/1324521?numeroProcesso=2535118948720 1920. Acessado em: 08/11/2024.
48. Imazio M, Lazaros G, Gattorno M, LeWinter M, Abbate A, Brucato A, et al. Anti-interleukin-1 agents for pericarditis: a primer for cardiologists. Eur Heart J. 2022Aug 14;43(31):2946-57. doi: 10.1093/eurheartj/ehab452.
49. Panettieri R, Lugogo N, Corren J, Ambrose CS. Tezepelumab for severe asthma: one drug targeting multiple disease pathways and patient types. J Asthma Allergy. 2024;17:219-36. doi:10.2147/JAA. S342391.
50. Kamal ME, Werida RH, Radwan MA, Askar SR, Omran GA, El-Mohamdy MA, et al. Efficacy and safety of infliximab and adalimumab in inflammatory bowel disease patients. Inflammopharmacology. 2024 Oct;32(5):3259-69. doi: 10.1007/s10787-024-01508-w.
51. Fleischmann R, Goldman JA, Leirisalo-Repo M, Zanetakis E, ElKadi H, Kellner H, et al. Infliximab efficacy in rheumatoid arthritis after an inadequate response to etanercept or adalimumab: results of a target-driven active switch study. Curr Med Res Opin. 2014 Nov;30(11):2139-49. doi: 10.1185/03007995.2014.942416.
52. Thomas TC, Rollins SA, Rother RP, Giannoni MA, Hartman SL, Elliott EA, et al. Inhibition of complement activity by humanized anti-C5 antibody and single-chain Fv. Mol Immunol. 1996 Dec;33(17-18):1389-401. doi: 10.1016/s0161-5890(96)00078-8.
53. Atagündüz P, Keser G, Soy M. Interleukin-1 inhibitors and vaccinationincluding covid-19ininflammatory rheumatic diseases: a nonsystematic review. Front Immunol. 2022;12:734279. doi:10.3389/fimmu.2021.734279.
54. Rabinowitz KM, Navon M, Edelman-Klapper H, Zittan E, Bar-Gil Shitrit A, Goren I, et al., On Behalf Of The Responses To CovidVaccine Israeli Ibd. Anti-TNF Treatment Impairs Long-Term Immune Responses to COVID-19 mRNA Vaccine in Patients with Inflammatory Bowel Diseases. Vaccines (Basel). 2022 Jul 26;10(8):1186. doi: 10.3390/vaccines10081186.
55. Garcia Garrido HM, Veurink AM, Leeflang M, Spijker R, Goorhuis A, Grobusch MP. Hepatitis A vaccine immunogenicity in patients using immunosuppressive drugs: A systematic review and metaanalysis. Travel Med Infect Dis. 2019;32:101479. doi:10.1016/j. tmaid.2019.101479.
56. Müller KE, Dohos D, Sipos Z, Kiss S, Dembrovszky F, Kovács N, et al. Immune response to influenza and pneumococcal vaccines in adults with inflammatory bowel disease: A systematic review and meta-analysis of 1429 patients. Vaccine. 2022 Mar 18;40(13):2076-86. doi: 10.1016/j.vaccine.2022.02.027.
57. Bass AR, Chakravarty E, Akl EA, Bingham CO, Calabrese L, Cappelli LC, et al. 2022 American College of Rheumatology Guideline for Vaccinations in Patients With Rheumatic and Musculoskeletal Diseases. Arthritis Care Res (Hoboken). 2023 Mar;75(3):449-64. doi: 10.1002/acr.25045.
58. Bula de Soliris®: eculizumabe. Responsável técnica Luciana Maciel Zuicker Maziero. São Paulo. Alexion Serviços e Farmacêutica do Brasil Ltda., 2022.
59. Jaeger VK, Hoffman HM, van der Poll T, Tilson H, Seibert J, Speziale A, et al. Safety of vaccinations in patients with cryopyrin-associated periodic syndromes: a prospective registry based study. Rheumatology (Oxford). 2017 Sep 1;56(9):1484-91. doi: 10.1093/rheumatology/kex185.
60. Mari D, White K. Live vaccine administration in patients treated with biologics for allergic disease. J Allergy Clin Immunol Pract. 2024;12(10):2842-2843.e3. doi:10.1016/j.jaip.2024.06.032.
61. Blauvelt A, Simpson EL, Tyring SK, Purcell LA, Shumel B, Petro CD, et al. Dupilumab does not affect correlates of vaccine-induced immunity: A randomized, placebo-controlled trial in adults with moderate-to-severe atopic dermatitis. J Am Acad Dermatol. 2019 Jan;80(1):158-67.e1. doi: 10.1016/j.jaad.2018.07.048.
62. Wechsler ME, Souza-Machado A, Xu C, Mao X, Kapoor U, Khokhar FA, et al. Preclinical and clinical experience with dupilumab on the correlates of live attenuated vaccines. J Allergy Clin Immunol Glob. 2021 Dec 8;1(1):9-15. doi: 10.1016/j.jacig.2021.12.003.
63. Narbutt J, uber Z, Lesiak A, Bie N, Szepietowski JC. Vaccinations in selected immune-related diseases treated with biological drugs and JAK Inhibitors - literature review and statement of experts from Polish Dermatological Society. Vaccines. 2024;12(1):82. doi:10.3390/vaccines12010082.
64. Lieberman JA, Chu DK, Ahmed T, Dribin TE, Abrams EM, Anagnostou A, et al. A systematic review and expert Delphi Consensus recommendation on the use of vaccines in patients receiving dupilumab: A position paper of the American College of Allergy, Asthma and Immunology. Ann Allergy Asthma Immunol. 2024 Sep;133(3):286-94. doi: 10.1016/j.anai.2024.05.014.
65. Villarino AV, Kanno Y, Ferdinand JR, O'Shea JJ. Mechanisms of Jak/STAT signaling in immunity and disease. J Immunol. 2015 Jan 1;194(1):21-7. doi: 10.4049/jimmunol.1401867.
66. Schwartz DM, Kanno Y, Villarino A, Ward M, Gadina M, O'Shea JJ. JAKinhibition as a therapeutic strategy forimmune andinflammatory diseases. Nat Rev Drug Discov. 2017;16(12):843-62. doi:10.1038/nrd.2017.201.
67. U.S. Centers for Disease Control and Prevention - CDC. Guidelines for Immunizations [Internet]. Disponível em: https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/immunocompetence.html. Acessado em: 08/10/2024.
68. Winthrop KL, Bingham CO 3rd, Komocsar WJ, Bradley J, Issa M, Klar R, et al. Evaluation of pneumococcal and tetanus vaccine responses in patients with rheumatoid arthritis receiving baricitinib: results from a long-term extension trial substudy. Arthritis Res Ther. 2019 Apr 18;21(1):102. doi: 10.1186/s13075-019-1883-1.
69. Winthrop K, Vargas JI, Drescher E, Garcia C, Friedman A, Hendrickson B, et al. Evaluation of response to 13-valent conjugated pneumococcal vaccination in patients with rheumatoid arthritis receiving upadacitinib: results from a phase 2 open-label extension study. RMD Open. 2022 Mar;8(1):e002110. doi: 10.1136/rmdopen-2021-002110.
70. Winthrop KL, Silverfield J, Racewicz A, Neal J, Lee EB, Hrycaj P et al. The effect of tofacitinib on pneumococcal and influenza vaccine responses in rheumatoid arthritis. Ann Rheum Dis. 2016 Apr;75(4):687-95. doi: 10.1136/annrheumdis-2014-207191.
71. Russell MD, Stovin C, Alveyn E, Adeyemi O, Chan CKD, Patel V, et al. JAK inhibitors and the risk of malignancy: a meta-analysis across disease indications. Ann Rheum Dis. 2023 Aug;82(8):1059-67. doi: 10.1136/ard-2023-224049.
72. Hong X, Xiao Y, Xu L, Liu L, Mo H, Mo H. Risk of hepatitis B reactivation in HBsAg-/HBcAb+ patients after biologic or JAK inhibitor therapy for rheumatoid arthritis: A meta-analysis. Immun Inflamm Dis. 2023 Feb;11(2):e780. doi: 10.1002/iid3.780.
73. Brasil. Ministério da Saúde. Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação [Internet]. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/svsa/vacinacao-imunizacao-pni/manual_eventos-_adversos_pos_ vacinacao_4ed_atualizada.pdf/view. Acessado em: 16/10/2024.
74. Talbot EA, Perkins MD, Silva SF, Frothingham R. Disseminated bacille Calmette-Guérin disease after vaccination: case report and review. Clin Infect Dis Off Publ Infect Dis Soc Am. 1997;24(6):1139-46. doi:10.1086/513642.
75. Fekrvand S, Yazdani R, Olbrich P, Gennery A, Rosenzweig SD, Condino-Neto A, et al. Primary Immunodeficiency Diseases and Bacillus Calmette-Guérin (BCG)-Vaccine-Derived Complications: A Systematic Review. J Allergy Clin Immunol Pract. 2020 Apr;8(4):1371-86. doi: 10.1016/j.jaip.2020.01.038.
76. Mazzucchelli JT, Bonfim C, Castro GG, Condino-Neto AA, Costa NM, Cunha L,et al. Severe combined immunodeficiency in Brazil: management, prognosis, and BCG-associated complications. J Investig Allergol Clin Immunol. 2014;24(3):184-91.
77. Zeng Y, Ying W, Wang W, Hou J, Liu L, Sun B, et al. Clinical and Genetic Characteristics of BCG Disease in Chinese Children: a Retrospective Study. J Clin Immunol. 2023 May;43(4):756-68. doi: 10.1007/s10875-022-01422-2.
78. Lyra PT, Souza E, Moura ACA, Matta MC, Torres LC, Coelho AVC, et al. Inborn Errors of Immunity in Patients with Adverse Events Following BCG Vaccination in Brazil. J Clin Immunol. 2022 Nov;42(8):1708-1720. doi: 10.1007/s10875-022-01302-9.
79. Ong RYL, Chan SB, Chew SJ, Liew WK, Thoon KC, Chong CY, et al. Disseminated bacillus-Calmette-Guérin infections and primary immunodeficiency disorders in Singapore: A single center 15-year retrospective review. Int J Infect Dis. 2020 Aug;97:117-25. doi: 10.1016/j.ijid.2020.05.117.
80. McKay SL, Guo A, Pergam SA, Dooling K. Herpes zoster risk in immunocompromised adults in the United States: a systematic review. Clin Infect Dis Off Publ Infect Dis Soc Am. 2020;71(7):e125-e134. doi:10.1093/cid/ciz1090.
81. Whitley RJ. Herpesvirus infections in the immunocompromised host: diagnosis and management. Adv Exp Med Biol. 1986;202:95-118. doi:10.1007/978-1-4684-1259-8_7.
82. Muñoz-Quiles C, López-Lacort M, Díez-Domingo J, Orrico-Sánchez A. Herpes zoster risk and burden of disease in immunocompromised populations: a population-based study using health system integrated databases, 2009-2014. BMC Infect Dis. 2020 Nov 30;20(1):905. doi: 10.1186/s12879-020-05648-6.
83. Lal H, Cunningham AL, Godeaux O, Chlibek R, Diez-Domingo J, Hwang SJ, et al.; ZOE-50 Study Group. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Engl J Med. 2015 May 28;372(22):2087-96. doi: 10.1056/NEJMoa1501184.
84. Bastidas A, de la Serna J, El Idrissi M, Oostvogels L, Quittet P López-Jiménez J, et al.; ZOE-HSCT Study Group Collaborators. Effect of Recombinant Zoster Vaccine on Incidence of Herpes Zoster After Autologous Stem Cell Transplantation: A Randomized Clinical Trial. JAMA. 2019 Jul 9;322(2):123-33. doi: 10.1001/jama.2019.9053.
85. Dagnew AF, Ilhan O, Lee WS, Woszczyk D, Kwak JY, Bowcock S, et al.; Zoster-039 study group. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in adults with haematological malignancies: a phase 3, randomised, clinical trial and post-hoc efficacy analysis. Lancet Infect Dis. 2019 Sep;19(9):988-1000. doi: 10.1016/S1473-3099(19)30163-X.