Número Atual: Abril-Junho 2025 - Volume 9 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Ana Karolina Barreto Berselli Marinho
- Claudia França Cavalcante Valente
- Ekaterini Simões Goudoris
- Anete Sevciovic Grumach
- Fátima Rodrigues Fernandes
- Claudia Leiko Yonekura Anagusko
- Clarissa Morais Bussato Gerhardt
- Gisele Feitosa Zuvanov Casado
- Angelica Varela Rondon
- Monica Araujo Álvares Silva
- Ronney Corrêa Mendes
- Antonio Paulo Costa Penido
- Lorena de Castro Diniz
- Bianca Noleto Ayres Guimarães
- Ana Paula Neves Burian
- Renato de Ávila Kfouri
- Mônica Levi
- Fabio Chigres Kuschnir
ARTIGO ESPECIAL
Reações de hipersensibilidade a vacinas e imunização de pacientes com asma: recomendações conjuntas da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Imunizações
Hypersensitivity reactions to vaccines and immunization in patients with asthma: joint recommendations of the Brazilian Association of Allergy and Immunology and the Brazilian Immunization Society
Ana Karolina Barreto Berselli Marinho1,2,3; Claudia França Cavalcante Valente1,3,4; Ekaterini Simões Goudoris5,6; Anete Sevciovic Grumach6,7; Fátima Rodrigues Fernandes1,8; Claudia Leiko Yonekura Anagusko1,2; Clarissa Morais Bussato Gerhardt1,2; Gisele Feitosa Zuvanov Casado1,9; Angelica Varela Rondon1,10; Monica Araujo Álvares Silva1,4; Ronney Corrêa Mendes1,11; Antonio Paulo Costa Penido1,12; Lorena de Castro Diniz1,13; Bianca Noleto Ayres Guimarães1,14; Ana Paula Neves Burian3,15; Renato de Ávila Kfouri3,16; Mônica Levi3,17; Fabio Chigres Kuschnir18,19
1. Associação Brasileira de Alergia e Imunologia (ASBAI), Departamento Científico de Imunizações - São Paulo, SP, Brasil
2. Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, Serviço de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
3. Comissão Técnica para Revisão dos Calendários Vacinais da Sociedade Brasileira de Imunizações (SBIm) - São Paulo, SP, Brasi
4. Hospital da Criança de Brasília, Serviço de Alergia e Imunologia - Brasília, DF, Brasil
5. Departamento de Pediatria da Faculdade de Medicina da UFRJ, Serviço de Alergia e Imunologia do IPPMG - UFRJ - Rio de Janeiro, RJ, Brasil
6. ASBAI, Departamento Científico de Erros Inatos da Imunidade - São Paulo, SP, Brasil
7. Centro Universitário Saúde ABC (CEUFMABC), Faculdade de Medicina, Serviço de Referência em Doenças Raras, Imunologia Clínica - Santo André, SP, Brasil
8. Hospital Infantil Sabará, Fundação José Luiz Egydio Setúbal, Instituto PENSI - São Paulo, SP, Brasil
9. Membro permanente titular do Comitê Estadual de Farmacovigilância de Vacinas e Outros Imunobiológicos (CEFAVI) - Maceió, AL, Brasil
10. Fundação Oswaldo Cruz, Centro de Referência para Imunobiológicos Especiais (CRIE) - Rio de Janeiro, RJ, Brasil
11. Alervac Clínica de Vacinação - São Luiz, MA, Brasil
12. Hospital Felício Rocho, Coordenador do Centro de Alergia e Imunologia e do Centro de Imunizações - Belo Horizonte, MG, Brasil
13. Centro de Referência de Imunobiológicos Especiais (CRIE) - Goiânia, GO, Brasil
14. Secretaria Municipal de Saúde, Hospital Municipal Rocha Maia, Centro de Referência para Imunobiológicos Especiais (CRIE) -Rio de Janeiro, RJ, Brasil
15. Centro de Referência de Imunobiológicos Especiais (CRIE) - Vitória, ES, Brasil
16. Vice-presidente da Sociedade Brasileira de Imunizações (SBIm) - São Paulo, SP, Brasil
17. Presidente da Sociedade Brasileira de Imunizações (SBIm) - São Paulo, SP, Brasil
18. Universidade do Estado do Rio de Janeiro (UERJ) , Faculdade de Ciência Médicas, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
19. Presidente da Associação Brasileira de Alergia e Imunologia (ASBAI) - São Paulo, SP, Brasil
Endereço para correspondência:
Claudia França Cavalcante Valente
E-mail: claudiafcvalente@gmail.com
Submetido em: 15/12/2024,
aceito em: 23/12/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Este artigo oferece informações e recomendações sobre reações de hipersensibilidade a vacinas e imunização de pacientes com asma. Apresenta-se uma análise das reações de hipersensibilidade imediata e tardia às vacinas, enfatizando a importância da avaliação cuidadosa dos antecedentes alérgicos do paciente e do uso de testes diagnósticos específicos para identificar sensibilizações. Discute-se ainda a aplicação de estratégias como a vacinação em doses fracionadas, visando minimizar o risco de reações alérgicas graves. O artigo também explora a segurança e a eficácia de vacinas recentes, como as para dengue, COVID-19, vírus sincicial respiratório recombinante e doenças pneumocócicas no contexto dos pacientes alérgicos, incluindo aqueles com asma. A imunização segura desse grupo de pacientes é essencial não apenas para a proteção individual, mas também para a saúde coletiva, prevenindo surtos de doenças infecciosas e aumentando a confiança nas campanhas de vacinação. As recomendações apresentadas nesta publicação foram adaptadas ao contexto brasileiro e ajustadas por consenso entre especialistas membros da Associação Brasileira de Alergia e Imunologia (ASBAI) e da Sociedade Brasileira de Imunizações (SBIm).
Descritores: Alergia, asma, hipersensibilidade, imunidade, vacinas.
Introducão
Desde a década de 1960, quando os programas nacionais de imunização começaram a ser estabelecidos, as vacinas transformaram a saúde pública mundial. Estima-se que os esforços globais de imunização em massa salvaram aproximadamente 154 milhões de vidas ao longo dos últimos 50 anos, sendo a maioria - 101 milhões - de crianças menores de 1 ano1. Esses números colocam a vacinação como o principal contribuinte para a queda das taxas globais de mortalidade infantil1.
A vacinação elimina ou reduz drasticamente o risco de adoecimento ou de manifestações graves de mais de 20 doenças. Em pacientes alérgicos, a vacinação pode requerer considerações especiais e análise individual, visto que esta população pode apresentar reações adversas, incluindo reações de hipersensibilidade, que embora raras, podem ser graves. Este artigo apresenta recomendações para a vacinação de pacientes alérgicos e sugere condutas para a investigação, prevenção e manejo de reações alérgicas a vacinas, bem como revisa as indicações de imunização para pacientes com asma. A proposta é oferecer orientações claras e práticas para garantir a imunização segura e eficaz desses pacientes.
Metodologia
As evidências e recomendações apresentadas neste trabalho foram baseadas em dados publicados disponíveis até o momento e adaptadas ao contexto brasileiro. Uma revisão não sistemática da literatura foi conduzida entre junho e julho de 2024, utilizando a base de dados MEDLINE para identificar artigos que abordassem diferentes aspectos relacionados à imunização em pacientes alérgicos.
Inicialmente, foram buscados estudos que explorassem as reações de hipersensibilidade a vacinas, tanto imediatas quanto tardias, incluindo a vacinação em condições específicas como asma. Também foram analisados estudos sobre novas vacinas no contexto do paciente alérgico ou com asma, com foco na imunização contra dengue, vírus sincicial respiratório (VSR), COVID-19 e doença pneumocócica invasiva (DPI).
As evidências coletadas foram discutidas durante o I Fórum de Imunização do Paciente Alérgico e Imunodeprimido (realizado em 09 de agosto e 2024, na cidade de São Paulo) e as recomendações foram adotadas ou ajustadas por consenso entre os especialistas participantes, todos membros do Departamento Científico da Associação Brasileira de Alergia e Imunologia (ASBAI) e/ou da Sociedade Brasileira de Imunizações (SBIm).
Reações de hipersensibilidade às vacinas
Com o aumento global da prevalência de doenças alérgicas2, tem crescido também a preocupação com as possíveis reações alérgicas associadas às vacinas e seus componentes.
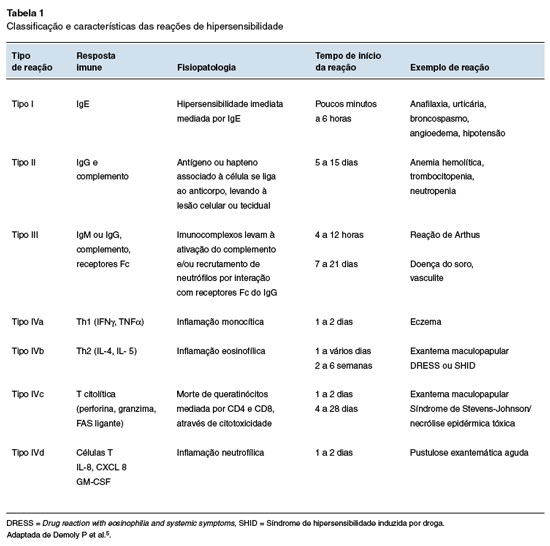
A Organização Mundial de Alergia recomenda a categorização das reações imunológicas a vacinas com base no tempo de aparecimento dos sintomas. Essa abordagem define dois tipos gerais de reações: imediatas (minutos a horas após a vacinação) e tardias (horas a dias após a vacinação). Essa classificação permite distinguir principalmente as reações mediadas por imunoglobulina E (IgE), conhecidas como reações imunológicas do tipo I, das demais reações (Tabela 1)3. Reações imediatas, que geralmente envolvem a mediação por IgE, são particularmente preocupantes devido ao risco de anafilaxia caso o paciente seja reexposto ao alérgeno4.
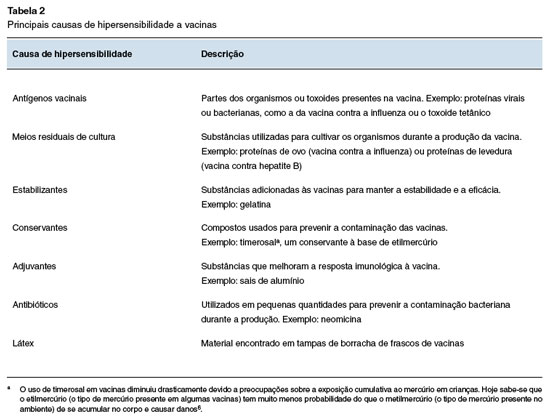
As reações de hipersensibilidade às vacinas podem ser desencadeadas por vários componentes, incluindo os antígenos vacinais, meios residuais usados para o cultivo dos organismos, estabilizantes, conservantes ou outros excipientes, conforme detalhado na Tabela 2.
Reações de hipersensibilidade imediata
As reações alérgicas imediatas, mediadas ou não por IgE, podem envolver vários sintomas. Os mais comuns estão listados a seguir.
- Sintomas cutâneos, incluindo rubor, prurido, urticária e angioedema.
- Sintomas respiratórios, incluindo coriza, congestão nasal, alteração na qualidade da voz, sensação de fechamento da garganta ou sufocamento, estridor, tosse, chiado e dispneia.
- Sintomas cardiovasculares, incluindo sensação de desmaio, síncope, alteração do estado mental, palpitações e hipotensão.
- Sintomas gastrointestinais como dor abdominal, vômitos e diarreia.
A forma mais grave de uma reação alérgica imediata é a anafilaxia, definida como uma reação alérgica sistêmica de início rápido, que pode ser fatal7. Casos de reações anafiláticas às vacinas são raros, variando de 0,3 a 2,9 casos por milhão de doses aplicadas8-11. Embora a anafilaxia seja uma reação potencialmente grave, na maioria das vezes ela pode ser tratada com um desfecho sem sequelas ou fatalidades. Uma revisão dos relatórios submetidos ao Sistema de Notificação de Eventos Adversos a Vacinas dos Estados Unidos descreve apenas oito mortes possivelmente causadas por reações anafiláticas à vacinação ao longo de 26 anos (1990 a 2016)10.
Quando a anafilaxia ocorre após a vacinação, os sintomas geralmente surgem dentro de 30 minutos após a administração do imunobiológico, embora, em casos raros, possam aparecer após várias horas10. Reações mais tardias tendem a ser menos graves e podem ser causadas pela absorção retardada do alérgeno ou pela exposição a outro alérgeno após a vacinação12. Nesse contexto, é essencial entender que a ocorrência de anafilaxia ou outro evento ad-verso não implica necessariamente que a vacina foi a causa do evento. Muitas vezes, esses eventos têm associação temporal ou resultam de outras condições de saúde do paciente.
Além disso, é crucial diferenciar a anafilaxia de outras reações, como as reações vasovagais pósvacinação e os sintomas relacionados à ansiedade13. As reações vasovagais são caracterizadas por hipotensão, palidez e desmaio, em contraste com a anafilaxia, que frequentemente começa com rubor, prurido e taquicardia13. Sintomas de ansiedade pós vacinação incluem espasmo das cordas vocais, que pode causar estridor e dispneia, e ataques de pânico, que podem provocar sensação de nó ou aperto na garganta, hipertensão, taquicardia, dispneia e outros sintomas14.
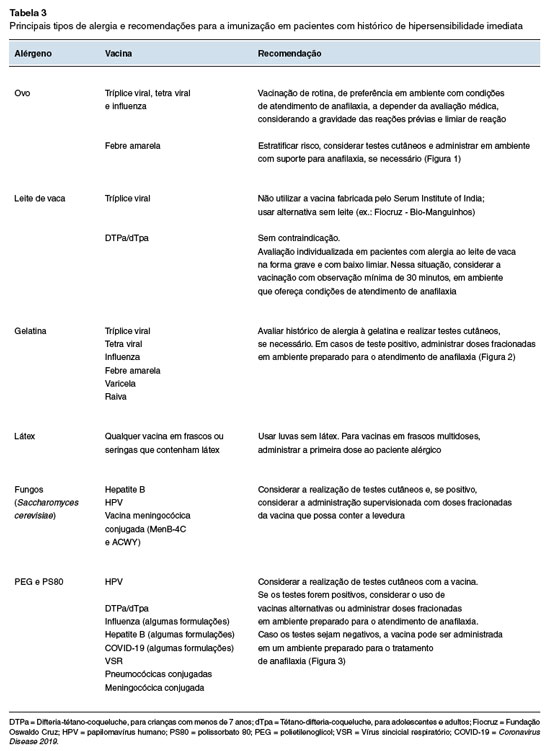
Pessoas com alergia ao ovo
Algumas vacinas usam ovos embionados em sua produção. Nesse processo, o vírus é inoculado em ovos embrionados, onde se replica. Após a replicação, o vírus é extraído, e inativado ou atenuado, para a produção vacinal15. Dessa forma, algumas vacinas podem conter traços de proteína do ovo, como a ovalbumina16. No entanto, os avanços nos métodos de produção têm reduzido significativamente a quantidade residual dessa proteína, tornando as vacinas mais seguras para pacientes com alergia ao ovo.
As vacinas tríplice viral (sarampo, caxumba e rubéola) e tetra viral (sarampo, caxumba, rubéola e varicela) contêm quantidades mínimas de ovoalbumina17,18. Estas vacinas são consideradas seguras para pacientes alérgicos ao ovo e não há contraindicação ao seu uso ou recomendação de teste cutâneo prévio17-19. Portanto, recomenda-se a vacinação de rotina. Para pacientes graves, com baixo limiar para reações ao contato com o alimento, considerar administração em ambiente com condições de atendimento de anafilaxia.
A vacina influenza, embora contenha traços de ovoalbumina, também é segura para pacientes alérgicos ao ovo20. Uma revisão de 28 estudos que envolveu 4.315 pacientes alérgicos ao ovo, dos quais 656 tinham histórico de anafilaxia ao ovo, mostrou que não houve reações graves relacionadas à vacina21. Portanto, a vacinação contra influenza é recomendada para pacientes alérgicos ao ovo, sem ressalvas. Para pacientes graves, com baixo limiar para reações ao contato com o alimento, considerar administração em ambiente com condições de atendimento de anafilaxia.
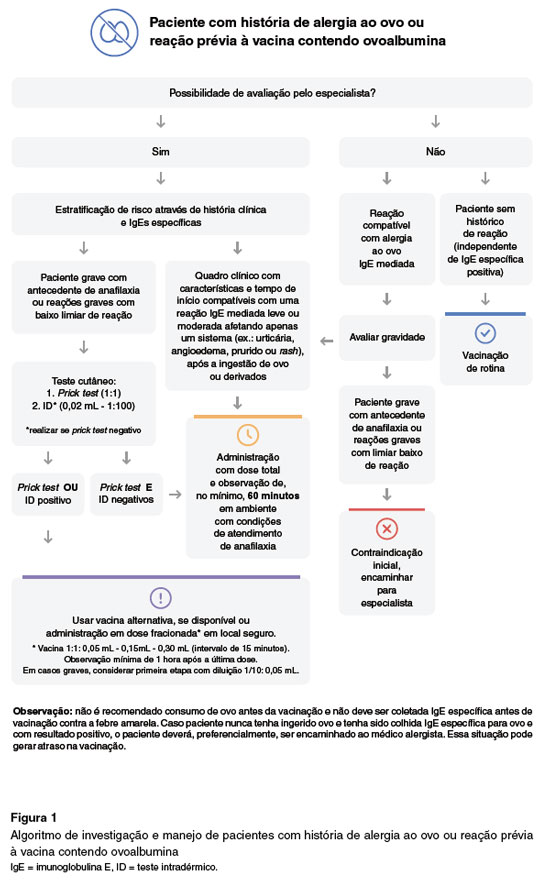
A vacina febre amarela contém maior quantidade de proteínas residuais do ovo em comparação às vacinas tríplice viral, tetra viral e influenza. A vacina é altamente imunogênica e tem um papel crucial no controle da doença em nosso país22, porém devese realizar estratificação de risco em pacientes com alergia grave ao ovo para que essa vacina possa ser realizada de forma segura. Essa estratificação deve levar em consideração a história clínica do paciente e testes específicos, como o IgE para ovo e seus componentes, conforme descrito na Figura 1. Além disso, poderá ser necessário realizar testes cutâneos com a vacina da febre amarela (prick test e teste intradérmico) para auxiliar na definição da melhor abordagem para a vacinação. Em casos leves a moderados, é recomendada a administração da vacina em ambiente com suporte para tratamento de anafilaxia. Em casos graves, os testes cutâneos de leitura imediata podem ser úteis. Caso prick test e o teste intradérmico sejam negativos, é recomendada a administração da dose total em ambiente com condições para tratamento de anafilaxia e observação de 60 minutos. Caso o prick test ou teste intradérmico sejam positivos, é recomendada a administração em doses fracionadas ou em esquema de dessensibilização23.
Gerhardt e cols.24 avaliaram a vacinação em pacientes com alergia ao ovo em um hospital quaternário, estratificando risco com base nos testes cutâneos. Dos 43 pacientes avaliados, 37 apresentaram prick test e intradérmico negativos, sendo administrada a dose plena da vacina, sem reações. Apenas 6 pacientes apresentaram teste intradérmico positivo, sendo realizada dessensibilização para a vacina. Metade desses pacientes (3/6) apresentou reações de hipersensibilidade leves e foi tratada com antihistamínico e/ou corticoide oral. Em outro estudo, conduzido por Cançado e cols.25, 132 pacientes com alergia ao ovo foram vacinados para febre amarela sem efeitos adversos, sendo que 92 (70%) receberam a dose plena e em 40 (30%, 17 com prick test positivo e 23 com intradérmico positivo) a vacina foi realizada em processo de dessensibilização. Outra coorte brasileira analisada em um centro de referência para imunobiológicos especiais (CRIE)26 avaliou 829 crianças vacinadas com história de alergia ao ovo. Foi observado apenas 11 (1,3%) casos de eventos adversos pós vacinação imediatos após a aplicação da vacina contra a febre amarela. Nesse mesmo estudo, 25 pacientes com história de anafilaxia ao ovo foram submetidos a testes cutâneos. Quinze pacientes apresentaram teste cutâneo positivo (prick test positivo em 6 pacientes e intradérmico positivo em 9 pacientes) e foram submetidos à dessensibilização, e apenas 1 paciente apresentou urticária. Todas as crianças com testes cutâneos negativos (prick test / intradérmico) não apresentaram reações.
Pessoas com alergia ao leite de vaca
Algumas vacinas podem conter proteínas derivadas do leite, como a lactoalbumina e a caseína, que são usadas durante o processo de produção. Entre as vacinas que podem conter esses componentes estão a tríplice viral fabricada pelo laboratório Serum Institute of India, e as vacinas DTPa (difteria-tétanocoqueluche, para crianças com menos de 7 anos) e dTpa (tétano-difteria-coqueluche, para adolescentes e adultos) de alguns fabricantes.
Para pacientes com alergia ao leite de vaca, é recomendado utilizar a vacina tríplice que não contenha proteína do leite, como a produzida pela Fiocruz-Bio-Manguinhos. Caso isso não seja possível, é aconselhável adiar a vacinação até que uma alternativa segura esteja disponível.
As vacinas DTPa e dTpa também podem conter proteínas do leite, usadas como meio de crescimento dos antígenos. Embora a quantidade seja muito pequena, não sendo suficiente para desencadear reações na maioria dos pacientes, há relatos de reações anafiláticas graves em crianças com alergia severa ao leite, possivelmente devido a presença de derivados da caseína27. Para pacientes graves, com baixo limiar para reações ao contato com o alimento, considerar administração dessas vacinas em ambiente com condições de atendimento de anafilaxia. Nos demais casos, recomenda-se a vacinação de rotina.
Quanto à vacina rotavírus, esta não contém proteína do leite de vaca em sua composição, e não há evidências científicas de que a administração dessa vacina cause alergia ao leite de vaca28. Portanto, a vacinação de rotina contra o rotavírus é segura para pessoas com alergia ao leite de vaca.
Pessoas com alergia à gelatina
A gelatina é frequentemente adicionada às vacinas como estabilizante, especialmente em vacinas que utilizam vírus atenuado (a depender do fabricante), como as vacinas tríplice viral, varicela, e febre amarela. Estudos têm demonstrado que a gelatina é a principal responsável por desencadear reações alérgicas graves, incluindo anafilaxia, em algumas dessas vacinas17,29,30.
Antes de administrar vacinas que contenham gelatina, é fundamental avaliar a história clínica do paciente em relação a reações prévias à gelatina, seja através da ingestão ou em resposta a vacinas anteriores. Pacientes com alergia a galactose-alfa-1,3-galactose (alfa-gal), uma condição associada a reações alérgicas tardias a carnes vermelhas e produtos derivados, também devem ser avaliados com cautela antes de receber vacinas contendo gelatina16.
Em casos em que há histórico de alergia à gelatina ou reações prévias a vacinas que contenham esse componente, a investigação pode incluir a dosagem de IgE específica para gelatina, realização de prick test com a vacina pura, e, em caso de resultado negativo no prick test, teste intradérmico com a vacina diluída a 1:10017. Se os testes cutâneos forem negativos, a vacina pode ser administrada na forma usual, com uma dose única, mantendo-se o paciente sob observação por, no mínimo, 30 minutos para monitorar possíveis reações17. Em situações em que um dos testes cutâneos são positivos, recomenda-se a administração da vacina em doses fracionadas em um ambiente preparado para o manejo de anafilaxia17, conforme ilustrado na Figura 2. Para pacientes com histórico de reação de hipersensibilidade grave após vacina contendo gelatina (anafilaxia grave com insuficiência respiratória com necessidade de O2 ou refratário a uso broncodilatador ou adrenalina ou necessidade de ventilação mecânica ou choque), está contraindicada a administração de vacinas que contenham esse componente.
Pessoas com alergia ao látex
As vacinas atualmente licenciadas no Brasil são comercializadas em frascos e seringas que podem conter látex. No entanto, casos de reações alérgicas causadas por esse tipo de exposição são extremamente raros e, na maioria dos casos, não foram realizados estudos específicos para determinar se o látex foi a causa da reação31.
Para minimizar os riscos em pacientes com alergia ao látex, recomenda-se que a administração de vacinas seja feita em ambiente látex-free. Além disso, para vacinas que são apresentadas em frascos multidoses, recomenda-se a administração da primeira dose retirada do frasco ao paciente alérgico ao látex. A sugestão de administrar a primeira dose ao paciente alérgico ao látex se baseia na ideia de que essa dose inicial tem menos chance de ter sido contaminada com partículas de látex.
Pessoas com alergia à fungos
No processo de fabricação de algumas vacinas, como as de hepatite B, papilomavírus humano (HPV) e alguns tipos de vacina meningocócica conjugada (como a MenB-4C e a ACWY), os antígenos são proteínas recombinantes expressas em Saccharomyces cerevisiae ou outras levedura16. Embora existam preocupações sobre possíveis reações alérgicas a essas vacinas em indivíduos com alergia a fungos, tais reações são extremamente raras.
Dada a raridade das reações alérgicas associadas às leveduras, a recomendação é que, em pacientes com histórico de alergia a S. cerevisiae, seja considerada a realização de testes cutâneos específicos.
Se o resultado for positivo, pode-se considerar a administração supervisionada da vacina em questão, preferencialmente com doses fracionadas, para minimizar o risco de uma reação adversa.
Pessoas com alergia ao polietilenoglicol (PEG) ou polissorbato 80 (PS80)
O PEG (ou macrogol) é um polímero de éter com peso molecular que varia de 200 a 35.000 g/mol. Ele é utilizado tanto na forma pura, como em preparações para colonoscopia e laxantes, quanto como excipiente em cosméticos, medicamentos e algumas vacinas32. O PS80 (ou Tween 80) é um detergente não iônico com cadeias laterais de poli(óxido de etileno) que são semelhantes à estrutura do PEG32. A alergia ao PEG ou ao PS80 é considerada extremamente rara, embora a prevalência exata permaneça desconhecida33.
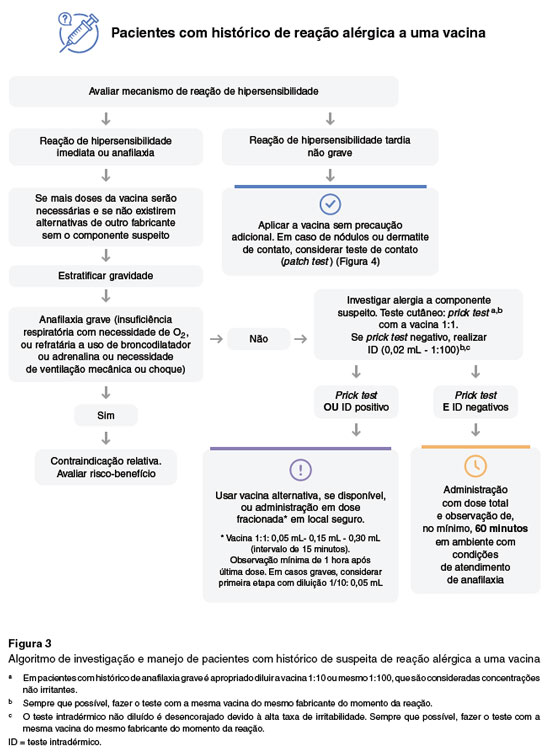
Para pacientes com história sugestiva de alergia ao PEG ou PS80, recomenda-se uma investigação cuidadosa por meio de história clínica e testes cutâneos, conforme detalhado na Figura 3. O algoritmo descrito na Figura 3 também se aplica a pacientes com histórico de suspeita de reação alérgica a uma vacina, o qual é discutido na seção "Algoritmo para investigação de pacientes com histórico de suspeita de reação alérgica a uma vacina".
Resumo das recomendações para a vacinação de pacientes com histórico de hipersensibilidade imediata
A Tabela 3 resume as recomendações para a vacinação de pacientes com histórico de hipersensibilidade imediata.
Reações de hipersensibilidade não imediatas
Reações locais, como calor prolongado, vermelhidão, enduração e inchaço no local da vacina, são as reações imunológicas não imediatas mais comuns após a vacinação. Essas reações podem ocorrer de horas a semanas depois a vacinação, o que dificulta a determinação de causalidade34. Essas reações locais geralmente não evoluem com gravidade e não contraindicam futuras vacinações35.
Reações mais graves, como a síndrome de Stevens-Johnson (SSJ) ou a necrólise epidérmica tóxica (NET) contraindicam doses futuras da vacina associada à reação. Destaca-se, entretanto, que tais reações são extremamente raras36-38. O eritema multiforme maior está associado a infecções virais (como a herpes simplex) e bacterianas (como a infecção por Mycoplasma pneumoniae), e raramente a vacinas39,40.
Outras reações cutâneas raras associadas a vacinas incluem pustulose exantemática aguda generalizada, eritema nodoso, granuloma anular, penfigoide bolhoso, síndrome de Sweet, síndrome de Gianotti-Crosti, erupções liquenoides, lúpus cutâneo, lúpus vulgar e reações semelhantes à doença do soro41. Muitas vezes, há relatos de infecção ativa anterior à vacinação e ao desenvolvimento dessas condições41. A maioria dos casos não apresenta recorrência após doses de reforço da vacina41.
Reações de hipersensibilidade tardia contra excipientes de vacinas (antimicrobianos, preservativos e adjuvantes) também foram descritas e podem se manifestar como uma reação generalizada ou uma reação de contato no local da vacina41. Em geral, essas reações são de menor gravidade e localizadas. Se um excipiente de vacina for uma causa suspeita de hipersensibilidade tardia, podem ser realizados testes de contato com a vacina ou componente da vacina separadamente42, conforme descrito na Figura 4. Não há contraindicação para doses subsequentes da mesma vacina, desde que haja acompanhamento clínico adequado.
Reação de Arthus
A reação de Arthus é uma reação de hipersensibilidade do tipo III, caracterizada pela deposição de imunocomplexos de antígeno, anticorpos IgG e complemento nos vasos sanguíneos locais43. Este tipo de reação geralmente se manifesta com dor, edema e endurecimento no local da aplicação da vacina, podendo, em casos mais graves, evoluir para úlceras ou necrose local43.
A reação de Arthus tende a iniciar entre 2 e 12 horas após a administração da vacina e é mais comum em pacientes que possuem anticorpos IgG preexistentes contra o antígeno presente na vacina44.Vacinas associadas à relatos de reação de Arthus incluem as vacinas contendo componente tetânico, hepatite B, raiva e pneumocócica 23-valente43.
O manejo da reação de Arthus é, em sua maioria, sintomático, incluindo o uso de anti-histamínicos, aplicação de compressas frias no local afetado e analgésicos para aliviar a dor. É importante informar ao paciente que esta é uma reação autolimitada e Síndrome de Guillain-Barré (SGB) com curto tempo de evolução (cerca de uma semana). Complicações neurológicas, como a SGB, são Apesar da reação, não há contraindicação para doses eventos adversos raramente associados à vacinaposteriores da vacina.
Síndrome de Guillain-Barré (SGB)
Complicações neurológicas, como a SGB, são eventos adversos raramente associados à vacinação41. A SGB geralmente se manifesta com fraqueza muscular progressiva, começando nas extremidades e se espalhando para o centro, podendo levar à insuficiência respiratória ou fraqueza dos nervos cranianos45. O início dos sintomas é considerado possivelmente relacionado à vacinação se ocorrer dentro de 6 semanas após a administração de vacinas que contenham componente tetânico, vírus da poliomielite, raiva ou influenza41. A fisiopatologia envolve uma reação imunomediada tardia com participação de linfócitos T CD4+ e CD8+ que cruzam reatividade com antígenos do sistema nervoso45.
Devido ao início tardio dos sintomas, é crucial uma compreensão mais aprofundada dos eventos da SGB para o diagnóstico e avaliação de possível causalidade. Outros fatores, como infecções anteriores por Campylobacter jejuni, citomegalovírus, vírus Epstein-Barr, influenza A, Mycoplasma pneumoniae ou Haemophilus influenzae, também podem desencadear a síndrome41.
Não há contraindicação para vacinar pacientes com histórico de SGB, desde que o episódio anterior não tenha sido relacionado à vacina que se deseja aplicar. Se o paciente desenvolveu a SGB há menos de 3 meses, é prudente adiar a vacinação45. Se houver suspeita de que um caso de SGB foi associado a uma vacinação anterior, as doses subsequentes da mesma vacina estarão contraindicadas. Nesse caso é importante que a análise do caso seja em consenso com a investigação e resposta da notificação do evento supostamente atribuível à vacinação.
Resumo das recomendações para a vacinação de pacientes com histórico de hipersensibilidade não imediata
A Figura 4 resume as recomendações para a vacinação de pacientes com histórico de hipersensibilidade não imediata pós-vacinação.
Pacientes com antecedentes pessoais ou familiares de atopia não possuem contraindicações para imunização, devendo ser vacinados conforme as orientações rotineiras de saúde. Para aqueles com histórico de alergia a algum componente específico da vacina, é recomendada avaliação prévia, realizada preferencialmente por um especialista em Alergia e Imunologia. Em casos de reações locais como dermatite de contato, nódulos, vermelhidão, dor, edema e endurecimento no local da aplicação da vacina, pode-se considerar a realização de um teste de contato (patch test ) para confirmação do agente causal, utilizando a própria vacina ou seus constituintes juntamente com um controle negativo. Tais reações, em geral, não contraindicam futuras doses dessas vacinas, e o paciente pode continuar o calendário de imunização normalmente.
Se houver suspeita de que um episódio de SGB foi associado a uma vacinação anterior, recomendase suspender as doses subsequentes da vacina associada. No entanto, se o episódio ocorreu há mais de 3 meses e não foi relacionado a uma vacinação prévia, a vacinação de rotina pode ser retomada com segurança.
Considerações especiais para pacientes com reações de hipersensibilidade
Vacina dengue (Qdenga®)
Em 2023, o Brasil registrou mais de 1,6 milhões de casos de dengue, sendo que 1.179 indivíduos evoluíram para óbito46. Até 12 de outubro de 2024 (semana epidemiológica 41), foram notificados mais de 6, 5 milhões de casos suspeitos, com 6.613 óbitos por dengue confirmados e 1.499 mortes ainda sob investigação46. Esses números sugerem uma piora substancial do cenário epidemiológico da dengue no Brasil, com um aumento tanto no número de casos quanto na mortalidade associada à doença.
Sem tratamento específico disponível, o manejo da dengue foca na identificação de sinais de alerta e gravidade, o que requer uma estrutura organizada dos sistemas de saúde e a capacitação adequada dos profissionais de atendimento. A prevenção da transmissão é dificultada pela resistência do mosquito transmissor, o Aedes aegypti, aos inseticidas47. Além disso, a urbanização e as condições climáticas, como o aumento de temperatura por período prolongado, contribuem para o aumento da incidência de dengue, mesmo em áreas com taxas de incidência historicamente baixas48.
Embora a vacina tetravalente contra dengue (CYDTDV; Dengvaxia, Sanofi-Pasteur) esteja licenciada no Brasil, ela é recomendada apenas para indivíduos com infecção anterior por dengue confirmada laboratorialmente. A aprovação da vacina Qdenga® (Takeda) pela Anvisa em 2022 ofereceu uma nova opção para a prevenção da doença. Trata-se de uma vacina atenuada que previne a infecção causada pelos quatro sorotipos do vírus: DENV-1, DENV-2, DENV-3 e DENV-4.
Considerando tanto pessoas soronegativas como soropositivas antes da vacinação, a eficácia da Qdenga® até 54 meses após a segunda dose é de cerca de 61% para doença sintomática confirmada virologicamente de qualquer gravidade e 84% para internação49. Durante o programa de desenvolvimento clínico da vacina, os dados de segurança foram avaliados em cerca de 27.000 participantes de estudos de fase 2 e 3 em regiões endêmicas e não endêmicas para dengue45. Uma análise integrada de segurança não identificou riscos significativos. A vacina foi bem tolerada, independentemente da idade, gênero ou status sorológico inicial para dengue, em indivíduos com idades entre 4 e 60 anos50. As reações adversas mais comuns após a primeira dose da vacina foram dor no local da injeção (43% para Qdenga® e 26% para placebo) e dor de cabeça (34% e 30%, respectivamente). Os eventos adversos no local da injeção foram, em sua maioria, leves e resolvidos em 1 a 3 dias50.
A vacina contra dengue foi incorporada ao Programa Nacional de Imunizações em dezembro de 2023 e em março de 2024 iniciou-se a vacinação de adolescentes de 10 a 14 anos em 521 municípios selecionados com base em dados epidemiológicos.
Dados de segurança pós-comercialização coletados entre março de 2023 e março de 2024 registraram 70 reações de hipersensibilidade associadas à Qdenga® no Brasil, com uma incidência geral de 19,15 por 100.000 doses aplicadas51. Destas, 16 foram classificadas como anafilaxia, resultando em uma incidência de anafilaxia de 4,38 por 100.000 doses aplicadas. A maioria dos casos de anafilaxia apresentou manifestações clínicas envolvendo pele e mucosas, com um número significativo de envolvimentos do sistema respiratório, circulatório e gastrointestinal. Nenhum dos casos evoluiu para óbito51.
A farmacovigilância registrou a ocorrência de 85 casos de reações de hipersensibilidade imediata após a vacinação com a Qdenga®, sendo 24 (63,1 casos por milhão) anafilaxias, incluindo três casos de choque anafilático, em 380.358 mil doses aplicadas entre 01/03/2023 e 11/03/202452. Em 10 desses casos (41,7%), as reações começaram dentro de 15 minutos após a vacinação. Não houve óbitos, sequelas ou complicações relacionados à anafilaxia. Essas informações ressaltam a necessidade de uma avaliação cuidadosa dos pacientes alérgicos antes e depois da administração da vacina8-11. Por isso, antes da administração da vacina, é essencial identificar qualquer histórico de alergias graves a componentes da vacina ou a vacinação anterior.
Pacientes que, após a primeira dose, apresentaram sintomas imediatos isolados ou subjetivos, como tosse, náuseas, vômitos, tontura e sensação de sufocamento sem evidência de alteração das vias aéreas (exemplos: edema, rouquidão, eritema ou prurido) e que melhoraram rapidamente sem intervenção médica, devem ser vacinados com a segunda dose e observados por pelo menos 30 minutos. Ainda, é importante considerar outros diagnósticos diferenciais para assegurar que os sintomas não estejam relacionados a outras condições médicas.
Para pacientes que apresentaram urticária e/ou angioedema (local ou generalizado) ou outros sintomas isolados que não são típicos de uma reação anafilática, a recomendação também é proceder com a segunda dose da vacina e observar o paciente por um período mínimo de 30 minutos para monitorar possíveis reações. Além disso, deve-se considerar a avaliação de um alergista para investigar outras causas que possam ter desencadeado a reação inicial. Para pacientes que apresentaram urticária ou reação de Arthus após a primeira dose da vacina, pode-se considerar o uso de anti-histamínicos 30 minutos antes da vacinação com a segunda dose. O tempo de uso do anti-histamínico pode variar conforme a gravidade e a recorrência das reações alérgicas. Cabe ressaltar que o uso de anti-histamínicos antes da aplicação de vacinas em pacientes que tiveram reações prévias não reduz o risco de novos eventos ou sua intensidade, incluindo anafilaxia.
No caso de uma anafilaxia em que dois ou mais sistemas são acometidos (como pele, sistema respiratório, sistema gastrointestinal, entre outros), os pacientes devem, preferencialmente, ser avaliados por um alergista. Essa avaliação deve considerar o risco epidemiológico, e em alguns casos, pode ser necessário realizar um teste de puntura (prick test ) ou teste intradérmico para identificar o componente que causou a reação alérgica. Em situações nas quais a administração da segunda dose da vacina é considerada necessária, recomenda-se seguir o algoritmo de investigação descrito na Figura 3.
Destaca-se ainda a importância da preparação e da capacidade de resposta para minimizar os riscos e tratar eficazmente qualquer reação alérgica após a vacinação contra a dengue ou outras vacinas em pacientes alérgicos dentro ou fora de ambientes de saúde (vacinação extramuros)53.
Vacina COVID-19
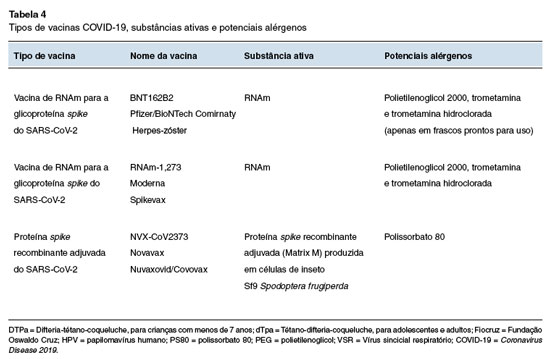
Os potenciais alérgenos contidos nas vacinas contra a COVID-19 atualmente disponíveis no Brasil estão listados na Tabela 4.
Ambas as vacinas de RNAm (Comirnaty e Spikevax) têm uma estrutura semelhante: não contêm proteína ou adjuvante, apenas o RNAm envolvido em estabilizadores dentro de uma nanopartícula lipídica coberta com PEG para aumentar a solubilidade em água. Embora o PEG tenha sido o primeiro suspeito em casos de reações alérgicas às vacinas de RNAm54, estudos posteriores sugeriram que a presença de PEG na formulação não afeta a eficácia ou a segurança de vacinas COVID-19 baseadas em nanopartículas lipídicas55.
Além do PEG, a vacina de RNAm-1273 da Moderna (Spikevax) também contém trometamina (ou trometamol), um agente tampão amplamente utilizado. Foram publicados alguns casos de anafilaxia a medicamentos injetáveis associados à presença de trometamina56,57. Na segunda versão da vacina Comirnaty® (Pfizer -frascos prontos para uso), a trometamina também foi adicionada à composição da vacina. Embora os relatos iniciais tenham destacado um alto risco de anafilaxia com as vacinas COVID-19, dados de farmacovigilância mais recentes mostram que a incidência de anafilaxia para as vacinas de RNAm (8,96 casos por milhão de doses administradas) é comparável às taxas observadas com outras vacinas (entre 1 e 10 casos por milhão de doses aplicadas)58,59. A incidência de choque anafilático foi de 1,46 por milhão de doses e as reações fatais foram extremamente raras, com taxas de 0,04 por milhão de doses para reações anafiláticas e 0,02 por milhão de doses para choques anafiláticos59. Estes dados reforçam a segurança desses imunizantes.
Alguns estudos descrevem casos de reações locais tardias após a administração das vacinas de RNAm contra COVID-19. Estas reações, caracterizadas por eritema, enduração e sensibilidade no local da injeção, geralmente surgem cerca de 6 a 8 dias após a vacinação e podem durar até duas semanas60-63. Embora essas reações possam ser desconfortáveis, não são consideradas contraindicações para doses subsequentes das vacinas. Na maioria dos casos documentados, os pacientes que experimentaram reações após a primeira dose receberam a segunda dose sem recorrência ou com reações de menor intensidade60-63. No estudo de fase 3 da vacina RNAm1273 (Moderna), reações locais tardias ocorreram em 0,8% dos pacientes após a administração da primeira dose, e em 0,2% após a segunda dose64.
Em caso de pacientes com histórico de suspeita de reação alérgica a vacina COVID-19, recomendase seguir o algoritmo de investigação descrito na Figura 3.
Imunização do paciente com asma
A asma é uma doença crônica que afeta cerca de 300 milhões de pessoas ao redor do mundo65. No Brasil, estima-se que 23,2% da população viva com asma66, sendo essa uma das principais causas de hospitalização entre crianças e adolescentes e um motivo frequente de visitas aos serviços de urgência67.
Vacina Influenza
Em pacientes asmáticos, acredita-se que a inflamação crônica das vias aéreas e as respostas imunes do tipo 2 prejudiquem a imunidade antiviral no trato respiratório68, resultando em maior susceptibilidade a doenças graves causadas pela influenza e infecções bacterianas associadas. Os mecanismos que aumentam a susceptibilidade à influenza em pacientes com asma incluem respostas imunológicas inatas mais fracas, respostas reduzidas de células T auxiliares do tipo 1, e uma resposta deficiente de interferon α das células dendríticas plasmocitoides à influenza69. Além disso, infecções por influenza podem levar à exacerbação da asma, muitas vezes exigindo hospitalização70. Durante a pandemia de influenza em 2009, pacientes com asma apresentaram um risco significativamente maior de hospitalização, com a maioria dos pacientes procurando atendimento devido à exacerbação dos sintomas respiratórios, e não somente pela infecção por influenza em si71.
Além de segura, a vacina influenza é eficaz em pacientes com asma. Um estudo de caso-controle realizado na Escócia avaliou a eficácia da vacina contra a influenza em pessoas com asma ao longo de seis temporadas (2010/2011 a 2015/2016) utilizando 5.910 amostras virológicas. A vacinação foi associada a uma redução de 55% nas infecções confirmadas laboratorialmente ao longo das seis temporadas72.
Recomenda-se que os pacientes com asma sigam o calendário regular de vacinação no Brasil, recebendo doses anuais da vacina influenza trivalente ou tetravalente a partir dos 6 meses de idade.
Em 2023, a vacina influenza tetravalente com alta concentração de antígenos (high dose) também foi disponibilizada no Brasil para indivíduos com 60 anos ou mais. O imunizante, fabricado pela Sanofi Pasteur com o nome comercial Efluelda®, contém quatro vezes mais antígenos em comparação às vacinas influenza quadrivalentes de dose padrão. A vacina Efluelda® demonstrou 24,2% de eficácia incremental quando comparada à vacina de dose padrão. Uma metanálise que avaliou dados colhidos ao longo de 10 temporadas de gripe demonstrou que a vacina de alta dose oferece benefícios de proteção além da gripe, como redução de 27% na hospitalização por pneumonia e de 18% nas internações por eventos cardiorrespiratórios73-75. A vacina pode ser encontrada nos serviços privados de vacinação e permite maior proteção para a população a partir de 60 anos de idade, cuja resposta vacinal é pior devido à imunossenescência e presença frequente de comorbidades.
Estratégias para aumentar a adesão à vacinação contra gripe em pacientes com asma são essenciais, pois podem reduzir significativamente o risco de exacerbações provocadas pela influenza.
Vacinação contra o vírus sincicial respiratório (VSR)
O VSR é a principal causa de bronquiolite e pneumonia em crianças menores de 5 anos76. Anualmente, o VSR é responsável por cerca de 33 milhões de infecções, mais de 3 milhões de hospitalizações e mais de 100.000 mortes em crianças de 0 a 5 anos em todo o mundo, com maior impacto nas regiões desfavorecidas economicamente76. Além das crianças, as hospitalizações associadas ao VSR também são elevadas em adultos com idade mais avançada, especialmente aqueles com mais de 65 anos e em portadores de doenças crônicas77,78, destacando a necessidade de incluir essas populações nas estratégias de vacinação contra o VSR.
A associação entre doença grave por VSR em lactentes e o desenvolvimento de asma é bem estabelecida79,80. Embora um vínculo causal entre a infecção por VSR e a asma ainda não tenha sido comprovado, evidências imunológicas sugerem uma tendência para uma resposta do tipo Th2 e uma redução da imunidade antiviral de interferon-γ durante a infecção por VSR, o que sustenta a hiper-reatividade das vias aéreas em um subconjunto de crianças suscetíveis79. A bronquiolite por VSR também tem sido associada a uma asma mais grave, evidenciada por uma taxa três vezes maior de internações por asma e uso de medicação em comparação com controles da mesma idade sem internação prévia por infecção do trato respiratório inferior por VSR81.
Em um estudo que incluiu aproximadamente 25.000 adultos com 60 anos ou mais, a vacina contra o VSR com adjuvante (RSVPreF3 OA, Arexvy, GlaxoSmith Kline) foi bem tolerada e reduziu o risco de doenças do trato respiratório inferior relacionadas ao VSR em 82,6% e de doenças respiratórias agudas relacionadas ao VSR (incluindo doenças leves) em 72%82. Quando a avaliação focou em participantes com uma ou mais doenças crônicas, como asma, doença pulmonar crônica, insuficiência cardíaca crônica e diabetes, a eficácia da vacina foi ainda maior83. Para aqueles com pelo menos uma doença crônica, a vacina reduziu o risco de doenças respiratórias do trato inferior relacionadas ao VSR em 95% e de doenças respiratórias agudas relacionadas ao VSR em 81%83. Em participantes com duas ou mais doenças crônicas, a redução de risco para doenças do trato respiratório inferior foi de 92%, e para doenças respiratórias agudas, 88%83 Esses resultados indicam que a vacina pode ser uma ferramenta importante para prevenir doenças graves relacionadas ao VSR em adultos acima de 60 anos com condições crônicas, incluindo asma.
No Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa) autorizou recentemente o registro de duas vacinas contra o VSR:
- a vacina Arexvy (com adjuvante), da empresa GlaxoSmith Kline foi a primeira vacina registrada contra o VSR (2023). Aprovada para uso em adultos com 60 anos de idade ou mais, e adultos entre 50 e 59 anos de idade com risco aumentado para infecção para o VSR, a vacina é aplicada por via intramuscular, em dose única, a qualquer momento, independente de sazonalidade do vírus. Dados atuais demonstram proteção sustentada por três sazonalidades de circulação do vírus (quase três anos)84. Desta forma, no momento, não há recomendação de doses de reforço;
- a vacina Abrysvo, da farmacêutica Pfizer, foi licenciada pela Anvisa para uso em gestantes entre 24 e 36 semanas de idade gestacional para proteção do recém-nascido. A administração é intramuscular e em dose única. A vacina tem dados de proteção até a segunda temporada. A vacina também foi autorizada para aplicação em pessoas com 60 anos ou mais, e pessoas de 18 a 59 anos de idade com risco aumentado para infecção pelo VSR, com dados de segurança e eficácia semelhantes à vacina Arexvy.
O uso dessas vacinas em pacientes com asma acima de 60 anos é recomendado pela SBIm e pela ASBAI.
Além das vacinas, o palivizumabe e o nirsevimabe são anticorpos monoclonais indicados para a prevenção de infecções pelo VSR em lactentes, especialmente para aqueles em grupos de alto risco. O palivizumabe é um anticorpo monoclonal humanizado que se liga à proteína de fusão do VSR, inibindo a entrada do vírus nas células hospedeiras85. Estudos clínicos demonstraram que o palivizumabe reduz significativamente as hospitalizações relacionadas ao VSR em lactentes prematuros extremos (menores de 28 semanas) e aqueles com displasia broncopulmonar ou cardiopatia congênita hemodinamicamente significativa85,86. A profilaxia com palivizumabe é administrada mensalmente durante a temporada de VSR, até o máximo de cinco doses.
O nirsevimabe é um anticorpo monoclonal de longa duração que também se liga à proteína de fusão do VSR, mas com uma meia-vida estendida, permitindo uma única dose para cobrir toda a temporada de circulação do vírus87. Estudos clínicos mostraram que o nirsevimabe é eficaz na redução de infecções graves e hospitalizações por VSR em lactentes saudáveis, prematuros e aqueles com comorbidades87-89. A eficácia do nirsevimabe foi comparável ou superior à do palivizumabe, com a vantagem adicional de ser aplicado em um regime de dose única88.
Em resumo, palivizumabe e nirsevimabe são eficazes na prevenção de infecções por VSR em lactentes, com nirsevimabe oferecendo a vantagem de uma única dose por temporada.
Vacinação contra doença pneumocóccica invasiva (DPI)
Doença pneumocócica é o nome dado a qualquer infecção causada pelo Streptococcus pneumoniae, ou pneumococo90. Este é o principal agente etiológico bacteriano de uma gama de infecções, incluindo infecções não invasivas, como sinusite, otite média e pneumonia adquirida na comunidade, e infecções invasivas, quando o pneumococo invade sítios previamente estéreis, como a corrente sanguínea (bacteremia) e os tecidos e fluidos que rodeiam o cérebro e medula espinhal (meningite)90,91. Estas condições são graves, muitas vezes requerem hospitalização e podem levar à morte90.
Já foram isolados cerca de 100 sorotipos de pneumococos tendo como base as diferenças antigênicas de suas cápsulas polissacarídicas. A cápsula é o principal fator de virulência desta bactéria e é responsável por induzir no hospedeiro a imunidade sorotipo específica92. Consequentemente, esses antígenos capsulares são a base das formulações vacinais atualmente utilizadas para prevenir a doença pneumocócica.
A asma tem sido associada a um risco aumentado de pneumonia e DPI, especialmente entre crianças93,94. Além disso, a asma pode afetar negativamente o desfecho da pneumonia e aumentar a taxa de mortalidade associada95. Por essa razão, agências de saúde, incluindo os Centros de Controle e Prevenção de Doenças dos Estados Unidos96, consideram a asma uma indicação para a vacinação pneumocócica. A iniciativa GINA argumenta que ainda há dados limitados que demonstrem inequivocamente a eficácia da vacina pneumocócica na população com asma para recomendar seu uso universal, embora reconheça que esses pacientes, especialmente crianças e idosos, estejam em maior risco de contrair infecções pneumocócicas65.
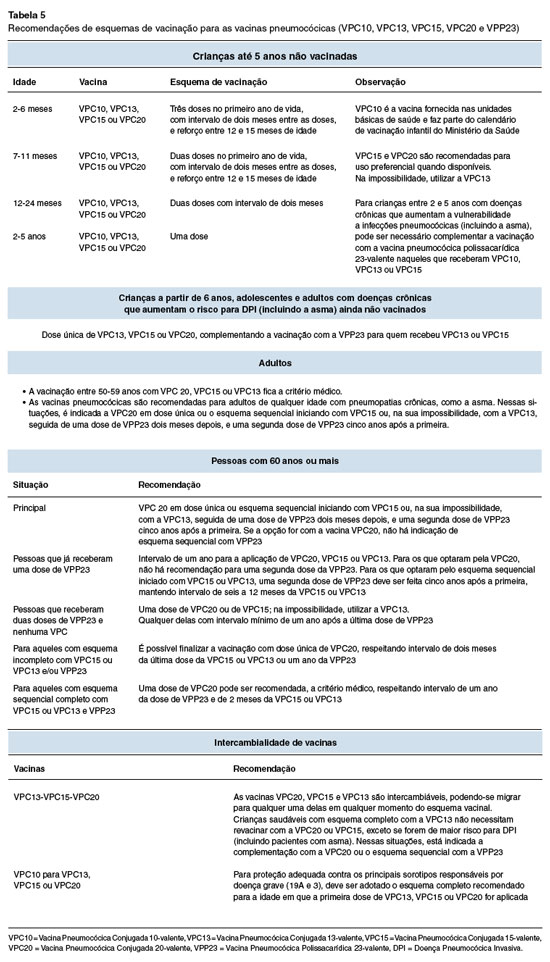
A vacinação pneumocócica faz parte do programa de imunização infantil em cerca de metade dos estados membros da Organização Mundial da Saúde, incluindo o Brasil. A vacinação reduz as hospitalizações por pneumonia em crianças e adultos e diminui o risco de doença invasiva97,98. Estão disponíveis dois tipos de vacinas: a vacina pneumocócica polissacarídica (VPP) e as vacinas pneumocócicas conjugadas (VPC). A vacina VPP proporciona imunidade específica para os sorotipos incluídos na formulação, conforme detalhado na Figura 5. Ela induz uma resposta imunológica de curto prazo ao estimular um subconjunto de células B que produzem anticorpos da subclasse IgG2. As vacinas conjugadas (VPC), que combinam um polissacarídeo com uma proteína, estimulam uma resposta imunológica específica do sorotipo dependente de células T e ativam células B de memória. A vacina VPP 23-valente está disponível no Brasil desde 1989, e a VPC 7-valente (VPC7) foi licenciada em 2000, sendo a primeira vacina conjugada disponível no mundo. Foi substituída por vacinas conjugadas contendo maior número de sorotipos, sendo hoje disponíveis no Brasil as vacinas 10-valente (VPC10), 13-valente (VPC13), 15-valente (VPC15) e 20-valente (VPC20).
A imunização rotineira contra o Streptococcus pneumoniae é segura em pacientes com asma e pode ajudar a mitigar a diminuição gradual da função respiratória causada por exacerbações infecciosas repetidas99. As recomendações de esquemas de vacinação para as vacinas pneumocócicas disponíveis atualmente no Brasil (VPC10, VPC13, VPC15, VPC20 e VPP23), incluindo a vacinação de pacientes com asma, estão descritas na Tabela 5. Em resumo, recomenda-se que o paciente com asma receba as vacinas VPC13, VPC15 ou VPC20. Para aqueles que receberam VPC7 ou VPC10 anteriormente, é importante ampliar a proteção com vacinas que contenham o sorotipo 19A. A vacina VPP23 é recomendada a partir dos 2 anos de idade para aqueles que receberam VPC13 ou VPC15. Para os vacinados com VPC20 não se recomenda a aplicação de VPP23. O número de doses dependerá da idade e situação imune do paciente.
Destaca-se que o teste sorológico não é recomendado antes ou depois de receber a vacina pneumocócica.
Vacinação contra a COVID-19
Pessoas com asma leve a moderada que contraem COVID-19 não apresentam maior risco de desenvolver formas graves65,100. No entanto, aqueles com asma não controlada têm um risco maior de hospitalização devido a doença grave se contraírem COVID-19101-103.
No Brasil, o Programa Nacional de Imunizações acrescentou a vacinação contra a COVID-19 no calendário de rotina para crianças entre 6 meses de vida e menores de 5 anos, incluindo aqueles com asma. Nesta população, são aplicadas duas ou três doses da vacina mais atualizada com um intervalo de 4 semanas entre a primeira e a segunda doses, e oito semanas entre a segunda e terceira doses (esquema primário)104.
Em 2024, foi adotada a aplicação de doses de reforço para pessoas com mais de 60 anos e grupos prioritários. Pacientes acima de 5 anos com asma grave (definidos como aqueles que fazem uso recorrente de corticosteroides sistêmicos e/ ou tiveram internação por crise asmática no último ano) são considerados grupo prioritário para a vacinação contra a COVID-19 e devem receber doses de reforço anuais. Imunocomprometidos e pessoas com 60 anos ou mais, nas condições mencionadas, devem receber doses de reforços semestrais com a versão da vacina mais atualizada disponível. De acordo com a Estratégia de Vacinação brasileira contra a COVID-19 de 2024, os esquemas primários de vacinação não são mais recomendados rotineiramente para pessoas com 5 anos de idade ou mais que não fazem parte dos grupos prioritários. Para aqueles que nunca se vacinaram, uma dose da vacina COVID-19 poderá ser realizada104.
Resumo das recomendações para a vacinação de pacientes com asma
A Tabela 6 resume as recomendações para a vacinação de pacientes com asma.
Algoritmo para investigação de pacientes com histórico de suspeita de reação alérgica a uma vacina
Pacientes com histórico de hipersensibilidade a vacinas devem ser investigados sempre que possível. A investigação começa pela coleta da história clínica detalhada, incluindo a manifestação clínica, a extensão da reação (local ou sistêmica), o tempo de início e duração (imediata ou tardia) e o tratamento necessário. Para a análise etiológica, é essencial registrar o fabricante e o lote da vacina administrada, além de revisar a bula para identificar possíveis componentes alergênicos, incluindo alumínio, formaldeído, timerosal, 2-fenoxietanol, lactose, gelatina, antibióticos, látex, ovoalbumina e fungos.
Se a história clínica sugerir uma reação de hipersensibilidade à vacina, procede-se com a investigação diagnóstica baseada no mecanismo de hipersensibilidade envolvido, conforme o algoritmo ilustrado na Figura 3. Nas reações de hipersensibilidade imediata ou anafilaxia, deve-se considerar o uso de testes cutâneos (como o prick test e o teste intradérmico de leitura imediata) com a vacina e seus constituintes. Se ambos os testes forem negativos, a vacinação pode ser realizada sob supervisão, com observação de no mínimo 60 minutos em local equipado para tratar reações anafiláticas.
Nos casos em que os testes cutâneos indicarem sensibilização, o especialista pode optar por utilizar uma vacina alternativa que não contenha o componente suspeito. Se isso não for possível, a vacina pode ser administrada de forma fracionada ou em esquema de dessensibilização, em ambiente seguro e preparado para manejar possíveis reações adversas105,106.
Reações locais não alérgicas, como vermelhidão, dor e edema, bem como febre, não contraindicam doses subsequentes da vacina12. Em todos os casos, é fundamental que a imunização não seja retardada para evitar um aumento da suscetibilidade a doenças infecciosas, especialmente considerando o cenário atual de queda nas taxas de cobertura vacinal no Brasil.
Embora reações graves de hipersensibilidade a vacinas sejam raras é essencial que os ambientes de vacinação estejam preparados para atender esses casos. Eles devem ser adequadamente equipados (dispor de adrenalina, anti-histamínicos, corticoides, beta 2-agonistas e fonte de oxigênio), ter uma equipe treinada e devem seguir protocolos claros de emergência para garantir uma resposta rápida e eficaz em caso de anafilaxia. Ressalta-se que histórico de reação de hipersensibilidade à vacina não contraindica todas as demais, já que a reação é decorrente de um componente específico da vacina e não de todas as vacinas. O médico alergista pode contribuir nessa avaliação e permitir que a vacinação subsequente possa ser realizada com mais segurança.
Notificação de eventos adversos pós-vacinação
Eventos supostamente atribuídos à vacinação ou imunização devem ser notificados e investigados conforme a 4ª edição do Manual de Vigilância Epidemiológica de Eventos Adversos PósVacinação107. A notificação adequada e oportuna desses eventos é essencial para garantir a segurança das vacinas, possibilitar respostas rápidas para minimizar riscos, e ajustar estratégias de vacinação quando necessário. A notificação pode ser realizada pela instituição que aplicou a vacina ou pelo médico assistente.
Conclusão
A identificação precoce de reações alérgicas, aliada a uma estratificação de risco adequada baseada na história clínica e em testes diagnósticos, é essencial para orientar a escolha da vacina e o manejo apropriado da imunização em pacientes com histórico de reações de hipersensibilidade a vacinas. Além disso, estratégias como a administração de vacinas em doses fracionadas e em ambientes controlados são eficazes na redução do risco de reações de hipersensibilidade, permitindo a vacinação segura destes pacientes.
O manejo adequado dos pacientes que apresentam reações de hipersensibilidade requer, sempre que possível, uma colaboração entre os especialistas em alergia e imunologia e outros profissionais de saúde. A vigilância contínua dos eventos supostamente atribuíveis a vacinação ou imunização (ESAVI), juntamente com uma comunicação transparente com os pacientes sobre os riscos e benefícios, é fundamental para fortalecer a confiança na vacinação. Além disso, promover a imunização em pacientes alérgicos, especialmente aqueles com asma, protege esses indivíduos contra infecções preveníveis, melhora o controle da doença de base e reduz o risco de exacerbações.
Agradecimentos
Os autores agradecem à Morgana Moretti pela assistência na redação deste manuscrito.
Referências
1. Shattock AJ, Johnson HC, Sim SY, Carter A, Lambach P, Hutubessy RCW, et al. Contribution of vaccination to improved survival and health: modelling 50 years of the Expanded Programme on Immunization. Lancet. 2024 May 25;403(10441):2307-16. doi: 10.1016/S0140-6736(24)00850-X.
2. Lötvall J, Pawankar R, Wallace DV, Akdis CA, Rosenwasser LJ, Weber RW, et al. ; American Academy of Allergy, Asthma & Immunology (AAAAI); American College of Allergy, Asthma & Immunology (ACAAI); European Academy of Allergy and Clinical Immunology (EAACI); World Allergy Organization (WAO). We call for iCAALL: International Collaboration for Asthma, Allergy and Immunology. Ann Allergy Asthma Immunol.2012 Apr;108(4):215-6.doi:10.1016/j. anai.2012.02.025.
3. Johansson SG, Bieber T, Dahl R, Friedmann PS, Lanier BQ, Lockey RF, et al.Revised nomenclature for allergy for global use:Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003.J Allergy Clin Immunol. 2004 May;113(5):832-6.doi: 10.1016/j.jaci.2003.12.591.
4. Mahler V, Junker AC. Anaphylaxis to additives in vaccines. Allergo J Int. 2022;31(5):123-36. doi:10.1007/s40629-022-00215-8.
5. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International Consensus on drug allergy. Allergy. 2014 Apr;69(4):420-37. doi: 10.1111/all.12350.
6. Clarkson TW, Magos L, Myers GJ. The toxicology of mercury-current exposures and clinical manifestations. N Engl J Med. 2003;349(18):1731-7. doi:10.1056/NEJMra022471.
7. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, et al. World allergy organization anaphylaxis guidance 2020.World Allergy Organ J.2020 Oct 30;13(10):100472. doi: 10.1016/j.waojou.2020.100472.
8. Bohlke K, Davis RL, Marcy SM, Braun MM, DeStefano F, Black SB, et al. ; Vaccine Safety Datalink Team. Risk of anaphylaxis after vaccination of children and adolescents. Pediatrics. 2003 Oct;112(4):815-20. doi: 10.1542/peds.112.4.815.
9. McNeil MM, Weintraub ES, Duffy J, Sukumaran L, Jacobsen SJ, Klein NP, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol. 2016 Mar;137(3):868-78. doi: 10.1016/j.jaci.2015.07.048.
10. Su JR, Moro PL, Ng CS, Lewis PW, Said MA, Cano MV.Anaphylaxis after vaccination reported to the Vaccine Adverse Event Reporting System, 1990-2016. J Allergy Clin Immunol. 2019;143(4):1465-73. doi:10.1016/j.jaci.2018.12.1003.
11. Choe YJ, Lee H, Kim JH, Choi WS, Shin JY. Anaphylaxis following vaccination among children in Asia: A large-linked database study. Allergy. 2021;76(4):1246-9. doi:10.1111/all.14562.
12. Kelso JM, Greenhawt MJ, Li JT, Nicklas RA, Bernstein DI, Blessing-Moore J, et al. Adverse reactions to vaccines practice parameter 2012 update. J Allergy Clin Immunol. 2012 Jul;130(1):25-43. doi: 10.1016/j.jaci.2012.04.003.
13. Taylor S, Asmundson GJG.Immunization stress-related responses: implications for vaccination hesitancy and vaccination processes during the COVID-19 pandemic.J Anxiety Disord.2021;84:102489. doi:10.1016/j.janxdis.2021.102489.
14. Gold MS, MacDonald NE, McMurtry CM, Balakrishnan MR, HeiningerU,Menning L,et al.Immunizationstress-relatedresponse-Redefining immunization anxiety-related reaction as an adverse event following immunization. Vaccine. 2020 Mar 23;38(14):30153020. doi: 10.1016/j.vaccine.2020.02.046.
15. Pérez Rubio A, Eiros JM. Cell culture-derived flu vaccine: Present and future. Human Vaccines & Immunotherapeutics. 2018;14(8): 1874-82. doi: 10.1080/21645515.2018.1460297.
16. McNeil MM, DeStefano F. Vaccine-associated hypersensitivity. J Allergy Clin Immunol. 2018;141(2):463-72. doi:10.1016/j. jaci.2017.12.971.
17. Dreskin SC, Halsey NA, Kelso JM, Wood RA, Hummell DS, Edwards KM, et al. International Consensus (ICON): allergic reactions to vaccines.World Allergy Organ J.2016 Sep 16;9(1):32.doi:10.1186/s40413-016-0120-5.
18. James JM, Burks AW, Roberson PK, Sampson HA. Safe administration of the measles vaccine to children allergic to eggs. N Engl J Med. 1995;332(19):1262-6. doi:10.1056/NEJM199505113321904.
19. Baxter DN. Measles immunization in children with a history of egg allergy. Vaccine. 1996;14(2):131-4. doi:10.1016/0264410x(95)00154-s.
20. Kelso JM. Influenza vaccine and egg allergy: nearing the end of an evidence-based journey. J Allergy Clin Immunol Pract. 2015;3(1):140-1. doi:10.1016/j.jaip.2014.08.011.
21. Kelso JM. Administering influenza vaccine to egg-allergic persons. Expert Rev Vaccines.2014;13(8):1049-57.doi:10.1586/14760584. 2014.933079.
22. Takey PRG.Imunogenicidade e segurança da vacina contra a febre amarela:revisão sistemática e metanálise [tese].Rio de Janeiro, RJ: Fundação Oswaldo Cruz, Instituto Nacional de Infectologia Evandro Chagas (INI) -Programa de Pós-graduação em Pesquisa Clínica em DoençasInfecciosas;2020.Disponível em:https://sucupiralegado.capes.gov.br/sucupira/public/consultas/coleta/trabalho Conclusao/viewTrabalhoConclusao.jsf?popup=true&id_trabalho=10263752 .
23. Gerhardt CMB, Feitosa GSJ, Aquilante BP, Dorna MB, Santos CJN, Pastorino AC, et al. Segurança da vacina de febre amarela em pacientes comprovadamente alérgicos à proteína do ovo. Arq Asma Alerg Imunol. 2019;3(2):143-50. doi: 10.5935/25265393.20190025.
24. Gerhardt CMB, Castro APBM, Pastorino AC, Dorna MB, Nunes-Santos CJ, Aquilante BP, et al. Safety of yellow fever vaccine administration in confirmed egg-allergic patients. Vaccine. 2020 Sep 29;38(42):6539-44. doi: 10.1016/j.vaccine.2020.08.020.
25. Cancado B, Aranda C, Mallozi M, Weckx L, Sole D. Yellow fever vaccine and egg allergy. Lancet Infect Dis. 2019;19(8):812. doi:10.1016/S1473-3099(19)30355-X.
26. Guimarães BNA, Petraglia TCMB, Marinho AKBB, Barbosa ADM. Eventos adversos imediatos à vacina febre amarela em crianças alérgicas ao ovo. Arq Asma Alerg Imunol. 2022;6(4):519-26. doi: 10.5935/2526-5393.20220060.
27. Kattan JD, Konstantinou GN, Cox AL, Nowak-Wegrzyn A, Gimenez G, SampsonHA,etal.Anaphylaxis todiphtheria, tetanus,andpertussis vaccines among children with cow's milk allergy. J Allergy Clin Immunol. 2011 Jul;128(1):215-8. doi: 10.1016/j.jaci.2011.04.046.
28. SBIm, ASBAI, SBP. Nota técnica conjunta SBIm/ASBAI/SBP - 08/02/2017.Vacina rotavírus [Internet].Disponível em:https://sbim.org.br/images/files/nota-sbim-asbai-sbp-rotavirus08022017-v2.pdf. Acessado em: 01/11/2024.
29. Kumagai T, Yamanaka T, Wataya Y, Umetsu A, Kawamura N, Ikeda K, et al. Gelatin-specific humoral and cellular immune responses in children with immediate- and nonimmediate-type reactions to live measles, mumps, rubella, and varicella vaccines. J Allergy Clin Immunol.1997 Jul;100(1):130-4.doi:10.1016/s00916749(97)70204-5.
30. Pool V, Braun MM, Kelso JM, Mootrey G, Chen RT, Yunginger JW, et al. ;VAERS Team.US Vaccine Adverse Event Reporting System. Prevalence of anti-gelatin IgE antibodies in people with anaphylaxis after measles-mumps rubella vaccine in the United States.Pediatrics. 2002 Dec;110(6):e71. doi: 10.1542/peds.110.6.e71.
31. Russell M, Pool V, Kelso JM, Tomazic-Jezic VJ.Vaccination of persons allergic to latex: a review of safety data in the Vaccine Adverse Event Reporting System (VAERS). Vaccine. 2004;23(5):664-7. doi:10.1016/j.vaccine.2004.06.042.
32. Nicaise-Roland P, Granger V, Soria A, Barbaud A, Pallardy M, Chollet-Martin S, et al. Immediate hypersensitivity to COVID-19 vaccines: Focus on biological diagnosis. Front Allergy. 2022 Sep 30;3:1007602. doi: 10.3389/falgy.2022.1007602.
33. Wenande E, Garvey LH. Immediate-type hypersensitivity to polyethylene glycols:a review.Clin Exp Allergy.2016 Jul;46(7):907-22. doi: 10.1111/cea.12760.
34. Loughlin AM, Marchant CD, Adams W, Barnett E, Baxter R, Black S, et al. Causality assessment of adverse events reported to the Vaccine Adverse Event Reporting System (VAERS).Vaccine.2012 Nov 26;30(50):7253-9. doi: 10.1016/j.vaccine.2012.09.074.
35. National Center for Immunization and Respiratory Diseases.General recommendations on immunization - Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR. 2011;60(2):1-64.
36. Ma L, Du X, Dong Y, Peng L, Han X, Lyu J, et al. First case of Stevens-Johnson syndrome after rabies vaccination. Br J Clin Pharmacol. 2018 Apr;84(4):803-5. doi: 10.1111/bcp.13512.
37. Christou EM, Wargon O. Stevens-Johnson syndrome after varicella vaccination. Med J Aust. 2012;196(4):240-1. doi:10.5694/ mja11.11484.
38. Chahal D, Aleshin M, Turegano M, Chiu M, Worswick S. Vaccine-induced toxic epidermal necrolysis: a case and systematic review. Dermatol Online J. 2018;24(1). doi:10.5070/D3241037941.
39. Keller N, Gilad O, Marom D, Marcus N, Garty BZ. Nonbullous Erythema Multiforme in Hospitalized Children: A 10-Year Survey. Pediatr Dermatol. 2015;32(5):701-3. doi:10.1111/pde.12659.
40. Canavan TN, Mathes EF, Frieden I, Shinkai K. Mycoplasma pneumoniae-induced rash and mucositis as a syndrome distinct from Stevens-Johnson syndrome and erythema multiforme:a systematic review. J Am Acad Dermatol. 2015;72(2):239-45. doi:10.1016/j. jaad.2014.06.026.
41. Stone Jr CA, Rukasin CRF, Beachkofsky TM, Phillips EJ. Immune-mediated adverse reactions to vaccines. Br J Clin Pharmacol. 2019;85(12):2694-706. doi:10.1111/bcp.14112.
42. Phillips EJ, Bigliardi P, Bircher AJ, Broyles A, Chang YS, Chung WH, et al. Controversies in drug allergy: Testing for delayed reactions. J Allergy Clin Immunol. 2019 Jan;143(1):66-73. doi: 10.1016/j. jaci.2018.10.030.
43. Peng B, Wei M, Zhu FC, Li JX. The vaccines-associated Arthus reaction. Hum Vaccines Immunother. 2019;15(11):2769-77. doi:1 0.1080/21645515.2019.1602435.
44. Pool V, Mege L, Abou-Ali A. Arthus Reaction as an Adverse Event Following Tdap Vaccination.Vaccines.2020;8(3):385. doi:10.3390/ vaccines8030385.
45. Willison HJ, Jacobs BC, Doorn PA van. Guillain-Barré syndrome. The Lancet. 2016;388(10045):717-27. doi:10.1016/S01406736(16)00339-1.
46. Brasil, Ministério da Saúde. Painel de Monitoramento das Arboviroses [Internet]. Disponível em: https://www.gov.br/saude/ pt-br/assuntos/saude-de-a-a-z/a/aedes-aegypti/monitoramentodas-arboviroses/painel . Acessado em: 28/08/2024.
47. Yang F, Schildhauer S, Billeter SA, Hardstone Yoshimizu M, Payne R, Pakingan MJ, et al. Insecticide Resistance Status of Aedes aegypti (Diptera: Culicidae) in California by Biochemical Assays. J Med Entomol. 2020 Jul 4;57(4):1176-83. doi: 10.1093/jme/tjaa031.
48. Barcellos C, Matos V, Lana RM, Lowe R. Climate change, thermal anomalies, and the recent progression of dengue in Brazil.Sci Rep. 2024;14(1):5948. doi:10.1038/s41598-024-56044-y
49. Tricou V, Yu D, Reynales H, Biswal S, Saez-Llorens X, Sirivichayakul C, et al. Long-term efficacy and safety of a tetravalent dengue vaccine (TAK-003): 4·5-year results from a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Glob Health. 2024 Feb;12(2):e257-e270. doi: 10.1016/S2214-109X(23)00522-3.
50. Patel SS, Rauscher M, Kudela M, Pang H.Clinical safety experience of TAK-003 for dengue fever:a new tetravalent live attenuated vaccine candidate. Clin Infect Dis. 2023;76(3):e1350-e1359. doi:10.1093/ cid/ciac418.
51. Anvisa - Agência Nacional de Vigilância Sanitária. Segurança da vacina Qdenga [Internet].Disponível em:https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/seguranca-da-vacina-qdenga . Acessado em: 29/08/2024.
52. Percio J, Kobayashi CD, Silva RMA, Marinho AKBB, Capovilla L, Andrade PHS, et al. Safety signal detected: Anaphylaxis after attenuated dengue vaccine (TAK-003) -Brazil, march 1, 2023march 11, 2024.Vaccine.2024 Dec 2;42(26):126407.doi:10.1016/j. vaccine.2024.126407.
53. Brasil, Ministério da Saúde.Nota Técnica N° 7/2024-CGFAM/DPNI/ SVSA/MS [Internet]. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/notas-tecnicas/2024/nota-tecnica-no-7-2024-cgfam-dpni-svsa-ms/view .Acessado em: 29/08/2024.
54. Krantz MS, Liu Y, Phillips EJ, Stone CA. COVID-19 vaccine anaphylaxis: PEG or not? Allergy. 2021;76(6):1934-7. doi:10.1111/ all.14722.
55. Guerrini G, Gioria S, Sauer AV, Lucchesi S, Montagnani F, Pastore G, et al.Monitoring Anti-PEG Antibodies Level upon Repeated Lipid Nanoparticle-Based COVID-19 Vaccine Administration. Int J Mol Sci. 2022 Aug 9;23(16):8838. doi: 10.3390/ijms23168838.
56. Lukawska J, Mandaliya D, Chan AWE, Foggitt A, Bidder T, Harvey J, et al. Anaphylaxis to trometamol excipient in gadolinium-based contrast agents for clinical imaging. J Allergy Clin Immunol Pract. 2019 Mar;7(3):1086-7. doi: 10.1016/j.jaip.2018.08.035.
57. Guler S, Ertok I, Sahin NY, Ramadan H, Katirci Y.Anaphylaxis after intravenous infusion of dexketoprofen trometamol. Turk J Emerg Med. 2016;16(3):132-3. doi:10.1016/j.tjem.2016.09.003.
58. Maltezou HC, Anastassopoulou C, Hatziantoniou S, Poland GA, Tsakris A.Anaphylaxis rates associated with COVID-19 vaccines are comparable to those of other vaccines.Vaccine.2022;40(2):183-6. doi:10.1016/j.vaccine.2021.11.066.
59. Boufidou F, Hatziantoniou S, Theodoridou K, Maltezou HC, Vasileiou K, Anastassopoulou C, et al. Anaphylactic Reactions to COVID-19 Vaccines: An Updated Assessment Based on Pharmacovigilance Data. Vaccines (Basel). 2023 Mar 8;11(3):613. doi: 10.3390/ vaccines11030613.
60. Baeck M, Marot L, Belkhir L. Delayed large local reactions to mRNA vaccines. N Engl J Med. 2021;384(24):e98. doi:10.1056/ NEJMc2104751.
61. Blumenthal KG, Freeman EE, Saff RR, Robinson LB, Wolfson AR, Foreman RK, et al. Delayed Large Local Reactions to mRNA1273 Vaccine against SARS-CoV-2. N Engl J Med. 2021 Apr 1;384(13):1273-7. doi: 10.1056/NEJMc2102131.
62. Samarakoon U, Alvarez-Arango S, Blumenthal KG. Delayed Large Local Reactions to mRNA Covid-19 Vaccines in Blacks, Indigenous Persons, and People of Color. N Engl J Med. 2021 Aug 12;385(7):662-4. doi: 10.1056/NEJMc2108620.
63. Higashino T, Yamazaki Y, Senda S, Satou Y, Yonekura Y, Imai K, et al. Assessment of Delayed Large Local Reactions After the First Dose of the SARS-CoV-2 mRNA-1273 Vaccine in Japan.JAMA Dermatol. 2022 Aug 1;158(8):923-7. doi: 10.1001/jamadermatol.2022.2088.
64. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. ; COVE Study Group. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021 Feb 4;384(5):403-16. doi: 10.1056/NEJMoa2035389.
65. Global Initiative for Asthma.2024 Global Initiative for Asthma (GINA) report: global strategy for asthma management and prevention [Internet]. Disponível em: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS. pdf. Acessado em: 29/08/2024.
66. Brasil, Ministério da Saúde. Em 2021, SUS registrou 1,3 milhão de atendimentos a pacientes com asma na Atenção Primária à Saúde [Internet]. Disponível em: https://www.gov.br/saude/pt-br/assuntos/noticias/2022/maio/em-2021-sus-registrou-1-3-milhaode-atendimentos-a-pacientes-com-asma-na-atencao-primaria-asaude-1 . Acessado em: 26/08/2024.
67. Marques CPC, Bloise RF, Lopes LBM, Godói LF, Souza PRP, Santa Rosa IM, et al. Epidemiologia da asma no Brasil, no período de 2016 a 2020.Res Soc Dev.2022;11(8):e5211828825-e5211828825. doi:10.33448/rsd-v11i8.28825.
68. Ritchie AI, Jackson DJ, Edwards MR, Johnston SL.Airway epithelial orchestrationofinnate immunefunction inresponse to virusinfection. A focus on asthma. Ann Am Thorac Soc. 2016;13 Suppl 1:S55-63. doi:10.1513/AnnalsATS.201507-421MG.
69. Gill MA, Bajwa G, George TA, Dong CC, Dougherty II, Jiang N, et al. Counterregulation between the FcepsilonRI pathway and antiviral responses in human plasmacytoid dendritic cells. J Immunol. 2010 Jun 1;184(11):5999-6006. doi: 10.4049/jimmunol.0901194.
70. PapadopoulosNG,ChristodoulouI,RohdeG,AgacheI,AlmqvistC, Bruno A, et al.Viruses and bacteria in acute asthma exacerbations- a GA² LEN-DARE systematic review.Allergy.2011 Apr;66(4):458-68. doi: 10.1111/j.1398-9995.2010.02505.x.
71. Wark PAB. Why are people with asthma more susceptible to influenza? Eur Respir J.2019;54(4).doi:10.1183/13993003.017482019.
72. Vasileiou E, Sheikh A, Butler CC, Robertson C, Kavanagh K, Englishby T, et al. Seasonal Influenza Vaccine Effectiveness in People With Asthma:A National Test-Negative Design Case-Control Study. Clin Infect Dis. 2020 Oct 23;71(7):e94-e104. doi: 10.1093/ cid/ciz1086.
73. DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, et al.Efficacy of high-dose versus standard-dose influenza vaccine in older adults. N Engl J Med. 2014 Aug 14;371(7):635-45. doi: 10.1056/NEJMoa1315727.
74. Chang LJ, Meng Y, Janosczyk H, Landolfi V, Talbot HK, QHD00013 Study Group.Safety and immunogenicity of high-dose quadrivalent influenza vaccine in adults ≥65 years of age:A phase 3 randomized clinical trial. Vaccine. 2019;37(39):5825-34. doi:10.1016/j. vaccine.2019.08.016
75. U.S. Food and Drug Administration (FDA). 2020. Package Insert- Fluzone High-Dose Quadrivalent. Sanofi Pasteur [Internet]. Disponível em: www.fda.gov/media/132238/download. Acessado em: 26/08/2024.
76. Li Y, Wang X, Blau DM, Caballero MT, Feikin DR, Gill CJ, et al. ; Respiratory Virus Global Epidemiology Network; Nair H; RESCEU investigators. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019:a systematic analysis. Lancet. 2022 May 28;399(10340):2047-64. doi: 10.1016/ S0140-6736(22)00478-0.
77. Shi T, Vennard S, Jasiewicz F, Brogden R, Nair H; RESCEU Investigators. Disease Burden Estimates of Respiratory Syncytial Virus related Acute Respiratory Infections in Adults With Comorbidity: A Systematic Review and Meta-Analysis. J Infect Dis. 2022 Aug 12;226(Suppl 1):S17-S21. doi: 10.1093/infdis/jiab040.
78. Zhou H, Thompson WW, Viboud CG, Ringholz CM, Cheng PY, Steiner C, et al. Hospitalizations associated with influenza and respiratory syncytial virus in the United States, 1993-2008. Clin Infect Dis. 2012 May;54(10):1427-36. doi: 10.1093/cid/cis211.
79. Binns E, Tuckerman J, Licciardi PV, Wurzel D. Respiratory syncytial virus, recurrent wheeze and asthma: A narrative review of pathophysiology, prevention and future directions. J Paediatr Child Health. 2022;58(10):1741-6. doi:10.1111/jpc.16197.
80. Rosas-Salazar C, Chirkova T, Gebretsadik T, Chappell JD, Peebles RS Jr, Dupont WD, et al.Respiratory syncytial virus infection during infancy and asthma during childhood in the USA (INSPIRE): a population-based, prospective birth cohort study.Lancet.2023 May 20;401(10389):1669-80. doi: 10.1016/S0140-6736(23)00811-5.
81. Coutts J, Fullarton J, Morris C, Grubb E, Buchan S, Rodgers-Gray B, et al. Association between respiratory syncytial virus hospitalization in infancy and childhood asthma. Pediatr Pulmonol. 2020 May;55(5):1104-10. doi: 10.1002/ppul.24676.
82. Papi A, Ison MG, Langley JM, Lee DG, Leroux-Roels I, Martinon-Torres F, et al. ; AReSVi-006 Study Group. Respiratory Syncytial Virus Prefusion F Protein Vaccine in Older Adults. N Engl J Med. 2023 Feb 16;388(7):595-608. doi: 10.1056/NEJMoa2209604.
83. Feldman RG, Antonelli-Incalzi R, Steenackers K, Lee DG, Papi A, Ison MG, et al. ; AReSVi-006 Study Group. Respiratory Syncytial Virus Prefusion F Protein Vaccine Is Efficacious in Older Adults With Underlying Medical Conditions. Clin Infect Dis. 2024 Jan 25;78(1):202-9. doi: 10.1093/cid/ciad471.
84. Ison MG, Papi A, Langley JM, Lee DG, Leroux-Roels I, Martinon-Torres F, et al. 1936. Efficacy of One Dose of the Respiratory Syncytial Virus (RSV) Prefusion F Protein Vaccine (RSVPreF3 OA) in Adults > 60 Years of Age Persists for 2 RSV Seasons. Open Forum Infect Dis. 2023 Nov 27;10(Suppl 2):ofad500.2467. doi: 10.1093/ofid/ofad500.2467.
85. National Library of Medicine. DailyMed. SYNAGIS- palivizumab injection, solution [Internet]. Disponível em: https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=3a0096c7-8139-44cdbba4-520ab05c2cb2 . Acessado em: 16/10/2024.
86. Gonzales T, Bergamasco A, Cristarella T, Goyer C, Wojdyla M, Oladapo A, et al. Effectiveness and Safety of Palivizumab for the Prevention of Serious Lower Respiratory Tract Infection Caused by Respiratory Syncytial Virus:A Systematic Review.Am J Perinatol. 2024 May;41(S 01):e1107-e1115. doi: 10.1055/a-1990-2633.
87. Griffin MP, Yuan Y, Takas T, Domachowske JB, Madhi SA, Manzoni P, et al. ; Nirsevimab Study Group. Single-Dose Nirsevimab for Prevention of RSV in Preterm Infants. N Engl J Med. 2020 Jul 30;383(5):415-25. doi: 10.1056/NEJMoa1913556.
88. Sun M, Lai H, Na F, Li S, Qiu X, Tian J, et al. Monoclonal Antibody for the Prevention of Respiratory Syncytial Virus in Infants and Children: A Systematic Review and Network Meta-analysis. JAMA Netw Open. 2023 Feb 1;6(2):e230023. doi: 10.1001/ jamanetworkopen.2023.0023.
89. Hammitt LL, Dagan R, Yuan Y, Baca Cots M, Bosheva M, Madhi SA, et al. ; MELODY Study Group. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022 Mar 3;386(9):837-46. doi: 10.1056/NEJMoa2110275.
90. Scelfo C, Menzella F, Fontana M, Ghidoni G, Galeone C, Facciolongo NC. Pneumonia and invasive pneumococcal diseases: the role of pneumococcal conjugate vaccine in the era of multi-drug resistance. Vaccines. 2021;9(5):420. doi:10.3390/ vaccines9050420.
91. O'Brien KL, Wolfson LJ, Watt JP, Henkle E, Deloria-Knoll M, McCall N, et al. ; Hib and Pneumococcal Global Burden of Disease Study Team.Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years:global estimates.Lancet.2009 Sep 12;374(9693):893-902. doi: 10.1016/S0140-6736(09)61204-6.
92. Song JY, Nahm MH, Moseley MA. Clinical implications of pneumococcal serotypes: invasive disease potential, clinical presentations, and antibiotic resistance. J Korean Med Sci. 2013;28(1):4-15. doi:10.3346/jkms.2013.28.1.4.
93. Li L, Cheng Y, Tu X, Yang J, Wang C, Zhang M, et al. Association between asthma and invasive pneumococcal disease risk: a systematic review and meta-analysis.Allergy Asthma Clin Immunol. 2020 Nov 10;16(1):94. doi: 10.1186/s13223-020-00492-4.
94. Castro-Rodriguez JA, Abarca K, Forno E. Asthma and the risk of invasive pneumococcal disease: a meta-analysis. Pediatrics. 2020;145(1):e20191200. doi:10.1542/peds.2019-1200.
95. Czaicki N, Bigaj J, Zielonka TM. Pneumococcal vaccine in adult asthma patients. Adv Exp Med Biol. 2021;1289:55-62. doi:10.1007/5584_2020_562.
96. CDC, Pneumococcal disease. Summary of risk-based pneumococcal vaccination recommendations [Internet]. Disponível em: https://www.cdc.gov/pneumococcal/hcp/vaccine-recommendations/risk-indications.html. Acessado em: 27/08/2024.
97. Moberley S, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults.Cochrane Database Syst Rev. 2013;2013(1):CD000422. doi:10.1002/14651858. CD000422.pub3.
98. Gladstone RA, Jefferies JM, Tocheva AS, Beard KR, Garley D, Chong WW, et al. Five winters of pneumococcal serotype replacement in UK carriage following PCV introduction. Vaccine. 2015 Apr 21;33(17):2015-21. doi: 10.1016/j. vaccine.2015.03.012.
99. Torres A, Blasi F, Dartois N, Akova M. Which individuals are at increased risk of pneumococcal disease and why? Impact of COPD, asthma, smoking, diabetes, and/or chronic heart disease on community-acquired pneumonia and invasive pneumococcal disease.Thorax.2015;70(10):984-9.doi:10.1136/thoraxjnl-2015206780
100. Costa VC, Barreto MP, Andrade MCC, Lopes SMS, Nascimento MML, Carvalho FP, et al. Asma como fator de risco para infecção por COVID-19 em crianças:uma revisão integrativa.Enferm Bras. 2023;22(4):492-506. doi: 10.33233/eb.v22i4.5284.
101. Shi T, Pan J, Katikireddi SV, McCowan C, Kerr S, Agrawal U, et al. ; Public Health Scotland and the EAVE II Collaborators. Risk of COVID-19 hospital admission among children aged 5-17 years with asthma in Scotland: a national incident cohort study. Lancet Respir Med. 2022 Feb;10(2):191-8. doi: 10.1016/S22132600(21)00491-4.
102. Williamson EJ, Walker AJ, Bhaskaran K, Bacon S, Bates C, Morton CE, et al. Factors associated with COVID-19-related death using OpenSAFELY. Nature. 2020 Aug;584(7821):430-6. doi: 10.1038/ s41586-020-2521-4.
103. Bloom CI, Drake TM, Docherty AB, Lipworth BJ, Johnston SL, Nguyen-Van-Tam JS, et al. ; ISARIC investigators. Risk of adverse outcomes in patients with underlying respiratory conditions admitted to hospital with COVID-19: a national, multicentre prospective cohort study using the ISARIC WHO Clinical Characterization Protocol UK. Lancet Respir Med. 2021 Jul;9(7):699-711. doi: 10.1016/S2213-2600(21)00013-8.
104. Brasil, Ministério da Saúde.Esquema vacinal Covid-19 [Internet]. Disponível em:https://www.gov.br/saude/pt-br/assuntos/covid-19/esquemas-vacinais/esquema-vacinal-covid-19/view. Acessado em: 27/08/2024.
105. Caubet JC, Rudzeviciene O, Gomes E, Terreehorst I, Brockow K, Eigenmann PA.Managing a child with possible allergy to vaccine. Pediatr Allergy Immunol Off Publ Eur Soc Pediatr Allergy Immunol. 2014;25(4):394-403. doi:10.1111/pai.12132.
106. Wood RA, Berger M, Dreskin SC, Setse R, Engler RJ, Dekker CL, et al. ;Hypersensitivity Working Group of the Clinical Immunization Safety Assessment (CISA) Network.An algorithm for treatment of patients with hypersensitivity reactions after vaccines. Pediatrics. 2008 Sep;122(3):e771-7. doi: 10.1542/peds.2008-1002.
107. Brasil, Ministério da Saúde.Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação [Internet].Disponível em:https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/svsa/vacinacao-imunizacao-pni/manual_eventos-_adversos_pos_vacinacao_4ed_atualizada.pdf/view. Acessado em: 16/10/2024.