Número Atual: Abril-Junho 2018 - Volume 2 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Herberto J. Chong Neto
- Dirceu Solé
- Paulo Camargos
- Nelson A. Rosário
- Emanuel C. Sarinho
- Débora Carla Chong-Silva
- Bernardo Kiertsman
- Antônio C. Pastorino
- Flávio Sano
- Marilyn Urrutia-Pereira
- Gustavo F. Wandalsen
- Ana Caroline Dela Bianca de Melo
- Bruno A. Paes Barreto
- Fábio C Kuschnir
- Joel Cunha
- Luciana R. Silva
- Mariane Cordeiro A. Franco
- Maria Luisa O. Alonso
- Murilo Britto
- Neusa F. Wandalsen
- Norma M. P. Rubini
- Sidnei Ferreira
ARTIGO ESPECIAL
Diretrizes da Associação Brasileira de Alergia e Imunologia e Sociedade Brasileira de Pediatria para sibilância e asma no pré-escolar
Guidelines of the Brazilian Association of Allergy and Immunology and the Brazilian Society of Pediatrics for wheezing and asthma in preschool children
Herberto J. Chong Neto1; Dirceu Solé1; Paulo Camargos1; Nelson A. Rosário2; Emanuel C. Sarinho1; Débora Carla Chong-Silva1; Bernardo Kiertsman1; Antônio C. Pastorino2; Flávio Sano2; Marilyn Urrutia-Pereira2; Gustavo F. Wandalsen2; Ana Caroline Dela Bianca de Melo2; Bruno A. Paes Barreto2; Fábio C Kuschnir1; Joel Cunha1; Luciana R. Silva1; Mariane Cordeiro A. Franco1; Maria Luisa O. Alonso2; Murilo Britto1; Neusa F. Wandalsen2; Norma M. P. Rubini2; Sidnei Ferreira1
1. Sociedade Brasileira de Pediatria - SBP
2. Associaçao Brasileira de Alergia e Imunologia - ASBAI
Endereço para correspondência:
Dirceu Solé
E-mail: dirceu.sole@unifesp.br
Submetido em: 23/02/2018
Aceito em 28/02/2018
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A asma é uma das doenças crônicas de maior frequência na infância. Parcela significativa de crianças com asma desenvolve sintomas nos primeiros anos de vida, mas nem sempre a sua confirmaçao diagnóstica é fácil. Outras causas de sibilância que podem gerar confusao diagnóstica, além da complexidade para a obtençao de medidas objetivas, tais como a realizaçao de provas de funçao pulmonar nessa faixa etária, sao justificativas para esse fato. Especialistas na abordagem desses pacientes, da Associaçao Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Pediatria, após revisao extensa da literatura pertinente elaboraram esse documento, onde sao comentados os possíveis agentes etiológicos, prevalência, diagnóstico diferencial, assim como tratamento e prevençao da sibilância e asma em pré-escolares.
Descritores: Asma, pré-escolares, alergia, vírus, tratamento.
INTRODUÇAO
Parcela significativa de crianças com asma desenvolve sintomas nos primeiros anos de vida, mas nem sempre a sua confirmaçao diagnóstica é fácil. Outras causas de sibilância que podem gerar confusao diagnóstica, além da complexidade para a obtençao de medidas objetivas, tais como a realizaçao de provas de funçao pulmonar nessa faixa etária sao justificativas para esse fato1,2. É importante comentar que o sistema respiratório tem o seu crescimento e desenvolvimento completados ao redor dos oito anos de vida, o que justifica muitas das diferenças observadas entre crianças e adultos3,4. Apesar disso, poucos sao os documentos destinados ao diagnóstico de asma nessa populaçao.
Assim, grupo de especialistas (pediatras alergistas, alergistas e pneumologistas pediátricos) envolvidos no atendimento desses pacientes reuniu-se e elaborou o presente documento financiado com recursos próprios das duas associaçoes cuja finalidade, à luz dos conhecimentos mais atuais, é fornecer ferramentas que permitam ao clínico estabelecer o diagnóstico de asma de modo mais preciso, além de permitir acesso a tratamento mais especializado a pacientes menores de cinco anos.
DEFINIÇAO
A asma é a doença crônica mais comum na infância e pode causar morbidade significativa (perdas de dia de aula, atendimentos em serviços de prontoatendimento, hospitalizaçao, entre outras). É doença heterogênea geralmente caracterizada por inflamaçao crônica das vias aéreas. É definida pela história de sintomas respiratórios tais como sibilância, respiraçao rápida e curta, aperto no peito e tosse que variam com o tempo e a intensidade, associados à variaçao do fluxo expiratório5. Em geral, a asma inicia-se nos primeiros anos de vida, e pode ser confundida com outras doenças que também cursam com os sintomas acima descritos, o que retarda a instituiçao de tratamento adequado. Segundo alguns autores, a referência à expressao "sibilância recorrente", ou seja, mais de três episódios de sibilância por ano, tem sido por eles defendida como sinômino de asma5,6. Nessa fase da vida é importante identificar os principais agentes desencadeantes de episódios de sibilancia5-7.
MICROBIOMA RESPIRATORIO
Atualmente, há evidências sugestivas de que a mucosa respiratória saudável é habitada por microbiota específica com maior densidade nas vias aéreas superiores. O desenvolvimento deste microbioma das vias aéreas ocorre exponencialmente muito cedo na vida e, mais tarde, de alguma forma pode ser influenciado pelo meio ambiente, estado de saúde e idade. O parto vaginal, o aleitamento materno, as exposiçoes ambientais durante as primeiras horas de vida e o ambiente em que vive a criança em torno dos primeiros 100 dias parecem definir a formaçao da microbiota respiratória com potencial de garantir condiçoes de saúde respiratória ao longo da vida. Neste aspecto, o tipo de partículas de poeira inaladas que transportam uma mistura complexa de micróbios e de fatores microbianos, poderiam interferir neste microbioma e assim ter alguma influência nas respostas imunológicas inatas e adaptativas8.
Em indivíduos normais, as vias aéreas superiores que representam grande superfície de contato com o meio externo, mostram especificidade de nichos bacterianos, de acordo com a regiao anatômica, onde no nariz, por exemplo, há predomínio de actinobactérias associadas à pele, enquanto na orofaringe encontra-se em maior proporçao membros dos filos Firmicutes e Proteobacteria9.
Quando o Projeto Microbioma Humano foi criado, o sistema respiratório nao foi incluído, pois se acreditava que o tecido pulmonar fosse estéril, porém a partir das novas técnicas de detecçao e replicaçao de microrganismos, sobretudo o sequenciamento via 16S rRNA, tem sido possível estabelecer um padrao microbiano associado aos pulmoes, embora com densidade populacional muito baixa, o que faz com que alguns pesquisadores ainda questionem a possibilidade de contaminaçao na coleta ou do próprio "kit" de extraçao do RNA10. Contudo, no epitélio respiratório, em nível pulmonar, em indivíduos normais, é possível detectarse quantidades proporcionais de espécies dos cinco maiores filos, quer sejam Proteobacteria, Firmicutes, Actinobacteria, Fusobacterium e Bacteriodetes9,11.
Dessa forma, assim como o microbioma intestinal tem sido responsabilizado como elemento fundamental no mecanismo patofisiológico de diversas doenças, intestinais e/ou sistêmicas, o microbioma respiratório (vias aéreas superiores e pulmao) provavelmente guarde estreita relaçao com o desenvolvimento de doenças respiratórias, como por exemplo, a asma, quer na sua forma de início precoce, na sibilância do lactente, ou na sua forma estabilizada mais clássica, nos adolescentes e adultos9.
Com relaçao ao microbioma das vias aéreas superiores, estudo de seguimemto de crianças após o nascimento mostrou que a maioria delas foi inicialmente colonizada por Staphylococcus ou Corynebacterium, antes da colonizaçao mais estável com Alloiococcus ou Moraxella. Incursoes transitórias de Streptococcus, Moraxella ou Haemophilus, características do microbioma da nasofaringe parecem ser determinantes na propagaçao de infecçao para as vias aéreas inferiores, na gravidade dos sintomas relativos ao processo inflamatório e no risco futuro de desenvolvimento da asma. A colonizaçao assintomática precoce (em menores de um ano) com Streptococcus foi um forte preditor para sensibilizaçao alérgica, aos dois anos, e sibilância de repetiçao/asma entre os cinco e dez anos de idade. Além disto, o uso precoce de antibióticos na infância interrompeu os padroes normais da colonizaçao do trato respiratório10. Já, nos indivíduos com asma parece haver um desequilíbrio em alguns destes filos da microbiota pulmonar, como por exemplo, um aumento na quantidade e variedade de espécies pertencentes ao filo Proteobacteria, como as famílias: Comamonadaceae, Nitrosomonadaceae , Oxalobacteraceae , Pastereurellaceae e Pseudomonadaceae. Por outro lado, observa-se diminuiçao nas espécies dos filos Bacteroidetes e Firmicutes9,11.
Pacientes com asma nao controlada e/ou corticorresistente sao predominantemente colonizados por microrganismos patogênicos como a Moraxella catarrhalis e membros do gênero Haemophilus ou Streptococcus. Além disto, o micobioma pulmonar de pacientes com asma, diferentemente do de controles saudáveis, apresenta tipos de fungos diferenciados, como: Psathyrella candolleana, Termitomyces clypeatus, Grifola sordulenta e Malassezia pachydermatis, sendo este último associado ao desenvolvimento de dermatite atópica neste perfil de pacientes. Em modelo murino, a instalaçao de disbiose fúngica, por meio da utilizaçao de antifúngicos induziu maior grau de inflamaçao brônquica, ratificando tal relaçao11,12.
Embora os estudos apresentados demonstrem uma relaçao do microbioma respiratório com a sibilância do lactente e/ou asma, isto nao significa necessariamente, até o momento, situaçao de causalidade. Fato este que mantém o questionamento central ainda sem resposta: seriam as alteraçoes do microbioma respiratório a causa do processo inflamatório crônico característico da sibilância/asma? Ou seriam consequência, a partir de um processo inflamatório previamente instalado, que promoveria uma seleçao de microrganismos mais adaptados a este substrato patológico?
SIBILANCIA E AGENTES INFECCIOSOS
O papel de agentes infecciosos distintos na gênese da asma é variado. Além das manifestaçoes agudas com exacerbaçoes da doença já estabelecida, sugere-se uma associaçao entre a infecçao, especialmente por vírus e o início de sintomas recorrentes de sibilância e asma em crianças, adolescentes e adultos jovens13,14.
A exacerbaçao da asma associada a infecçoes virais é mais frequente durante a idade pré-escolar e escolar, e, embora a prevalência de asma seja mais comum em meninos nesta idade, nao há evidências de que a incidência ou prevalência de asma relacionada à infecçao varie de acordo com o gênero13.
Muitos autores têm estudado a relaçao entre a infecçao viral, notadamente pelo Vírus Sincicial Respiratório (VSR) e o posterior desenvolvimento de asma. Avalia-se o fato de certos indivíduos apresentarem uma predisposiçao genética para a sibilância induzida por vírus e o desenvolvimento da asma15.
As infecçoes bacterianas e a colonizaçao do trato respiratório também foram associadas à exacerbaçao e à sibilância recorrente, um efeito que pode ser independente ou relacionado a um cofator, como os vírus. Infecçoes bacterianas atípicas, como as causadas por Mycoplasma pneumoniae e Chlamydia pneumoniae e as por fungos, especialmente a aspergilose broncopulmonar alérgica (ABPA), também desempenham um papel potencial na induçao e exacerbaçao da doença15.
Comprovou-se interaçoes bidirecionais entre vírus e bactérias nas vias aéreas e que parecem influenciar a gravidade da doença e a probabilidade de crise16.
VIRUS
Estudos epidemiológicos, com crianças com diagnóstico de pneumonia aguda adquirida na comunidade, mostraram o VSR como o agente etiológico mais comum em vários continentes17,18 e responsável por epidemias da doença em todo o mundo19. Acima de 90% das crianças com até dois anos de idade apresentam anticorpos para o VSR, denotando algum contato com este vírus até esta idade20.
Outros vírus, como o rinovírus humano (RVH), influenza, o grupo parainfluenza e o adenovírus, também estao entre os agentes causadores de infecçoes do trato respiratório inferior em crianças menores de cinco anos de idade21-23. O coronavírus, bocavírus e metapneumovírus também foram isolados em secreçoes de crianças com infecçoes agudas do trato respiratório inferior, boa parte dos pacientes apresentavam sibilos como sintoma24-26, porém o papel destes vírus na sibilância recorrente ainda é discutido.
Os enterovírus têm sido responsabilizados por ocasionar quadros de sibilância em crianças18.
Tanto o VSR como o RVH sao capazes de produzir doenças agudas graves do trato respiratório
inferior (bronquiolite) que requerem hospitalizaçao, e evidências apontam estes vírus como envolvidos em risco subsequente de sibilância e desenvolvimento de asma27.
Rinovírus Humano (RVH)
O RVH é o vírus respiratório mais prevalente nas infecçoes respiratórias e é classificado em três espécies (A, B e C), sendo cada uma delas composta por diferentes subtipos: A (80 sorotipos), B (32 sorotipos), e C (até 55 sorotipos)28.
Existem diferenças significativas entre as espécies RVH. Os RVH-A e C, mais parecidos filogeneticamente, sao propensos a causar doenças respiratórias moderadas a graves29. O RVH-C está associado a exacerbaçoes de sibilância clinicamente significativas30, e tende a maior viremia, conferindo-lhe um potencial mais virulento30.
Tanto em adultos como em crianças, o RVH é o vírus mais frequentemente identificado associado à crise de asma31,32. Os mecanismos celulares presentes na asma e que justificam essa ocorrência incluem maior expressao de molécula de adesao intercelular-1 (ICAM-1) em células epiteliais respiratórias, interrupçao da funçao de barreira epitelial, apoptose prejudicada, aumento da lise celular, resposta Th1 deficiente (por exemplo, interferon [IFN]-γ) e o maior recrutamento de neutrófilos33. Diante disso, e com o epitélio danificado, o indivíduo com asma fica predisposto a infecçoes virais, que levariam à inflamaçao e consequente obstruçao das vias aéreas.
A infecçao por RVH também induz a formaçao de mediadores pró-inflamatórios, incluindo interleucina (IL) -6, IL-8, fator de necrose tumoral α (TNF-α), IL-β, regulador da ativaçao T normal expresso e segregado (RANTES) e fator estimulador de colônias de granulócitos-macrófagos (GM-CSF)34. As espécies A e B utilizam principalmente a ICAM-1 e o receptor de lipoproteínas de baixa densidade (LDLR) como receptores para entrada na célula e replicaçao, enquanto que RV-C utiliza um receptor único, ainda nao identificado35.
Além do aumento dos neutrófilos, a crise da asma induzida por RVH também pode estar associada ao aumento dos eosinófilos nas vias respiratórias36. Estes eosinófilos ligam-se ao RVH e participam de respostas imunológicas específicas, apresentando antígenos e ativando células T37. As células T ativadas juntamente com a proteína catiônica eosinofílica (ECP) aumentam a expressao de ICAM-1 em células epiteliais38. Como já conhecido, 90% dos RVH-A e RVH-B utilizam o ICAM-1 como receptor, levando entao a um ciclo de perpetuaçao da infecçao viral e inflamaçao38.
Vírus Sincicial Respiratório
O VSR apresenta dois grupos antigênicos: A e B, sendo o VSR-A predominante no outono e início do inverno, e o VSR-B no inverno e no início da primavera39. Comumente o VSR-A está associado a doença mais grave que o VSR-B40. Dentre as proteínas virais traduzidas por este vírus, três delas: as proteínas F, G e SH, sao as mais importantes, por ligarem o vírus à célula hospedeira41.
O VSR é o principal agente relacionado à bronquiolite viral aguda e também pode contribuir para exacerbaçoes de asma em crianças e adultos35, por induzir inflamaçao e promover a hiper-reatividade das vias aéreas42.
Tem-se procurado identificar a resposta imunológica responsável por esta situaçao, já no momento da infecçao aguda43-47. Analisando a resposta humoral e celular de crianças infectadas pelo VSR, demonstrou-se que antes do terceiro mês de vida a taxa de soroconversao é baixa, e a detecçao de níveis altos de IgG específica, especialmente IgG1, ocorre às custas de anticorpos maternos, que apresentam pouca atividade neutralizadora48. Crianças maiores de três meses de idade, onde já ocorre resposta humoral efetiva por linfócito B (CD20), apresentam boa soroconversao48.
Em humanos e em modelos animais, os linfócitos pulmonares, quando infectados pelo VSR, estimulam ambas as respostas Th1 e Th2. As principais proteínas do hospedeiro envolvidas sao ICAM-1, IFN-γ, ERK 1,2, STAT - 1/3 e PKC-α49. O IFN-γ parece estar relacionado à replicaçao do VSR, e as demais proteínas à sua expressao gênica precoce e à inflamaçao49. Mais recentemente, outras ILs também foram identificadas na infecçao pelo VSR, como IL-12, IL-18, e quimocinas como o IL-8, IL-10, RANTES, proteína inflamatória de macrófagos (MIP)-1α, proteína quimiotática de monócitos (MCP)-1 e eotaxina50,51. Após a apresentaçao do antígeno viral, o recrutamento de células inflamatórias adicionais, como células T CD8+, células B e granulócitos (neutrófilos e eosinófilos, pode ocorrer51.
Na vigência da infecçao pelo VSR comprovou-se, em determinadas situaçoes, a ocorrência da estimulaçao de linfócitos Th252. Os níveis de IFN-γ e TNF-α foram significativamente menores na exacerbaçao de asma induzida por VSR quando comparados aos de indivíduos com asma infectados com o vírus influenza53. De fato, a resposta Th1 mais fraca durante a infecçao viral nesses indivíduos pode levar à reduçao da depuraçao viral e prolongar a doença, ou torná-la mais grave53. O VSR é potente indutor de quimocinas51, RANTES e eotaxina. A eotaxina parece ser um componente chave da resposta Th254. Níveis de eotaxina correlacionam-se estreitamente com a degranulaçao dos eosinófilos (neurotoxina derivada de eosinófilos [EDN] e ECP) na asma54.
Quanto à gravidade da doença aguda pelo VSR, a presença de níveis elevados de IgE específica contra o vírus, bem como níveis de IL-2 e IL-10, estao relacionados à gravidade do episódio agudo, duraçao da insuficiência respiratória e consequentemente maior morbidade do quadro respiratório após a alta55,56.
Fatores do hospedeiro podem ser críticos na determinaçao da gravidade da doença induzida por VSR, mesmo quando estao relacionados à idade, infecçao recente, poluiçao e exposiçao a alérgenos57. Estudos genéticos de hospedeiros observaram vários polimorfismos, incluindo aqueles no receptor de quimocinas KCR550 (que se liga a MIP-1α, MIP-1β e RANTES), CXCL8, IL-4 e variantes promotoras de IL-9, IL-10 e TNF-α que se relacionaram à doença grave pelo VSR, confirmando assim a contribuiçao das interaçoes gênico-ambiente com a suscetibilidade a doenças induzidas pelo VSR57.
VSR e desenvolvimento de asma: o ovo ou a galinha?
Estudos de crianças com bronquiolite confirmada pelo VSR acompanhadas por três anos verificaram que 60% apresentaram sibilância recorrente no período de acompanhamento contra 32% dos indivíduos controle. Entre os casos VSR positivos, 32% apresentavam relaçao com atopia44.
Estudo de seguimento ambulatorial de crianças com infecçoes virais de diferentes etiologias até os 13 anos, concluiu que as com infecçao confirmada pelo VSR apresentaram três a quatro vezes mais chances de sibilância recorrente até os seis anos de idade quando comparadas aos controles45, entretanto, aos 13 anos de idade esta diferença nao foi significante. Os demais agentes etiológicos identificados neste estudo: influenza, adenovírus, rinovírus, clamídia e até algumas bactérias, mostraram a mesma tendência de manutençao de sintomas recorrentes após a infecçao aguda, porém em menor consistência quando comparado ao VSR45.
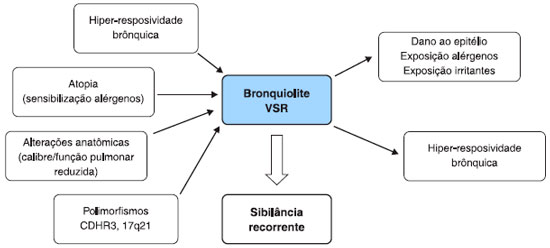
Referente ao VSR sugere-se duas hipóteses que justifiquem a associaçao da infecçao com sibilância recorrente e asma. Na primeira, a infecçao aguda por VSR (bronquiolite aguda) seria o desencadeador da sibilância recorrente em pacientes com predisposiçao à atopia, e, na segunda, essa infecçao, em fase precoce da vida, seria a causadora da asma.
Na primeira hipótese, o VSR seria um mero indicador de uma condiçao pré-existente58. Seriam fatores predisponentes para o desenvolvimento de sibilância recorrente a partir da infecçao aguda pelo VSR: hipersensibilidade a alérgenos comuns, hiperresponsividade da via aérea e alteraçoes anatômicas ou fisiológicas58. A produçao de IgE específica ao VSR, e o consequente envolvimento de mastócitos e basófilos na infecçao aguda, parece ser condiçao inerente da criança infectada, além de ser fator sinalizador de atopia e sibilância recorrente59,60.
A detecçao de histamina em secreçao nasofaríngea, de leucotrieno (LT) C4 urinário, de eosinofilia periférica e de proteína catiônica eosinofílica (ECP) têm sido consideradas bons marcadores de sibilância recorrente neste grupo de indivíduos46,61,62. A predisposiçao de produzir uma reaçao de hipersensibilidade tipo I quando em contato com o VSR tem sido o fator determinante dos sintomas recorrentes.
A administraçao de omalizumabe reduziu as exacerbaçoes de asma sazonal causadas principalmente por infecçoes virais das vias aéreas superiores14. Essas observaçoes indicam que as interaçoes entre a sensibilizaçao alérgica (antígeno -formaçao específica de anticorpos IgE) e doenças respiratórias virais desempenham um papel importante no controle da asma14.
Estudos genéticos já apontaram para o fato da variabilidade genética, em vários loci diferentes (CDHR3 e regiao 17q21 no genoma), contribuir para a frequência e gravidade da resposta do hospedeiro à infecçao viral63,64.
A presença de hiper-responsividade brônquica a estímulos inespecíficos parece ser uma condiçao pré-existente que precisa ser valorizada. Sugere-se que crianças com hiper-responsividade quando em contato com VSR desencadeariam sintomas respiratórios mais facilmente quando comparadas a crianças sem esta condiçao65. A dificuldade em confirmar hiper-responsividade por meio de exames de provocaçao (metacolina, histamina), especialmente antes do episódio agudo, tem deixado esta hipótese ainda distante de confirmaçao65,66.
Alteraçoes anátomo-fisiológicas, como reduçao do calibre da via aérea e consequente reduçao da funçao pulmonar, seriam fatores predisponentes de sibilância por vírus. Demonstrou-se que crianças com parâmetros reduzidos de funçao pulmonar ao nascimento apresentam mais sibilância ao contato com vírus e quadros de recorrência destes sintomas até aproximadamente os três anos de idade, seriam os sibilantes transitórios65.
A segunda hipótese sustenta a ideia de que o VSR seria causador de quadros de sibilância recorrente em crianças sem predisposiçao para asma. Nestes casos, o dano da mucosa respiratória gerado pelo intenso processo inflamatório durante a infecçao aguda, facilitaria a sensibilizaçao a alérgenos ou provocaria a exposiçao de receptores irritativos, resultando na sibilância recorrente66. Linfócitos humanos após infecçao por VSR demonstraram grande sensibilizaçao ao ácaro Dermatophagoides farinae, caseína e ovoalbumina67.
É importante lembrar que fatores como poluiçao, tabagismo passivo e sensibilizaçao a outros alérgenos fazem parte da vida destas crianças e podem interferir em diferentes proporçoes com quadros de sibilância recorrente durante a infância e a vida adulta17 (Figura 1).
Enterovírus (EV) EV-D68
Os EV, incluindo os poliovírus, circulam principalmente no verao, havendo queda dessa circulaçao em climas temperados69. Existem mais de 100 EV humanos e nao humanos, sendo os mais novos classificados em quatro espécies, EV-A, EV-B, EV-C e EV-D. O EV-D inclui três subtipos conhecidos por causar doenças em seres humanos: EV-D68, EV-D70 e EV-D9470.
Embora o EV-D68 tenha sido isolado em 1962, surgiu na última década como um patógeno respiratório importante, com infecçoes comprovadas em vários continentes, causando doença respiratória grave, especialmente em crianças com asma71.
Desconhece-se a patogênese do EV-D68 na via aérea inferior, uma vez que os receptores celulares para este vírus sao encontrados predominantemente no trato respiratório superior72. Sugere-se que cepas recentes de EV-D68 que estao associadas à infecçao do trato respiratório inferior tenham sofrido mutaçoes genéticas capazes de influenciar a antigenemia ou o trofismo pelas células das vias aéreas inferiores72.
OUTROS VIRUS
O impacto do vírus Influenza sobre a asma tem sido debatido73. Observa-se morbidade significativa associada à infecçao por Influenza em pacientes com condiçoes crônicas subjacentes (como a asma), em comparaçao a controles saudáveis74. Observou-se taxa média quatro vezes maior de hospitalizaçoes associada à gripe, e duas vezes maior de visitas ambulatoriais, para o grupo de crianças com asma75. Mais estudos precisam ser realizados para confirmar uma forte associaçao de gripe e exacerbaçoes de asma.
O metapneumovírus humano (MPV), um Paramyxovirus estreitamente relacionado ao RSV, tem sido associado, tanto ao início da asma quanto às exacerbaçoes nas populaçoes pediátricas e adultas76. Estudo com crianças internadas por bronquiolite viral, comparando as causadas por MPV e VSR nos dois primeiros anos de vida, documentou ser a infecçao por MPV o fator de risco mais importante para o desenvolvimento da asma nos anos pré-escolares (OR = 15,9)76. Outros estudos encontraram resultados semelhantes com maior significância em crianças até três anos de idade, indicando o MPV como importante no início da vida76.
Outros vírus, como o Bocavírus, detectados com certa frequência nas infecçoes de vias aéreas inferiores de crianças, necessitam ser melhor avaliados no que se refere às exacerbaçoes de asma, bem como seu impacto na induçao de sibilância recorrente25,26.
BACTÉRIAS
Além dos vírus, investigaçoes comprovam a relaçao entre o microbioma do hospedeiro e o início de exacerbaçoes de asma. Estudo mostra associaçao entre a colonizaçao da hipofaringe neonatal por Haemophilus influenza, Streptococcus pneumoniae e Moraxella catarrhalis com o aumento do risco de desenvolver sibilância recorrente e asma na infância77,78. Nao é claro, a partir desses achados, se a colonizaçao precoce com esses organismos influencia o desenvolvimento da asma, ou se a presença desses organismos é um reflexo de um sistema imunológico modificado, que predispoe à alteraçao de respostas das vias aéreas do hospedeiro a agentes patogênicos respiratórios79.
Bactérias atípicas
As infecçoes por Mycoplasma pneumoniae e Chlamydia pneumoniae desempenham papel potencial na induçao e exacerbaçao da asma79. Os primeiros estudos envolvendo C. pneumoniae sugerem ligaçao entre a infecçao e o início da asma80.
Indivíduos com asma estável com positividade à reaçao em cadeia da polimerase (PCR) para M. pneumoniae ou C. pneumoniae melhoraram sua funçao pulmonar quando tratados com claritromicina81, embora a adiçao de claritromicina à fluticasona nao tenha se associado à melhora semelhante da funçao pulmonar e do controle de asma, e houve algum resultado somente na hiper-responsividade brônquica39.
Estudo longitudinal com indivíduos diagnosticados com infecçao aguda ou crônica por C. pneumoniae nao mostrou maior chance de desenvolverem asma em comparaçao a outros sem infecçao, no entanto, os que desenvolveram asma tiveram declínio mais progressivo da funçao pulmonar, em comparaçao aos sem infecçao pelas bactérias citadas40.
Crianças com asma têm níveis de anticorpos para M. pneumoniae mais baixos quando comparados a controles saudáveis, sugerindo resposta humoral mais fraca. Entre os pacientes com asma, aqueles que apresentaram resultados positivos para M.pneumoniae tiveram escores significativamente menores nos questionários de controle de asma e de qualidade de vida82.
SIBILANCIA E ALERGIAS
Estudos populacionais prospectivos de longo prazo, sobretudo coortes de nascimento, têm fornecido cada vez mais novos conhecimentos sobre o desenvolvimento e a história natural da asma e sibilância na infância e adolescência.
A coorte de Tucson1 mostrou que a história familiar de atopia, principalmente materna, é o fator de risco mais bem definido para o desenvolvimento de sibilância recorrente e o aparecimento de asma que persiste ao longo da infância, achado este corroborado por outros autores83.
Estudo conduzido em Curitiba, integrante do Estudo Internacional de Sibilâncias em Lactentes (EISL), mostrou que crianças cujos pais e irmaos tinham história de asma apresentaram maior chance de crises de sibilos no primeiro ano de vida do que aquelas sem história familiar, independentemente de outros fatores de risco84. Estes resultados ressaltam a importância dos fatores genéticos no desenvolvimento de sibilos em lactentes.
Um conjunto de evidências sugere que nos dois primeiros anos de vida é possível que seja comum a progressao de outras doenças alérgicas, como a dermatite atópica e a alergia alimentar, evoluirem para sibilância, asma e sensibilizaçao a alérgenos inalatórios na idade escolar85-87. Estudos mostraram que lactentes com dermatite atópica e sensibilizaçao a ovo e outros alérgenos alimentares têm maior risco para o desenvolvimento posterior de asma, em especial naqueles com mutaçao dos genes da filagrina88,89.
A sensibilizaçao a aeroalérgenos no início da vida também constitui importante fator de risco para o desenvolvimento de asma na infância90,91. Essa relaçao parece ser mais complexa do que simplesmente a presença ou ausência de atopia, com a época de início, o tipo e número de aeroalérgenos envolvidos desempenhando um papel importante nesta associaçao92,93.
Estudos diversos revelaram que crianças monossensibilizadas, especialmente aos ácaros da poeira domiciliar, têm melhor prognóstico para asma do que aquelas com atopia múltipla precoce (aerolalérgenos e/ou alimentos)94-96. Crianças com este perfil de sensibilizaçao alérgica podem apresentar um fenótipo particular de asma de mau prognóstico, caracterizado por sibilância persistente, exacerbaçoes graves com admissao hospitalar, e perda progressiva da funçao pulmonar ao longo da infância97-99.
Além disso, a sensibilizaçao aos aeroalérgenos parece aumentar o risco de sibilância induzida por rinovírus, e a combinaçao de sensibilizaçao precoce e infecçao viral pode ter um efeito sinérgico no risco de asma futura100.
É importante ressaltar que respostas IgE específicas dirigidas a proteínas alimentares, particularmente ao ovo de galinha e ao leite de vaca, assim como para aeroalérgenos, podem já estar presentes durante os primeiros meses de vida. Deste modo, a realizaçao de testes alérgicos (cutâneos ou séricos) deve ser considerada em lactentes e pré-escolares com sibilância, uma vez que estes podem ter alto valor preditivo para o desenvolvimento de asma na idade escolar e adolescência, e podem contribuir para o melhor controle precoce da doença101.
Estudos genéticos sobre asma representam um desafio em funçao da sua natureza multifatorial, diferentes exposiçoes ambientais ao longo da vida e complexidade das interaçoes genético-ambientais e gene-a-gene. Além disso, especialmente na infância, esta avaliaçao é dificultada pela presença de desfechos comuns a diferentes fenótipos clínicos da doença, como sibilância e tosse. Apesar dessas dificuldades, alguns genes candidatos foram estudados quanto a sua possível associaçao com a regulaçao da inflamaçao alérgica. Este grupo inclui aqueles que regulam a diferenciaçao Th1 / Th2 e sua funçao efetora, como IL-13, IL-4RA, STAT6, TBX21 e GATA3, bem como os genes IRAKM e PHF11, que potencialmente regulam a sensibilizaçao atópica e o grau de inflamaçao ao nível dos órgaos-alvo nas doenças alérgicas102.
EPIDEMIOLOGIA DA SIBILANCIA/ASMA
Estudos epidemiológicos têm empregado a persistência da sibilância ou a sua recorrência (três ou mais episódios, SR) no lactente como sinônimo de asma. A SR representa problema significativo de saúde pública, sobretudo em países em desenvolvimento. A aquisiçao de um instrumento padronizado, utilizado em lactentes, sobre sibilância e fatores associados (EISL)103 permitiu pela primeira vez conhecer-se a real dimensao da sibilância em lactentes de países desenvolvidos e em desenvolvimento, e revelou serem significantemente maiores nestes últimos103,104.
O EISL foi idealizado como um estudo multicêntrico internacional, com participaçao de países da América Latina (Argentina, Brasil, Chile, Colômbia, México, Peru, Uruguai e Venezuela), da Espanha e da Holanda, cujos dados foram obtidos por questionário escrito e padronizado, validado para o português, espanhol e inglês, respondido pelos pais ou cuidadores de lactentes com 12 a 15 meses de vida103.
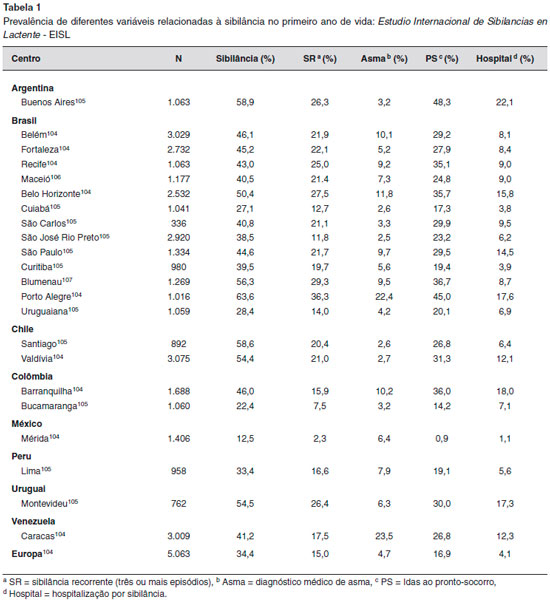
Na Tabela 1 sao apresentados os dados de prevalência obtidos pelo EISL em centros brasileiros, da América Latina, assim como a compilaçao de centros europeus. Nela observamos grande variaçao. No Brasil a prevalência de sibilância alguma vez, no primeiro ano de vida, oscilou entre 27,1% e 63,6%, a de sibilância recorrente entre 11,8% e 36,3%, a de diagnóstico médico de asma entre 2,6% e 24,0% (Tabela 1). As maiores taxas de prevalência foram observadas em Porto Alegre. Por comparaçao simples verificamos que os nossos dados foram superiores aos observados na Europa. Embora parcela significativa de lactentes tenha recebido o diagnóstico de asma por médico, a prescriçao de medicamentos para o seu controle nao foi paralela104. Entre os lactentes com sibilância recorrente foram observadas as maiores taxas de morbidade104,105.
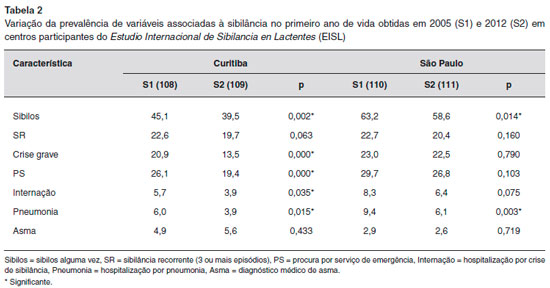
O estudo das taxas de prevalência de sibilância em centros que participaram de duas fases do EISL, intercaladas por período de sete anos, possibilitou avaliar a tendência temporal da prevalência da sibilância. No Brasil, os municípios de Curitiba108,109 e Sao Paulo110,111 participaram dessas duas avaliaçoes (Tabela 2). Houve permanência de valores altos para a prevalência de sibilância no primeiro ano de vida, embora com tendência a queda nos demais. Menores índices de hospitalizaçao por sibilância e procura por serviços de urgência ocorreram em Curitiba (Tabela 2).
Outro desafio com esses pacientes que iniciam quadro de sibilância no primeiro ano de vida é reconhecer quais persistirao com sibilância, e serao definidos como tendo asma. Parte dos lactentes avaliados pelo EISL, em Sao Paulo, Cuiabá e Maceió foi contatada, em média 18 meses após a primeira avaliaçao, para conhecer-se a evoluçao do seu quadro de sibilância. Dos pré-escolares contatados (n = 677), 75,8% permaneciam sem história de sibilância, 7,2% mantiveram sibilância recorrente (sibilância persistente), 9,2% inicialmente identificados como sem sibilância apresentaram piora (sibilância tardia), e 7,8% apresentaram melhora dos sintomas, sendo que 4,2% nao apresentaram mais episódios de sibilância112.
MORBIDADE DA SIBILANCIA EM LACTENTES
Além da frequência de sibilância no primeiro ano de vida entre os lactentes brasileiros, chama-nos à atençao a morbidade elevada que esse quadro determina. Isto pode ser verificado pela frequência de idas a serviço de urgência, que oscilou entre 17,3% e 45,0%, e a de hospitalizaçao por sibilância entre 3,8% e 17,6% (Tabela 1), valores significantemente mais elevados do que os observados na Europa104,105. Entre os SR, a taxa de pneumonias referidas oscilou entre 7,4% e 38,5%105.
PREVALENCIA DE ASMA EM CRIANÇAS
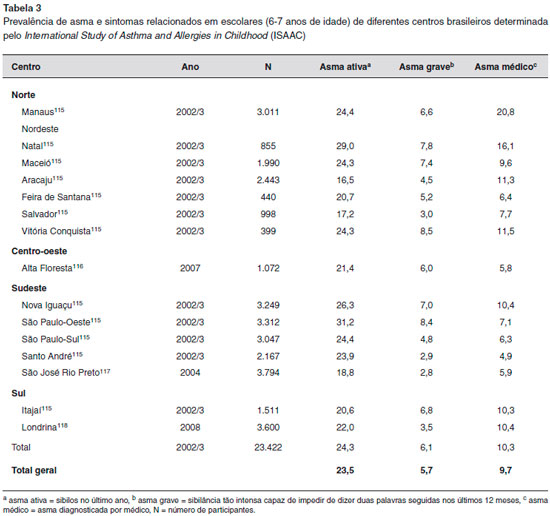
Como resultado da avaliaçao da prevalência de asma entre crianças brasileiras de 6 e 7 anos, empregando-se o protocolo do International Study of Asthma and Allergies in Childhood (ISAAC), verificouse valores variados tanto na primeira avaliaçao113, quanto numa segunda114, intercaladas em média por 7 anos (Tabela 3).
MORTALIDADE POR ASMA EM CRIANÇAS
A implantaçao de programas de combate à asma tem mudado os índices de morbidade e mortalidade até entao conhecidos. O acesso à educaçao sobre asma, além da disponibilizaçao de medicamentos a partir de 2002 para as formas mais graves, têm sido apontados como os principais responsáveis por esses fatos119. Os dados sobre mortalidade por asma em crianças brasileiras de até 19 anos de vida, durante os anos de 1980 a 2007, revelam queda significante da taxa de mortalidade anual por asma, indo de 0,89/100.000 habitantes a 0,30/100.000 habitantes, sendo a queda mais expressiva entre os menores de cinco anos120.
FENOTIPOS DE SIBILANCIA
A presença de sibilância no pré-escolar representa uma condiçao altamente prevalente, atingindo valores no Brasil entre 27,7% e 63,6% para sibilância alguma vez, e entre 13,5% e 36,3% para sibilância recorrente no primeiro ano de vida105. Prever o percentual dessas crianças que serao asmáticas tem sido o dilema da literatura mundial e de pediatras e especialistas que cuidam desses pacientes, buscando formas práticas e nao invasivas para sua definiçao.
O termo "fenótipo" refere-se às características físicas observáveis de um organismo, que incluem a aparência, o desenvolvimento, o comportamento do organismo com sinais e sintomas. O fenótipo de um organismo é determinado primariamente pelo seu genótipo, mas sofre influências ambientais sobre esses genes. A primeira classificaçao de asma em possíveis fenótipos ocorreu há mais de 60 anos, quando se apresentava a asma como extrínseca ou intrínseca121, sendo a asma extrínseca aquela de aparecimento na infância, com história familiar e pessoal de atopia e evidência de sensibilizaçao a alérgenos. Já a asma intrínseca se desenvolvia no adulto sem evidência de atopia, e associada à doença respiratória exacerbada por aspirina (DREA).
Com a descoberta de padroes inflamatórios Th1 e Th2, por muito tempo se acreditou que a asma seria uma única doença com predomínio do componente inflamatório do tipo Th2, onde a obstruçao, hiperresponsividade e o remodelamento seriam suas marcas principais, mas muitos estudos demonstraram sua heterogeneidade, especialmente em adultos e adolescentes e em pacientes mais graves que nao respondiam tao bem aos corticosteroides122,123.
Definir fenótipos baseados em características clínicas, gravidade de sintomas, idade de aparecimento, resposta ao tratamento e mesmo biomarcadores inflamatórios facilitaria a abordagem terapêutica cada vez mais individualizada - o que vem sendo definido como uma terapêutica-alvo ou personalizada. Outra forma de se classificar a asma nas diferentes faixas etárias seria pela divisao em endotipos, definidos por distintos mecanismos funcionais e fisiopatológicos, e cada endotipo pode abranger diferentes fenótipos, e vice-versa124,125.
Os lactentes e pré-escolares apresentam características diferentes dos demais grupos de sibilantes por vários motivos, destacando-se: menor calibre das vias aéreas nos primeiros anos de vida, infecçoes frequentes por agentes virais numa fase de amadurecimento do sistema imunológico, exposiçao passiva à fumaça de cigarro e alérgenos, entre outros, com um número grande de outras causas que poderiam provocar sibilância5.
A descriçao de fenótipos de asma em crianças foi iniciada por estudos de coorte que avaliaram grupos de crianças ao longo de vários anos e que, de maneira retrospectiva, classificaram esses pré-escolares após os seis anos como sibilantes transitórios, sibilantes de início tardio ou persistentes, e descreveram os fatores de risco mais importantes para cada grupo1.
Em 2008, um grupo de trabalho da Sociedade Europeia de Doenças Respiratórias tentou simplificar essa classificaçao em dois grandes grupos: pré-escolares sibilantes após episódios virais ou os com múltiplos desencadeantes. No primeiro grupo, os sintomas seriam desencadeados pelas infecçoes virais, permaneceriam assintomáticos ou oligossintomáticos entre as crises, e teriam maior chance de reduzirem seus sintomas ao longo dos anos. Já o grupo com múltiplos desencadeantes seria mais sintomático entre as crises, e estas nao sao relacionadas aos vírus, e podem incluir crianças com fenótipos preditivos de asma126. No mesmo ano de 2008, foi publicado o consenso PRACTALL sobre diagnóstico e tratamento de asma na criança maior de dois anos, e que subdividiu os fenótipos de asma pela idade de aparecimento dos sintomas e os agentes desencadeantes. Nessa publicaçao, o algoritmo para a classificaçao dos fenótipos se iniciava pela persistência ou nao dos sintomas entre as crises. Em seguida levou-se em conta se os desencadeantes eram apenas os vírus ou exercícios, caracterizando as formas intermitentes. Entre os com sintomas persistentes, os alérgenos podem ser os principais desencadeantes, e há um outro subgrupo de pacientes com asma desencadeada por diferentes etiologias. Em todos os grupos poderiam existir crianças sensibilizadas e consideradas atópicas6.
A maior desvantagem dessa classificaçao é nao poder prever antecipadamente qual seria o grupo em que os pacientes se classificariam ao início da evoluçao, além de apresentar baixo grau de evidência6,126.
Essas tentativas iniciais de classificaçao de grupos de pré-escolares sibilantes levaram ao desenvolvimento de vários índices preditivos de asma que vêm sendo utilizados e adaptados às características populacionais de cada país, e serao discutidos em capítulo a seguir nesta diretriz127,128.
Os fenótipos da asma baseados no tipo de células inflamatórias envolvidas associados à gravidade e à idade de aparecimento da asma têm classificado os pacientes pelo predomínio de células presentes no lavado broncoalveolar em: fenótipos eosinofílico, neutrofílico ou pauci-granulocítico, e com predomínio Th2 ou nao Th2129. Estudo de revisao sobre os fenótipos de asma em todas as faixas etárias propoe a seguinte classificaçao: asma de aparecimento precoce, de maior gravidade e com maior duraçao de exposiçao alérgica como Th2 e com predomínio de inflamaçao alérgica para crianças. Os fenótipos de obesidade e DREA, de aparecimento tardio e relacionados ao fumo de cigarro para os adultos, e no grupo nao Th2 onde poderiam predominar os neutrófilos ou o grupo pauci-granulocítico123.
Em relaçao aos estudos genéticos que poderiam auxiliar na classificaçao fenotípica, ainda nao estao bem definidos os genes responsáveis pela susceptibilidade, gravidade e resposta terapêutica na asma130,131, com alguns estudos promissores buscando os genes relacionados com fatores epigenéticos132.
Revisao sobre a classificaçao dos sibilantes de 2008 pela Sociedade Europeia de Doenças Respiratórias, promovida em 2014, aponta para uma clara variaçao na duraçao dos sintomas e resposta terapêutica, em cada subgrupo de pré-escolares sibilantes, sejam eles anteriormente apontados como sibilantes virais, ou com múltiplos desencadeantes, e sugerem novos estudos que apontem melhores biomarcadores, além dos marcadores clínicos e genéticos133.
Estudos evolutivos de pré-escolares sibilantes classificados como sibilantes virais ou com múltiplos desencadeantes, apontavam para a boa evoluçao dos casos de início precoce e com desencadeantes virais e sem sinais de atopia, tornando-se assintomáticos ou com baixo risco para asma após os cinco anos, ao contrário do grupo com múltiplos desencadeantes e atópicos134. Por outro lado, outros estudos longitudinais mostraram que até 80% dos pré-escolares sibilantes tiveram sua classificaçao modificada ao longo da evoluçao135-137, com as mais variadas mudanças entre os grupos nao sibilantes, sibilantes virais e sibilantes a múltiplos desencadeantes138.
A classificaçao fenotípica mais utilizada e encontrada nos estudos evolutivos ainda permanece com os dois principais tipos: sibilantes apenas com desencadeantes virais, e os com múltiplos desencadeantes, nao obstante as críticas e o baixo grau de evidências dessa categorizaçao135-139.
Concluindo, a Iniciativa Global para Asma (GINA5) em sua revisao mais recente aponta as dificuldades do uso dessas classificaçoes fenotípicas na clínica diária, pela grande variaçao dos sibilantes em fase pré-escolar ao longo do tempo, tanto em seus aspectos clínicos como na gravidade e resposta terapêutica. Sugere o uso de dados pessoais e familiares de atopia, acompanhamento de sintomas, avaliaçao inicial de atopia e triagem terapêutica como elementos para a boa evoluçao desses pacientes e um seguimento mais atento e regular para intervençoes mais precoces, na expectativa de melhores definiçoes de classificaçao ou de biomarcadores para esse grupo de sibilantes tao frequente e variável5.
DIAGNOSTICO DA ASMA NO LACTENTE E NO PRÉ-ESCOLAR
Clínico
O diagnóstico de sibilância recorrente e asma no lactente e no pré-escolar sao essencialmente clínicos, e a presença de sibilância, tosse, desconforto respiratório e despertares noturnos de natureza contínua ou recorrente, sao os achados principais.
Sibilância é o sintoma chave, e o pediatra deve estar atento que frequentemente os pais, e até mesmo os profissionais de saúde, confundem o sintoma com roncos e estridor140,141. Um inquérito envolvendo 196 menores de cinco anos atendidos em um centro de cuidados terciários de pediatria do Sistema Unico de Saúde (SUS) em Pernambuco mostrou por questionário que cerca de 50% das crianças sibilaram alguma vez na vida. No entanto, a superestimaçao do sintoma foi de quase duas vezes maior quando se comparou com um vídeo-questionário142. Auxiliam no diagnóstico de asma a história de melhora dos sintomas com uso de broncodilador administrado pela via inalatória, além de antecedentes pessoais de doença alérgica e familiares de asma/alergia. Para que se determine resposta positiva a broncodilatador, é necessário levar em conta se a dosagem e a forma de administraçao dos fármacos sao adequadas (aqui compreendido o tamanho adequado da máscara facial e sua correta adaptaçao ao rosto), o que muito frequentemente nao ocorre143.
O diagnóstico de asma em pré-escolares e nos mais jovens é difícil, uma vez que sibilância e tosse sao comuns em crianças sem asma e os exames complementares sao pouco úteis5. Desta forma, muitas vezes é possível apenas o diagnóstico sindrômico de sibilância recorrente, e somente o seguimento até a idade escolar ou posterior permite uma definiçao etiológica mais precisa.
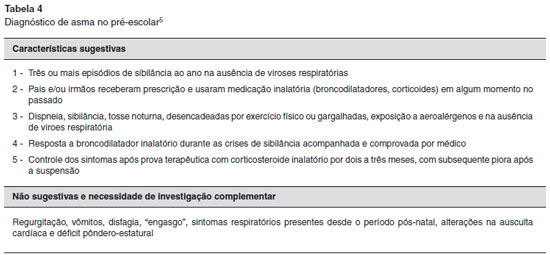
Assim sendo, o diagnóstico clínico fundamenta-se na anamnese detalhada e exame físico cuidadoso, formulaçao do diagnóstico diferencial e monitoramento rigoroso, ou seja, o diagnóstico deve ser feito em bases clínicas como nas crianças maiores, adolescentes e adultos (Tabela 4).
Indices preditivos
O desenvolvimento de qualquer regra de prediçao clínica inclui inicialmente a sua criaçao, que deverá ser posteriormente validada, e finalmente ter sua utilidade analisada no comportamento do profissional médico e os seus respectivos desfechos clínicos em diferentes contextos e realidades de saúde. No entanto, a maioria dessas regras de prediçao nao vai além da fase de criaçao, e este é o caso dos índices preditivos para asma. Muito difundida entre pediatras, o exemplo clássico de uma regra de prediçao bem-sucedida é o escore de Apgar, ampla e universalmente utilizada há décadas.
Apresentados e por vezes defendidos como métodos de prediçao de asma ao final do período pré-escolar, estes índices ficaram intimamente relacionados, nao apenas com as formas de expressao desta enfermidade e à probabilidade de asma ativa, mas também, equivocadamente, passaram a ser adotados como critérios diagnósticos de asma na idade pré-escolar140.
Várias regras de prediçao foram desenvolvidas para auxiliar o clínico no diagnóstico de asma em pré-escolares, e a multiplicidade delas revela a dificuldade no desenvolvimento de uma regra de ampla aceitaçao, como é o caso do escore de Apgar. Entre elas se encontram, Asthma Predictive Index (API)144, Cumulative risk score of the Isle of Wright birth cohort (Pontuaçao de risco cumulativa da coorte de nascimentos da Ilha de Wright)145, Severity score for obstructive airway disease (Pontuaçao de gravidade da doença obstrutiva das vias aéreas)146, que de fato é uma extensao do escore de gravidade anterior, os dois fenótipos propostos pela European Respiratory Society (multitrigger wheeze e episodic viral wheeze)126, Practical Allergy (PRACTALL)6,147, Avon Longitudinal Study of Parents and Children (ALSPAC)148 e Dutch Prevention and Incidence of Asthma and Mite Allergy (Prevençao e Incidência Holandesa de Asma e Alergia ao Acaro, conhecida pela sigla PIAMA)149.
A generalizaçao das regras de prediçao para contextos distintos daquele em que ela foi desenvolvida poderia desdobrar-se no seu emprego amplo na prática clínica. No entanto, esse nao é o caso, por vários motivos. A falta de um padrao ouro para diagnosticar a asma no período pré-escolar é uma importante lacuna das regras de prediçao. Ademais, a definiçao de asma difere entre os estudos que desenvolveram as regras de prediçao acima mencionadas. Além do fato de que ainda é desconhecida a definiçao de asma que realmente identifica a doença neste grupo etário, o que prejudica a comparaçao das regras de prediçao entre si, o objetivo da regra de prediçao deve ser claro: será utilizada como instrumento de triagem diagnóstica (para descartar a asma numa populaçao de pré-escolares), ou como uma ferramenta de diagnóstico (para identificar crianças com maior risco de desenvolvimento de asma em uma populaçao com alta prevalência desta doença)?
É possível identificar várias limitaçoes na acurácia desses índices preditivos na sua habilidade para diagnosticar asma no pré-escolar, a saber:
1) têm baixa sensibilidade (menor que 50%, ou seja, aos seis anos serao verdadeiramente asmáticos menos da metade dos indivíduos diagnosticados com asma no período pré-escolar); valor preditivo positivo baixo (menor que 80%, ou seja, préescolares diagnosticados como asmáticos terao risco considerável de ser falsamente considerados como asmáticos aos seis anos) e, principalmente, razao de probabilidade ou de verossimilhança reduzida (likelihood ratio, em inglês), cujo valor, em geral, nao ultrapassa 5,0, como é o caso do API2 e do PIAMA149. O escore desenvolvido por Pescatore e colaboradores constitui a única exceçao, pois que, dependendo do ponto de corte, este índice pode atingir valores superiores a 10,0150. E este é um critério fundamental, pois para ser clinicamente útil este valor deveria ser igual ou superior a 10,0. A constataçao geral é que, para a imensa maioria das regras de prediçao disponíveis, é de apenas cinco vezes maior a probabilidade de uma dada regra ser confirmada aos seis anos, quando no período pré-escolar asmáticos sao comparados com nao-asmáticos;
2) como dito anteriormente, nenhum desses índices foi validado de forma independente em populaçoes diferentes daquelas em que foram desenvolvidos, originalmente aplicados e avaliados, entre as quais se incluem pré-escolares brasileiros151;
3) embora frequentemente empregados para estratificar ou selecionar pacientes em ensaios clínicos, há controvérsias se as crianças com escores preditivos positivos e negativos para asma respondem de forma efetivamente diferente às abordagens terapêuticas e, finalmente;
4) há evidências que sugerem que o desaparecimento de sintomas de asma no período pré-escolar pode nao se correlacionar com a ausência de sequelas futuras (remodelamento brônquico, por exemplo)143.
Em conclusao, as regras de prediçao atualmente disponíveis que visam identificar crianças pré-escolares com asma na idade escolar sao de valor clínico modesto. Ademais, até que surjam novos estudos, a utilizaçao de alguma das citadas regras de prediçao na prática clínica pode afetar negativamente o julgamento clínico clássico, baseado em anamnese e exame físico rigoroso e aprofundado152.
Laboratorial (alérgico e funcional)
Alérgico
Para o diagnóstico de alergia é necessária a correlaçao entre história clínica e exposiçao153. Pode-se suspeitar de alergia pela anamnese e exame físico, mas a confirmaçao deve ser baseada na detecçao de IgE sérica específica (sIgE) ao alérgeno suspeito. A presença de sIgE mostra que há sensibilizaçao ao alérgeno sob investigaçao, que nao obrigatoriamente é a causa dos sintomas153.
Métodos in vivo
Teste cutâneo de hipersensibilidade imediata (TCHI) ou prick test
O TCHI é a ferramenta mais comumente utilizada pelo alergista para a pesquisa da sIgE em decorrência da facilidade da técnica, alta sensibilidade, resultado rápido, custo relativamente baixo, além de poder ser realizado ambulatorialmente. A resposta cutânea imediata resulta da açao de mediadores inflamatórios e neurogênicos. Entre os primeiros, a histamina, liberada pelos mastócitos teciduais, produz vasodilataçao e aumento da permeabilidade capilar, determinando o aparecimento de pápulas, geralmente acompanhadas por um halo eritematoso154.
Devem ser empregados extratos comerciais de alérgenos de procedência idônea e mantidos em condiçoes adequadas de refrigeraçao, selecionados com base nos dados da anamnese e no conhecimento do ambiente do paciente.
A técnica consiste na deposiçao de gotas dos extratos alergênicos padronizados, do controle positivo e do controle negativo na regiao volar do antebraço, estando a pele sem lesoes que interfiram na leitura do teste, com espaço de pelo menos 2 cm entre uma gota e outra. Com o auxílio de um puntor, lanceta ou agulha apropriada, pressiona-se levemente a pele através da gota, produzindo um pequeno orifício na epiderme, sem que ocorra sangramento. Para cada uma das substâncias testadas, deve-se utilizar diferentes puntores. A leitura deve ser feita após 15 a 20 minutos, medindo-se os maiores diâmetros das pápulas e os a eles perpendiculares pelo seu ponto médio, que devem ser somados e divididos por dois, obtendo-se o diâmetro médio. Resultados do diâmetro médio iguais ou superiores a 3 mm sao considerados positivos e indicam sensibilizaçao àquele alérgeno155.
A correlaçao entre os resultados positivos do TCHI e os sintomas é maior entre os aeroalérgenos do que entre os alérgenos alimentares, conferindo alta sensibilidade e especificidade ao teste, especialmente no diagnóstico de asma e rinite alérgica.
A deposiçao dos extratos com intervalo menor do que 2 cm entre eles pode tornar as reaçoes indistinguíveis, comprometendo a leitura dos resultados, assim como a induçao de sangramento e a presença de dermografismo (falsos positivos), e a penetraçao insuficiente do puntor (falsos negativos). Crianças jovens, mais frequentemente antes dos dois anos, podem apresentar diminuiçao da reatividade cutânea e menor liberaçao de histamina local, influenciando os resultados dos TCHI. O uso contínuo ou prolongado de alguns medicamentos, especialmente anti-histamínicos, antidepressivos e corticosteroides, inclusive os tópicos, reduzem a reatividade cutânea, devendo ser suspensos antes da realizaçao dos testes, por períodos determinados pela farmacocinética de cada um. Anti-histamínicos clássicos bloqueiam a reatividade por até 24 horas, enquanto que os de segunda geraçao podem manter esse efeito por até 10 dias156.
Os testes cutâneos devem ser realizados por profissional treinado, sempre na presença de um médico e em local que disponha de equipamento de emergência, pois, embora geralmente seguros, existem riscos de reaçoes adversas graves. Deve-se evitar realizar o teste durante exacerbaçoes.
Os aeroalérgenos mais importantes no Brasil pertencem aos ácaros das espécies Dermatophagoides pteronyssinus, Dermatophagoides farinae, Blomia tropicalis, baratas (Periplaneta americana) e epitélios de cao e gato157.
Métodos in vitro
IgE sérica específica (sIgE)
A determinaçao da concentraçao da IgE sérica total tem valor limitado no diagnóstico de alergia, sendo realizada como um exame de triagem. Níveis séricos elevados de IgE total sugerem a possibilidade de sensibilizaçao, no entanto, valores normais nao sao capazes de excluí-la158.
A investigaçao da sensibilizaçao alérgica in vitro se baseia na determinaçao da concentraçao de sIgE originalmente pelo teste de quimioluminescência (emissao de luz). O teste imunoenzimático ELISA (Enzyme-linked immuno sorbent assay) permitiu a detecçao de todas as classes de anticorpos. O RAST (teste de radioalergosorvência) foi uma variaçao do ELISA, empregado por muito tempo. Atualmente, foi substituído pelo método de fluorescência enzimática, de maior sensibilidade159,160.
Basicamente, o soro a ser investigado é colocado em uma cápsula com estrutura de celulose, semelhante a uma esponja, à qual se encontram aderidos 25 µg do alérgeno a ser estudado. Caso o soro contenha a sIgE para o alérgeno em questao, ocorre a ligaçao antígeno-anticorpo. A estrutura de celulose permite uma ampla superfície de adesao, minimizando a possibilidade de que excedentes de IgE nao encontrem locais de adesao. Após a lavagem do sobrenadante, acrescenta-se uma soluçao com anticorpos anti-IgE marcados com uma enzima, os quais aderem ao complexo formado anteriormente. O anti-IgE nao ligado é removido por lavagem e o complexo é incubado com substrato acoplado à enzima. A reaçao é suspensa num determinado tempo, e a fluorescência do eluido é mensurada, sendo diretamente proporcional à quantidade de sIgE da amostra. Trata-se de um teste quantitativo, com resultados expressos em kilounidades por litro e limite de variaçao entre 0,10 kU/L e 100 kU/L para a sIgE, com especificidade entre 84% e 95%, e sensibilidade entre 85% e 94%. Valores iguais ou superiores a 0,35 kU/L caracterizam a presença de sensibilizaçao ao alérgeno avaliado161.
Os métodos in vitro, apesar de mais onerosos, podem ser realizados em pacientes impossibilitados de serem avaliados pelos testes cutâneos, ou quando a finalidade é a complementaçao destes6. Com o emprego desses métodos, a pesquisa da sIgE pode ser realizada em qualquer faixa etária, sendo indicada nas manifestaçoes alérgicas cuja fisiopatogenia envolva a sua produçao. A correlaçao com a história clínica torna-se necessária para o diagnóstico de alergia, da mesma forma que ocorre com o TCHI.
Quanto maior o nível de sIgE, maior a chance de o indivíduo ser alérgico, ou seja, apresentar sintomas. Os valores de sIgE que determinam o diagnóstico sao chamados de valores de corte, devem ser considerados no contexto em que foram estabelecidos, e nunca serem extrapolados para outras populaçoes.
Diagnóstico resolvido por componentes (CRD)
Com o avanço da tecnologia molecular, utilizando o mesmo método de imunofluorescência enzimática, tornou-se possível investigar a sensibilizaçao direcionada aos componentes constituintes da fonte alergênica, teste conhecido como Component Resolved Diagnosis (CRD).
A sensibilizaçao a componentes específicos pode adicionar informaçoes, como identificar se a sensibilizaçao é genuína (causada por determinada fonte) ou cruzada (causada por outra fonte), e elaborar prognósticos, pelo conhecimento de que a sensibilizaçao a determinados componentes se associa a alto risco de reaçao grave (geralmente em alergia alimentar)162-164.
A investigaçao de sIgE pelo CRD pode ser solicitada para cada componente isoladamente, ou pelo painel fixo de 112 componentes alergênicos, o ImmunoCAP-ISAC® (microarray), exame útil em casos de polissensibilizaçao163.
Funcional
A avaliaçao da funçao pulmonar tem importante papel no diagnóstico da asma nas crianças maiores e nos adultos. Seu uso nos lactentes e pré-escolares, entretanto, é limitado pelas dificuldades técnicas na realizaçao destes exames nessa faixa etária164. Apesar disso, a documentaçao de obstruçao ao fluxo aéreo e de reversibilidade brônquica, duas características importantes da asma, seguramente podem contribuir no diagnóstico da doença, particularmente nas crianças pequenas que nao apresentem manifestaçoes clínicas típicas5,165. Além do diagnóstico, a avaliaçao da funçao pulmonar nos indivíduos com asma também é relevante no seguimento e no manejo farmacológico da doença.
a) Lactentes
O estudo da funçao pulmonar em lactentes possibilitou avanços importantes no entendimento da asma e da sibilância nas crianças, como na definiçao dos fenótipos de sibilância na infância, no entendimento do impacto das infecçoes virais e de diferentes fatores genéticos e ambientais na origem da doença, além do papel de diferentes medicamentos166. Apesar da sua importância na pesquisa, a avaliaçao da funçao pulmonar em lactentes teve pouco impacto no manejo e diagnóstico da asma na prática médica, uma vez que é realizada apenas em poucos centros de pesquisa. Os exames nessa faixa etária normalmente necessitam sedaçao, equipamentos caros e sofisticados e equipe altamente especializada.
Diferentes técnicas de avaliaçao da funçao pulmonar em lactentes já foram desenvolvidas e padronizadas, como a análise da respiraçao corrente, da mecânica respiratória passiva, pletismografia de corpo total e curvas expiratórias forçadas167-170. Além das dificuldades técnicas na realizaçao dos exames, a interpretaçao dos resultados dos lactentes no cenário clínico também pode ser prejudicada pela falta de valores de referência apropriados, e pela sobreposiçao dos valores encontrados nos lactentes sadios e doentes171.
b) Pré-escolares
Espirometria
A espirometria é o principal teste de funçao pulmonar empregado no diagnóstico e seguimento de crianças e adultos com asma. Apesar de tradicionalmente ser realizada apenas em crianças com idade igual ou superior a seis anos, parte considerável das crianças pré-escolares é capaz de realizar manobras espirométricas de modo adequado165. Treinamento prévio da criança, equipe experiente do laboratório e programas interativos de incentivo aumentam a probabilidade de sucesso dos testes nas crianças pequenas.
Os critérios para aceitar as manobras e para interpretar os testes sao um pouco diferentes nos pré-escolares, e as principais particularidades sao mostradas na Tabela 5. Crianças pequenas muitas vezes terminam a expiraçao antes de um segundo, e volumes expiratórios forçados (VEFt) com tempos menores devem ser avaliados (VEF0,75 e VEF0,5). Dados de estudos nacionais mostram diferentes taxas de sucesso na realizaçao de espirometrias aceitáveis por pré-escolares, variando de 46%172 a 85%173, com incremento progressivo conforme a idade172. Ainda nao há consenso sobre os pontos de corte mais adequados para a análise da resposta ao broncodilatador nessa faixa etária171.
Oscilometria de impulso
A oscilometria de impulso (IOS) é uma técnica simples e nao invasiva que avalia a funçao pulmonar durante a respiraçao corrente, sem necessidade da realizaçao de manobras respiratórias165,174. Por estas características, a IOS tem sido considerada uma técnica particularmente interessante de se empregar em crianças na idade pré-escolar165,174. Nesta técnica é possível mensurar a impedância pulmonar e seus componentes (resistência [R] e reactância [X]) em diferentes frequências (5 a 20 Hz)175. Nas crianças com asma é possível observar padrao obstrutivo, com aumento de R5 e de outros parâmetros (frequência de ressonância [Fres] e R5-20), além de reduçao de X5 (valores mais negativos)176. Em crianças maiores, considera-se resposta positiva ao broncodilatador quando há reduçao nos valores de R5 entre 25% e 35%174,176. A IOS tem sido empregada como método auxiliar no diagnóstico da asma em pré-escolares, assim como no monitoramento clínico, podendo ser empregada como método alternativo ou complementar à espirometria177.
DIAGNOSTICO DIFERENCIAL
O diagnóstico da asma em pré-escolares é complexo, uma vez que nessa faixa etária há maior dificuldade e limitaçoes para realizaçao das provas funcionais e alérgicas, além de um maior número de possíveis diagnósticos alternativos. Dados extraídos da anamnese e do exame físico sao fundamentais na confirmaçao do diagnóstico de asma, ou na suspeiçao de diagnósticos alternativos.
A sibilância respiratória tem sido tradicionalmente usada para definir a asma em crianças pequenas. No entanto, outras doenças que se manifestam com sibilância, tosse e falta de ar devem ser consideradas e excluídas antes de confirmar o diagnóstico de asma no pré-escolar5, especialmente em casos de asma grave ou de difícil controle178.
A presença de infecçoes de vias aéreas de repetiçao, sintomas neonatais ou muito precoces, desenvolvimento pôndero-estatural inadequado, vômitos associados a sintomas respiratórios, sinais pulmonares focais, hipoxemia na ausência de quadros infecciosos agudos e alteraçoes cardiovasculares sugerem um diagnóstico alternativo para asma. Ainda, é de suma importância questionar a possibilidade de outro diagnóstico quando há ausência de associaçao dos sintomas com os desencadeantes típicos, como infecçoes virais das vias aéreas, quando nao houver resposta esperada ao tratamento de controle da asma, ou na presença de sibilância contínua5.
A descriçao dos pais sobre a tosse, a falta de ar e a sibilância e seu padrao podem direcionar o raciocínio ao avaliar uma criança com provável doença de vias aéreas. Alguns distúrbios das vias aéreas produzem sintomas de forma persistente, como as malformaçoes e doenças cardíacas, enquanto outros, como a asma, sibilância transitória induzida por vírus e síndromes aspirativas sao intermitentes, e este padrao pode ajudar no raciocínio diagnóstico179.
Embora a sibilância seja tradicionalmente o sintoma mais associado à asma, a tosse e a falta de ar podem ser tao comuns quanto a sibilância na infância. Nesta faixa etária, a ausculta do sibilo pelo médico nao é um pré-requisito para o diagnóstico de asma, e uma avaliaçao global quantitativa de sintomas pulmonares significativos nos primeiros três anos de vida seria um melhor preditor de asma do que apenas a avaliaçao da presença da sibilância180. Assim, a tosse crônica, quando persiste por mais de quatro semanas, deve ser avaliada considerando-se a asma um possível diagnóstico, especialmente se há melhora após uso de corticosteroide oral. Outras causas de tosse crônica devem ser afastadas, e a avaliaçao detalhada ajudará a definir o tratamento de manutençao apropriado181.
Dentre os possíveis diagnósticos diferenciais, destacam-se: anormalidades estruturais das vias aéreas, obstruçao intrabrônquica, aspiraçao de corpo estranho, refluxo gastroesofágico com microaspiraçao recorrente, fibrose cística, imunodeficiências, bronquiectasias, doença pulmonar da prematuridade, síndrome da bronquiolite obliterante. A maioria destas condiçoes exigirá referência ao especialista, se houver suspeita pelo pediatra178 (Tabela 6).
A investigaçao de diagnósticos alternativos à asma, quando suspeitada, deve ser dirigida pela história clínica e pelo exame físico, com a solicitaçao de exames complementares específicos para cada caso. Riscos e benefícios potenciais de cada teste devem ser considerados.
AVALIAÇAO E CLASSIFICAÇAO DA ASMA
Os objetivos finais do tratamento da asma sao atingir e manter o controle clínico, reduzir riscos futuros ao paciente e permitir que o mesmo tenha uma vida sem restriçoes decorrentes da doença5,6,182-185.
O conceito de controle da asma é abordado em todos os consensos de tratamento da asma, e o nível de controle está relacionado à terapêutica necessária para a obtençao do mesmo, controle dos sintomas presentes com o exercício, despertares noturnos, uso de medicaçao de alívio e a capacidade de executar as atividades diárias.
Os riscos de longo prazo ao paciente com controle precário além das exacerbaçoes de asma incluem restriçao ou aceleraçao da perda da funçao pulmonar e os efeitos adversos decorrentes do tratamento.
Apesar da utilizaçao de medicaçao efetiva, muitas crianças nao atingem o controle adequado da asma3,186. Isto acarreta implicaçoes na qualidade de vida, da atividade física diária e impacta nos custos familiares e sociais da doença.
A conduta na asma deve ser ajustada continuamente de acordo com o nível de controle, objetivando-se manter a doença controlada e a vida do paciente sem ou com pouca limitaçao. Desta forma, a monitorizaçao contínua é essencial nestas crianças, bem como proporcionar um ótimo controle com a menor dosagem de medicaçao necessária, minimizando os custos e reduzindo os possíveis efeitos adversos das medicaçoes5.
O controle da asma pode ser avaliado utilizandose diversos indicadores, como sintomas (frequência, intensidade, etc.), consumo de medicaçao, limitaçao de atividades, ou por medidas objetivas como avaliaçao da funçao pulmonar ou de marcadores inflamatórios que refletem o mecanismo fisiopatológico que envolve a doença.
Os aspectos da doença passíveis de variaçao com o tratamento devem receber especial atençao, como a frequência e a gravidade dos sintomas, mudanças na funçao pulmonar, o grau de inflamaçao e de hiper-responsividade brônquica. Estas podem coexistir em combinaçoes diversas para diferentes pacientes; entretanto, até o momento evidências de como integrar todas estas características para a monitorizaçao ótima da criança com asma ainda sao limitadas.
A definiçao de controle baseada no monitoramento de parâmetros inflamatórios como eosinófilos no escarro e fraçao exalada do óxido nítrico (FeNO) pode talvez ajudar a avaliar de forma mais específica e detalhada o controle em comparaçao ao definido apenas por sintomas clínicos, funçao pulmonar e hiper-responsividade brônquica187.
A variabilidade dos sintomas da asma, bem como os dados objetivos encontrados durante a infância serao determinantes no desafio para decidir o que, quando, como, quao frequente, para quem e em quem, diferentes formas de avaliaçao da asma deverao ser realizadas, para a indicaçao do melhor tratamento.
Variabilidade em termos de gravidade, apresentaçao clínica, exacerbaçoes, comorbidades, idade, estado socioeconômico, fatores psicossociais e exposiçoes ambientais podem influenciar nas estratégias de monitorizaçao. O ideal seria que o monitoramento da asma em crianças considerasse todos estes aspectos, mas nao existe uma diretriz clara sobre a qual pudéssemos integrar todas estas variáveis na avaliaçao individual do paciente.
Segundo a atualizaçao do GINA5, definir satisfatoriamente o controle dos sintomas em crianças menores de cinco anos é problemático. Nessa idade os profissionais de saúde sao totalmente dependentes dos relatos dos familiares ou dos cuidadores, que muitas vezes nao conseguem identificar a presença de sintomas da asma, nem sao capazes de relacioná-los com um quadro de descontrole da doença.
A Tabela 7 apresenta esquema de avaliaçao do controle da asma em crianças com cinco anos ou menos, baseado na opiniao de especialistas. Sao incorporados: avaliaçao dos sintomas, nível de atividade e a necessidade de tratamento de alívio/resgate (A) e também a avaliaçao dos fatores de risco para desfechos indesejados (B)5.
TRATAMENTO DE MANUTENÇAO DA ASMA
Fármacos
O tratamento farmacológico da asma persistente é composto por medicaçoes de controle e terapias adicionais5.
As medicaçoes de controle sao para uso regular no tratamento de manutençao, reduzem a inflamaçao das vias aéreas, controlam os sintomas e reduzem os riscos futuros, como exacerbaçoes e perda da funçao pulmonar. Nesta categoria estao representados os corticosteroides inalatórios como droga de escolha5.
Os medicamentos adicionais, utilizados em pacientes com asma grave, devem ser considerados quando a criança apresenta sintomas persistentes e/ou exacerbaçoes, mesmo utilizando medicaçoes de controle em doses altas e tratando os fatores de risco modificáveis. Neste grupo estao representados os agonistas de receptores β-2 adrenérgicos de longa duraçao (liberados para maiores de 4 anos), os antagonistas dos receptores de leucotrienos (ARLT)188,189 e o tiotrópio, um antagonista muscarínico de longa açao, liberado para maiores de seis anos (LAMA)5,190,191 e a anti-IgE (omalizumabe), apenas para pacientes com asma grave, é recomendada para crianças maiores de seis anos5,192,193.
O controle adequado da asma pode ser atingido na maioria das crianças a partir de uma estratégia farmacológica definida, com parceria estabelecida entre os pais/cuidadores e os profissionais de saúde. Assim como em outras doenças crônicas, o tratamento farmacológico é parte dos pontos-chave para o sucesso do controle da asma, como educaçao, treinar habilidades e aderência dos dispositivos inalatórios, controle ambiental, monitoramento regular e revisao clínica periódica5.
A recomendaçao de tratamento em pré-escolares deve responder questoes como: (a) a medicaçao de escolha nos passos de tratamento para o controle da asma minimiza riscos futuros?; (b) resposta a tratamentos prévios; (c) preferências dos pais; (d) pontos práticos (custo, técnica e aderência)5.
Assim como para escolares e adolescentes, o manejo farmacológico passo a passo também está indicado nas crianças pré-escolares. Neste contexto, devemos identificar quais crianças devem receber prescriçao de tratamento regular.
Crianças com episódios de sibilância intermitente, de qualquer gravidade, ocasionados por vírus, episódios sazonais ou asma induzida por alérgeno, ou asma nao diagnosticada nao controlada devem receber como tratamento inicial da crise aguda, agentes β-2 agonistas de curta açao (SABA) a cada 4 a 6 horas, por um ou mais dias, até que os sintomas desapareçam5.
No entanto, se os sintomas sugerem o diagnóstico de asma, com sintomas respiratórios nao controlados e/ou episódios de sibilância frequentes, o tratamento regular de controle deve ser indicado. Episódios graves de sibilância induzida por vírus, mesmo que com menor frequência, podem também indicar tratamento regular para controle5.
Se o diagnóstico de asma é duvidoso, e o uso de SABA precisa ser repetido frequentemente (a cada 6 a 8 semanas, por exemplo), prova terapêutica com corticosteroide inalatório deve ser considerada para confirmar o quanto os sintomas sao ocasionados pela asma5.
Consideraçoes devem ser feitas antes de iniciar o tratamento passo a passo:
a) confirmar o diagnóstico de asma e, se verdadeiro, iniciar tratamento;
b) checar e corrigir técnica do inalador;
c) verificar aderência ao tratamento;
d) inquirir sobre fatores de risco, alérgenos e exposiçao ao tabaco;
e) casos duvidosos e de difícil abordagem, encaminhar ao especialista.
Passo 1
Agente β-2 agonista de curta açao quando necessário.
Passo 2
Dose baixa de corticosteroide inalatório (CI) (Tabela 8) por pelo menos três meses para avaliar a eficácia e controle da asma. O uso de monoterapia com ARLT reduz pouco os sintomas e a necessidade de uso de corticosteroide oral (CO), tanto de modo regular ou administrado de modo intermitente189. O uso de CI intermitente pode ser considerado, mas apenas após o emprego de tratamento de modo regular194,195.
Passo 3
Dose média de CI usada regularmente (dobro da dose baixa diária). Considerar a possibilidade de associar ARLT à dose baixa de CI.
Passo 4
Encaminhar ao especialista se nao houver controle da asma, se as exacerbaçoes persistirem, ou na suspeita de eventos adversos do tratamento. O melhor tratamento neste passo nao está bem estabelecido.
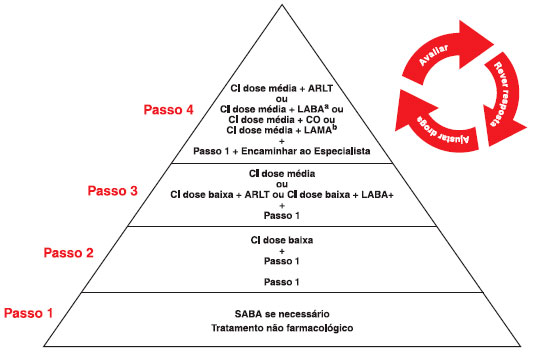
Figura 2 Abordagem terapêutica passo a passo da asma em pré-escolares5
CI = corticosteroide inalatório, ARLT = antagonista do receptor de leucotrieno, LABA = beta agonistas de longa duraçao, LAMA = antagonista muscarínico de longa açao, SABA = β-2 agonista de curta duraçao. a para maiores de 4 anos de idade, b para maiores de 6 anos de idade.
Aumentar a dose de CI, associar ARLT, teofilina ou uma dose de CO ou ainda adicionar CI intermitente ao CI regular por algumas poucas semanas até o controle pode ser benéfico5.
Apesar do tiotrópio ser indicado atualmente como terapia adicional para crianças maiores de 6 anos, nos passos 4 e 5 do GINA5, o estudo Nino-Tina envolveu 101 crianças com idades entre 1 e 5 anos (média = 3,1±1,4 anos) com asma persistente (há mais de 6 meses), em uso de CI em dose estável como monoterapia ou associado a outra terapia adicional por pelo menos quatro semanas e parcialmente controlados de acordo com GINA. Houve comparaçao de maneira duplo-cega e controlada com placebo, quanto à segurança e eficácia do tiotrópio (Respimat®) em três braços de tratamento, com dose única noturna (2,5 µg, 5 µg e placebo) por 12 semanas. O tiotrópio, liberado para crianças maiores de seis anos de idade, mostrou-se seguro e reduziu as exacerbaçoes da asma190.
Eventos adversos foram pouco avaliados com o uso de CI nesta populaçao, e estudo em pré-puberes tratados por 1 a 2 anos mostrou haver reduçao na velocidade de crescimento, com perda de 0,7% da estatura alvo; no entanto, o nao controle da asma por si só tem sido capaz de afetar a estatura na fase adulta196.
Dispositivos inalatórios
A via de administraçao de escolha dos medicamentos para tratar boa parte das doenças respiratórias, assim como a asma, é a inalatória, através da qual se depositam as drogas diretamente no órgao envolvido, o que exige doses menores para alcançar os efeitos desejados num curto intervalo de tempo. A utilizaçao destes dispositivos deve ser adequada, para que os medicamentos tenham seus efeitos esperados. Grande número de pacientes nao apresenta um controle adequado da doença devido ao uso inadequado dos dispositivos inalatórios prescritos por seus médicos5,197,198.
Atualmente estao disponíveis os nebulizadores de jato, os ultrassônicos, os de rede ou malha (mesh), os inaladores dosimetrados pressurizados e os inaladores de pó como opçoes capazes de otimizar a deposiçao dos medicamentos nas vias aéreas inferiores. Dispositivos modernos lançados nos últimos anos produzem uma espécie de névoa suave sem propelente, proporcionando melhor eficiência na deposiçao pulmonar199.
A funçao primordial dos dispositivos inalatórios é a produçao de aerossóis, soluçoes ou suspensoes de partículas sólidas em um gás197, com a capacidade de se depositar nas pequenas vias aéreas200.
A deposiçao pulmonar média dos aerossóis terapêuticos pode variar muito, dependendo do tipo de dispositivo utilizado, da técnica aplicada, da formulaçao em questao e do grau de obstruçao das vias aéreas201, partindo de menos de 10% e podendo alcançar até 60% da dose nominal, quando a técnica é adequada197,202.
Para os pré-escolares, devido à falta de coordenaçao inspiratória, utiliza-se somente os inaladores em spray e, eventualmente, os nebulizadores, por se observar maior facilidade em utilizar corretamente esses dispositivos. Respirando normalmente dentro da máscara, inalam o medicamento de forma adequada.
1 - Inaladores dosimetrados pressurizados (IDP)
Os IDP sao dispositivos de baixo custo, pequenos e fáceis de transportar, estao disponíveis para vários fármacos, o que facilita a aderência às diferentes modalidades do tratamento da asma (corticosteroides e agonistas beta-adrenérgicos). Atualmente, o propelente no qual as partículas micronizadas da droga estao dispersas é o hidrofluoralcano (HFA), que afeta menos a camada de ozônio e produz um jato mais lento e com partículas ainda menores do que se obtinha com seu antecessor, o clorofluorcarbono (CFC), aumentando a deposiçao pulmonar202.
As técnicas de uso dos IDPs podem ser didaticamente relacionadas com a faixa etária do paciente. Em crianças menores de seis anos nao utilizamos o spray sem o espaçador5.
Espaçadores
Consistem em tubos simples ou extensoes, preferencialmente bivalvulados, dotados de válvula ins e expiratória, utilizados como recurso auxiliar na otimizaçao da terapêutica inalatória. Ao atravessar o seu percurso no interior do espaçador, o jato perde velocidade, diminuindo a impactaçao na orofaringe, e o propelente contido no aerossol evapora, reduzindo o tamanho das partículas do medicamento203. Boa parte das partículas que permanecem grandes fica retida no interior do espaçador, ao invés de se depositar na boca e orofaringe, o que reduz a absorçao sistêmica e os efeitos locais indesejados dos medicamentos inalados.
Os espaçadores disponíveis no mercado sao produzidos em plástico ou metal. Os plásticos, mais baratos, por serem materiais maus condutores, acumulam carga eletrostática à medida que sao manuseados diariamente, e, por isso, podem reter em suas paredes uma quantidade significativa de partículas terapêuticas dos aerossóis. Sendo assim, foi demonstrado que o tratamento periódico dos espaçadores de plástico, semanal, no mínimo mensal, que consiste na submersao por 30 minutos em uma soluçao com proporçao de duas gotas de detergente caseiro neutro para um litro de água, seguida de secagem espontânea, promove a formaçao de um filme antiestático que assegura maior oferta de partículas respiráveis para o paciente204. Espaçadores caseiros, feitos com garrafas plásticas lisas de água mineral ou refrigerantes, parecem ter eficácia equivalente aos modelos industrializados, inclusive nas exacerbaçoes da asma em crianças. Diferença fundamental entre eles é a existência de válvula no espaçador industrializado205,206.
Técnicas para utilizaçao dos espaçadores
a) Crianças entre quatro e seis anos
Técnica com espaçador bivalvulado e bocal207
- Posiçao: sentado ou em pé,
- Retirar a tampa,
- Agitar por 3-5 segundos,
- Acoplar o frasco do IDP à entrada do espaçador na vertical,
- Posicionar o bocal do espaçador entre os lábios bem cerrados, bloquear a passagem de ar pelas narinas e manter a respiraçao pela boca,
- Disparar uma dose do IDP, preferencialmente no início de uma inspiraçao para o máximo aproveitamento do jato,
- Completar 6-8 ciclos respiratórios após o disparo,
- Quando indicadas mais doses, realizar cada um dos passos novamente,
- Lavar a boca após o uso.
Para os menores de seis anos de idade, ou indivíduos de qualquer outra faixa etária incapazes de realizar a manobra de apneia, foram desenvolvidas as aerocâmaras bivalvuladas, que garantem a retençao do aerossol até a completa inalaçao203. Para os mais jovens, é indicada a aerocâmara bivalvulada com máscara sobre o nariz e a boca, de tamanho adequado para reduzir o espaço morto, enquanto os maiores se beneficiam do uso do bocal, que elimina as fossas nasais do trajeto do aerossol até os pulmoes.

Figura 3 Uso do IDP com espaçador valvulado e bocal
b) Crianças menores de quatro anos
Técnica com espaçador bivalvulado e máscara sobre o nariz e a boca207
- Posiçao: sentado ou deitado,
- Retirar a tampa,
- Agitar por 3-5 segundos,
- Acoplar o frasco do IDP à entrada do espaçador na vertical,
- Ajustar a máscara sobre o nariz e a boca, mantendo a respiraçao espontânea,
- Disparar uma dose do IDP, preferencialmente no início de uma inspiraçao para o máximo aproveitamento do jato,
- Completar 6-8 ciclos respiratórios após o disparo,
- Quando indicadas mais doses, realizar cada um dos passos novamente,
- Lavar a boca e o rosto após o uso.
2 - Nebulizadores
Existem dois tipos de nebulizadores no mercado: os nebulizadores de jato (NJ), e os nebulizadores ultrassônicos (NU), que podem ser usados com máscara ou peça bucal, conforme o grau de compreensao do paciente.
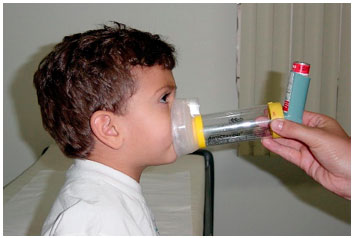
Figura 4 Uso do IDP com espaçador bivalvulado e máscara
Como vantagens, que ainda hoje asseguram seu espaço no arsenal terapêutico, os nebulizadores contam com a disponibilidade para uso por qualquer faixa etária, sem a exigência de técnicas inalatórias especiais, podendo ser utilizados a volume corrente, mesmo durante as exacerbaçoes da asma, por exemplo, nas quais o oxigênio pode ser a fonte do jato208. Entretanto, comparativamente aos IDPs com espaçadores, apresentam desvantagens que os colocam, nos dias atuais, como uma segunda opçao, dentre as quais estao o custo mais elevado, a necessidade de uma fonte de gás ou energia elétrica para o funcionamento, emprego de máscaras de tamanho adequado que se ajustam perfeitamente ao rosto do pré-escolar (exigência que muito frequentemente nao é observada), o tempo prolongado na inalaçao e a exigência de manutençoes mais frequentes.
Os inaladores pressurizados mais modernos de névoa suave, tecnicamente, caem na definiçao dos nebulizadores. Entretanto, sao dispositivos portáteis cujo representante no mercado é o Respimat®, que nao contém propelentes e utiliza a energia de uma mola comprimida em seu interior para liberar lentamente uma nuvem suave de aerossol. A técnica de uso é semelhante à do IDP com espaçador, a formulaçao disponível em nosso meio é o brometo de tiotrópio, ainda pouco usado em pediatria, mas pode ser utilizado como opçao terapêutica em crianças a partir de seis anos209.
Escolha dos dispositivos para tratamento da asma
Na prática clínica, todos os dispositivos inalatórios podem funcionar muito bem com pacientes que saibam usá-los corretamente210.
A revisao mais recente de um consenso de especialistas de diferentes países5 apresenta estratégia elaborada em etapas para garantir melhor aproveitamento dos dispositivos inalatórios recomendados no tratamento da asma:
1. Escolher
- Escolher o dispositivo mais apropriado para cada paciente;
- Evitar o uso de múltiplos dispositivos, para evitar confusoes.
2. Checar
- Checar a técnica em cada oportunidade;
- Pedir ao responsável pelo paciente que demonstre como usa o dispositivo, nao apenas perguntar se sabe usá-lo.
3. Corrigir
- Demonstrar ao responsável pelo paciente como se usa o dispositivo corretamente; pode-se lançar mao de um placebo;
- Checar a técnica novamente; pode ser necessário repetir esta etapa mais de uma vez;
- Considerar outro dispositivo apenas se o paciente nao for capaz de usá-lo após algumas sessoes de treinamento.
4. Confirmar
- Conhecer a técnica correta de cada um dos dispositivos que sao prescritos;
- Farmacêuticos e enfermeiras treinados podem oferecer dicas de uso dos dispositivos.
GUIA DE AUTOMANEJO
O que é um guia de automanejo?
A utilizaçao da prática do autocontrole, automanejo ou automonitoramento é uma realidade na abordagem de muitas doenças crônicas, como a asma. Vários serviços especializados utilizam esse conceito de tomada de decisao pelo paciente frente aos sintomas da doença, podendo ser direcionada diretamente ou nao pelo médico assistente211.
Em ambos os casos, as orientaçoes sao preferencialmente escritas e explicadas ao responsável/ cuidador do paciente, uma vez que ele deverá tomar a decisao frente ao problema, sem necessariamente comunicar ao médico, e no segundo caso as principais decisoes serao tomadas juntamente com o médico em consultas planejadas ou consultas extras211.
O objetivo de um guia de automanejo, com plano de açao de asma definido, é auxiliar o paciente e/ ou seu cuidador a tomar medidas precoces para prevenir ou reduzir a gravidade de uma crise de asma211. Tenta-se ampliar os conceitos e definiçoes de automanejo, especialmente para adolescentes, como o conjunto de comportamentos que os mesmos usam para prevenir, monitorar, gerenciar e comunicar sintomas de asma a outros indivíduos com o objetivo de controlar individualmente o que está ocorrendo de importância, e que pode estar influenciado por fatores interpessoais complexos e próprios ao paciente212,213.
Para que o automanejo seja efetivo, sao necessários três pontos básicos:
- acesso à informaçao: monitoramento adequado dos sinais e sintomas pelo paciente ou cuidador;
- decisao - quem, o que, quando, onde, por que - plano de açao escrito de como reconhecer e de como agir frente ao agravamento da asma;
- revisao - monitoramento periódico do controle, do tratamento e das características clínicas da asma por um profissional da saúde.
Um plano de açao escrito para asma consiste em conjunto de instruçoes que ajudam o paciente ou cuidador a reconhecer o agravamento da asma, e lhe diz o que fazer em resposta às mudanças ocorridas213,214. Podem ser construídos diferentes planos de açao para se adequar à diversidade de pacientes, mas todos os planos devem conter informaçoes imprescindíveis para o sucesso. Um plano de açao individualizado para asma deve incluir215:
1) a lista dos medicamentos para asma de uso habitual do paciente em questao, incluindo doses;
2) instruçoes sobre o que fazer no caso de piora da doença, incluindo quando utilizar doses extras dos medicamentos habituais ou outros medicamentos novos (extras) e quando entrar em contato com o médico ou ir ao serviço de emergência;
3) o que fazer na crise de asma;
4) o nome do médico ou outro profissional de saúde que preparou o plano junto ao paciente;
5) a data.
As dificuldades em relaçao ao automanejo em pacientes menores que cinco anos se encontram na dependência do seu grau de entendimento e o de seus cuidadores. Poucas sao as referências sobre automanejo que incluem apenas pré-escolares, sendo que muitas metanálises nao separam dados apenas dessa faixa etária, existindo poucas evidências de efetividade das estratégias de automanejo aplicadas aos pais/pacientes desses possíveis asmáticos210. Estudo prospectivo, randomizado, controlado e parcialmente cego, em centro pediátrico de asma no Reino Unido avaliou pais de pré-escolares entre 18 e 60 meses de idade e que estavam internados ou compareciam à emergência por sibilância e receberam (grupo de intervençao; n = 99) ou nao (grupo controle; n = 101) um livro geral sobre asma para pré-escolares, um plano de açao e duas reunioes de 20 minutos com enfermeira especializada e diplomas para os pais e crianças. Os dois grupos foram acompanhados com consultas aos 3, 6 e 12 meses. Nao houve diferença estatisticamente significante entre os dois grupos durante os 12 meses de seguimento em relaçao ao número de visitas a pronto-socorro, consultas de rotina, prescriçoes de medicamentos para asma e nos escores de qualidade de vida para pacientes pediátricos com asma216. Outros estudos conduzidos com pré-escolares sibilantes na Suécia e na Alemanha mostraram que grupos de intervençao multiprofissionais (pediatras, enfermeiras e psicólogos) para pequeno grupo de parentes com várias sessoes ao longo do tempo, proporcionavam respostas positivas a curto e até longo prazo, evitando-se consultas em pronto-socorro e uso desnecessário de medicaçoes217,218.
O guia de automanejo pode monitorar situaçoes diferenciadas: monitoramento somente dos sintomas clínicos e/ou monitoramento do pico de fluxo expiratório (PFE)219. Nas crianças, os planos com base nos sintomas sao preferidos, tendo-se a dificuldade técnica da realizaçao do PFE por essas crianças pequenas. Na maioria das crianças com asma, a mudança nos sintomas é tao eficaz quanto o fluxo máximo para indicar que a doença está piorando219.
No caso do automonitoramento de sintomas, os pais/cuidadores dos pacientes devem ser treinados para acompanhar os sintomas da asma (com ou sem diário), observar e tomar medidas se necessário, quando os sintomas começarem a piorar.
Na utilizaçao do PFE (pré-escolar) o automonitoramento pode ser útil em várias situaçoes: monitoramento em curto prazo, para avaliar a recuperaçao após a crise; após a mudança de medicaçao (objetivando acompanhar a resposta do paciente); quando os sintomas parecerem excessivos e nao relacionados aos dados obtidos pela funçao pulmonar; para identificar fatores ambientais e ocupacionais desencadeantes de exacerbaçoes da doença219. E o monitoramento em longo prazo, para detecçao precoce em pacientes com dificuldade de percepçao clínica da limitaçao ao fluxo aéreo, para pacientes com história de exacerbaçoes graves de início súbito e para aqueles que sofrem de asma difícil de controlar ou grave219. Para registro adequado dos valores do PFE, deve-se utilizar um gráfico compacto, incluído na lateral do diário, e que permita a identificaçao visual mais precisa do agravamento da asma219,220.
Para pais ou cuidadores de crianças com asma, obter cópias extras do plano para deixá-lo com avós e outros cuidadores regulares, deixar uma cópia na escola, pré-escola e/ou creche da criança é medida prudente214.
É muito importante que o guia de automanejo seja revisado regularmente junto ao médico assistente, uma vez que a classificaçao de gravidade e/ou controle de asma pode mudar ao longo do tempo.
Quais os benefícios de guia de automanejo?
A prática de autocontrole adequado, incluindo os pontos básicos já citados, reduz drasticamente a morbidade da asma em adultos211 (Evidência A), e em crianças e adolescentes221 (Evidência A).
Os benefícios incluem reduçao de 30% a 60% nas internaçoes relacionadas à asma, visitas ao serviço de emergência e consultas clínicas nao programadas, dias de trabalho/escola perdidos e despertares noturnos. Intervençoes menos intensivas que envolvem educaçao sobre autocontrole, mas nao plano de açao escrito sao menos efetivos, e aqueles que oferecem somente a informaçao por si sao ineficazes211,223.
Metanálise sobre automanejo em asma concluiu que a educaçao para crianças que têm exacerbaçoes de asma aguda e seus cuidadores em pronto-socorro pode resultar em menor risco futuro de novas exacerbaçoes e admissao hospitalar226. Vale ressaltar que nessa metanálise onde foram incluídos 38 estudos com 7.843 crianças, apenas três estudos abrangiam pré-escolares abaixo de cinco anos, o que correspondia a 5% dos casos (n = 399). Também concluem sobre a incerteza do tempo de efeito a longo prazo de educaçao sobre outros marcadores de morbidade da asma, como qualidade de vida, sintomas e funçao pulmonar e sobre o tipo, duraçao e intensidade dos modelos educacionais que seriam mais eficazes na reduçao da utilizaçao de pronto-socorros224.
A eficácia do automanejo é similar, independentemente da escolha pelo esquema mais ativo, onde o paciente faz seu próprio ajuste ou em planos onde os ajustes de medicaçao sao feitos por um médico, ou seja, mesmo aqueles pacientes que nao conseguem realizar modificaçoes no tratamento sozinhos ainda podem obter benefícios de um programa estruturado com revisao médica regular223.
Exemplos de guias de automanejo/planos de açao
Vários exemplos de guias de automanejo/planos de açao já foram elaborados, especialmente para adultos e adolescentes, por organizaçoes e serviços que atendem pacientes com asma. Modelos que atendam crianças pequenas sao mais raros, e sua elaboraçao, um desafio.
Desde que contenham informaçoes imprescindíveis, estes podem adotar diferentes formas, tamanhos e cores, como por exemplo, um Z-card, que se dobra ao tamanho de um cartao de crédito, facilitando guardá-lo na bolsa e carteira214, até os modelos de aplicativos móveis, como o Asthma Buddy225.
Modelos para pacientes com baixa alfabetizaçao podem ser encontrados em vários sites de organizaçoes internacionais (por exemplo: Asthma UK, www.asthma.org.uk; Asthma Society of Canada, www.asthma.ca; Family Physician Airways Group of Canada, www.fpagc.com; National Asthma Council Australia, www.nationalasthma.org.au)214,228-228.
Profissionais de saúde, em todos os níveis do atendimento, devem familiarizar-se com planos de açao relevantes para as condiçoes de saúde local, as opçoes de tratamento disponíveis, bem como o contexto cultural, social e de escolaridade (alfabetizaçao) dos pacientes e cuidadores que assistem, garantindo assim a melhor escolha e a otimizaçao deste importante instrumento5.
EDUCAÇAO PARA FAMILIARES OU CUIDADORES
É de importância a identificaçao de crianças com asma, pois as medidas preventivas para evitar as exacerbaçoes agudas sao necessárias durante todo o ano229-231. A família deve saber identificar a criança com asma, especialmente as de fundo alérgico, pois a reduçao do absenteísmo escolar será estimulada, proporcionando a melhor qualidade de vida da mesma. É fundamental o incentivo à educaçao dos pais em relaçao a todas as medidas de prevençao e da vigilância permanente dos sinais de alarme que devem estimular a conduçao imediata da criança a um serviço de urgência232.
O médico assistente (pediatra ou de atençao primária) deve ser o grande incentivador do conhecimento familiar adequado sobre a doença, pois há necessidade cada vez maior de orientaçao e preparo no manejo de tais casos que provocam grande preocupaçao nos pais, transformando-se em grande desafio para pediatrias, com destaque ao diagnóstico correto e conduçao adequada (necessidade de anamnese abrangente e minuciosa), especialmente na prevençao de exacerbaçoes e uso adequado de medicamentos disponíveis. Portanto, a relaçao médico-família-paciente deve ter um vínculo robusto e solidificado na confiança233.
A criança precisa dispor em sua residência e na escola de todas as orientaçoes prescritas, pelo médico que a assiste, sobre as medidas a serem tomadas aos primeiros indícios de exacerbaçoes de asma, o plano de açao terapêutico, baseado em sinais e sintomas ou no PFE234,235. Tais orientaçoes devem ficar em local de fácil acesso, especialmente aos cuidadores do menor e com os funcionários responsáveis na escola. Os cuidados com a criança devem abranger todos os ambientes onde ela circula diariamente (casa, quarto, creche, escola, etc.)236.
O médico assistente precisa ter certeza que a família e todas as pessoas envolvidas no atendimento das crianças com asma estejam bem orientadas sobre a doença, e explicar que os objetivos na conduçao adequada de cada caso, sao: a prevençao de sintomas crônicos e indesejáveis, a manutençao da funçao pulmonar e do nível de atividade dentro dos padroes de normalidade, melhorando assim as noites de sono, minimizando as idas ao pronto-socorro e ao hospital, e orientando a utilizaçao dos medicamentos adequados, com mínimo de efeitos colaterais236,237.
As avaliaçoes médicas periódicas sao fundamentais para o controle da asma, para que os familiares e cuidadores possam identificar os sintomas iniciais das exacerbaçoes e também saber, de imediato, o que fazer até a chegada ao pronto atendimento mais próximo, evitando o agravamento do caso nas formas agudas da doença. Portanto, nao se pode duvidar da necessidade da família bem informada e treinada para evitar os transtornos emergenciais. O médico atendente deve alertar sobre todos os fatores de risco que podem provocar ou contribuir para o início das crises agudas. Destacando-se os aeroalérgenos intra ou extradomiciliares; infecçoes das vias aéreas superiores; medicamentos, alimentaçao, ar frio, exercícios físicos, perfumes, fumo, emoçoes fortes (riso ou choro), refluxo gastroesofágico, e outras comorbidades236.
Os alérgenos intradomiciliares encontrados com maior frequência sao os ácaros da poeira doméstica, pelos/caspa de animais de estimaçao, baratas, fungos e polens238. É importante o médico atendente alertar sobre a reduçao da exposiçao da criança a esses fatores desencadeantes. O uso de capas em colchoes e travesseiros é fundamental. Lavagem frequente das roupas de cama com água quente também é importante, embora seja questionada. Retirar brinquedos de pelúcia do quarto. Evitar contato com urina, pelos e saliva de animais de estimaçao, colocando, de preferência, o animal para dormir fora do quarto das crianças, sobretudo nos casos de sensibilizaçao comprovada. As baratas representam problema grave, especialmente nas áreas urbanas. Recomenda-se o máximo controle de higiene ambiental para evitá-las. A vigilância do excesso de umidade intradomiciliar também é importante para evitar a formaçao de mofo e proliferaçao excessiva dos ácaros238,239.
Assim, o ambiente da criança deverá ser limpo, arejado e com ventilaçao adequada, com o objetivo de reduzir a exposiçao aos fatores desencadeantes do meio ambiente, evitando também o uso de produtos industrializados excessivamente perfumados como talcos, colônias, sabonetes e shampoo240.
Outro fator de risco diretamente relacionado ao desencadeamento das crises e/ou desenvolvimento da asma é a fumaça do cigarro. O tabagismo passivo intradomiciliar deve ser rigorosamente proibido aos pais e familiares dos menores com a doença. Importante também alertar sobre a nao utilizaçao do cigarro no período gestacional e amamentaçao do lactente241,242.
Os pais e cuidadores das crianças com asma devem tomar todos os cuidados e medidas necessárias para a prevençao das exacerbaçoes. Nas crises de sibilância a identificaçao de sinais e sintomas de gravidade como tosse, aperto no peito, aumento da frequência respiratória, cianose, mudança do estado geral e recusa alimentar. Orientar cuidados iniciais da criança, até o momento do atendimento de urgência: manter a criança bem hidratada, lavar com frequência as narinas com soro fisiológico, uso de antitérmicos e broncodilatador, conforme prescriçao do médico atendente contida no plano de açao terapêutico5.
A carteira de imunizaçao deve estar sempre com a vacinaçao atualizada, especialmente contra influenza243. Estímulo ao aleitamento materno exclusivo até o sexto mês de vida da criança, com manutençao o maior tempo possível244. Essas sao orientaçoes gerais que o médico atendente deve atentar em alertar a família, com o objetivo de melhorar a qualidade de vida da criança e da família, visando a reduçao e o controle das exacerbaçoes de asma245.
EDUCAÇAO DA CRECHE E PRÉ-ESCOLA
O cuidado com as crianças com asma e sibilância na creche e na pré-escola passa, em primeiro lugar, pela grande heterogeneidade dos estabelecimentos no que se refere às condiçoes materiais e humanas, notadamente a capacitaçao dos profissionais234,236,246. Há pré-escolas que têm médico e/ou profissional de enfermagem, enquanto outras sao completamente despreparadas para qualquer tipo de atendimento mais complexo. Em qualquer caso, sao necessárias pessoas com disposiçao e competências individuais para executar as açoes e tomar as decisoes necessárias. A escola deve garantir a presença de pelo menos um profissional capacitado para atendimentos, durante o tempo integral de seu funcionamento, o que está previsto em algumas legislaçoes locais247, embora se reconheça a carência desse aspecto na formaçao profissional.
Há recomendaçoes gerais às pré-escolas para lidar com procedimentos médicos e administraçao de medicamentos em suas dependências248. As principais sao:
a) priorizar o uso de medicamentos e procedimentos mais complexos e demorados para a residência da criança, restando à escola o menor número de doses possível, somente quando imprescindível;
b) administrar remédios na escola mediante receita médica; medicamentos na embalagem original, dentro do prazo de validade e etiquetados com o nome da criança;
c) estabelecer horários para medicamentos e procedimentos que interfiram o mínimo possível com as atividades pedagógicas;
d) observar constantemente o estado de saúde das crianças, especialmente daquelas com agravos já conhecidos e que inspiram mais cuidados;
e) estabelecer logística que permita acesso fácil e rápido tanto às informaçoes quanto aos medicamentos e materiais que se fizerem necessários.
Recomendaçoes para educaçao de profissionais da creche/pré-escola nas questoes que envolvem o controle de asma e sibilância
Nem sempre a família é boa intermediária entre o médco assitente e a escola, no que se refere à transmissao correta e precisa das informaçoes sobre cuidados com a saúde de seus filhos. Asma e sibilância em pré-escola implicam em risco e complexidade diferenciados em relaçao a outras condiçoes patológicas, demandando atençao e preparo especial dos profissionais de educaçao que lidam com as crianças afetadas.
É reconhecida a necessidade de açoes coordenadas entre profissionais de saúde e de educaçao, família e agentes governamentais234.
Profissionais de saúde comprometidos com a orientaçao de educadores sobre temas específicos de saúde, no caso, asma e sibilância, podem pautar suas açoes em alguns passos, para dar maior consistência e efetividade nos resultados esperados.
a) Após contato inicial e sensibilizaçao da direçao e da equipe, realizar uma ou mais explanaçoes presenciais, claras e detalhadas, sobre a importância do tema e a totalidade das informaçoes pertinentes. Além das questoes ligadas ao tratamento das exacerbaçoes e controle da asma, ressaltar o possível impacto na saúde, na segurança e no desempenho das atividades escolares. Reservar tempo para esclarecimento de dúvidas;
b) Demonstraçao presencial de procedimentos (por exemplo, uso de aerossóis dosimetrados com espaçador e máscara), com a possibilidade de os educadores praticarem os mesmos e repetirem até se sentirem seguros para sua execuçao, quando for necessário;
c) Realizaçao de testes de conhecimento, escritos, orais e práticos, para avaliar a fixaçao de conceitos e informaçoes e a correçao na execuçao de procedimentos e na tomada de decisoes;
d) Incentivo para que as famílias notifiquem à escola quais as crianças com asma;
e) Orientaçao para obter, junto ao médico assistente ou da unidade básica de saúde, por escrito, o conjunto da observaçao dos sinais de asma e sibilância, a correta valorizaçao e interpretaçao dos sintomas relatados pela criança e a descriçao passo a passo sobre o uso de medicaçao e a instituiçao de outros procedimentos. Esse item é de particular importância, porque as prescriçoes e procedimentos podem variar de criança para criança e precisam ser cumpridos rigorosamente conforme o recomendado. Esse conjunto de informaçoes constitui um plano de açao individualizado para controle da asma e conduta nas situaçoes de crise ou de emergência;
f) Tais documentos (plano de açao, receitas médicas, instruçoes escritas para o manuseio de equipamentos, descriçao por escrito dos procedimentos) devem ser mantidos em local de rápido e fácil acesso ao profissional da escola, sempre que for necessário;
g) Disponibilizar, sempre que possível, vídeos com demonstraçao de procedimentos, para consulta pela equipe, revisao e atualizaçao das informaçoes pertinentes. Os educadores podem revisar açoes práticas sem a presença dos profissionais de saúde, como, por exemplo, manuseio de medidores de pico de fluxo expiratório e aerossóis dosimetrados com espaçador e máscara;
h) Orientaçao para que toda ocorrência, seja leve ou grave, ou mudanças no estado de saúde da criança seja comunicada aos pais ou responsáveis, ou ao seu médico, se autorizado;
i) Orientaçao para que a equipe encaminhe para avaliaçao os alunos com baixo rendimento em suas atividades escolares, seja pela ocorrência de sintomas, seja por possíveis efeitos colaterais de medicaçao. Incentivo para que a escola reconheça e identifique estudantes com asma230;
j) Discussao, em conjunto, quanto à adequaçao e adaptaçao de atividades escolares, visando à participaçao dos asmáticos da forma mais integral que seja possível;
k) Orientaçoes para que a escola promova a reduçao dos fatores com potencial para desencadear a asma, notadamente poeira, mofo, ácaros, epitélio de animais, além de fatores irritantes no ambiente. Limpeza adequada e ventilaçao das salas importantes para o manejo e controle da asma no ambiente escolar234,236,238. A lei que proíbe fumar em ambientes de uso coletivo deve ser rigorosamente cumprida249,250;
l) Orientaçoes para a realizaçao de atividades fora da escola, de modo que o plano de açao e as medicaçoes estejam disponíveis durante o transporte e a atividade.
Promover saúde em ambiente escolar abrange cuidar das crianças alérgicas, em estreita relaçao entre os profissionais da educaçao e da saúde.
EXACERBAÇOES DE ASMA
Diagnóstico da crise
A crise de asma em crianças menores de cinco anos é definida como deterioraçao aguda ou subaguda do controle dos sintomas, suficiente para causar angústia, risco à saúde e necessidade de visita ao serviço de saúde ou utilizaçao de corticosteroide sistêmico.
Dentre os sintomas precoces de uma crise podem estar presentes o aumento da sibilância e a respiraçao mais curta; aumento da tosse, especialmente durante o sono; letargia ou reduçao da tolerância ao exercício; incapacidade de executar atividades rotineiras, incluindo a alimentaçao e resposta insatisfatória às medicaçoes de alívio5.
Estudo realizado em crianças com 2 a 5 anos de vida demonstrou que a combinaçao de aumento de tosse e sibilância ao longo do dia, associado à utilizaçao de agente beta-2 agonista à noite foi um forte preditor de crise iminente (um dia depois). Esta combinaçao foi capaz de predizer 70% das exacerbaçoes, com 14% de falso positivo. Em contraste, nenhum outro sintoma individual foi sugestivo de crise iminente251.
Sintomas de infecçoes das vias aéreas superiores frequentemente precedem o início da crise asmática, indicando o papel das infecçoes virais do trato respiratório superior na precipitaçao da crise, na grande maioria dos casos252.
A avaliaçao da criança com quadro de sibilância compreende anamnese cuidadosa e exame físico. O médico assistente deve considerar vários diagnósticos diferenciais, além de determinar o local de origem da sibilância; se nas vias aéreas superiores ou nas inferiores252,253.
Etiologias nao infecciosas de sibilância crônica ou recorrente, nesta faixa etária incluem-se anormalidades estruturais, doenças cardiovasculares, alteraçoes da árvore traqueobrônquica ou massas mediastinais, sendo que todas elas nao respondem à terapia broncodilatadora. Dentre as causas funcionais a serem investigadas, incluem as síndromes aspirativas, como a doença do refluxo gastroesofágico, que podem apresentar vômitos, rouquidao, sintomas na posiçao supina ou após alimentaçao, ou laringites de repetiçao.
Imunodeficiências e fibrose cística podem ser a causa de pneumonias de repetiçao, sibilância localizada e dificuldades de alimentaçao. A ausência de resposta à terapia broncodilatadora sugere etiologia nao viral da sibilância.
Informaçao importante para nortear a terapia da sibilância viral aguda e avaliar o risco para o desenvolvimento de asma inclui a história prévia de sibilos, sua frequência de recorrência, tosse crônica, tosse com exercício, quadros graves que necessitaram internaçao, visitas a pronto-atendimento, sintomas noturnos, quadros anteriores com infecçao viral confirmada e resposta prévia ao uso de agente beta-2 agonista inalado e corticosteroides orais.
Também é importante a história perinatal (idade gestacional, tipo de parto), alimentar (aleitamento materno), história familiar de atopia e de asma, história pessoal de dermatite atópica ou alergias alimentares e fatores ambientais que possam aumentar o risco da gravidade e persistência dos sintomas254.
Avaliaçao diagnóstica
O RX de tórax pode ser útil no quadro agudo do lactente na presença de febre ou sibilância persistente ou ainda na investigaçao de alteraçoes anatômicas ou aspiraçao de corpo estranho. A eosinofilia observada antes do início do tratamento com corticosteroide sistêmico no quadro agudo e excluídas parasitoses intestinais pode sugerir atopia e ser um fator de risco para quadros de sibilância recorrente255, de acordo com os índices determinados pelo escore de índice preditivo de asma101,127,256-258.
Testes para a identificaçao de vírus e bactérias geralmente nao sao realizados na prática diária. O teste rápido para influenza está disponível, e pode ser útil na definiçao do uso, ou nao, de agentes antivirais, embora a sua sensibilidade seja baixa. A especificidade, dependendo do sorotipo, pode atingir até 90%. Testes rápidos pela técnica do RT-PCR para rinovírus, metapneumovirus humano, vírus sincicial respiratório, influenza, parainfluenza, coronavírus e outros estao disponíveis259,260.
Avaliaçao das exacerbaçoes
No domicílio
Nos lactentes sibilantes, obviamente, a observaçao de fatores de risco, assim como critérios de gravidade para a crise de sibilância, no domicílio, sao atribuiçoes de seus pais, familiares ou cuidadores, que, na maioria das vezes, nao estao treinados ou devidamente informados para o reconhecimento destas características e da conduta a ser estabelecida subsequentemente261.
Identificar as exacerbaçoes, assim como sua gravidade, é fundamental para o prognóstico, sobretudo na asma, já que é a doença crônica respiratória de maior prevalência na infância e a intensidade dos seus sintomas durante os dois primeiros anos de vida está fortemente relacionada ao seu prognóstico110.
Orientaçoes devem ser dadas aos cuidadores e familiares pelo médico ou profissional da saúde que assiste o lactente que apresenta sibilância de repetiçao. Baseado no GINA5, as características seguintes seriam parâmetros de gravidade e indicaçao para tratamento hospitalar ou em unidade de emergência: alteraçao da consciência, oximetria de pulso (< 92%), dificuldade para emitir frases inteiras, frequência cardíaca (pulso) aumentada (> 200 bpm em menores de 5 anos e > 180 bpm entre 4 e 5 anos), presença de cianose central e sibilância inaudível (pelo broncoespasmo intenso)5.
No entanto, parte destes critérios sao técnicos, de difícil avaliaçao por parte dos familiares e cuidadores. Por isso, características gerais e específicas, da crise de sibilância, de mais fácil análise devem ser avaliadas, as quais se seguem:
- Gerais: hipoatividade e alteraçao da consciência; dificuldade de alimentaçao (sucçao deficiente ou recusa alimentar); vômitos associados à tosse5,262.
- Específicas: alteraçoes na frequência e na intensidade da respiraçao.
a. Alteraçao na frequência: como a frequência respiratória pode estar aumentada em períodos de choro e agitaçao, sua contagem deve ser valorizada isoladamente somente quando a criança estiver calma. Nestas condiçoes, frequência respiratória acima do normal (Tabela 9) é indicativo de que a criança seja avaliada por um médico262.
b. Alteraçao na intensidade: a presença de esforço respiratório é indicativa de gravidade de crise e pode ser avaliado por meio das seguintes observaçoes: batimento de asa de nariz; retraçoes (tiragens) de fúrcula esternal; intercostais e subdiafragmáticas; e em situaçoes mais críticas a presença de cianose central262.
O ideal seria que todas estas avaliaçoes na gravidade da crise de sibilância fossem seguidas por planos de açao que estivessem bem claros para familiares e cuidadores, e pudessem incluir: o tipo de medicaçao de resgate, a dose e maneira de administrar; além de dados referentes aos médicos assistentes, serviços de referência e contatos de hospitais e ambulâncias5.
Na emergência
Avaliaçao clínica e oximetria
A abordagem eficaz na abordagem das exacerbaçoes de asma no serviço de emergência compreende a realizaçao de uma breve anamnese, da qual deverao constar o tempo de início da crise, fatores desencadeantes e medicaçoes já em uso, além da presença de fatores de risco para asma fatal/quase fatal (Tabela 10). Cabe ressaltar que as propriedades anátomo-funcionais das vias áreas inferiores características desta faixa etária contribuem para a maior facilidade no colabamento, acúmulo de secreçoes, menor resistência e fadiga muscular precoce frente a uma enfermidade pulmonar aguda.
Simultaneamente à história, o exame físico visa o reconhecimento de sinais de alerta para exacerbaçoes graves (Tabela 11) e a pronta instituiçao do tratamento mais adequado para cada caso.
A presença de qualquer um dos sintomas abaixo indica a necessidade de tratamento urgente e transferência imediata para hospital.
- Saturaçao de oxigênio (SaO2) < 92% (antes de tratamento com oxigênio ou broncodilatador), medida pela oximetria de pulso. Este achado está associado à alta morbidade e provável necessidade de hospitalizaçao. Níveis de SaO2 entre 92-95% também apresentam elevado risco de internaçao hospitalar263;
- Alteraçoes da consciência, como agitaçao, sonolência e confusao, podem ser resultado de hipercapnia e hipoxemia cerebral;
- O tórax silencioso na ausculta indica ventilaçao mínima, insuficiente para produzir uma sibilância, caracterizando uma obstruçao brônquica intensa.
A utilizaçao de escores clínicos como o PRAM (Pediatric Respiratory Assestement Measure) e o PASS (Pediatric Asthma Severity Score) também tem se mostrado útil na avaliaçao das exacerbaçoes de asma em lactentes e pré-escolares, possuindo propriedades discriminatórias da gravidade das exacerbaçoes264,265.
A avaliaçao funcional do grau de limitaçao do fluxo de ar em crianças menores de cinco anos é difícil na prática clínica. Por outro lado, reavaliaçoes seriadas dos parâmetros clínicos e de SaO2 devem ser obtidas para avaliar as respostas a cada etapa do tratamento.
Exames complementares
A radiografia de tórax pode ser considerada na presença de sinais sugestivos de pneumotórax, pneumonia, atelectasia ou aspiraçao de corpo estranho. Outros exames complementares normalmente nao sao necessários.
O hemograma, se solicitado, deve ser interpretado com cautela, uma vez que a corticoterapia sistêmica pode acarretar leucocitose, discreta a moderada, com desvio à esquerda, induzindo ao diagnóstico de infecçao bacteriana associada ao quadro respiratório, e muitas vezes ao uso equivocado de antibioticoterapia. A gasometria arterial é recomendada apenas nos pacientes hospitalizados, especialmente naqueles em Unidade de Terapia Intensiva, e principalmente para adequaçao de suporte ventilatório mecânico.
Hospitalizaçao
A hospitalizaçao deve ser considerada para qualquer criança com quadro de insuficiência respiratória, com pouca resposta à terapia de emergência e na presença de problemas psicossociais significativos que impeçam os cuidados ótimos de uma crise de asma aguda. A decisao de internar também deve ser baseada na presença de fatores de risco para mortalidade por asma, já citados anteriormente5.
Critérios e cuidados na alta hospitalar
Os principais critérios para alta hospitalar em crianças abaixo de cinco anos incluem uma boa resposta para terapia broncodilatadora, sustentada por pelo menos 1 hora, SaO2 > 94% em ar ambiente, e recursos adequados para manutençao do tratamento no domicílio. Além disso, a criança deve estar confortável e capaz de manter a alimentaçao e hidrataçao adequadas de acordo com a expectativa para sua idade.
Os responsáveis deverao receber um plano de açao individualizado e adequado ao nível cultural familiar do paciente, do qual deverá constar: o reconhecimento e manejo dos sintomas recorrentes ou exacerbaçoes, identificaçao de fatores desencadeantes e como evitá-los, além de instruçoes sobre o uso de medicamentos de resgate e de controle e de dispositivos inalatórios266.
Os cuidadores devem ser instruídos sobre a visita de acompanhamento, que deverá ocorrer no máximo dentro de duas semanas267. A referência a um especialista em asma deve ser considerada para todas as crianças com exacerbaçoes graves, ou múltiplas visitas ao departamento de emergência, ou hospitalizaçoes.
TRATAMENTO DA CRISE
As evidências científicas que respaldam o tratamento neste grupo etário, seja de longo prazo, seja da crise de sibilância, sao de acurácia e precisao questionáveis. Isto se deve à heterogeneidade da definiçao de asma e de sibilância recorrente, à caracterizaçao imprecisa dos fenótipos, e também à escassez de ensaios randomizados e revisoes sistemáticas140. No entanto, algum esforço tem sido feito no sentido de responder ao manejo efetivo, e este tópico se fundamenta em evidências recentes sobre o tema.
Sabe-se que para crianças, incluindo recémnascidos e lactentes, a via inalatória é a preferida para o tratamento. Todavia, algumas características dos lactentes e pré-escolares exigem um manejo específico. Os aerossóis dosimentrados com espaçadores sao comprovadamente eficazes para este grupo. Ensaio randomizado conduzido com crianças suecas de até seis anos de idade demonstrou equivalência do aerossol dosimetrado acoplado a espaçador (400 µg em menores de 2 anos, e 600 µg em maiores) quando comparado à nebulizaçao a jato no tratamento de asma ou sibilância aguda induzida por vírus268.
Para o uso de inaladores dosimetrados, recomenda-se utilizar espaçador com máscara facial de tamanho adequado para os menores de quatro anos, e com adaptador bucal para os mais velhos. Espaçadores menores de 350 mL podem ser úteis nos mais jovens, devido ao menor volume corrente dos lactentes e pré-escolares5,269.
Os fármacos utilizados nas crises de sibilância neste grupo etário sao: beta-2 agonistas de açao curta, brometo de ipratrópio, adrenalina, sulfato de magnésio, corticosteroide inalatório, corticosteroide sistêmico e azitromicina. Em lactentes com bronquiolite viral aguda, há estudos sobre a eficácia da salina hipertônica e da adrenalina nebulizados, que sao abordados em um documento específico270.
Agentes beta-2 agonistas de açao curta
Revisao sistemática recente, de revisoes sistemáticas de boa qualidade, que incluiu menores de três anos de idade, documentou que a inalaçao de agente beta-2 agonista determinou melhora do escore clínico, da frequência respiratória e da saturaçao de oxigênio, sem aumento dos efeitos adversos com o fármaco, quando comparado a placebo. Comparando-se a administraçao por aerossol dosimetrado acoplado a espaçador com a por nebulizador, observou-se reduçao significativa da taxa de hospitalizaçao com o primeiro. A resposta foi melhor naqueles com exacerbaçoes moderadas ou graves273. A dose empregada pode ser: 2 a 6 jatos a cada 20 minutos na primeira hora.
Brometo de ipratrópio
Um único ensaio que comparou a administraçao de agente beta-2 agonista inalado, isolado ou em associaçao ao brometo de ipratrópio em crianças, nao documentou diferenças quanto à reduçao da frequência respiratória ou melhora da saturaçao de O2271.
Sulfato de Magnésio
Até o momento nao existem ensaios randomizados com o fármaco publicados em pré-escolares no PubMed. No grupo de indivíduos de 3 a 18 anos, um único ensaio randomizado pequeno nao mostrou diferenças entre o agente beta-2 agonista inalado isolado ou associado ao MgSO4271.
Corticosteroide inalado
Ensaio randomizado com número reduzido de crianças menores de três anos mostrou equivalência entre a budesonida nebulizada (2.000 µg/dia) e a prednisolona intravenosa (1,5 mg/Kg/dia) nas exacerbaçoes de asma272. Estudo semelhante em crianças japonesas demonstrou equivalência entre a budesonida inalada (500 µg/dia) e a metilprednisolona intravenosa (1 mg/Kg/dia)273. Ensaio randomizado com pré-escolares turcos demonstrou que a budesonida nebulizada (3.000 µg) versus placebo, adicionada ao tratamento padrao com salbutamol e metilprednisolona, reduziu de modo significante a frequência de hospitalizaçao e melhorou o escore clínico em pacientes com exacerbaçoes moderadas e graves274. Outro estudo randomizado com crianças de um a quatro anos de idade, com sibilância recorrente, demonstrou reduçao significativa dos sintomas e da tosse com beclometasona inalada (400 µg/dia) associada ao salbutamol versus placebo associado ao salbutamol durante sete dias275.
Corticosteroide sistêmico
Revisao sistemática de ensaios randomizados com pré-escolares demonstrou que a terapia ambulatorial com corticosteroide sistêmico é ineficaz, porém traz benefícios durante as exacerbaçoes que motivam atendimento de emergência ou hospitalizaçao276. No entanto, a evidência atual nao é suficientemente precisa e acurada para se recomendar o uso neste grupo de crianças, sugerindo que a heterogeneidade de sibilância da primeira infância pode ser, pelo menos parcialmente, responsável276. O corticosteroide sistêmico pode ser benéfico para crianças com exacerbaçoes de sibilância/asma mais graves. Porém, para responder essa questao de forma mais definitiva, sao necessários estudos com uma qualidade metodológica mais homogênea276. Na crise, quando necessário, pode ser usado prednisolona 1 a 2 mg/kg/dia por até 5 dias, com dose máxima de 20 mg/dia para menores de 2 anos, e 30 mg/dia para maiores de 2 anos.
Azitromicina
Ensaio randomizado com pré-escolares comparou a administraçao de azitromicina com placebo e demonstrou ser ineficaz em reduzir o tempo de sintomas, assim como em reduzir o uso de agente beta-2 agonista de demanda277.
Em suma, conforme as evidências existentes e a opiniao de alguns peritos140,277,278, recomenda-se que o tratamento seja baseado na gravidade dos episódios. Os agentes beta-2 agonistas sao a primeira linha do tratamento, devendo ser preferentemente utilizados por via inalatória, com espaçadores com máscara ou adaptador bucal. Os corticosteroides sistêmicos devem ser reservados para pré-escolares com exacerbaçoes moderadas a graves, atendidos em emergência ou hospitalizados. O sulfato de magnésio, os corticosteroides inalados e a azitromicina exigem ainda mais estudos para que se possa incluí-los na rotina diária.
PREVENÇAO PRIMARIA
Leite materno
Prevençao primária compreende medidas a serem implementadas em lactentes de risco para desenvolver atopia, quando um ou ambos os pais sao atópicos. Algumas estratégias podem ser justificadas nestas populaçoes, mas sempre sobrecarregam as famílias e podem ter efeitos negativos ao esperado279.
É consenso geral que o leite materno é o melhor alimento para o lactente com ou sem hereditariedade atópica, mesmo que os resultados de estudos sobre a prevençao de atopia sejam conflitantes (por diferenças metodológicas, de composiçao do leite humano, viés de seleçao, etc.). De maneira geral, o aleitamento materno (AM) associa-se a risco menor de sintomas de asma no lactente, mas seu efeito nao persiste com avanço da idade280. Em revisao sistemática pioneira conduzida por especialistas de diferentes áreas, informaçoes conclusivas determinaram recomendaçoes em relaçao ao AM na prevençao de asma e doenças alérgicas, as quais se seguem:
Para todas as crianças
(1) AM exclusivo reduz o risco de asma e sibilância recorrente causada por infecçoes virais. (2) Estes efeitos protetores aumentam com a duraçao do AM, e por no mínimo 4 meses. (3) A proteçao parece persistir durante a primeira década de vida281.
Para crianças com história familiar de atopia
(1) Os benefícios do AM sao mais robustos nestes lactentes. (2) Quando o AM for insuficiente, fórmulas extensamente hidrolisadas talvez possam reduzir o risco de desenvolvimento de dermatite atópica, asma e sibilância recorrente281.
Estudos posteriores, com delineamentos mais rigorosos, foram realizados. Entre estes, destaca-se a coorte com 5.828 participantes acompanhados do nascimento aos 10 anos de idade, que coletou informaçoes sobre a duraçao do aleitamento materno (< 2 meses, 2 a 4, 4 a 6 e > 6 meses) e se fora exclusivo por no mínimo quatro meses ou nao exclusivo. A sensibilizaçao alérgica avaliada por testes cutâneos com alérgenos alimentares e inalantes, e diagnóstico médico de alergias por questionário também fizeram parte deste estudo. Os resultados mostraram nao haver associaçao entre AM com qualquer sensibilizaçao alérgica e, tampouco, com doenças alérgicas282.
Outros estudos longitudinais de nascimento documentaram e ratificaram a eficácia do AM na prevençao do desenvolvimento de sensibilizaçao alérgica, hiper-responsividade brônquica e asma283-285.
Com relaçao à variável tempo de AM, revisao sistemática mostrou que o prolongamento do AM exclusivo é capaz de reduzir, em 26%, o risco de rinite alérgica e eczema em pré-escolares, mas nao a alergia alimentar. No entanto, outros estudos parecem mostrar que o efeito seria passageiro, evanescendo com o passar do tempo. Padroes de sibilância avaliados em coorte de 5.675 crianças revelaram que o AM por menos tempo estava associado a início de sibilância antes dos três anos de idade, e asma ativa aos seis anos de idade287,288.
Metanálise de 117 estudos observacionais com 775.718 crianças mostrou que o AM se associava a risco diminuído de asma, qualquer que fosse a definiçao de asma nos estudos ou a idade em que a asma foi identificada, incluindo em lactentes289.
Em conclusao, o AM além de ser o alimento ideal para o bebê, parece ser benéfico também em prevenir doenças alérgicas, apesar de estudos adicionais serem ainda necessários para corroborarem esta assertiva.
Prebióticos e probióticos
Probióticos sao microrganismos vivos que, administrados em quantidades adequadas, conferem benefícios à saúde de quem os ingere288. Prebióticos sao componentes alimentares nao digeríveis que estimulam seletivamente a proliferaçao ou atividade de populaçoes de bactérias desejáveis no intestino (colon), beneficiando o indivíduo hospedeiro dessas bactérias290.
Estudo pioneiro com grávidas de risco para atopia, utilizando Lactobacilus GG ou placebo, no período pré e pós-natal, mostrou reduçao à metade, aos dois anos de vida, na prevalência de eczema atópico, em comparaçao àquelas crianças cujas maes receberam placebo durante a gestaçao; este efeito protetor permaneceu até os sete anos de idade291,292.
Metanálise (17 estudos e 4.755 crianças) mostrou risco relativo significantemente inferior para desenvolver alergias no grupo tratado com probiótico, quando comparado ao controle, sobretudo para aquelas gestantes que receberam mistura de cepas probióticas, em relaçao as que receberam uma cepa isoladamente293.
Estudos em animais mostraram que a modificaçao da microbiota modula as respostas do sistema imunológico e reduz as taxas de sensibilizaçao e de inflamaçao alérgica. Um aspecto sobre os efeitos imunoestimulatórios dos probióticos é sua capacidade, por meio da modificaçao do microbioma, de reduzir o número de infecçoes do trato respiratório superior, que conhecidamente estao relacionadas à sibilância recorrente do lactente, à obstruçao das vias aéreas, e ao processo de sensibilizaçao alérgica. Esta modificaçao da microbiota, tanto intestinal quanto respiratória, associada à utilizaçao precoce de cepas probióticas, pode se prolongar até a vida adulta, determinando fenótipos asmáticos distintos, os quais diferem na resposta imunológica e nos mecanismos patofisiológicos envolvidos294-296.
A administraçao de probióticos para prevençao ou tratamento de doenças alérgicas tem resultados conflitantes. Em primeira análise, revisao sistemática de estudos mostrou que a administraçao de probióticos no período neonatal reduziu os níveis de IgE total e sensibilizaçao atópica, mas nao reduziu o aparecimento de asma ou sibilância297.
No entanto, o momento da introduçao de tais cepas probióticas parece ser fundamental, pois probióticos administrados somente no período pré-natal ou no pós-natal nao preveniram atopia e alergia alimentar mediada por IgE, mas poderiam ser efetivos se a administraçao fosse nos dois períodos, pré e pós-natal298.
Mesmo com alguns resultados negativos de probióticos na prevençao de doenças alérgicas e asma/sibilância recorrente, exceto dermatite atópica, evidenciados em três metanálises, a Organizaçao Mundial de Alergia (WAO), em recente guia, sugere como recomendaçoes: o uso de probióticos na gestante e lactante de risco para atopia; e no lactente com o mesmo perfil de risco para desenvolvimento de alergias, por considerar estratégia benéfica na prevençao do eczema atópico, e, desta maneira, diminuir a possibilidade de evoluçao da "marcha alérgica", com posterior aparecimento de rinite alérgica e/ou asma297,299-301.
Embora o documento da WAO seja rigoroso e baseado em evidências, revisao sistemática recente da Cochrane, envolvendo 3.720 participantes (adultos e crianças) mostrou que os probióticos sao estatisticamente capazes de reduzir o número de infecçoes das vias aéreas superiores (IVAS), sua duraçao, o uso de antibiótico e o absenteísmo escolar/trabalho. No entanto, os próprios autores reconhecem a fragilidade das conclusoes por terem analisado estudos com diferentes cepas, em diferentes populaçoes etárias302,303.
Estudo caso-controle, realizado com matriz de probióticos em doses elevadas durante 8 semanas em lactentes brasileiros nao demonstrou efeito em reduzir a recorrência de sibilância304. Portanto, a prevençao ou tratamento de doenças alérgicas com probióticos em populaçoes de risco ou nao para atopia, aguarda estudos mais robustos, controlados e randômicos para sua indicaçao com esta finalidade.
Prebióticos sao alimentos nao digeríveis e seletivamente fermentados que modificam a composiçao e funçao da microbiota intestinal, conferindo benefícios para o indivíduo305.
Nos mesmos moldes da análise feita para os probióticos pela WAO, um grupo de pesquisadores na área realizou revisao sistemática de estudos randômicos e controlados de prebióticos na prevençao de alergia. Embora nao tenham sido identificados estudos de suplementaçao de prebióticos em gestantes ou nutrizes, o painel sugere a suplementaçao de prebióticos em lactentes nao amamentados exclusivamente ao seio para a prevençao de doenças alérgicas, no intuito de reduzir o risco de asma/sibilância recorrente e alergia alimentar306.
Mais recentemente, estes mesmos autores, em revisao sistemática, encontraram somente dois estudos e sugeriram, por meio de evidências indiretas, que os prebióticos poderiam reduzir a sibilância recorrente, mas com pouca segurança, pelo número baixo do efeito estimado291.
Revisao sistemática da Cochrane mostrou nao haver efeito significativo na prevençao de sibilância por prebióticos, mas incluiu prematuros no estudo307.
Muitos fatores dificultam a comparaçao entre os vários estudos com pré e probióticos, devido à considerável heterogeneidade no seu desenho, do tamanho amostral, métodos de análise do microbioma intestinal e localizaçao geográfica. Atualmente, nao existe uma recomendaçao positiva consistente para usar pré ou probióticos para a prevençao ou tratamento de doenças alérgicas. Embora existam evidências científicas válidas in vitro, nao há informaçoes suficientes para sugerir o uso de probióticos específicos na prevençao de alergias e asma310. Assim, concluindo este tópico, estes produtos nao sao indicados, pois podem onerar a família, sem benefícios evidentes.
Imunoterapia materna durante a gestaçao
A imunoterapia alérgeno-específica (IAE) tem como característica modular a resposta imunológica, desviando do padrao linfocitário Th2 dependente, e, por isso, seria capaz de modificar a história natural da doença atópica. Neste sentido, a Academia Europeia de Alergia e Imunologia Clínica recomenda a IAE como estratégia de prevençao primária e secundária. Por exemplo, estudos bem delineados mostram que a utilizaçao de IAE em pacientes com rinite alérgica seria estratégia capaz de prevenir o aparecimento de asma futura. Neste sentido, surge um questionamento: seria a IAE capaz de prevenir sibilância em lactentes, quando realizada na mulher/ grávida com risco para atopia309,310.
Estudo caso-controle comparou crianças nascidas de maes que utilizaram IAE por pelo menos nove meses antes do parto com um grupo controle. A razao de chance de desenvolver asma ou qualquer doença alérgica foi significativamente menor nas crianças cujos pais alérgicos receberam IAE. Outros estudos nao-controlados seguiram crianças até dois anos de idade, e observaram prevençao primária de alergia, após IAE para inalantes, durante a gestaçao. Fato semelhante aconteceu com mulheres tratadas com imunoterapia para pólen de gramíneas durante a gestaçao, as quais desenvolveram anticorpos IgG específicos para o respectivo alérgeno, protegendo seus futuros filhos de sensibilizaçao IgE específica. Por isso, a IAE na gestaçao pode representar uma estratégia plausível para prevençao de sensibilizaçao alérgica nas crianças com risco para alergia311-315.
Concluindo, a IAE na grávida com sintomas de rinite e/ou asma poderá representar em futuro próximo uma estratégia de prevençao primária de doenças alérgicas às crianças de risco.
REFERENCIAS
1. Martinez FD, Wright AL, Taussig LM, Holberg CJ, Halonen M, Morgan WJ. Asthma and wheezing in the first six years of life. The Group Health Medical Associates. N Engl J Med.
1995;332:133-8.
2. Martinez FD. The connection between early life wheezing and subsequent asthma: the viral march. Allergol Immunopathol (Madr). 2009;37:249-51.
3. Aguirre V, Mallol J. Fisiologia do sistema respiratório na infância. In: Solé D, Wandalsen GF, Lanza FC, eds. Asma no lactente, na criança e no adolescente. 1ª ed. Rio de Janeiro: Atheneu; 2016. p. 13-16.
4. Ribeiro JD. Semiologia do sistema respiratório em crianças. In: Solé D, Wandalsen GF, Lanza FC, eds. Asma no lactente, na criança e no adolescente. 1ª ed. Rio de Janeiro: Atheneu, 2016. p. 17-28.
5. Global Initiative for Asthma - GINA- update 2018. Disponível em www.ginasthma.org. Acesso em janeiro de 2018.
6. Bacharier LB, Boner A, Carlsen KH, Eigenmann PA, Frischer T, Götz M, et al. Diagnosis and treatment of asthma in childhood: PRACTALL consensus report. Allergy. 2008;63(1):5-34.
7. Papadopoulos NG, Arakawa H, Carlsen KH, Custovic A, Gern J, Lemanske R, et al. International consensus on (ICON) pediatric asthma. Allergy. 2012;67(8):976-97.
8. Pisi G, Fainardi V, Aiello M, Bertorelli G, Crisafulli E, Chetta A. The role of the microbiome in childhood asthma. Immunotherapy. 2017;9(15):1295-304.
9. Lynch SV. The Lung Microbiome and Airway Disease. Ann Am Thorac Soc. 2016;13(5):S462-S465.
10. Teo SM, Mok D, Pham K, Kusel M, Serralha M, Troy N, et al. The infant nasopharyngeal microbiome impacts severity of lower respiratory inifection and risk of asthma development. Cell Host Microbe. 2015;17(5):704-15.
11. Rivas MN, Crother TR, Arditi M. The Microbiome in Asthma. Curr Opin Pediatr. 2016;28(6):764-71.
12. Sullivan A, Hunt E, MacSharry J, Murphy DM. The Microbiome and the Pathophysiology of Asthma. Resp Res. 2016;17:163.
13. Lemanske RF Jr, Jackson DJ, Gangnon RE, Evans MD, Li Z, Shult PA, et al. Rhinovirus illnesses during infancy predict subsequent childhood wheezing. J Allergy Clin Immunol. 2005;116:571-7.
14. Rosenthal LA, Avila PC, Heymann PW, Martin RJ, Miller EK, Papadopoulos NG, et al. Viral respiratory tract infections and asthma: the course ahead. J Allergy Clin Immunol. 2010;125:1212-7.
15. Thomas AO, Lemanske RF Jr., Jackson DJ. Infections and their role in childhood asthma inception. Pediatr Allergy Immunol. 2014;25(2):122-8.
16. Kim CK, Callaway Z, Gern JE. Viral infections and associated factors that promote acute exacerbations of asthma. Allergy Asthma Immunol Res. 2018;10(1):12-7.
17. Law BJ, Carbonell-Estrany X, Simoes EA. An update on respiratory syncytial virus epidemiology: a developed country perspective. Respir Med. 2002;96:S1-S7.
18. Ducoffre G, Cauchi P, Hendrickx E. Respirarory syncytial virus epidemiology in Belgium in 1998, 1999 and 2000. J Perinat Med. 2001;29(Suppl I, Part 2):352.
19. Smyth RL, Openshaw PJM. Bronchiolitis. Lancet. 2006;368:312-22.
20. Glezen WP, Paredes A, Allison JE, Taber KH, Frank AL. Risk of respiratory syncytial virus infection for infants from low-income families in relationship to age, sex, ethnic group, and maternal antibody level. J Pediatr.
1981;98:708-15.
21. Macanerney JM, Johnson S, Schoub BD. Surveillance of respiratory viruses: a 10-year laboratory-based study. S Afr Med J.
1994;84:473-7.
22. Hemming VG. Viral respiratory diseases in children: classification, etiology, epidemiology, and risk factors. J Pediatr.1994;124:S13-S60.
23. Knott AM, Long CE, Hall CB. Parainfluenza viral infections in pediatrics outpatients: seasonal patterns and clinical characteristics. Pediatr Infect Dis J.
1994;13:269-73.
24. Woo PC, Lau SK, Chu CM. Characterization and complete genome sequence of a novel coronavirus HKU1 from patients with pneumonia. J Virol. 2005;79:884-95.
25. Foulongne V, Rodière M, Segondy M. Human Bocavirus in children. Emerg Infect Dis. 2006;12:1-4.
26. Manoha C, Espinosa S, Aho SL, Huet F, Pothier P. Epidemiological and clinical features of HMPV, RSV and RVs infections in young children. J Clin Virol. 2007;38:221-6.
27. Korppi M, Kotaniemi-Syrjanen A, Waris M, Vainionpaa R, Reijonen TM. Rhinovirus-associated wheezing in infancy: comparison with respiratory syncytial virus bronchiolitis. Pediatr Infect Dis J. 2004;23(11):995-9.
28. Fuji N, Suzuki A, Lupisan S, Sombrero L, Galang H, Kamigaki T, et al. Detection of human rhinovirus C viral genome in blood among children with severe respiratory infections in the Philippines. PLoS One. 2011;6(11):e27247.
29. Lee WM, Lemanske RF Jr, Evans MD, Vang F, Pappas T, Gangnon R, et al. Human rhinovirus species and season of infection determine illness severity. Am J Respir Crit Care Med. 2012;186(9):886-91.
30. Cox DW, Bizzintino J, Ferrari G, Khoo SK, Zhang G, Whelan S, et al. Human rhinovirus species C infection in young children with acute wheeze is associated with increased acute respiratory hospital admissions. Am J Respir Crit Care Med. 2013;188(11):1358-64.
31. Monto AS. The seasonality of rhinovirus infections and its implications for clinical recognition. Clin Ther. 2002;24:1987-97.
32. Johnston NW, Johnston SL, Duncan JM, Greene JM, Kebadze T, Keith PK, et al. The September epidemic of asthma exacerbations in children: a search for etiology. J Allergy Clin Immunol. 2005;115:132-8.
33. Stern DA, Guerra S, Halonen M, Wright AL, Martinez FD. Low IFNgamma production in the first year of life as a predictor of wheeze during childhood. J Allergy Clin Immunol. 2007;120:835-41.
34. Kim JH, Kim YS, Cho GS, Kim NH, Gong CH, Lee BJ, et al. Human rhinovirus-induced proinflammatory cytokine and Interferon-β responses in nasal epithelial cells from chronic rhinosinusitis patients. Allergy Asthma Immunol Res. 2015;7:489-96.
35. Bochkov YA, Palmenberg AC, Lee WM, Rathe JA, Amineva SP, Sun X, et al. Molecular modeling, organ culture and reverse genetics for a newly identified human rhinovirus C. Nat Med. 2011;17:627-32.
36. Fraenkel DJ, Bardin PG, Sanderson G, Lampe F, Johnston SL, Holgate ST. Lower airways inflammation during rhinovirus colds in normal and in asthmatic subjects. Am J Respir Crit Care Med.
1995;151:879-86.
37. Handzel ZT, Busse WW, Sedgwick JB, Vrtis R, Lee WM, Kelly EA, et al. Eosinophils bind rhinovirus and activate virus-specific T cells. J Immunol.
1998;160:1279-84.
38. Chihara J, Urayama O, Tsuda A, Kakazu T, Higashimoto I, Yamada H. Eosinophil cationic protein induces insulin-like growth factor I receptor expression on bronchial epithelial cells. Int Arch Allergy Immunol.
1996;111(Suppl 1):43-5.
39. Papadopoulos NG, Gourgiotis D, Javadyan A, Bossios A, Kallergi K, Psarras S, et al. Does respiratory syncytial virus subtype influences the severity of acute bronchiolitis in hospitalized infants? Respir Med. 2004;98:879-82.
40. Oliveira TF, Freitas GR, Ribeiro LZ, Yokosawa J, Siqueira MM, Portes SA, et al. Prevalence and clinical aspects of respiratory syncytial virus A and B groups in children seen at Hospital de Clínicas of Uberlândia, MG, Brazil. Mem Inst Oswaldo Cruz. 2008;103:417-22.
41. Chong-Silva DC. Asma e Infecçoes virais: o ovo ou a galinha? J Paran Ped. 2009;10:14-16.
42. Liu AH, Covar RA, Spahn JD, Leung DY. Childhood asthma. In: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, editors. Nelson textbook of pediatrics.
18th ed. Philadelphia (PA): Saunders Elsevier; 2007. p. 953-70.
43. Sims DG, Downham MA, Gardner PS. Study of 8-year-old children with a history of respiratory syncytial virus bronchiolitis in infancy. BMJ.
1978;1:11-7.
44. Sigurs N, Bjarnason R, Sigursbergsson F, Kjellman B, Brorksten B. Asthma and immunoglobulin E antibodies after respiratory syncytial virus bronchiolitis: a prospective cohort study with matched controls. Pediatrics.
1995;95:500-5.
45. Stein RT, Sherill D, Morgan WJ, Holberg CJ, Halonen M, Taussig LM, et al. Respiratory syncycial virus in early life and risk of wheeze and allergy by age 13. Lancet.
1999;354: 541-5.
46. Ehlenfield DR, Cameron K, Welliver RC. Eosinophilia at the time of respiratory syncytial virus bronchiolitis predicts childhood reactive airway disease. Pediatrics. 2000;105:79-83.
47. Chong DC, Raboni SM, Abujamra K, Marani DM, Nogueira MB, Tsuchiya LR, et al. Respiratory virus in pediatric necropsies: an immunohistochemical study. Pediatr Develop Pathol. 2009;12:211-6.
48. Queiróz DA, Durigon EL, Botosso VF, Ejzemberg B, Vieira SE, Mineo JR, et al. Immune response to respiratory syncytial virus in young Brazilian children. Braz J Med Biol Res. 2002;35:1183-93.
49. Mohopatra SS, Lockey RF. Respiratory Syncytial Virus infection: from biology to therapy, a perspective. WAO Journal. 2008;1:21-8.
50. Welliver RC, Garofalo RP, Ogra PL. Beta-chemokines, but neither T helper type 1 nor T helper type 2 cytokines, correlate with severity of illness during respiratory syncytial virus infection. Pediatr Infect Dis J. 2002;21:457-61.
51. Noah TL, Becker S. Chemokines in nasal secretions of normal adults experimentally infected with respiratory syncytial virus. Clin Immunol. 2000;97:43-9.
52. Adams O, Weis J, Jasinska K, Vogel M, Tenenbaum T. Comparison of human metapneumovirus, respiratory syncytial virus and Rhinovirus respiratory tract infections in young children admitted to hospital. J Med Virol. 2015;87(2):275-8.
53. Matsuse H, Tsuchida T, Fukahori S, Kawano T, Tomari S, Matsuo N, et al. Differential airway inflammatory responses in asthma exacerbations induced by respiratory syncytial virus and influenza virus A. Int Arch Allergy Immunol. 2013;161:378-82.
54. Borish L, Rosenwasser LJ. Cytokines in allergic inflammation. In: Adkinson NF, Yunginger JW, Busse WW, Bochner BS, Holgate ST, Simons FE, eds. Middleton's allergy principles & practice. 6th ed. St. Louis (MO): Mosby; 2003. p. 35-57.
55. Welliver RC. Respiratory syncytial virus immunoglobulin and monoclonal antibodies in the prevention and treatment of respiratory syncytial virus infection. Sem Perinatol.
1994;22:87-95.
56. Bont L, Van Aalderen WMC, Kimpen JLL. Long-term consequences of respiratory syncycial virus (RSV) bronchiolitis. Paediatr Respir Rev. 2000;1:221-7.
57. Openshaw PJ, Tregoning JS. Immune responses and disease enhancement during respiratory syncytial virus infection. Clin Microbiol Rev. 2005;18:541-55.
58. Larrañaga C, Avendano L. Infección por virus sincicial respiratorio humano. Rev Chil Infectol.
1990;7:189-95.
59. Welliver RC, Duffy L. The relationship of RSV-specific immunoglobulin E antibody responses in infancy, recurrent wheezing, and pulmonary function at age 7-8 years. Pediatr Pulmonol.
1993;15:19-27.
60. Caswell SJ, Thomson AH, Ashmore SP, Beardsmore CS, Simpson H. Lactent sensitization to respiratory syncytial virus during acute bronchiolitis and lung function after recovery. Arch Dis Child.
1990;65:946-52.
61. Martinez FD, Stern DA, Wright AL, Taussig LM, Halonen M. Differential immune response to acute lower respiratory illness in early life and subsequent development of persistent wheezing and asthma. J Allergy Clin Immunol.
1998;102:915-20.
62. Sigurs N, Bjarnason R, Sigurbergsson F. Eosinophil cationic protein in nasal secretion and in serum and myeloperoxidase in serum in respiratory syncytial virus bronchiolitis: relation to asthma and atopy. Acta Paediatr.
1994;83:1151-5.
63. Singh AM, Moore PE, Gern JE, Lemanske RF Jr, Hartert TV. Bronchiolitis to asthma: a review and call for studies of gene-virus interactions in asthma causation. Am J Respir Crit Care Med. 2007;175(2):108-19.
64. Faber TE, Schuurhof A, Vonk A, Koppelman GH, Hennus MP, Kimpen JL, et al. IL1RL1 gene variants and nasopharyngeal IL1RL-a levels are associated with severe RSV bronchiolitis: a multicenter cohort study. PLoS One. 2012;7(5):e34364.
65. Martinez FD, Morgan WJ, Wright AL, Holberg CJ, Taussig LM. Diminished lung function as a predisposing factor for wheezing respiratory illness in infants. N Engl J Med.
1988;319:1112-7.
66. Folkerts G, Nijkamp FP. Virus-induced airway hyperresponsiviness - role of inflammatory cells and mediators. Am J Respir Crit Care Med.
1995;151:1666-74.
67. Noma T, Mori A, Yoshizawa I. Induction of allergen-specific IL-2 responsiviness of lymphocytes after respiratory syncytial virus infection and prediction of onset of recurrent wheezing and bronchial asthma. J Allergy Clin Immunol.
1996;98:1-26.
68. Fonseca CB, Grisi S. Bronchiolitis, respiratory syncytial virus and recurrent wheezing: what is the relationship? Hosp Clin Fac Med S Paulo. 2003;58:39-48.
69. Meissner C, Storch GA. Picornaviruses: poliovirus, other enteroviruses, and the rhinoviruses. In: Schaechter M, Engleberg NC, Eisenstein BI, Medoff G, eds. Mechanisms of microbial disease. 3rd ed. Philadelphia (PA): Lippincott Williams & Wilkins; 1999. p.
305-14.
70. Smura T, Ylipaasto P, Klemola P, Kaijalainen S, Kyllönen L, Sordi V, et al. Cellular tropism of human enterovirus D species serotypes EV-94, EV-70, and EV-68 in vitro: implications for pathogenesis. J Med Virol. 2010;82:1940-9.
71. Foster CB, Friedman N, Carl J, Piedimonte G. Enterovirus D68: a clinically important respiratory enterovirus. Cleve Clin J Med. 2015;82:26-31.
72. Imamura T, Okamoto M, Nakakita S, Suzuki A, Saito M, Tamaki R, et al. Antigenic and receptor binding properties of enterovirus 68. J Virol. 2014;88:2374-84.
73. Glezen WP. Asthma, influenza, and vaccination. J Allergy Clin Immunol. 2006;118:1199-206.
74. Glezen WP, Greenberg SB, Atmar RL, Piedra PA, Couch RB. Impact of respiratory virus infections on persons with chronic underlying conditions. JAMA. 2000;283:499-505.
75. Miller EK, Griffin MR, Edwards KM, Weinberg GA, Szilagyi PG, Staat MA, et al. Influenza burden for children with asthma. Pediatrics. 2008;121:1-8.
76. Garcia-Garcia ML, Calvo C, Casas I, Bracamonte T, Rellan A, Gozalo F, et al. Human metapneumovirus bronchiolitis in infancy is an important risk factor for asthma at age 5. Pediatr Pulmonol. 2007;42:458-64.
77. Bisgaard H, Hermansen MN, Buchvald F, Loland L, Halkjaer LB, Bonnelykke K, et al. Childhood asthma after bacterial colonization of the airway in neonates. N Engl J Med. 2007;357(15):1487-95.
78. De Schutter I, Dreesman A, Soetens O, De Waele M, Crokaert F, Verhaegen J, et al. In young children, persistent wheezing is associated with bronchial bacterial infection: a retrospective analysis. BMC Pediatr. 2012;12:83.
79. Kraft M, Cassell GH, Henson JE, Watson H, Williamson J, Marmion BP, et al. Detection of Mycoplasma pneumoniae in the airways of adults with chronic asthma. Am J Respir Crit Care Med.
1998;158:998-1001.
80. Hahn DL, Dodge RW, Golubjatnikov R. Association of Chlamydia pneumoniae (strain TWAR) infection with wheezing, asthmatic bronchitis, and adult-onset asthma. JAMA.
1991;266(2):225-30.
81. Kraft M, Cassell GH, Pak J, Martin RJ. Mycoplasma pneumoniae and Chlamydia pneumoniae in asthma: effect of clarithromycin. Chest. 2002;121(6):1782-8.
82. Wood PR, Hill VL, Burks ML, Peters JI, Singh H, Kannan TR, et al. Mycoplasma pneumoniae in children with acute and refractory asthma. Ann Allergy Asthma Immunol. 2013;110(5):328-34.
83. Belanger K, Beckett W, Triche E, Bracken MB, Holford T, McSharry J, et al. Symptoms of wheeze and persistent cough in the first year of life: associations with indoor allergens, air contaminants, and maternal history of asthma. Am J Epidemiol. 2003;158:195-202.
84. Chong Neto HJ, Rosário NA; Grupo EISL Curitiba (Estudio Internacional de Sibilancias en Lactantes). Risk factors for wheezing in the first year of life. J Pediatr (Rio J). 2008; 84(6):495-502.
85. Kulig M, Bergmann R, Tacke U, Wahn U, Guggenmoos-Holzmann I. Long-lasting sensitization to food during the first two years precedes allergic airway disease. The MAS Study Group, Germany. Pediatr Allergy Immunol.
1998;9:61-7.
86. Dharmage SC, Lowe AJ, Matheson MC, Burgess JA, Allen KJ, Abramson MJ. Atopic dermatitis and the atopic march revisited. Allergy. 2014;69(1):17-27.
87. von Kobyletzki LB, Bornehag CG, Hasselgren M, Larsson M, Lindstrom CB, Svensson A. Eczema in early childhood is strongly associated with the development of asthma and rhinitis in a prospective cohort. BMC Dermatol. 2012;12:11.
88. Warner JO; ETAC Study Group. Early Treatment of the Atopic Child. A double-blinded, randomized, placebo-controlled trial of cetirizine in preventing the onset of asthma in children with atopic dermatitis: 18 months' treatment and 18 months' post treatment follow-up. J Allergy Clin Immunol. 2001;108(6):929-37.
89. Filipiak-Pittroff B, Schnopp C, Berdel D, Naumann A, Sedlmeier S, Onken A, et al. Predictive value of food sensitization and filaggrin mutations in children with eczema. J Allergy Clin Immunol. 2011;128(6):1235-41.
90. Zeiger RS, Heller S. The development and prediction of atopy in high-riskchildren: follow-up at age seven years in a prospective randomized study of combined maternal and infant food allergen avoidance. J Allergy Clin Immunol.
1995;95:1179-90.
91. Lodge CJ, Lowe AJ, Gurrin LC, Hill DJ, Hosking CS, Khalafzai RU, et al. House dust mite sensitization in toddlers predicts current wheeze at age 12 years. J Allergy Clin Immunol. 2011;128:782-8.
92. Sly PD, Boner AL, Bjorksten B, Bush A, Custovic A, Eigenmann PA, et al. Early identification of atopy in the prediction of persistent asthma in children. Lancet. 2008;372:1100-6.
93. Stoltz DJ, Jackson DJ, Evans MD, Gangnon RE, Tisler CJ, Gern JE, et al. Specific patterns of allergic sensitization in early childhood and asthma & rhinitis risk. Clin Exp Allergy. 2013;43:233-41.
94. Illi S, von Mutius E, Lau S, Niggemann B, Grüber C, Wahn U, et al. Perennial allergen sensitisation early in life and chronic asthma in children: a birth cohort study. Lancet. 2006;368:763-70.
95. Simpson A, Soderstrom L, Ahlstedt S, Murray CS, Woodcock A, Custovic A. IgE antibody quantification and the probability of wheeze in preschool children. J Allergy Clin Immunol. 2005;116:744-9.
96. Lazic N, Roberts G, Custovic A, Belgrave D, Bishop CM, Winn J, et al. Multiple atopy phenotypes and their associations with asthma: similar findings from two birth cohorts. Allergy. 2013;68:764-70.
97. Just J, Gouvis-Echraghi R, Rouve S, Wanin S, Moreau D, Annesi- Maesano I. Two novel, severe asthma phenotypes identified during childhood using a clustering approach. Eur Respir J. 2012;40:55-60.
98. Garden FL, Simpson JM, Marks GB; CAPS Investigators. Atopy phenotypes in the Childhood Asthma Prevention Study (CAPS) cohort and the relationship with allergic disease: clinical mechanisms in allergic disease. Clin Exp Allergy. 2013;43:633-41.
99. Belgrave DC, Buchan I, Bishop C, Lowe L, Simpson A, Custovic A. Trajectories of lung function during childhood. Am J Respir Crit Care Med. 2014;189:1101-9.
100. Rubner FJ, Jackson DJ, Evans MD, et al. Early life rhinovirus wheezing, allergic sensitization, and asthma risk at adolescence. J Allergy Clin Immunol. 2017;139(2):501-7.
101. Chang TS, Lemanske RF Jr, Guilbert TW, Gern JE, Coen MH, Evans MD, et al. Evaluation of the modified asthma predictive index in high-risk preschool children. J Allergy Clin Immunol Pract. 2013;1(2):152-6.
102. Collins AS, Lockett GA, Holloway JW. The Genetics of Allergic Disease and Asthma. In: Leung DYM, Szefler SJ, Bonilla FA, Cezmi A Akdis CA, Sampson H, eds. Pediatric Allergy: Principles and Practice. 3rd Edition. Elsevier. p.
18-30.
103. Mallol J, García-Marcos L, Aguirre V, Martinez-Torres A, Perez- Fernández V, Gallardo A, et al. The international study of wheezing in infants: questionnaire validation. Int Arch Allergy Immunol. 2007;144:44-50.
104. Garcia-Marcos L, Mallol J, Solé D, Brand PL, EISL Study Group. International study of wheezing in infants: risk factors in affluent and non-affluent countries during the first year of life. Pediatr Allergy Immunol. 2010;21:878-88.
105. Mallol J, García-Marcos L, Solé D, Brand P; EISL Study Group. International prevalence of recurrent wheezing during the first year of life: variability, treatment patterns and use of health resources. Thorax. 2010;65:1004-9.
106. Mallol J, Solé D, Garcia-Marcos L, Rosário NA, Aguirre V, Chong HJ, et al. Prevalence, Severity, and Treatment of Recurrent Wheezing During the First Year of Life: A Cross-Sectional Study of 12,405 Latin American Infants. Allergy Asthma Immunol Res. 2016;8(1):22-31.
107. Fogaça HR, Marson FA, Toro AA, Solé D, Ribeiro JD. Epidemiological aspects of and risk factors for wheezing in the first year of life. J Bras Pneumol. 2014;40:617-25.
108. Chong Neto HJ, Rosario N, Solé D, Mallol J. Prevalência de sibilância recorrente em lactentes. J Pediatr (Rio J). 2007;83:357-62.
109. Chong Neto HJ, Rosário N, Grassellis EA, Silvas FC, Bojarski L, Rosario CS, et al. Sibilância recorrente em lactentes: mudanças epidemiológicas. J Pediatr (Rio J). 2011;87:547-50.
110. Dela Bianca AC, Wandalsen GF, Mallol J, Sole D. Prevalence and severity of wheezing in the first year of life. J Bras Pneumol. 2010;36:402-9.
111. Aranda CS, Wandalsen GF, Fonzar LF, Dela Bianca ACC, Mallol J, Solé D. Risk factors for recurrent wheezing - International Study of Wheezing in Infants (EISL) Phase 3. Allergol immunopathol. 2016;44(1):3-8.
112. Aranda CS, Wandalsen GF, Dela Bianca AC, Moraes L, Lamenha Medeiros M, Mallol J, et al. Wheezing and the first thousand days of life. Pediatr Allergy Immunol. 2017;28(4):397-400.
113. International Study of Asthma and Allergies in Childhood Steering Committee. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet.
1998;351:1225-32.
114. Asher MI, Montefort S, Björkstén B, Lai CK, Strachan DP, Weiland SK, et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. Lancet. 2006;368:733-43.
115. Solé D, Wandalsen GF, Camelo-Nunes IC, Naspitz CK, ISAAC - Grupo Brasileiro. Prevalence of symptoms of asthma, rhinitis, and atopic eczema among Brazilian children and adolescents identified by the International Study of Asthma and Allergies in Childhood (ISAAC). Phase 3. J Pediatr (Rio J). 2006;82:341-6.
116. de Farias MR, Rosa AM, Hacon SS, de Castro HA, Ignotti E. Prevalence of asthma in schoolchildren in Alta Floresta- a municipality in the southeast of the Brazilian Amazon. Rev Bras Epidemiol. 2010;13:49-57.
117. Menin AMCR. Prevalência e gravidade dos sintomas de asma, rinite e eczema, em escolares de 6 a 7 anos, na cidade de Sao José do Rio Preto, SP, avaliados pelo ISAAC (International Study of Asthma and Allergies in Childhood) [tese de mestrado]. Ribeirao Preto (SP): USP, Faculdade de Medicina de Ribeirao Preto; 2008.
118. Castro LK, Cerci Neto A, Ferreira Filho OF. Prevalence of symptoms of asthma, rhinitis and atopic eczema among students between 6 and 7 years of age in the city of Londrina, Brazil. J Bras Pneumol. 2010;36:286-92.
119. Stelmach R, Neto AC, Fonseca AC, Ponte EV, Alves G, Araujo- Costa IN, et al. A workshop on asthma management programs and centers in Brazil: reviewing and explaining concepts. J Bras Pneumol. 2015;41:3-15.
120. Prietsch SOM, Zhang L, Catharino AR, Vauchinski L, Rodrigues FE. Mortalidade por asma em crianças brasileiras de até 19 anos de idade no período entre 1980 a 2007. J Pediatr (Rio J). 2012;88(5):384-8.
121. Rackemann F. A working classification of asthma. Am J Med.
1947;3:601-6.
122. Wenzel SE, Szefler SJ, Leung DY, Sloan SI, Rex MD, Martin RJ. Bronchoscopic evaluation of severe asthma. Persistent inflammation associated with high dose glucocorticoids. Am J Respir Crit Care Med.
1997;156:737-43.
123. Wenzel SE. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med. 2012;18(5):716-25.
124. Lötvall J, Akdis CA, Bacharier LB, Bjermer L, Casale TB, Custovic A, et al. Asthma endotypes: a new approach to classification of disease entities within the asthma syndrome. Allergy Clin Immunol. 2011;127(2):355-60.
125. Canonica GW, Ferrando M, Baiardini I, Puggioni F, Racca F, Passalacqua G, et al. Asthma: personalized and precision medicine. Curr Opin Allergy Clin Immunol. 2018;18(1):51-8.
126. Brand PL, Baraldi E, Bisgaard H, Boner AL, Castro-Rodriguez JA, Custovic A, et al. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence-based approach. Eur Respir J. 2008;32(4):1096-110.
127. Castro-Rodriguez JA, Holberg CJ, Wright AL, Martinez FD. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med. 2000;162:1403-6.
128. Guilbert TW, Morgan WJ, Zeiger RS, Bacharier LB, Boehmer SJ, Krawiec M, et al. Atopic characteristics of children with recurrent wheezing at high risk for the development of childhood asthma. J Allergy Clin Immunol. 2004;114(6):1282-7.
129. Wang F, He XY, Baines KJ, Gunawardhana LP, Simpson JL, Li F, et al. Different inflammatory phenotypes in adults and children with acute asthma. Eur Respir J. 2011;38(3):567-74.
130. Baines KJ, Simpson JL, Wood LG, Scott RJ, Fibbens NL, Powell H, et al. Sputum gene expression signature of 6 biomarkers discriminates asthma inflammatory phenotypes. J Allergy Clin Immunol. 2014;133(4):997-1007.
131. Park HW, Dahlin A, Tse S, Duan QL, Schuemann B, Martinez FD, et al. Genetic predictors associated with improvement of asthma symptoms in response to inhaled corticosteroids. J Allergy Clin Immunol. 2014;133(3):664-9.
132. Davidson EJ, Yang IV. Role of epigenetics in the development of childhood asthma. Curr Opin Allergy Clin Immunol. 2018 Jan 31. doi: 10.1097/ACI.0000000000000429.
133. Brand PL, Caudri D, Eber E, Gaillard EA, Garcia-Marcos L, Hedlin G, et al. Classification and pharmacological treatment of preschool wheezing: changes since 2008. Eur Respir J. 2014;43(4):1172-7.
134. Just J, Saint-Pierre P, Gouvis-Echraghi R, Boutin B, Panayotopoulos V, Chebahi N, et al. Wheeze phenotypes in young children have different courses during the preschool period. Ann Allergy Asthma Immunol. 2013;111(4):256-61.
135. Schultz A, Brand PL. Episodic viral wheeze and multiple trigger wheeze in preschool children: a useful distinction for clinicians? Paediatr Respir Rev. 2011;12(3):160-4.
136. van Wonderen KE, Geskus RB, van Aalderen WM, Mohrs J, Bindels PJ, van der Mark LB, et al. Stability and predictiveness of multiple trigger and episodic viral wheeze in preschoolers. Clin Exp Allergy. 2016;46(6):837-47.
137. Schultz A, Devadason SG, Savenije OEM, Sly PD, Le Souf PN, Brand PLP. The transient value of classifying preschool wheeze into episodic viral wheeze and multiple trigger wheeze. Acta Paediatr Int J Paediatr. 2010;99(1):56-60.
138. Just J, Saint-Pierre P, Amat F, Gouvis-Echraghi R, Lambert- Guillemot N, Guiddir T, et al. What lessons can be learned about asthma phenotypes in children from cohort studies? Pediatr Allergy Immunol. 2015;26(4):300-5.
139. Spycher BD, Cochrane C, Granell R, Sterne JAC, Silverman M, Pedersen E, et al. Temporal stability of multitrigger and episodic viral wheeze in early childhood. Eur Respir J. 2017;50(5). doi: 10.1183/13993003.00014-2017.
140. Ducharme FM, Tse SM, Chauhan B. Diagnosis, management, and prognosis of preschool wheeze. Lancet. 2014;383:1593-604.
141. Cane RS, Ranganathan SC, McKenzie SA. What do parents of wheezy children understand by "wheeze?" Arch Dis Child. 2000;82:327-32.
142. Espindola Filho M, Cavalcanti E, Silva Junior W, Bezerra P, Melo E, Britto M. Accuracy of wheezing in infants and preschool children by written questionnaire. In: 16th International Congress on Pediatric Pulmonology. Lisbon; 2017.
143. Lustosa G, Britto M, Bezerra P. Manejo de crises asmáticas em crianças: conhecimento de profissionais de saúde quanto ao tópico em hospitais-escola do Recife (PE). J Bras Pneumol. 2011;37:584-8.
144. Castro-Rodriguez JA. The Asthma Predictive Index: a very useful tool for predicting asthma in young children. J Allergy Clin Immunol. 2010;126(2):212-6.
145. Bousquet J, Gern JE, Martinez FD, Anto JM, Johnson CC, Holt PG, et al. Birth cohorts in asthma and allergic diseases: report of a NIAID/NHLBI/MeDALL joint workshop. J Allergy Clin immunol. 2004;133(6):1535-46.
146. Devulapalli CS, Carlsen KC, Håland G, Munthe-Kaas MC, Pettersen M, Mowinckel P, et al. Severity of obstructive airways disease by age 2 years predicts asthma at 10 years of age. Thorax. 2008;63(1):8-13.
147. Brand PL, Caudri D, Eber E, Gaillard EA, Garcia-Marcos L, Hedlin G, et al. Classification and pharmacological treatment of preschool wheezing: changes since 2008. Eur Respir J. 2014;43(4):1172-7.
148. Sherriff A, Peters TJ, Henderson J, Strachan D; ALSPAC Study Team. Avon Longitudinal Study of Parents and Children. Risk factor associations with wheezing patterns in children followed longitudinally from birth to 3(1/2) years. Int J Epidemiol. 2001;30(6):1473-84.
149. Brunekreef B, Smit J, de Jongste J, Neijens H, Gerritsen J, Postma D, et al. The prevention and incidence of asthma and mite allergy (PIAMA) birth cohort study: design and first results. Pediatr Allergy Immunol. 2002;13(Suppl 15):55-60.
150. Pescatore AM, Dogaru CM, Duembgen L, Silverman M, Gaillard EA, Spycher BD, Kuehni CE. A simple asthma prediction tool for preschool children with wheeze or cough. J Allergy Clin Immunol. 2014;133:111-18.
151. Smit HA, Pinart M, Antó JM, Keil T, Bousquet J, Carlsen KH,Moons KGM, Hooft L, Lodrup Carlsen KC. Childhood asthma prediction models: a systematic review. Lancet Respir Med. 2015;3:973-84.
152. Savenije OEM, Kerkhof M, Koppelman GH, Postma DS. Predicting who will have asthma at school age among preschool children. J Allergy Clin Immunol. 2012;130:325-31.
153. Johansson S. Milestones in understanding allergy and its diagnosis. Clin Exp All Rev. 2002;2:2-7.
154. Carr T, Saltoun C. Skin testing in allergy. Allergy Asthma Proc. 2012;33 (Suppl 1):S6-S8.
155. van der Valk J, Gerth van Wijk R, Hoorn E, Groenendijk L, Groenendijk IM, de Jong NW. Measurements and interpretation of skin prick test results. Clin Transl Allergy. 2016;23:6-8.
156. Bousquet J, Heinzerling L, Bachert C, Papadopoulos NG, Bousquet P, Burney P, et al. Global Allergy and Asthma European Network. Allergic Rhinitis and its Impact on Asthma. Practical guide to skin prick tests in allergy to aeroallergens. Allergy. 2012;67:18-24.
157. Aranda C, Cocco, R, Pierotti F, Mallozi M, Porto A, Goudouris E, et al. Increased sensitization to several allergens over a 12-year period in Brazilian children. Pediatr Allergy Immunol. 2018;29(3):321-4.
158. Kerkhof M, Dubois A, Postma D, Schouten J, de Monchy J. Role and interpretation of total serum IgE measurements in the diagnosis of allergic airway disease in adults. Allergy. 2003;58:905-11.
159. Moneret-Vautrin D, Kanny G, Halpern G. Detection of antibody IgE by in vitro tests and diagnosis of food allergy. Allerg Immunol (Paris).
1993;25:198-204.
160. Hamilton R, Williams P. Specific IgE Testing Force of the American Academy of Allergy, Asthma & Immunology; American College of Allergy, Asthma & Immunology. Human IgE antibody serology: a primer for the practicing North American allergist/immunologist. J Allergy Clin Immunol. 2010;126:33-8.
161. ThermoScientific ImmunoCAP Specific IgE. Disponível em: http://www.phadia.com/pt-BR/Produtos/Produtos/ImmunoCAPEnsaios/ImmunoCAP-Specific-IgE/. Acesso em: 18 de março de 2018.
162. Lopes de Oliveira L, Aderhold M, Brill M, Schulz G, Rolinck- Werninghaus C, Clare Mills E, et al. The value of specific IgE to peanuts and its component Ara h 2 in the diagnosis of peanut allergy. J Allergy Clin Immunol Pract. 2013;1:394-8.
163. Canonica G, Ansotegui I, Pawankar R, Schmid-Grendelmeier P, van Hage M, Baena-Cagnani C, et al. A WAO - ARIA - GA2LEN consensus document on molecular-based allergy diagnosis. World Allergy Organ J. 2013;6:1-17.
164. Ando H, Moverate R, Kondo Y, Tsuge I, Tanaka A, Borre M, et al. Utility of ovomucoid-specific IgE concentrations in predicting symptomatic egg allergy. J Allergy Clin Immunol. 2008;122:583-8.
165. Beydon N, Davis S, Lombardi E, Allen J, Arets J, Aurora P, et al. An official American Thoracic Society / European Respiratory Society statement: pulmonary function testing in preschool children. Am J Respir Crit Care Med. 2007;175:1304-45.
166. Lanza F, Wandalsen G. Funçao pulmonar em lactentes. In: Solé D, Wandalsen G, Lanza F, eds. Asma no lactente, na criança e no adolescente. Sao Paulo: Ed. Atheneu; 2017. p. 49-60.
167. Sly P, Tepper R, Henschen M, Gappa M, Stocks J, ERS/ATS Task Force for Infant Respiratory Function Testing. Eur Respir J. 2000;16:741-8.
168. Gappa M, Colin A, Goetz I, Stocks J. Passive respiratory mechanics: the occlusion techniques. Eur Respir J. 2001;17:141-8.
169. Stocks J, Godfrey S, Beardsmore C, Bar-Yishay E, Castile R, ERS/ATS Task force on Standards for Infant Respiratory Function Testing. Plethysmographic measurements of lung volume and airway resistance. Eur Respir J. 2001;17:302-12.
170. American Thoracic Society/European Respiratory Society. Statement: raised volume forced expirations in infants. Am J Respir Crit Care Med. 2005;172:1463-71.
171. Rosenfeld M, Allen J, Arets B, Aurora P, Beydon N, Calogero C, et al. An official American Thoracic Society workshop report: optimal lung function tests for monitoring cystic fibrosis, bronchopulmonary dysplasia, and recurrent wheezing in children less than 6 years of age. Ann Am Thoracic Soc. 2013;10:S1-S11.
172. Burity E, Pereira C, Rizzo J, Sarinho E, Jones M. Efeito da terminaçao precoce da expiraçao nos parâmetros espirométricos em crianças pré-escolares saudáveis. J Bras Pneumol. 2011;37:464-70.
173. França D, Camargos P, Jones M, Martins J, Vieira B, Colosimo E, et al. Prediction equations for spirometry in four- to six-year-old children. J Pediatr (Rio J). 2016;92:400-8.
174. Komarow H, Myles I, Uzzaman A, Metcalfe D. Impulse oscillometry in the evaluation of diseases of the airways in children. Ann Allergy Asthma Immunol. 2011;106:191-9.
175. Valle E. Resistência das vias aéreas: técnica da oscilaçao forçada. J Pneumol. 2002; 28(Supl 3):151-4.
176. Bickel S, Popler J, Lesnick B, Eid N. Impulse oscillometry. Chest. 2014;146:841-7.
177. Dos Santos K, Fausto LL, Camargos PAM, Kviecinski MR, da Silva J. Impulse oscillometry in the assessment of asthmatic children and adolescents: from a narrative to a systematic review. Paediatr Respir Rev. 2017;23:61-7.
178. Guilbert TW, Bacharier LB, Fitzpatrick AM. Severe asthma in children. J Allergy Clin Immunol Pract. 2014;2:489-500.
179. Finder J. Understanding Airway Disease in Infants. Curr Probl Pediatr.
1999;29:65-81.
180. Skytt N, Bonnelykke K, Bisgaard H. ''To wheeze or not to wheeze'': That is not the question. J Allergy Clin Immunol. 2012;130:403-7.
181. Weinberger M, Fischer A. Differential diagnosis of chronic cough in children. Allergy Asthma Proc. 2014;35:95-103.
182. National Asthma Education and Prevention Program. Expert panel report 3 (EPR-3): guidelines for the diagnosis and management of asthma - summary report 2007. J Allergy Clin Immunol. 2007; 120(Suppl. 5):S94-S138.
183. Reddel HK, Taylor DR, Bateman ED, Boulet LP, Boushey HA, Busse WW, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice. Am J Respir Crit Care Med. 2009;180:59-99.
184. British Thoracic Society Scottish Intercollegiate Guidelines. British guideline on the management of asthma. Thorax. 2008;63(Suppl. 4):1-121.
185. Fuhlbrigge AL, Guilbert T, Spahn J, Peden D, Davis K. The influence of variation in type and pattern of symptoms on assessment in pediatric asthma. Pediatrics. 2006;118:619-25.
186. Gustafsson PM, Watson L, Davis KJ, Rabe KF. Poor asthma control in children: evidence from epidemiological surveys and implications for clinical practice. Int J Clin Pract. 2006;60:321-34.
187. Chipps BE, Zeiger RS, Borish L, Wenzel SE, Yegin A, Hayden ML, et al. Key findings and clinical implications from the epidemiology and natural history of asthma: outcomes and treatment regimens (TENOR) study. J Allergy Clin Immunol. 2012;130:332-4.
188. Knorr B, Franchi LM, Bisgaard H, Vermeulen JH, LeSouef P, Santanello N, et al. Montelukast, a leukotriene receptor antagonist, for the treatment of persistent asthma in children aged 2 to 5 years. Pediatrics. 2001;108:E48.
189. Brodie M, Gupta A, Rodriguez-Martinez CE, Castro-Rodriguez JA, Ducharme FM, McKean MC. Leukotriene receptor antagonists as maintenance and intermittent therapy for episodic viral wheeze in children. Cochrane Database Syst Rev. 2015: CD008202.
190. Evaluation of Tiotropium 2.5 and 5 mcg Once Daily Delivered Via the Respimat® Inhaler Compared to Placebo in 1 to 5 Year Old Patients With Persistent Asthma. Disponível em https://clinicaltrials.gov/ct2/show/study/NCT01634113?sect=X156. Acessado em Janeiro de 2018.
191. McIvor ER, McIvor RA. The evolving role of tiotropium in asthma. J Asthma Allergy. 2017;10:231-6.
192. Chauhan BF, Chartrand C, Ni Chroinin M, Milan SJ, Ducharme FM. Addition of long-acting beta2-agonists to inhaled corticosteroids for chronic asthma in children. Cochrane Database Syst Rev. 2015 24;(11):CD007949.
193. Chipps BE, Bradley EC, Lanier B, Milgrom H, Deschildre A, Hedlin G, Szefler SJ, et al. Omalizumab in children with uncontrolled allergic asthma. Review of clinical trial and real-world experience. J Allergy Clin Immunol. 2017;139:1431-44.
194. Bisgaard H, Hermansen MN, Loland L, Halkjaer LB, Buchvald F. Intermittent inhaled corticosteroids in infants with episodic wheezing. N Engl J Med. 2006;354:1998-2005.
195. Zeiger RS, Mauger D, Bacharier LB, Guilbert TW, Martinez FD, Lemanske RF Jr, et al. Daily or intermittent budesonide in preschool children with recurrent wheezing. N Engl J Med. 2011;365:1990-2001.
196. Loke YK, Blanco P, Thavarajah M, Wilson AM. Impact of inhaled corticosteroids on growth in children with asthma: systematic review and meta-analysis. PLoS One. 2015;10:e0133428.
197. Sanchis J, Corrigan C, Levy ML, Viejo JL, ADMIT Group. Inhaler devices-from theory to practice. Respir Med. 2013;107(4):495-502.
198. Price D, Bosnic-Anticevich S, Briggs A, Chrystyn H, Rand C, Scheuch G, et al. Inhaler competence in asthma: common errors, barriers to use and recommended solutions. Respir Med. 2013;107:37-46.
199. Dalby R, Spallek M, Voshaar T. A review of the development of Respimat Soft Mist Inhaler. Int J Pharm. 2004;283(1-2):1-9.
200. Heyder J, Gebhart F, Rudolf G, Schiller C F, Stahlhofen W. Deposition of particles in the human respiratory tract in the size range 0.005-15 μm. J Aerosol Sci. 1986;17:811-25.
201. Ariyananda PL, Agnew JE, Clarke SW. Aerosol delivery systems for bronchial asthma. Postgrad Med J. 1996;72(845):151-6.
202. Leach CL, Davidson PJ, Boudreau RJ. Improved airway targeting with the CFC-free HFA-beclomethasone metereddose inhaler compared with CFC-beclomethasone. Eur Respir J. 1998;12(6):1346-53.
203. Lavorini F, Fontana GA. Targeting drugs to the airways: the role of spacer devices. Expert Op Drug Deliv. 2009;6:91-102.
204. Piérart F, Wildhaber JH, Vrancken I, Devadason SG, Le Souëf PN. Washing plastic spacers in household detergent reduces electrostatic charge and greatly improves delivery. Eur Respir J. 1999;13(3):673-8.
205. Taylor SA, Asmus MJ, Liang J, Coowanitwong I, Vafadari R, Hochhaus G. Performance of a corticosteroid inhaler with a spacer fashioned froma plastic cold-drink bottle: effects of changing bottle volume. J Asthma. 2003;40:237-42.
206. Duarte M, Camargos P. Efficacy and safety of a homemade nonvalved spacer for bronchodilator therapy in acute asthma. Acta Paediatrica. 2002;91(9):909-13.
207. Harari DK, Ferone EA, Kiertsman B. Dispositivos inalatórios. In: Solé D, Wandalsen GF, Lanza FC, eds. Asma no Lactente, na Criança e no Adolescente. Sao Paulo: Atheneu; 2017. p.
299-311.
208. O'Callaghan C, Barry PW. The science of nebulised drug delivery. Thorax. 1997;52(2):S31-S44.
209. Szefler SJ, Murphy K, Harper III T, Boner A, Laki I, Engel M, et al. A phase III randomized controlled trial of tiotropium add-on therapy in children with severe symptomatic asthma. J Allergy Clin Immunol. 2017;140(5):1277-87.
210. Dolovich MB, Ahrens RC, Hess DR, Anderson P, Dhand R, Rau JL, et al. Device selection and outcomes of aerosol therapy: evidence-based guidelines: American College of Chest Physicians/ American College of Asthma, Allergy, and Immunology. Chest. 2005;127(1):335-71.
211. Gibson PG, Powell H, Coughlan J, Wilson AJ, Abramson M, Haywood P, et al. Self-management education and regular practitioner review for adults with asthma. Cochrane Database Syst Rev. 2003(1):CD001117.
212. Mammen J, Rhee H. Adolescent asthma self-management: a concept analysis and operational definition. Pediatr Allergy Immunol Pulmonol. 2012;25(4):180-9.
213. Mammen J, Rhee H, Norton SA, Butz AM, Halterman JS, Arcoleo K. An integrated operational definition and conceptual model of asthma self-management in teens. J Asthma. 2018;19:1-13.
214. National Asthma Council Australia, disponível em https://www.nationalasthma.org.au/living-with-asthma/asthma-action-plans. Acesso em 31/01/2018.
215. British guideline on the management of asthma. A national clinical guideline. Sep 2016. Disponível em: https://www.brit-thoracic.org.uk/document-library/clinical-information/asthma/btssign-asthmaguideline-2016/. Acesso em 04/02/2018.
216. Stevens CA, Wesseldine LJ, Couriel JM, Dyer AJ, Osman LM, Silverman M. Parental education and guided self-management of asthma and wheezing in the pre-school child: a randomised controlled trial. Thorax. 2002;57(1):39-44.
217. Hederos CA, Janson S, Hedlin G. Six-year follow-up of an intervention to improve the management of preschool children with asthma. Acta Paediatr. 2009;98(12):1939-44.
218. Szczepanski R, Jaeschke R, Spindler T, Ihorst G, Forster J, ASEV Study Group. Preschoolers' and parents' asthma education trial (P2AET): a randomized controlled study. Eur J Pediatr. 2010;169(9):1051-60.
219. Killian KJ, Watson R, Otis J, St Amand TA, O'Byrne PM. Symptom perception during acute bronchoconstriction. Am J Respir Crit Care Med. 2000;162:490-6.
220. Jansen J, McCaffery KJ, Hayen A, Ma D, Reddel HK. Impact of graphic format on perception of change in biological data: implications for health monitoring in conditions such as asthma. Prim Care Respir J. 2012;21:94-100.
221. Guevara JP, Wolf FM, Grum CM, Clark NM. Effects of educational interventions for self-management of asthma in children and adolescents: systematic review and meta-analysis. BMJ. 2003;326:1308-9.
222. Boyd M, Lasserson TJ, McKean MC, Gibson PG, Ducharme FM, Haby M. Interventions for educating children who are at risk of asthma-related emergency department attendance. Cochrane Database Syst Rev. 2009:CD001290.
223. Powell H, Gibson PG. Options for self-management education for adults with asthma. Cochrane Database Syst Rev. 2003:CD004107.
224. Gibson PG, Powell H. Written action plans for asthma: an evidencebased review of the key components. Thorax. 2004;59:94-9.
225. Asthma Buddy App. Disponível em https://www.asthmabuddy.org.au/#login. Acesso em 31/01/2018.
226. Asthma UK. Disponível em https://www.asthma.org.uk/advice/manage-your-asthma/. Acesso em 31/01/2018.
227. Asthma Society of Canada. Disponível em www.asthma.ca. Acesso em 31/01/2018.
228. Family Physician Airways Group of Canadá. Disponível em www.fpagc.com. Acesso em 31/01/2018.
229. World Allergy Organization. Pawankar R, Canonica GW, Holgate ST, Lockey RF. WAO White Book on Allergy 2011-2012: Executive Summary, USA, 2011. http://www.worldallergy.org/publications/wao_white_book.pdf. Acesso em janeiro de 2018
230. American Lung Association Epidemiology and Statistics Unit Research and Program Services Division. Trends in asthma morbidity and mortality. New York: American Lung Association, Setembro 2012. http://www.lung.org/assets/documents/research/asthma-trend-report.pdf. Acesso em janeiro de 2018.
231. Asher MI, Keil U, Anderson HR, Beasley R, Crane J, Martinez F, et al. International Study of asthma and allergies in childhood (ISAAC): rationale of methods. Eur Respir J. 1995;8:483-91.
232. Moonie S, Sterling DA, Figgs LW, Castro M. The relationship between school absence, academic performance, and asthma status. J Sch Health. 2008;78(3):140-8.
233. Akinbami L. Centers for Disease Control and Prevention National Center for Health Statistics. The state of childhood asthma. United States, 1980-2005. Adv Data. 2006;381:1-24.
234. Urrutia-Pereira M, To T, Cruz AA, Solé D. The school as a health promoter for children with asthma: the purpose of an education programme. Allergol Immunopathol (Madr). 2017;45(1):93-8.
235. Muraro A, Clark A, Beyer K, Borrego LM, Borres M, Lodrup Carlsen KC, et al. The management of the allergic child at school: EAACI/ GA2LEN Task Force on the allergic child at school. Allergy. 2010;65(6):681-9.
238. Rubini NM, Wandalsen GF, Rizzo MCV, Aun MV, Chong Neto HJ, Solé D. Guia prático sobre controle ambiental para pacientes com rinite alérgica. Arq Asma Alerg Imunol. 2017;1(1):7-22.
239. Oeder S, Jorres RA, Weichenmeier I, Pusch G, Schober W, Pfab F, et al. Airborne indoor perticles from schools are more toxic than outdoor particles. Am J Respir Cell Mol Biol. 2012;47(5):575-82.
240. United States Environmental Protection Agency, "IAQ tools for Schools," Health and Achievement Managing Asthma in the School Environment. http://www.epa.gov/iaq/schools/managingasthma.html. Acesso em janeiro de 2018.
241. Inamdar AS, Croucher RE, Chokhandre MK, Mashyakhy MH, Marinho VC. Maternal Smokeless Tobacco Use in Pregnancy and Adverse Health Outcomes in Newborns: A Systematic Review. Nicotine Tob Res. 2015;17(9):1058-66.
242. Vardavas CI, Hohmann C, Patelarou E, Martinez D, Henderson AJ, Granell R, et al. The independ role of prenatal and postnatal exposure to active and passive smoking on the development of early wheeze in children. Eur Respir J. 2016;48(1):115-24.
243. Coleman BL, Fadel SA, Fitzpatrick T, Thomas SM. Risk factors for serious outcomes associated with influenza illness in high- versus low- and middle-income countries: Systematic literature review and meta-analysis. Influenza Other Resp Viruses. 2018;12(1):22-9.
244. Klopp A, Vehling L, Becker AB, Subbarao P, Mandhane PJ, Turvey SE, et al. Modes of Infant Feeding and the Risk of Childhood Asthma: A prospective Birth Cohort Study. J Pediatr. 2017;190:192-199.e2.
245. Cano-Garcinuño A, Díaz-Vázquez C, Carvajal-Urueña I, Praena- Crespo M, Gatti-Viñoly A, García-Guerra I. Group education on asthma for children and caregivers: a randomized, controlled trial addressing effects on morbidity and quality of life. J Investig Allergol Clin Immunol. 2007;17(4):216-26.
246. Solé D, Urrutia-Pereira M, Sisul-Alvariza JC, Jares EJ, Sánchez- Borges M, Ansotegui IJ, et al. La Carta de Jerusalén: un nuevo paradigma en el cuidado de los niños y adolescentes alérgicos en las escuelas de Latinoamérica. Rev Alerg Mex. 2017;64(1):3-6.
247. Câmara Municipal do Rio de Janeiro. Lei nº 2852 de 28 de julho de 1999. Disponível em: https://cm-rio-de-janeiro.jusbrasil.com.br/legislacao/267266/lei-2852-99. Acesso em janeiro de 2018.
248. Cunha JCB. Uso de medicamentos na creche e na escola. In: Sociedade Brasileira de Pediatria. Tratado de Pediatria. Campos Júnior D, Burns DAR, orgs. 3ª ed. Barueri: Manole; 2014.
249. Presidência da República. Lei nº 12.546 de 14 de dezembro de 2011. Disponível em: http://www.planalto.gov.br/ccivil_03/_ato2011-2014/2011/lei/l12546.htm. Acesso em janeiro de 2018.
250. Presidência da República. Decreto nº 8.262, de 31 de maio de 2014. Disponível em: http://www.planalto.gov.br/ccivil_03/_ato2011-2014/2014/decreto/d8262.htm. Acesso em janeiro de 2018.
251. Swern AS, Tozzi CA, Knorr B, Bisgaard H. Predicting an asthma exacerbation in children 2 to 5 years of age. Ann Allergy Asthma Immunol. 2008;101:626-30.
252. National Heart Lung and Blood Institute N. Global initiative for asthma. Global strategy for asthma management and prevention. NHBLI/WHO workshop. 1995:NIH Publication no. 95-3659.
253. Schunemann HJ, Jaeschke R, Cook DJ, Bria WF, El-Solh AA, Ernst A, et al. An official ATS statement: grading the quality of evidence and strength of recommendations in ATS guidelines and recommendations. Am J Respir Crit Care Med. 2006;174:605-14.
254. Miller EK, Avila PC, Khan YW, Word CT, Pelz BJ, Papadopoulos NG, et AL. Wheezing exacerbations in early childhood: evaluation, treatment, and recent advances relevant to the genesis of asthma. J Allergy Clin Immunol Pract. 2014;2(5):537-43.
255. Just J, Nicoloyanis N, Chauvin M, Pribil C, Grimfeld A, Duru G. Lack of eosinophilia can predict remission in wheezy infants? Clin Exper Allergy. 2008;38:767-73.
256. Guilbert TW, Morgan WJ, Krawiec M, Lemanske RF, Sorkness C, Szefler SJ, et al. The prevention of early asthma in kids study: design, rationale and methods for the childhood asthma research and education network. Cont Clin Trials. 2004;25:286-310.
257. Guilbert TW, Morgan WJ, Zeiger RS, Mauger DT, Boehmer SJ, Szefler SJ, et al. Long-term inhaled corticosteroids in preschool children at high risk for asthma. N Eng J Med. 2006;354:1985-97.
258. Expert pannel report 3: Guidelines for the diagnosis and management of asthma. Bethesda, MD: National Institutes of Health: National Heart, Lung, and Blood Institute; 2007. Program NAEaP.
259. Center of Diseases Control. Rapid Influenza Diagnostic Tests. Disponível em: http://www.cdc.gov/flu/professionals/diagnosis/clinician_guidance_ridt.htm. Acesso em 02/02/2018.
260. Harper SA, Bradley JS, Englund JA, File TM, Gravenstein S, Hayden FG, et al. Seasonal Influenza in Adults and Children-Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America. Clinical Infectious Diseases Society of America. Clin Infect Dis. 2009;48(8):1003-32.
261. Navaie-Waliser M, Misener M, Mersman C, Lincoln P. Evaluating the Needs of Children With Asthma in Home Care: The Vital Role of Nurses as Caregivers and Educators. Public Health Nurs. 2004;21(4):306-15.
262. Chatkin JM; Machado, ARJ. Infecçao respiratória aguda na criança. In: Duncan BD, Schmidt MI, Giugliani ERJ. Medicina ambulatorial: condutas de atençao primária baseadas em evidências. 3a ed. Porto Alegre: Artmed; 2004. p. 1335-41.
263. Geelhoed GC, Landau LI, Le Souef PN. Evaluation of SaO2 as a predictor of outcome in 280 children presenting with acute asthma. Ann Emerg Med. 1994;23:1236-41.
264. Gouin S, Robidas I, Gravel J, Guimont C, Chalut D, Amre D. Prospective evaluation of two clinical scores for acute asthma in children 18 months to 7 years of age. Acad Emerg Med. 2010;17:598-603.
265. Ducharme FM, Chalut D, Plotnick L, Savdie C, Kudirka D, Zhang X, et al. The Pediatric Respiratory Assessment measure: a valid clinical score for assessing acute asthma severity from toddlers to teenagers: J. Pediatr. 2008;152:476-80.
266. Ducharme FM, Zemek RL, Chalut D, McGillivray D, Nova FJ, Resendes S, et al. Written action plan in pediatric emergency room improves asthma rescribing, adherence, and control. Am J Respir Crit Care Med. 2011;183(2):195-203.
267. Smith SR, Jaffe DM, Fisher EB, Trinkaus KM, Highstein G, Strunk RC. Improving follow-up for children with asthma after an acute Emergency Department visit. J Pediatr. 2004;145:772-7.
268. Mitselou N, Hedlin G, Hederos CA. Spacers versus nebulizers in treatment of acute asthma - a prospective randomized study in preschool children. J Asthma. 2016;53(10):1059-62.
269. Ribeiro JD, de Britto MCA. Sibilancia Recorrente do Lactente e Pré-escolar. In: de Matos Bezerra PG, de Brito R de CCM, de Britto MCA, eds. Pneumologia Pediátrica. 1ª ed. Rio de Janeiro: Medbook; 2016. p. 167-78.
270. Sociedade Brasileira de Pediatria (SBP). Diretrizes para o manejo da infecçao causada pelo vírus sincicial respiratório (VSR) - 2017. Disponível em http://www.sbp.com.br/fileadmin/user_upload/20277e-Diretrizes_VSR.pdf. Acesso em janeiro de 2018.
271. Pollock M, Sinha IP, Hartling L, Rowe BH, Schreiber S, Fernandes RM. Inhaled short-acting bronchodilators for managing emergency childhood asthma: an overview of reviews. Allergy Eur J Allergy Clin Immunol. 2017;72(2):183-200.236. Urrutia-Pereira M, Solé D. The allergic child at school. What do we need to know? Rev Alerg Mex. 2016;63(3):283-392.237. Jaramillo Y, Reznik M. Do United States' Teachers know and adhere to the National Guidelines on Asthma Management in the Classroom? A Systematic Review. Scientific World Journal. 2015;2015:624828.
272. Saito M, Kikuchi Y, Lefor AK, Hoshina M. High-dose nebulized budesonide is effective for mild asthma exacerbations in children under 3 years of age. Eur Ann Allergy Clin Immunol. 2017;49(1):22-7.
273. Yanagida N, Tomikawa M, Shukuya A, Iguchi M, Ebisawa M. Budesonide inhalation suspension versus methylprednisolone for treatment of moderate bronchial asthma attacks. World Allergy Organ J. 2015;8(1):1-7.
274. Razi CH, Cörüt N, Andıran N. Budesonide reduces hospital admission rates in preschool children with acute wheezing. Pediatr Pulmonol. 2017;52(6):720-8.
275. Papi A, Nicolini G, Boner AL, Baraldi E, Cutrera R, Fabbri LM, et al. Short term efficacy of nebulized beclomethasone in mild-tomoderate wheezing episodes in pre-school children. Ital J Pediatr. 2011;37(1):1-6.
276. Castro-Rodríguez JA, Beckhaus AA, Forno E. Efficacy of oral corticosteroids in the treatment of acute wheezing episodes in asthmatic preschoolers: systematic review with meta-analysis. Pediatr Pulmonol. 2016;51(8):868-76.
277. Mandhane PJ, Paredes Zambrano de Silbernagel P, Aung YN, Williamson J, Lee BE, Spier S, et al. Treatment of preschool children presenting to the emergency department with wheeze with azithromycin: a placebo-controlled randomized trial. PLoS One. 2017:1-15.
278. Bush A, Grigg J, Saglani S. Managing wheeze in preschool children. BMJ. 2014;348:1-7.
279. Nieto A, Wahn U, Bufe A, Eigenmann P, Halken S, Hedlin G, et al. Allergy and asthma prevention 2014. Pediatr Allergy Immunol. 2014;25(6):516-33.
280. Bousquet J, Grattan C, Bieber T, Matricardi P, Simon HU, Wahn U, et al. Prediction and prevention of allergy and asthma in EAACI journals (2016). Clin Transl Allergy. 2017;7:46.
281. Van Odjik J, Kull I, Borres MP, Brandtzaeg P, Edberg U, Hanson LA, et al. Breastfeeding and allergic disease: a multidisciplinary review of the literature (1966-2001) on the mode of early feeding in infancy and its impact on later atopic manifestations. Allergy. 2003;58:833-43.
282. Elbert NJ, van Meel ER, den Dekker HT, de Jong NW, Nijsten TEC, Jaddoe VWV, et al. Duration and exclusiveness of breastfeeding and risk of childhood atopic diseases. Allergy. 2017;72:1936-43.
283. Bion V, Lockett GA, Soto-Ramirez N, Zhang H, Venter C, Karmaus W, et al. Evaluating the efficacy of breastfeeding guidelines on longterm outcomes for allergic disease. Allergy. 2016;71:661-70.
284. Elliott L, Henderson J, Northstone K, Chiu GY, Dunson D, London SJ. Prospective study of breast-feeding in relation to wheeze, atopy, and bronchial hyperresponsiveness in the Avon Longitudinal Study of Parents and Children (ALSPAC). J Allergy Clin Immunol. 2008;122:49-54.
285. Mandhane PJ, Greene JM, Sears MR. Interactions between breastfeeding, specific parental atopy, and sex on development of asthma and atopy. J Allergy Clin Immunol. 2007;119:1359-66.
286. Lodge CJ, Tan DJ, Lau MX, Dai X, Tham R, Lowe AJ, et al. Breastfeeding and asthma and allergies: a systematic review and meta-analysis. Acta Paediatr. 2015;104:38-53.
287. Sonnenschein-van der Voort AM, Jaddoe VW, van der Valk RJ, Willemsen SP, Hofman A, Moll HA, et al. Duration and exclusiveness of breastfeeding and childhood asthma-related symptoms. Eur Respir J. 2012;39:81-9.
288. den Dekker HT, Sonnenschein-van der Voort AM, Jaddoe VW, Reiss IK, de Jongste JC, Duijts L. Breastfeeding and asthma outcomes at the age of 6 years: the generation R study. Pediatr Allergy Immunol. 2016;27:486-92.
289. Dogaru CM, Nyffenegger D, Pescatore AM, Spycher BD, Kuehni CE. Breastfeeding and childhood asthma: systematic review and meta-analysis. Am J Epidemiol. 2014;179:1153-67.
290. Cuello-Garcia CA, Fiocchi A, Pawankar R, Yepes-Nuñez JJ, Morgano GP, Zhang Y et al. Prebiotics for the prevention of allergies: A systematic review and meta-analysis of randomized controlled trials. Clin Exp Allergy. 2017;47:1468-77.
291. Kalliomäki M, Salminen S, Arvilommi H, Kero P, Koskinen P, Isolauri E. Probiotics in primary prevention of atopic disease: a randomized placebo-controlled trial. Lancet. 2001;357:1076-79.
292. Kalliomäki M, Salminen S, Poussa T, Isolauri E. Probiotics during the first 7 years of life: a cumulative risk reduction of eczema in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2007;119:1019-21.
293. Zuccotti G, Meneghin F, Aceti A, Barone G, Callegari ML, Di Mauro A, et al. Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis. Allergy. 2015;70:1356-71.
294. Feleszko W, Jaworska J, Rha RD, Steinhausen S, Avagyan A, Jaudszus A, et al. Probiotic-induced suppression of allergic sensitization and airway inflammation is associated with an increase of T regulatory-dependent mechanisms in a murine model of asthma. Clin Exp Allergy. 2007;37:498-505.
295. Edwards MR, Walton RP, Jackson DJ, Feleszko W, Skevaki C, Jartti T, et al. The potential of anti-infectives and immunomodulators as therapies for asthma and asthma exacerbations. Allergy. 2018;73(1):50-63.
296. Turturice BA, McGee HS, Oliver B, Baraket M, Nguyen BT, Ascoli C, et al. Atopic asthmatic immune phenotypes associated with airway microbiota and airway obstruction. PLoS ONE. 2017;12(10): e0184566.
297. Elazab N, Mendy A, Gasana J, Vieira ER, Quizon A, Forno E. Probiotic administration in early life, atopy, and asthma: a metaanalysis of clinical trials. Pediatrics. 2013;132:666-76.
298. Zhang GQ, Hu HJ, Liu CY, Zhang Q, Shakya S, Li ZY. Probiotics for Prevention of Atopy and Food Hypersensitivity in Early Childhood: A PRISMA-Compliant Systematic Review and Meta- Analysis of Randomized Controlled Trials. Medicine (Baltimore). 2016;95:e2562.
299. Cuello-Garcia CA, Brozek JL, Fiocchi A, Pawankar R, Yepes-Nunez JJ, Terracciano L, et al. Probiotics for the prevention of allergy: A systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2015;136:952-61.
300. Azad MB, Coneys JG, Kozyrskyj AL, Field CJ, Ramsey CD, Becker AB, et al. Probiotic supplementation during pregnancy or infancy for the prevention of asthma and wheeze: systematic review and meta-analysis. BMJ. 2013;347:6471.
301. Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, et al. World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Org J. 2015;8:4.
302. Hao Q, Dong BR, Wu T. Probiotics for preventing acute upper respiratory tract infections. Cochrane Database of Systematic Reviews. 2015; Issue 2. Art. No.: CD006895.
303. Barreto BA. Microbioma and probiotics: from gut to Mars. Braz J Otorhinolaryngol. 2017. http://dx.doi.org/10.1016/j.bjorl.2017.10.004.
304. de Araujo GV, Peixoto DM, Sarinho ESC, de Lorena VMB, Montenegro SM, de Albuquerque EC. Probiotics as an adjunct for the treatment of recurrent wheezing in infants and effects on expression of T-helper 1 and regulatory T cytokines. J Funct Foods. 2017;35:398-407.
305. Agostoni C, Axelsson I, Goulet O, Koletzko B, Michaelsen KF, Puntis JW, et al. Prebiotic oligosaccharides in dietetic products for infants: a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2004;39:465-73.
306. Osborn DA, Sinn JK. Prebiotics in infants for prevention of allergy. Cochrane Database Syst Rev. 2013;3:CD006474.
307. Mennini M, Dahdah L, Artesani MC, Fiocchi A, Martelli A. Probiotics in Asthma and Allergy Prevention. Front Pediatr. 2017;5:165.
308. Zuccotti G, Meneghin F, Aceti A, Barone G, Callegari ML, DiMauro A, et al. Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis. Allergy. 2015;70:1356-71.
309. Halken S, Larenas-Linnemann D, Roberts G, Calderón MA, Angier E, Pfaar O, et al. EAACI guidelines on allergen immunotherapy: Prevention of allergy. Pediatr Allergy Immunol. 2017;28(8):728-45.
310. Dinakar C, Portnoy JM. Allergen immunotherapy in the prevention of asthma. Curr Opin Allergy Clin Immunol. 2004;4(2):131-6.
311. Bozek A, Jarzab J, Bednarski P. The effect of allergenspecific immunotherapy on offspring. Allergy Asthma Proc. 2016;37:59-63.
312. Oykhman P, Kim HL, Ellis AK. Allergen immunotherapy in pregnancy. Allergy Asthma Clin Immunol. 2015;11:31.
313. Flicker S, Marth K, Kofler H, Valenta R. Placental transfer of allergen-specific IgG but not IgE from a specific immunotherapytreated mother. J Allergy Clin Immunol. 2009;124:1358-60.
314. Glovsky MM, Ghekiere L, Rejzek E. Effect of maternal immunotherapy on immediate skin test reactivity, specific rye I IgG and IgE antibody, and total IgE of the children. Ann Allergy. 1991;67:21-4.
315. Settipane RA, Chafee FH, Settipane GA. Pollen immunotherapy during pregnancy: long-term follow-up of offsprings. Allergy Proc. 1988;9:555-61.