Número Atual: Janeiro-Março 2018 - Volume 2 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Dirceu Solé
- Luciana Rodrigues Silva
- Renata Rodrigues Cocco
- Cristina Targa Ferreira
- Roseli Oselka Sarni
- Lucila Camargo Oliveira
- Antonio Carlos Pastorino
- Virgínia Weffort
- Mauro Batista Morais
- Bruno Paes Barreto
- José Carlison Oliveira
- Ana Paula Moschione Castro
- Jackeline Motta Franco
- Herberto José Chong Neto
- Nelson Augusto Rosário
- Maria Luisa Oliva Alonso
- Emanuel Cavalcanti Sarinho
- Ariana Yang
- Hélcio Maranhao
- Mauro Sérgio Toporovski
- Matias Epifanio
- Neusa Falbo Wandalsen
- Norma Motta Rubini
ARTIGO ESPECIAL
Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 2 - Diagnóstico, tratamento e prevenção. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia
Brazilian Consensus on Food Allergy: 2018 - Part 2 - Diagnosis, treatment and prevention. Joint position paper of the Brazilian Society of Pediatrics and the Brazilian Association of Allergy and Immunology
Dirceu Solé1; Luciana Rodrigues Silva2; Renata Rodrigues Cocco1; Cristina Targa Ferreira3; Roseli Oselka Sarni4; Lucila Camargo Oliveira1; Antonio Carlos Pastorino5; Virgínia Weffort6; Mauro Batista Morais7; Bruno Paes Barreto8; José Carlison Oliveira9; Ana Paula Moschione Castro5; Jackeline Motta Franco10; Herberto José Chong Neto11; Nelson Augusto Rosário11; Maria Luisa Oliva Alonso12; Emanuel Cavalcanti Sarinho13; Ariana Yang14; Hélcio Maranhao15; Mauro Sérgio Toporovski16; Matias Epifanio17; Neusa Falbo Wandalsen4; Norma Motta Rubini18
1. Universidade Federal de Sao Paulo, Disciplina de Alergia, Imunologia Clínica e Reumatologia - Sao Paulo, SP, Brasil
2. Universidade Federal da Bahia, Departamento de Pediatria - Salvador, BA, Brasil
3. Universidade Federal de Ciências da Saúde de Porto Alegre, Departamento de Pediatria - Porto Alegre, RS, Brasil
4. Faculdade de Medicina do ABC, Departamento de Pediatria - Santo André, SP, Brasil
5. Universidade de Sao Paulo, Instituto da Criança - Sao Paulo, SP, Brasil
6. Universidade Federal do Triângulo Mineiro, Departamento de Pediatria - Uberaba, MG, Brasil
7. Universidade Federal de Sao Paulo, Departamento de Pediatria - Sao Paulo, SP, Brasil
8. Universidade do Estado do Pará, Departamento de Pediatria - Belém, PA, Brasil
9. Universidade Federal da Bahia, Departamento de Alergia e Imunologia - Salvador, BA, Brasil
10. Universidade Federal de Sergipe, Departamento de Pediatria - Aracaju, SE, Brasil
11. Universidade Federal do Paraná, Departamento de Pediatria - Curitiba, PR, Brasil
12. Universidade Federal do Rio de Janeiro, Departamento de Medicina - Rio de Janeiro, RJ, Brasil
13. Universidade Federal de Pernambuco, Departamento de Pediatria - Recife, PE, Brasil
14. Faculdade de Medicina da Universidade Sao Paulo, Disciplina de Imunologia e Alergia - Sao Paulo, SP, Brasil
15. Universidade Federal do Rio Grande do Norte, Departamento de Pediatria - Natal, RN, Brasil
16. Faculdade de Ciências Médicas da Santa Casa de Sao Paulo, Departamento de Pediatria - Sao Paulo, SP, Brasil
17. Faculdade de Medicina da Pontifícia Universidade Católica, Departamento de Pediatria - Porto Alegre, RS, Brasil
18. Universidade Federal do Estado do Rio de Janeiro, Disciplina de Alergia e Imunologia Clínica - Rio de Janeiro, RJ, Brasil.
Endereço para correspondência:
Dirceu Solé
E-mail: sole.dirceu@gmail.com ou dirceu.sole@unifesp.br
Submetido em: 24/02/2018
Aceito em 26/02/2018
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
Na última década o conhecimento sobre a etiopatogenia da alergia alimentar (AA) avançou muito. A identificaçao de novas formas clínicas de apresentaçao, aliada à aquisiçao de novos métodos laboratoriais, possibilitaram a realizaçao do diagnóstico etiológico de modo mais preciso, sobretudo quanto à reatividade cruzada entre alimentos e mesmo na identificaçao de marcadores indicativos de formas clínicas transitórias, persistentes e quadros mais graves. A padronizaçao dos testes de provocaçao oral permitiu a sua realizaçao de forma mais segura e possibilitou a sua inclusao entre as ferramentas disponíveis para uso na confirmaçao etiológica da AA. Apesar disso, a exclusao do alimento responsável pelas manifestaçoes clínicas continua sendo a principal conduta terapêutica a ser empregada. Entre os pacientes alérgicos às proteínas do leite de vaca, a disponibilidade de fórmulas especiais, por exemplo parcialmente hidrolisadas, extensamente hidrolisadas à base da proteína do leite de vaca e fórmulas de aminoácidos, tem facilitado o tratamento substitutivo do leite de vaca para esses pacientes. A abordagem atual da anafilaxia é revisada, uma vez que os alimentos sao os principais agentes etiológicos em crianças. Avanços na conduta de algumas manifestaçoes gastrintestinais também sao abordados. Na atualidade, a imunoterapia oral tem sido cada vez mais utilizada. A aquisiçao de novos agentes, os imunobiológicos, também sao apresentados à luz das evidências científicas e clínicas atuais. Consideraçoes sobre história natural da AA, assim como sobre formas de prevençao da AA também sao abordadas. Em conclusao, o Consenso Brasileiro sobre Alergia Alimentar de 2018 objetivou rever os métodos diagnósticos e esquemas de tratamento disponíveis e empregados no acompanhamento de pacientes com AA, visando a melhor abordagem terapêutica desses pacientes.
Descritores: Hipersensibilidade alimentar, testes cutâneos, imunoglobulinas, imunoterapia sublingual, diagnóstico.
INTRODUÇAO
Na avaliaçao diagnóstica das reaçoes adversas a alimentos, a história clínica tem papel fundamental. O seu valor depende muito da capacidade recordatória dos sintomas pelos pacientes, e da habilidade e sensibilidade do médico em diferenciar as manifestaçoes causadas por hipersensibilidade alimentar daquelas relacionadas a outras condiçoes.
Além disso, com base nas informaçoes obtidas pela anamnese, a investigaçao laboratorial poderá ser implementada ou nao, e muitas vezes, lançando-se mao de exames complementares para confirmaçao e/ou elucidaçao diagnóstica. A avaliaçao crítica do mecanismo provável da alergia alimentar irá dirigir a solicitaçao dos exames complementares, quando necessários1,2.
Na dependência dos mecanismos imunológicos envolvidos na gênese das manifestaçoes clínicas da alergia alimentar (hipersensibilidade IgE mediada ou tipo I e a hipersensibilidade celular ou tipo IV), a abordagem laboratorial será distinta.
Diagnóstico diferencial
Na Tabela 1 estao listadas as principais situaçoes que impoem diagnóstico diferencial com as reaçoes de hipersensibilidade alimentar.

DIAGNOSTICO LABORATORIAL
Hemograma
Embora nao seja exame diagnóstico para alergia alimentar, auxilia na detecçao de complicaçoes a ela associadas, como a anemia. As reservas corporais de ferro (ferritina sérica) devem ser avaliadas. Teoricamente, na alergia alimentar pode ocorrer deficiência de ferro em funçao de perdas fecais ou de má absorçao secundária à lesao do intestino delgado, ou da inflamaçao sistêmica. Nos casos de doenças gastrintestinais (esofagite eosinofílica, gastroenterite eosinofílica, proctocolite eosinofílica), a eosinofilia é encontrada em parcela expressiva dos casos, e pode auxiliar no diagnóstico3-8.
Investigaçao de sensibilizaçao IgE específica
A determinaçao da IgE específica auxilia apenas na identificaçao das alergias alimentares mediadas por IgE e nas reaçoes mistas, e este é um dado fundamental. A pesquisa de IgE específica ao alimento suspeito pode ser realizada tanto in vivo, por meio dos testes cutâneos de hipersensibilidade imediata (TC), como in vitro, pela dosagem da IgE específica no sangue. A detecçao de IgE específica tem sido considerada como indicativo de sensibilizaçao ao alimento, na maioria das vezes apenas orientando o alimento a ser utilizado no teste de provocaçao duplocego placebo controlado (DCPC)9.
In vivo: testes cutâneos de hipersensibilidade imediata
Os testes cutâneos (TC) avaliam a sensibilizaçao aos alérgenos. Sao testes simples, rápidos, podem ser realizados no próprio consultório de médico capacitado e requerem cuidados em sua execuçao e interpretaçao. A utilizaçao de extratos padronizados confere a estes testes valores preditivos positivos de no máximo 60%, mas raramente sao positivos na ausência de alergias mediadas por IgE (valor preditivo negativo de até 95%)10,11.
A quantidade reduzida de extratos padronizados disponíveis para uso clínico e a instabilidade de muitos alérgenos alimentares sao problemas que limitam a sua aplicaçao de modo mais amplo2,11.
Sao considerados testes positivos quando houver formaçao de pápula com pelo menos 3 mm de diâmetro médio, reaçao com o controle positivo (soluçao de histamina) e ausência de pápula com o controle negativo (excipiente da soluçao). Nao há restriçao de idade para a realizaçao do teste12, entretanto, deve-se ter em mente que crianças menores de 6 meses de idade podem nao ter sido expostas a vários alimentos, impossibilitando a formaçao de anticorpos.
A utilizaçao de alérgenos in natura aplicados à pele do paciente pode ser útil em pacientes com história clara de relaçao entre determinado alérgeno e sintomas, na ausência de extratos padronizados. Esta variaçao do TC tem sido utilizada com frutas e vegetais frescos, e é denominado de prick to prick e, à semelhança do teste de puntura, deve ser acompanhado pelos controles positivo e negativo para sua interpretaçao2,13,14. O teste cutâneo é atributo do especialista, pois embora seja muito seguro, pode desencadear reaçoes sistêmicas15.
Embora alguns estudos tenham focado na definiçao de valores médios de corte para pápulas ao teste com alguns alimentos como forma de predizer possível reatividade clínica, a heterogeneidade encontrada nas diferentes populaçoes estudadas nao permite que se estabeleça valores universais17.
In vitro: dosagem de IgE sérica específica
Entre os métodos disponíveis para a determinaçao dos níveis de IgE sérica específica, o mais empregado é o Sistema ImmunoCAPr. Da mesma forma referida para os testes cutâneos, valores de corte para níveis de IgE sérica específica que pudessem minimizar a chance de testes de provocaçao oral foram identificados em diferentes amostras populacionais. Os resultados divergiram entre os estudos, de acordo com o fenótipo da doença, idade e características regionais de cada populaçao. Desta forma, nao é possível predizer valores universais de IgE específica, a partir dos quais a chance de reaçao clínica seria maior.
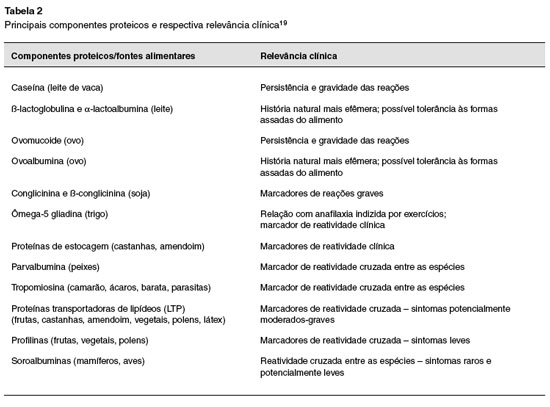
O avanço da biologia molecular permite, atualmente, um refinamento dos extratos alergênicos. Fraçoes proteicas de diversas fontes alergênicas denominadas "componentes" (CRD) foram identificadas e conferem maior especificidade ao diagnóstico das alergias alimentares2,18. Alguns dos principais componentes e suas respectivas características clínicas podem ser visualizados na Tabela 2.
Em paralelo, os microarrays (ou plataforma multiplex) permitem que os componentes moleculares possam ser analisados concomitantemente quanto à capacidade de estimular a produçao de IgE.Trata-se de um método semiquantitativo indicado para os casos de situaçoes complexas de polissensibilizaçao18.
Atualmente, a plataforma microarray disponível comercialmente para detecçao de IgE a 112 componentes proteicos, provenientes de 51 diferentes fontes alergênicas, é denominada ImmunoCAP ISACr (Thermo Fisher Scientific, Uppsala, Suécia). Sua indicaçao precisa e a interpretaçao criteriosa visam impedir um ônus indevido, bem como restriçoes dietéticas e terapêuticas medicamentosas desnecessárias.
Na prática clínica, sao indicaçoes para a utilizaçao do CRD em pacientes com suspeita diagnóstica de alergia alimentar19, as seguintes:
- discriminaçao entre reatividade cruzada e reatividade genuína em pacientes polissensibilizados;
- avaliaçao do risco de reaçoes sistêmicas graves x reaçoes locais leves, em casos selecionados.
Teste de contato atópico com alimentos (atopy patch test - APT)
O APT para alimentos (leite, ovo, trigo e soja) está em investigaçao para aumentar a especificidade do diagnóstico das reaçoes tardias em pacientes com dermatite atópica ou esofagite eosinofílica e com sensibilizaçao IgE específica a alimentos. Estes testes permanecem nao recomendados para o uso na prática clínica, devido à ausência de padronizaçao e à baixa sensibilidade2,20,21.
Outros
Nao há qualquer evidência científica que respalde a utilizaçao de exames laboratoriais com base na mensuraçao de IgG para alimentos para fins de diagnóstico22,23.
A identificaçao dos diferentes fenótipos e endótipos é foco atual para o desenvolvimento de uma "Medicina de Precisao" na alergia alimentar. Algumas mutaçoes e variaçoes genéticas, associaçao de genes e fatores epigenéticos em diversos genes ou gene loci como SPINK5, FOXP3, HLA-DR, ou HLA-DQ estao associados ao início precoce dos sintomas19,24. Outros biomarcadores, como células T regulatórias e atividade Th1, podem predizer a resoluçao da doença.
O teste de ativaçao de basófilos permite a determinaçao da expressao de CD63, preditor de presença e gravidade das reaçoes; a presença de IgG e IgG4 específicos conferem maior probabilidade de tolerância oral2,25.
Informaçoes genéticas e possíveis riscos ambientais para o desenvolvimento da AA estao sendo identificados como biomarcadores que podem determinar o prognóstico e eficácia para refinamento das opçoes de tratamento.
TESTE DE PROVOCAÇAO ORAL
O teste de provocaçao oral (TPO), procedimento introduzido na prática clínica em meados dos anos 1970, a despeito de todo avanço científico, continua sendo ainda o método mais confiável no diagnóstico da alergia alimentar26. Consiste na oferta progressiva do alimento suspeito e/ou placebo, em intervalos regulares, sob supervisao médica para monitoramento de possíveis reaçoes clínicas, após um período de exclusao dietética necessário para resoluçao dos sintomas clínicos2,27.
Pode ser indicado em qualquer idade, para26,27:
- confirmar ou excluir uma alergia alimentar;
- avaliar a aquisiçao de tolerância em alergias alimentares potencialmente transitórias, como a do leite de vaca, do ovo, do trigo ou da soja;
- avaliar reatividade clínica em pacientes sensibilizados e nos com dieta restritiva a múltiplos alimentos;
- determinar se alérgenos alimentares associados a doenças crônicas podem causar reaçoes imediatas;
- avaliar a tolerância a alimentos envolvidos em possíveis reaçoes cruzadas; e
- avaliar o efeito do processamento do alimento em sua tolerabilidade.
De acordo com o conhecimento do paciente (ou de sua família) e do médico quanto à natureza da substância ingerida (alimento ou placebo), os testes de provocaçao oral sao classificados como aberto (paciente e médico cientes), simples cego (apenas o médico sabe) ou duplo cego e controlado por placebo (TPODCPC), quando nenhuma das partes sabe o que está sendo ofertado27. O TPODCPC é considerado padrao ouro no diagnóstico da alergia alimentar26,28-31. No entanto, tem desvantagens relacionadas ao tempo necessário para sua execuçao, custos envolvidos, e necessidade de estrutura física e de equipe médica treinada para atendimento de possíveis reaçoes graves, o que limita sua utilizaçao na prática clínica, sendo geralmente utilizados para fins de pesquisa29.
A decisao da escolha do TPO e do momento de sua execuçao podem ser influenciadas pela história clínica, idade, tipo de sintoma, tempo da última reaçao, resultados dos testes cutâneos e/ou dos níveis séricos de IgE específicas, bem como pelo valor nutricional do alimento e pela decisao conjunta com pacientes maiores e seus familiares27.
Os TPO abertos podem ser utilizados para confirmar reaçoes IgE e nao IgE mediadas e sao, em geral, adequados para fins clínicos32. É a primeira opçao quando resultado negativo e sintomas objetivos sao esperados33. Em menores de 3 anos com sintomas objetivos, quando supervisionado por médico, é considerado suficiente para o diagnóstico28, dispensando o TPODCPC29. Sintomas subjetivos (coceira na garganta, recusa alimentar, náuseas, dores de cabeça, etc.) e também os de início tardio, como sao mais difíceis de serem interpretados, exigem a realizaçao do TPODCPC para esclarecimento diagnóstico30, visto que, mesmo em crianças, até metade dos TPO abertos, considerados positivos, nao sao reproduzidos no TPODCPC34.
O TPO simples cego é uma possibilidade, porém como possui as mesmas dificuldades técnicas do TPODCPC, acaba nao sendo utilizado pelo fato do duplo cego afastar a influência por parte do observador28.
Os TPODCPC sao principalmente indicados para confirmaçao diagnóstica, se resultados positivos sao esperados28. No entanto, quando negativos, a exposiçao ao alimento em sua forma natural deve ser realizada, aproximadamente 2 horas após o procedimento, seguida de observaçao adicional por mais 2 horas, ou em dia separado, antes de se concluir que há tolerância. Essas recomendaçoes baseiam-se na possibilidade de que em 3% das crianças (sem dados disponíveis para adultos) surgirem reaçoes ao alimento testado, em sua forma natural, possivelmente em decorrência da maior quantidade ingerida do alimento durante provocaçao aberta, sem administraçao gradual e sem sofrer os efeitos da matriz do veículo, sobre a acessibilidade dos alérgenos e sua absorçao27.
TPOs positivos apresentam riscos inerentes, incluindo reaçoes alérgicas potencialmente fatais, como a anafilaxia e a Síndrome da enterocolite induzida pela proteína alimentar (FPIES)27. Resultados de testes laboratoriais nunca devem ser indicaçao ou contraindicaçao absoluta para realizaçao de um TPO, devendo sempre ser interpretados no contexto clínico e individualizado do paciente27.
Diferentes valores de IgE sérica específica e de diâmetros médios de pápulas do teste cutâneo de leitura imediata (TCLI), a partir dos quais a chance de se ter sintomas seria maior do que 95%, foram estabelecidos, com o intuito de evitar os testes de provocaçao oral (TPO)35-39. Contudo, os valores encontrados nao foram necessariamente reprodutíveis em populaçoes distintas, e nao devem ser extrapolados de uma populaçao para outra40-43.
Doenças cardiovasculares, gravidez e condiçoes médicas que possam interferir na interpretaçao, tais como dermatite grave e asma nao controlada, também funcionam como contraindicaçoes relativas para a execuçao do teste27. Os pacientes nao devem ser submetidos ao TPO se tiverem recebido corticosteroides sistêmicos recentemente (por exemplo, dentro de 7 a 14 dias), porque a recuperaçao da doença pode confundir a interpretaçao dos resultados. Aspirina, drogas anti-inflamatórias nao esteroides, inibidores da enzima de conversao da angiotensina, álcool e antiácidos podem atuar como fatores indesejáveis, aumentando a reatividade em pacientes suscetíveis. Os beta-bloqueadores podem representar um problema de segurança, se a adrenalina for necessária para tratamento27.
Execuçao do teste de provocaçao oral
Quando se decide que um TPO é necessário para diagnóstico de alergia alimentar, o primeiro passo consiste em explicar detalhadamente ao paciente e/ou familiares sobre o procedimento, seus riscos e benefícios, e as implicaçoes de um resultado positivo ou negativo. Este teste deve ser realizado sempre em ambiente hospitalar, onde haja toda infraestreutura para atendimento à situaçao de emergência. Depois de esclarecidos, os familiares devem assinar termo de consentimento informado. A Figura 1 apresenta um modelo de termo de consentimento informado.
O próximo passo é escolher o local ideal. Existem opçoes, que incluem: a unidade de terapia intensiva, uma sala ambulatorial em hospital, ou em clínica privada. No entanto, questoes devem ser previamente consideradas nesta decisao: idade do paciente, mecanismo imunológico envolvido, presença de doenças concomitantes e de fatores de risco para doenças cardiovasculares, assim como o tempo de dieta de exclusao e quantidades necessárias para o teste de provocaçao oral da reaçao27,30.
Em geral, sempre que houver um risco potencial para reaçao aguda e/ou grave, a supervisao médica é obrigatória43. A decisao para esta supervisao inclui, mas nao se limita, a um histórico de reaçoes significativas anteriores e/ou testes positivos para IgE. A estrutura ideal é a de ambiente hospitalar, tanto para paciente internado como ambulatorial44, porém, excepcionalmente, em casos de risco muito elevado para uma reaçao grave, podem ser realizados em unidade de terapia intensiva27.
Testes de provocaçao considerados de baixo risco, em pacientes cooperativos, sao os apropriados para serem realizados ambulatoriamente, mas sempre sob supervisao médica com estrutura para atender qualquer emergência27,30. Mesmo assim, é recomendável que os TPO sejam sempre iniciados sob supervisao médica, mesmo para os pacientes que apresentam exclusivamente manifestaçoes digestivas33. Outro tópico importante é apontado por estudos nacionais que mostram mudança no padrao de reaçao clínica manifestada em relaçao às apresentadas quando do diagnóstico de alergia às proteínas do leite de vaca em parcela dos pacientes com TPO positivo45,46.
Para os pacientes que apresentem reaçoes em situaçoes especiais, com exercícios físicos ou com uso concomitante de fármacos, pela possibilidade de reaçoes mais graves, devem ser sempre realizados sob supervisao médica em ambientes estruturados para atendimento de possíveis reaçoes graves28.
Pacientes com FPIES devem realizar os TPO sob supervisao médica, com acesso a fluidos intravenosos, antes mesmo do início do procedimento, como recomendado para pacientes com risco de ter reaçao anafilática20. A sua execuçao em consultório pode ser considerada em pacientes sem histórico de reaçao grave de FPIES, embora cautela seja necessária pelo fato de nao existirem dados que possam prever a gravidade futura das reaçoes, e pelo fato de em até 50% dos resultados positivos, o tratamento com fluídos intravenosos seja necessário47. Nesses casos, o TPO no domicílio nao é recomendado, dado o potencial de reaçoes graves47. Embora estudo recente tenha relatado conduçao bem-sucedida das reaçoes com reidrataçao oral48, é aconselhável ter hidrataçao intravenosa prontamente disponível48,49.
Antes da realizaçao do TPO, parâmetros relacionados ao paciente, ao ambiente e ao alimento devem ser adotados e checados para garantir a qualidade do teste29.
Parâmetros relacionados ao paciente
É essencial que o paciente esteja em boas condiçoes de saúde antes de ser submetido ao TPO. Alguns fatores podem comprometer a interpretaçao do exame e devem ser averiguados inicialmente, como quadros infecciosos e uso de drogas. Se necessário, o TPO poderá ser cancelado e reagendado.
Orientaçoes sobre a importância da isençao do alérgeno, por período mínimo de duas semanas, e sobre o tempo de jejum necessário para realizaçao do exame antes do TPO devem ser previamente fornecidas e checadas no dia do exame. Maes de lactentes em aleitamento materno também devem ser incluídas na dieta de restriçao28,50.
O jejum deve ser de no mínimo duas a quatro horas36. Crianças de baixa idade que nao consigam fazer jejum prolongado podem consumir metade da porçao usual de uma refeiçao leve, de acordo com a idade, duas horas antes do teste27. A principal finalidade do jejum é facilitar a absorçao do alimento testado, evitar que a ingestao prévia de alimentos interfira na interpretaçao dos resultados e reduzir o risco ao paciente, caso sejam necessárias manobras de ressuscitaçao27.
O paciente deve descontinuar medicamentos que possam interferir com o resultado do teste. Como regra geral, os anti-histamínicos devem ser suspensos, mas nao há consenso sobre por quanto tempo antes do TPO o paciente deve evitá-los27. Corticosteroides inalatórios podem ser mantidos em doses mínimas o suficiente para controlar a asma, e os tópicos podem ser aplicados em pequenas áreas da pele51, mas os corticosteroides sistêmicos devem ser suspensos como orientado alguns dias antes do teste (Tabela 3).
Parâmetros relacionados ao ambiente
Quanto ao ambiente, condiçoes locais de higiene, luminosidade e ventilaçao devem ser checadas, assim como os equipamentos, materiais e medicaçoes necessários para prestar assistência em reaçoes graves. As medicaçoes e respectivas dosagens, assim como o fluxograma de atendimento, devem ser afixados no leito do paciente, a fim de garantir a sistematizaçao do atendimento multidisciplinar29.
A presença de nutricionista, responsável pelo preparo das diluiçoes e das porçoes administradas durante o TPO, principalmente nos TPODCPC, é recomendável.
O médico deve permanecer ao lado do paciente durante a realizaçao dos TPOs. Na presença de reaçoes clínicas, com o auxílio da equipe de enfermagem, devem administrar medicaçoes e monitorizar periodicamente os sinais vitais, até controle das manifestaçoes clínicas28.
Parâmetros relacionados ao alimento
Os alimentos podem ser trazidos de casa pelo paciente e/ou pais para execuçao do TPO aberto27. No TPODCPC a oferta do alimento deve ser realizada em duas fases: alimento a ser investigado e na outra, o placebo, ambos oferecidos em doses crescentes em intervalos regulares e adicionados a veículos.Veículo é o material que acomoda o alimento a ser testado e tem a funçao de mascarar o odor, sabor, textura e cor, nao permitindo que existam diferenças quando comparado ao placebo52.
O alimento deve ser preparado sem contaminaçao cruzada ou contato com outros alimentos, aos quais o paciente possa reagir. De preferência, como ingrediente único27. Caso haja dificuldade de aceitaçao, principalmente pelas crianças, recomenda-se misturar o alimento em avaliaçao a outros alimentos consumidos habitualmente, como: sucos e papas de frutas, fórmulas hipoalergênicas previamente ingeridas e fórmulas de aminoácidos, eventualmente com adiçao de modificadores de sabor27,52.
O processamento térmico, aquecimento e cozimento podem alterar a conformaçao da proteína e resultar em alteraçao de sua alergenicidade53. Leite de vaca, ovo, carne, peixe, marisco, frutas e vegetais implicados na Síndrome da alergia oral podem sofrer alteraçoes53. Nos últimos anos, testes com alimentos processados sao utilizados para caracterizaçao de fenótipos dentro da alergia alimentar54-56. Além da susceptibilidade individual ao calor e à digestao, as proteínas sofrem interaçoes com outras substâncias presentes em um alimento complexo, designadas coletivamente como o efeito da matriz alimentar, reduzindo sua alergenicidade e, ao ser toleradas, sao adicionados à dieta, melhorando a qualidade de vida do paciente57.
Para diagnosticar reaçoes mediadas por IgE, doses crescentes do alimento devem ser administradas para minimizar o risco de reaçoes graves e permitir uma identificaçao precisa da menor dose capaz de provocar sintomas. Em geral, a quantidade total administrada durante um escalonamento progressivo no TPO deve ser igual a 8 a 10 g para alimentos secos, 16 a 20 g para carnes ou peixes, e de 100 mL para alimentos líquidos58.
Nos pacientes com FPIES, em que existe baixo risco de reaçoes imediatas, é consenso atualmente administrar-se o alimento suspeito em uma dose de 0,06 a 0,6 g, geralmente 0,3 g da proteína alimentar, por quilo de peso corporal, em 3 doses iguais ao longo de 30-45 minutos. Em geral, recomenda-se nao exceder um total de 3 g de proteína ou 10 g de alimento total (100 mL de líquido) para uma alimentaçao inicial (que visa aproximar um tamanho de porçao) e observar o paciente por 4 a 6 horas94. No entanto, para as FPIES atípicas, com IgE detectável para o alimento desencadeado, a administraçao mais gradual é recomendada49.
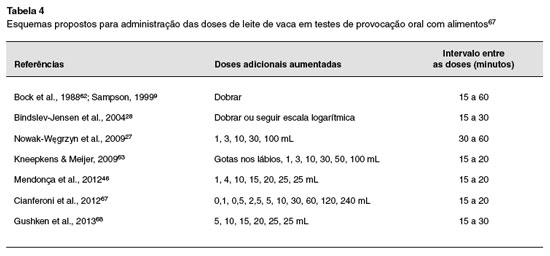
Na ausência de estudos comparativos entre diferentes protocolos de TPO, nao há consenso sobre a quantidade das doses e o intervalo entre elas, na administraçao do alimento a ser desencadeado (Tabela 4). Em casos com risco de reaçao grave ao leite de vaca, pode-se iniciar com 1 gota de leite de vaca diluído a 1:100 em água59. Nao é indicado iniciar o teste passando o leite de vaca na pele do indivíduo, tendo em vista que eritemas apenas nos locais de contato com o alimento nao representam positividade no TPO60.
Alguns estudos sugerem que a dose inicial deva ser menor do que aquela necessária para deflagrar sintomas na criança, de acordo com o referido pelos responsáveis28,61,62. Outros especificam que o volume inicial deva ser de 0,1 ou 1 mL27,28,63. As doses devem ser aumentadas progressivamente, sendo dobradas27,28,64-66 ou seguindo uma escala logarítmica (1, 3, 10, 30, 100 mL)27,28. Há outras propostas de progressao das doses, como as descritas na Tabela 4.
Utensílios familiares, copos e pratos favoritos podem ser trazidos de casa a fim de criar um ambiente adequado para as crianças, tornando a experiência mais agradável e menos propícia à ansiedade27.
Interpretaçao do teste de provocaçao oral
Sao considerados sintomas objetivos na interpretaçao dos exames: urticária generalizada, eritema, palidez, angioedema, tosse e/ou sibilância, estridor laríngeo, alteraçao da voz, coriza, espirros repetitivos, obstruçao nasal, hiperemia conjuntival, lacrimejamento, vômitos, diarreia, diminuiçao da pressao arterial em 20%, aumento da frequência cardíaca em 20% (que também pode ocorrer devido à ansiedade), colapso e anafilaxia. O aparecimento e persistência destes sintomas classificam o TPO como positivo, portanto, justificam a interrupçao do exame e o uso de medicamentos, quando necessário.
Em casos de sintomas considerados subjetivos ou nao observáveis (relatos dos pacientes) como por exemplo: prurido sem lesao de pele aparente, dor abdominal e náusea, disfagia, sensaçao de obstruçao respiratória, dispneia, alteraçoes do comportamento, prostraçao, cefaleia ou recusa em ingerir o leite, nao se justifica a interrupçao do procedimento. Período de observaçao maior, para permitir a resoluçao dos sintomas, deve ser disponibilizado antes da oferta da dose subsequente16,26,27.TPO com sintomas subjetivos podem ser considerados positivos se as manifestaçoes ocorrerem após três doses do alimento testado, mas nao se reproduzirem com o placebo27.
Em crianças pequenas que ainda nao falam, as pistas para o início de uma reaçao podem ser sinais sutis, como prurido em orelha, fricçao na língua, arranhoes no pescoço ou mudança no comportamento, ficando quieto, se retirando ou assumindo a posiçao fetal, ou ficando irritadas27.
Enfim, quando positivo, o teste traz benefícios relacionados à confirmaçao do diagnóstico de alergia alimentar, à reduçao do risco de exposiçao acidental e da ansiedade sobre o desconhecido, além de validar o esforço do paciente e de seus familiares em evitar o alimento. Se negativo, permite a ingesta do alimento suspeito, reduzindo risco nutricional e melhorando a qualidade de vida do paciente27.
EXAMES COPROLOGICOS
A pesquisa de sangue oculto nas fezes atualmente é feita pelo método específico para hemoglobina humana. Contribui quando há dúvida pela anamnese se realmente a perda referida é de sangue. Por outro lado, nao tem valor no diagnóstico de alergia alimentar. Estudo realizado com lactentes brasileiros assintomáticos (sem manifestaçoes de alergia alimentar) evidenciou sangue oculto positivo em 46,8% dos lactentes alimentados com leite de vaca integral, o que mostra alta possibilidade de resultados falso-positivos16.
A dosagem de alfa-1-antitripsina fecal muito empregada no passado, tem valor apenas nas alergias gastrintestinais associadas à síndrome de enteropatia perdedora de proteínas. Sua utilizaçao isolada nao tem valor definido, tanto para diagnosticar como para descartar alergia alimentar em pacientes com manifestaçoes inespecíficas.
A calprotectina fecal é uma proteína ligadora de zinco produzida principalmente por neutrófilos, monócitos e macrófagos3. Tem açao imunomodulatória, antimicrobiana e antiproliferativa. Nos processos inflamatórios do intestino observa-se aumento da quantidade de calprotectina nas fezes. Na alergia alimentar, observa-se reduçao nos valores médios de calprotectina após o início da dieta de exclusao69-71. No entanto, nao há definiçao dos pontos de corte relacionados com o teste de provocaçao oral.
ENDOSCOPIA DIGESTIVA ALTA E COLONOSCOPIA COM BIOPSIAS
Tanto a endoscopia alta como a colonoscopia atualmente podem ser indicadas para o diagnóstico diferencial de alergia alimentar em alguns pacientes, mas vale ressaltar que estes exames apenas devem ser indicados por gastroenterologistas, pois sao exames invasivos. Na ausência de resposta à dieta de exclusao em um paciente sintomático, com o intuito de excluir outra doença, pode ser necessária a endoscopia. O paciente que faz exclusao das proteínas alergênicas e que nao responde ou nao melhora, deve ser encaminhada a um gastroenterologista, pela suspeita de que possa haver alguma outra doença e fazer procedimentos endoscópicos33,58. Estes procedimentos, no entanto, só devem ser solicitados pelo gastroenterologista e executados por profissionais com experiência em realizá-los em crianças e adolescentes. Na suspeita de doença celíaca, de doenças eosinofílicas, de doença inflamatória intestinal ou de outras doenças de absorçao, a endoscopia e a colonoscopia estao indicadas e cada caso será avaliado quanto ao número e locais de biópsias a serem obtidas33,34. Pacientes com esofagite eosinofílica sao os candidatos potenciais a endoscopia, seguida por biópsias de mucosa esofágica. No controle habitual das alergias alimentares, a endoscopia e a colonoscopia nao estao indicadas33,69.
INVESTIGAÇAO DE REFLUXO GASTROESOFAGEANO SECUNDARIO A ALERGIA ALIMENTAR
Em relaçao ao diagnóstico de DRGE ou refluxo secundário à alergia alimentar, a pHmetria esofágica de 24 horas nao permite diferenciar claramente as duas situaçoes. Estudos mais recentes utilizando a impedâncio-pHmetria esofágica mais prolongada de 48 horas observaram que a exposiçao à proteína ofensiva, após período prévio de oferta de fórmula à base de aminoácido, demonstra aumento do número e duraçao dos refluxos, porém em especial os denominados fracamente ácidos. O método de investigaçao, entretanto, carece de praticidade para utilizaçao cotidiana72,73. Casos individualizados poderao requerer tal investigaçao.
Nos casos de esofagite determinada por doença do RGE ou decorrente da alergia alimentar, ambas podem exibir hiperplasia da camada basal, alongamento das papilas e exocitose de linfócitos. A presença de infiltrado eosinofílico moderado pode estar presente em ambas as situaçoes, sendo o diagnóstico final mais útil no sentido de detectar possível esofagite eosinofílica (acima de 15 eos/CGA)73.
RESPOSTA AO TESTE TERAPEUTICO SEGUIDA POR TESTE DE PROVOCAÇAO ORAL
Em pacientes com alergia alimentar nao-IgE mediada tem sido recomendada a dieta de exclusao, seguida por teste de provocaçao oral, para confirmaçao do diagnóstico3,16. No caso de APLV, a dieta de exclusao diagnóstica é recomendada ser feita com fórmulas com proteínas extensamente hidrolisadas à base da proteína do leite de vaca, sem especificaçao se de caseína ou de proteína do soro. Caso nao haja melhora clínica, após duas semanas, recomenda-se a substituiçao por fórmula de aminoácidos16,33. Se houver melhora, deve ser realizado o teste de provocaçao oral. Se o resultado for positivo, a dieta de exclusao terapêutica com a mesma fórmula deve ser mantida pelo período de 6 a 12 meses. Nas crianças pequenas amamentadas, a mae deve retirar da sua dieta os produtos à base de leite de vaca, e os sintomas do lactente devem ser monitorados.
TRATAMENTO DA ALERGIA ALIMENTAR
Na urgência
A história de ingestao de alimento suspeito, em paciente com antecedentes de reaçoes clínicas anteriores desencadeadas pelo mesmo alimento, deve orientar a interrupçao imediata da ingestao ou do contato com o alimento envolvido. O tratamento deve estar voltado para o alívio dos sintomas desencadeados. Os casos mais graves ou com história prévia de anafilaxia deverao ser mantidos em observaçao contínua, até o alívio dos sintomas, ou mesmo deverao ser hospitalizados. Nesta fase, é importante que se identifique o paciente que está evoluindo para reaçao mais grave: edema de glote e/ou choque anafilático, e se observem os critérios de definiçao para anafilaxia para o imediato uso de epinefrina intramuscular74.
Na presença de quadro cutâneo isolado, urticária e/ou angioedema, raramente é necessária a administraçao de epinefrina (soluçao milesimal) intramuscular. Em geral, os pacientes devem ser liberados com a prescriçao de anti-histamínico oral por prazo recomendável de no mínimo 7 dias. Em casos mais extensos, um curso rápido de corticosteroides orais pode ser necessário.
Da mesma forma, na presença de sintomas respiratórios isolados, o tratamento deve ser iniciado com a nebulizaçao de agente broncodilatador, que deverá ser mantido, sobretudo nos pacientes com antecedentes de asma, por no mínimo 5 dias. Os pacientes com manifestaçoes gastrintestinais isoladas, além da suspensao do alimento da dieta, deverao receber tratamento sintomático (antieméticos e/ou antiespasmódicos) e soluçoes hidratantes. A atençao deve ser dada para os pacientes que apresentem pelo menos dois órgaos ou sistemas envolvidos, para que nao se retarde o diagnóstico e o pronto tratamento da anafilaxia75.
Na emergência
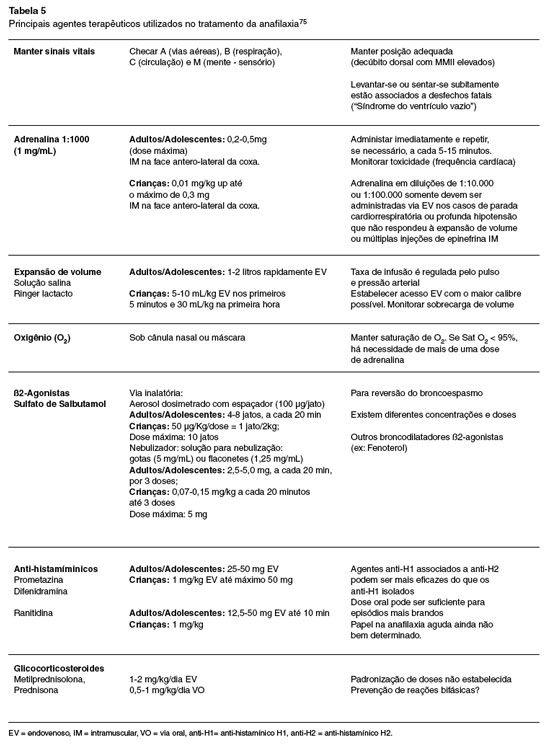
A alergia alimentar é a principal causa de anafilaxia tratada em serviços de emergência nos Estados Unidos, especialmente na populaçao mais jovem. Apesar disso, pouca atençao tem sido dada ao tratamento da anafilaxia na emergência. A Tabela 5 reúne os principais agentes empregados no tratamento da anafilaxia.
Estudo retrospectivo recente nos EUA reviu o diagnóstico de anafilaxia desencadeada por alimentos entre crianças e adolescentes (6 meses a 18 anos) em 37 hospitais pediátricos entre os anos de 2007 e 2012. Os autores encontraram um aumento do número de casos (de 41 para 71 casos/100.000 visitas ao pronto-socorro). Descreveram 7.303 episódios de anafilaxia, sendo mais comum entre 1 e 5 anos de idade (52%), relacionadas à ingestao de amendoim (37%), seguido de outras castanhas ou sementes (21%), peixe (8%) e leite (6%), e entre os pacientes com asma (20%) e com doenças crônicas complexas (3%)76. A análise dos pacientes mostrou haver associaçao entre a necessidade de internaçao e os seguintes fatores: menores de 1 ano, exposiçao a castanhas, apresentar simultaneamente asma ou outras condiçoes crônicas76.
Revisao sistemática de artigos publicados após os anos 2000 sobre anafilaxia na Europa mostrou incidência variável entre 1,5-7,9 casos/100.000/ ano, sendo que 0,3% da populaçao europeia já apresentou anafilaxia na vida. A etiologia dos casos está relacionada a alimentos, medicaçoes, insetos e látex, sendo que em 20% dos casos o agente nao foi identificado. A taxa de óbitos atingiu 0,000002% a 0,0001% habitantes77.
Estudo sobre as tendências temporais na prescriçao de epinefrina autoinjetável e o seguimento com especialista em alergia após episódio de anafilaxia, entre os anos de 2005 e 2014 nos EUA, demonstrou que após 1 ano da alta apenas 46% dos 18.279 casos dispunha de uma prescriçao de adrenalina autoinjetável, e 29% fizeram seguimento com especialistas. Esses percentuais se mantiveram ao longo dos 10 anos de observaçao. Quando foram analisados os menores de 18 anos, houve um aumento das prescriçoes entre 2005 e 2014 de 16%, e no seguimento com especialistas um aumento de 18,8%, enquanto para os adultos houve uma reduçao no seguimento com especialistas em 15,4%. As anafilaxias que mais receberam orientaçao para o uso de epinefrina autoinjetável foram aquelas desencadeadas por veneno de insetos e por alimentos. Isto reforça a necessidade de maiores pesquisas e programas de educaçao para o melhor reconhecimento e cuidados terapêuticos na anafilaxia78.Várias tentativas têm sido feitas no Brasil, mas até o momento a adrenalina autoinjetável ainda nao é comercializada.
O médico deve lembrar que a anafilaxia ocorre como parte de um evento clínico dinâmico. Mesmo sintomas que nao cursam com risco de morte iminente podem progredir rapidamente, a menos que medidas terapêuticas sejam prontamente estabelecidas79.
As recomendaçoes terapêuticas sao dependentes do conhecimento médico, e do seu discernimento sobre a necessidade de intervençao rápida, e várias diretrizes sobre anafilaxia foram desenvolvidas80-82. Deve ser ressaltado que a anafilaxia pode ter um curso bifásico em 11% dos casos (com grandes variaçoes de 0,4 a 23,3%) com melhora inicial, seguido por recorrência de sintomas graves em 2 a 4 horas, mais comuns nas anafilaxias desencadeadas por picadas de insetos do que naquelas após ingestao de alimentos80,82. Levando-se em consideraçao estas reaçoes tardias, recomenda-se a observaçao do paciente por no mínimo quatro horas, estendendo-se para 6-8 horas se apresentarem sintomas respiratórios, e 12 a 24 horas com colapso circulatório. Raramente a anafilaxia pode ter curso protraído, com sintomas durando alguns dias82.
Etapas do tratamento
a. Avaliar a permeabilidade das vias aéreas, respiraçao, circulaçao e nível de consciência (estado mental alterado pode sugerir a presença de hipóxia);
b. Iniciar imediatamente a ressuscitaçao cardiopulmonar se observarmos parada cardiorrespiratória;
c. Administrar adrenalina (soluçao 1/1000) na dose de 0,01 mg/kg (ou 0,01 mL/kg) em crianças, máximo 0,3 mg em pré-púberes e 0,5 mg em adolescentes, e adultos por via intramuscular (IM) a cada 5-15 minutos, até o controle dos sintomas e aumento da pressao sanguínea. Em geral 6% a 19% dos casos necessitam duas doses, e raramente outra dose adicional. As doses de adrenalina autoinjetável sao fixas e podem ser aplicadas em crianças a partir de 7,5 Kg até 25 Kg na dose de 0,15 mg, e nas crianças maiores ou iguais a 25 Kg, a dose recomendada é de 0,3 mg80,82,83. Evidenciou-se que a aplicaçao de adrenalina IM na coxa (vasto lateral) determina absorçao mais rápida e níveis séricos mais altos do que a aplicaçao em outros músculos, tanto em crianças quanto em adultos83. Nenhum estudo evidencia a eficácia da adrenalina administrada por outras vias como sendo mais eficaz no tratamento da anafilaxia. Nao há contraindicaçao absoluta para o uso de epinefrina mesmo nos idosos e com doença cardiovascular pré-existente, levando-se em conta o benefício maior do que o risco83; e
d. Deve-se chamar por auxílio de emergência.
Após a aplicaçao de adrenalina, outros cuidados sao necessários80-82, como descritos a seguir.
1. Colocar o paciente em posiçao supina, com elevaçao dos membros inferiores se ele tolerar. Isto diminui a progressao de alteraçoes hemodinâmicas; evitar mudanças bruscas de posiçao; se a paciente estiver grávida, colocar em posiçao lateral esquerda com as extremidades inferiores elevadas.
2. Fundamental manter as vias aéreas pérvias; assistência ventilatória pode ser necessária, assim como intubaçao traqueal ou cricotireoidostomia.
3. Considerar o uso de adrenalina nebulizada no estridor por edema laríngeo na dose de 2 a 5 ampolas, em adiçao à adrenalina IM.
4. Oxigênio: deve ser administrado a todos os pacientes com anafilaxia que tenham reaçoes prolongadas, hipoxemia prévia ou disfunçao miocárdica, para aqueles que receberam ß2-agonista inalado como parte do tratamento, ou ainda naqueles que necessitaram múltiplas doses de adrenalina.
5. Acesso venoso para reposiçao volêmica, preferencialmente com soluçao salina. Crianças - 5 a 10 mL/kg nos primeiros cinco minutos, e 30 mL/ kg na primeira hora; adolescentes/adultos - 1 a 2 litros rapidamente EV. A avaliaçao circulatória deve ser periódica, pois muitas vezes há necessidade de aumentar este aporte de volume.
6. Considerar a administraçao de difenidramina 1 a 2 mg/kg ou 25-50 mg/dose (parenteral); no nosso meio, a prometazina 0,5/kg/dose até 25 mg/dose. Os anti-histamínicos (agonistas inversos dos receptores H1) sao considerados de segunda linha, e nunca devem ser administrados isoladamente no tratamento da anafilaxia.
7. Considerar a prescriçao de ranitidina, 50 mg em adultos, ou 1 mg/kg em crianças EV. Outra opçao em adultos é a cimetidina 4 mg/kg EV, mas em crianças com anafilaxia, a dose ainda nao foi estabelecida.
8. Em broncoespasmos resistentes a doses adequadas de adrenalina, deve-se considerar o uso de ß2-agonista por nebulizaçao.
9. Na hipotensao refratária à reposiçao volêmica e à adrenalina IM, considerar a administraçao de agentes vasopressores.
10. Os glicocorticoides EV nao sao úteis para manifestaçoes agudas, mas ajudam a controlar a hipotensao persistente ou o broncoespasmo. A administraçao oral de prednisona (1 a 2 mg/kg até 75 mg) pode ser útil nos episódios anafiláticos menos graves, e pode prevenir as reaçoes bifásicas. Altas doses nebulizadas de corticosteroides podem ser úteis no edema laríngeo.
11.De acordo com a evoluçao, deve-se considerar a transferência do paciente para unidade de tratamento intensivo até a sua completa estabilizaçao.
Na alta, deve-se fornecer um plano de açao por escrito de maneira clara e simples para os pacientes e seus familiares. Deve ser incluído o nome do paciente, contatos de familiares e dos profissionais médicos, nome do alérgeno conhecido e cofatores desencadeantes, nome de medicaçoes a serem administradas e doses. O paciente deve sempre ser orientado para consultar especialista visando a confirmaçao do agente etiológico/cofatores, orientaçao dietética (alimentos substitutos, reatividade cruzada, alérgenos ocultos, etc.), educaçao do paciente e familiares (manifestaçoes de anafilaxia e uso de autoplicador de adrenalina), e avaliaçao do prognóstico (desenvolvimento de tolerância)82.
Ambulatorial especializado
Uma vez estabelecido o diagnóstico de alergia alimentar, a única terapia comprovadamente eficaz é a exclusao dietética do alérgeno implicado nas manifestaçoes clínicas. Estudos recentes em pacientes com alergia alimentar têm sugerido a ingestao regular de alimentos processados a altas temperaturas contendo proteínas do leite e ovo, demostrando que em até 70% dos casos esses produtos sao bem tolerados e que podem beneficiar um estado de tolerância aos mesmos, no entanto, ainda em casos especiais. A imunoterapia oral com alimentos processados a altas temperaturas e mesmo alimentos in natura deve ser restrita a casos bem selecionados, e em ambiente e com pessoal preparado para o atendimento de reaçoes sistêmicas graves84,85.
Os pacientes, seus responsáveis ou ambos, devem ser educados e informados detalhadamente sobre como garantir de fato a exclusao do alérgeno alimentar (p. ex: leitura de rótulos), evitar situaçoes de risco (p. ex: alimentaçao em aniversários, festas e buffets), reconhecer os sintomas e instituir o tratamento precoce de possíveis reaçoes anafiláticas80,82,83.
Sabendo das dificuldades em se evitar alguns alimentos abundantes na culinária, como o leite e o ovo, deve-se orientar o paciente e sua família sobre as medidas que deverao ser tomadas em caso de ingestao acidental. Em especial nos casos que envolvem reaçoes graves (anafilaxia), o paciente deverá transportar sempre consigo a adrenalina autoinjetável, a ser utilizada imediatamente se os sintomas forem desencadeados. Tao logo isso aconteça, o paciente deverá ser levado a um serviço de emergência para monitoramento por período de 4 a 6 horas e instituídas as medidas que se fizerem necessárias. As recomendaçoes atuais sugerem que os pacientes com asma moderada ou grave e que apresentaram anafilaxia desencadeada por alimentos devem portar uma segunda dose de adrenalina autoinjetável82.
Tratamento medicamentoso
Com relaçao ao tratamento medicamentoso, várias drogas podem fornecer alívio para certas manifestaçoes da alergia alimentar. Os anti-histamínicos, por exemplo, aliviam parcialmente os sintomas da síndrome da alergia oral e os sintomas cutâneos decorrentes de reaçoes mediadas pela IgE, porém nao sao capazes de bloquear as manifestaçoes sistêmicas mais graves82. Nao é correto afirmar que o uso de anti-histamínicos pode prevenir o aparecimento de reaçoes sistêmicas em pacientes sabidamente anafiláticos àquele alimento. Os quadros de alergia nao mediadas por IgE nao respondem a estas medicaçoes.
Os corticosteroides sistêmicos sao geralmente eficazes no tratamento das doenças crônicas IgE mediadas ou mistas (p. ex. dermatite atópica e asma), ou das doenças gastrintestinais nao IgE mediadas graves (p. ex. esofagite ou gastrenterite eosinofílica alérgica e enteropatia induzida pela dieta). O emprego de corticosteroide oral por curto prazo pode ser utilizado para reverter os sintomas inflamatórios graves, contudo seu uso prolongado está contraindicado, tendo em vista os importantes efeitos adversos que ocasiona86.
O tratamento da esofagite eosinofílica (EoE) tem se baseado em inibidores de bomba de prótons (IBP), dieta de exclusao dos alimentos envolvidos (seja selecionados por exames ou empiricamente) e no uso de corticosteroides tópicos (budesonida ou fluticasona deglutida), administrada através de aerossois dosimetrados em vários grupos de pacientes pediátricos e adultos, mas deve-se enfatizar o aparecimento de candidíase esofagiana em cerca de 10% destes pacientes, que deve ser prontamente tratada87,88. As diretrizes atuais para EoE apresentam vários esquemas de exclusao alimentar e o uso de medicamentos, incluindo terapêutica com monoclonais84,85. Estudos mostram a pouca utilidade e falta de evidências para o uso de cromoglicato de sódio, dos antagonistas de receptores de leucotrienos cisteínicos e mesmo a anti-IgE no tratamento da esofagite ou gastrenterite eosinofílica87,88.
No caso das doenças mediadas por IgE, para as manifestaçoes clínicas que envolvam órgaos que nao o trato gastrintestinal, o tratamento deve ser o mesmo empregado quando outros alérgenos que nao os alimentares desencadeiam os sintomas. Assim, por exemplo, asma, urticária, dermatite atópica e rinite devem ser tratadas como de rotina.
TRATAMENTOS EMERGENTES E IMUNOMODULAÇAO
O tratamento preconizado até o momento para as alergias alimentares é a restriçao absoluta do alimento responsável da dieta do paciente. Muitas vezes trata-se de tarefa árdua, uma vez que os antígenos mais envolvidos estao presentes de modo constante na culinária habitual (ex. leite de vaca, ovo, trigo), sobretudo quando a criança já se encontra em idade de frequentar escola e está na fase de socializaçao. Devido à chance de reaçoes graves acometer os indivíduos mais sensibilizados, impoem-se novos planos terapêuticos para o controle das alergias alimentares. Apesar dos muitos estudos nesta área de pesquisa, nenhum tratamento definitivo foi estabelecido até o presente89.
Prebióticos e probióticos
Prebióticos e probióticos carecem de evidências como produtos para prevençao ou tratamento de alergia alimentar90. A administraçao de probióticos para prevençao ou tratamento de doenças alérgicas tem resultados conflitantes. Uma microbiota intestinal alterada poderia predispor crianças à alergia alimentar por modificar a sinalizaçao de receptores Toll-like e a integridade de células epiteliais intestinais91.
Metanálise de estudos randômicos controlados investigando o uso de probióticos em crianças visando a prevençao primária de alergias encontrou discreta reduçao no risco de eczema clínico em lactentes menores de 1 ano, mas considera que as evidências sao insuficientes para uma recomendaçao a respeito da suplementaçao de probióticos visando a prevençao de alergias e hipersensibilidade alimentar92. Outra metanálise mais recente, incluindo ensaios clínicos randômicos e controlados com o objetivo de avaliar a associaçao entre a suplementaçao com probióticos e o risco de alergias e hipersensibilidade na criança, mostrou que o efeito protetor sobre a hipersensibilidade alimentar só foi observado quando os probióticos foram utilizados no pré-natal pelas gestantes, ou nos primeiros meses de vida pelo lactente (uso precoce)93.
Com respeito ao tratamento das alergias alimentares, permanece nao esclarecido o papel dos probióticos na correçao das alteraçoes da microbiota intestinal e sua influência na aquisiçao de tolerância94.
Revisao Cochrane mostrou benefício potencial na prevençao da dermatite atópica com o uso de prebióticos, mas evidências nao conclusivas na prevençao de outras doenças alérgicas, incluindo a alergia alimentar95.
Há poucos estudos com probióticos na prevençao de alergia alimentar documentada por testes de provocaçao oral. Em pacientes com APLV comprovada, o tratamento com Lactobacillus casei e Bifidobacterium lactis por 12 meses nao interferiu na resoluçao da APLV. No entanto, o tratamento com Lactobacillus rhamnosus associado a fórmula de caseína extensamente hidrolisada aumentou a resoluçao de APLV comparada com grupo que recebeu fórmula hidrolisada isolada96-99.
Metanálise de 17 estudos randômicos e controlados mostrou que probióticos administrados no período pré-natal ou pós-natal poderiam prevenir alergia alimentar mediada por IgE93. Outras revisoes sistemáticas de estudos randômicos e controlados apontam para a reduçao de sintomas com a suplementaçao de probióticos em pacientes com APLV, mas a ineficácia pelo contrário, também foi verificada, razao pela qual a Academia Europeia de Alergia e Imunologia Clínica (EAACI) nao se definiu até o presente sobre a suplementaçao de probióticos em longo prazo para tratamento de alergia alimentar100, e mais estudos sao necessários.
Os benefícios dos probióticos provavelmente dependem das cepas utilizadas. Dados de disbiose da microbiota intestinal em pacientes com alergia alimentar permitirao o delineamento de estudos clínicos randômicos adequados em pacientes com alergia alimentar.
Prebióticos sao alimentos nao digeríveis e seletivamente fermentados que modificam a composiçao e funçao da microbiota intestinal, conferindo benefícios para o indivíduo101. Nao há evidências de que os prebióticos possam auxiliar no tratamento de doenças alérgicas, em particular na alergia alimentar102.
Painel de especialistas da Organizaçao Mundial de Alergia (WAO) realizou revisao sistemática de estudos randômicos e controlados de prebióticos na prevençao de alergia. O painel sugere a suplementaçao de prebióticos em lactentes nao amamentados exclusivamente ao seio para a prevençao de doenças alérgicas, para reduzir o risco de asma/sibilância recorrente e alergia alimentar103.
Imunoterapia
A imunoterapia oral (ITO) e a sublingual (ITSL) para o tratamento de alergia alimentar é uma área de investigaçao ativa. Apesar da eficácia em certos casos, limitaçoes emergentes devem ser consideradas, como o alto índice de reaçoes adversas, o tempo longo de tratamento, e evidências da perda rápida da proteçao com a interrupçao do tratamento ativo, demonstrado com o amendoim e com o leite de vaca104-106. Com isto, há necessidade de novas opçoes ou de terapias adjuvantes para melhorar a segurança e a efetividade da imunoterapia107-109.
A IT alérgeno específica pode ser considerada para crianças a partir dos 4-5 anos de idade e com sintomas de alergia alimentar mediada por IgE ao leite (Grade A), ovo de galinha (Grade B) ou amendoim (Grade A) acompanhada por evidência de sensibilizaçao ao alérgeno desencadeante110. A maioria das crianças alérgicas ao leite e ao ovo desenvolve tolerância espontaneamente. Para esses pacientes, esperar para ver se eles superam suas alergias, antes de iniciar IT, pode ser uma opçao sensata110.
Estudos duplo-cegos, controlados com placebo demonstraram eficácia da ITO para ovo. O índice de dessensibilizaçao atinge 80-90% mesmo entre as crianças com alergia grave ao ovo, e com protocolos que induzem dessensibilizaçao em 5 dias111-116.
A alergia às proteínas do leite de vaca (APLV), a mais frequente das alergias alimentares, persiste mais provavelmente em doença mediada por IgE e quando há forte sensibilizaçao (níveis mais elevados de IgE ou reaçoes aos testes cutâneos fortemente positivas), múltiplas sensibilizaçoes alimentares e alergia respiratória concomitante (asma e rinite)80. A APLV resolve espontaneamente na maioria das crianças. No entanto, para a alergia persistente, a induçao da tolerância oral pode ser uma opçao de tratamento para alguns casos, em especial, quando há risco de ingestao acidental e ocorrer reaçoes graves. O conceito de induçao de tolerância oral segue os mesmos princípios da imunoterapia em outras doenças alérgicas107,117.
A administraçao de doses mínimas do alimento é progressivamente aumentada até atingir-se a dose alvo esperada capaz de nao causar reaçao, ou interrompe-se na dose anterior à de aparecimento de sintomas. Esta fase de induçao é seguida pela manutençao diária da dose máxima tolerada111. Desde o relato pioneiro de Patriarca e cols., várias observaçoes se seguiram: abertas e randômicas107-124.
No caso de induçao de tolerância oral em APLV, quatro tipos de reaçao podem ocorrer: (a) ausência de resposta; (b) resposta parcial (tolerância de > 5 mL, mas menos que 150 mL); (c) resposta com desenvolvimento de tolerância a > 150 mL de leite de vaca, mas com necessidade de manter a ingestao diária para manter a tolerância; e (d) resposta com tolerância persistente mesmo após períodos de nao ingestao do alimento111,125-131.
Em diretrizes internacionais, a seleçao de pacientes para ITO nao está bem estabelecida. No Japao, baseando-se na história natural da alergia alimentar e em estudos clínicos, as indicaçoes de ITO sao para pacientes com alergia alimentar e confirmada por teste de provocaçao oral; pacientes nos quais, a tolerância pela história natural nao é esperada.
Os requerimentos para centros onde ITO é realizada incluem: especialistas familiarizados com alergia alimentar e que conduzem rotineiramente testes de provocaçao oral e sao capazes de tratar os sintomas induzidos, sabem selecionar os pacientes para ITO, conhecem os mecanismos de açao, eficácia, efeitos colaterais associados e o tratamento dos mesmos; locais com aprovaçao de comitê de ética e assinatura de termo de consentimento informado91.
Os mecanismos de açao da ITO nao sao conhecidos em muitos aspectos, mas sao condizentes com as alteraçoes observadas na imunoterapia para alérgenos inaláveis, como produçao de IgG4, estimulaçao de linfócitos Treg e de suas citocinas, atenuaçao do predomínio de células Th2 sobre Th1, reduçao da reatividade de mastócitos, basófilos e linfócitos, reduçao da reatividade IgE específica no soro e testes cutâneos102,107,112.
Estas modificaçoes imunológicas sao resultantes da ITO. Durante o processo da imunoterapia, a condiçao de dessensibilizaçao (nao induçao de sintomas pelo alimento culpado) pode ser alcançada com consumo diário do alimento causador de alergia. No entanto, em alguns pacientes, a interrupçao de ingestao deste alimento pode induzir sintomas se ingerido novamente (perda da tolerância)107,112,132,133. Daí a importância de se realizar o teste de provocaçao oral (TPO), quando a ingestao regular do alimento é interrompida, pois a dessensibilizaçao induzida pode ser transitória127.
Muitos pacientes podem ter aumento no limiar de induçao de sintomas ou dessensibilizaçao pela ITO. Esta pode ser mantida em alguns pacientes, mesmo quando a ingestao regular do alimento é interrompida108,134,135. O termo "dessensibilizaçao" significa a capacidade de ingerir o alimento alergênico sem ter reatividade clínica, mas para isto, exigindo o consumo contínuo daquele alimento para manter o estado de nao reatividade136.
Revisoes sistemáticas, estudos randômicos e nao randômicos demonstraram aumento da tolerância em crianças e adultos com diferentes alergias alimentares. Por outro lado, um nao mostrou benefício, e duas revisoes sistemáticas tiveram resultados mistos, concluindo que a ITO nao deveria ser empregada como tratamento rotineiro103,137-142.
O período de duraçao da ITO e a manutençao do estado de tolerância/dessensibilizaçao foram analisados em poucos estudos. A nao reatividade ao alimento após sua exclusao por períodos de semanas a 6 meses varia entre 13% e 36%, demonstrada por provocaçoes repetidas. Embora tenha havido reduçao da frequência de resposta positivas, a maioria dos pacientes manteve reatividade com limiares mais baixos dos observados antes do tratamento143.
A presença de níveis mais baixos de anticorpos IgE específicos para o alimento, ao início da ITO, foi associada à persistência da hiporreatividade106.
Tentativas de dessensibilizaçao para alimentos empregaram ITO, ITSL e a imunoterapia por via epicutânea (EPI)145. ITSL e EPI sao consideradas abordagens mais seguras, por suas reaçoes serem locais na cavidade oral ou cutâneas, mas há descriçao de anafilaxia em ITSL para amendoim145-147.
Pouco se sabe sobre a duraçao ótima ou eficácia em longo prazo destes tratamentos imunoterápicos. Há o risco potencial de estes pacientes tratados terem reaçoes com lapsos de breve exposiçao ao alimento. É provável que estes tratamentos tenham que ser mantidos indefinidamente para conservar o estado de proteçao144. A Tabela 6 resume algumas características relacionadas à imunoterapia em pacientes com alergia alimentar.
Revisao sistemática recente observou ser 2,7% o risco de aparecimento de EoE em pacientes submetidos à imunoterapia oral148.
Imunobiológicos
O omalizumabe, anticorpo monoclonal humanizado anti-IgE, foi explorado como tratamento adjuvante à ITO, com a vantagem de permitir, em algumas observaçoes, dessensibilizaçao mais rápida e mais segura para leite de vaca, amendoim ou múltiplos alimentos simultaneamente149-153. O omalizumabe foi administrado 8 semanas antes e 8 semanas após esquema de induçao de tolerância oral abreviado em pacientes com sensibilizaçoes a 5 alimentos. Embora experimental, o esquema permitiu induçao de tolerância oral com rapidez e segurança para até 5 alimentos. A mediana de tempo para atingir-se a dose máxima de alérgeno foi 18 semanas para o grupo omalizumabe contra as habituais 85 semanas anteriormente observadas em protocolo sem uso de omalizumabe150.
O omalizumabe permite alcançar com maior segurança a dose desejada, diminui o número de reaçoes relacionadas às doses, e desvia o índice risco/ benefício da ITO para leite de vaca. Nao influencia a eficácia e nem está associado à induçao de tolerância imunológica (hiporresponsividade persistente)153,154.
Foi realizado estudo controlado com placebo sobre a eficácia de omalizumabe na dessensibilizaçao rápida, em um dia, de pacientes com alergia grave ao amendoim, seguido por incrementos semanais até atingir-se 2000 mg. O tratamento prévio de 12 semanas com omalizumabe permitiu tolerância dez vezes maior: 250 mg x 22,5 mg de amendoim tolerados, respectivamente pelo grupo omalizumabe e o placebo. A induçao de tolerância oral foi bem sucedida em 79% do grupo tratado contra 12% do grupo placebo, e foi persistente mesmo após interrupçao do omalizumabe. Três pacientes desenvolveram esofagite eosinofílica, que reverteu com interrupçao da ITO155-157.
O omalizumabe aumenta o limiar para a reaçao alérgica ao alimento no TPO em até 80 vezes157. Utilizado em criança com asma grave e anafilaxia a diferentes alimentos após ser submetido à aferese específica para IgE (processo ainda em investigaçao em que a IgE é removida da circulaçao geral do indivíduo empregando-se filtros específicos). Este procedimento prévio reduz drasticamente os níveis de IgE, para entao permitir o emprego do omalizumabe. Com este tratamento, o paciente se tornou tolerante a todos os alimentos que lhe causavam anafilaxia157.
Respostas inflamatórias orquestradas por linfócitos Th2 sao características da alergia alimentar. Este predomínio da inflamaçao tipo 2 está associado à produçao aumentada de IL-4, IL-5, e IL-13. A IL-4 induz a proliferaçao de células Th2 e mastócitos, e desvio para isotipo de células B. A IL-5 promove crescimento, maturaçao, recrutamento e ativaçao de eosinófilos. A IL-13 induz a síntese de IgE, recrutamento de eosinófilos e basófilos, aumenta a atividade de células epiteliais e a secreçao de muco.
O epitélio de qualquer tecido também tem papel chave na reaçao alérgica. Serve como barreira para proteínas estranhas e agentes microbiológicos. O aumento da permeabilidade epitelial facilita a sensibilizaçao alérgica. As células epiteliais produzem citocinas e quimiocinas que favorecem a resposta tipo 2 por células dendríticas e incluem linfopoietina timo-estrômica (TSLP), IL-25, e IL-33. Estas ativam ainda células linfoides inatas (ILC) que também produzem citocinas do tipo Th2109,158-161.
Pacientes com dermatite atópica podem ter alergia alimentar mediada por IgE e por outros mecanismos nao dependentes de IgE. A doença tem fenótipos com domínio Th2 em alguma fase, e pode servir de exemplo para a imunomodulaçao com imunobiológicos162,163.
Com este cenário estabelecido nas reaçoes alérgicas tipo 2 por alimentos, o alvo do tratamento pode ser representado pelas citocinas e os receptores de citocinas. Níveis elevados de IL-4, IL-5 e IL-13 foram observados em pacientes com alergia alimentar164,165. Variantes de IL-13 associadas a níveis elevados de IgE foram observadas em alergia alimentar, particularmente em pacientes com alergia à clara de ovo166.
Anticitocinas contra um único tipo de citocina talvez sejam menos eficazes no controle de sintomas, possivelmente pela açao concomitante de outras citocinas Th2. Intervençoes possíveis com anti IL-5 ou antirreceptor de IL-5, já empregados em pacientes com esofagite eosinofílica, e possivelmente mais racional, o anticorpo monoclonal antirreceptor de IL-4/IL-13 sao promissores no tratamento de alergia alimentar167-171.
As perspectivas para pacientes alérgicos parecem melhores nos anos que virao. Imunoterapia por diversas vias de administraçao, alérgenos modificados, imunobiológicos, biomarcadores, sao alguns recursos que modificarao a história do tratamento da alergia alimentar.
"I do not know what food immunotherapy will be like 20 to 30 years from now, but I am hopeful that it will look nothing like the therapies described in this review. These will be exciting times that might eventually allow us to use words like tolerance and cure in treating patients with severe persistent food allergy." Robert A. Wood144.
HISTORIA NATURAL DA ALERGIA ALIMENTAR
Conhecer o prognóstico e a evoluçao da alergia alimentar tem impacto em decisoes importantes durante o seguimento clínico, como a escolha do momento para reavaliar a tolerância clínica, assim como para decisoes terapêuticas, diante de novas perspectivas de tratamento172. A maior parte das alergias alimentares que acometem as crianças sao transitórias, enquanto os adultos apresentam fenótipo de alergia persistente. Porém, a história natural da alergia alimentar vem sofrendo transformaçoes. Além da prevalência de alergia alimentar estar aumentando, o tempo para o desenvolvimento de tolerância tem sido maior do que previamente descrito172,173. A evoluçao da alergia alimentar depende de algumas variáveis, principalmente do tipo de alimento envolvido, das características do paciente, e do mecanismo imunológico responsável pelas manifestaçoes clínicas174-180.
Dentre os vários fatores associados ao risco de maior persistência da alergia alimentar, destacam-se: antecedente de reaçoes graves, reaçoes desencadeadas por mínimas quantidades do alimento, presença de comorbidades alérgicas e altos níveis de IgE específica para o alimento alergênico172,181.
O mecanismo envolvido na patogênese da alergia alimentar tem implicaçoes, tanto no tipo e gravidade das manifestaçoes clínicas, quanto no padrao de evoluçao natural da doença172,178. As alergias mediadas por anticorpos IgE habitualmente levam mais tempo para aquisiçao de tolerância, enquanto que as manifestaçoes gastrointestinais de alergias mediadas por mecanismos celulares costumam se resolver espontaneamente até os 2-3 anos de idade181-186. Além disso, na alergia IgE mediada os pacientes que reagem a alérgenos alimentares por inalaçao parecem compor um grupo de risco para reaçoes graves e mais persistentes, porém este grupo representa uma pequena proporçao dos casos184.
As causas mais comuns de alergia alimentar na infância como o leite, a soja, o ovo e o trigo, com frequência se associam à remissao da alergia ao longo do tempo, enquanto que para amendoim, nozes e castanhas, a alergia é considerada persistente173-183. Embora alguns casos possam desenvolver tolerância clínica para peixe e camarao, existem poucos estudos que avaliaram a história natural de alergia a frutos do mar, as quais também sao consideradas persistentes186.
Em relaçao ao leite de vaca, historicamente a alergia apresenta prognóstico muito favorável para tolerância. Porém, estudos mais recentes demonstram um aumento do número de crianças que nao desenvolvem tolerância até o início da idade adulta187. As taxas de remissao de alergia ao leite variam conforme a populaçao, sendo que um estudo em hospital terciário nos EUA observou que 19% das crianças desenvolveram tolerância até os 4 anos de idade, 42% até os 8 anos, 64% até os 12 anos, e 79% até os 16 anos de idade187. A expectativa de resoluçao da alergia ao leite é menor em pacientes com níveis elevados de IgE específica, tendo sido observado que apenas 60% daqueles com IgE para leite maior do que 50 kUA/L adquiriram tolerância até os 18 anos de idade187.
Os alérgicos à soja, em sua maioria, desenvolvem tolerância ao alimento durante a infância, podendo persistir por mais tempo os casos que apresentam IgE específica para soja maior que 50 kUA/L179.
Em relaçao ao ovo, o prognóstico para resoluçao da alergia também é bom, e atualmente sabe-se que a tolerância pode variar conforme o grau de processamento térmico do ovo. Tem sido observado que muitas crianças toleram inicialmente o ovo cozido, para depois deixar de reagir ao alimento cru173. Estudos observaram que a média de resoluçao da alergia ao ovo foi de 9 anos de idade, entretanto apenas 10% dos casos com IgE específica maior que 50 kUA/L desenvolveram tolerância até os 18 anos186.
Em relaçao ao trigo existem poucos trabalhos, mas um estudo grande, restrospectivo, documentou que a média de idade para tolerância foi de 6 anos, embora tenha sido observado que 35% entraram na adolescência ainda alérgicos187.
A alergia ao amendoim, considerada menos frequente no Brasil, é persistente na maioria das vezes, tendo sido observado que 22% podem resolver a alergia até os 4 anos de idade188.
A compreensao da história natural das diferentes formas de alergia alimentar, permite ao médico individualizar quando e como avaliar a tolerância, através do teste de provocaçao oral com o alimento. É necessário o acompanhamento sistemático por equipe multiprofissional das crianças com alergia alimentar, a intervalos mais curtos nos lactentes (3 a 6 meses), anual e até bianual nas crianças maiores e adultos, a depender do tipo de alergia e de alimento189. Este acompanhamento deve, além de avaliar a evoluçao relacionada à alergia, realizar a avaliaçao e monitoraçao da condiçao nutricional, pois muitas vezes a exclusao de um determinado alimento sem orientaçao nutricional apropriada pode determinar grave comprometimento do crescimento e desenvolvimento.
TRATAMENTO DIETÉTICO
A base do tratamento da alergia alimentar é essencialmente nutricional e está apoiada sob dois grandes pilares: (a) a exclusao dos alérgenos alimentares responsáveis pela reaçao alérgica com substituiçao apropriada, (b) a utilizaçao de fórmulas ou dietas hipoalergênicas, em lactentes, em situaçoes de APLV190.
Orientaçoes nutricionais
O objetivo global do tratamento nutricional é evitar o desencadeamento dos sintomas, a progressao da doença e a piora das manifestaçoes alérgicas, proporcionar à criança crescimento e desenvolvimento adequados e prevenir distúrbios nutricionais.
Os alimentos que devem ser eliminados e posteriormente testados por meio de teste de provocaçao oral sao os apontados pela história do paciente, no registro alimentar acoplado ou nao a diário, onde a família anota manifestaçoes associadas à ingestao/exposiçao a determinado alimento e, quando necessário, testes de hipersensibilidade (puntura ou prick test, IgE sérica específica in vitro para alimentos) positivos. Quando há falha na identificaçao dos potenciais alérgenos, dieta com restriçao de mais de um alimento alergênico suspeito pode ser necessária, por um período de 2 a 4 semanas (sendo 2 a 4 semanas para pacientes com sintomas gastrintestinais como diarreia e constipaçao, e de 1 a 2 semanas para os demais)33.
Os lactentes que estao em aleitamento materno devem ser assim mantidos, e a mae deve ser submetida à dieta de exclusao do alérgeno envolvido, tanto para os com alergia alimentar IgE mediada, como para os com nao-IgE mediada. Quando necessária a dieta materna com restriçao total de leite de vaca e derivados, deve ser recomendada a suplementaçao de cálcio191 e vitamina D (colecalciferol)30. É válido ressaltar que nos casos em que o lactente em aleitamento natural nao manifestar reaçoes com alérgenos veiculados pelo leite materno, nao há indicaçao de se restringir a dieta da nutriz, ainda que os sintomas possam ser observados após a ingestao do alimento diretamente pela criança.
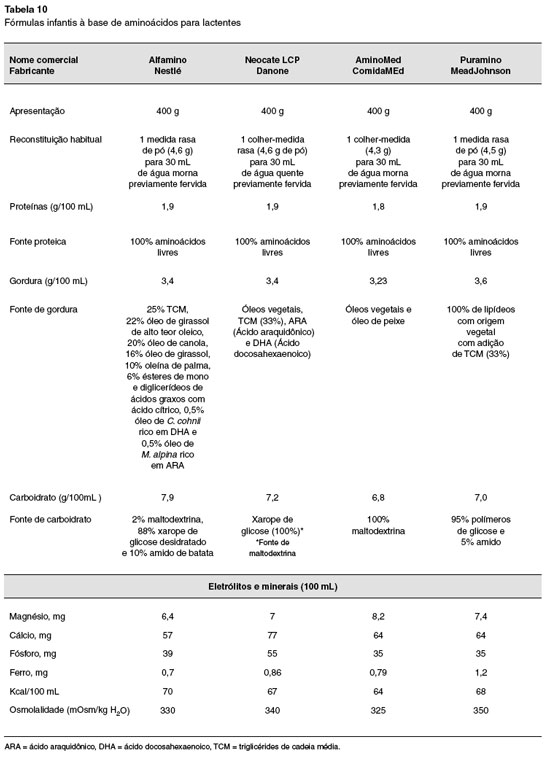
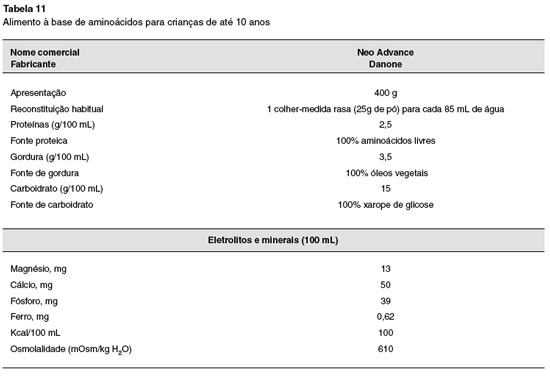
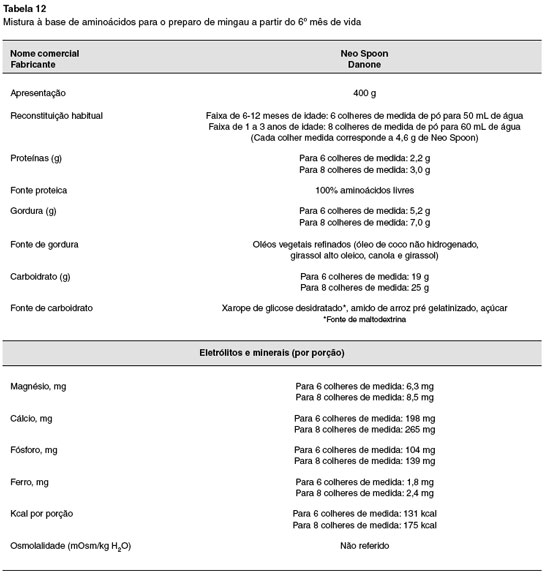
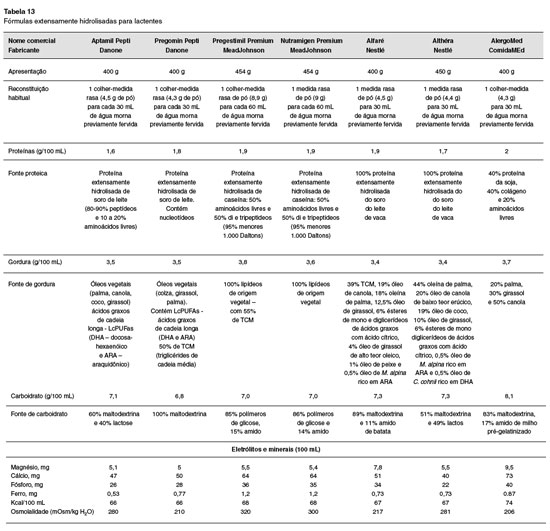
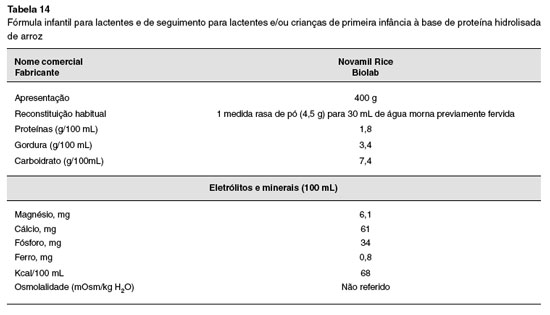
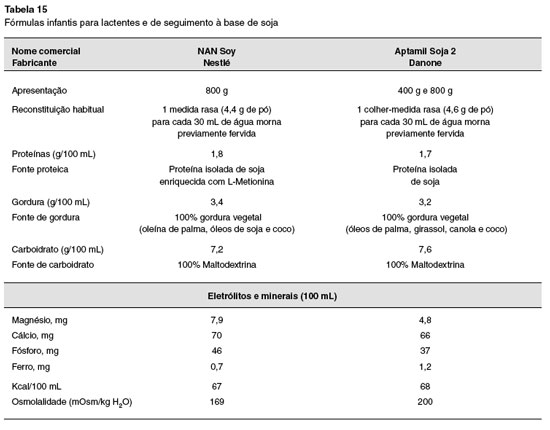
Para os lactentes que por algum motivo nao estejam sendo amamentados, ou o leite materno seja insuficiente, as fórmulas hidrolisadas devem ser utilizadas. Durante este período, os lactentes com APLV devem ser mantidos com fórmulas sem a proteína intacta do leite de vaca, que podem ser extensamente hidrolisadas à base da proteína do leite de vaca, dieta semielementar ou hidrolisado proteico), aminoácidos livres (dieta elementar) ou de proteína isolada de soja (somente para crianças maiores de seis meses e sem manifestaçao gastrintestinal). Outra possibilidade para lactentes muito jovens é a relactaçao, que nao deve ser esquecida, sempre enfatizando a exclusao de produtos lácteos pela nutriz. Mais recentemente, em alguns países se começa a utilizar a proteína hidrolisada de arroz, que ainda carece de maiores estudos192. O alimento identificado como causador da alergia deve ser totalmente excluído, para posterior exposiçao, isolada ou em sequência (a depender se um ou mais alimentos estao envolvidos), mediante o teste de provocaçao oral (TPO)193,194.
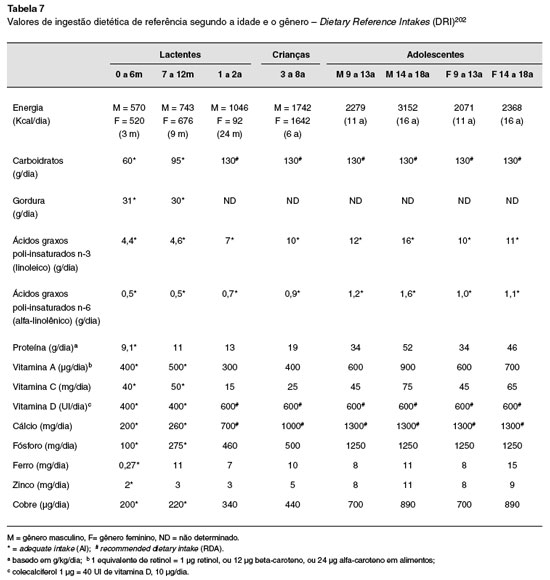
Assim, a retirada dos alimentos alergênicos da alimentaçao da criança é ainda a única forma disponível comprovadamente eficaz no tratamento da alergia alimentar195-197. Tal conduta deve contemplar a total exclusao do alimento reconhecido ou supostamente envolvido, inclusive os produtos dele derivados e de preparaçoes que o contenham. É importante a identificaçao do alérgeno, a fim de se manter a oferta alimentar qualitativa e quantitativamente adequada, evitando, portanto, o uso de dietas desnecessárias e muito restritivas183,198,199. A avaliaçao adequada do estado nutricional com o objetivo de planejar e adequar a ingestao às necessidades nutricionais da criança de acordo com os tipos de alimentos permitidos é prioritária200,201.Todo empenho deve ser feito no intuito de realizar as substituiçoes alimentares visando garantir a oferta nutricional adequada, alcançando-se as suas necessidades que devem atender as atuais recomendaçoes nutricionais202. A Tabela 7 indica as recomendaçoes nutricionais nas diferentes faixas etárias para alguns nutrientes.
Para garantir o atendimento às recomendaçoes é fundamental amplo trabalho de educaçao nutricional da família, principalmente da mae e/ou cuidador, assim como a conscientizaçao da criança, quando em idade que permita a compreensao.
Esclarecimentos completos devem ser dados sobre os alimentos recomendados e substitutos, as formas de apresentaçao disponíveis, bem como aqueles que devem ser evitados e, dentre esses, outros que possivelmente possam envolvê-los na sua composiçao. Além disto, deve ser realizada orientaçao detalhada quanto à inspeçao e leitura minuciosa dos rótulos de alimentos consumidos que podem apresentar alérgenos, bem como informaçoes sobre nomenclaturas de difícil interpretaçao pelas famílias como, por exemplo, soro/whey, caseína, lactoglobulina, lactoferrina ou caseinatos, significando presença de leite, ou albumina, indicando presença de ovo. A leitura da rotulagem deve ser feita periodicamente antes da aquisiçao do produto, pois modificaçoes na composiçao podem ocorrer com o passar do tempo. É importante ressaltar a grande dificuldade dos pais reconhecerem corretamente os rótulos que indicam leite de vaca e outras proteínas alergênicas nos produtos industrializados, podendo ser esta uma forma de transgressao nao intencional à dieta de exclusao. Este aspecto foi observado em estudo nacional que avaliou a capacidade dos pais identificarem produtos com e sem leite de vaca203.
Outra dificuldade de interpretaçao ocorre quando há informaçao na rotulagem sobre a existência de "traços" do potencial alérgeno, indicando que crianças com formas graves de alergia alimentar nao devem consumi-lo, tendo em vista que esses alimentos sao produzidos pelo mesmo equipamento industrial empregado para elaborar outro alimento que contém o referido alérgeno. Outros produtos domésticos e de higiene podem conter proteínas alergênicas, incluindo alimentos para animais, medicamentos, cosméticos, sabonetes, loçoes, protetores solares, sendo necessária a observaçao rigorosa da rotulagem. Devido ao grande número de situaçoes de risco possíveis, as famílias devem ser amplamente orientadas quanto a procedimentos em situaçoes graves, tema já anteriormente abordado.
Em geral, as alergias IgE mediadas sao as que expoem os pacientes a quadros mais graves, com risco de morte, ou seja, a anafilaxia. Portanto, para esses pacientes os cuidados em relaçao à evitaçao do alérgeno envolvido na reaçao devem ser reforçados, sobretudo se o paciente já manifestou previamente reaçao anafilática82.
O trabalho em equipe multidisciplinar, incluindo o nutricionista, representa auxílio valioso na diminuiçao das dificuldades à adesao integral ao tratamento. Programas de apoio às crianças com alergia alimentar devem avaliar periodicamente os pacientes admitidos a fim de reavaliar e estabelecer as melhores medidas de acompanhamento, intervençao nutricional e dietética188. Em particular, o estabelecimento de reavaliaçoes periódicas do paciente tem como objetivo manter a monitorizaçao do seu adequado crescimento e desenvolvimento, além de possibilitar a detecçao de transgressoes à conduta proposta, acidentais ou voluntárias, o que pode determinar a persistência dos sintomas ou sua recorrência. É aconselhável que a família faça periodicamente um registro alimentar de no mínimo quatro dias (envolvendo pelo menos um dia de final de semana) associado a um diário em que anote toas as reaçoes associadas à ingestao de qualquer alimento, e que seja incluída na anamnese a avaliaçao da ingestao alimentar por meio do dia alimentar habitual, recordatório de 24 horas e/ou frequência de consumo. A análise de ingestao permite avaliar se houve a exclusao completa da proteína alergênica da dieta, assim como corrigir eventuais inadequaçoes por meio da educaçao nutricional associada ou nao à suplementaçao nutricional ou medicamentosa de nutrientes que nao atinjam as recomendaçoes nutricionais, evitando-se assim, desnutriçao, comprometimento estatural e outras carências199.
É importante que as famílias tragam para a consulta o rótulo de alimentos industrializados habitualmente oferecidos à criança, para a avaliaçao do médico e/ou nutricionista. Recomenda-se, também, que procure informaçoes mais detalhadas sobre ingredientes específicos que entram na composiçao nutricional do alimento oferecido, diretamente com a indústria, por intermédio dos serviços de atendimento ao consumidor, ou prestadores de serviços alimentares, como restaurantes, cantinas e lanchonetes183,198. A higiene ambiental e doméstica, assim como cuidados com manipulaçao inadvertida de alimentos contendo proteínas alergênicas, devem ser reforçados. Há possibilidade de reaçoes por inalaçao durante o preparo de alimentos, como, por exemplo, à cocçao.
Embora em menor frequência, comparativamente às proteínas do leite de vaca, outros alimentos podem ser importantes desencadeadores de reaçoes alérgicas, a depender da regiao e dos hábitos alimentares daquela populaçao. Dentre esses, as proteínas da soja, ovo, trigo, peixes e frutos do mar, e, menos frequentes em nosso meio, amendoim, castanhas e nozes.
Tem-se dado importância à ocorrência de alergias múltiplas. As crianças e adolescentes que têm essa forma de alergia alimentar estao em risco nutricional, sendo fundamental o monitoramento rigoroso do consumo alimentar e do estado nutricional. Para cada alimento ou grupo de alimentos excluído, deve-se avaliar os riscos de deficiência de macro e micronutrientes, tanto para a criança como para a nutriz, que também deverá ser submetida à dieta de exclusao em situaçoes de manutençao do aleitamento materno. Quando a dieta for muito restrita, houver baixa adesao ou grave comprometimento nutricional e a alergia múltipla incluir o leite de vaca, é recomendado o uso substitutivo e complementar das fórmulas hipoalergênicas já citadas anteriormente.
A introduçao da alimentaçao complementar em crianças com APLV deve seguir os mesmos princípios do preconizado para crianças sem alergia, a partir do sexto mês em crianças amamentadas ao seio até essa fase, ou que recebem fórmulas infantis. Reforçase que nao há necessidade de restriçao de alimentos contendo proteínas potencialmente alergênicas (p.ex. ovo, peixe, carne bovina, de frango ou porco). Deve-se evitar apenas a introduçao simultânea de dois ou mais alimentos fontes de novas proteínas. A possibilidade de reaçao cruzada entre LV e carne bovina é inferior a 10%, e relaciona-se à presença da albumina sérica bovina, por isso a carne de vaca nao deve ser excluída da alimentaçao da criança, a nao ser que haja certeza que o seu consumo se relaciona com piora dos sintomas33.
O leite de outros mamíferos (p. ex.: cabra e ovelha), fórmulas parcialmente hidrolisadas, fórmulas poliméricas isentas de lactose, os preparados e bebidas à base de soja e arroz nao devem ser indicados para crianças com APLV33.
A ANVISA publicou no DOU n° 125 a Resoluçao - RDC n° 26, de 02 de julho de 2015, que dispoe sobre os requisitos para rotulagem obrigatória dos principais alimentos que causam alergias alimentares. A norma se aplica aos alimentos, incluindo as bebidas, ingredientes, aditivos alimentares e coadjuvantes de tecnologia embalados na ausência dos consumidores, inclusive aqueles destinados exclusivamente ao processamento industrial e os destinados aos serviços de alimentaçao204.
Sao 17 tipos de alimentos que deverao trazer essas informaçoes: trigo (centeio, cevada, aveia e suas estirpes hibridizadas), crustáceos, ovos, peixes, amendoim, soja, leite de todas as espécies de animais mamíferos, amêndoa, avelas, castanha-decaju, castanha-do-brasil ou castanha-do-pará, macadâmias, nozes, pecas, pistaches, pinoli castanhas e látex natural204,205.
Também é importante salientar que nos casos em que nao for possível garantir a ausência de contaminaçao cruzada, deve constar no rótulo a declaraçao "Alérgicos: pode conter (nomes comuns dos alimentos que causam alergias alimentares)". Essas informaçoes devem estar agrupadas imediatamente após ou abaixo da lista de ingredientes, em caixa alta, negrito, cor contrastante com o fundo do rótulo e altura mínima de 2 mm205.
Os alimentos listados na norma devem trazer a declaraçao:
"Alérgicos: contém (nomes comuns dos alimentos que causam alergias alimentares)"; ou
"Alérgicos: contém derivados de (nomes comuns dos alimentos que causam alergias alimentares)" ; ou
"Alérgicos: contém (nomes comuns dos alimentos que causam alergias alimentares) e derivados", conforme o caso.
As indústrias tiveram prazo de 12 meses para promover as adequaçoes necessárias na rotulagem dos produtos abrangidos por esta Resoluçao, contados a partir da data de sua publicaçao que se deu no DOU em 3 de julho de 2015.
Fórmulas substitutas do leite de vaca em pacientes com APLV - mediadas ou nao por IgE
Em lactentes, deve-se priorizar a manutençao do aleitamento materno exclusivo até seis meses, com introduçao da alimentaçao complementar posterior a esta idade. Nessas condiçoes, caso seja identificada uma alergia alimentar isolada ou múltipla, submete-se a mae à dieta de exclusao com orientaçao nutricional adequada para ela e para a criança por ocasiao da introduçao dos alimentos complementares.
A utilizaçao de fórmulas consideradas hipoalergênicas em situaçoes de APLV quando houve a interrupçao do aleitamento materno é a alternativa preconizada. Segundo a Academia Americana de Pediatria (AAP), para ser considerada hipoalergênica, tal fórmula nao deve causar reaçoes alérgicas em até 90% das crianças com APLV, comprovaçao esta realizada em testes de provocaçao duplo-cego controlados com placebo, em estudos prospectivos e randomizados198. Neste sentido, nao sao recomendadas as fórmulas parcialmente hidrolisadas, por conterem proteínas intactas do leite de vaca e, portanto, potencial alergênico. Também nao devem ser empregados para os lactentes os preparados à base de soja em apresentaçoes líquidas ou em pó (por nao atenderem recomendaçoes nutricionais para a faixa etária e por nao conterem proteínas isoladas e purificadas), assim como os produtos à base de leite de cabra, ovelha e outros mamíferos (pela similaridade antigênica) (Tabela 8)206.
As fórmulas atualmente disponíveis no mercado adequadas para crianças menores de um ano e que podem ter indicaçao no tratamento dietético da alergia às proteínas do leite de vaca sao:
1) fórmulas e dietas à base de proteína extensamente hidrolisada (hidrolisados proteicos), compostas por peptídeos, sobretudo, e aminoácidos obtidos por hidrólise enzimática e/ou térmica ou por ultrafiltragem;
2) fórmulas e dietas à base de aminoácidos, as únicas consideradas nao alergênicas207;
3) fórmulas à base de proteína isolada de soja, com proteínas purificadas e suplementadas para atingir as recomendaçoes nutricionais do lactente, idealmente acima de seis meses, sobretudo nas formas IgE mediadas e nos pacientes que têm dificuldade de adquirir as fórmulas mais caras;
4) fórmulas à base de proteína hidrolisada do arroz, suplementadas para atingir as recomendaçoes nutricionais do lactente desde o nascimento192,193, embora ainda poucos países adotem esta prática, e ainda nao seja consenso208.
As fórmulas à base de proteína de soja apresentam algumas diferenças em sua composiçao quando comparadas a fórmulas poliméricas à base de leite de vaca212: maior conteúdo proteico (2,45 a 3,1 g/100 kcal) devido ao menor valor biológico de suas proteínas, sao isentas de lactose, contêm fitatos (cerca de 1% a 2%) e oligossacarídeos que interferem na absorçao do cálcio, fósforo, zinco e ferro (os níveis de cálcio e fósforo, por exemplo, sao superiores em 20% às fórmulas com proteína do leite de vaca), contêm glicopeptídeos da soja que interferem no metabolismo do iodo, conteúdo mais elevado de alumínio e presença de fitoestrógenos (isoflavonas, genisteína e daidzeína).
O National Toxicology Program of US Department of Health and Human Services, nos Estados Unidos, realizou recentemente reuniao de especialistas e concluiu que a possibilidade de eventos adversos a longo prazo ou discretos sobre o desenvolvimento ou reproduçao humana nao pode ser descartada, isso porque embora eventos dessa natureza nao tenham sido descritos após mais de 40 anos do uso de fórmulas a base de proteína de soja naquele país, este assunto nunca foi estudado de forma adequada213.
Nas hipersensibilidades nao mediadas por IgE e manifestadas como colites, enterocolites ou esofagites, o risco de sensibilizaçao simultânea à soja pode chegar a 10%, nao sendo, portanto, rotineiramente recomendado o seu uso, exceto em formas clínicas leves ou nas fases mais tardias de tratamento em algumas situaçoes, após, no mínimo, 6 a 8 semanas de uso de dietas à base de proteína extensamente hidrolisada ou à base de aminoácidos211,212.
Por apresentarem eficácia em 90% dos casos, as dietas à base de proteína extensamente hidrolisada (hidrolisados proteicos) sao recomendadas, nas formas mediadas por IgE (lactentes menores de 6 meses) e nas formas nao mediadas por IgE, por todas essas sociedades científicas internacionais americanas e europeias, incluindo a Academia Americana de Alergia, Asma e Imunologia (AAAAI) e o Colégio Americano de Alergia, Asma e Imunologia (ACAAI)209,212,214. Apenas uma pequena proporçao de crianças, cerca de 10%, também demonstrarao alergia a tais dietas, e podem apresentar reaçoes alérgicas em resposta à presença de resíduos alergênicos215.
Nesta circunstância, deve ser destacada a importância da realizaçao do teste de provocaçao oral com finalidade diagnóstica, uma vez que, em metade dos casos que apresentam melhora, o teste de provocaçao oral é negativo216,217. Esta situaçao pode ser explicada por duas justificativas: hipótese diagnóstica de alergia alimentar estabelecida quando na realidade as manifestaçoes nao sao resultantes de alergia alimentar, ou pelo desenvolvimento precoce de tolerância oral durante o período de dieta de exclusao diagnóstica.
Alguns autores e médicos têm usado a fórmula de aminoácidos como abordagem dietética inicial de lactente com suspeita de APLV, por quatro semanas, para confirmaçao diagnóstica após TPO218,219, apresentando-se como estratégia diagnóstica custo-efetiva, de menor custo e menos dias com sintomas218.
Para finalizar, deve ser destacada, a importância do teste de provocaçao oral ser realizado obrigatoriamente após a recuperaçao proporcionada pela dieta de exclusao para comprovaçao do diagnóstico. Com certeza, uma parcela expressiva dos lactentes com suspeita de alergia ao leite de vaca será liberada da dieta de exclusao, uma vez que, o diagnóstico de alergia alimentar será descartado. Entretanto, vale ressaltar que trata-se de procedimento complexo, que exige incentivo à padronizaçao nos serviços de saúde, além de estrutura mínima, alocaçao e treinamento das equipes nele envolvidas.
Crianças com persistência dos sintomas em uso de dieta extensamente hidrolisada (alergia ao hidrolisado proteico) ou síndrome de má absorçao grave com intenso comprometimento da condiçao nutricional (escore Z de peso para a estatura inferior a 2 desvios-padrao) sao consideradas prioritárias para o uso das fórmulas à base de aminoácidos209,214,220. Pacientes com dermatite atópica moderada-grave associada à alergia alimentar também constituem indicaçao para fórmula de aminoácidos. Após a recuperaçao do quadro e da funçao intestinal, poder-se-á cogitar a possibilidade de substituiçao pelas fórmulas extensivamente hidrolisadas212.
A Tabela 9 reúne as indicaçoes de fórmulas substitutas do leite de vaca, segundo a apresentaçao clínica30.
A introduçao dos alimentos complementares para a criança com APLV deve ser parcimoniosa, com período de observaçao mínimo de uma semana após a introduçao de cada alimento, especialmente aqueles contendo proteínas, e seguir a preconizaçao proposta pela Sociedade Brasileira de Pediatria para crianças saudáveis, evitando-se restriçoes desnecessárias que podem comprometer o estado nutricional221-223.
Nas Tabelas 10 a 20 sao apresentados os principais produtos disponíveis para a alimentaçao de crianças com alergia alimentar, sobretudo ao leite de vaca (informaçoes fornecidas pelos fabricantes). A Tabela 10 reúne as fórmulas infantis à base de aminoácidos para lactentes, a Tabela 11 os alimentos à base de aminoácidos para crianças de até 10 anos, e na Tabela 12 a mistura à base de aminoácidos para o preparo de mingau a partir do 6° mês de vida. O alimento à base de aminoácidos para crianças com até 10 anos (Tabela 11) corresponde a um alimento substituto do leite adequado para a faixa etária. Pode ser consumido de modo exclusivo (quando necessário), ou complementar à alimentaçao. A mistura para preparo de mingau, indicada a partir dos 6 meses (Tabela 12) corresponde a um suplemento, com sabor neutro. Este pode ser útil quando há a necessidade de consistência espessada da dieta, especialmente na fase de início da introduçao alimentar, a fim de incentivar a mastigaçao e desenvolvimento do sistema motor. Entretanto, deve-se atentar para a importância da orientaçao nutricional adequada, garantindo a oferta de alimentos em consistência, quantidade e variedade, com o objetivo de promover uma boa evoluçao nutricional. Ressalta-se, ainda, que a mistura para o preparo de mingau contém amido de arroz, o que contraindica sua utilizaçao em pacientes com alergia a este alimento.
A Tabela 13 reúne fórmulas extensamente hidrolisadas para lactentes, e a Tabela 14 as fórmulas infantis para lactentes e fórmulas de seguimento para lactentes e/ou crianças de primeira infância à base de proteína hidrolisada de arroz.
Na Tabela 15 estao as fórmulas infantis para lactentes e de seguimento à base de soja; na Tabela 16 os pós para preparo de bebida de soja; na Tabela 17 os iogurtes à base de soja (composiçao para 110 mL); na Tabela 18 as bebidas à base de soja (composiçao para 100 mL); na Tabela 19 os alimentos à base de soja enriquecidos com cálcio (composiçao para 100 mL). Deve-se ressaltar que os produtos das Tabelas 16 a 19 nao sao nutricionalmente completos, deve-se estar atento ao excesso de proteína e carboidratos para orientaçao nutricional adequada para a idade. Na Tabela 20 temos alimento para situaçoes metabólicas especiais para nutriçao enteral/ oral para crianças de 3 a 10 anos e corresponde a um suplemento. Os suplementos (Tabelas 12 e 20) nao se enquadram na categoria de fórmulas infantis e, portanto, nao devem ser utilizados de forma exclusiva. Sao alternativas para situaçoes como alergia alimentar múltipla, seletividade alimentar, dificuldade do consumo alimentar adequado de calorias, macro e micronutrientes e desaceleraçao do ganho de peso. Entretanto, deve-se atentar para a importância da orientaçao nutricional adequada e, por ter amido de arroz pré-gelatinizado na sua composiçao, é contraindicado para paciente com alergia a este alimento.
O fluxograma representado na Figura 2 resume a orientaçao proposta pela Sociedade Brasileira de Pediatria e Associaçao Brasileira de Alergia e Imunologia para crianças menores de dois anos, com suspeita de alergia a proteína do leite de vaca nas formas IgE e nao IgE mediadas.
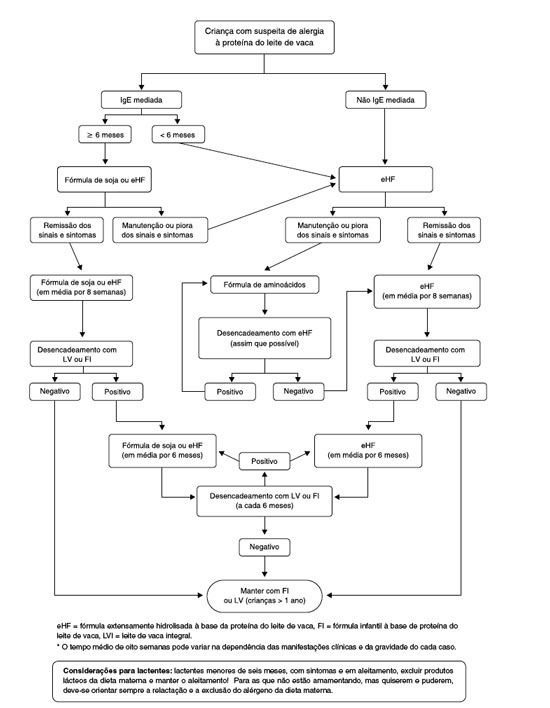
Figura 2 Fluxograma para abordagem de crianças menores de dois anos e com suspeita de alergia às proteínas do leite de vaca
Duraçao da dieta e reintroduçao alimentar
O tempo de duraçao da dieta de exclusao tem como variáveis a idade do paciente ao iniciar o tratamento e sua adesao a esse, os mecanismos envolvidos, as manifestaçoes apresentadas e o histórico familiar para alergia. Admite-se que a maioria das crianças desenvolverá tolerância clínica nos primeiros três anos, embora este percentual possa ser variável224. Para a alergia ao leite de vaca, preconiza-se que a dieta de exclusao seja, no mínimo, de seis a doze meses. Crianças com colite alérgica, diagnosticada antes dos seis meses de idade, podem vir a tolerar a reintroduçao do alimento seis a oito meses após a dieta de exclusao. Entretanto, esse prazo pode ser ampliado, pois cada paciente deve ser avaliado periodicamente de forma individualizada.
Recomenda-se postergar a exposiçao ao alimento, quando as reaçoes envolvidas sao mediadas por IgE. A tolerância clínica ocorre para a maioria dos alimentos, exceto para o amendoim, nozes e frutos do mar, que geralmente persistem durante toda a vida do indivíduo220,225.
As maiores dificuldades na execuçao da dieta sao a exclusao completa do(s) antígeno(s), já comentadas no início deste tópico, além de prover uma dieta adequada que permita o crescimento e o desenvolvimento satisfatórios222. Alguns estudos demonstram o risco de se ofertar uma dieta que pode comprometer o estado nutricional e causar carências nutricionais específicas, tais como menor ingestao de calorias, proteínas, lipídios, cálcio, fósforo, vitamina D e outros micronutrientes, assim como seu impacto sobre a neofobia alimentar223-226. Tais distúrbios nutricionais refletem um manejo nutricional inadequado, por vezes pela falta de equipe multiprofissional envolvida no atendimento, dificuldades relacionadas à dinâmica familiar, falta de acesso às fórmulas, ou pelo contexto social122,209,227.
É importante para os pacientes e familiares encontrarem um equilíbrio entre a vigilância adequada e a sobrecarga sobre a rotina diária pelos cuidados com a dieta de exclusao. Embora estratégias para minimizar a probabilidade de ingestao acidental de alérgenos devam ser realizadas, cuidados excessivamente cautelosos podem criar um fardo desnecessário para as famílias. É papel do profissional de saúde apoiar os pacientes e familiares para aprender a lidar com a percepçao de risco associada à alergia alimentar, com o objetivo de procurar manter uma vida mais próxima do normal possível, e de prevenir consequências negativas em longo prazo, como, por exemplo, alteraçoes na percepçao da imagem corporal, transtornos alimentares e dificuldades nos relacionamentos interpessoais na vida futura228-230.
Com respeito à introduçao de produtos "baked" (termicamente tratados), que ocorre especialmente na dieta de exclusao para o tratamento de crianças com alergia IgE mediada a leite de vaca ou ovo, é necessário, além da correta aplicaçao do protocolo, uma atençao especial aos hábitos de alimentaçao saudável. De acordo com o Guia Alimentar para a Populaçao Brasileira, recomenda-se evitar o consumo de alimentos ultraprocessados (por exemplo, biscoito, bolos e paes industrializados) e preferir as preparaçoes caseiras231. Também vale ressaltar a preocupaçao com a variedade da alimentaçao e o prazer em se alimentar. Neste contexto, a estratégia deve ser individualizada, considerando-se a real melhora na qualidade de vida do paciente e familiares, e o impacto na promoçao da alimentaçao saudável visando a prevençao futura de doenças crônicas. Quando for adotada, é interessante fornecer orientaçoes de preparaçoes caseiras e variadas, ou orientar adaptaçoes de receitas da família e avaliar a aceitaçao desta proposta pelo paciente232.
PREVENÇAO DA ALERGIA ALIMENTAR
O papel da prevençao primária da doença alérgica tem sido debatido nas últimas décadas, e nao há dúvida que seja muito importante. Conforme descrito anteriormente, os fatores de risco associados ao desenvolvimento das alergias sao vastos, compreendem fatores genéticos e ambientais. No entanto, poucas sao as evidências a respeito de intervençoes que possam minimizar o aparecimento das doenças alérgicas185,233. A única medida que pode, de fato, diminuir esta chance é a amamentaçao exclusiva com leite materno até os seis meses.
Restriçoes alimentares impostas à gestante devem ser desencorajadas. A eliminaçao empírica de potenciais alérgenos alimentares foi associada à perda ponderal pelo feto, e nao apresentou papel preventivo no aparecimento de dermatite atópica aos 18 meses, ou na sensibilizaçao a alérgenos alimentares no primeiro, segundo ou sétimo anos de vida234.
É consenso que o aleitamento materno exclusivo deva ser mantido até o sexto mês de vida. A exclusao de determinado alimento da dieta da nutriz deve ser considerada apenas se houver manifestaçao de sintomas pelo lactente em aleitamento natural.
O adiamento na introduçao do leite de vaca e dos alimentos sólidos também nao está relacionado à diminuiçao no risco de desenvolvimento de alergias alimentares. Crianças que evitaram leite de vaca até o primeiro ano de vida, ovo até os 2 anos e amendoim até os 3 anos nao apresentaram menor índice de sensibilizaçao a alimentos, em comparaçao com crianças sem restriçoes235.
Nowak-Węgrzyn & Chatchatee, em estudo recente, revisaram os principais estudos clínicos que avaliaram o momento ideal para a introduçao de alguns alimentos potencialmente mais alergênicos236. As populaçoes estudadas sao heterogêneas em relaçao aos fatores de risco, e o desfecho é variável. Exceto pelo estudo LEAP, que encontrou menor taxa de alergia ao amendoim nas crianças que foram expostas precocemente, nenhum outro estudo justificou a demora na introduçao de outros alimentos, como leite e ovo235.
O papel das fórmulas hidrolisadas na prevençao de doenças atópicas vem sendo objeto de estudo nas últimas décadas. Metanálise recente avaliou 37 estudos clínicos com mais de 19.000 participantes, e comprovou que conflitos de interesses ou vieses nos desenhos dos estudos comprometem as evidências de que as fórmulas hidrolisadas poderiam reduzir a incidência de doenças alérgicas237. A revisao conclui por nao haver evidências consistentes de que as fórmulas hidrolisadas (parcialmente ou extensamente) poderiam funcionar como medidas preventivas no desenvolvimento de doenças alérgicas237.
Entre os mais de 100 estudos publicados sobre o assunto, apenas 14 eram randômicos e incluíram lactentes nascidos a termo, e nestes foi comparado o uso conjunto dessas fórmulas com o aleitamento materno ou com as fórmulas poliméricas infantis. Nao houve evidência de que as fórmulas hidrolisadas poderiam ser mais benéficas do que o leite materno. Nos estudos com lactentes de alto risco para doenças alérgicas que nao puderam receber amamentaçao exclusiva por quatro a seis meses de vida houve apenas discreta evidência de que a dermatite atópica poderia ser retardada ou prevenida pelo uso de fórmulas parcial ou extensamente hidrolisadas, em comparaçao às fórmulas infantis habituais237.
As fórmulas de soja nao devem ser recomendadas para a prevençao de alergias.
As evidências científicas atuais com base em estudos randômicos avaliando os benefícios da introduçao precoce de alérgenos alimentares nao suportam a modificaçao na norma vigente de início da alimentaçao complementar a partir do sexto mês de vida, sem restriçao na introduçao dos alimentos potencialmente alergênicos (p. ex. ovo, peixe e trigo), independentemente do risco familiar de atopias236.
AGRADECIMENTOS
Agradecemos às nutricionistas Renata Magalhaes Boaventura e Julia Rosental de Souza Cruz pela colaboraçao na revisao das fórmulas alimentares.
REFERENCIAS
1. Nowak-Węgrzyn A, Szajewska H, Lack G. Food allergy and the gut. Nat Rev Gastroenterol Hepatol. 2017;14:241-57.
2. Gupta M, Cox A, Nowak-Węgrzyn A, Wang J. Diagnosis of Food Allergy. Immunol Allergy Clin North Am. 2018;38(1):39-52.
3. Konikoff MR, Noel RJ, Blanchard C, Kirby C, Jameson SC, Buckmeier BK, et al. A randomized, double-blind, placebo-controlled trial of fluticasone propionate for pediatric eosinophilic esophagitis. Gastroenterology. 2006;131(5):1381-91
4. Aceves SS, Bastian JF, Newbury RO, Dohil R. Oral viscous budesonide: a potential new therapy for eosinophilic esophagitis in children. Am J Gastroenterol. 2007;102(10):2271-9.
5. Kia L, Hirano I.Distinguishing GERD from eosinophilic oesophagitis: concepts and controversies. Nat Rev Gastroenterol Hepatol. 2015;12:379-86.
6. Feuille E, Nowak-Węgrzyn A. Definition, etiology, and diagnosis of food protein enterocolitis syndrome.Curr Opin Clin Allergy Immunol. 2014;14:222-8.
7. Manti S, Leonardi S, Salpietro A, Del Campo G, Salpietro C, Cuppari C.A systematic review of food protein-induced enterocolitis syndrome from the last 40 years. Ann Allergy Asthma Immunol. 2017;118(4):411-8.
8. Lozinsky AC, Morais MB.Colite eosinofílica em lactentes.J Pediatr (Rio J). 2014;90:16-21.
9. Sampson HA. Food Allergy. Part 2: Diagnostic and management. J Allergy Clin Immunol. 1999;103:981-9.
10. Beyer K, Teuber SS.Food Allergy diagnostic:scientific and un- proven procedures. Curr Opin Allergy Clin Immunol. 2005;5:261-6.
11. Crespo JF, James JM, Rodrigues J. Diagnosis and therapy of food allergy. Mol Nutr Food Res. 2004;48:347-55.
12. Keller Franco A, Oselka Sarni R, Carvalho Mallozi M, Solé D. Body Mass Index and skin reactivity to histamine and Dermatophagoides pteronyssinus in children and adolescents followed in a pediatric allergy service. Eur Ann Allergy Clin Immunol. 2017;49(3):110-13.
13. Dreborg S, Foucard T.Allergy to apple, carrot and potato in children with birch pollen allergy. Allergy. 1983;38:167-72.
14. Hill DJ, Heine RG, Hosking CS. The diagnostic value of skin prick testing in children with food allergy. Pediatr Allergy Immunol. 2004;15:435-41.
15. Valyasevi MA, Maddox DE, Li JT.Systemic reactions to allergy skin tests. Ann Allergy Asthma Immunol. 1999;83:132-6.
16. Solé D, Silva LR, Rosário Filho NA, Sarni ROS, Pastorino AC, Jacob CMA, et al. Consenso Brasileiro sobre Alergia Alimentar: 2007 - Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associaçao Brasileira de Alergia e Imunopatologia. Rev bras alerg imunopatol. 2008;31:64-89.
17. Franco JM, Pinheiro APSG, Vieira SCF, Barreto IDC, Gurgel RQ, Cocco RR, Solé D. Acurácia de concentraçoes de IgE séricas e de diâmetros de pápulas do teste cutâneo no diagnóstico de alergia ao leite de vaca. J Pediatr (Rio J). 2017 Sep 28. pii: S00217557(17)30059-1. doi: 10.1016/j.jped.2017.06.022. [Epub ahead of print].
18. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, van Hage M, Baena-Cagnani CE, et al. A WAO - ARIA - GA²LEN consensus document on molecular-based allergy diagnostics.World Allergy Organ J. 2013;6(1):17.
19. Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, et al. EAACI Molecular Allergology User's Guide. Pediatr Allergy Immunol. 2016;27(S23):1-250.
20. Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, et al. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014;69:1008-25.
21. Mansouri M, Rafiee E, Darougar S, Mesdaghi M, Chavoshzadeh Z. Is the atopy patch test reliable in the evaluation of food allergyrelated atopic dermatitis? Int Arch Allergy Immunol. 2018 Jan 13. doi: 10.1159/000485126. [Epub ahead of print]
22. Sampson HA, Aceves S, Bock SA, James J, Jones S, Lang D, et al. Food allergy: a practice parameter update-2014. J Allergy Clin Immunol. 2014;134(5):1016-25.
23. Catherine Hammond C, Lieberman JA. Unproven diagnostic tests for food allergy. Immunol Allergy Clin N Am. 2018;38:153-63.
24. Muraro A, Lemanske RF Jr, Castells M, Torres MJ, Khan D, Simon HU, et al.Precision medicine in allergic disease-food allergy, drug allergy, and anaphylaxis-PRACTALL document of the European Academy of Allergy and Clinical Immunology and the American Academy of Allergy, Asthma and Immunology. Allergy. 2017;72(7):1006-21.
25. Santos AF, James LK, Bahnson HT, Shamji MH, Couto-Francisco NC, Islam S et al. IgG4 inhibits peanut-induced basophil and mast cell activation in peanut-tolerant children sensitized to peanut major allergens. J Allergy Clin Immunol. 2015;135(5):1249-56.
26. Ballmer-Weber BK, Beyer K. Methods in Allergy/Immunology: Food Challenges, J Allergy Clin Immunol. 2017; doi:10.1016/j. jaci.2017.06.038.
27. Nowak-Węgrzyn A, Assa'ad AH, Bahna SL, Bock SA, Sicherer SH, Teuber SS. Adverse Reactions to food Committee of American Academy of Allergy, Asthma & Immunology. Work group report: oral food challenge testing. J Allergy Clin Immunol. 2009;123(Suppl):S365-83.
28. Bindslev-Jensen C, Ballmer-Weber BK, Bengtsson U, Blanco C, Ebner C, Hourihane J, et al.Standardization of double-blind, placebocontrolled food challenges in patients with immediate reactions to foods. Allergy. 2004;59(7):690-7.
29. Niggemann B, Beyer K.Diagnosis of food allergy in children:toward a standardization of food challenge. J Pediatr Gastroenterol Nutr. 2007;45:399-404.
30. Fiocchi A, Brozek J, Schünemann H, Bahna SL, von Berg A, Beyer K, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) Guidelines. World Allergy Organ J. 2010;3(4):57-161.
31. Luyt D, Ball H, Makwana N, Green MR, Bravin K, Nasser SM, et al. BSACI guideline for the diagnosis and management of cow's milk allergy. Clin Exp Allergy. 2014;44:642-72.
32. Greenhawt M. Oral food challenges in children: review and future perspectives. Curr Allergy Asthma Rep. 2011;11:465-72.
33. Koletzko S, Niggemann B, Arato A, Dias JA, Heuschkel R, Husby S, et al. Diagnostic approach and management of cow's-milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines. J Pediatr Gastroenterol Nutr. 2012;55(2):221-9.
34. Fiocchi A, Bouygue GR, Restani P, Bonvini G, Startari R, Terracciano L. Accuracy of skin prick tests in bovine protein allergy (BPA). Ann Allergy Asthma Immunol. 2002;89:26-32.
35. Garcia-Ara C, Boyano-Martinez T, Diaz-Pena JM, Martín-Muñoz F, Reche-Frutos M, Martín-Esteban M. Specific IgE levels in the diagnosis of immediate hypersensitivity to cow's milk protein in the infant. Allergy Clin Immunol. 2001;107:185-90.
36. Celik-Bilgili S, Mehl A, Verstege A, Staden U, Nocon M, Beyer K, et al. The predictive value of specific immunoglobulin E levels in serum for the outcome of oral food challenges. Clin Exp Allergy. 2005;35:268-73.
37. Gushken AKF, Castro ABB, Pastorinho AC, Ciccione AC, Gonçalves RFF, Jacob CMA. Establishing a milk specific decision point in IgE mediated cow's milk allergy (CMA) patients from a terciary pediatric Brazilian Center. J Allergy Clin Immunol. 2006;117(44):176.
38. Rolinck-Werninghaus C, Niggemann B, Grabenhenrich L, Wahn U, Beyer K. Outcome of oral food challenges in children in relation to symptom-eliciting allergen dose and allergen-specific IgE. Allergy. 2012;67:951-7.
39. Castro AP, Pastorino AC, Gushken AKF, Kokron CM, Filho UD, Jacob CMA. Establishing a cut-off for serum levels of specific IgE to milk and its components for cow's milk allergy. Results from a specific population. Allergol Immunopathol. 2015;43(1):67-72.
40. Verstege A, Mehl A, Rolinck-Werninghaus C, Staden U, Nocon M, Beyer K, Niggemann B. The predictive value of the skin prick test weal size for the out-come of oral food challenges. Clin Exp Allergy. 2005;35:1220-6.
41. Calvani M, Alessandri C, Frediani T, Lucarelli S, Miceli Sopo S, Panetta V, et al.Correlation between skin prick test using commercial extract of cow's milk protein and fresh milk and food challenges. Pediatr Allergy Immunol. 2007;18:583-8.
42. Imai T, Yanagida N, Ogata M, Komata T, Tomikawa M, Ebisawa M.The Skin Prick Test is not useful in the diagnosis of the immediate type food allergy tolerance acquisition. Allergol Int. 2014;63:205-10.
43. Sicherer SH. Food allergy: When and how to perform oral food challenges. Pediatr Allergy Immunol. 1999;10:226-34.
44. Wuthrich B. Ambulatory oral provocation testing. Hautarzt. 1995;46:352-3.
45. Correa FF, Vieira MC, Yamamoto DR, Speridiao PGL, Morais MB. Open Challenge for diagnosis of cow's milk protein allergy.J Pediatr (Rio J.). 2010;86:163-6.
46. Mendonça RB, Franco JM, Cocco RR, Souza FIS, Oliveira LCL, Sarni ROS, et al.Open oral food challenge the confirmation of cow's milk allergy mediated by immunoglobulin E.Allergol Immunopathol. 2012;40:25-30.
47. Nowak-Węgrzyn A, Sampson HA, Wood RA, Sicherer SH. Food protein-induced enterocolitis syndrome caused by solid food proteins. Pediatrics. 2003;111:829-35.
48. Katz Y, Goldberg MR, Rajuan N, Cohen A, Leshno M.The prevalence and natural course of food protein-induced enterocolitis syndrome to cow's milk: a large-scale, prospective population based study. J Allergy Clin Immunol. 2011:127:647-53.
49. Nowak-Węgrzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary - Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017;139:1111-26.
50. Caffarelli C, Petroccione T.False-negative food challenges in children with suspected food allergy. Lancet. 2001;385:1871-2.
51. Bernstein IL, Li JT, Bernstein DI, Hamilton R, Spector SL, Tan R, et al. Allergy diagnostic testing: an updated practice parameter. Ann Allergy Asthma Immunol. 2008;100(3 suppl. 3):S1-148.
52. Vlieg-Boerstra BJ, Bijleveld CM, van der Heide S, Beusekamp BJ, Wolt- Plompen SA, Kukler J, et al. Development and validation of challenge materials for double-blind, placebo-controlled food challenges in children. J Allergy Clin Immunol. 2004;113:341-6.
53. Thomas K, Herouet-Guicheney C, Ladics G, Bannon G, Cockburn A, Crevel R, et al. Evaluating the effect of food processing on the potential human allergenicity of novel proteins: international workshop report. Food Chem Toxicol. 2007;45:1116-22.
54. Nowak-Węgrzyn A, Bloom KA, Sicherer SH, Shrefer WG, Noone S, Wanich N, et al.Tolerance to extensively heated milk in children with cow's milk allergy, J Allergy Clin Immunol. 2008;122:342-7.
55. Kim J, Kim H, Park M, Choi J, Shim J, Kim M, et al. Diagnostic Decision points of specific IgE concentrations in korean children with egg and cow's milk allergies. Allergy Asthma Immunol Res. 2015;7(4):332-8.
56. Lemon-Mulé H, Sampson HA, Sicherer SH, Shref er WG, Noone S, Nowak-Węgrzyn A. Imunologic changes in children with egg allergy ingesting extensively heated egg. J Allergy Clin Immunol. 2008;122:977-83.
57. Teuber SS. Hypothesis: the protein body effect and other aspects of food matrix effects. Ann N Y Acad Sci. 2002;964:111-6.
58. Mofidi S, Bock SA (eds). A health professional's guide to food challenges. Fairfax (VA): Food Allergy and Anaphylaxis Network; 2005.
59. Scurlock AM, Vickery BP, Hourihane JO, Burks AW. Pediatric food allergy and mucosal tolerance. Mucosal Immunol. 2010;3:345-54.
60. Niggemann B. When is an oral food challenge positive? Allergy. 2010;65:2-6.
61. Bahna SL.Unusual presentations of food allergy.Ann Allergy Asthma Immunol. 2001;86(4):414-20.
62. Bock SA, Sampson HA, Atkins FM, Zeiger RS, Lehrer S, Sachs M, et al. Double-blind placebo-controlled food challenge (DBPCFC) as an office procedure: A manual. J Allergy Clin Immunol. 1988;82:986-97.
63. Kneepkens CMF, Meijer Y.Clinical practice.Diagnosis and treatment of cow's Milk allergy. Eur J Pediatr. 2009;168:891-6.
64. Nowak-Węgrzyn A, Bloom KA, Sicherer SH, Shrefer WG, Noone S, Wanich N, et al.Tolerance to extensively heated milk in children with cow's milk allergy, J Allergy Clin Immunol. 2008;122:342-7.
65. Kim J, Kim H, Park M, Choi J, Shim J, Kim M, et al. Diagnostic Decision points of specific IgE concentrations in korean children with egg and cow's milk allergies. Allergy Asthma Immunol Res. 2015;7(4):332-8.
66. Solé D, Amancio OMS, Jacob CMA, Cocco RR, Sarni ROS, Suano F, et al. Guia prático de diagnóstico e tratamento da Alergia às Proteínas do Leite de Vaca mediada pela imunoglobulina E. Rev bras alerg imunopatol. 2012;35:213-33.
67. Cianferoni A, Garrett JP, Naimi DR, Khullar K, Spergel JM.Predictive values for food challenge-induced severe reactions: development of a simple food challenge score. Isr Med Assoc J. 2012;14:24-8.
68. Gushken AK, Castro AP, Yonamine GH, Corradi GA, Pastorino AC, Jacob CM. Double-blind, placebo-controlled food challenges in Brazilian children: adaptation to clinical practice. Allergol Immunopathol. 2013;41(2):94-101.
69. Be er OF, Sancak S, Erkan T, Kutlu T, Coku ra H, Coku ra FÇ. Can fecal calprotectin level be used as a markers of inflammation in the diagnosis and follow-up of cow's milk protein allergy? Allergy Asthma Immunol Res. 2014;6(1):33-8.
70. Merras-Salmio L, Kolho KL, Pelkonen AS, Kuitunen M, Mäkelä MJ, Savilahti E. Markers of gut mucosal inflammation and cow's milk specific immunoglobulins in non-IgE cow's milk allergy. Clin Transl Allergy. 2014;4(1):8.
71. González A, Vera Medialdea R, Ramón Salguero JM. [Faecal calprotectin as an aid to the diagnosis of non-IgE mediated cow's milk protein allergy. An Pediatr (Barc). 2016;84(6):318-23.
72. Borrelli O, Mancini V, Thapar N, Giorgio V, Elawad M, Hill S, et al. Cow's milk challenge increases weakly acidic reflux in children with cow's milk allergy and gastroesophageal reflux disease. J Pediatr. 2012;161(3):476-481.e1
73. Kia L, Hirano I.Distinguishing GERD from eosinophilic oesophagitis: concepts and controversies. Nat Rev Gastroenterol Hepatol. 2015;12:379-86.
74. Sampson HA, Furlong AM, Campbell RL, Adkinson NF, Bock SA, Branum A, et al. Symposium of the definition and management of anaphylaxis: summary report. J Allergy Clin Immunol. 2005;115:584-91.
75. Lockey RF, Kemp SF, Lieberman PL, Sheikh A. Anaphylaxis. in: Pawankar R, Canonica GW, Holgate S, Lockey R, Blaiss M (eds). World Allergy Organization (WAO) White Book on Allergy. Update 2013. WAO; 2013:48-53.
76. Parlaman JP, Oron AP, Uspal NG, De Jong KN, Tieder JS. Emergency and Hospital Care for Food-Related Anaphylaxis in Children. Hosp Pediatr. 2016;6(5):269-74.
77. Panesar SS, Javad S, de Silva D, Nwaru BI, Hickstein L, Muraro A, et al. The epidemiology of anaphylaxis in Europe: a systematic review. Allergy. 2013;68(11):1353-61.
78. Grabenhenrich LB, Dölle S, Moneret-Vautrin A, Köhli A, Lange L, Spindler T, et al. Anaphylaxis in children and adolescents: The European Anaphylaxis Registry. J Allergy Clin Immunol. 2016;137(4):1128-37.
79. Motosue MS, Bellolio MF, Van Houten HK, Shah ND, Bellamkonda VR, Nestler DM, et al.Temporal Trends in Epinephrine Dispensing and Allergy/Immunology Follow-up Among Emergency Department Anaphylaxis Patients in the United States, 2005-2014.J Allergy Clin Immunol Pract. 2017;26. pii: S2213-2198(17)30474-9.
80. Simons FE, Ebisawa M, Sanchez-Borges M, Thong BY, Worm M, Tanno LK, et al. 2015 update of the evidence base: World Allergy Organization anaphylaxis guidelines. World Allergy Organ J. 2015;8(1):32.
81. Simons FER, Ardusso LR, Bilò MB, El-Gamal YM, Ledford DK, Ring J, et al. World allergy organization guidelines for the assessment and management of anaphylaxis.World Allergy Organ J. 2011;4(2):13-37.
82. Muraro A, Roberts G, Worm M, Bilò MB, Brockow K, Fernández Rivas M, et al.Anaphylaxis:guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014;69(8):1026-45.
83. Sicherer SH, Simons FER; Section on Allergy and Immunology. Epinephrine for first-aid management of anaphylaxis. Pediatrics 2017;139(3). pii: e20164006.
84. Goldberg MR, Nachshon L, Appel MY, Elizur A, Levy MB, Eisenberg E, et al. Efficacy of baked milk oral immunotherapy in baked milk-reactive allergic patients. J Allergy Clin Immunol. 2015;136(6):1601-6.
85. Leonard SA. Baked Egg and Milk Exposure as Immunotherapy in Food Allergy. Curr Allergy Asthma Rep. 2016;16(4):32.
86. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: updated consensus recommendations forchildren and adults.J Allergy Clin Immunol. 2011;128:3-20.e6.
87. Ruffner MA, Spergel JM. Eosinophilic Esophagitis in Children. Curr Allergy Asthma Rep. 2017;17(8):54.
88. Lucendo AJ, Molina-Infante J, Arias A, von Arnim U, Bredenoord AJ, Bussmann C, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5(3):335-58.
89. Keet CA, Wood RA. Emerging therapies for food allergy. J Clin Invest. 2014;124:1880-6.
90. Ebisawa M, Ito K, Fujisawa T; Committee for Japanese Pediatric Guideline for Food Allergy, The Japanese Society of Pediatric Allergy and Clinical Immunology, et al. Japanese guidelines for food allergy 2017. Allergol Int. 2017;66:248-64.
91. de Kivit S, Tobin MC, De Meo MT, Fox S, GarsenJ, Forsyth CB, et al. In vitro evaluation of intestinal TLR activation in preventing food allergic responses. Clin Immunol. 2014;154:91-9.
92. Cuello-Garcia CA, Brozek JL, Fiocchi A, Pawankar R, Yepes-Nuñez JJ, Terracciano L, et al. Probiotics for the prevention of allergy: a systematic review and meta-analysis of randomized clinical trials. J Allergy Clin Immunol. 2015;136:952-61.
93. Zhang GQ, Hu HJ, Liu CY, Zhang Q, Shakya S, Li ZY. Probiotics for Prevention of atopy and food hypersensitivity in early childhood: a PRISMA-compliant systematic review and metaanalysis of randomized controlled trials. Medicine (Baltimore). 2016;95:e2562.
94. Berni Canani R, Sangwan N, Stefka AT, Nocerino R, Paparo I, Aitoro R, et al. Lactobacillus rhamnosus GG-supplemented formula expands butyrate-producing bacterial strains in food allergic infants. ISME J. 2016;10:742-50.
95. Osborn DA, Sinn JK.Prebiotics in infants for prevention of allergy. Cochrane Database Syst Ver 2013; CD006474.
96. Elazab N, Mendy A, Gasana J, Vieira ER, Quizon A, Forno E. Probiotic administration in early life, atopy, and asthma: a metaanalysis of clinical trials. Pediatrics. 2013;132:666-76.
97. Canani RB, Nocerino R, Terrin G, Coruzzo A, Cosenza L, Leone L, et al. Effect of Lactobacillus GG on tolerance acquisition in infants with cow's milk allergy: a randomized trial. J Allergy Clin Immunol. 2012;129:580-2.
98. Canani RB, Nocerino R, Terrin G, Frediani T, Lucarelli S, Cosenza L, et al. Formula selection for management of children with cow's milk allergy influences the rate of acquisition of tolerance: a prospective multicenter study. J Pediatr. 2013;163:771-7.
99. Hol J, van Leer EH, Elink Schuurman BE, de Ruiter LF, Samsom JN, Hop W, et al. The acquisition of tolerance toward cow's milk through probiotic supplementation:a randomized, controlled trial. J Allergy Clin Immunol. 2008;121:1448-54.
100. de Silva D, Geromi M, Panesar SS, Muraro A, Werfel T, Hoffmann-Sommergruber K, et al.Acute and long-term management of food allergy: systematic review. Allergy. 2014;69:159-67.
101. Agostoni C, Axelsson I, Goulet O, Koletzko B, Michaelsen KF, Puntis JW, et al.Prebiotic oligosaccharides in dietetic products for infants:a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2004;39:465-73.
102. Boyce JA, Assa'ad A, Burks AW, Jones SM, Sampson HA, Wood RA, et al. Guidelines for the diagnosis and management of food allergy in the United States:report of the NIAID-sponsored expert panel. J Allergy Clin Immunol. 2010;126:S1-S58.
103. Cuello-Garcia CA, Fiocchi A, Pawankar R, Yepes-Nuñez JJ, Morgano GP, Zhang Y, et al.World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Prebiotics. WAO J. 2016;9:10.
104. Vickery BP, Scurlock AM, Kulis M, Steele PH, Kamilaris J, Berglund JP, et al. Sustained unresponsiveness to peanut in subjects who have completed peanut oral immunotherapy.J Allergy Clin Immunol. 2014;133:468-75.
105. Sampson HA. Peanut oral immunotherapy: is it ready for clinical practice? J Allergy Clin Immunol Pract. 2013;1:15-21.
106. Keet CA, Seopaul S, Knorr S, Narisety S, Skripak J, Wood RA. Long-term follow-up of oral immunotherapy for cow's milk allergy. J Allergy Clin Immunol. 2013;132:737-9.
107. Cavkaytar O, Akdis CA, Akdis M.Modulation of immune responses by immunotherapy in allergic diseases. Curr Opin Pharmacol. 2014;30-7.
108. Anagnostou K, Islam S, King Y, Foley L, Pasea L, Bond S, et al. Assessing the efficacy of oral immunotherapy for the desensitization of peanut allergy in children (STOP II): a phase 2 randomized controlled trial. Lancet. 2014;383:1297-304.
109. Bauer RN, Manohar M, Singh AM, Jay DC, Nadeau KC.The future of biologics: Applications for food allergy. J Allergy Clin Immunol. 2015;135:312-23.
110. Pajno GB, Fernandez-Rivas M, Arasi S, Roberts G, Akdis CA, Alvaro-Lozano M, et al. EAACI Guidelines on allergen immunotherapy: IgE-mediated food allergy. Allergy. 2017 Sep 27. doi: 10.1111/all.13319. [Epub ahead of print]
111. Staden U, Rolinck-Werninghaus C, Brewe F, Wahn U, Niggemann B, Beyer K. Specific oral tolerance induction in food allergy in children: efficacy and clinical patterns of reaction. Allergy. 2007;62:1261-9.
112. Burks AW, Jones SM, Wood RA, Fleischer DM, Sicherer SH, Lindblad RW, et al. Oral immunotherapy for treatment of egg allergy in children. N Engl J Med. 2012;367:233-43.
113. Caminiti L, Pajno GB, Crisafulli G, Chiera F, Collura M, Panasci G, et al. Oral immunotherapy for egg allergy: a double-blind placebo-controlled study, with post desensitization follow-up. J Allergy Clin Immunol Pract. 2015;3:532-9.
114. Vickery BP, Pons L, Kulis M, Steele P, Jones SM, Burks AW. Individualized IgE-based dosing of egg oral immunotherapy and the development of tolerance. Ann Allergy Asthma Immunol. 2010;105:444-50.
115. Meglio P, Giampietro PG, Carello R, Gabriele I, Avitabile S, Galli E. Oral food desensitization in children with IgE-mediated hen's egg allergy: a new protocol with raw hen's egg. Pediatr Allergy Immunol. 2013;24:75-83.
116. Garcia Rodriguez R, Urra JM, Feo-Brito F, Galindo PA, Borja J, Gomez E, et al. Oral rush desensitization to egg: efficacy and safety. Clin Exp Allergy. 2011;41:1289-96.
117. Suárez-Fueyo A, Ramos T, Galán A, Jimeno L, Wurtzen PA, Marin A, et al.Grass tablet sublingual immunotherapy downregulates the TH2 cytokine response followed by regulatory T-cell generation. J Allergy Clin Immunol. 2014;133:130-8.
118. Patriarca G, Schiavino D, Nucera E, Schinco G, Milani A, Gasbarrini GB. Food allergy in children: results of a standardized protocol for oral desensitization. Hepatogastroenterology. 1998;45:52-8.
119. Martorell A, Felix-Toledo R, Cerda-Mir JC, Martorell-Calatayud A. Oral rush desensitization to cow milk. Following of desensitized patients during three years. Allergol Immunopathol (Madr). 2007;35:174-6.
120. Meglio P, Bartone E, Plantamura M, Arabito E, Giampietro PG. A protocol for oral desensitization in children with IgE-mediated cow's milk allergy. Allergy. 2004;59:980-7.
121. Patriarca G, Nucera E, Pollastrini E, Roncallo C, De Pasquale T, Lombardo C, et al. Oral specific desensitization in food-allergic children. Dig Dis Sci. 2007;52:1662-72.
122. Zapatero L, Alonso E, Fuentes V, Martinez MI. Oral desensitization in children with cow's milk allergy. J Investig Allergol Clin Immunol. 2008;18:389-96.
123. Longo G, Barbi E, Berti I, Meneghetti R, Pittalis A, Ronfani L, et al. Specific oral tolerance induction in children with very severe cow's milk induced reactions. J Allergy Clin Immunol. 2008;121:343-7.
124. Martorell A, de la Hoz B, Ibanez MD, Bone J, Terrados MS, Michavila A, et al. Oral desensitization as a useful treatment in 2-year-old children with cow's milk allergy. Clin Exp Allergy. 2011;41:1297-304.
125. Salmivesi S, Korppi M, Makela MJ, Paassilta M. Milk oral immunotherapy is effective in school-aged children. Acta Paediatr. 2013;102:172-6.
126. Skripak JM, Nash SD, Rowley H, Brereton NH, Oh S, Hamilton RG, et al. A randomized, double-blind, placebo controlled study of milk oral immunotherapy for cow's milk allergy. J Allergy Clin Immunol. 2008;122:1154-60.
127. Rolinck-Werninghaus C, Staden U, Mehl A, Hamelmann E, Beyer K, Niggemann B. Specific oral tolerance induction with food in children: transient or persistent effect on food allergy? Allergy. 2005;60:1320-2.
128. Brozek JL, Terracciano L, Hsu J, Kreis J, Compalati E, Santesso N, et al. Oral immunotherapy for IgE-mediated cow's milk allergy: a systematic review and meta-analysis. Clin Exp Allergy. 2012;42:363-74.
129. Caminiti L, Passalacqua G, Vita D, Ruggeri P, Barberio G, Pajno GB. Food-exercise-induced anaphylaxis in a boy successfully desensitized to cow milk. Allergy. 2007;62:335-6.
130. Anagnostou K, Clark A, King Y, Islam S, Deighton J, Ewan P. Efficacy and safety of high-dose peanut oral immunotherapy with factors predicting outcome. Clin Exp Allergy. 2011;41:1273-81.
131. Fisher HR, Du Toit G, Lack G. Specific oral tolerance induction in food allergic children: is oral desensitization more effective than allergen avoidance? A meta-analysis of published RCTs. Arch Dis Child. 2011;96:259-64.
132. Jones SM, Pons L, Roberts JL, Scurlock AM, Perry TT, Kulis M, et al. Clinical efficacy and immune regulation with peanut oral immunotherapy. J Allergy Clin Immunol. 2009;124:292-300.
133. Narisety SD, Frischmeyer-Guerrerio PA, Keet CA, Gorelik M, Schroeder J, Hamilton RG, et al. A randomized, doubleblind, placebo-controlled pilot study of sublingual versus oral immunotherapy for the treatment of peanut allergy. J Allergy Clin Immunol. 2015;135:1275-82.
134. Sato S, Utsunomiya T, Imai T, Yanagida N, Asaumi T, Ogura K, et al. Wheat oral immunotherapy for wheat-induced anaphylaxis. J Allergy Clin Immunol. 2015;136:1131-3.
135. Gorelik M, Narisety SD, Guerrerio AL, Chichester KL, Keet CA, Bieneman AP, et al. Suppression of the immunologic response to peanut during immunotherapy is often transient. J Allergy Clin Immunol. 2015;135:1283-92.
136. Calvani M, Giorgio V, MiceliSopo S. Specific oral tolerance induction for food. A systematic review. Eur Ann Allergy Clin Immunol. 2010;42:11-9.
137. Chafen JJ, Newberry SJ, Riedl MA, Bravata DM, Maglione M, Suttorp MJ, et al. Diagnosing and managing common food allergies: a systematic review. JAMA. 2010;303(18):1848-56.
138. Chinthrajah RS, Hernandez JD, Boyd SD, Galli SJ, Nadeau KC. Molecular and cellular mechanisms of food allergy and food tolerance. J Allergy Clin Immunol. 2016;137:984-97.
139. Morisset M, Moneret-Vautrin DA, Guenard L, Cuny JM, Frentz P, Hatahet R et al. Oral desensitization in children with milk and egg allergies obtains recovery in a significant proportion of cases. A randomized study in 60 children with cow's milk allergy and 90 children with egg allergy. Eur Ann Allergy Clin Immunol. 2007;39:12-19.
140. Keet CA, Frischmeyer-Guerrerio PA, Thyagarajan A, Schroeder JT, Hamilton RG, Boden S et al. The safety and efficacy of sublingual and oral immunotherapy for milk allergy. J Allergy Clin Immunol. 2012;129:448-55.
141. Pajno GB, Caminiti L, Ruggeri P, De Luca R, Vita D, La Rosa M, et al. Oral immunotherapy for cow's milk allergy with a weekly up-dosing regimen: a randomized single-blind controlled study. Ann Allergy Asthma Immunol. 2010;105:376-81.
142. Kim JS, Nowak-Węgrzyn A, Sicherer SH, Noone S, Moshier EL, Sampson HA. Dietary baked milk accelerates the resolution of cow's milk allergy in children. J Allergy Clin Immunol. 2011;128:125-31.
143. Bégin P, Chinthrajah RS, Nadeau KC. Oral immunotherapy for the treatment of food allergy. Hum Vaccin Immunother. 2014;10:2295-302.
144. Wood RA. Food allergen immunotherapy: Current status and prospects for the future. J Allergy Clin Immunol. 2016;137:973-82.
145. Dupont C, Kalach N, Soulaines P, Legoué-Morillon S, Piloquet H, Benhamou P-H. Cow's milk epicutaneous immunotherapy in children: a pilot trial of safety, acceptability, and impact on allergic reactivity. J Allergy Clin Immunol. 2010;125:1165-7.
146. De Boissieu D, Dupont C. Sublingual immunotherapy for cow's milk protein allergy: a preliminary report. Allergy. 2006;61:1238-9.
147. Kim EH, Bird JA, Kulis M, Laubach S, Pons L, Shreffler W, et al. Sublingual immunotherapy for peanut allergy: clinical and immunologic evidence of desensitization. J Allergy Clin Immunol. 2011;127:640-6.
148. Lucendo AJ, Arias A, Tenias JM. Relation between eosinophilic esophagitis and oral immunotherapy for food allergy: a systematic review with meta-analysis. Ann Allergy Asthma Immunol. 2014;113(6):624-9.
149. Blanchard C, Simon D, Schoepfer A, Straumann A, Simon HU, et al. Changes in antigen-specific T-cell number and function during oral desensitization in cow's milk allergy enabled with omalizumab. Mucosal Immunol. 2012;5:267-76.
150. Sampson HA, Leung DY, Burks AW, Lack G, Bahna SL, Jones SM, et al. A phase II, randomized, double-blind, parallel group, placebo-controlled oral food challenge trial of Xolair (omalizumab) in peanut allergy. J Allergy Clin Immunol. 2011;127:1309-10.
151. Sampson HA, Leung DY, LeBovidge J, Blood E, Mittal M, Umetsu DT. A pilot study of omalizumab to facilitate rapid oral desensitization in high-risk peanut-allergic patients. J Allergy Clin Immunol. 2013;132:1368-74.
152. Burks AW, Sampson HA, Plaut M, Lack G, Akdis CA. Treatment for food allergy. J Allergy Clin Immunol. 2018;141:1-9.
153. Wood RA, Kim JS, Lindblad R, Nadeau K, Henning AK, Dawson P, et al. A randomized, double-blind, placebo controlled study of omalizumab combined with oral immunotherapy for the treatment of cow's milk allergy. J Allergy Clin Immunol. 2016;137:1103-10.
154. McGinnitie AJ, Rachid R, Gragg H, Little SV, Lakin P, Cianferoni A, et al. Omalizumab facilitates rapid oral desensitization for peanut allergy. J Allergy Clin Immunol. 2017;139:873-81.
155. Nadeau KC, Schneider LC, Hoyte L, Borras I, Umetsu DT. Rapid oral desensitization in combination with omalizumab therapy in patients with cow's milk allergy. J Allergy Clin Immunol. 2011;127:1622-4.
156. Savage JH, Courneya JP, Sterba PM, Macglashan DW, Saini SS, Wood RA. Kinetics of mast cell, basophil, and oral food challenge responses in omalizumab-treated adults with peanut allergy. J Allergy Clin Immunol. 2012;130:1123-9.
157. Dahdah L, Ceccarelli S, Amendola S, Campagnano P, Cancrini C, Mazzina O, et al. IgE immunoadsorption knocks down the risk of food-related anaphylaxis. Pediatrics. 2015;136:1617-20.
158. Chu DK, Llop-Guevara A, Walker TD, Flader K, Goncharova S, Boudreau JE, et al. IL-33, but not thymic stromal lymphopoietin or IL-25, is central to mite and peanut allergic sensitization. J Allergy Clin Immunol. 2013;131:187-200.
159. Saenz SA, Siracusa MC, Monticelli LA, Ziegler CG, Kim BS, Brestoff JR, et al. IL-25 simultaneously elicits distinct populations of innate lymphoid cells and multipotent progenitor type 2 (MPPtype2) cells. J Exp Med. 2013;210:1823-37.
160. Leyva-Castillo JM, Hener P, Michea P, Karasuyama H, Chan S, Soumelis V, et al. Skin thymic stromal lymphopoietin initiates Th2 responses through an orchestrated immune cascade. Nat Commun. 2013;4:2847.
161. Kim HY, Chang Y-J, Subramanian S, Lee H-H, Albacker LA, Matangkasombut P, et al. Innate lymphoid cells responding to IL-33 mediate airway hyperreactivity independently of adaptive immunity. J Allergy Clin Immunol. 2012;129:216-27.
162. Howell MD, Parker ML, Mustelin T, Ranade K. Past, present, and future for biologic intervention in atopic dermatitis. Allergy. 2015;70:887-96.
163. Carvalho VO, Sole D, Antunes AA, Bau AEK, Kuschnir FC, Mallozzi MC, et al. Guia Prático de atualizaçao em dermatite atópica Parte II: abordagem terapêutica. Arq Asma Alerg Imunol. 2017;1:157-82.
164. Michaud B, Aroulandom J, Baiz N, Amat F, Gouvis-Echraghi R, Candon S, et al. Casein-specific IL-4- and IL-13-secreting T cells: a tool to implement diagnosis of cow's milk allergy. Allergy. 2014;69:1473-80.
165. Sicherer SH, Wood RA, Stablein D, Burks AW, Liu AH, Jones SM, et al. Immunologic features of infants with milk or egg allergy enrolled in na observational study (Consortium of Food Allergy Research) of food allergy. J Allergy Clin Immunol. 2010;125:1077-83.
166. Zitnik SE, Rüschendorf F, Müller S, Sengler C, Lee Y-A, Griffioen RW, et al. IL13 variants are associated with total serum IgE and early sensitization to food allergens in children with atopic dermatitis. Pediatr Allergy Immunol. 2009;20:551-5.
167. Gandhi, NA, Bennett, BL, Graham, NM, Pirozzi, G, Stahl, N, and Yancopoulos, GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15:35-50.
168. Burton OT, Noval Rivas M, Zhou JS, Logsdon SL, Darling AR, Koleoglou KJ, et al. Immunoglobulin E signal inhibition during allergen ingestion leads to reversal of established food allergy and induction of regulatory T cells. Immunity. 2014;41:141-51.
169. Fiocchi A, Pecora V, Valluzzi RL, Fierro V, Mennini M. Use of biologics in severe food allergies. Curr Opin Allergy Clin Immunol. 2017;17:232-8.
170. Savage JH, Sicherer S, Wood R. The Natural History of Food Allergy. J Allergy Clin Immunol Pract. 2016;4:196-203.
171. Wood RA, Sicherer SH, Vickery BP, Jones SM, Liu AH, Fleischer DM, et al. The natural history of milk allergy in an observational cohort. J Allergy Clin Immunol. 2013;131:805-12.
172. Sicherer SH, Wood RA, Vickery BP, Jones SM, Liu AH, Fleischer DM, et al. The natural history of egg allergy in an observational cohort. J Allergy Clin Immunol. 2014;133:492-9.
173. Ford RP, Taylor B. Natural history of egg hypersensitivity. Arch Dis Child. 1982;57:649-52. 174. Spergel JM, Beausoleil JL, Pawlowski NA. Resolution of childhood peanut allergy. Ann Allergy Asthma Immunol. 2000;85:473-6.
175. Elizur A, Rajuan N, Goldberg MR, Leshno M, Cohen A, Katz Y. Natural course and risk factors for persistence of IgE-mediated cow's milk allergy. J Pediatr. 2012;161:482-7.
176. Ho MH, Wong WH, Heine RG, Hosking CS, Hill DJ, Allen KJ. Early clinical predictors of remission of peanut allergy in children. J Allergy Clin Immunol. 2008;121:731-6.
177. Yavuz ST, Buyuktiryaki B, Sahiner UM, Birben E, Tuncer A, Yakarisik S, et al. Factors that predict the clinical reactivity and tolerance in children with cow's milk allergy. Ann Allergy Asthma Immunol. 2013;110:284-9.
178. Fleischer DM, Conover-Walker MK, Matsui EC, Wood RA. The natural history of tree nut allergy. J Allergy Clin Immunol. 2005;116:1087-93.
179. Savage JH, Kaeding A, Matsui E, Wood R. The natural history of soy allergy. J Allergy Clin Immunol. 2010;125:683-6.
180. Neuman-Sunshine DL, Eckman JA, Keet CA, Matsui EC, Peng RD, Lenehan PJ, et al. The natural history of persistent peanut allergy. Ann Allergy Asthma Immunol. 2012;108:326-31.
181. Czaja-Bulsa G, Bulsa M. The natural history of IgE mediated wheat allergy in children with dominant gastrointestinal symptoms. Allergy, Asthma Clin Immunol. 2014;10:12.
182. Deschildre A, Elégbédé CF, Just J, Bruyère O, Van der Brempt X, Papadopoulos A, et al. Peanut allergic patients in the MIRABEL survey: characteristics, allergists' dietary advice and lessons from real life. Clin Exp Allergy. 2016;46:610-20.14.
183. Chapman JA, Bernstein IL, Lee RE. Food Allergy: a practice parameter. Ann Allergy Asthma Immunol. 2006;96:S1-S68.
184. Thalayasingam M, Lee BW. Fish and Shellfish Allergy. Chem Immunol Allergy. 2015;101:152-161.
185. Skripak JM, Matsui EC, Mudd K, Wood RA. The natural history of IgE-mediated cow's milk allergy. J Allergy Clin Immunol. 2007;120:1172-7.
186. Savage JH, Matsui E, Skripak JM, Wood R. The natural history of egg allergy. J Allergy Clin Immunol. 2007;120:1413-7.
187. Keet C, Matsui E, Dhillon G, Lenehan P, Paterakis M, Wood R. The natural history of wheat allergy. Ann Allergy Asthma Immunol. 2009;102:410-5.
188. Peters RL, Allen KJ, Dharmage SC, Koplin JJ, Dang T, Tilbrook KP, et al. Natural history of peanut allergy and predictors of resolution in the first 4 years of life: a population-based assessment. J Allergy Clin Immunol. 2015;135:1257-66.
189. Sicherer SH, Sampson HA. Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment. J. Allergy Clin Immunol. 2014;133:291-307.
190. Parrish CP, Kim EH, Bird JA. Interventional Therapies for the Treatment of Food Allergy. Immunol Allergy Clin North Am. 2018;38(1):77-88.
191. Luyt D, Ball H, Makwana N, Green MR, Bravin K, Nasser SM, et al. BSACI guideline for the diagnosis and management of cow's milk allergy. Clin Exp Allergy. 2014;(44):642-72.
192. Vandenplas Y, De Greef E, Hauser B. Safety and tolerance of a new extensively hydrolyzed rice protein-based formula in the management of infants with cow's milk protein allergy. Eur J Pediatr. 2014;73:1209-16.
193. Fiocchi A, Dahda L, Dupont C, Campoy C, Fierro V, Nieto A. Cow's milk allergy: towards an update of DRACMA guidelines. World Allergy Organ J. 2016;9(1):35.
194. Fiocchi A, Schunemann H, Ansotegui I, Assa'ad A, Bahna S, Canani RB, et al. The global impact of the DRACMA guidelines cow's milk allergy clinical practice. World Allergy Organ J. 2018;11(1):2.
195. Maranhao HS, Ramos MRM, Cocco RR, Gomes RC. Alergia alimentar. In: Weffort VRS, Lamounier JA (coord.). Nutriçao em pediatria: da neonatologia à adolescência. 2.ed. Barueri: Manole; 2017. p. 673-83.
196. Sampson HA, McCaskill CM. Food hypersensitivity and atopic dermatitis: evaluation of 113 patients. J Pediatr. 1985;107:669-75.
197. Bock SA, Atkins FM. Patterns of food hipersensivity during sixteen years of double-blind placebo-controlled oral food challenges. J Pediatr. 1990;117:561-7.
198. American Academy of Pediatrics. Committee on Nutrition. Hypoallergenic infant formulas. Pediatrics. 2000;106:346-9.
199. Mofidi S. Nutritional management of pediatric food hypersensitivity. Pediatrics. 2003;111:1645-53.
200. Aguiar ALA, Maranhao CM, Spinelli LC, Figueiredo RM, Maia JMC, Gomes RC, et al. Avaliaçao clínica e evolutiva de crianças em programa de atendimento ao uso de fórmulas para alergia à proteína do leite de vaca. Rev Paul Pediatr. 2013;31:152-8.
201. Kapoor G, Roberts Y, Bynoe M, Gaughan M, Habibi P, Lack G. Influence of a multidisciplinary paediatric allergy clinic on parental knowledge and rate of subsequent allergic reactions. Allergy. 2004;59:185-91.
202. National Institutes of Health. Offices of Dietary Supplements. Nutrient recommendations: Dietary Reference Intakes (DRI). Disponível em https://ods.od.nih.gov/Health_Information/ Dietary_Reference_Intakes.aspx. Acessado em: 07/2017.
203. Weber TK, Speridiao PG, Sdepanian VL, Neto UF, Morais MB. The performance of parents of children receiving cow's milk free diets at identification of commercial food products with and without cow's milk. J Pediatr (Rio J). 2007;83(5):459-64.
204. ANVISA. Perguntas e Respostas sobre Rotulagem de Alimentos Alergênicos Gerência de Avaliaçao de Risco e Eficácia para Alegaçoes Gerência Geral de Alimentos. Brasília/DF www.anvisa. gov.br Julho de 2015. Disponível em http://portal.anvisa.gov.br/ documents/33916/396679/Perguntas%2Be%2BRespostas%2 Bsobre%2BRotulagem%2Bde%2BAlerg%25C3%25AAnicos. pdf/dd699b1a-adc8-4bba-9971-7c2813b2394b. Acessado em: 08/2017.
205. ANVISA. Resoluçao ANVISA/DC Nº 26 DE 02/07/2015. Disponível em https://www.legisweb.com.br/legislacao/?id=286510. Acessado em: 08/2017.
206. Oldaeus G, Bradley CK, Bjorksten B, Kjellman NI. Allergenicity screening of "hypoallergenic" milk-based formulas. J Allergy Clin Immunol. 1992;90:133-5.
207. Host A, Koletzko B, Dreborg S, Muraro A, Wahn U, Aggett P, et al. Joint Statement of the European Society for Paediatric Allergology and Clinical Immunology (ESPACI) / Committee on Hypoallergenic Formulas and the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). Dietary products used in infants for treatment and prevention of food allergy. Arch Dis Child. 1999;81:80-4.
208. Reche M, Pascual C, Fiandor A, Polanco I, Rivero-Urgell M, Chifre R, et al. The effect of a partially hydrolysed formula based on rice protein in the treatment of infants with cows milk protein allergy. Pediatr Allergy Immunol. 2010:21:577-85.
209. Zeiger RS, Sampson HA, Bock SA, Burks AW Jr, Harden K, Noone S, et al. Soy allergy in infants and children with IgE-associated cow's milk allergy. J Pediatr. 1999;134:27-32.
210. Seidman EG, Singer S. Therapeutic modalities for cow's milk allergy. Ann Allergy Asthma Immunol. 2003;90:104-11.
211. Muraro MA. Soy and other protein sources. Pediatr Allergy Immunol. 2001;12:85-90.
212. Kemp A. Hypoallergenic formula prescribing practices in Australia. J Paediatr Child Health. 2006;42:191-5.
213. National Toxicology Program of US Department of Health and Human Services. NTP-CERHR Monograph on soy infant formula. Disponível em https://ntp.niehs.nih.gov/ntp/ohat/genisteinsoy/ soyformula/soymonograph2010_508.pdf. Acessado em: 08/2017.
214. Kelso JM, Sampson HA. Food protein-induced enterocolitis to casein hydrolysate formulas. J Allergy Clin Immunol. 1993;92:909-10.
215. Sampson HA. Anaphylaxis and emergency treatment. Pediatrics. 2003;111:1601-8.
216. Lins MGM, Horowitz MR, Silva GAP, Motta MEFA. Teste de desencadeamento alimentar oral na confirmaçao diagnóstica da alergia à proteína do leite de vaca. J. Pediatr (Rio J.). 2010;86:285-9.
217. Petrus NC, Schoemaker AF, van Hoek MW, Jansen L, Jansen-van der Weide MC, van Aalderen WM, et al. Remaining symptoms in half the children treated for milk allergy. Eur J Pediatr. 2015;174:759-65.
218. Morais MB, Spolidoro JV, Vieira MC, Cardoso AL, Clark O, Nishikawa A, Castro AP. Amino acid formula as a new strategy for diagnosing cow's milk allergy in infants: is it cost-effective? J Med Econ. 2016;19:1207-14.
219. Guest JF, Yang AC, Oba J, Rodrigues M, Caetano R, Polster L. Relative cost-effectiveness of using an extensively hydrolyzed casein formula in managing infants with cow's milk allergy in Brazil. Clinicoecon Outcomes Res. 2016;8:629-39.
220. Medeiros LCS, Speridiao PGL, Sdepanian VL, Fagundes-Neto U, Morais MB. Ingestao de nutrientes e estado nutricional de crianças em dieta isenta de leite de vaca e derivados. J Pediatr (Rio J). 2004;80:363-70.
221. Carroccio A, Montalto G, Custro N, Notarbartolo A, Cavataio F, D'Amico D, et al. Evidence of very delayed clinical reactions to cow's milk in cow's milk -intolerant patients. Allergy. 2000;55:574-9.
222. Jones M, Campbell KA, Duggan C, Young G, Bousvaro A, Higgins L, et al. Multiple micronutrient deficiences in a child fed on elemental formula. J Pediatr Gastroenterol Nutr. 2001;33:602-5.
223. Isolauri E, Siitas Y, Salo MK, Isosomppi R, Kaila M. Elimination diet in cow's milk allergy: risk for impaired growth in young children. J Pediatr. 1998;132:1004-9.
224. Fleischer DM, Convover-Walker MK, Christie L, Burks AW, Wood RA. The natural progression of peanut allergy resolution and the possibility of recurrence. J Allergy Clin Immunol. 2003;112:183-9.
225. Sampson HA. Food Allergy Part 1: Immunopathogenesis and clinical disorders. J Allergy Clin Immunol. 1999;103:717-28.
226. Rigal N, Reiter F, Morice C, De Boissieu D, Dupont C. Food allergy in the child: an exploratory study on the impact of the elimination diet of food neophobia. Arch Pediatr. 2005;12:1714-20.
227. Sampson HA. Immunological approaches to the treatment of food allergy. Pediatr Allergy Immunol. 2001;12:S91-96.
228. Polloni L, Schiff S, Ferruzza E, Lazzarotto F, Bonaguro R, Toniolo A, et al. Food allergy and attitudes to close interpersonal relationships: an exploratory study on attachment. Pediatr Allergy Immunol. 2017;28(5):458-63.
229. Shaker MS, Schwartz J, Ferguson M. An update on the impact of food allergy on anxiety and quality of life. Curr Opin Pediatr. 2017;29(4):497-502.
230. Shanahan L, Zucker N, Copeland WE, Costello EJ, Angold A. Are children and adolescents with food allergies at increased risk for psychopathology? J Psychosom Res. 2014;77(6):468-73.
231. Brasil. Ministério da Saúde. Secretaria de Atençao à Saúde. Departamento de Atençao Básica. Guia alimentar para a populaçao brasileira / Ministério da Saúde, Secretaria de Atençao à Saúde, Departamento de Atençao Básica. 2ª ed., 1. reimpr. - Brasília: Ministério da Saúde, 2014.
232. Venter C, Brown T, Meyer R, Walsh J, Shah N, Nowak-Węgrzyn A, et al. Better recognition, diagnosis and management of non- IgE-mediated cow's milk allergy in infancy: iMAP-na international interpretation of the MAP (Milk Allergy in Primary Care) guideline. Clin Transl Allergy. 2017;7:26.
233. Dreborg MA. Dietary prevention of allergic diseases on infants and small children. Part I: Immunologic background and criteria for hypoallergenicity. Part II: Evaluation for methods in allergy prevention studies and sensitization markers. Definitions and diagnostic criteria of allergic diseases. Part III: Critical review of published peer-reviewed observational and interventional studies and final recommendations. Pediatr Allergy Immunol. 2004;15:103-307.
234. Kramer MS, Kakuma R. Maternal dietary antigen avoidance during pregnancy or lactation, or both, for preventing or treating atopic disease in the child. Cochrane Database Syst Rev 2012;9:CD000133.
235. Luccioli S, Zhang YT, Verrill L, Ramos-Valle M, Kwegyir-Afful E. Infant feeding practices and reported food allergies at 6 years of age. Pediatric. 2014;134:S21-S28.
236. Nowak-Węgrzyn A, Chatchatee P. Mechanisms of Tolerance Induction. Ann Nutr Metab. 2017;70(suppl 2):7-24.
237. Boyle RJ, Ierodiakonou D, Khan T, Chivinge J, Robinson Z, Geoghegan N, et al. Hydrolysed formula and risk of allergic or autoimmune disease: systematic review and meta-analysis. BMJ. 2016;352:i974.