Número Atual: Janeiro-Março 2018 - Volume 2 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Dispositivos únicos ou múltiplos para testes cutâneos alérgicos em crianças?
Single or multiple devices for allergic skin test in children?
Laís Keiko Lopes; Cristine Secco Rosário; Carlos Antônio Riedi; Herberto José Chong Neto; Nelson Augusto Rosário
Universidade Federal do Paraná, Serviço de Alergia e Imunologia Pediátrica, Complexo Hospital de Clínicas - Curitiba, PR, Brasil
Endereço para correspondência:
Herberto Jose Chong Neto
E-mail: h.chong@uol.com.br
Submetido em 20/08/2017
Aceito em 30/01/2018
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVOS: Comparar os resultados obtidos com agulha e Multi-Test II® em testes cutâneos por puntura com diferentes concentraçoes de histamina e de extrato de Dermatophagoides pteronyssinus e a dor relatada em cada teste.
MÉTODOS: Estudo experimental, realizado no complexo Hospital de Clínicas em Curitiba, Paraná. Foram incluídas no estudo 104 crianças com idade entre 6 e 15 anos, com diagnóstico de asma e/ou rinite e/ou dermatite atópica e teste cutâneo alérgico positivo para Dermatophagoides pteronyssinus. Foram realizados testes com agulha hipodérmica descartável BD Precision Glide® 13 x 0,3 e com dispositivo Multi-test II® com histamina 10 mg/mL e 1 mg/ mL, Dermatophagoides pteronyssinus 5000 PNU/mL e 10000 PNU/mL e soluçao salina. Avaliaçao da dor foi obtida após cada teste pela escala de faces de dor de Wong-Baker.
RESULTADOS: A sensibilidade do teste cutâneo alérgico para os dois dispositivos foi 100% nas concentraçoes de histamina 10 mg/mL. Com histamina 1 mg/mL o Multi-test II® apresentou maior valor de sensibilidade (S = 86,5%) que a agulha (S = 56,7%). Alto nível de concordância entre os dois dispositivos foi observada com extrato de Dermatophagoides pteronyssinus na concentraçao de 10000 PNU/mL. Com a concentraçao de 5000 PNU/mL, o nível de concordância entre os testes foi 69,1% (Kappa = 0,2). A dor foi relatada por 65 (62,5%) crianças com Multi-Test II®, e 48 (46,2%) com agulha (p = 0,01).
CONCLUSAO: Houve alta sensibilidade para os dispositivos utilizados.Houve diferenças entre os tamanhos das pápulas nos testes cutâneos alérgicos com os dois dispositivos, porém resultados falso-positivos foram pouco observados. Ambos os dispositivos foram bem tolerados pelas crianças.
Descritores: Criança, testes cutâneos, mediçao da dor.
INTRODUÇAO
Os testes cutâneos alérgicos (TCA) de leitura imediata como o teste de puntura (prick test) e o teste intradérmico sao exames auxiliares na identificaçao etiológica das doenças alérgicas mediadas por IgE como a rinite, asma, anafilaxia, alergia alimentar ou a hipersensibilidade a medicamentos1. O resultado do teste cutâneo deve ser relacionado com a história clínica, exame físico e se exposiçao a determinados antígenos suspeitos (alérgenos de ácaros, polens, epitélio de animais, alimentos e alguns medicamentos) podem ser fatores desencadeantes dos sinais e sintomas. Testes cutâneos positivos indicam sensibilizaçao, e isoladamente nao fazem diagnóstico de alergia2. É importante destacar que parte da populaçao tem resultados positivos aos testes cutâneos, sem apresentar sintomatologia clínica3.
O teste cutâneo alérgico é o exame diagnóstico mais utilizado na prática do alergista. A técnica foi introduzida em 1924 por Lewis, modificado por Pepys em 1968, e é utilizada até os dias atuais. O exame consiste na aplicaçao de alérgenos na pele e introduçao do mesmo através da ruptura da epiderme, utilizando instrumento pontiagudo com ângulo de 45 a 60° com a superfície da pele. Pode ser realizado na regiao superior do dorso ou na superfície volar do antebraço2,4,5.
A introduçao do alérgeno nas camadas superficiais da pele gera uma reaçao imediata, dependente da desgranulaçao de mastócitos, liberaçao de histamina e outros mediadores, originando reaçao de pápula e eritema no local6.
Para assegurar a interpretaçao correta dos resultados, recomenda-se incluir controles positivo (histamina) e negativo (soluçao salina ou soluçao glicerinada a 50%). Recomenda-se intervalo de 2 a 5 cm entre cada alérgeno aplicado2,4,5. O teste é considerado positivo quando o tamanho da pápula for maior ou igual a 3 mm em relaçao ao controle negativo2.
O prick testé em geral seguro7, de baixo custo, fácil execuçao, com maior especificidade quando comparado ao teste intradérmico2, e com maior sensibilidade quando comparado aos testes in vitro(determinaçao de IgE específica)8,9. Outra vantagem do teste, é a utilizaçao de alimentos in natura, e alguns medicamentos em que nao há teste sorológico disponível para IgE específica10. Pode ser realizado em qualquer idade, porém resultados falsonegativos tendem a ocorrer com maior frequência em lactentes11.
Diversos instrumentos cortantes (agulha hipodérmica, lanceta com ou sem ponta bifurcada e aparelhos de múltiplas cabeças) podem ser utilizados na realizaçao do TCA2 . As reaçoes produzidas pelos dispositivos divergem de diversas maneiras, sendo que a principal diferença está na profundidade do trauma aplicado na pele. Quanto maior o trauma, maior a reaçao com histamina ou alérgeno, e geralmente menor a probabilidade de uma reaçao falso-negativa. Por outro lado, quanto maior o trauma, maior a probabilidade de reaçao com formaçao de pápulas no local do controle negativo, e maior o desconforto do paciente12,13.
Novos dispositivos cutâneos continuam sendo desenvolvidos com a tendência de permitir a aplicaçao de vários antígenos simultaneamente, o que é conhecido como aplicador de múltiplas cabeças. Estes dispositivos permitem a aplicaçao simultânea de oito alérgenos, o que pode reduzir o tempo do exame e aumentar a eficiência do teste14.
O objetivo do estudo foi comparar a sensibilidade dos testes utilizando dois dispositivos (agulha e Multi-Test II®) pela análise do tamanho da pápula gerada com diferentes concentraçoes de histamina e de extrato alergênico do ácaro Dermatophagoides pteronyssinus(Dp). Além disso, avaliar a dor relatada pelos dispositivos no TCA.
MÉTODOS
Estudo experimental realizado no ambulatório de Alergia e Imunologia do complexo Hospital de Clínicas da Universidade Federal do Paraná.
O trabalho foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do HC-UFPR sob número 54125715.3.0000.0096.
Foram incluídos no estudo 104 crianças com idade entre 6 e 15 anos, com diagnóstico de alergia (asma e ou rinite e ou dermatite atópica), e teste cutâneo alérgico positivo para Dp. A seleçao dos pacientes ocorreu entre os meses de maio e setembro de 2016. Os critérios de exclusao foram: uso de antihistamínicos na última semana, corticoide tópico nas últimas 3 semanas, dermatite atópica grave e dermografismo.
Todos os pacientes e responsáveis concordaram em participar do estudo e assinaram o Termo de Assentimento Livre e Esclarecido e o Termo de Consentimento Livre e Esclarecido, respectivamente.
Foram realizados testes cutâneos na superfície volar de cada antebraço, um com agulha hipodérmica (0,3 x 13 mm, BD Precision Glide®) e no outro com Multi-Test II® (Multi-Test II, Lincoln Diagnostics, INC, Decatur, Illinois 62525, USA). O mesmo pesquisador realizou todos os testes.
No teste com agulha, a gota do extrato a ser testado foi colocada na pele do paciente, cada uma na sua devida marcaçao, respeitando intervalo mínimo de 2 cm entre elas. A pele foi perfurada com a agulha hipodérmica fazendo pressao suficiente para que sua ponta penetrasse superficialmente a pele. Imediatamente após, limpou-se a regiao com algodao.
No teste com dispositivo de múltiplas cabeças (Multi-Test II®), após imersao nos extratos alergênicos, o dispositivo foi colocado em contato com a pele e realizado pressao suficiente para penetraçao de todas as cabeças na superfície do antebraço.
Os extratos utilizados foram produzidos por ASAC-PHARMA Brasil nas seguintes concentraçoes: histamina 10 mg/mL, histamina 1 mg/mL, Dp 5.000 PNU/mL (Dp 5), Dp 10.000 PNU/mL (Dp 10) e soluçao salina.
Após 15 minutos da aplicaçao do teste, foi registrada a média do diâmetro das pápulas. Para o cálculo foi utilizado a seguinte equaçao: D1+D2/2, onde D1 é o maior diâmetro da pápula obtido, e D2 o maior diâmetro perpendicular medido a partir da metade de D1. Os valores foram registrados em milímetros. O teste foi considerado positivo quando a média do diâmetro da pápula foi maior ou igual a 3 mm, nao considerando a área de eritema4,5.
Foi considerado resultado falso-positivo quando a média do diâmetro da pápula produzida pela soluçao com glicerina foi maior ou igual a 3 mm e reaçao falsonegativa quando a média do diâmetro da pápula de histamina foi menor que 3 mm.
A avaliaçao da dor foi realizada imediatamente após a aplicaçao de cada teste utilizando a escala de classificaçao de faces de dor de Wong-Baker, medida numa escala de 0-1014.
Para avaliar diferenças entre as medianas do tamanho das pápulas obtidas pelos dois dispositivos, empregou-se o teste U de Mann-Whitney, a intensidade da dor entre os dispositivos foi avaliada pelo teste de qui-quadrado de Pearson. A concordância entre os testes com as diferentes concentraçoes do extrato de Dp foi avaliada pelo coeficiente de concordância de Kappa. O coeficiente de variaçao foi calculado pela divisao do desvio-padrao pela média do diâmetro das pápulas. O valor p < 0,05 foi associado à significância estatística.
RESULTADOS
Cento e quatro crianças com média de idade de 10,3±2 anos, sessenta e nove (66,3%) do gênero masculino. Apresentavam rinite alérgica 96,1%, asma 88,4%, e dermatite atópica 10,5%.
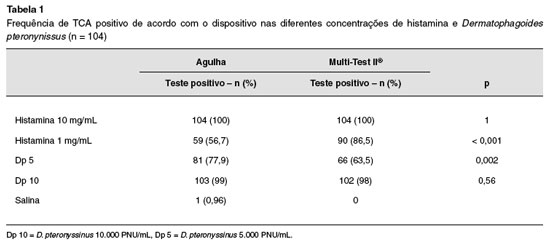
A sensibilidade (capacidade de discriminar a reaçao à histamina da reaçao com soluçao salina) nos dois dispositivos utilizando histamina 10 mg/mL foi de 100%. Com histamina 1 mg/mL a sensibilidade do Multi-Test II®foi de 86,5%, e da agulha de 56,7%. A especificidade foi avaliada utilizando a definiçao de falso-positivo, e chegou em 100% para o Multi-Test II®, e 99% para agulha. Nao ocorreu nenhuma reaçao (pápula ou eritema) nos locais onde nao havia extrato nas pontas do dispositivo Multi-Test II®.
A positividade dos testes utilizando as concentraçoes de Dp 5 e Dp 10, histamina 10 mg/mL, histamina 1 mg/mL e soluçao salina encontra-se na Tabela 1.
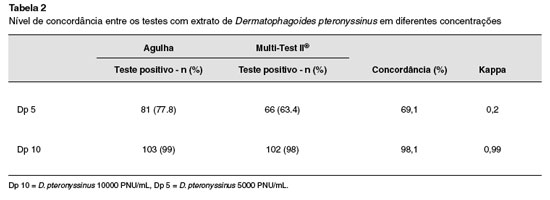
A concordância entre os testes realizados com agulha e Multi-Test II®para o extrato de Dp 10 foi de 98,1%. Para o Dp 5 foi observado baixo nível de concordância, 69,1% (Tabela 2).
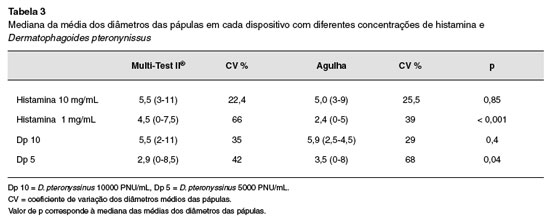
A mediana das médias dos diâmetros das pápulas nos dois dispositivos utilizando os cinco extratos está demonstrada na Tabela 3. Houve diferença entre os dispositivos nas concentraçoes de histamina 1mg/ mL e Dp 5.
Na avaliaçao da dor gerada na realizaçao dos testes cutâneos foi observado que 65 (62,5%) crianças referiram dor com Multi-Test II®, e 48 (46,2%) referiram dor com agulha (p = 0,01). A Figura 1 ilustra a distribuiçao da intensidade da dor utilizando a escala visual de faces de dor de Wong-Baker.
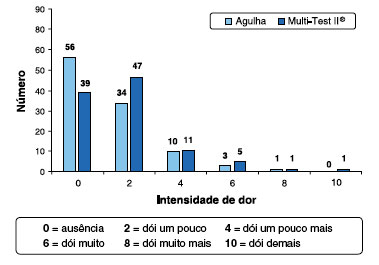
Figura 1 Distribuiçao da frequência de intensidade de dor pela escala de faces de dor de Wong-Baker com os dispositivos (n = 104)
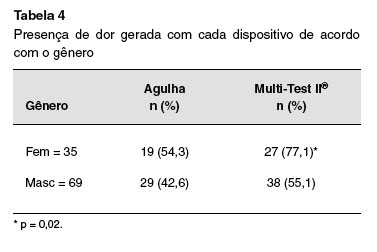
Na comparaçao entre os gêneros, 77,1% das meninas apresentaram dor com o Multi-Test II®, enquanto que nos meninos a dor foi referida em 55,1% (p = 0,02). Com a agulha encontrou-se que 54,3% das meninas relataram dor, e os meninos 42,6%, porém esta diferença nao foi significativa (Tabela 4).
DISCUSSAO
A prevalência das doenças alérgicas na infância vem crescendo nas últimas décadas. A determinaçao do agente desencadeante destas doenças se faz necessária, visto que condutas como exclusao de um alérgeno específico, tratamento farmacológico direcionado e imunoterapia dependem da identificaçao do mesmo. O teste de puntura é ferramenta importante no diagnóstico destas doenças16.
O Dermatophagoides pteronyssinusé o principal constituinte da poeira domiciliar, e um dos aeroalérgenos que mais provocam sensibilizaçao na populaçao geral em nosso país17,18. Em estudo realizado na cidade de Curitiba, foi encontrado maior prevalência de sensibilizaçao ao Dp em todas as faixas etárias, justificando a seleçao dos pacientes sensibilizados a este ácaro neste trabalho19.
A decisao de comparar agulha descartável com o Multi-test II®em crianças ocorreu, pois com o Multi-Test II® pode-se realizar 8 testes diferentes e de forma simultânea. Além disso, as crianças, em geral, sao avessas às agulhas e toleram pouco os procedimentos que demandam maior tempo para realizaçao.
Os dois dispositivos estudados apresentaram 100% de sensibilidade quando se comparou a reaçao à histamina na concentraçao padrao (10 mg/mL). Na concentraçao de 1 mg/mL, o Multi-Test II®foi mais sensível que a agulha, com sensibilidade de 86,5% e 56,7%, respectivamente. Em estudo realizado em crianças polonesas com idade de 9 anos foi observado positividade do teste utilizando histamina a 1 mg/ mL em apenas 10% desta populaçao, já em crianças italianas a positividade foi de 85,3%, o que mostra a grande variabilidade das reaçoes dos testes nesta concentraçao de histamina20.
Sabe-se que a resposta à histamina pode ser influenciada por vários fatores como idade, etnia, local anatômico do teste, dispositivo utilizado, medicamentos e atopia14,21,22. Em geral observa-se que quanto maior o trauma gerado na pele, maior será o tamanho da pápula. O teste ideal deveria provocar o menor trauma, menor desconforto para o paciente, mas gerar maior tamanho de pápula.
Quando foi analisado a média de diâmetro das pápulas por cada dispositivo, houve diferença significativa nas concentraçoes mais baixas. Nas concentraçoes de histamina 10 mg/mL e Dp 10, nao houve diferença. Estudos realizados anteriormente encontraram diferenças significativas nas médias dos diâmetros das pápulas quando o teste foi realizado com diferentes dispositivos nas duas concentraçoes13,14,23.
Foi observado maior média de diâmetro das pápulas nas concentraçoes de histamina (10 mg/mL e 1 mg/mL) com o Multi-test II®, mas para o extrato do Dp nas duas concentraçoes a média foi maior com a agulha. Sabe-se que o tamanho da pápula gerada pelo alérgeno nao necessariamente se correlaciona com o tamanho da pápula gerada pela histamina, como observado em estudo de Horsmanheimo24. Malling observou que nao há correlaçao entre o tamanho da pápula induzida pela histamina e o extrato do alérgeno, e que isso pode ser explicado por uma diferença na liberaçao de histamina endógena, ou pela diferença no número de receptores de histamina de cada indivíduo, nos seus diferentes graus de sensibilidade25.
Apesar disso, esta discrepância nos resultados dos testes pode, talvez, ser explicada pela dificuldade de se exercer a mesma pressao em todos os pontos do dispositivo de múltiplas cabeças, devido à curvatura natural do antebraço, e a sua dimensao reduzida nas crianças de menor idade. Cabe salientar que os extratos contendo histamina e Dp ficaram localizados em lados opostos no Multi-Test II®, sendo assim, diferentes intensidades de pressao em cada extremidade do dispositivo podem ter sido aplicadas, resultando em diferentes tamanhos de pápulas.
Contrariamente ao apresentado neste estudo, Carr e cols. e Tverski e cols. encontraram média maior de tamanho de pápula no dispositivo único quando comparado ao de múltiplas cabeças quando utilizaram a histamina, porém a populaçao estudada era composta de adultos (maiores de 18 anos), e os testes foram realizados em outros locais anatômicos14,23.
Alto nível de concordância entre os dois dispositivos foi observado com o Dp na concentraçao de 10.000 PNU/mL. Utilizando concentraçao inferior de 5000 PNU/mL o nível de concordância entre os testes foi baixo.
Apenas um resultado falso-positivo foi encontrado no teste com agulha, ou seja, formaçao de pápula maior que 3 milímetros na soluçao salina. Pode-se explicar este resultado se for considerado que houve contaminaçao do dispositivo na realizaçao do teste. A contaminaçao pode ter ocorrido pela proximidade em que os extratos foram dispostos ou porque o alérgeno permaneceu na agulha apesar da limpeza com algodao embebido em álcool.
Sabe-se que a distância mínima de 2 cm entre cada teste é fundamental para evitar a contaminaçao entre as substâncias26. Recomenda-se que nao se utilize agulha única entre os diferentes extratos em um mesmo teste, devido ao grande número de resultados falso-positivos. Para os diferentes alérgenos havia número elevado de resultados falso-positivos utilizando a mesma lanceta, porém nenhum resultado falso-positivo para salina27. Kupczyk e cols. encontraram resultados semelhantes de contaminaçao entre os extratos de alérgenos utilizando lanceta única, mas nao encontraram falso-positivos para a salina28.
A utilizaçao da mesma agulha no teste justificase pela economia e rapidez na sua execuçao, mas pode haver risco nao intencional de contaminaçao. É importante destacar que um resultado falso-negativo (ocorre quando a histamina gera pápula menor que 3 mm), pois este resultado invalida o teste cutâneo, e quando é falso-positivo, a valorizaçao do teste pode ser realizada erroneamente.
A avaliaçao da dor com o Multi-Test II®revelou mais desconforto que a agulha, porém nas crianças que referiram dor, esta foi caracterizada como de leve intensidade. Era esperado maior escore de dor no teste realizado com agulha que no Multi-Test II®, pela aparência dos dois dispositivos. Além disso, sabese que as crianças, em geral, têm uma perspectiva negativa quando procedimentos com agulha sao realizados. A utilizaçao do Multi-Test II®requer uma aplicaçao comparado a cinco aplicaçoes realizadas com agulha, o que poderia ter gerado pior expectativa quanto ao teste com agulha.
Estudo realizado por Tversky e cols. nao mostrou diferença significativa na dor gerada pelos testes com dispositivo único ou múltiplo, como observado neste trabalho. No entanto, diferente deste estudo, o dispositivo único nao era a agulha, o Multi-Test II®nao fez parte dos dispositivos múltiplos avaliados, os participantes eram adultos e o teste foi realizado por mais de um observador em diferentes locais de aplicaçao23. Carr e cols.14observaram, em adultos, que dispositivos de múltiplas cabeças, entre os quais o Multi-Test II®, provocam maior desconforto que os dispositivos de cabeça única, como observado neste estudo. Nao está claro se estas diferenças têm importância clínica, uma vez que a intensidade da dor foi leve.
CONCLUSAO
Nao houve resultados falso-negativos para histamina com os dois dispositivos. Diferenças entre os tamanhos das pápulas existem, porém resultados falso-positivos praticamente nao foram encontrados. O Multi-Test II®gerou maior número de crianças com dor em relaçao a agulha, no entanto a dor foi de leve intensidade, demonstrando que os dispositivos sao bem tolerados pelas crianças.
REFERENCIAS
1. Chong Neto HJ, Rosário NA. Studying specific IgE: in vivo or in vitro. Allergol et Immunopathol. 2009;37:31-5.
2. Bernstein IL, Li JT, Bernstein DI, Hamilton R, Spector SL, Tan R, et al. Allergy diagnostic testing: an updated practice parameter. Ann Allergy Asthma Immunol. 2008;100:1-148.
3. Bodtger U, Poulsen LK, Malling HJ.Asymptomatic skin sensitization to birch predicts later development of birch pollen allergy in adults:a 3-year follow-up study. J Allergy Clin Immunol. 2003;111:149-54.
4. Antunes J, Borrego L, Romeira A, Pinto P. Skin prick tests and allergy diagnosis. Allergol Immunopathol. 2009;37:155-64.
5. Demoly P, Bousquet J, Manderscheid JC, Dreborg S, Dhivert H, Michel FB. Precision of skin prick and puncture tests with nine methods. J Allergy Clin Immunol. 1991;88:758-62.
6. Friedman MM, Kaliner M. Ultrastructural changes in human skin mast cells during antigen-induced degranulation in vivo. J Allergy Clin Immunol. 1988;82:998-1005.
7. Sellaturay P, Nasser S, Ewan P. The incidence and features of systemic reaction to skin prick tests. Ann Allergy Asthma Immunol. 2015;115:229-33.
8. Brand PL, Kerstjens HA, Jansen HM, Kauffman HF, de Monchy JG. Interpretation of skin tests to house dust mite and relationship to other allergy parameters in patients with asthma and chronic obstructive pulmonary disease. The Dutch CNSLD Study Group. J Allergy Clin Immunol. 1993;91:560-70.
9. Oppenheimer J. Skin testing versus in vitro testing in the evaluation of aeroallergy: The great debate. Am J Rhinol Allergy. 2015;29:362-4.
10. Heinzerling L, Mari A, Bergmann KC, Bresciani M, Burbach G, Darsow U, et al. The skin prick test -European standards. Clin Transl Allergy. 2013;3:3.
11. Ménardo JL, Bousquet J, Rodière M, Astruc J, Michel FB. Skin test reactivity in infancy. J Allergy Clin Immunol. 1985;75:646-51.
12. Nelson HS, Rosloniec DM, McCall LI, Iklé D. Comparative performance of five commercial prick skin test devices. J Allergy Clin Immunol. 1993;92:750-6.
13. Nelson HS, Kolehmainen C, Lahr J, Murphy J, Buchmeier A. A comparison of multiheaded devices for allergy skin testing.J Allergy Clin Immunol. 2004;113:1218-9.
14. Carr WW, Martin B, Howard RS, Cox L, Borish L. Comparison of test devices for skin prick testing. J Allergy Clin Immunol. 2005;116:341-6.
15. Tomlinson D, Baeyer T, Stinson JN, Sung L. A Systematic review of faces scales for the self-report of pain intensity in children.Pediatrics. 2010;1126:68.
16. Eigenmann PA, Atanaskovic-Markovic M, O'B Hourihane J, Lack G, Lau S, Matricardi PM, et al.Testing children for allergies:why, how, who and when, an updated statement of the European Academy of Allergy and Clinical Immunology (EAACI) Section on Pediatrics and the EAACI Clemens von Pirquet Foundation. Pediatr Allergy Immunol. 2013;24:195-209.
17. Godinho R, Lanza M, Godinho A, Rodriques A, Assiz TM.Frequência de positividade em teste cutâneo para aeroalérgenos. Rev Bras Otorrinolaringol. 2003;69:824-8.
18. Dutra BM, Rosario Filho NA, Zavadniak AF. Alérgenos inaláveis em Curitiba: uma revisao de sua relevância clínica. Rev bras alerg imunopatol. 2001;24:189-95.
19. Maniglia SF, Tsuru FM, Santos VC, Ueda DM. Sensitization profile to allergens in patients using Multi-Test II.Int Arch Otorhinolaryngol. 2014;18:391-7.
20. Ronchetti R, Haluszka J, Martella S. Skin reactivity to histamine and to allergens in unselected 9-year-old children living in Poland and Italy. Pediatr Allergy Immunol. 2003;14:201-6.
21. Ronchetti R, Pia Villa M, Ciofetta G, Barreto M, Falasca C, Martella S. Changes over 13 years in skin reactivity to histamine in cohorts of children aged 9-13 years. Allergy. 2001;56:436-44.
22. Almeida MM, Gaspar A, Romeira A. Reactividade cutânea inespecífica em estudos populacionais. Rev Port Imuno Alergol. 2001;8:199-204.
23. Tversky JR, Chelladurai Y, McGready J, Hamilton RG.Performance and pain tolerability of current diagnostic allergy skin prick test devices. J Allergy Clin Immunol. 2015;3:888-93.
24. Horsmanheimo L, Harvima IT, Harvima RJ, Ylönen J, Naukkarinen A, Horsmanheimo M. Histamine release in skin monitored with the microdialysis technique does not correlate with the wheal size induced by cow allergen. Br J Dermatol. 1996;134:94-100.
25. Malling HJ. Skin prick testing and the use of histamine references. Allergy. 1984;39:596-601.
26. Nelson HS, Knoetzer J, Bucher B. Effect of distance between sites and region of the body on results of skin prick tests. J Allerg Clin Immnunol. 1996;97:596-601.
27. Piette E, Bourret J, Bousquet P, Demoly P.Prick tests to aeroallergens: is it possible simply to wipe the device between tests? Allergy. 2002;57:940-2.
28. Kupczyk M, Kuprys I, Gorski P, Kuna P. Not one lancet for multiple SPT. Allergy. 2001;56:256-7.