Número Atual: Janeiro-Março 2018 - Volume 2 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Determinação da potência relativa de extratos alergênicos de Phleum pratense por testes cutâneos
Establishing the relative potency of Phleum pratense allergenic extracts using skin prick tests
Nelson A. Rosario Filho1; Elizabeth M. Mercer Mourao1; Alessandra dos Santos Bitencourt1; Cristine S. Rosario1; Désirée E.S. Larenas Linnemann2
1. Serviço de Medicina Respiratória Pediátrica, Complexo Hospital de Clínicas, Universidade Federal do Paraná - Curitiba, PR, Brasil
2. Hospital Medica Sur - México, D.F., México
Endereço para correspondência:
Nelson A. Rosario FilhoE-mail: nelson.rosario@ufpr.br
Submetido em: 23/02/2018
Aceito em 26/02/2018
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVOS: Comparar a potência de extratos europeus de Phleum pratensepara imunoterapia sublingual (ITSL), em relaçao ao extrato referência norte-americano.
MÉTODOS: Foram selecionados 15 sujeitos, com idade entre 18 e 55 anos, histórico clínico sazonal compatível e teste cutâneo com alta reatividade a gramíneas. O delineamento de estudo foi transversal, triplo cego e randômico, e comparadas as potências dos seguintes extratos alergênicos para ITSL: (A) Soluprick®(30 HEP/mL) e (B) Grazax®75.000 SQ-T, ambos os extratos da ALK-Abelló; (C) Oralair®e (D) Staloral®, com 300 IR/mL, Stallergènes, França. O extrato de origem norteamericana (E) foi o padrao, contendo 10.000 BAU/mL. Todos os extratos foram usados em forma de concentrados e nas diluiçoes 1:3, 1:10, e 1:30. Os testes foram aplicados em quadruplicata em dois dias nao consecutivos. Os diâmetros de pápula e eritema foram registrados após 15 minutos.
RESULTADOS: Nao houve diferença significativa entre os testes realizados no primeiro e segundo dias (p = 0,37) com extratos concentrados, na diluiçao 1:3 e também 1:10 (p = 0,20 e p = 0,33, respectivamente). No segundo dia de testes, a média obtida das pápulas do extrato A foi de 16,7 mm na diluiçao 1:3; de 14,3 mm na diluiçao 1:10; e de 9,8 mm na diluiçao 1:30. Houve diferenças significativas entre os extratos A, B, C, D e E na comparaçao entre as médias das pápulas obtidas em todas as diluiçoes, mostrando diferença de potência entre os extratos. O diâmetro das pápulas obtidas com o material concentrado, em ordem decrescente de potência, foram C > A > E > D > B. As reaçoes observadas com extratos concentrados mostrou que o mais potente foi Staloral, e o menos potente Grazax.
CONCLUSOES: Houve variabilidade significativa de potência nos diversos extratos comparados. Isto reforça a necessidade de padronizaçao de extratos alergênicos para ITSL.
Descritores: Imunoterapia com alérgenos, alérgenos, alergia a pólen.
INTRODUÇAO
As manifestaçoes clínicas da alergia ao pólen podem ocorrer durante todo o ano ou durante a primavera, época de polinizaçao mais intensa. No Sul do Brasil, a polinizaçao de gramíneas inicia em setembro e pode se estender até janeiro. As variaçoes climáticas e o índice de precipitaçao pluviométrica controlam a época de polinizaçao e a carga atmosférica do pólen, resultando em modificaçoes na intensidade e no início dos sintomas em cada estaçao1,2. Várias espécies de gramíneas produtoras de pólen têm sido reconhecidas como alergênicas, entre elas, Lolium perenne, Poa pratensis, Phleum pratense, Dactylis glomerata e Cynodon dactylon2,3.
Lolium multiflorum, gramínea conhecida como azevém, é a principal causadora de polinose na regiao Sul do Brasil4,5. Estudos imunológicos indicam que há até 95% de homologia antigênica entre as gramíneas Lolium multiflorume Phleum pratense. Phleum pratenseé uma gramínea de relevância alergênica em regioes de clima temperado. Entre seus alérgenos se destacam: Phl p 1, Phl p 2, Phl p 5 e Phl p 6. Os grupos 1 e 5, sao os mais prevalentes na sensibilizaçao de pacientes3.
Imunoterapia específica para alérgenos é o único tratamento disponível que pode limitar a progressao das doenças alérgicas e prevenir o surgimento de novas sensibilizaçoes alérgicas6-8.
Os testes cutâneos de leitura imediata, por puntura ou intradérmicos, sao usados há décadas como forma de identificar a presença de anticorpos IgE específicos para alérgenos9. Sao altamente sensíveis para diagnóstico das doenças atópicas com rapidez e reprodutibilidade10.11. Testes cutâneos por puntura ou intradérmicos em indivíduos conhecidamente alérgicos foram ambos validados para avaliar a potência biológica dos extratos de imunoterapia, e ainda permitir a comparaçao da potência de extratos de diferentes fabricantes12-16.
Extratos alergênicos sao produzidos para diagnóstico e tratamento de doenças mediadas por IgE. Esses extratos sao constituídos por complexos de materiais biológicos17-19. A padronizaçao é o processo de avaliaçao da potência de determinado extrato, comparando-o a amostras de referência com quantidades conhecidas de alérgenos específicos16,20. Embora seja altamente desejável, nem todos os extratos utilizados na prática clínica sao padronizados, nesse caso cada produtor deve ter seu controle interno para assegurar um nível aceitável de comparaçao a cada novo lote preparado19,21.
Os objetivos deste estudo sao comparar em testes de puntura as potências de extratos europeus de Phleum pratenseem relaçao ao extrato de referência do FDA (Food and Drug Administration) dos Estados Unidos da América.
MATERIAL E MÉTODOS
Para documentar a potência relativa em testes cutâneos de extratos alergênicos de Phleum pratensede diferentes fabricantes, o delineamento selecionado foi um ensaio clínico de superioridade de potência, com a finalidade de avaliar um dos pilares do tratamento com extratos alergênicos. O estudo foi triplo cego, randômico, multicêntrico e internacional. Os dados gerados neste Serviço foram analisados interinamente. Os participantes foram recrutados através de notificaçao eletrônica via intranet (sistema eletrônico do Complexo Hospital de Clínicas - UFPR), e que tivessem sintomas típicos de rinoconjuntivite alérgica durante o período da primavera.
Foram selecionados os sujeitos de qualquer sexo ou raça, com idade entre 18 e 55 anos, com histórico clínico sazonal compatível com possível alergia ao pólen e confirmada por resultado positivo para teste de puntura (diâmetro médio de pápula de 8 mm) para Phleum pratensecom extrato contendo 10.000 AU/mL, Greer Laboratories, EUA. Nenhum dos sujeitos havia usado medicaçao nos últimos 15 dias que pudesse interferir com os resultados de testes cutâneos.
Os critérios de exclusao foram os seguintes: espirometria com volume expiratório forçado no primeiro segundo (VEF1) abaixo de 80% do valor normal previsto; gravidez ou pacientes femininos sem prática contraceptiva aceitável; pacientes com histórico de anafilaxia ou reaçoes alérgicas graves; necessidade de anti-histamínicos para controlar sintomas; administraçao de corticoide nos últimos 15 dias, ou de açao prolongada nos últimos 90 dias; portadores de dermatite atópica ativa; hiperreatividade cutânea - controle negativo superior a 3 mm de diâmetro ou tendência a urticária; pacientes em vigência de imunoterapia ou com história de realizá-la nos últimos 5 anos.
Testes cutâneos foram realizados na regiao dorsal de 15 pacientes alérgicos, selecionados conforme critérios de inclusao e exclusao, por história clínica sugestiva de alergia a Loliume teste cutâneo de puntura com alta reatividade a este alérgeno.
O dispositivo usado para puntura foi lanceta de aço inoxidável, calibrada e descartável Alk Lancet®.
Extratos alergênicos
Para reduzir esta diferença em potência, o concentrado de extrato dos Estados Unidos da América foi diluído em 50%, portanto, o concentrado de extrato americano de Phleum pratenseteria 5.000 BAU/mL. Através de testes de puntura foram comparadas as potências dos seguintes extratos alergênicos para imunoterapia sublingual: (A) Soluprick®(30 HEP/mL), e (B) Grazax®75.000 SQ-T, ambos os extratos feitos da mesma matéria prima da ALK-Abelló; (C) Staloral®e (D) Oralair®, com 300 IR/mL, Stallergènes, França. O extrato de origem norte-americana (E) é o padrao Center for Biologics Evaluation and Research/Food and Drug Administration USA, CBER/FDA de 10.000 BAU/mL.
A quantidade de antígeno Phl p 5 em microgramas por mililitro de cada extrato alergênico é de uma publicaçao prévia: 15 µg em Grazax®; 8,4 µg em Staloral®; 5,2 µg em Oralair®; 9,2 µg em Soluprick®, e 64 µg no extrato original do FDA22.
O diluente utilizado foi glicerina 50%, fornecido por Greer Laboratories®. Os extratos de pólen de Phleum pratenseforam testados em duplicata em cada sessao de testes cutâneos por paciente, portanto, em resultado quádruplo. As formulaçoes em comprimidos foram dissolvidas no mesmo diluente glicerinado. Para os testes por puntura todos os extratos foram usados em forma de concentrados, e nas diluiçoes 1:3, 1:10, e 1:30.
Os extratos alergênicos de Phleum pratensede diferentes fontes e diluiçoes foram selecionados de forma cega e aplicados em lados opostos do dorso do indivíduo. Os frascos de concentrados identificados com as letras A-E e os controles negativos e positivos foram mantidos em códigos, e revelados apenas ao final do estudo.
Testes cutâneos
Para obter resultados mais confiáveis, antes de iniciar os testes de puntura com os extratos em estudo, o técnico designado para aplicaçao dos testes foi submetido a treinamento. O teste de proficiência consistiu na aplicaçao alternada de histamina e soluçao salina no antebraço do paciente. Ambas, histamina e salina foram aplicadas 10 vezes, e a média do diâmetro das pápulas usadas para calcular o coeficiente de variaçao, que nao deveria ser superior a 20%. O teste foi repetido até o aplicador ser aprovado.
Os testes de puntura para cada extrato, concentrados e diluídos, foram aplicados em quadruplicata - dois lados do dorso, em dois dias nao consecutivos. O aplicador do teste soube somente quais eram os controles positivos e negativos, assim como os frascos com os concentrados. Além disso, o controle negativo foi usado para confirmar a reatividade da pele do paciente, conforme descrito nos critérios de inclusao.
Os resultados foram avaliados após 15 minutos pelo contorno da pápula e eritema com caneta porosa e transferidos com adesivo transparente para uma folha branca de papel. Esse método, utilizando a fita adesiva, é padrao ouro no registro de testes cutâneos, utilizado em diversos estudos.
Após 7 a 15 dias, durante a segunda sessao, a mesma rotina foi estabelecida e o teste foi repetido, para conseguir o total de quatro repetiçoes.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do Hospital de Clínicas da Universidade Federal do Paraná, e os participantes, após informaçao sobre o protocolo, assinaram Termo de Consentimento Livre e Esclarecido.
RESULTADOS
Foram analisados testes cutâneos por puntura de 15 pacientes, com idade entre 18-48 anos e história clínica compatível com rinoconjuntivite alérgica sazonal ao pólen de gramíneas. Esses pacientes realizaram duas visitas ao serviço de referência e foram submetidos a testes no dorso à esquerda e à direita, com padrao em duplicata, dos extratos analisados em suas diluiçoes padronizadas.
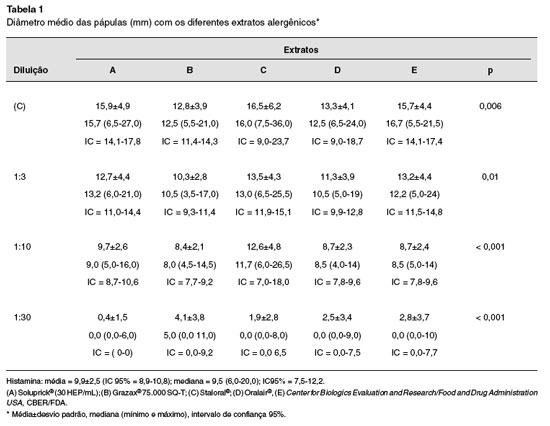
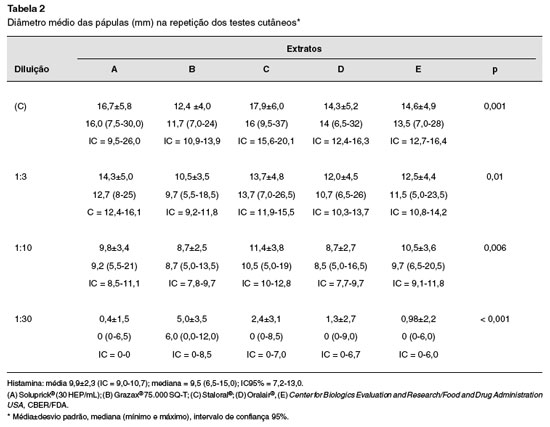
Os dados obtidos foram submetidos à mensuraçao manual, em régua milimetrada, por um único examinador. Foram avaliadas média, desvio padrao, mediana e intervalo de confiança de todos os dados, descritos nas Tabelas 1 e 2. Considerou-se resultado estatisticamente significativo para o valor obtido de p < 0,05. Nao houve diferença significativa entre os testes realizados no primeiro e segundo dias (p = 0,37) na comparaçao dos diâmetros médios das pápulas obtidas com extratos concentrados, na diluiçao 1:3 e também 1:10 (respectivamente p = 0,20 e p = 0,33). Para comparaçao entre os extratos na diluiçao 1:30, foi utilizado o teste de Wilcoxon, e tampouco revelou diferenças significativas nos valores dos diâmetros médios das pápulas (p = 0,30). Nao houve diferença entre os testes realizados no dorso à direita e à esquerda, pelo teste Anova (p = 0,97).
No segundo dia de testes, a média obtida das pápulas do extrato A concentrado foi de 16,7 mm na diluiçao 1:3; de 14,3 mm na diluiçao 1: 10; e de 9,8 mm na diluiçao 1: 30. Nesta diluiçao1:30 a mediana obtida foi 0 mm, pois alguns testes foram negativos (Tabela 2).
A média das pápulas do extrato B concentrado foi de 12,4 mm; 10,5 mm na diluiçao 1:3; 8,7 mm na diluiçao 1:10; e 5,0 mm na diluiçao 1:30. A mediana obtida com 1:30 foi 6 mm.
A média obtida das pápulas do extrato C concentrado foi de 17,9 mm; na diluiçao 1:3 a média foi 13,7 mm; na diluiçao 1:10 a média foi 11,4 mm; e na diluiçao 1:30 foi 2,4 mm.
As médias obtidas das pápulas com o extrato D foram respectivamente 14,3 mm; 12 mm; 8,7 mm; e 1,3 mm com o concentrado e diluiçoes 1:3, 1:10 e 1:30.
Para o extrato E, as médias das pápulas foram, respectivamente, de 14,6 mm, 12,5 mm, 10,5 mm e 0,98 mm com o concentrado e diluiçoes 1:3, 1:10 e 1:30.
Na comparaçao entre os extratos concentrados, os resultados obtidos foram semelhantes nos extratos A e C. O extrato B, na diluiçao 3, foi diferente dos demais na comparaçao entre os demais extratos. Nas variáveis com distribuiçao simétrica foi utilizado o teste paramétrico Anova. Nas variáveis com distribuiçao assimétrica foi utilizado o teste nao paramétrico Anova de Kruskal-Wallis.
Houve diferenças significativas entre os extratos A, B, C, D e E na comparaçao entre as médias das pápulas obtidas em todas as diluiçoes, mostrando diferença de potência entre os extratos. Ao se comparar a potência dos extratos no segundo dia de teste, o diâmetro médio das pápulas obtidas com o material concentrado, em ordem decrescente de potência foram C > A > E > D > B.
Assim, o extrato C foi o mais potente nos testes cutâneos com extratos concentrados, e o extrato B o menos potente.
Na diluiçao 1:3 a potência se manifestou da seguinte forma em ordem decrescente: C > A > E > D > B. Na diluiçao 1:10 a potência em ordem decrescente foi:C > E > A > D = B.Na diluiçao 1:30 a potência em ordem decrescente foi: B > C > D > E > A.
A média obtida das reaçoes aos testes com histamina 10 mg/mL no primeiro e segundo dias foi de 9,9 mm.
DISCUSSAO
Este estudo se propôs a comparar extratos alergênicos para imunoterapia sublingual comercialmente disponíveis, que em teoria deveriam ter a mesma eficácia na melhora clínica do paciente com sensibilizaçao a alérgenos de gramíneas.
Existe variaçao considerável nos métodos para verificar a potência de extratos alergênicos. Na Europa, a maioria dos fabricantes reporta a potência de um extrato alergênico em unidades baseadas em referência própria, o que dificulta a compreensao da dose exata utilizada. A tendência de alguns fabricantes em expressarem a potência de seus produtos em unidades de massa (microgramas do alérgeno dominante) ainda é unidade arbitrária, e varia com as técnicas empregadas para a determinaçao dos alérgenos23. A imunoterapia é o único tratamento imunomodulador específico capaz de influenciar a resposta imunológica iniciada pelo alérgeno e restabelecer a imunidade normal, além de ser o único tratamento com objetivo de tratar a causa e nao os sintomas da alergia respiratória24. Baseia-se na administraçao de doses crescentes do alérgeno identificado como causal, visando reduzir a reatividade de pacientes alérgicos6,25. Tais efeitos culminam na remissao da doença por tempo prolongado, melhora clínica, reduçao da terapia farmacológica e diminuiçao da resposta ao alérgeno nos testes cutâneos de resposta imediata e na provocaçao alergênica específica.
A eficácia da imunoterapia por via sublingual ou subcutânea depende da dose do alérgeno administrada6,26. A induçao terapêutica de tolerância pode restaurar a imunidade em distúrbios alérgicos e autoimunes. A imunoterapia é um dos melhores exemplos para ilustrar a induçao de tolerância por antígenos externos24.
A padronizaçao dos extratos alergênicos é tema de extrema relevância em alergologia, uma vez que permite ao médico atuante tomar a melhor decisao na escolha do extrato para imunoterapia, de acordo com a sensibilizaçao do paciente6,24.
A ausência de unidade comum aos extratos disponíveis mundialmente dificulta a adequada comparaçao da potência dos mesmos27.
Os extratos comparados neste estudo sao de apresentaçao líquida e em comprimido de dissoluçao sublingual.
Os resultados obtidos mostraram que há diferença estatisticamente significativa ao se comparar por teste de puntura os extratos alergênicos disponíveis para imunoterapia sublingual. A relaçao entre concentraçao em microgramas de alérgenos por mililitro e diâmetro de reaçao cutânea obtida, nao se aplica, uma vez que nao há informaçoes precisas do método de preparo e obtençao dos extratos. Além disso, conforme se observou, o extrato com maior concentraçao de Phleum pratensepor mililitro -o extrato do FDA, nao apresentou reaçoes proporcionalmente maiores, embora já diluído em 50%.
Na avaliaçao dos extratos, a potência observada pelo teste de puntura com extratos concentrados o mais potente foi Staloral, e o menos potente, Grazax. Resultados obtidos em quadruplicata, no primeiro e segundo dia de testes, e à direita e à esquerda, no dorso dos pacientes. Mostrando dessa forma que há, sim, diferença de potência entre os extratos disponíveis para imunoterapia, mas isto nao indica se poderá gerar uma diferença na resposta clínica individual do paciente.
Essa diferença observada entre os extratos comprova a necessidade de padronizaçao, como no estudo que comparou níveis de alérgenos de Dermatophagoides pteronyssinus(µg/mcL) em extratos de vários fabricantes, e encontrou níveis insuficientes para alcançar doses efetivas preconizadas internacionalmente para imunoterapia efetiva28. É importante a qualidade de extratos alergênicos visando a segurança e eficácia do tratamento imunoterápico. A padronizaçao dos mesmos permite uma reduçao na frequência e gravidade das reaçoes sistêmicas secundárias a imunoterapia.
A variabilidade significativa de potência nos diversos extratos disponíveis na Europa e Estados Unidos da América é inevitável, mas a relevância clínica no tratamento das doenças alérgicas nao foi estabelecida21,22. O extrato Staloral®foi o mais potente nos testes cutâneos com extratos concentrados, e o extrato Grazax®o menos potente. Estes resultados reforçam a necessidade de padronizaçao de extratos alergênicos visando resposta semelhante e confiável, de acordo com a preferência do médico assistente, no tratamento dos pacientes alérgicos em imunoterapia sublingual para alérgenos, especialmente porque essa terapia se encontra em ascensao no Brasil.
REFERENCIAS
1. Pfaar O, Bastl K, Berger U, Buters J, Calderon MA, Clot B, Darsow U, et al. Defining pollen exposure times for clinical trials of allergen immunotherapy for pollen induced rhinoconjunctivitis - an EAACI Position Paper. Allergy. 2017;72:713-22.
2. Rosário Filho NA. Alergia ao pólen de gramíneas: "back to the future". Rev bras alerg imunopatol. 2012;35:82-4.
3. Garcia-Mozo H. Poaceae pollen as the leading aeroallergen worldwide: a review. Allergy. 2017, doi: 10.1111/all.13210.
4. Rosário Filho NA. Pollinosis in Brazil: changing concepts. J Allergy Clin Imunol. 1990;85:819-20.
5. Rosário Filho NA. Atualizaçao sobre polinose: Um problema médico e ecológico recente no Brasil. Rev bras alerg imunopatol. 1989;12:104-8.
6. Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W et al. International consensus on allergy immunotherapy. J Allergy Clin Immunol. 2015;136:556-68.
7. Di Bona D, Plaia A, Leto-Barone MS, La Piana S, Macchia L, Di Lorenzo G. Efficacy of allergen immunotherapy in reducing the likelihood of developing new allergen sensitizations: a systematic review. Allergy. 2017;72:691-704.
8. Kristiansen M, Dhami S, Netuveli G, Halken S, Muraro A, Roberts G, Larenas-Linnemann D, et al. Allergen immunotherapy for the prevention of allergy:a systematic review and meta-analysis.Pediatr Allergy Immunol. 2017:28:18-29.
9. Bernstein IL, Li JT, Bernstein DI, et al. Allergy diagnostic testing: an updated practice parameter. Ann Allergy Asthma Immunol. 2008;100(Suppl 3):S1-S148.
10. Haahtela T, Burbach GJ, Bachert C, Bindslev-Jensen C, Bonini S, Bousquet J, et al. Clinical relevance is associated with allergen-specific wheal size in skin prick testing. Clin Exp Allergy. 2014;44:407-16.
11. Chong Neto HJ, Rosario NA. Studying specific IgE: in vivo or in vitro. Allergol et Immunopathol. 2009;37:31-5.
12. Zavadniak AF, Rosário Filho NA, Arruda LK, Castro FFM, Solé D, Aun WT, et al. Evaluation of the potency of commercially available Dermatophagoides pteronyssinusallergenic extracts for immunotherapy Rev bras alerg imunopatol. 2004;27:46-54.
13. Larenas-Linnemann D, Cox LS; Immunotherapy and Allergy Diagnostics Committee of the American Academy of Allergy, Asthma and Immunology. European allergen extract units and potency: review of available information. Ann Allergy Asthma Immunol. 2008;100:137-45.
14. Larenas-Linnemann D, Cruz AA, Gutierrez IR, et al. European and Mexican vs US diagnostic extracts of Bermuda grass and cat in skin testing. Ann Allergy Asthma Immunol. 2011;106:421-8.
15. Nordic Council on Medicines.Registration of allergenic preparations. Nordic guidelines, 2nd edn. Uppsala: NLN Publications; 1989. p. 1-34.
16. Turkeltaub PC. Biological standardization based on quantitative skin testing - the ID50 EAL method (intradermal dilution for 50 mm sum of erythema diameters determines the allergy unit). Arb Paul Ehrlich Inst Georg Speyer Haus Ferdinand Blum Inst Frankf A M. 1987;80:169-73.
17. Khurana T, Bridgewater JL, Rabin RL.Allergenic extracts to diagnose and treat sensitivity to insect venoms and inhaled allergens. Ann Allergy Asthma Immunol. 2017;118:531-6.
18. Cox L, Nelson H, Lockey R, Calabria C, Chacko T, Finegold I, et al. Allergen immunotherapy: a practice parameter third update. J Allergy Clin Immunol. 2011;127(1 Suppl):S1-S55.
19. Larenas Linnemann DES, Singh J, Rosario N, Esch R, Matta JJ, Maspero J, et al. Similar biological activity in skin prick test for Oralair®(8200 BAU) and Grazax®(6200 BAU) reinforces effective SLIT dosing level. Allergy. 2016;71:1782-6.
20. Bachert C, Larché M, Bonini S, Canonica GW, Kündig T, Larenas-Linnemann D, et al. Allergen immunotherapy on the way to product based evaluation -a WAO statement. World Allergy Organ J. 2015;8:29.
21. Larenas-Linnemann D, Matta JJ, Shah-Hosseini K, Michels A, Mosges R. Skin prick test evaluation of Dermatophagoides pteronyssinusdiagnostic extracts from Europe, Mexico, and the United States. Ann Allergy Asthma Immunol. 2010;104:420-5.
22. Larenas-Linnemann D, Esch R, Plunkett G, Brown S, Maddox D, Barnes C, et al. Maintenance dosing for sublingual immunotherapy by prominent European allergen manufacturers expressed in bioequivalent allergy units. Ann Allergy Asthma Immunol. 2011;107:448-58.
23. Esch RE. Evaluation of allergen vaccine potency. Curr Allergy Asthma Rep. 2006;6:402-6.
24. Akdis M, Akdis CA.Mechanisms of allergen-specific immunotherapy: multiple suppressor factors at work in immune tolerance to allergens. J Allergy Clin Immunol. 2014;133:621-31.
25. Li JT, Bernstein DI, Calderon MA, Casale TB, Cox L, Passalacqua G, et al. Sublingual grass and ragweed immunotherapy: clinical considerations -a PRACTALL consensus report. J Allergy Clin Immunol. 2016;137:369-76.
26. Canonica GW, Bachert C, Hellings P, Ryan D, Valovirta E, Wickman M, et al. Allergen Immunotherapy (AIT): a prototype of Precision Medicine. World Allergy Organization Journal. 2015; 8:31.
27. van Ree R, Chapman MD, Ferreira F, Vieths S, Bryan D, Cromwell O, et al. The CREATE project: development of certified reference materials for allergenic products and validation of methods for their quantification. Allergy. 2008;63:310-26.
28. Zavadniak AF, Rosário Filho NA, Arruda LK, Castro FFM, Solé D, Aun WT, et al. Evaluation of the potency of commercially available Dermatophagoides pteronyssinus allergenic extracts for immunotherapy. Rev bras alerg imunopatol. 2004;27:46-54.