Número Atual: Janeiro-Março 2018 - Volume 2 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Aplicações práticas de uma plataforma multiplex para detecção de IgE específica por componentes alergênicos em doenças alérgicas
Practical applications of a multiplex platform for specific IgE detection based on allergenic components in allergic diseases
Renata Rodrigues Cocco1; Herbert José Chong Neto2; Marcelo Vivolo Aun3; Antonio Carlos Pastorino4; Gustavo Falbo Wandalsen1; Lillian Sanches Lacerda Moraes5; Bárbara Gonçalves Silva6; Bruno Acatauassu Paes Barreto7; José Carlison Santos Oliveira8; Jackeline Motta Franco9; Ekaterini Simoes Goudouris10
1. Universidade Federal de Sao Paulo, Disciplina de Alergia e Imunologia Clínica, Departamento de Pediatria - Sao Paulo, SP, Brasil
2. Universidade Federal do Paraná, Departamento de Pediatria - Curitiba, PR, Brasil
3. Faculdade Israelita de Ciências da Saúde Albert Einstein, Disciplina Agente-Hospedeiro - Sao Paulo, SP, Brasil. Faculdade de Medicina da Universidade de Sao Paulo, Disciplina de Imunologia Clínica e Alergia - Sao Paulo, SP, Brasil
4. Hospital de Clínicas da Faculdade de Medicina da Universidade de Sao Paulo, Unidade de Alergia e Imunologia do Departamento de Pediatria - Sao Paulo, SP, Brasil.
5. Universidade Federal do Mato Grosso, Departamento de Pediatria - Cuiabá, MT, Brasil
6. Fleury Medicina e Saúde, Centro de Pesquisa e Desenvolvimento do Fleury Medicina e Saúde - Sao Paulo, SP, Brasil
7. Universidade do Estado do Pará, Departamento de Pediatria - Belém, PA, Brasil. Centro Universitário do Estado do Pará, Departamento de Pediatria - Belém, PA, Brasil
8. Universidade Federal da Bahia, Serviço de Alergia e Imunologia - Salvador, BA, Brasil
9. Universidade Federal de Sergipe, Departamento de Pediatria - Aracaju, SE, Brasil
10. Faculdade de Medicina da Universidade Federal do Rio de Janeiro, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Renata Rodrigues Coccorecocco@hotmail.com
Submetido em: 24/09/2017
Aceito em 10/02/2018
Conflito de interesses: os autores referem ter recebido "fee" da ThermoFisher Diagnostic por consultoria técnico-científica.
RESUMO
As doenças alérgicas destacam-se entre as principais doenças crônicas nao transmissíveis das últimas décadas. O avanço da biologia molecular, por sua vez, permite melhor compreensao sobre os mecanismos envolvidos na fisiopatologia das doenças, e consequente aprimoramento no diagnóstico. A identificaçao de componentes alergênicos específicos, recombinantes ou purificados, possibilita um conhecimento mais específico do perfil de sensibilizaçao do paciente alérgico, inferindo informaçoes relevantes na investigaçao de alergias mediadas por IgE. Paralelamente, a utilizaçao de plataformas multiplex viabiliza a detecçao simultânea de dezenas de componentes alergênicos, otimizando a investigaçao de pacientes polissensibilizados. A compreensao de instrumentos laboratoriais que permitam detectar a presença de IgE, suas vantagens, desvantagens e aplicabilidade clínica sao fundamentais para melhor controle do paciente alérgico e manejo terapêutico. Esta revisao tem como objetivo descrever os principais dados publicados sobre o papel das plataformas multiplex (ImmunoCAP ISAC®) em diferentes situaçoes clínicas relacionadas a doenças alérgicas.
Descritores: Imunoglobulina E, diagnóstico, alérgenos, hipersensibilidade, biologia molecular.
INTRODUÇAO
As doenças alérgicas ocupam posiçao de destaque entre as publicaçoes médicas científicas nas últimas décadas, dada sua crescente incidência e impacto na qualidade de vida dos doentes acometidos. Atualmente, estas doenças sao consideradas manifestaçoes de desregulaçao imunológica que decorrem de fatores genéticos e ambientais, culminando em uma vasta gama de sintomas relacionados ao acometimento de diferentes órgaos e sistemas.
No contexto imunológico, a imunoglobulina E (IgE) específica apresenta papel central. A presença de IgE na membrana de mastócitos pode representar um estado de sensibilizaçao (na ausência de sintomas) ou desencadear doença pela liberaçao de mediadores inflamatórios após o contato com o alérgeno. A detecçao destes anticorpos é, portanto, um instrumento valioso para o diagnóstico, e deve ser sempre interpretada à luz da história clínica. O diagnóstico em alergia é importante na prática diária para orientar medidas e lidar especificamente com os alérgenos por meio de dietas de eliminaçao, controle ambiental e imunoterapia alergeno-específica1.
A IgE sérica total parece estar correlacionada com a complexidade do repertório de IgE2e a mensuraçao de IgE específica (in vivo ouin vitro), muito útil para avaliar a sensibilizaçao a alérgenos. Até há alguns anos, os únicos testes laboratoriais in vitro disponíveis para detectar a presença de IgE específica utilizavam extratos alergênicos compostos por diversos antígenos simultâneos. A reduzida especificidade para cada uma das proteínas alergênicas acarreta uma série de dificuldades inerentes à sua capacidade de diferenciar sensibilizaçao primária e reatividade cruzada, bem como de estabelecer significado clínico para os resultados positivos.
O avanço da biologia molecular permitiu a identificaçao individual de proteínas relevantes do ponto de vista imunológico (ligaçao com IgE), alérgenos semelhantes dispostos em diferentes fontes alergênicas (pan-alérgenos), assim como marcadores de gravidade de reaçoes, de presença e persistência da doença. Denominadas "componentes proteicos para diagnóstico" (sigla em inglês: CRD -component-resolved diagnosis), as fraçoes proteicas recombinantes, naturais ou purificadas, se tornaram disponíveis na prática clínica, permitindo maior acurácia no diagnóstico das doenças alérgicas1.
Em paralelo, foram desenvolvidos os microarrays(ou plataformas multiplex) que permitiram que os componentes moleculares pudessem ser analisados concomitantemente. Por se apresentarem em forma de "miniatura de chips", o método reduz o ônus da produçao das proteínas recombinantes, assim como a quantidade de soro necessária para o teste3.
A plataforma microarraydisponível comercialmente para detecçao de IgE para 112 componentes proteicos, provenientes de 51 diferentes fontes alergênicas, é denominada ImmunoCAP ISAC®(Thermo Fisher Scientific, Uppsala, Suécia). Trata-se de um método semiquantitativo capaz de prover informaçoes extensas e detalhadas acerca do perfil de pacientes alérgicos, sobretudo em situaçoes complexas ou de polissensibilizaçao4. Sua indicaçao precisa e a interpretaçao criteriosa de seus resultados visam impedir um ônus indevido por conta de restriçoes dietéticas inadequadas e/ou desnecessariamente amplas, além de terapêuticas medicamentosas desnecessárias.
O objetivo deste trabalho foi realizar uma revisao narrativa da literatura e apresentar indicaçoes, contraindicaçoes e propostas de aplicabilidade prática do ImmunoCAP ISAC® em diferentes situaçoes clínicas relacionadas a doenças alérgicas.
PACIENTES COM ALTOS NIVEIS DE IgE
A imunoglobulina E (IgE) é um isotipo produzido primariamente por plasmócitos, nos tecidos linfoides associados às mucosas (MALT). Quase indetectável ao nascimento e presente em níveis muito baixos no plasma, costuma estar elevada em pacientes geneticamente predispostos para o desenvolvimento de doenças atópicas como asma, rinite alérgica e, sobretudo, dermatite atópica, sendo, por isso, considerada um marcador para estas doenças. Níveis elevados de IgE plasmática total na infância podem estar associados à presença de asma em etapa posterior da vida, assim como níveis elevados na adolescência podem estar associados a hiper-responsividade brônquica5,6.
No entanto, a IgE total, isoladamente, nao se apresenta como um marcador fidedigno de atopia. Algumas doenças que cursam com desregulaçao imunológica com polarizaçao para o perfil Th2 (parasitoses intestinais e cutâneas), bem como algumas imunodeficiências (síndrome de Wiscott-Aldrich, síndrome de Hiper-IgE) também podem cursar com níveis muito elevados de IgE total plasmática7,8.
O algoritmo diagnóstico para as doenças alérgicas nao difere das demais patologias no que diz respeito à semiologia. História clínica criteriosa, exame físico completo e, na suspeita de atopia, exames para detectar IgE específica, in vivo(testes cutâneos de leitura imediata) ou in vitro(séricos) sao os passos para adequada investigaçao diagnóstica e abordagem terapêutica destas doenças9.
Porém, nao rara é a situaçao em que pacientes com elevados níveis de IgE total (superiores a 5.000 IU/mL, considerando que 1U = 2,4 nanogramas de IgE) apresentam resultados positivos para vários alérgenos (alimentares e/ou ambientais), quando analisados por meio da pesquisa de IgE sérica específica (ImmunoCAP). A presença de IgE específica denota haver sensibilizaçao a estes alérgenos, mas nao necessariamente reatividade clínica a eles, ou a todos eles10.
Recentes estudos apontam que pacientes com doenças alérgicas como asma, rinite alérgica e dermatite atópica, sobretudo aqueles multissensibilizados e com elevados níveis de IgE total, podem se beneficiar da análise da IgE específica por componentes moleculares (ImmunoCAP ISAC®). Como detalhado mais adiante neste texto, características de diferentes componentes alergênicos podem nortear a especificidade da sensibilizaçao, presença de reatividade cruzada, gravidade e prognóstico das reaçoes, contribuindo para melhor acurácia no diagnóstico e manejo medicamentoso e nutricional11.
ALERGIA ALIMENTAR MULTIPLA
Estima-se que a prevalência das alergias a alimentos está em torno de 4 a 8% da populaçao infantil, e em até 4% da populaçao adulta12. Mecanismos imunológicos IgE mediados e nao IgE mediados estao envolvidos, produzindo diferentes tipos de manifestaçoes clínicas. A sensibilizaçao a múltiplos alimentos é relativamente comum, particularmente naquelas doenças em que há elevados valores de IgE, tal como a dermatite atópica (DA)12.
A confirmaçao diagnóstica de alergia a um determinado alimento demanda exposiçao controlada a este alimento. O principal benefício de um teste laboratorial na investigaçao de alergias alimentares seria a tentativa de isentar o paciente do teste de provocaçao oral e seus inerentes riscos.
A avaliaçao de alergias alimentares múltiplas requer uma abordagem diferente das situaçoes em que um ou dois alimentos estao envolvidos. A multissensibilizaçao a alimentos geralmente envolve a presença de alérgenos de estrutura semelhante, encontrados em diferentes fontes alergênicas, inter ou intraespécies.
A utilizaçao de testes com extratos naturais (mixde proteínas) pode revelar a presença de anticorpos sem reatividade clínica secundária. A mensuraçao de IgE para componentes proteicos permite melhor conhecimento do repertório individual de sensibilizaçao, e pode ser realizado para um único, para poucos, ou para múltiplos componentes. A avaliaçao múltipla é indicada em pacientes polissensibilizados a alimentos derivados de plantas (frutas, trigo, soja, castanhas, amendoim), polens e/ou látex, como exemplos13.
Neste contexto, o ISAC permitiria o conhecimento do perfil do paciente polissensibilizado e um possível prognóstico sobre a gravidade das reaçoes, com base no componente reagente (proteínas de estocagem, LTP, PR-10, profilinas, CCD). Seus resultados sao comparáveis aos encontrados no ImmunoCAP (fluorescência enzimática), apesar da menor sensibilidade (método semiquantitativo). Situaçoes em que alérgenos alimentares e respiratórios estejam envolvidos concomitantemente representam indicaçao precisa para avaliaçao pelo ISAC4.
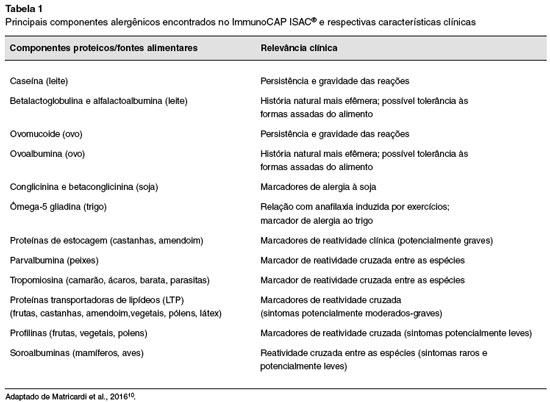
A identificaçao do componente alergênico responsável pelas reaçoes funciona como importante instrumento na assertividade de informaçoes, como gravidade dos sintomas, história natural da doença, chance de reatividade cruzada e de reatividade clínica (marcadores de alergia). A Tabela 1 resume as principais características clínicas associadas a alguns dos principais CRD encontrados no ImmunoCAP ISAC®.
As prolaminas sao as principais proteínas de estocagem da maioria das sementes de cereais e, como tal, sao uma importante fonte de proteína na dieta humana e de animais. Além disso, as prolaminas de trigo sao os principais componentes do glúten, cujas propriedades determinam a qualidade da farinha de trigo utilizada em vários processos tecnológicos, incluindo panificaçao. As albuminas 2S, grupo de proteínas de estocagem presentes em alimentos vegetais, castanhas, leguminosas, sementes de óleo e cereais, estao relacionadas a sintomas clínicos importantes14.
As profilinas sao exemplos de pan-alérgenos identificadas em pólen de árvores, gramíneas e ervas daninhas, em alimentos derivados de plantas e no látex. Desta forma, a sensibilizaçao à profilina é um fator de risco para reaçoes alérgicas a múltiplas fontes de pólen e alérgenos alimentares15. Por serem sensíveis à desnaturaçao por calor e digestao gástrica, dificilmente a sensibilizaçao ocorre pelo trato gastrointestinal. De fato, o consumo de alimentos crus por pacientes sensibilizados pela profilina leva a reaçoes que geralmente sao leves e restritas à cavidade oral16.
As proteínas de transferência de lipídeos (LTPs) sao uma parte da superfamília de prolaminas, e estao localizadas na casca de frutas, mais do que na polpa, o que pode explicar por que alguns indivíduos sensibilizados com LTPs podem tolerar mais facilmente os frutos após serem descascados17. As LTPs também foram identificadas no pólen de árvores e ervas daninhas, alimentos derivados de plantas e no látex, o que justifica a possível reatividade entre as espécies. O potencial alergênico das LTPs é influenciado por vários fatores, como sua localizaçao genuínos, com capacidade para induzir sintomas graves, por resistirem ao processamento de alimentos e ao ambiente agressivo do trato gastrointestinal (alta resistência ao calor e à proteólise)18. A sensibilizaçao aos LTPs é caracterizada por diferenças geográficas e, presumivelmente, várias vias de sensibilizaçao estao muitas vezes associadas a sintomas graves de alergia alimentar.
ESOFAGITE EOSINOFILICA
Esofagite eosinofílica (EEo) é uma doença inflamatória crônica do esôfago, imunologicamente mediada, caracterizada histologicamente por inflamaçao com predomínio de eosinófilos. É a causa mais comum de esofagite crônica após a doença do refluxo gastroesofágico, levando a sintomas de disfagia e impactaçao de alimentos em crianças e adultos jovens. O tratamento consiste em dieta de e estabilidade à desnaturaçao proteolítica e térmica. exclusao de 4 ou 6 alimentos, corticosteroides orais, Além disso, podem atuar como alérgenos alimentares antileucotrienos e dilataçao esofágica19.
Crianças com EEo sao frequentemente polissensibilizadas tanto a aeroalérgenos como a alimentos, no entanto, a relaçao entre os sintomas e a sensibilizaçao pode nao ser tao evidente11. Em adultos, um estudo identificou que os alérgenos predominantemente envolvidos foram gramíneas, polens e proteínas transportadoras de lipídeos (LTP) de pêssego, avela e Artemisia 20.
A hipersensibilidade mediada por células parece ter papel mais importante na patogênese da EEo do que a IgE23. Sendo assim, o valor dos testes in vivo e in vitropara identificar alérgenos alimentares relevantes na EoE sao limitados, o que faz com que a dieta de eliminaçao, seguida de reintroduçao do alimento, com biópsias esofágicas de controle, sejam a maneira mais adequada para avaliar a melhora/piora da inflamaçao local relacionada a diferentes alimentos24. Portanto, a identificaçao da etiologia por meio de dieta de eliminaçao de alimentos requer múltiplas endoscopias, o que pode afetar sobremaneira a qualidade de vida dos pacientes. Além disto, as dietas sao extensas, difíceis de implementar (6 grupos de alimentos) e de palatabilidade ruim (dietas elementares).
A estratégia de medir IgE para componentes de alérgenos por meio da nova tecnologia CRD foi recentemente avaliada como possível guia para o manejo da dieta de eliminaçao na EEo. Um estudo avaliou 67 pacientes com EEo, 50 com alergia a pólen e 50 controles saudáveis, todos submetidos a análise pela tecnologia do microarray. Apenas sete entre os 67 pacientes com EEo nao apresentaram positividade no exame. Entre os demais, os alérgenos predominantes incluíram polens (59,5%), LTP do pêssego (19,40%), avela (17,91%) e Artemisia(19,40%). Neste estudo, observou-se que a melhora da inflamaçao avaliada por biópsia esofágica após suspensao do alimento foi mais favorável naqueles pacientes cuja dieta foi direcionada pelos CRD. No entanto, os autores alertam para a necessidade de mais estudos randomizados e controlados que comprovem estes achados20.
DERMATITE ATOPICA
A dermatite atópica (DA) é uma doença alérgica complexa caracterizada por processo inflamatório crônico e recorrente na pele, no qual estao envolvidos desregulaçao imunológica (com alteraçoes relacionadas à IgE e nao relacionadas à IgE), assim como disfunçao da barreira cutânea23.
Pacientes com DA em geral sao polissensibilizados a diversos alérgenos, apresentando complexos perfis de IgE específica24, tendo sido detectada correlaçao significativa entre valor de IgE sérica total e número de alérgenos25. A DA está relacionada à sensibilizaçao a aeroalérgenos, particularmente ácaros, em mais de 85% dos casos26.
A sensibilizaçao a alimentos (presença de IgE específica) é bastante comum em pacientes com DA, ocorrendo em 30 a 80% dos casos27. Em crianças, estima-se que exista associaçao com alergia alimentar (clínica relevante associada a um alimento) em aproximadamente um terço dos casos de DA, particularmente nos casos de maior gravidade e em lactentes28. Em adultos, a associaçao com alergia alimentar é incomum29.
Os alimentos mais comumente implicados na infância sao clara de ovo e leite de vaca, que correspondem a cerca 80% dos agentes comprovados em testes de provocaçao30.
O tratamento habitual da DA inclui cuidados com a pele, controle ambiental, medicaçoes tópicas e sistêmicas30. Mais recentemente, a DA tem sido incluída entre as indicaçoes de imunoterapia alérgeno-específica, entretanto sao necessários estudos randomizados e controlados mais amplos para definir melhores indicaçoes e real eficácia deste método terapêutico31. Dietas de exclusao de um ou mais alimentos habitualmente sao indicadas quando há evidências clínicas de que alimentos estejam implicados, ou como prova terapêutica em casos nao responsivos ao tratamento habitual, particularmente naqueles de maior gravidade em crianças de menor faixa etária. Entretanto, há evidências mais recentes de que alergia alimentar deva ser investigada em crianças com DA persistente, independentemente da resposta ao tratamento e da gravidade32.
A investigaçao em alergia alimentar habitualmente nao está indicada em pacientes com quadros leves de DA. Pacientes com DA moderada a grave e/ou com relato de exacerbaçao do quadro após exposiçao a um determinado alérgeno sao mais beneficiados com a investigaçao30.
A avaliaçao de sensibilizaçao alergênica na DA pode ser feita in vivo, por meio de testes cutâneos de puntura de leitura imediata ou testes de contato; estes últimos, no entanto, nao estao recomendados rotineiramente, uma vez que nao se encontram padronizados30. A investigaçao de alérgenos também pode ser realizada in vitro por meio da pesquisa de IgE específica no soro.
A sensibilizaçao a múltiplos alimentos é frequente em pacientes com DA que apresentem altos valores de IgE sérica33. Entretanto, é relevante frisar que a detecçao de IgE específica para um alimento ou seus componentes nao implica necessariamente em representatividade clínica, que deve ser confirmada por meio de eliminaçao e reexposiçao ao(s) alergeno(s) em questao32,34. A avaliaçao etiológica da DA, doença com ciclos de melhora e de piora relacionados a uma grande multiplicidade de fatores, pode ser tarefa bastante difícil35,36.
O diagnóstico molecular é capaz de identificar sensibilizaçao a alérgenos naturais ou recombinantes, e permite diferenciar entre alergia genuína ou reatividade cruzada em pacientes polissensibilizados, orientando o tratamento direcionado a alérgenos e identificando o risco de anafilaxia a algumas proteínas alimentares24,34. Exemplo disto é a sensibilizaçao ao ovo, bastante comum em pacientes com DA, estimada em torno de 35 a 73%. A presença de IgE específica para o componente ovomucoide pode auxiliar na diferenciaçao entre alergia e sensibilizaçao, além de estar associada à persistência da alergia37.
Campana et al. descreveram melhor correlaçao entre o ImmunoCap ISAC® e testes cutâneos para alimentos do que com a pesquisa de IgE por ImmunoCap® em crianças com DA moderada a grave, sugerindo maior especificidade da pesquisa por microarray24. Fung et al.38 demonstraram boa correlaçao entre dosagem de IgE para componentes por microarray e suspeita de alergia alimentar em pacientes com DA. Demonstraram, também, que alguns componentes sao melhores para discriminar alergia de sensibilizaçao, e que sensibilizaçao a maior número de componentes seria um bom indicador de alergia. No entanto, mais e maiores estudos sao necessários para que se estabeleça a real utilidade da pesquisa de IgE específica por microarray(ImmunoCAP ISAC®) na investigaçao da DA39.
ASMA
A asma é uma doença crônica comum no Brasil, com elevada prevalência em todas as faixas etárias. O manejo da asma é complexo e envolve a identificaçao dos agentes causais e de fatores de risco, educaçao do paciente e sua família, tratamento farmacológico para controle de sintomas e reduçao de risco, tratamento das exacerbaçoes e acompanhamento prolongado. O manejo da asma é particularmente complexo em uma pequena parcela dos pacientes (entre 5 a 10%) que apresenta dificuldades no controle da doença. Estes pacientes com asma grave ou de difícil controle, abordados neste texto como apresentando asma grave, sao responsáveis pela maior parte dos custos diretos e indiretos da doença, e sao aqueles mais suscetíveis às complicaçoes da doença40.
Dentro das etapas iniciais de avaliaçao de pacientes com asma grave, devemos confirmar o diagnóstico, verificar a adesao ao tratamento, corrigir a técnica e as doses das medicaçoes utilizadas, tratar as possíveis comorbidades e identificar fatores desencadeantes41. Em relaçao aos fatores desencadeantes, a pesquisa de sensibilizaçao alérgica é parte importante da avaliaçao do paciente com asma, possibilitando a orientaçao de medidas preventivas e, quando indicado, de imunoterapia específica.
O padrao eosinofílico presente na asma pode representar um padrao de melhor resposta a corticoides em relaçao ao padrao neutrofílico e/ou paucicelular. A diferenciaçao laboratorial dos padroes inflamatórios inclui a dosagem de IgE total e a pesquisa de IgE específica, tanto pelo teste cutâneo de hipersensibilidade imediata (prick test) como pelo estudo das IgEs específicas no soro para aeroalérgenos e alimentos. Além disso, a identificaçao de sensibilizaçao a certos alérgenos já foi associada a maior gravidade e persistência da asma, de maneira que estes alérgenos podem atuar como biomarcadores da asma grave40.
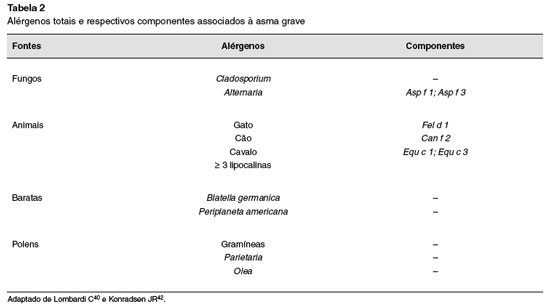
A utilizaçao das plataformas multiplex na asma, especialmente nas formas graves ou de difícil controle, tem sido alvo de diversos estudos. Lombardi et al.40, em 2017, apresentaram uma revisao da literatura sobre a importância da sensibilizaçao alergênica na asma grave, descrevendo os principais alérgenos envolvidos. A sensibilizaçao a fungos se associa com asma mais grave, hospitalizaçao em adultos e hiper-responsividade em crianças. Cladosporiume Alternariarespondem pelas espécies mais relacionadas à asma persistente e grave, e os componentes Asp f 1e/ou Asp f 3sao associados a asma alérgica. As crianças com asma grave e sensibilizadas a fungos costumam apresentar maior necessidade de corticosteroides orais.
Em relaçao aos polens, os autores demonstraram que a prevalência da asma é maior nos pacientes sensibilizados a esses agentes, e com maior gravidade naqueles com sensibilizaçao para polens-frutas. Apontam, ainda, uma relaçao entre tempestades de polens e crises graves de asma, onde Parietaria, gramíneas e Olea, associados a agentes poluentes, respondem como os principais desencadeantes40.
Entre os animais domésticos, a literatura tem demonstrado que a presença de sensibilizaçao a três ou mais componentes de animais é fortemente associada com asma grave ou nao controlada. A explicaçao para a reatividade cruzada entre cao, gato e cavalo está relacionada à sensibilizaçao ao componente lipocalina (Can f 6 e Fel d 4). Os componentes Fel d 1 e Can f 2 estao associados à presença de asma; Can f 3, à gravidade da rinite; e Equ c 3, à gravidade da asma40. A Tabela 2 descreve os principais alérgenos totais e respectivos componentes associados à asma grave.
Outro estudo tipo caso controle desenvolvido na Suécia por Konradsen et al.42 também demonstrou maior associaçao entre asma grave e componentes de alérgenos do gato, cao e cavalo, o que nao foi identificado quando se utilizaram extratos completos. Neste estudo, a sensibilizaçao a três ou mais lipocalinas associou-se fortemente à asma grave.
Borres et al.43descreveram que, para o gato, o componente Fel d 1é considerado o componente de sensibilizaçao primária mais relacionado à asma e até 90% dos alérgicos ao gato apresentam IgE específica para Fel d 1. O componente Fel d 2, relacionado à albumina sérica do gato, pode representar reaçao cruzada com albuminas de outros animais, como Can f 3 (cao), Equ c 3 (cavalo), Sus s PSA(porco) e Bos d 6(vaca), mas com menor chance de reatividade clínica. Para o cao, os componentes relacionados à sensibilizaçao primária sao Can f 1, Can f 2 e Can f 5. A sensibilizaçao às baratas (Blatella sp e Periplaneta sp) acarreta maior morbidade, associaçao com maior gravidade, pior controle dos sintomas e maior risco de idas a serviços de emergência40. A sensibilizaçao para alimentos foi importante apenas para a asma ocupacional em trabalhadores da indústria alimentícia, onde o trigo e seus componentes (LTP, Tri a 14, alfa amilase) sao mais importantes que os do glúten (glutenina, ômega 5 gliadina), na revisao realizada por Lombardi et al.40.
Em estudo multicêntrico desenvolvido por Patelis et al.44, 467 pacientes adultos europeus (371 sem asma e 96 com asma) foram avaliados por meio de plataforma multiplex para 103 componentes alergênicos. Os resultados demonstraram que sensibilizaçao a pelo menos um alérgeno estava presente em 70% dos asmáticos e 40% dos nao asmáticos. A presença de múltiplas sensibilizaçoes se mostrou preditiva para maior risco de asma, inflamaçao das vias aéreas (mensuradas pela expiraçao de óxido nítrico) e hiperresponsividade brônquica.
Um estudo recente avaliou a pesquisa de sensibilizaçao alérgica em crianças e adolescentes com asma grave por diferentes métodos45. Quando comparadas com dois métodos tradicionais de avaliaçao de sensibilizaçao (ImmunoCAP e prick test), as plataformas multiplex forneceram informaçoes novas e clinicamente relevantes em 47% dos pacientes, incluindo casos de sensibilizaçao a componentes importantes de alimentos, componentes envolvidos na síndrome da alergia oral, marcadores de asma grave e alérgenos "ocultos", incomuns na regiao e nao suspeitos pela história clínica.
Apesar de promissor, ainda nao há consenso sobre as situaçoes onde a pesquisa de sensibilizaçao alérgica por plataforma multiplex deva ser indicada nos pacientes com asma. Fatores como o custo do teste e seu potencial benefício clínico devem ser considerados, com melhor relaçao custo/benefício nos casos graves ou de difícil controle.
RINOCONJUNTIVITE ALÉRGICA
A prevalência da rinite alérgica (RA) pode chegar a 30% na populaçao geral, tornando-a a mais comum doença crônica na populaçao pediátrica46. Em aproximadamente um terço dos casos pode ser acompanhada da asma alérgica47,48. Além do acometimento frequente das vias aéreas inferiores, estima-se que mais da metade dos pacientes com RA apresentem sintomas oculares compatíveis com conjuntivite alérgica, embora frequentemente o quadro ocular seja negligenciado49,50. Estudos recentes sugerem que até 50% da populaçao pode apresentar sintomas sugestivos de alergia ocular, o que se denomina rinoconjuntivite alérgica (RCA)51. Dados nacionais apontam ainda que, comparando pacientes asmáticos atópicos e nao atópicos, a frequência de sintomas nasais nao diferia entre os grupos, mas a presença de sintomas oculares era associada ao fenótipo alérgico52.
Há ainda poucos estudos acerca da pesquisa de sensibilizaçao a componentes alergênicos neste grupo de pacientes. Em um estudo realizado em Cingapura, pacientes atópicos com RA, asma e DA foram avaliados. Os autores verificaram que a sensibilizaçao a ácaros foi associada ao fenótipo de RA, mas o ISAC nao demostrou ser útil como ferramenta de triagem, caso a suspeita principal (clínica ou epidemiológica) fosse de monossensibilizaçao53. Jung et al., na Coreia, mostraram que a concordância entre ISAC e ImmunoCAP é bastante elevada para os ácaros Dermatophagoides sp, mas o mesmo nao ocorreu com os polens de bétula ou com o fungo Alternaria alternata, para os quais a sensibilidade do ImmunoCAP foi superior ao ISAC54.
O número de sensibilizaçoes a alérgenos parece funcionar como parâmetro na distinçao entre paciente com RA apenas daqueles com predisposiçao também à asma. Resultados de uma coorte britânica demonstraram que crianças com rinoconjuntivite eram mais sensibilizadas a ácaros e polens, enquanto as asmáticas eram sensibilizadas nao só a essas duas fontes de antígenos, mas também a epitélios de animais55. Um estudo em atletas de elite participantes das Olimpíadas de Pequim avaliou 72 indivíduos polissensibilizados por meio do ImmunoCAP ISAC® 56. Além de distinguir alergias genuínas e sensibilizaçao por reatividade cruzada, o método confirmou que o fenótipo RCA era mais associado à monossensibilizaçao, ao passo que asmáticos eram mais frequentemente polissensibilizados.
Em Curitiba, 101 crianças com RA realizaram teste cutâneo para o pólen de Lolium multiflorum, entre outros aeroalérgenos, e dosagem de IgE específica por plataforma multiplex ImmunoCAP ISAC®versao 103. A sensibilizaçao alérgica ao pólen de Lolium multiflorumdeterminada por teste cutâneo alérgico foi de 14,9%; a sensibilizaçao aos componentes de gramíneas mais frequentes foram Cyn d 1em 16,8%, Phl p 1e Phl p 4 em 14,8% e 12,9%, respectivamente57.
Em relaçao aos ácaros, a sensibilizaçao a Dermatophagoides spe Blomia tropicalisapresenta acurácia semelhante pelo ISAC quando comparado ao ImmunoCAP e testes de puntura. Além disso, os componentes Der p 1e Der p 2se correlacionam com atopia e níveis séricos de IgE para Der p, diferentemente dos componentes Der p 10e MUXF3 (bromelina)58,59.
Em relaçao à sensibilizaçao a fungos, nao há estudos realizados especificamente em RCA utilizando a técnica microarray. Um estudo retrospectivo em crianças com RCA ou asma comparou o componente Alt a 1dosado pelo método ImmunoCAP e a fonte de alérgeno Alternaria sp. Os resultados apontaram que a acurácia de ambos é bastante comparável, sugerindo que qualquer um poderia ser utilizado para avaliar sensibilizaçao60.
A semelhança do que é descrito para asma, alérgenos de animais ditos "peludos" podem estar associados a RCA. O principal fato a ser conhecido pelo médico assistente ao paciente exposto ou sensibilizado a animais domésticos, particularmente cao e gato, é a de que as albuminas (exemplos Fel d 2, Can f 3) sao proteínas que nao acarretam sintomas e apresentam reatividade cruzada entre si, ao passo que as lipocalinas (Can f 1 e Can f 2) e secretoglobinas (Fel d 1) sao associadas a reatividade clínica e nao compartilham mimetismo molecular. Neste contexto, foi sugerido que o ImmunoCAP ISAC®poderia ser indicado com vistas a diferenciar sensibilizaçao de alergia, ou mesmo para avaliar indivíduos de maior risco para futura reatividade, de acordo com o grau de exposiçao61. Nessa mesma linha, uma coorte sueca recentemente publicada revelou que os componentes Fel d 1 e Can f 1documentados pelo chipmultiplex eram melhores preditores da evoluçao da alergia do que os extratos de gato e cao62.
A plataforma multiplex tem sido utilizada na detecçao de sensibilizaçao precoce para componentes de polens e posterior desenvolvimento de RA. Em uma coorte alema de nascidos vivos, foi aplicado questionário e coletada amostra de sangue de 820 crianças com 1, 2, 3, 5, 6, 7, 10 e 13 anos. Diagnóstico de RA sazonal relacionada ao pólen foi realizado de acordo com sintomas nasais. Anticorpos IgE específicos para Phleum pratensese 8 componentes foram realizados por ImmunoCAP®e plataforma multiplex. Cento e setenta e sete desenvolveram RA sazonal. A sensibilizaçao ao Phl p 1foi precoce e a mais comum (78%) nas crianças com RA. A sensibilizaçao aos 3 anos apareceu como fator preditivo de rinite alérgica aos 12 anos63.Westman e cols.64 realizaram estudo com 764 crianças com plataforma multiplex para detecçao de IgE específica para investigaçao da patogênese de IgE para proteínas da família PR-10 e RA à bétula aos 16 anos. O risco de persistência de RA à Bet v 1aos 16 anos foi oito vezes maior (OR = 8,2) quando a criança apresentava sensibilizaçao a PR-10 aos 4 anos.
O uso dos CRD também pode modificar a indicaçao de imunoterapia específica na RA por polens65. Além disso, a diminuiçao dos níveis de IgE, associada ao aumento de IgG4 específica podem nortear a eficácia do tratamento66.
Dois estudos recentes utilizaram a técnica multiplex para detecçao dos componentes alergênicos na lágrima em pacientes com alergia ocular, sendo um deles um relato de caso67, e o outro, um artigo de uma série de 10 pacientes com ceratoconjuntivite vernal68. Ambos demonstraram que a IgE específica por componentes é quantificável pelo método ISAC na lágrima, e pode diferir dos resultados da IgE específica sérica. Esses dados sugerem que, num futuro próximo, os CRD em secreçoes possam ser incorporados e colaborar no diagnóstico etiológico das doenças alérgicas, particularmente em quadros complexos, como a ceratoconjuntivite vernal.
ANAFILAXIA E ALERGIA AO LATEX
Assim como as doenças alérgicas de uma maneira geral, a prevalência da anafilaxia está aumentando, atualmente entre 0,05% a 2% da populaçao geral69. Seu diagnóstico, embora eminentemente clínico, é subestimado em cerca de 80% dos pacientes, pois mimetiza doenças como asma brônquica e urticária, e pode se apresentar sem hipotensao70.
A anafilaxia pode envolver mecanismos imunológicos (dependentes ou nao da IgE) e nao imunológicos; pode ser idiopática e confundida com desordens como síndrome carcinoide, feocromocitoma e angioedema, hereditário ou adquirido71. Entre os fatores de risco para a anafilaxia estao o grau de sensibilizaçao para um determinado alérgeno, a qualidade da ligaçao com a IgE, via de contato (cutâneo, trato gastrintestinal, parenteral) e a presença de cofatores69.Tais cofatores podem ser intrínsecos, como as doenças atópicas (31,8%), cardiovasculares (18,5%) e as doenças de pele (0,7%); extrínsecos, como os medicamentos, e, por último, podem ser fatores que modulam diretamente a resposta imunológica, como o exercício (15,9%), ingestao de álcool (1% a 15,2%) e as infecçoes (1,3% a 11%)69. Os quadros de anafilaxia estao mais comumente relacionados a alimentos, medicamentos e picadas de insetos Hymenoptera, e podem estar relacionados ao exercício físico (com ou sem relaçao com alimentos) e desordens mastocitárias clonais70.
O impacto na qualidade de vida nos pacientes com anafilaxias é extremamente negativo, enquanto que, para o médico, a incapacidade de identificar o alérgeno desencadeante pode acarretar a necessidade de realizar investigaçoes a cada novo episódio. A utilizaçao do ImmunoCAP ISAC®pode auxiliar na investigaçao dos quadros de anafilaxia, de modo a reduzir a recorrência dos episódios e melhorar a qualidade de vida do indivíduo.
Em um estudo realizado em 110 pacientes com anafilaxia considerada idiopática submetidos ao ImmunoCAP ISAC®, 55 (48%) nao apresentaram sensibilizaçao a qualquer alérgeno, em 35 pacientes (32%) os alérgenos sensibilizados se mostraram irrelevantes para a anafilaxia, mas para 20% dos pacientes, a identificaçao de componentes como ômega 5 gliadina e alérgenos do camarao acrescentou informaçoes relevantes para o diagnóstico, que direcionaram o manejo terapêutico71.
A anafilaxia induzida pelo exercício (AIE) é responsável por 5 a 10% de todas as causas de anafilaxia, e em aproximadamente metade dos casos, a ingestao de certos alimentos antes da atividade física predispoe às reaçoes. Dentre os alimentos implicados, o mais conhecido é o trigo, e a ômega 5 gliadina, seu componente que é responsável pela AIE71.
A anafilaxia pelo veneno de Hymenoptera, principal causa de anafilaxias por inseto, deve ser investigada nos indivíduos com história suspeita, ainda que apresentem testes cutâneos negativos72. Cerca de 20 a 40% da populaçao geral possui IgE para Hymenoptera, e apenas 0,3 a 7,5% apresentam reaçao sistêmica73. Portanto, resultados positivos podem nao estar relacionados com manifestaçoes clínicas e, na ausência de história clínica compatível, exames positivos nao sao suficientes para predizer o risco de reaçao sistêmica. A pesquisa de IgE para componentes específicos pode aumentar a acurácia do diagnóstico, destacando-se dentre estes a Api m 1 (abelha)74.
A alergia ao látex é situaçao clínica relevante, nao somente pela gravidade dos sintomas, mas pela dificuldade no manejo em situaçoes cotidianas. O diagnóstico é baseado em história e mensuraçao de IgE específica. Neste sentido, a abordagem molecular tem sido muito importante para a identificaçao das proteínas responsáveis por incitar reaçoes, e de componentes relacionados a reaçoes cruzadas com outras fontes alergênicas75.
Entre os 16 diferentes alérgenos da Hevea brasilienses, os componentes Hev b 1, Hev b 3, Hev b 5, Hev b 6.01, Hev b 7, Hev b 8, Hev b 9, Hev b 10 e Hev b 11 encontram-se disponíveis no ImmunoCAP ISAC®. Entre eles, os componentes Hev b 1, Hev b 3, Hev b 5e Hev b 6podem ser considerados marcadores de reaçoes ao látex, enquanto que o Hev b 8(profilina) nao apresenta qualquer relevância clínica76,77.
URTICARIA
Urticárias agudas (com duraçao menor do que seis semanas) respondem pela grande maioria dos quadros de urticária. Sao quadros autolimitados, em que a etiologia é melhor investigada por meio de criteriosa e detalhada história clínica.
No caso das urticárias crônicas e/ou recorrentes, no entanto, a investigaçao diagnóstica é mais complexa, envolvendo a pesquisa de patologias autoimunes, inflamatórias e infecciosas. Alguns estudos ressaltam a indicaçao do ImmunoCAP ISAC®em situaçoes em que mais de 10 alérgenos suspeitos devam ser avaliados para IgE específica78.
CONCLUSOES
A partir do que foi exposto, podemos sugerir que as indicaçoes da pesquisa de IgE específica por microarray(ImmunoCAP ISAC®) para as doenças alérgicas incluem: (1) quadros moderados a graves; (2) história clínica que nao permite identificar pontualmente alérgenos possivelmente implicados; (3) resposta inadequada ao tratamento habitual inicial; (4) IgE total elevada (> 1000); (5) pacientes polissensibilizados; (6) dificuldade para determinar correlaçao entre a resposta clínica a dieta de exclusao e/ou exposiçao a múltiplos alimentos com a sensibilizaçao detectada por meio de outros testes diagnósticos.
A pesquisa de IgE específica por microarray (ImmunoCAP ISAC®) nao está indicada em casos simples, com história clínica clara, em pacientes monossensibilizados ou tao somente para realizar levantamento de perfil de sensibilizaçao a diversos alérgenos, sem que haja relaçao com história clínica.
REFERENCIAS
1. Valenta R, Lidholm J, Niederberger V, Hayek B, Kraft D, Grönlund H.The recombinant allergen-based concept of component-resolved diagnostics and immunotherapy (CRD and CRIT).Clin Exp Allergy. 1999;29:896-904.
2. Willumsen N, Holm J, Christensen LH, Würtzen PA, Lund K. The complexity of allergic patients' IgE repertoire correlates with serum concentration of allergen-specific IgE. Clin Exp Allergy. 2012;42(8):1227-36.
3. Mari A.When does a protein become na allergen? Searching for a dynamic definition based on most advanced technology tools. Clin Exp Allergy. 2008;38:1089-94.
4. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, van Hage M, Baena-Cagnani CE, et al. A WAO - ARIA - GA²LEN consensus document on molecular-based allergy diagnostics.World Allergy Organ J. 2013;6(1):17.
5. Liu AH, Martinez FD. Natural History of Allergic Diseases and Asthma. In: Leung DYM, et al. Pediatric Allergy: Principles and Practice. 3ª ed. New York: Elsevier. p:7-17.
6. Oettgen HC. Regulation and Biology of Immunoglobulin E. In: Leung DYM et al. Pediatric Allergy: Pediatric Allergy: Principles and Practice. 3ª ed. New York: Elsevier. p. 31-40.
7. Blank U, Falcone FH, Nilsson G. The history of mast cell and basophil research -some lessons learnt from the last century. Allergy. 2013;68:1093-101.
8. Williams KW, Milner JD, Freeman, AF. Eosinophilia associated with disorders of immune deficiency or immune dysregulation. Immunol Allergy Clin North Am. 2015;35(3):523-44.
9. Hamilton RG. Laboratory Diagnosis of Human Allergic Disease. In: Leung DYM, et al. Pediatric Allergy: Principles and Practice. 3ª ed. New York: Elsevier. p. 167-76.
10. Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, et al. EAACI molecular allergology user's guide.Pediatr Allergy Immunol. 2016;27:Suppl 23:1-250.
11. Patelis A, Borres MP, Kober A, Berthold M. Multiplex componentbased allergen microarray in recent clinical studies. Clinical & Experimental Allergy. 2016;46:1022-32.
12. Sicherer SH, Sampson HA. Food allergy: epidemiology, pathogenesis, diagnosis, and treatment. J Allergy Clin Immunol. 2014;133(2):291-307.
13. Santos AF, Brough HA.Making the most of in vitro tests to diagnose food allergy. J Allergy Clin Immunol Pract. 2017;5(2):237-48.
14. Moreno FJ, Clemente A. 2S Albumin storage proteins: what makes them food allergens? The Open Biochemistry Journal. 2008;2:16-28.
15. Asero R, Mistrello G, Roncarolo D, Amato S, Zanoni D, Barocci F, Caldironi G. Detection of clinical markers of sensitization to profilin in patients allergic to plant-derived foods. J Allergy Clin Immunol. 2003;112:427-32.
16. Breiteneder H, Radauer C. A classification of plant food allergens. J Allergy Clin Immunol. 2004;113:821-30.
17. Fernandez-Rivas M, Cuevas M.Peels of Rosaceae fruits havea higher allergenicity than pulps. Clin Exp Allergy. 1999;29:1239-47.
18. Zuidmeer L, van Ree R. Lipid transfer protein allergy: primary food allergy or pollen/food syndrome in some cases. Curr Opin Allergy Clin Immunol. 2007;7:269-73.
19. González-Cervera J, Lucendo AJ. Eosinophilic esophagitis: an evidence-based approach to therapy.J Investig Allergol Clin Immunol. 2016;26(1):8-18.
20. Armentia A, Martin S, Barrio J, Martin B, Garcia JC, Veja JM, et al. Value of microarray allergen assay in the management of eosinophilic oesophagitis. Allergologia et Immunopathologia. 2015;43(1):73-80.
21. Van Rhujn BD, Vlieg-Boerstra BJ, Versteeg AS, Akkerdaas JH, Van Ree R, Terreehorst I, et al. J Allergy Clin Immunol. 2015;136(4):1095-6.
22. Balmer-Weber BK. Value of allergy tests for the diagnosis of food allergy. Dig Dis. 2014;32:84-8.
23. Boguniewicz M, Leung DYM. Atopic Dermatitis. In: Middleton's Allergy Principles and Practice. 8ª ed. Philadelphia: Elsevier; 2014. Cap. 34.
24. Campana R, Dzoro S, Mittermann I, Fedenko E, Elisyutina O, Khaitov M, Valenta R. Molecular aspects of allergens in atopic dermatitis. Curr Opin Allergy Clin Immunol. 2017;17:269-77.
25. Ott H, Weibmantel S, Kennes LN, Merk HF, Baron JM, Folster-Holst R. Molecular microarray analysis reveals allergen - and exotoxinspecific IgE repertoires in children with atopic dermatitis. JEADV. 2014;28:100-7.
26. D'Auria E, Banderali G, Barberi S, Gualandri L, Pietra B, Riva E, Cerri A.Atopic dermatitis:recent insight on pathogenesis and novel therapeutic target. Asian Pac J Allergy Immunol. 2016;34:98-108.
27. Eller E, Kjaer HF, Host A, et al. Food allergy and food sensitization in early childhood: results from the DARC cohort. Allergy. 2009;64(7):1023-9.
28. Eigenmann PA, Sicherer SH, Borkowski TA, et al. Prevalence of IgE mediated food allergy among children with atopic dermatitis. Pediatrics. 1998;101(3):E8.
29. Manam S, Tsakok T, Till S, and Flohr C. The association between atopic dermatitis and food allergy in adults. Curr Opin Allergy Clin Immunol. 2014;14:423-9.
30. Caubet JC, Nowak-Węgrzyn.Atopic dermatites in infants and young children. In: Sampson HA. Mount Sinai Expert Guides. New York: Wiley Blackwell; 2015. Cap.1
31. Cox L, Calderon MA. Allergen Immunotherapy for atopic dermatitis: is there room for debate? J Allergy Clin Immunol Pract. 2016;4(3):435-44.
32. Spergel JM, Boguniewicz M, Schneider L, Hanifin JM, Paller AS. Food allergy in infants with atopic dermatitis: limitations of foodspecific ige measurements. Pediatrics. 2015;136(6):e1530-8.
33. de Bruin Weller MS, Knulst AC, Meijer Y, Bruijnzeel-Koomen CA, Pasmans SG. Evaluation of the child with atopic dermatitis. Clin Exp Allergy. 2012;42(3):352-62.
34. Fedenko E, Elisyutina O, Shtyrbul O, Pampura A, Valenta R, Lupinek C, et al. Microarray-based IgE serology improves management of severe atopic dermatitis in two children. Ped Allergy Immunol. 2016;27(6):645-9.
35. Breuer K, Heratizadeh A, Wulf A, Baumann U, Constien A, Tetau D, et al. Late eczematous reactions to food in children with atopic dermatitis. Clin Exp Allergy. 2004;34:817-24.
36. Werfel T, Ballmer-Weber B, Eigenmann PA, Niggemann B, Rance F, Turjanmaa K, et al. Eczematous reactions to food in atopic eczema: position paper of the EAACI and GA2LEN. Allergy. 2007;62:723-8.
37. Gray CL, Levin ML, Toit G. Egg sensitization, allergy and component patterns in African children with atopic dermatitis. Pediatric Allergy and Immunology. 2016;27(7):709-15.
38. Fung I, Kim JS, Spergel JM.Relating microarray component testing and reported food allergy and food-triggered atopic dermatitis:a realworld analysis. Ann Allergy Asthma Immunol. 2013;110:173-7.
39. Foong RX, Roberts G, Fox AT, du Toit G. Pilot study: assessing the clinical diagnosis of allergy in atopic children using a microarray assay in addition to skin prick testing and serum specific IgE. Clin Mol Allergy. 2016;14:8-14.
40. Lombardi C, Savi E, Ridolo E, Passalacqua G, Canonica GW. Is allergic sensitization relevant in severe asthma? Which allergens may be culprit? World Allergy Organ J. 2017;10:2.
41. Global Initiative for asthma.Global strategy for asthma management and prevention, 2017. Disponível em: www.ginasthma.org.
42. Konradsen JR, Nordlund B, Onell A, Borres MP, Gręonlund H, Hedlin G. Severe childhood asthma and allergy to furry animals: Refined assessment using molecular-based allergy diagnostics. Pediatr Allergy Immunol. 2014;25:187-92.
43. Borres MP, Ebisawa M, Eigenmann PA.Use of allergen components begins a new era in pediatric allergology. Pediatr Allergy Immunol. 2011;22:454-61.
44. Patelis A, Gunnbjörnsdottir M, Malinovschi A, Matsson P, Onell A, Högman M, et al. Population-based study of multiplexed IgE sensitization in relation to asthma, exhaled nitric oxide, and bronchial responsiveness. J Allergy Clin Immunol. 2012;130:397-402.
45. Önell A, Whiteman A, Nordlund B, Baldracchini F, Mazzoleni G, Hedlin G, et al. Allergy testing in children with persistent asthma: comparison of four diagnostic methods. Allergy. 2017;72:590-7.
46. Bousquet J, Van Cauwenberge P, Khaltaev N. Aria Workshop Group, World Health Organization. Allergic rhinitis and its impact on asthma. J Allergy Clin Immunol. 2001;108(suppl):S147-334.
47. Giavina-Bianchi P. Defining phenotypes in rhinitis: a step toward personalized medicine. J Allergy Clin Immunol. 2015;135(1):151-2.
48. Giavina-Bianchi P, Aun MV, Takejima P, Kalil J, Agondi RC. United airway disease: current perspectives. J Asthma Allergy. 2016;11(9):93-100.
49. Rosario N, Bielory L. Epidemiology of allergic conjunctivitis. Curr Opin Allergy Clin Immunol. 2011;11(5):471-6.
50. Neto HJ, Rosário NA, Westphal GL, Riedi CA, Santos HL. Allergic conjunctivitis in asthmatic children: as common as underreported. Ann Allergy Asthma Immunol. 2010;105(5):399-400.
51. Geraldini M, Chong Neto HJ, Riedi CA, Rosário NA. Epidemiology of ocular allergy and co-morbidities in adolescents. J Pediatr. 2013;89(4):354-60.
52. Takejima P, Agondi RC, Rodrigues H, Aun MV, Kalil J, Giavina-Bianchi P. Allergic and nonallergic asthma have distinct phenotypic and genotypic features. Int Arch Allergy Immunol. 2017;172(3):150-60.
53. Santosa A, Andiappan AK, Rotzschke O, Wong HC, Chang A, Bigliardi-Qi M, et al. Evaluation of the applicability of the Immunosolid-phase allergen chip (ISAC) assay in atopic patients in Singapore. Clin Transl Allergy. 2015;27:5-9.
54. Jung JH, Kang IG, Kim ST. Comparison of component-resolved diagnosis by using allergen microarray with the conventional tests in allergic rhinitis patients: the first using in Korea. Clin Exp Otorhinolaryngol. 2015;8(4):385-9.
55. Prosperi MC, Belgrave D, Buchan I, Simpson A, Custovic A. Challenges in interpreting allergen microarrays in relation to clinical symptoms: a machine learning approach. Pediatr Allergy Immunol. 2014;25(1):71-9.
56. Bonini M, Marcomini L, Gramiccioni C, Tranquilli C, Melioli G, Canonica GW, et al.Microarray evaluation of specific IgE to allergen components in elite athletes. Allergy. 2012;67(12):1557-64.
57. Araujo LML, Rosário NA, Mari A. Molecular-based diagnosis of respiratory allergic diseases in children from Curitiba, a city in Southern Brazil. Allergol Immunopathol. 2016;44(1):18-22.
58. Bronnert M, Mancini J, Birnbaum J, Agabriel C, Liabeuf V, Porri F, et al. Component-resolved diagnosis with commercially available D. Pteronyssinus Der p 1, Der p 2 and Der p 10: relevant markers for house dust mite allergy. Clin Exp Allergy. 2012;42(9):1406-15.
59. Zeng G, Luo W, Zheng P, Wei N, Huang H, Sun B, Zhao X.Component-Resolved Diagnostic Study of Dermatophagoides Pteronyssinus Major Allergen Molecules in a Southern Chinese Cohort.J Investig Allergol Clin Immunol. 2015;25(5):343-51.
60. Nieto M, Lafuente I, Calderon R, Uixera S, Pina R, Calaforra S, et al. Component-resolved diagnosis: performance of specific IgE to Alternaria compared to Alt a 1. Pediatr Allergy Immunol. 2014;25(8):832-4.
61. Liccardi G, Bilò MB, Manzi F, Piccolo A, Di Maro E, Salzillo A.What could be the role of molecular-based allergy diagnostics in detecting the risk of developing allergic sensitization to furry animals? Eur Ann Allergy Clin Immunol. 2015;47(5):163-7.
62. Asarnoj A, Hamsten C, Wadén K, Lupinek C, Andersson N, Kull I, et al. Sensitization to cat and dog allergen molecules in childhood and prediction of symptoms of cat and dog allergy in adolescence: a BAMSE/MeDALL study. J Allergy Clin Immunol. 2016;137(3):813-21.
63. Hatzler L, Panetta V, Lau S, Wagner P, Bergmann RL, Illi S, et al. Molecular spreading and predictive value of preclinical IgE response toPhleum pratensein children withhay fever.J Allergy Clin Immunol. 2012;130:894-901.
64. Westman M, Lupinek C, Bousquet J, Andersson N, Pahr S, Baar A, et al. Early childhood IgE reactivity to pathogenesis-related class 10 proteins predicts allergic rhinitis in adolescence. J Allergy Clin Immunol. 2015;135:1199-206.
65. Stringari G, Tripodi S, Caffarelli C, Dondi A, Asero R, Businco ADR, et al.The effect of component-resolved diagnosis on specific immunotherapy prescription in children with hay fever.J Allergy Clin Immunol. 2014;134:75-81.
66. Schmid JM, Wuurtzen PA, Dahl R, Hoffmann HJ. Pretreatment IgE sensitization patterns determine the molecular profile of the IgG4 response during updosing of subcutaneous immunotherapy with timothy grass pollen extract. J Allergy Clin Immunol. 2016;137:562-70.
67. Baye A, Batellier L, Doan S, Bury T, Vitte J.Multiplex assay of specific IgE antibodies in tear fluids by means of microarray technology. J Fr Ophtalmol. 2016;39(7):e183-5.
68. Leonardi A, Borghesan F, Faggian D, Plebani M. Microarray-based IgE detection in tears of patients with vernal keratoconjunctivitis. Pediatr Allergy Immunol. 2015;26(7):641-5.
69. Wölbing F & Biedermann T. Anaphylaxis: opportunities of stratified medicine for diagnosis and risk assessment. Allergy. 2013;68:1499-508.
70. Castells M.Diagnosis and management of anaphylaxis in precision medicine. J Allergy Clin Immunol. 2017;140:321-3.
71. Heaps A, Carter S, Selwood C, Moody M, Unsworth J, Deacock S, et al. The utility of the ISAC allergen array in the investigation of idiopathic anaphylaxis. Clin Exp Immunol. 2014;177:483-90.
72. Golden DBK. Anaphylaxis to insect stings. Immunol Allergy Clin N Am. 2015;35:287-302.
73. Bokanovic D, Aberer W, Griesbacher A, Sturm GJ. Prevalence of Hymenoptera venom allergy and adherence to immunotherapy in Austria. Allergy. 2011;66:1395-16.
74. Sturm GJ, Schuster C, Kranzelbinder B, Wiednig M, Groselj-Strele A, Aberer W. Asymtomatic sensitization to Hymenoptera venom is related to total immunoglobulin E levels. Int Arch Allergy Immunol. 2009;148:261-4.
75. Garnier L, Selman L, Rouzaire P, Bouvier M, Roberts O, Bérard F, et al. Molecular allergens in the diagnosis of látex allergy. Eur Ann Allergy Clin Immunol. 2012;44(2):73-9.
76. Seyfarth F, Schliemann S, Wiegand C, Hipler UC, Elsner P.Diagnostic value of the ISAC allergy chip in detecting latex sensitizations. Int Arch Occup Environ Health. 2014;87:775-81.
77. Luengo O, Cardona V.Component resolved diagnosis:when should it be used? Clin Translational Allergy. 2014;4:28.
78. Nettis E, Bonifazi F, Bonini S, Di Leo E, Maggi E, Melioli G, et al. Molecular diagnosis and the Italian Board for ISAC. Eur Ann Allergy Clin Immunol. 2014;46(2):68-73.