Número Atual: Janeiro-Março 2018 - Volume 2 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Dirceu Solé
- Luciana Rodrigues Silva
- Renata Rodrigues Cocco
- Cristina Targa Ferreira
- Roseli Oselka Sarni
- Lucila Camargo Oliveira
- Antonio Carlos Pastorino
- Virgínia Weffort
- Mauro Batista Morais
- Bruno Paes Barreto
- José Carlison Oliveira
- Ana Paula Moschione Castro
- Jackeline Motta Franco
- Herberto José Chong Neto
- Nelson Augusto Rosário
- Maria Luisa Oliva Alonso
- Emanuel Cavalcanti Sarinho
- Ariana Yang
- Hélcio Maranhao
- Mauro Sérgio Toporovski
- Matias Epifanio
- Neusa Falbo Wandalsen
- Norma Motta Rubini
ARTIGO ESPECIAL
Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 1 - Etiopatogenia, clínica e diagnóstico. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia
Brazilian Consensus on Food Allergy: 2018 - Part 1 - Etiopathogenesis, clinical features, and diagnosis. Joint position paper of the Brazilian Society of Pediatrics and the Brazilian Association of Allergy and Immunology
Dirceu Solé1; Luciana Rodrigues Silva2; Renata Rodrigues Cocco1; Cristina Targa Ferreira3; Roseli Oselka Sarni4; Lucila Camargo Oliveira1; Antonio Carlos Pastorino5; Virgínia Weffort6; Mauro Batista Morais7; Bruno Paes Barreto8; José Carlison Oliveira9; Ana Paula Moschione Castro5; Jackeline Motta Franco10; Herberto José Chong Neto11; Nelson Augusto Rosário11; Maria Luisa Oliva Alonso12; Emanuel Cavalcanti Sarinho13; Ariana Yang14; Hélcio Maranhao15; Mauro Sérgio Toporovski16; Matias Epifanio17; Neusa Falbo Wandalsen4; Norma Motta Rubini18
1. Universidade Federal de Sao Paulo, Disciplina de Alergia, Imunologia Clínica e Reumatologia - Sao Paulo, SP, Brasil
2. Universidade Federal da Bahia, Departamento de Pediatria - Salvador, BA, Brasil
3. Universidade Federal de Ciências da Saúde de Porto Alegre, Departamento de Pediatria - Porto Alegre, RS, Brasil
4. Faculdade de Medicina do ABC, Departamento de Pediatria - Santo André, SP, Brasil
5. Universidade de Sao Paulo, Instituto da Criança - Sao Paulo, SP, Brasil
6. Universidade Federal do Triângulo Mineiro, Departamento de Pediatria - Uberaba, MG, Brasil
7. Universidade Federal de Sao Paulo, Departamento de Pediatria - Sao Paulo, SP, Brasil
8. Universidade do Estado do Pará, Departamento de Pediatria - Belém, PA, Brasil
9. Universidade Federal da Bahia, Departamento de Alergia e Imunologia - Salvador, BA, Brasil
10. Universidade Federal de Sergipe, Departamento de Pediatria - Aracaju, SE, Brasil
11. Universidade Federal do Paraná, Departamento de Pediatria - Curitiba, PR, Brasil
12. Universidade Federal do Rio de Janeiro, Departamento de Medicina - Rio de Janeiro, RJ, Brasil
13. Universidade Federal de Pernambuco, Departamento de Pediatria - Recife, PE, Brasil
14. Faculdade de Medicina da Universidade Sao Paulo, Disciplina de Imunologia e Alergia - Sao Paulo, SP, Brasil
15. Universidade Federal do Rio Grande do Norte, Departamento de Pediatria - Natal, RN, Brasil
16. Faculdade de Ciências Médicas da Santa Casa de Sao Paulo, Departamento de Pediatria - Sao Paulo, SP, Brasil
17. Faculdade de Medicina da Pontifícia Universidade Católica, Departamento de Pediatria - Porto Alegre, RS, Brasil
18. Universidade Federal do Estado do Rio de Janeiro, Disciplina de Alergia e Imunologia Clínica - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Dirceu Solé
E-mail: sole.dirceu@gmail.com ou dirceu.sole@unifesp.br
Submetido em: 23/02/2018
Aceito em 28/02/2018
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A alergia alimentar é definida como uma doença consequente a uma resposta imunológica anômala, que ocorre após a ingestao e/ou contato com determinado(s) alimento(s). Atualmente é considerada um problema de saúde pública, pois a sua prevalência tem aumentado no mundo todo. É um capítulo à parte entre as reaçoes adversas a alimentos, e de acordo com os mecanismos fisiopatológicos envolvidos, essas reaçoes podem ser imunológicas ou nao-imunológicas. Em geral, a alergia alimentar inicia precocemente na vida com manifestaçoes clínicas variadas na dependência do mecanismo imunológico envolvido. A anafilaxia é a forma mais grave de alergia alimentar mediada por IgE. Conhecimentos recentes permitiram a melhor caracterizaçao da Síndrome da enterocolite induzida por proteína alimentar (FPIES), assim como da esofagite eosinofílica. Vários fatores de risco, assim como novos alérgenos alimentares, têm sido identificados nos últimos anos.Tomando-se como ponto de partida o "Consenso Brasileiro sobre Alergia Alimentar: 2007" foi realizada revisao e atualizaçao dos conceitos apresentados por grupo de alergologistas, gastroenterologistas, nutrólogos e pediatras especializados no tratamento de pacientes com alergia alimentar. Novos conceitos foram apresentados sobretudo pela melhor caracterizaçao. O objetivo desta revisao foi elaborar um documento prático capaz de auxiliar na compreensao dos mecanismos envolvidos na alergia alimentar, assim como dos possíveis fatores de risco associados à sua apresentaçao, bem como sobre a sua apresentaçao clínica.
Descritores: Hipersensibilidade alimentar, fatores de risco, anafilaxia, sistema respiratório.
INTRODUÇAO
Definiçao
Considerada atualmente um problema de saúde pública, a alergia alimentar é definida como uma doença consequente a uma resposta imunológica anômala, que ocorre após a ingestao e/ou contato com determinado(s) alimento(s). A alergia alimentar representa um capítulo à parte entre as reaçoes adversas a alimentos. De acordo com os mecanismos fisiopatológicos envolvidos, as reaçoes adversas a alimentos podem ser classificadas em imunológicas ou nao-imunológicas.
As reaçoes nao-imunológicas dependem principalmente da substância ingerida (p. ex: toxinas bacterianas presentes em alimentos contaminados) ou das propriedades farmacológicas de determinadas substâncias presentes em alimentos (p. ex: cafeína no café, tiramina em queijos maturados)1. As reaçoes adversas nao munológicas podem ser desencadeadas também pela fermentaçao e efeito osmótico de carboidratos ingeridos e nao absorvidos. O exemplo clássico é a intolerância por má absorçao de lactose. Mais recentemente vem sendo valorizados também outros carboidratos nao completamente absorvidos conhecidos pela sigla em inglês "FODMAPs": F = fermentável, O = oligossacarídeos (frutanos, galactooligosacarídeos), D = dissacarídeos (lactose, sacarose), M = monossacarídeos (frutose), e P = polióis (sorbitol)2.
As reaçoes imunológicas dependem de susceptibilidade individual e podem ser classificadas segundo o mecanismo imunológico envolvido."Alergia alimentar" é um termo utilizado para descrever as reaçoes adversas a alimentos, dependentes de mecanismos imunológicos, mediados por anticorpos IgE ou nao3.
Classificaçao
As reaçoes de hipersensibilidade aos alimentos podem ser classificadas de acordo com o mecanismo imunológico envolvido em1:
Mediadas por IgE
Decorrem de sensibilizaçao a alérgenos alimentares com formaçao de anticorpos específicos da classe IgE, que se fixam a receptores de mastócitos e basófilos. Contatos subsequentes com este mesmo alimento e sua ligaçao a duas moléculas de IgE próximas determinam a liberaçao de mediadores vasoativos e citocinas Th2, que induzem às manifestaçoes clínicas de hipersensibilidade imediata. Sao exemplos de manifestaçoes mais comuns que surgem logo após a exposiçao ao alimento: reaçoes cutâneas (urticária, angioedema), gastrintestinais (edema e prurido de lábios, língua ou palato, vômitos e diarreia), respiratórias (broncoespasmo, coriza) e reaçoes sistêmicas (anafilaxia e choque anafilático)1-4.
Reaçoes mistas (mediadas por IgE e hipersensibilidade celular)
Neste grupo estao incluídas as manifestaçoes decorrentes de mecanismos mediados por IgE associados à participaçao de linfócitos T e de citocinas pró-inflamatórias. Sao exemplos clínicos deste grupo a esofagite eosinofílica, a gastrite eosinofílica, a gastrenterite eosinofílica, a dermatite atópica e a asma1-4.
Reaçoes nao mediadas por IgE
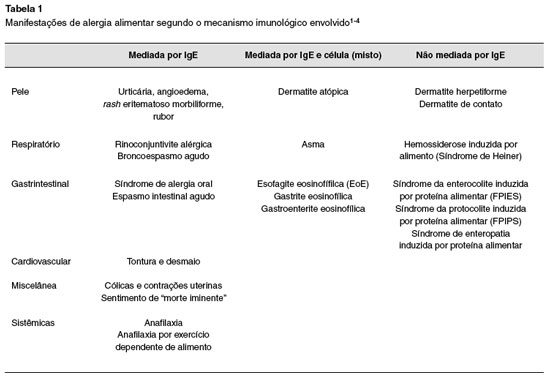
As manifestaçoes nao mediadas por IgE nao sao de apresentaçao imediata e caracterizam-se basicamente pela hipersensibilidade mediada por células (Tabela 1). Embora pareçam ser mediadas por linfócitos T, há muitos pontos que necessitam ser mais estudados nesse tipo de reaçoes. Aqui estao representados os quadros de proctite, enteropatia induzida por proteína alimentar e enterocolite induzida por proteína alimentar1-4.
Epidemiologia
Os dados sobre a prevalência de alergia alimentar, ao redor do mundo, sao conflitantes e variáveis a depender de: idade e características da populaçao avaliada (cultura, hábitos alimentares, clima), mecanismo imunológico envolvido, método de diagnóstico (autorreferido, questionário escrito, testes cutâneos, determinaçao de IgE sérica específica ou testes de provocaçao oral), tipo de alimento, regioes geográficas, entre outros4,5. É mais comum em crianças e a sua prevalência parece ter aumentado nas últimas décadas em todo o mundo. Estima-se que a prevalência seja aproximadamente de 6% em menores de três anos, e de 3,5% em adultos5-8.
Estudo norte-americano avaliou a prevalência de alergia alimentar na populaçao geral (questionário online) e a observou oscilar entre 1% e abaixo de 10%9 estudo posterior, em crianças e baseado no relato de seus pais, apontou ser de 8%10.
Estudo populacional realizado a partir de registros médicos eletrônicos integrados do Partners HealthCare, em Boston (EUA), avaliou os dados sobre reaçoes adversas a alimentos, entre 2000 e 2013. Foram avaliadas as reaçoes potencialmente mediadas por IgE e anafiláticas entre 27 milhoes de pacientes. Identificou-se ser a prevalência de intolerância/alergia a pelo menos um alimento 3,6%11.
Os principais alérgenos identificados foram frutos do mar (0,9%), fruta ou vegetal (0,5%), leite e derivados (0,5%), e amendoim (0,5%)11.
Na Europa, revisao sistemática seguida por metanálise de estudos sobre alergia alimentar em todas as idades documentou ser a prevalência cumulativa de alergia alimentar variável de acordo com o critério usado para diagnóstico: a autorreferida, 17,3%; prevalência pontual, 5,9%; identificada por teste cutâneo, 2,7%; presença de IgE sérica específica, 10,1%; e a confirmada por teste de provocaçao oral, 0,9%12. As maiores taxas foram observadas entre as crianças12. Segundo os alimentos identificados como responsáveis pelas reaçoes (autorreferidos, presença de IgE sérica específica), verificou-se leite de vaca (6,0%), trigo (3,6%), ovo (2,5%), peixe (2,2%), frutos do mar (1,3%), castanhas (1,3%) e amendoim (0,3%). Empregando-se o teste de provocaçao oral como critério diagnóstico, os índices mudaram substancialmente: leite de vaca (0,6%), castanhas (0,5%), soja (0,3%), ovo (0,2%), amendoim (0,2%), trigo (0,1%), peixe (0,1%) e frutos do mar (0,1%)13.
No Brasil, os dados sobre prevalência de alergia alimentar sao escassos e limitados a grupos populacionais, o que dificulta uma avaliaçao mais próxima da realidade. Estudo realizado por gastroenterologistas pediátricos apontou ser a incidência de alergia às proteínas fo leite de vaca 2,2%, e a prevalência 5,4% em crianças entre os serviços avaliados14
Silva e colaboradores empregaram protocolo europeu para avaliar a prevalência de alergia alimentar entre adultos brasileiros (18 a 65 anos). Enquanto a taxa de sintomas referidos foi de 10,8% dos pacientes avaliados, o número de diagnósticos médicos de alergia alimentar caiu para 1,0%; leite de vaca e camarao foram os mais apontados15. Entre préescolares (4 a 59 meses) o mesmo grupo verificou ser a suspeita de 0,61%16.
Embora mais de 170 alimentos tenham sido reconhecidos como potencialmente alergênicos, uma pequena parcela entre eles tem sido responsabilizada pela maioria das reaçoes ocorridas, destacando-se que a sensibilizaçao a esses alérgenos comuns é variável segundo a idade dos pacientes e a regiao geográfica que habitam6. Na infância, os alimentos mais responsabilizados pelas alergias alimentares sao leite de vaca, ovo, trigo e soja, que em geral sao transitórias. Menos de 10% dos casos persistem até a vida adulta7,8,13. Entre os adultos, os alimentos mais identificados sao amendoim, castanhas, peixe e frutos do mar7,8,13.
As reaçoes adversas aos aditivos alimentares sao raras (abaixo de 1%)17. Os aditivos mais implicados em reaçoes adversas sao os sulfitos, o glutamato monossódico, a tartrazina e o vermelho carmin17.
MECANISMOS DE DEFESA DO TRATO GASTRINTESTINAL
O trato gastrintestinal (TGI) é o único órgao onde existe uma convivência harmônica entre grande número de micro-organismos e o sitema imunológico além de ter a capacidade de receber diariamente grande quantidade de antígenos alimentares sem que haja um processo inflamatório que cause danos. Essa funçao do TGI de promover a digestao com a incorporaçao de nutrientes, água, eletrólitos e ao mesmo tempo manutençao de um equilíbrio imunológico só é conseguida pela presença de mecanismos de defesa bem elaborados18.
Durante a vida, sao ingeridas grandes quantidades de alimentos com alta carga proteica e, apesar disto, apenas alguns indivíduos desenvolvem alergia alimentar, demonstrando que existem mecanismos de defesa competentes no TGI, que contribuem para o desenvolvimento de tolerância oral. A permeabilidade da barreira intestinal é variável e pode ser afetada ou mesmo promover o desenvolvimento de várias doenças no lactente e no adulto19,20. Estes mecanismos de defesa existentes podem ser classificados como inespecíficos e específicos.
Os mecanismos de defesa inespecíficos englobam: a barreira mecânica representada pelo próprio epitélio intestinal e pela junçao firme entre suas células epiteliais (promovida por tight junctions, desmossomos, entre outros), a flora intestinal, o ácido gástrico, as secreçoes biliares e pancreáticas e a própria motilidade intestinal18,20. Para se manter a integridade da barreira epitelial se faz necessária uma regulaçao precisa em sua estrutura e funçao, de modo a promover um balanço entre os mecanismos pró e anti-inflamatórios que ocorrem no TGI18,20.
O epitélio intestinal é renovado a cada semana, em decorrência da proliferaçao, diferenciaçao e migraçao das stem-cell progenitoras, das criptas em direçao ao lúmen, mantendo sua funçao de barreira. As stem-cell intestinais geram 80% de enterócitos com capacidade absortiva, além de células de Goblet produtoras de muco, células êntero-endócrinas e células de Paneth produtoras de peptídeos antimicrobianos. Outra célula epitelial bem diferenciada é conhecida como célula M, que nao apresenta camada de muco em sua superfície21.
Um elemento importante da defesa inespecífica é representado pelo muco, que recobre as células epiteliais e contém diferentes mucinas. O muco auxilia na formaçao de uma primeira linha de defesa e facilita a aderência de bactérias através de componentes de sua parede celular, promovendo sua eliminaçao pela peristalse. No intestino delgado, essa camada de muco é mais fina e penetrável, em comparaçao com o cólon, permitindo maior absorçao de nutrientes. Também tem a funçao de matriz onde sao mantidos os peptídeos antimicrobianos produzidos pelas células de Paneth, facilitando sua difusao através do muco. Uma funçao adicional das mucinas é ser fonte nutricional para os micro-organismos comensais, podendo regular a microflora intestinal. As principais moléculas produzidas pelas células de Paneth sao: alfa-defensina, lisozima C, fosfolipases e lectina tipo-C, que contribuem para a barreira mucosa e na prevençao da invasao microbiana22.
Alteraçoes na permeabilidade intestinal e nos mecanismos de barreira podem ser a origem de doenças do TGI envolvendo processos inflamatórios23. Entre os mecanismos de defesa específicos encontramos aqueles relacionados à defesa imunológica do TGI, que podem ser encontrados em três níveis, a saber: (1) Barreira epitelial intestinal; (2) Lâmina própria; e (3) Sistema imunológico do trato gastrintestinal (GALT - Gut-associated lymphoid tissue). Este último faz parte de um grande sistema de imunidade de mucosas (MALT-Mucosa-associated lymphoid tissue), que entra em contato com o meio externo, sendo considerado o maior órgao linfoide do organismo. O GALT, por sua vez, é composto por diferentes tecidos linfoides organizados, que incluem: as placas de Peyer (PP), folículos linfoides isolados (FLI) e linfonodos mesentéricos (LNM)24. A quantidade de linfócitos presentes do TGI atinge 5x1010, enquanto a pele contém cerca de 2x1010e o sangue 1010, com cerca de 6x1010de plasmócitos produtores de imunoglobulinas.
Pode-se considerar as funçoes do sistema imunológico de mucosas levando em conta locais indutores e locais efetores, sendo os indutores aqueles onde a entrada de antígenos pelas superfícies mucosas ativam os linfócitos "virgens" ou naive e os de memória, tanto T quanto B, presentes nos tecidos linfoides organizados, como classificados acima. Por outro lado, os sítios efetores sao representados pelos linfócitos presentes na lâmina própria e nos que permeiam as células epiteliais24.
Na lâmina própria estao localizadas a maioria das células imunológicas: as que já entraram em contato com antígenos anteriormente (linfócitos T e B de memória), sendo na maioria linfócito do tipo CD4+, mas também estao presentes CD8+, CD4+CD25hi (conhecidos como linfócitos T reguladores - Treg) e outras células imunológicas, como células dendríticas (DC), macrófagos, mastócitos, eosinófilos e células linfoides inatas (ILC).
As PP sao estruturas linfoides organizadas, distribuídas no intestino delgado, especialmente no íleo distal e que representam os principais sítios indutores. Consistem de um centro germinativo que contém grande quantidade de linfócitos B, circundados de poucos linfócitos T. Os linfócitos B sao direcionados principalmente para a produçao de IgA.
Uma particularidade das PP é a presença de células epiteliais especializadas, as chamadas células M. Essas células M nao apresentam microvilosidades e camada superficial de muco, o que facilita a captaçao de antígenos (Ag) particulados, vírus, bactérias ou parasitas intactos. Sua localizaçao e características permitem o contato na regiao do domo das PP com uma grande quantidade de DC, que interagem com esses Ag e os colocam em contato direto com linfócitos T e B, induzindo a produçao de IgA, mediada por TGF-ß secretado pelos linfócitos T24.
Após a apresentaçao antigênica na mucosa do TGI pela captaçao do antígeno pelas células M, ocorre a captaçao destes antígenos pelas DC, que representam as células apresentadoras de antígeno (APC) mais competentes para esta funçao, embora outras células também possam exercer este papel. Estas APC apresentam estes antígenos às células T helper naive (Th0) presentes nos tecidos linfoides associados ao intestino. Na dependência da alergenicidade do Ag e das células presentes no local da apresentaçao, as células Th0 diferenciam-se em diferentes tipos de linfócitos T, classificados pelo perfil de interleucinas (IL) que produzem. Linfócitos Th1 produzem interferon gama (INFg), IL-2 e fator de necrose tumoral alfa (TNF-α), e os linfócitos Th2, preferentemente IL-4, IL-5, IL- 9 e IL-1324. A ativaçao de outros tipos de linfócitos T, como os Th-17, que produzem citocinas do tipo IL-17 e IL-22, também pode ocorrer e proteger contra infecçao por germes extracelulares. A captaçao de Ag nao ocorre apenas através das células M, mas também pela captaçao direta no lúmen pelos dendritos das DC que se infiltram entre as células epiteliais da mucosa, através das próprias células epiteliais ou células de Goblet, ou mesmo penetrando através de aberturas entre as tight junction que interligam as células epiteliais24.
As DC também ativam células Treg, resultando no desenvolvimento de tolerância oral24,25. As células Treg sao linfócitos que controlam ou suprimem a funçao de outras células, e podem ser naturais ou induzidos perifericamente, em especial no TGI. Várias células Treg CD4+ foram identificadas (Treg CD4+CD25hi;Tr1; Th3) e sao reconhecidas por sua açao supressora sobre outros tipos de linfócitos, seja pela produçao de TGF-ß e IL-10, principais inibidores da resposta Th2 ou pela presença de moléculas inibitórias como CTLA4 (cytotoxic T lymphocyte antigen-4). O TGF-ß é o principal indutor da produçao de IgA na mucosa pelos linfócitos B24,25.
Os linfócitos intraepiteliais (IEL) sao linfócitos T que apresentam a funçao de manter e proteger a barreira mucosa, além de regular e manter a homeostase intestinal.
A presença de numerosas células linfoides inatas (ILC) também tem sido implicada no mecanismo imunológico de regulaçao intestinal. Essas células funcionam como os linfócitos T CD4+dos diferentes tipos Th-1, Th-2 ou Th-17 na dependência de serem ILC grupo 1, 2 ou 3, respectivamente, e produzirem as mesmas IL de cada um dos tipos de linfócitos T24.
A produçao da IgA secretora pelos linfócitos B, induzidos pela presença de TGF-ß, representa um dos principais mecanismos de defesa do TGI, referido como exclusao imunológica e com açao sinérgica com outros mecanismos imunológicos. A IgA secretora incorporada ao muco também representa a primeira linha de defesa da barreira mucosa26,27, e tem a capacidade de inibir a adesao bacteriana às células epiteliais, neutralizar vírus e toxinas bacterianas, e prevenir a penetraçao de antígenos alimentares na barreira epitelial.
A lâmina própria do intestino é o maior local de produçao de anticorpos do organismo, onde se encontram cerca de 80% de células B ativadas. Embora a IgA seja encontrada no sangue como um monômero, a IgA secretora é formada por duas moléculas ligadas por um peptídeo chamado de "cadeia J". A IgA secretora, derivada de células B presentes na lâmina própria, é transportada através das células do intestino com a ajuda do componente secretor presente na superfície basal das células epiteliais, que se incorpora ao dímero IgA e favorece a sua resistência à digestao26,27.
A falta de IgA secretora pode ser compensada pela presença de IgM secretora e outros mecanismos imunológicos inatos e adquiridos, o que explica porque grande parcela de pacientes com deficiência de IgA nao apresenta infecçoes/parasitoses recorrentes no TGI. Por outro lado, a importância da IgA secretora na mucosa é demonstrada em pacientes com deficiência de IgA, onde a prevalência de hipersensibilidade a alimentos e aeroalérgenos é mais referida por familiares27.
Sugere-se que o sistema imunológico imaturo dos neonatos e lactentes jovens favoreça a sensibilizaçao alérgica. Nesta fase da vida, a barreira intestinal é imatura e mais permeável, tornando o epitélio mais suscetível à penetraçao dos diferentes antígenos, portanto, mais vulnerável à sensibilizaçao alérgica18,19. Além disso, nesta fase da vida há produçao diminuída de anticorpos IgA secretores, o que favorece a penetraçao de alérgenos e consequentemente a ocorrência de alergias. A evoluçao simultânea da imunidade do ser humano com sua microflora estabeleceu interaçoes regulatórias essenciais para a manutençao da saúde, e uma quebra ou alteraçao da microbiota pode acarretar no aumento das doenças alérgicas e autoimunes28.
Outro aspecto fundamental de defesa é representado pelo aleitamento materno nos lactentes jovens, pela similaridade antigênica da espécie e pelos fatores protetores carreados, sejam imunológicos ou nao-imunológicos, que contribuem para a manutençao de uma microbiota adequada neste período precoce da vida29.
A microbiota comensal também auxilia no desenvolvimento dos tecidos linfoides secundários, como as PP e os folículos linfoides isolados, mantendo a homeostasia hospedeiro-microbiota e evitando doenças inflamatórias em longo prazo28.
Microbiota e saúde
O trato digestório do ser humano hospeda trilhoes de micro-organismos, sendo a grande maioria no intestino (1014), onde estao presentes aproximadamente 4.000 diferentes cepas, que respondem pela microbiota intestinal propriamente dita. A diversidade desta microbiota resulta de um processo de coevoluçao das comunidades bacterianas e do hospedeiro ao longo do tempo, onde ambas as partes se beneficiam, determinando uma situaçao mutual de convivência (mutualismo)29,30.
Nos últimos anos vêm sendo identificadas bactérias na unidade feto-placentária, líquido amniótico e mecônio, contrapondo-se à clássica teoria de que o feto, incluindo o tubo digestivo e anexos, eram estéreis.
No entanto, ainda é necessário confirmar os mecanismos de colonizaçao durante a gestaçao, e demonstrar a relevância destes achados microbiológicos31.
Neste sentido, a colonizaçao intestinal pré, peri e pós-natal, que se estabiliza nos primeiros anos de vida, é um processo dinâmico e fundamental para o desenvolvimento morfofuncional de diversos sistemas, sobretudo o sistema imunológico, em suas respostas inatas ou adaptativas. Dois fatores fundamentais para a instalaçao de eubiose sao o leite materno e o parto vaginal. As evidências científicas por trás destas afirmaçoes sao ratificadas por estudos com animais germ-free, que apresentam hipoplasia do sistema imunológico de mucosa, em especial das PP, diminuiçao da síntese de IgA, diminuiçao no número de linfócitos (CD4+) e modulaçao imunológica mediada por subpopulaçoes linfocitárias (células T reguladoras, Treg) inapropriada. Esta situaçao de imunodeficiência, nestes animais germ-free, é revertida após o início da colonizaçao intestinal com bactérias que simulam a condiçao fisiológica32.
Embora outros fatores interfiram com a funçao do sistema imunológico, como por exemplo, a genética do indivíduo, seu estilo de vida (dieta e estresse, amamentaçao), sua exposiçao antigênica pregressa (higiene ambiental, uso de antibióticos, tipo de parto), é fato que o estabelecimento de uma microbiota inadequada (disbiose) pode resultar em alteraçoes nos mecanismos reguladores (linfócitos Treg) e culminar em maior susceptibilidade a infecçoes ou desequilíbrio nos fenômenos de tolerância, induzindo respostas de hipersensibilidade, como as alergias alimentares33.
RESPOSTA IMUNOLOGICA NORMAL A ANTIGENOS INGERIDOS
Em indivíduos saudáveis, a ingestao de alimentos determina um estado de tolerância, que é entendido como um estado ativo de nao resposta à ingestao de antígenos alimentares solúveis, mediado por uma resposta do GALT. Na maioria dos indivíduos, os mecanismos de defesa intestinal atuam desde as fases precoces de proteçao pela barreira intestinal e na ativaçao de respostas reguladoras, o que promove a liberaçao de IL-10 e TGF-ß que, por sua vez, induzem a produçao de IgA com seus efeitos de exclusao imunológica. Em indivíduos suscetíveis, ou na presença de fatores que interferem nos mecanismos de barreira, inespecíficos ou mesmo específicos, ocorre o direcionamento para uma resposta Th2 bem definida, com produçao de IgE, ligaçao aos mastócitos e basófilos e liberaçao de mediadores inflamatórios. Após nova exposiçao ao mesmo antígeno, ocorre a ativaçao de linfócitos T de memória, que secretam mais IL de perfil Th2, e induzem maior produçao de IgE, com todos seus efeitos locais e sistêmicos34.
A via intestinal, embora seja a via predominante de sensibilizaçao alergênica, nao é a única capaz de induzir alergia alimentar. A pele e o trato respiratório podem também atuar como vias de penetraçao e sensibilizaçao a antígenos alimentares. Acredita-se que a sensibilizaçao transcutânea ocorra especialmente nos pacientes com dermatite atópica, onde a quebra da barreira cutânea é um mecanismo favorecedor da penetraçao de alérgenos35-38. A sensibilizaçao primária pela via respiratória é rara, e o principal exemplo é a "asma do padeiro", por sensibilizaçao ao trigo devido à inalaçao frequente e em grandes quantidades deste alérgeno.
As causas para ocorrência da menor ativaçao das células Treg em indivíduos alérgicos ainda é desconhecida, e o papel dos demais fatores presentes no intestino sobre o sistema imunológico, como a microflora intestinal, ainda necessitam mais estudos para sua compreensao.
Para o desenvolvimento de alergia alimentar sao necessários: substrato genético, dieta com proteínas com alta capacidade alergênica e quebra dos mecanismos de defesa do trato gastrintestinal, quando há incapacidade do desenvolvimento de tolerância oral. Fatores ambientais e epigenéticos também devem ser considerados para explicar a recente "epidemia" de alergia alimentar39,40.
ALÉRGENOS ALIMENTARES
Define-se como alérgeno, qualquer substância capaz de estimular uma resposta de hipersensibilidade. Os alérgenos alimentares sao na sua maior parte representados por glicoproteínas hidrossolúveis com peso molecular entre 10 e 70 kDa41. Podem sofrer modificaçoes conforme o processamento do alimento ou durante a digestao, resultando em aumento ou diminuiçao da alergenicidade. Um epítopo alergênico pode ser de origem conformacional, quando a estrutura terciária da proteína é que suscita a resposta imunológica. Epítopos conformacionais podem perder sua capacidade de ligaçao ao anticorpo quando submetidos a processos de cocçao, hidrólise ou outros procedimentos químicos. Epítopos também podem ser lineares, uma sequência de aminoácidos que se liga ao anticorpo e, neste cenário, procedimentos químicos simples sao incapazes de modificar sua alergenicidade42.
Os alérgenos alimentares relacionados a manifestaçoes mais graves de alergia sao em geral termoestáveis e resistentes à açao de ácidos e proteases. Há três possibilidades de um alimento se tornar capaz de induzir reaçoes:
- quando o alimento é ingerido ou há contato com a pele ou o trato respiratório;
- quando, pela reatividade cruzada, houve produçao de IgE específica e sensibilizaçao antes mesmo do contato com o alimento;
- quando há reatividade cruzada entre um alérgeno inalável (ex. polens, látex) responsável pela sensibilizaçao e produçao de IgE e ingestao do alimento42.
Embora virtualmente qualquer alimento possa causar alergia, cerca de 80% das manifestaçoes de alergia alimentar ocorrem com a ingestao de leite de vaca, ovo, soja, trigo, amendoim, castanhas, peixes e crustáceos. Deve-se destacar, entretanto, que novos alérgenos têm sido descritos, como kiwi e gergelim, e alguns deles bastante regionais, como a mandioca43.
O conceito clássico de alérgeno envolve proteínas que suscitam uma resposta de hipersensibilidade; entretanto há, em alergia alimentar, importante exceçao que precisa ser destacada: alérgenos compostos por carboidratos. O mecanismo pelo qual estes compostos conseguem estimular a produçao de IgE específica ainda nao é muito conhecido, mas estima-se que ao conjugar-se com uma proteína do organismo seria capaz de estimular a síntese de IgE específica via receptores presentes na superfície de linfócitos B. Os principais alérgenos compostos por açúcares sao:
- Fucoses ou xiloses: inespecíficas e se ligam a glucanas presentes em uma série de frutas e invertebrados, mas nao em vertebrados. Por serem capazes de suscitar uma resposta imunológica e estarem presentes em virtualmente todas as plantas, sao conhecidas como CCDs (Crossreactive carbohydrate determinant). Quando há suspeita de alergia a muitas plantas e se detecta a IgE específica a este componente, há grande chance de reatividade cruzada sem reatividade clínica efetiva42;
- Alfa-gal (nome completo: Gal-a1-3Gal-ß13GlcNAc): trata-se de um açúcar presente na carne de todos os mamíferos, com exceçao dos primatas. A sensibilizaçao ocorre de maneira inusitada, quando o indivíduo entra em contato com o alérgeno através da picada de carrapato. Em indivíduos sensibilizados, a infusao de cetuximabe pode se seguir por manifestaçoes alérgicas imediatas. Sintomas tardios incluindo anafilaxia (3 a 5 horas) podem ocorrer, geralmente após a ingestao de carnes42.
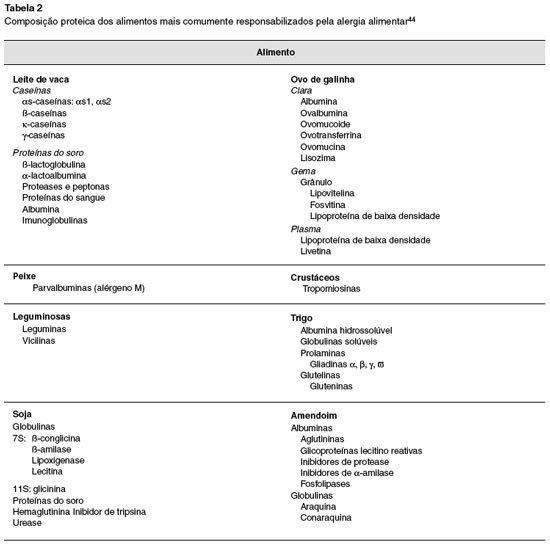
Na Tabela 2 estao representados os alimentos mais comumente envolvidos na alergia alimentar, assim como suas principais proteínas. Pacientes com alergia alimentar podem apresentar perfis diferentes de sensibilizaçao, resultando em manifestaçoes diversas.
Componentes alergênicos e alérgenos alimentares
Embora a maior parte das alergias alimentares se restrinja a um pequeno número de possíveis desencadeantes, estes alimentos sao muito complexos quando se avalia seu potencial alergênico. Cada um destes alimentos é um conjunto de proteínas que pode, de maneira diferenciada, estimular o sistema imunológico a produzir IgEs específicas e causar reaçoes graves. Até mesmo carboidratos de alguns alimentos têm sido descritos como deflagradores de reaçoes. Esta possibilidade de fracionar o alérgeno e entender alguns de seus componentes como de potencial importância para definiçao de risco de reaçao clínica, reatividade cruzada ou mesmo de persistência da alergia, inaugurou uma nova era na alergia, denominada "alergia molecular"41,45.
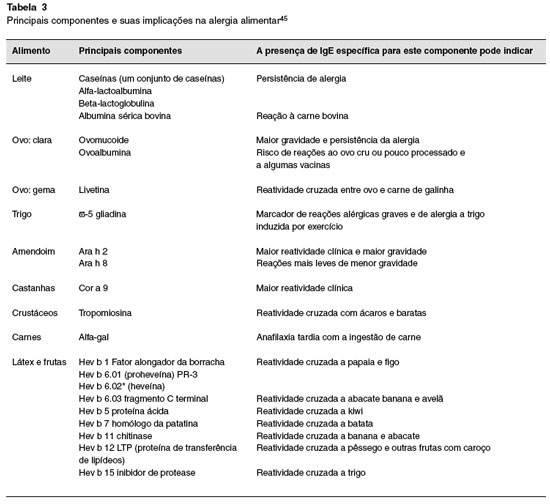
Muito se tem avançado com relaçao aos principais alérgenos, e a Tabela 3 os nomeia e destaca seus principais componentes.
Reatividade cruzada entre alérgenos
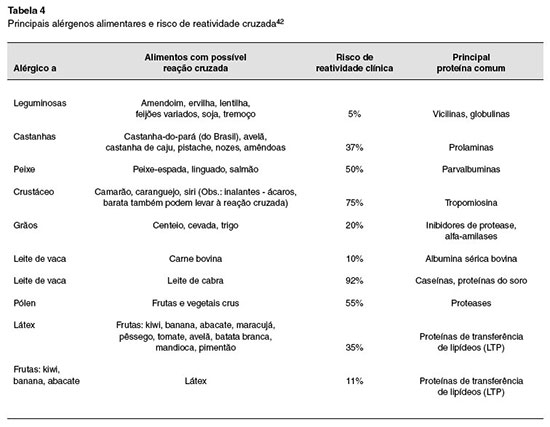
Estudos de biologia molecular documentam que vários alérgenos podem produzir reaçoes cruzadas entre os alimentos. As reaçoes cruzadas ocorrem quando duas proteínas alimentares compartilham parte de uma sequência de aminoácidos que contêm um determinado epítopo alergênico. Alguns alérgenos estao amplamente distribuídos entre diversas espécies e sao, por esta razao, denominados pan-alérgenos. Tropomiosina do camarao ou profilinas de plantas sao exemplos de alérgenos com ampla distribuiçao, facilitando a reatividade cruzada.
As principais proteínas causadoras de reatividades cruzadas com alimentos estao resumidas na Tabela 4. Vale ressaltar, entretanto, que reatividade laboratorial pode nao se refletir em reatividade clínica. Dois clássicos exemplos sao: (a) a positividade da IgE específica para soja em pacientes com alergia a amendoim - ambos sao leguminosas, mas a reatividade clínica é bastante reduzida; (b) a reatividade à carne em pacientes com alergia ao leite de vaca, muito menos frequente do que os resultados de teste cutâneo propoe (instabilidade térmica da proteína comum, albumina sérica bovina)42,45.
Há, entretanto, algumas situaçoes clínicas de reatividade cruzada que devem ser consideradas:
- o leite de vaca é um dos principais alérgenos alimentares em todo o mundo e pacientes alérgicos a suas proteínas apresentam elevadas taxas de reatividade a leites de outros mamíferos, com destaque para cabra, ovelha e búfala. Os leites de égua e de camela apresentam menor percentual de reaçao42,45;
- pacientes alérgicos a proteínas de ovo de galinha reagem à clara de ovo de outras aves. E quando alérgicos à gema, podem apresentar reaçao à carne de frango42,45;
- embora pouco frequentes, algumas reaçoes a carnes têm sido descritas envolvendo albumina sérica, um alérgeno menor do leite, também presente em várias carnes de outros mamíferos. Neste cenário, observa-se a alergia a gato e a porco, onde pacientes com reatividade a alguns alérgenos do gato podem reagir à carne de porco, e a possibilidade de reaçao à carne de vaca em pacientes com alergia às proteínas de leite de vaca. Cerca de 10% apresentam reatividade à realizaçao do teste cutâneo de leitura imediata, com taxas de reatividade clínica bem inferiores42,45, já que a albumina sérica é termolábil, tornando-se menos presente após o cozimento/processamento do alimento;
- com relaçao ao látex, há uma conhecida reatividade cruzada entre alérgenos do látex e algumas frutas. Estima-se que entre 30% e 50% dos alérgicos ao látex apresentem reatividade clínica a algumas frutas, mas somente 11% dos pacientes que apresentam reaçoes a frutas desenvolverao alergia ao látex. Entretanto, nao há estudos recentes que estabeleçam a reatividade clínica entre as frutas deste grupamento. Sabe-se que as frutas mais classicamente relacionadas à síndrome látex-fruta sao: banana, abacate, maracujá, papaia e kiwi, mas um número crescente de alimentos tem adentrado esta lista, com destaque à mandioca, um alimento de grande consumo regional. Alguns dos componentes do látex estao especialmente relacionados à reatividade a frutas42,45;
- a síndrome pólen-fruta, bastante frequente na Europa, é raramente descrita no Brasil. Mas, é importante saber que a sensibilizaçao ocorre durante a inalaçao de polens, e que as proteínas presentes nestas plantas podem apresentar reatividade cruzada com algumas frutas, especialmente se esta fruta for ingerida em sua forma crua. As reaçoes ocorrem basicamente de duas maneiras: edema e urticária em mucosa oral, caracterizando a síndrome da alergia oral ou reaçoes sistêmicas. Na primeira situaçao, o alérgeno é provavelmente sensível ao processo digestivo, e as reaçoes somente ocorrem durante o contado com a mucosa oral, tratando-se provavelmente de um epítopo conformacional. No caso das reaçoes sistêmicas, os epítopos sao resistentes (lineares) e podem causar reaçoes graves, como a anafilaxia42,45.
ADITIVOS ALIMENTARES
Os aditivos alimentares sao representados por antioxidantes, flavorizantes, corantes, conservantes ou espessantes. Apesar de serem frequentemente relacionados com reaçoes adversas, os relatos relacionados à alergia que puderam ser confirmados sao raros e descritos de maneira isolada. Há uma evidente discrepância entre a prevalência de reaçoes adversas a aditivos que é referida pelo paciente ou seus pais (7%) e a prevalência obtida após a realizaçao de testes de provocaçao (0,01-0,23%)46.
Manifestaçoes como urticária, angioedema, asma ou anafilaxia, consequentes a aditivos alimentares, sao extremamente raras, embora possa parecer um pouco mais prevalente entre crianças com atopia (2% a 7%)47. Em uma avaliaçao que incluiu 100 pacientes (14 a 67 anos) com urticaria crônica, 43 referiam piora relacionada com o uso de aditivos. Ao serem avaliados por teste de provocaçao oral unicego com 11 corantes e aditivos alimentares, os autores detectaram apenas 2 pacientes com reaçao adversa a aditivos alimentares, reiterando a raridade do evento46.
Reaçoes a aditivos podem ser consideradas em pacientes com história de sintomas a múltiplos e alimentos mal referidos, ou quando o mesmo alimento provocar reaçoes quando ingerido na forma industrializada, e nao na forma "caseira". Pacientes com manifestaçoes idiopáticas de alergia também merecem investigaçao quanto aos aditivos, mas outros diagnósticos relacionados à anafilaxia idiopática também devem ser considerados, com destaque à mastocitose. Existem alguns relatos de reaçoes anafiláticas relacionadas a aditivos como os sulfitos, eritritol (adoçante fermentativo presente em cervejas, vinhos, soja, queijos e cogumelo), anato (coloraçao amarelada em derivados lácteos, pipoca, cereais e sorvete), açafrao e colorau, ou carmim (corante vermelho)47,48.
De maneira geral há baixa correlaçao entre urticária e angioedema e hipersensibilidade a aditivos como glutamato monossódico, nitratos, benzoatos, parabenzoicos, sulfitos, butil-hidroxi-anisol (BHA), butil-hidroxi-tolueno (BHT) e tartrazina. Esta última, talvez o aditivo mais conhecido, já esteve associada a episódios agudos de asma em indivíduos sensíveis ao ácido acetil-salicílico. Este conceito foi abandonado devido à completa falta de evidências de que a tartrazina faria reaçao cruzada com drogas inibidoras da ciclo-oxigenase47.
A única maneira de se fazer o diagnóstico da reaçao aos aditivos é por intermédio do teste de provocaçao oral. A exceçao do vermelho carmim, um corante de origem proteica, nao existem métodos laboratoriais, in vivo ou in vitro, que possam servir como parâmetro.
FATORES DE RISCO
Pesquisas reconheceram que apenas a exposiçao aos alérgenos nao determina o aumento global na incidência da doença e, assim, a identificaçao de possíveis fatores de risco pode ajudar a elaborar recomendaçoes preventivas para indivíduos considerados de baixo, médio e alto risco para alergia alimentar e outras atopias. Uma série de fatores de risco têm sido associados à alergia alimentar, tais como ser lactente do sexo masculino, etnia asiática e africana, comorbidades alérgicas (dermatite atópica), desmame precoce, insuficiência de vitamina D, reduçao do consumo dietético de ácidos graxos poliinsaturados do tipo ômega 3, reduçao de consumo de antioxidantes, uso de antiácidos que dificulta a digestao dos alérgenos, obesidade como doença inflamatória, época e via de exposiçao aos potenciais alérgenos alimentares e outros fatores relacionados à Hipótese da higiene49,50.
A predisposiçao genética, associada a fatores de risco ambientais, culturais e comportamentais, formam a base para o desencadeamento das alergias alimentares em termos de frequência, gravidade e expressao clínica51. Apesar de vários fatores de risco para alergia alimentar terem sido identificados, ainda nao está claro quais destes fatores sao importantes para a elevaçao da prevalência de alergia alimentar, seja nas formas IgE mediadas como nas nao IgE mediadas52.
Os fatores de risco, quando estao presentes no início da vida, inclusive na gravidez, sao de fundamental importância. O ideal seria a avaliaçao da predisposiçao genética, antes ou pelo menos ao nascimento, e a partir da identificaçao dos vários fatores de risco efetuar a aplicaçao imediata de métodos preventivos52.
Os fatores de risco já identificados, que podem agir na gestante (pré-sensibilizantes) ou atuar diretamente na criança e no adulto, serao detalhados a seguir.
Herança genética
Estima-se que os fatores genéticos exerçam papel fundamental na expressao da doença alérgica, especialmente nas formas mediadas pela IgE. Embora nao haja, no momento, testes genéticos diagnósticos disponíveis para identificar indivíduos com risco de alergia alimentar, a história familiar de atopia ainda é o melhor indicativo de risco para o seu aparecimento. Em estudo com lactentes comprovadamente diagnosticados com alergia alimentar, o risco de alergia alimentar foi aumentado para 40% se um membro da família nuclear apresentasse qualquer doença alérgica, e em 80% quando isto aconteceu em dois familiares próximos52,53. Assim, a expressao da herança genética é mais intensa quando há antecedentes bilateralmente (pai e mae), determinando sintomas mais precoces e frequentes.
Embora haja alguma evidência que implique genes específicos na susceptibilidade a alergias alimentares, os estudos nao foram replicados em grande escala. As mutaçoes que acarretam perda de funçao no gene da filagrina foram associadas à alergia ao amendoim, independente da presença da dermatite atópica, e levantou a possibilidade da pele funcionar como uma via potencial de sensibilizaçao49. Na Dinamarca, as mutaçoes do gene da filagrina também foram associadas ao aumento de alergia referida a ovo, leite de vaca, trigo e peixes, bem como à presença de níveis elevados de IgE específicos à proteína do leite de vaca, todavia, ainda é controversa a participaçao determinante da filagrina na alergia alimentar, especialmente em pacientes com história familiar de doenças alérgicas54-56. Os polimorfismos no gene STAT6 foram associados à sensibilizaçao e retardo na tolerância em alergia ao leite de vaca57.
Embora pareça muito provável que haja base genética para o desenvolvimento de alergias alimentares, sao necessários mais estudos para identificar os loci específicos envolvidos, e como ainda nao é possível modificá-la, todas as açoes devem ser direcionadas ao ambiente, no sentido de estabelecer os fatores de risco e, a partir destes, tentar evitar a sensibilizaçao alérgica.
Fatores dietéticos
Alimentaçao da gestante e da nutriz
A alimentaçao bem balanceada ajuda a modular o perfil imunológico do bebê. O papel da dieta na gestante sobre o desenvolvimento de alergia alimentar ainda permanece controverso. A maioria das sociedades científicas internacionais, consistentemente, orientam todas as maes a consumirem dietas normais, balanceadas e equilibradas sem restriçoes durante a gestaçao e a lactaçao52,58-60.
Revisao sistemática e metanálise enfatizou nao haver evidências para apoiar uma associaçao entre o consumo de peixe, vitamina A, vitamina C, vitamina E ou zinco durante a gravidez e alergia alimentar no bebê61. O consumo de frutas cítricas associouse a maiores taxas de sensibilizaçao, mas nao de alergia62.
O consumo materno de proteínas e de carboidratos em alimentos lácteos nao é per se fator de risco para alergia alimentar no lactente, com dúvidas nos com história familiar de alergia às proteínas do leite de vaca. Da mesma forma, nao há estudos que indiquem que o consumo de ovo seja fator de risco, inclusive nos casos com familiares alérgicos a este alimento. Assim, a recomendaçao é que nao haja qualquer restriçao alimentar durante a gravidez60.
Em relaçao ao consumo de amendoim na gestaçao, o estudo ALSPAC (Avon Longitudinal Study of Parents and Children) nao mostrou efeito do consumo de amendoim na gestaçao e lactaçao e o desenvolvimento de reaçoes clínicas ou imunológicas ao amendoim na criança até os 4 a 6 anos de idade63.
Assim, nao há evidências consistentes de benefícios quanto à modificaçao da dieta de gestantes e lactantes visando a prevençao da alergia alimentar e, portanto, todas as maes, independentemente do risco familiar para alergias, deveriam receber dieta balanceada e equilibrada nessas fases. No entanto, ainda há controvérsias na comunidade científica, uma vez que outros estudos indicam que tanto a sensibilizaçao quanto a tolerância imunológica, principalmente ao amendoim, leite de vaca e ovo, pode acontecer através da amamentaçao52,63. Apesar disso, a recomendaçao atual é de nao se prescrever dieta de exclusao durante a gravidez e a lactaçao60.
Privaçao do aleitamento materno
O aleitamento materno e o ato de amamentar sao de extrema importância na promoçao da saúde e na prevençao de doenças em curto e longo prazo, para a nutriz e seu filho. Assim, o aleitamento materno deve ser recomendado de forma exclusiva até o sexto mês e complementado (por meio de alimentaçao complementar balanceada e equilibrada) até os dois anos ou mais64.
O leite materno contém IgA secretora, que funciona como bloqueador de antígenos alimentares e ambientais, bem como vários fatores de amadurecimento da barreira intestinal e fatores imunorreguladores importantes no estabelecimento da microbiota. O leite materno tem papel importante na induçao de tolerância oral, quando o alimento alergênico é introduzido de forma complementar, em pequenas quantidades.
O aleitamento materno exclusivo, sem a introduçao de leite de vaca, de fórmulas infantis à base de leite de vaca e de alimentos complementares até os seis meses tem sido ressaltado como eficaz na prevençao do aparecimento de sintomas alérgicos. Estudo de revisao de trabalhos que avaliaram o efeito protetor do leite materno entre lactentes com risco familiar de alergia alimentar ao serem amamentados exclusivamente até os quatro meses de vida, demonstrou reduçao na incidência cumulativa de alergia às proteínas do leite de vaca até os 18 meses, e de dermatite atópica até os três anos de idade43.
Uso de fórmulas lácteas
Receber fórmulas de leite de vaca, ainda no berçário, pode ser indutor de disbiose intestinal, e fator de risco importante de alergia alimentar. Da mesma forma, em crianças de alto risco, vários estudos avaliaram o uso de fórmulas de soja ou hidrolisados proteicos na reduçao do risco de alergia às proteínas do leite de vaca. A soja nao determinou reduçao do risco e nao é apropriada para utilizaçao em lactentes menores de 6 meses. O emprego de fórmulas hidrolisadas a crianças sem a possibilidade de aleitamento natural e com alto risco de alergia alimentar, com o intuito de reduzir a incidência de alergia às proteínas do leite de vaca e de outras doenças alérgicas acompanhou-se de resultados contraditórios65-67.
Há algumas evidências que sugerem que fórmulas de soro do leite de vaca parcialmente hidrolisadas e fórmulas de caseína extensamente hidrolisadas podem diminuir o risco de desenvolver eczema para lactentes com alto risco de doença alérgica60. A evidência de um efeito preventivo de fórmulas hidrolisadas sobre rinite alérgica, alergia alimentar e asma é inconsistente e insuficiente68
Introduçao precoce de alimentos sólidos
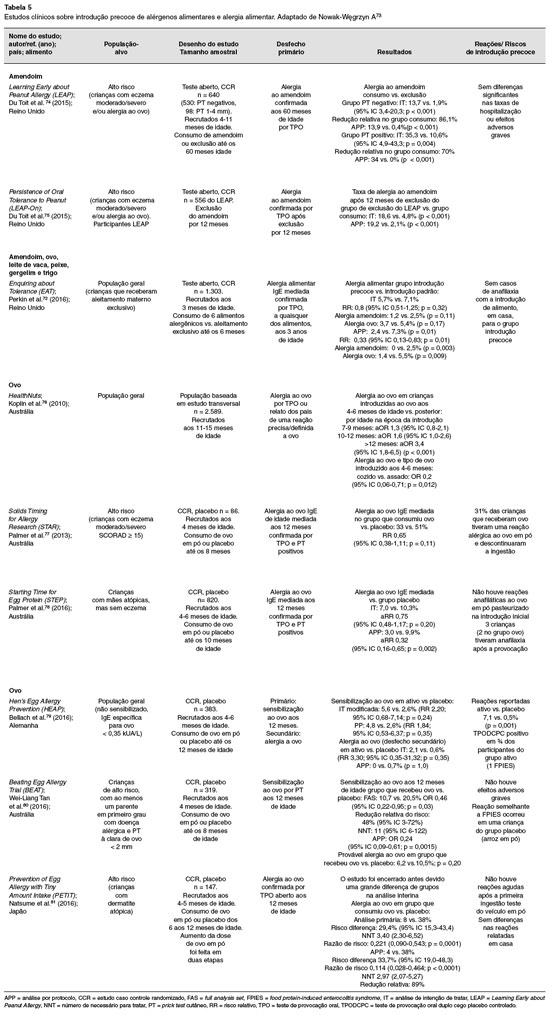
A introduçao precoce de leite de vaca, ovo, amendoim, castanhas, peixe e frutos do mar poderia ser fator de risco e induzir o desenvolvimento de alergia alimentar. Contudo, na atualidade a noçao é oposta, de que a exclusao por tempo prolongado de alimentos com potencial alergênico pode ser fator de risco porque a induçao da tolerância oral poderia ser alcançada por outras rotas de exposiçao, particularmente através da pele, em especial quando inflamada em pacientes com dermatite atópica. A maior diversidade de alimentos na infância pode ter efeito protetor sobre a sensibilizaçao alimentar, bem como prevenir a alergia alimentar clínica, mais tarde na infância54,69-71.
É importante ressaltar que há falta de evidências de benefícios para introduzir alimentos precocemente, visando a prevençao de alergia alimentar64. Os estudos disponíveis enfocam a prevençao nas formas de alergia mediadas por IgE, portanto, nao se conhece o efeito dessa introduçao nas formas nao-IgE mediadas39. Recomenda-se entao manter a norma da OMS, em funçao dos inúmeros benefícios para a saúde materna e infantil (em curto e longo prazo): "aleitamento materno exclusivo até o sexto mês e complementado (alimentaçao complementar saudável, balanceada e equilibrada) até dois anos ou mais". Há ainda, como demonstrado pelo EAT Study, preocupaçoes a respeito do aumento do risco de FPIES com a introduçao precoce de alimentos alergênicos (antes dos três meses)72.
A Tabela 5 reúne os principais estudos que avaliaram a introduçao precoce de alimentos sobre a evoluçao da alergia alimentar.
Disbiose intestinal
Logo após o nascimento, inicia-se a colonizaçao do recém-nascido. Alguns fatores que interferem nesse processo sao: parto cesariano, uso materno de antibiótico, condiçoes excessivas de higiene e o uso de fórmula complementar oferecida à criança que pode resultar em disbiose. O leite materno é rico em oligossacarídeos, responsáveis pelo efeito bifidogênico, o que faz com que lactentes em aleitamento materno tenham aumento de bifidobactérias em seu trato gastrintestinal. Já as crianças que recebem fórmulas infantis ou leite de vaca integral desenvolvem uma microbiota intestinal com predomínio de enterobactérias e bacteroides, tornando o sistema imunológico mais vulnerável à quebra de tolerância. Algumas pesquisas sugerem que a alimentaçao precoce com probióticos poderia reduzir o desenvolvimento de doenças alérgicas, particularmente dermatite atópica, mas outros estudos discordam sobre o papel dos probióticos na infância precoce sobre o desenvolvimento de alergia alimentar ou outras doenças alérgicas82,83.
Revisao sistemática avaliou a influência da exposiçao microbiana sobre o aparecimento de alergia alimentar, incluindo nascimento por parto cesariano, presença de irmaos, atendimento em creches e tratamento com probióticos, e nao documentou evidências de qualquer efeito protetor84. Várias organizaçoes internacionais de especialistas nao recomendam o uso de probióticos e prebióticos para a prevençao primária de doenças alérgicas. Metanálise recente envolvendo o documento da World Allergy Organization (WAO) reconhece que as recomendaçoes de ambos, prebióticos e probióticos, é condicional e baseada em recomendaçoes de baixa qualidade de evidência85.
Insuficiência de vitamina D
A insuficiência de vitamina D (abaixo de 15 ng/mL) foi associada a risco aumentado para a sensibilizaçao ao amendoim63. A insuficiência de vitamina D como fator de risco para alergia alimentar é mais frequente em países distantes do Equador e com menor radiaçao ultravioleta86, apesar desta associaçao ser controversa87. Estudo duplo cego randômico, ainda em andamento, propôs-se avaliar o papel da suplementaçao de vitamina D em desfechos relacionados ao sistema imunológico88.
Fatores comportamentais e culturais
Estes fatores também estao associados ao risco de alergia alimentar, e podem ser modificáveis. Os filhos de gestantes que fumaram na gravidez apresentam níveis elevados de IgE e eosinofilia no sangue do cordao umbilical, sugerindo que este irritante respiratório pode ser indutor de desvio Th2 e consequentemente, de doença alérgica. Do mesmo modo, o consumo de álcool durante a gestaçao encontra-se documentado como um fator de risco importante, com elevaçao da IgE específica para antígenos alimentares e aeroalérgenos. Crianças expostas no início da vida a irmaos mais velhos e animais de estimaçao em casa podem apresentar menor risco de alergia ao ovo aos 12 meses, em decorrência da estimulaçao do microbioma, o que pode ter efeito protetor em termos de desenvolvimento de alergia89.
Comorbidades alérgicas
Comorbidades alérgicas sao fatores de risco para o desenvolvimento de alergia alimentar. Estudos indicam que a alergia alimentar pode predispor à asma, e, da mesma forma, a asma pode predispor à alergia alimentar. Estudo de seguimento de lactentes verificou que a dermatite atópica grave e alergia ao ovo foram fatores de risco para sensibilizaçao ao amendoim52,59,70.
MICROBIOTA INTESTINAL
A microbiota intestinal tem íntima relaçao com os elementos imunológicos subjacentes ao epitélio intestinal e, assim, participa do processo de tolerância imunológica para antígenos alimentares. Inicialmente o efeito ocorre por meio do processamento dos antígenos, reduzindo sua alergenicidade e, posteriormente, melhorando as funçoes de barreira. A microbiota é capaz de modular a resposta imunológica, com ativaçao de células linfocitárias intraepiteliais e de linfócitos da lâmina própria, que se diferenciam em células reguladoras, fundamentais para estes mecanismos de tolerância imunológica29.
Neste sentido, em analogia à influência da microbiota intestinal sobre o sistema imunológico, a utilizaçao de cepas probióticas poderia prevenir o aparecimento de alergias na infância. Em 2001, estudo pioneiro com grávidas de risco para atopia, utilizando Lactobacilos GG ou placebo, no período pré e pós-natal, mostrou reduçao, aos sete anos de vida, na prevalência de eczema atópico à metade, em comparaçao àquelas crianças cujas maes receberam placebo durante a gestaçao; este efeito protetor permaneceu até os quatro anos de idade90,91.
Para avaliar a relaçao entre o uso de probióticos com as alergias cutâneas, respiratórias e alimentares, muitos estudos clínicos e experimentais vêm sendo desenvolvidos. Dentre estes, alguns apontam que cepas probióticas específicas podem ser eficazes no tratamento de um subgrupo de pacientes, sobretudo naqueles onde existe alergia a um único alimento. Neste sentido, a utilizaçao de cepas de Lactobacillus GG adicionadas à fórmula extensamente hidrolisada ou à imunoterapia sublingual promoveram aquisiçao de tolerância oral mais precocemente em pacientes com alergia às proteínas do leite de vaca e alergia ao amendoim, respectivamente92,93. Metanálise (17 estudos e 4.755 crianças, realizada em 2015) mostrou risco relativo significantemente inferior para desenvolver alergias no grupo probiótico, quando comparado ao controle, sobretudo para aquelas gestantes que receberam mistura de cepas probióticas, em relaçao às que receberam uma cepa isoladamente94.
Por conta de desenhos e desfechos diferentes e, sobretudo, pela utilizaçao de cepas diferentes, a interpretaçao em conjunto destes estudos tornase inconsistente, sobretudo para uma afirmaçao consensual. Por isso, os comitês de nutriçao das sociedades europeias de alergia (EAACI) e de gastroenterologia pediátrica (ESPGHAN) nao recomendam a utilizaçao de pré, probióticos ou outros suplementos dietéticos na prevençao de alergia alimentar. No entanto, a Organizaçao Mundial de Alergia, em 2015, sugere a utilizaçao de probióticos na grávida, na lactante e no lactente de risco para o desenvolvimento de alergias futuras, sobretudo nos com risco de dermatite atópica, realçando a fraca qualidade da recomendaçao69,95,96.
REAÇOES DE HIPERSENSIBILIDADE: IGE E NAO-IGE MEDIADAS
As manifestaçoes clínicas das reaçoes de hipersensibilidade aos alimentos sao dependentes dos mecanismos imunológicos envolvidos. Enquanto as reaçoes mediadas por IgE tipicamente ocorrem minutos após a exposiçao ao alimento envolvido, as nao-mediadas por IgE e as formas mistas podem demorar de horas até dias para se tornarem clinicamente evidentes97.
As respostas de hipersensibilidade induzidas por antígenos alimentares mediadas por IgE podem ser o resultado de falta da induçao ou quebra dos mecanismos de tolerância oral no trato gastrintestinal, que ocorrem em indivíduos geneticamente predispostos98. Tanto na falta de induçao, como na quebra dos mecanismos de tolerância, ocorre produçao excessiva de IgE específica ao alimento envolvido. Estes anticorpos ligam-se a receptores de alta afinidade (FceRI), presentes em mastócitos e basófilos e em receptores de baixa afinidade (FceRII), presentes em macrófagos, monócitos, linfócitos, eosinófilos e plaquetas. Com uma nova exposiçao ao alérgeno alimentar, ocorre sua ligaçao aos anticorpos IgE específicos, fixados em mastócitos e basófilos, sendo liberados mediadores como histamina, prostaglandinas e leucotrienos, que promovem vasodilataçao, contraçao do músculo liso e secreçao de muco, com induçao de sintomas característicos. A ativaçao de mastócitos também promove a liberaçao de várias citocinas, que sao importantes na fase tardia da resposta IgE-mediada.
Embora vários relatos discutam outros mecanismos de hipersensibilidade nao mediados por IgE, as evidências que dao respaldo ao seu papel sao limitadas, sendo a resposta de hipersensibilidade celular tipo IV (induzida por células), a mais relacionada com várias doenças, e nela a resposta clínica pode ocorrer de várias horas até dias após a ingestao do alimento suspeito. Esta resposta celular pode contribuir em várias reaçoes aos alimentos, como nas enterocolites e nas enteropatias induzidas por proteínas alimentares, mas há necessidade de mais estudos comprovando esse mecanismo imunológico99,100.
MANIFESTAÇOES CLINICAS DE HIPERSENSIBILIDADE A ALIMENTOS
Cutâneas
As manifestaçoes cutâneas de alergia alimentar estao entre as mais descritas, sendo mais prevalentes nas alergias IgE mediadas101. Entre as manifestaçoes cutâneas de hipersensibilidade alimentar, destacamse: urticária, angioedema e dermatite atópica.
Urticária e angioedema
A pele é o principal órgao acometido nas manifestaçoes agudas de alergia alimentar, IgE mediadas, sendo a urticária e o angioedema os sintomas mais prevalentes. A urticária é caracterizada pela presença de pápulas eritematosas bem delimitadas na pele, de contornos geográficos com halo central e, em geral, intensamente pruriginosas. As lesoes resultam do extravasamento de líquido oriundo de pequenos vasos ou de capilares à derme superficial. No angioedema, o processo é semelhante, mas há acometimento de porçoes mais profundas da pele. É preciso lembrar que alergia alimentar como causa de urticária ocorre em cerca de 20% dos casos de urticária aguda e menos de 8% nos casos de urticária crônica, sendo necessário muito cuidado na valorizaçao do alimento como fonte desencadeante.
Por outro lado, a urticária pode ser o sintoma inicial de anafilaxia, uma vez que cerca de 90% dos pacientes que desenvolvem esta reaçao grave apresentam manifestaçoes dermatológicas. A urticária de contato também é bastante descrita na alergia alimentar, caracterizada pela formaçao da pápula no exato local ou bem próximo do contato do alimento com a pele.Vale destacar que a presença de urticária de contato nao é necessariamente sinal de manifestaçao sistêmica de alergia alimentar. Ela é mediada por IgE, e apesar de ser reconhecida como urticária de contato, deve ser diferenciada do eczema de contato, resultante da exposiçao crônica a determinado alérgeno agressor, inclusive alimentos (doença profissional na maior parte dos casos), e resultante da resposta dos linfócitos T frente ao alérgeno alimentar6,101.
A urticária induzida por alimentos pode vir acompanhada de sintomas gastrintestinais ou respiratórios e, neste caso, caracteriza-se uma anafilaxia. Por ser reaçao do tipo imediato, a identificaçao do alimento envolvido pode ser mais fácil, uma vez que a manifestaçao ocorre até duas horas após a ingestao do alimento6,101.
A liberaçao nao imunológica de histamina pode ocorrer após a ingestao de algumas frutas, como morango e banana, certos queijos e tomate. Da mesma forma há ativaçao de mastócitos de maneira inespecífica frente a bactérias presentes em alimentos contaminados ou em peixes em mal estado de conservaçao, que podem converter a histidina em níveis elevados de histamina, gerando urticária por intoxicaçao exógena; esta situaçao pode ser confundida com alergia alimentar6,101.
Dermatite atópica
Uma das manifestaçoes mais controversas de alergia alimentar é a dermatite atópica, pela dificuldade do estabelecimento de causalidade entre ingestao do alimento e piora das lesoes e pela complexidade da fisiopatologia da doença. Entretanto, em estudos que utilizaram testes de provocaçao duplo-cego controlado por placebo para avaliar a piora da dermatite atópica, observou-se haver relaçao de piora dos sintomas em até 30% dos casos, especialmente em crianças que desenvolveram a doença precocemente e que apresentam a doença nas formas moderada ou grave. Nos Estados Unidos, o principal alimento envolvido na dermatite atópica é o ovo, seguido pelo leite de vaca, soja e amendoim (cerca de 80% dos pacientes com dermatite atópica cuja etiologia sejam alimentos apresentam o ovo como alérgeno desencadeante). Deve ser destacado que grande parte dos pacientes com dermatite atópica apresentam níveis séricos elevados de IgE total e podem apresentar reatividade aos testes laboratoriais de forma inespecífica, sendo necessário confirmálos por meio da história clínica. Para confirmaçao da relaçao entre o alimento e a dermatite atópica podem ser necessárias dietas de exclusao por um tempo limitado (4 semanas), seguidas de nova introduçao de alimentos. Muito importante lembrar que houve descriçao de reaçoes IgE mediadas após ingestao do alimento em pacientes com dermatite atópica que realizaram dieta de exclusao por tempo prolongado6,101,102.
Manifestaçoes gastrintestinais
As manifestaçoes gastrintestinais na alergia alimentar podem ser variadas na dependência dos mecanismos fisiopatológicos envolvidos: mediados por IgE ou nao mediados por IgE.
Síndrome da alergia oral
A síndrome da alergia oral acomete basicamente a orofaringe. Os principais alimentos desencadeantes sao frutas e vegetais frescos. Esta reaçao alérgica, que simula a alergia de contato, é precedida por sensibilizaçao por via respiratória a polens que contêm proteínas homólogas às encontradas em determinadas frutas (banana, cereja, kiwi, maça, nozes, pera), castanhas e vegetais (aipo, batata e cenoura). As proteínas responsáveis por este tipo de reaçao, em geral, sao sensíveis ao calor, razao pela qual estes alimentos nao geram reaçoes quando consumidos após cocçao. Este quadro ocorre predominantemente em adultos. Na criança pode ocorrer reaçao ao leite de vaca e ovo44,103.
As manifestaçoes clínicas têm início logo após a exposiçao ao alérgeno e incluem edema, hiperemia, prurido e sensaçao de queimaçao nos lábios, língua, palato e garganta. Os sintomas costumam ser breves. Raramente ocorre disfagia, náuseas e dor abdominal, edema de glote e anafilaxia44,103.
Sintomas orais idênticos à síndrome de alergia oral podem ser a manifestaçao inicial de reaçao sistêmica em pacientes com alergia a alimentos como leite de vaca e ovo (nao relacionadas com o pólen). Portanto, pacientes com alergia alimentar com sintomas orais devem ser avaliados quanto à necessidade de tratamento imediato103.
Hipersensibilidade gastrintestinal imediata
Hipersensibilidade gastrintestinal imediata (ou anafilaxia gastrintestinal) caracteriza-se por náuseas, vômitos, dor abdominal e diarreia que aparecem em minutos ou até duas horas após a ingestao do alérgeno44,103. Em crianças com menor idade, vômito imediato nem sempre é a principal manifestaçao. Podem ocorrer vômitos intermitentes acompanhados de déficit de crescimento44. As manifestaçoes gastrintestinais acompanhadas por outras manifestaçoes alérgicas acometendo a pele e/ou o pulmao caracterizam a anafilaxia. O tratamento deve ser imediato, e as manifestaçoes clínicas diminuem após a administraçao de adrenalina103.
Esofagite eosinofílica
A esofagite eosinofílica (EoE) representa uma enfermidade crônica e mediada imunologicamente do esôfago, caracterizada clinicamente por manifestaçoes de disfunçao esofagiana e histologicamente por inflamaçao predominantemente eosinofílica. O diagnóstico é feito pela endoscopia digestiva alta com biópsias que revelam infiltrado eosinofílico no esôfago em número maior ou igual a 15 eosinófilos por campo de grande aumento (CGA). A EoE é uma doença emergente no mundo inteiro, como documentada em muitos países104. No Brasil, apesar de algumas séries de casos publicadas, nao há uma taxa de prevalência oficial105,106.
A EoE é definida atualmente como uma entidade clínico-patológica caracterizada por: (a) sintomas de problemas alimentares e de doença do refluxo gastroesofágico (DRGE) na criança menor e, principalmente, de disfagia e impactaçao alimentar no esôfago nas crianças maiores e nos adultos; (b) infiltrado eosinofílico em contagem igual ou superior a 15 eos/CGA no esôfago; (c) ausência de aumento de eosinófilos em outros segmentos do tubo digestivo e exclusao de outras doenças que poderiam causar eosinofilia esofágica, como doença inflamatória intestinal, síndrome hipereosinofílica, infecçoes, e outras doenças107,108.
A endoscopia digestiva alta com biópsias é essencial para o diagnóstico. Os achados endoscópicos incluem anéis concêntricos fixos e/ou transitórios, exsudato granular em forma de pontilhado esbranquiçado, sulcos ou estrias verticais, edema com apagamento da trama vascular, estreitamento do calibre esofágico, estenoses e fragilidade da mucosa tipo "papel crepom". Histologicamente temos infiltrado eosinofílico, que reforça o diagnóstico109.
A EoE ocorre mais frequentemente no sexo masculino (até 80%), e alguns estudos relatam a existência de atopia em até 81% dos pacientes, com positividade em provas de diagnóstico (IgE sérica específica e teste cutâneo de leitura imediata), e às vezes com os testes de contato alérgico (patch test). Isso demonstra uma provável participaçao de mecanismos de hipersensibilidade imediata e tardia na etiopatogenia da EoE110.
A EoE é uma doença crônica, com períodos de melhora e de piora dos sintomas, o que traz a necessidade de tratamento adequado. Nao existe consenso sobre o tratamento ideal para os pacientes com EoE, entretanto, sao prescritos dieta de restriçao com ou sem medicaçoes (inibidores de bomba de prótons [IBP] ou corticosteroides tópicos) e dilataçoes. Após a confirmaçao histológica (> 15 eos/CGA), é recomendado iniciar o tratamento com IBP (1 a 2 mg/Kg/ dose), 2 doses ao dia, por 8 a 12 semanas, quando a endoscopia e biópsia devem ser repetidas. Se houver reduçao do número de eosinófilos (< 15 eos/CGA), o paciente pode ser mantido somente com IBP e tenta-se diminuir a dose para uma vez ao dia. Por outro lado, se nao houver resposta e persistência da eosinofilia, deve-se optar pelo tratamento dietético ou com corticosteroides110.
As opçoes terapêuticas atuais incluem a utilizaçao de dietas de restriçao, empíricas ou baseadas nos testes alérgicos, e o uso de corticosteroides tópicos deglutidos ou, muito eventualmente, sistêmico110-112.
A maioria dos pacientes (97%) com EoE responde à dieta elementar (fórmulas de aminoácidos), com resoluçao dos sintomas e melhora da histologia. A rápida resoluçao dos sintomas com a dieta elementar é muito animadora, e pode ser utilizada para a melhora do paciente. No entanto, a palatabilidade, o preço e a necessidade de grandes volumes de dieta ainda sao obstáculos para esta modalidade de tratamento. Grande parte dos pacientes precisa utilizar sondas nasogástricas para receber a quantidade adequada de fórmula de aminoácidos. Nestes pacientes, depois da melhora clínica, os alimentos podem ser reiniciados gradualmente com acompanhamento clínico e endoscópico. Outras opçoes incluem a dieta de exclusao de seis alimentos (leite de vaca, ovo, soja, trigo, amendoim e frutos do mar), de quatro alimentos (leite, ovo, soja, trigo), de dois alimentos (leite e trigo) ou mesmo apenas de leite de vaca. Essas alternativas geralmente sao mais aceitas do que a dieta elementar devido à melhor adesao ao tratamento pelo paciente, porém os índices de sucesso sao menores e caem significantemente segundo o número de alimentos retirados110,113.
O uso de corticosteroides tópicos (fluticasona e budesonida) deglutidos tem demonstrado bons resultados. Os dispositivos empregados no tratamento da asma sao os utilizados. Os jatos devem ser disparados diretamente na orofaringe e a seguir deglutidos, recomendando-se ao paciente nao ingerir alimentos ou líquidos, por via oral, durante meia hora a uma hora após a administraçao do medicamento. Outra opçao é o uso de uma formulaçao de corticosteroide tópico, budesonida tópica viscosa (budesonida misturada com sucralose) com índices positivos de melhora clínica, histológica e endoscópica110,114-116. Os corticosteroides sistêmicos sao eficazes no tratamento da EoE grave e sao capazes de induzir melhora clínica e histológica. No entanto, a recidiva após a sua suspensao faz com que seja necessário repetir seu uso com maior chance de desenvolvimento de efeitos colaterais.
O prognóstico dos pacientes ainda nao está bem estabelecido, mas aparentemente os sintomas tendem a recorrer ou persistir até a idade adulta, com períodos de melhora e piora. O desenvolvimento de estenoses fibróticas, decorrentes da inflamaçao crônica e deposiçao de colágeno, sao as possíveis complicaçoes de longo prazo descritas. Até o momento, nao há casos de malignidade associados à EoE110.
Gastrite / Duodenite eosinofílicas
Embora o número crescente de casos de EoE, há poucos estudos epidemiológicos sobre as outras doenças eosinofílicas do TGI. O diagnóstico de doenças eosinofílicas nem sempre é fácil, devido ao fato de que o número de eosinófilos nos diferentes segmentos do trato gastrointestinal nao é bem estabelecido, e porque requer exclusao de outras causas de eosinofilia tecidual117.
A gastrite eosinofílica alérgica é decorrente de reaçao de hipersensibilidade a alimentos do tipo mista (IgE mediada e nao IgE-mediada), e caracterizada pela presença de processo inflamatório eosinofílico, em geral na camada mucosa. A gastrite eosinofílica alérgica é mais comum em lactentes e adolescentes, podendo comprometer recém-nascidos também. Nestes casos, em geral apenas um único alérgeno alimentar está envolvido. Os alérgenos alimentares mais frequentemente implicados sao: leite de vaca, milho, soja e amendoim116. Crianças maiores costumam apresentar alergia a múltiplos alérgenos. Os pacientes podem se apresentar com infiltrado eosinofílico no duodeno configurando a duodenite eosinofílica, que pode se apresentar com sintomas obstrutivos.
Os sintomas incluem: vômitos, dor abdominal, anorexia, saciedade precoce, hematêmese/sangramento gástrico, déficit de crescimento, e mais raramente, sintomas de obstruçao antral ou duodenal. Caracteriza-se ainda por ausência de resposta ao tratamento convencional com anti-histamínicos H2 ou IBP. Aproximadamente 50% dos pacientes têm atopia, níveis elevados de IgE sérica e eosinofilia periférica.
A relaçao entre o alérgeno alimentar causal e o resultado positivo aos testes cutâneos de hipersensibilidade imediata é fraca, com especificidade menor que 50%. O tratamento e a evoluçao apresentam semelhanças com os das outras doenças eosinofílicas, e sao pacientes que respondem a corticosteroides. O problema é a alta taxa de recidiva após a retirada da medicaçao. A resposta à eliminaçao do alérgeno alimentar, e nos casos graves, o uso de fórmulas e dietas à base de aminoácidos, é excelente118.
Estudo recente nos EUA demonstrou ser a prevalência de gastrite eosinofílica de 5,1 casos/100.000 habitantes e o da colite alérgica de 2,1/100.000 habitantes118,119.
A gastroenterite eosinofílica é mais prevalente na faixa etária pediátrica105. Compreende o infiltrado eosinofílico patológico de qualquer porçao do trato digestório e parece ser exemplo de hipersensibilidade a alimentos de tipo mista, mediada por células Th2119. Acomete crianças em qualquer idade e apresenta sintomas semelhantes àqueles descritos na esofagite e gastrite eosinofílicas alérgicas, pois também apresenta processo inflamatório eosinofílico nas camadas mucosa, muscular e/ou serosa do estômago e intestino. Deste modo, o comprometimento do intestino delgado determina sintomas de má absorçao e de enteropatia perdedora de proteínas, que podem ser proeminentes e traduzidos por acentuado déficit pôndero-estatural, hipogamaglobulinemia e edema generalizado, secundário à hipoalbuminemia. Aproximadamente 70% dos pacientes com gastroenterite eosinofílica sao atópicos e têm níveis séricos elevados de IgE total e específica. A eosinofilia periférica pode ser observada em 50% dos casos. O leite de vaca, os cereais, a soja, o peixe e o ovo sao os alérgenos alimentares mais frequentemente implicados. A especificidade do teste cutâneo é menor que 50%.
A resposta à eliminaçao do alérgeno alimentar é obtida em aproximadamente 50% dos casos após três a oito semanas da exclusao. Semelhante à esofagite e à gastrite eosinofílicas, a gastroenterite eosinofílica apresenta excelente resposta às fórmulas e dietas extensamente hidrolisadas, e principalmente, às fórmulas à base de aminoácidos nos lactentes pequenos com quadros graves, assim como nos que necessitam hospitalizaçao.
Refluxo gastroesofágico por alergia alimentar
Muitos lactentes nos primeiros meses de vida apresentam sintomas de refluxo gastroesofágico (RGE), especialmente regurgitaçoes, vômitos ocasionais e algum grau de desconforto. Esses sintomas, acompanhados de boa aceitaçao alimentar e ganho ponderal adequado, caracterizam o RGE fisiológico, de ocorrência muito comum e potencialmente autolimitado até o final do primeiro ano de vida120.
Há situaçoes, em que os sintomas de RGE sao mais expressivos, tais como vômitos propulsivos, regurgitaçoes frequentes, má aceitaçao alimentar, choro excessivo, arqueamento de tronco e desaceleraçao do ganho ponderal, que podem caracterizar a doença do RGE ou o RGE secundário à alergia alimentar. Há publicaçoes que indicam ocorrência de alergia às proteínas do leite de vaca em quase a metade dos casos graves de RGE em lactentes121.
Dados como início dos sintomas após a introduçao de fórmula, história familiar de alergia alimentar e presença de dermatite atópica aumentam a suspeiçao de alergia às proteínas do leite de vaca. As reaçoes imunologicamente mediadas nesses casos sao especialmente nao-IgE e envolvem a participaçao de eosinófilos, mastócitos e citocinas Th2, como a IL-13. Ocorre dismotilidade do trato digestivo superior, bradigastria, resultando em vômitos e retardo do esvaziamento gástrico. Estudos recentes que utilizam a impedâncio-pHmetria esofágica durante a provocaçao com fórmula à base de LV apontam para a ocorrência de RGE fracamente ácidos, em maior número e mais duradouros durante a prova. Esses episódios de refluxo provavelmente nao apresentarao resposta ao emprego de inibidores de secreçao ácida122,123.
Nao há um mecanismo imunologicamente mediado na patogenia da DRGE, porém na prática, o emprego de fórmulas com proteínas extensamente hidrolisadas promove a aceleraçao do esvaziamento gástrico, resultando em melhora dos sintomas em ambas as situaçoes. O diagnóstico definitivo de alergia deverá ser firmado após teste de provocaçao oral, realizado em geral, 2 a 4 semanas após estabilizaçao do quadro clínico, onde a ingestao de proteína do leite de vaca provoca retorno dos sintomas124.
Há um subgrupo de lactentes com RGE grave e alergia alimentar que nao respondem convenientemente ao tratamento nutricional, e que necessitam de endoscopia digestiva alta, no sentido de detectar esofagite eosinofílica ou gastroenteropatia eosinofílica125.
Cólica do lactente/choro excessivo
A cólica do lactente, segundo os critérios de Roma IV, é classificada como doença de ordem funcional, tendo início precoce e finda em lactentes menores de 3 meses de idade. Tem início abrupto, sem causa aparente, com duraçao de poucas horas, alternando na apresentaçao períodos de choro agudo com períodos de irritabilidade e desconforto. Os episódios álgicos sao referidos pelos pais ou cuidadores como de difícil controle. Nao há igualmente medidas preventivas claras e eficazes. O lactente nao apresenta alteraçao do estado nutricional, febre ou doença orgânica detectável126.
As cólicas ocorrem com maior intensidade entre 4-6 semanas de vida, com nítido decréscimo em torno da 12ª semana. Os paroxismos de choro ocorrem especialmente no final da tarde e início da noite. A etiologia da cólica do lactente é multifatorial, conjugando fatores gastrintestinais, como imaturidade intestinal, hipermotilidade, controle autonômico instável, alteraçoes na microbiota intestinal, fatores relacionados ao sistema nervoso central, ciclo do sono e fatores ambientais.
Os lactentes que se apresentam clinicamente bem, com boa aceitaçao alimentar, ganho de peso adequado, nao devem ser avaliados para a ocorrência de alergia alimentar. Estudos apontam melhora do quadro de cólicas em vigência do aleitamento natural, após a eliminaçao do leite de vaca da dieta materna e, naqueles alimentados com fórmulas à base do leite de vaca, por substituiçao para fórmulas de soja ou extensamente hidrolisadas. Esses estudos, entretanto, sao na maioria das vezes inconsistentes do ponto de vista metodológico, nao incluindo grupos controle ou resultados de testes de provocaçao oral após a intervençao nutricional127.
A alergia alimentar só deverá ser aventada nas situaçoes mais graves, onde as cólicas estao associadas a outros sintomas gastrintestinais, tais como vômitos, má aceitaçao alimentar, diarreia, constipaçao ou sintomas dermatológicos, especialmente a dermatite atópica127,128.
Enteropatia induzida por proteína alimentar
A enteropatia induzida por proteína alimentar ocorre especialmente em lactentes nos primeiros meses de vida, caracterizada, em geral, por diarreia nao sanguinolenta, de caráter protraído. A manutençao do quadro resulta em má absorçao intestinal significante e déficit pôndero-estatural. O quadro é acompanhado muitas vezes por vômitos intermitentes e anemia. A perda proteica entérica pode ser determinante de hipoalbuminemia, traduzindo-se clinicamente por edema carencial129,130.
O início do quadro clínico é por vezes, de difícil detecçao, e podem ocorrer após quadros de gastroenterite infecciosa de curso prolongado, que resulta em sensibilizaçao às proteínas heterólogas da dieta. Nos primeiros meses de vida a proteína do leite de vaca é a mais envolvida na gênese desta doença, seguindo-se em alguns casos a soja, o ovo e o trigo. Em crianças maiores observam-se reaçoes com a ingestao de arroz, carne de galinha e peixe. As provas diagnósticas para alergia IgE mediada sao negativas na quase totalidade dos casos130,131.
Para o diagnóstico definitivo, impoe-se realizaçao de endoscopia digestiva alta com biópsia intestinal. As alteraçoes de mucosa sao de caráter focal com presença de graus variados de atrofia vilositária. Em muitos casos ocorre hipertrofia de criptas, aumento de linfócitos intraepiteliais e pouca infiltraçao eosinofílica. Nestas circunstâncias, se o lactente já estiver ingerindo glúten, devem ser requisitados os exames sorológicos, para descartar doença celíaca132,133.
Síndrome da enterocolite induzida por proteína alimentar
A síndrome da enterocolite desencadeada por proteína alimentar - "FPIES" (do inglês Food Protein Induced Enterocolitis Syndrome) é uma manifestaçao potencialmente grave da alergia alimentar nao-IgE mediada, com manifestaçoes clínicas heterogêneas100,134. É considerada uma alergia alimentar com fisiopatologia e incidência desconhecidas. Parece haver diferentes fenótipos126. Por sua gravidade, e por determinar em algumas situaçoes o choque, deve ser considerada uma urgência entre as crianças com alergia às proteínas do leite de vaca. Antes considerada uma entidade rara, a FPIES tem sido cada vez mais descrita100.
Na Austrália, a incidência de FPIES em lactentes menores do que 24 meses foi 15,4/100.000/ano e o alérgeno mais comumente implicado foi o arroz136,137. No Brasil ainda nao há dados sobre a incidência e a prevalência de FPIES.
A FPIES se manifesta usualmente em lactentes por náuseas, vômitos intratáveis, hipotonia, palidez, apatia e diarreia com muco e/ou sangue ou nao que iniciam 1 a 3 horas após a ingestao da proteína desencadeante. Pode haver desidrataçao, acidose metabólica, choque hipovolêmico, o que propicia o diagnóstico equivocado de sepse ou de alergia alimentar IgE mediada. A diarreia pode ser mais tardia (5 a 10 horas após). Manifestaçoes respiratórias e cutâneas estao ausentes na FPIES138.
Comumente, é desencadeada pelas proteínas do leite de vaca e da soja, mas também pode ser decorrente de outros alimentos, como peixe, galinha, trigo, arroz, entre outros. Os sintomas, em geral, se desenvolvem no primeiro ano de vida, começando nos primeiros contatos com a proteína heteróloga. O início mais tardio está associado à introduçao tardia do LV ou soja em crianças amamentadas exclusivamente. A FPIES raramente ocorre em crianças que sao alimentadas exclusivamente ao seio materno139,140; geralmente acontece quando a criança começa a receber fórmula. Os alimentos sólidos sao mais comuns de desencadear FPIES em crianças maiores. As FPIES iniciadas na fase adulta, em geral estao relacionadas à introduçao tardia de peixes e/ou mariscos99,141.
Como o FPIES nao é mediada por IgE, os testes alérgicos que detectam anticorpos IgE específicos para antígenos alimentares podem ser negativos, e o diagnóstico baseia-se nos dados clínicos, isto é, na resoluçao dos sintomas com a eliminaçao do antígeno, associado ao reaparecimento dos sintomas com a sua reintroduçao via provocaçao oral142.
Durante o episódio agudo pode haver leucocitose no hemograma. Ademais, pode ser observada a presença de pneumatose intestinal à avaliaçao radiológica, sugerindo o diagnóstico de enterocolite necrosante. Assim, antes de confirmar o diagnóstico, deve-se excluir outros problemas gastrintestinais e a presença de gastroenterites infecciosas.
Nas crises agudas, em geral, as crianças evoluem bem, com hidrataçao venosa e fórmulas com proteínas extensamente hidrolisadas, ou fórmula com aminoácidos. As manifestaçoes da FPIES sao modificadas pela quantidade e frequência de antígeno ingerido: sintomas crônicos aparecem quando a ingestao da proteína alergênica é feita regularmente e sintomas agudos surgem quando essa ingestao se realiza em base intermitente, ou quando a criança recebe uma grande quantidade de repente (primeiras mamadeiras)143.
A avaliaçao endoscópica nao está indicada de rotina nos casos de FPIES, pois os achados sao inespecíficos. A biópsia jejunal, que nao é realizada de rotina, pode apresentar atrofia vilositária em graus variáveis, edema e aumento de linfócitos, eosinófilos e mastócitos. A colonoscopia, que também nao é realizada rotineiramente, demonstra a presença de colite, com acometimento ileal variável. A mucosa do cólon pode estar friável e demonstrar hemorragia, erosoes e/ou úlceras. Os abscessos de criptas sao identificados no estudo histológico de alguns pacientes.
Os pacientes que apresentam estes quadros desencadeados pelas proteínas do leite de vaca e de soja, em geral, tornam-se tolerantes por volta dos 2 a 3 anos de idade, enquanto aqueles desencadeados por alimentos sólidos tendem a ter evoluçao mais prolongada.
Alguns autores têm descrito a forma crônica da FPIES que se caracteriza pela persistência de sintomas que apesar de serem menos intensos do que os da forma aguda, podem ser graves. Os sintomas mais relatados sao emese, diarreia (às vezes com sangue), letargia, desidrataçao, distensao abdominal e parada de crescimento144. Nestas situaçoes deve-se buscar o diagnóstico diferencial com doenças inflamatórias intestinais.
Proctocolite eosinofílica
A proctocolite (ou colite) eosinofílica, também denominada de alérgica é uma forma comum de apresentaçao da alergia às proteínas do leite de vaca44,103,130,145, porém, sua prevalência é desconhecida146. Indiscutivelmente, constatou-se, na prática, aumento da sua incidência nas últimas décadas. Do ponto de vista clínico, a proctocolite eosinofílica é mais frequente em meninos do que em meninas (60% versus 40%), tem início nos primeiros meses de vida (80% antes dos 6 meses), e na maior parte dos casos as fezes nao apresentam reduçao de consistência (70% dos casos). Em cerca da metade dos casos (44%) pode ser observado eosinofilia no sangue periférico145. Em geral, nao há comprometimento do estado geral e a criança apresenta-se saudável e com bom ganho de peso. Na maioria dos casos, a perda de sangue é discreta44, porém, pode ocorrer anemia por deficiência de ferro. O quadro clínico é mais comum da alergia às proteínas do leite de vaca, no entanto, existem alguns questionamentos147.
Ao contrário do que se acreditava no passado44, cerca da metade dos casos ocorre na vigência de aleitamento natural exclusivo (reaçoes às proteínas ingeridas pela mae com transmissao através do leite materno)146. Nas crianças em aleitamento misto ou artificial, as proteínas do leite de vaca sao a causa mais frequente, no entanto, há descriçoes de reaçoes à soja44,147. Em menos de 10% dos casos, fórmulas com proteínas extensamente hidrolisadas podem provocar proctocolite alérgica127.
Em geral, a perda de sangue desaparece poucos dias após a exclusao da proteína alergênica da dieta da mae (lactentes em aleitamento natural exclusivo) ou do lactente44,103,127,146. Na dieta de exclusao, as fórmulas com proteínas extensamente hidrolisadas sao eficazes em mais de 90% dos casos. Para os lactentes que apresentam proctocolite eosinofílica na vigência de aleitamento natural exclusivo e que necessitam de fórmula complementar, a melhor opçao sao as fórmulas de aminoácidos. A pesquisa de IgE específica a proteínas (soro e teste cutâneo) nao contribuem para o diagnóstico44,103,127,146. A pesquisa de sangue nas fezes é inadequada e pode permanecer positiva mesmo depois do controle clínico do paciente103.
A maioria dos casos nao necessita avaliaçao colonoscópica e biópsias da mucosa colônica e retal. Quando realizada, a colonoscopia está alterada na maiora dos casos e apresenta colite indeterminada, com lesoes lineares, edema e friabilidade da mucosa. As biópisas mostram intenso infiltrado esosinofílico44,146. O desenvolvimento espontâneo de tolerância oral na proctocolite alérgica ocorre na maioria dos casos até os 12 meses de vida103,146.
Constipaçao intestinal por alergia alimentar
A alergia alimentar pode provocar dismotilidade digestiva, incluindo constipaçao intestinal. Na maioria dos pacientes pediátricos a etiologia da constipaçao intestinal é funcional127,148,149. No entanto, em uma parcela dos casos a alergia alimentar, em especial a alergia às proteínas do leite de vaca, pode causar constipaçao intestinal refratária103,107,148-150. Nas diretrizes internacionais, para o diagnóstico e tratamento da constipaçao intestinal crônica, a alergia às proteínas do leite de vaca é considerada como um dos diagnósticos diferenciais148,149. O diagnóstico deve ser comprovado ou descartado de acordo com a resposta clínica obtida com dieta de exclusao da proteína alergênica, seguida por teste de provocaçao oral148,149.
O mecanismo exato na gênese da dismotilidade digestiva é desconhecido. É provável que exista interaçao entre o sistema nervoso entérico e células inflamatórias, como mastócitos e eosinófilos, além da secreçao de citocinas pró-inflamatórias. Neste contexto, a estimulaçao do sistema nervoso aferente pode fazer com que o cérebro induza alteraçao no tônus esfincteriano, provocando alteraçao do ritmo intestinal na vigência do processo alérgico127. Observou-se correlaçao entre a intensidade da inflamaçao intestinal com anormalidades pressóricas aferidas pela manometria anorretal151. Na mucosa retal podem ser encontrados eosinófilos. No entanto, este achado nao substitui a dieta de exclusao e teste terapêutico de provocaçao oral para confirmaçao diagnóstica149-151.
A associaçao entre constipaçao intestinal e APLV é considerada por alguns autores como controversa. O quadro clínico é incaracterístico, e certas diretrizes sugerem que o diagnóstico de constipaçao intestinal seja considerado quando ocorre falha no tratamento da constipaçao intestinal funcional149,150. Em estudo realizado em ambulatório brasileiro de gastroenterologia pediátrica constatou-se maior chance de APLV em crianças menores de 2 anos de idade, com fissuras anais recorrentes ou resistentes ao tratamento, com antecedente pregresso de sangue nas fezes e antecedente pessoal e/ou familiar de doenças alérgicas152.
Conforme mencionado previamente, à suspeita do diagnóstico deve ser realizada dieta de exclusao e posterior teste de provocaçao oral a obter-se resposta clínica favorável. Vale destacar que em duas casuísticas, o diagnóstico de constipaçao por APLV nao foi confirmado conforme o descrito anteriormente152.
Respiratórias
A inalaçao direta do alérgeno alimentar pelo trato respiratório pode gerar quadros raros de asma ou rinite, induzidos por alimento153,154. A resposta da mucosa do trato gastrintestinal frente à quebra da tolerância é traduzida pelo mecanismo patogênico mais comum, e que pode gerar sintomas no próprio sistema digestório ou a distância, como na pele, no sistema respiratório ou até mesmo as manifestaçoes sistêmicas da anafilaxia153,155.
Apesar dos sintomas nasais e da dispneia serem frequentes como sintomas gerais na anafilaxia por alimentos, a asma e a rinite isoladas raramente ocorrem como expressao localizada de alergia alimentar. De maneira geral, os sintomas respiratórios quando presentes em quadros de alergia alimentar indicam manifestaçao mais grave, e geralmente fazem parte do quadro clínico de anafilaxia. O diagnóstico de alergia alimentar como causa de rinite alérgica ou asma crônica é difícil de ser estabelecido.
Reaçao respiratória a alimentos como componente de anafilaxia
É a situaçao mais comum entre as manifestaçoes respiratórias e pode manifestar-se como edema de laringe e/ou crises de asma de intensa gravidade. Se os sintomas representam risco de morte, devem ser prontamente reconhecidos e tratados156. Os sintomas tipicamente incluem prurido em orofaringe, angioedema, estridor, tosse, dispneia, sibilos e disfonia. A presença prévia de asma crônica tem sido um indicador de maior gravidade da reaçao alérgica alimentar, com risco de anafilaxia fatal155,157.
Rinite alérgica
Algumas vezes a rinite é atribuída à alergia alimentar, e tipicamente pode ocorrer associada a sintomas cutâneos ou do trato gastrintestinal. As pesquisas existentes até o momento nao comprovam que a rinite alérgica, como manifestaçao isolada, seja decorrente de alergia alimentar e, em especial, ao leite de vaca, em lactentes e crianças pequenas. O mesmo pode ser dito em relaçao à otite média de repetiçao, e à otite média serosa158.
Asma persistente
A asma como manifestaçao isolada causada por alergia alimentar é evento raro158. Contudo, a alergia alimentar, em especial à proteína do leite de vaca ou ao ovo157 em lactentes, pode ser um fator de risco para o desenvolvimento posterior de asma. A prevalência estimada de asma em pacientes com alergia ao leite de vaca tem sido considerada elevada. Os aditivos alimentares, muito incriminados no passado, sao causas raras de dispneia.
Asma e rinite pela inalaçao de partículas alimentares
Sao basicamente doenças profissionais, e podem acometer padeiros, carregadores e agricultores que armazenam alimentos, mas as crianças e adolescentes assim expostos também podem ser acometidos155. O principal quadro é a "asma e rinite do padeiro" por sensibilizaçao ao trigo.
Síndrome de Heiner
É uma síndrome específica respiratória decorrente de alergia à proteína do leite de vaca. É uma manifestaçao incomum, ocorrendo na infância e caracterizase por anemia, atraso no crescimento, hemossiderose pulmonar e pneumonia recorrente, com infiltrados pulmonares persistentes, além de serem detectados anticorpos precipitantes ao leite de vaca156.
Manifestaçoes sistêmicas
Anafilaxia
A anafilaxia induzida por alimentos é uma forma de hipersensibilidade mediada por IgE, com manifestaçoes súbitas de sintomas e representa um quadro emergencial com risco de morte. O complexo de sintomas resulta da açao de mediadores que atuam em alvos como os sistemas respiratório, cardiovascular, gastrintestinal, cutâneo e nervoso. Embora qualquer alimento potencialmente possa induzir uma reaçao anafilática, os mais apontados sao leite de vaca, ovo, camarao, peixe, amendoim e nozes.
Os principais sinais e sintomas de anafilaxia159sao: (a) pele: eritema, prurido, urticária, angioedema, pode ocorrer ainda exantema morbiliforme e ereçao de pelos; (b) sistema gastrintestinal: prurido e/ou edema dos lábios, língua e palato, sabor metálico na boca, náuseas, vômitos, diarreia e dor abdominal; (c) sistema respiratório: é o principal órgao do choque anafilático. Pode ocorrer: prurido e sensaçao de garganta "fechando", disfonia, tosse seca irritativa, edema de glote e de laringe, dispneia, sensaçao de aperto torácico, sibilos generalizados, crises de espirros, lacrimejamento e congestao nasal intensa; (d) sistema cardiovascular: síncope, dor torácica, arritmia, hipotensao e choque; e (e) sistema nervoso: cefaleia, diminuiçao do vigor, confusao metal, sonolência, convulsoes, incontinência, perda de consciência e coma156,159. Na Tabela 6 sao apresentados os critérios utilizados para o diagnóstico de anafilaxia.
Anafilaxia induzida por exercício dependente de alimentos
A anafilaxia induzida por exercício dependente de alimentos (AIEDA) é um tipo particular de anafilaxia por exercício, caracterizada pelo aparecimento de uma reaçao sistêmica desencadeada pelo exercício, quando este é realizado nas primeiras duas horas após a ingestao alimentar. A ausência de quadro clínico durante exercício quando em jejum e a tolerância do alimento na ausência do exercício possibilitam o diagnóstico diferencial com alergia alimentar pelo referido alimento.
A prevalência de AIEDA ainda é desconhecida em decorrência da sua raridade. Têm sido descritos casos de AIEDA associados a múltiplos alimentos, principalmente o trigo161.
O diagnóstico da AIEDA é baseado em critérios clínicos e a combinaçao entre ingestao alimentar e exercício para o aparecimento de sintomas sistêmicos, uma vez que na ausência de um dos fatores, nao ocorre a reaçao. A confirmaçao do diagnóstico é realizada pelos testes cutâneos de hipersensibilidade imediata (puntura, extratos comerciais ou prick to prick), determinaçao de IgE séricas específicas e provas de provocaçao alimentar e de exercício (em jejum, após refeiçao sem alimento suspeito e outra com alimento suspeito)162.
A presença de IgE sérica específica a ômega-5 gliadina tem sido apontada como marcador de reaçoes graves e de anafilaxia induzida por exercício dependente de alimento, no caso o trigo162.
Outras
Embora na prática clínica a hipersecreçao brônquica, as otites de repetiçao e a língua geográfica sejam frequentemente atribuídas à alergia alimentar, nao há consenso na literatura, nao devendo, portanto, estas manifestaçoes serem atribuídas à alergia alimentar. Assim, é necessária a busca de causas etiológicas para estas manifestaçoes, nao se justificando a introduçao de dietas restritivas a estes pacientes.
Doenças inflamatórias intestinais também têm sido atribuídas à alergia alimentar (doença de Crohn e colite ulcerativa), e embora esta hipótese seja atraente, estudos sao necessários para documentar essa possibilidade ainda nao comprovada163.
Alguns estudos têm sugerido que a artrite crônica pode estar relacionada à alergia alimentar, mas apenas em alguns poucos casos pôde se comprovar esta relaçao, por meio de teste de provocaçao oral com alimento suspeito de modo duplo cego e controlado por placebo163.
De modo similar, outros distúrbios ou sintomas foram relacionados à ingestao de alimentos ou aditivos alimentares. Sao eles a enxaqueca ou a epilepsia após ingestao de um determinado alimento ou a hiperatividade148. Em todos esses casos há necessidade de maior comprovaçao que firme o diagnóstico de alergia alimentar. A relaçao entre transtorno do espectro autista e alergia alimentar nao foi confirmada165-167.
REFERENCIAS
1. Sampson HA. Food allergy: past, present and future. Allergol Int. 2016;65(4):363-9.
2. Gibson PR. History of the low FODMAP diet. J Gastroenterol Hepatol. 2017;32(Suppl 1):5-7.
3. Tordesillas L, Berin MC, Sampson HA.Immunology of Food Allergy. Immunity. 2017;47(1):32-50.
4. Boyce JA, Assa'ad A, Burks AW, Jones SM, Sampson HA, Wood RA, et al. Guidelines for the diagnosis and management of food allergy in the United States: report of the NIAID-sponsored expert panel. J Allergy Clin Immunol. 2010;126(6 Suppl.):S1e58.
5. Moore LE, Stewart PH, de Shazo RD. Food allergy: what we know now. Am J Med Sci. 2017;353(4):353-66.
6. Burks AW, Tang M, Sicherer S, Muraro A, Eigenmann PA, Ebisawa M, et al. ICON: food allergy. J Allergy Clin Immunol. 2012;129(4):906-20.
7. Sicherer SH. Epidemiology of food allergy. J Allergy Clin Immunol. 2011;127:594-602.
8. Sicherer SH, Sampson HA. Food allergy: a review and update on epidemiology, pathogenesis, diagnosis, prevention, and management. J Allergy Clin Immunol. 2018;141:41-58.
9. Chafen JJ, Newberry SJ, Riedl MA, Bravata DM, Maglione M, Suttorp MJ, et al.Diagnosing and managing common food allergies: a systematic review. JAMA. 2010;303(18):1848-56.
10. Gupta RS, Springston EE, Warrier MR, Smith B, Kumar R, Pongracic J, et al.The prevalence, severity, and distribution of childhood food allergy in the United States. Pediatrics. 2011;128(1):e9-17.
11. Acker WW, Plasek JM, Blumenthal KG, Lai KH, Topaz M, Seger DL, et al. Prevalence of food allergies and intolerances documented in electronic health records. J Allergy Clin Immunol. 2017;140(6):1587-91.
12. Nwaru BI, Hickstein L, Panesar SS, Muraro A, Werfwl T, Cardona V, et al. The epidemiology of food allergy in Europe - Systematic review and meta-analysis. Allergy. 2014;69:62-75.
13. Nwaru BI, Hickestein L, Panesar SS, Roberts G, Muraro A, Sheikh A, et al.Prevalence of common food allergies in Europe - Systematic review and meta-analysis. Allergy. 2014;69(8):992-1007.
14. Vieira MC, Morais MB, Spolidoro JV, Toporovski MS, Cardoso AL, Araujo GT, et al. A survey on clinical presentation and nutritional status of infants with suspected cow' milk allergy. BMC Pediatr. 2010 Apr 23;10:25. doi: 10.1186/1471-2431-10-25.
15. Silva LA, Silva AF, Ribeiro AC, Silva AO, Vieira FA, Segundo GR. Adult Food Allergy Prevalence: Reducing Questionnaire Bias. Int Arch Allergy Immunol. 2016;171(3-4):261-4.
16. Gonçalves LC, Guimaraes TC, Silva RM, Cheik MF, de Ramos Nápolis AC, Barbosa e Silva G, et al. Prevalence of food allergy in infants and pre-schoolers in Brazil. Allergol Immunopathol (Madr). 2016;44(6):497-503.
17. Sicherer SH, Teuber S. Current approach to the diagnosis and management of adverse reaction to food. J Allergy Clin Immunol. 2004;114:1146-50.
18. Choi W, Yeruva S, Turner JR. Contributions of intestinal epithelial barriers to health and disease. Exp Cell Res. 2017;358(1):71-7.
19. Kalach N, Rocchiccioli F, de Boissieu D, Benhamou PH, Dupont C. Intestinal permeability in children: variation with age and reliability in the diagnosis of cow's milk allergy. Acta Paediatr. 2001;90(5):499-504.
20. Qi Y, Goel R, Kim S, Richards EM, Carter CS, Pepine CJ, et al. Intestinal permeability biomarker zonulin is elevated in healthy aging. J Am Med Dir Assoc. 2017 Sep 1;18(9):810.e1-810.e4.
21. Salvo Romero E, Alonso Cotoner C, Pardo Camacho C, Casado Bedmar M, Vicario M. The intestinal barrier function and its involvement in digestive disease. Rev Esp Enferm Dig. 2015;107(11):686-96.
22. Chairatana P, Nolan EM. Defensins, lectins, mucins, and secretory immunoglobulin A:microbe-binding biomolecules that contribute to mucosal immunity in the human gut. Crit Rev Biochem Mol Biol. 2017;52(1):45-56.
23. Scaldaferri F, Pizzoferrato M, Gerardi V, Lopetuso L, Gasbarrini A. The gut barrier: new acquisitions and therapeutic approaches. Clin Gastroenterol. 2012;46 Suppl:S12-7.
24. Ahluwalia B, Magnusson MK, Öhman L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scand J Gastroenterol. 2017;12:1-9.
25. Brandtzaeg P. Food allergy: separating the science from the mythology. Nat Rev Gastroenterol Hepatol. 2010;7(7):380-400.
26. Mantis NJ, Rol N, Corthésy B. Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut. Mucosal Immunol. 2011;4(6):603-11.
27. Janzi M, Kull I, Sjöberg R, Wan J, Melén E, Bayat N, et al. Selective IgA deficiency in early life: association to infections and allergic diseases during childhood. Clin Immunol. 2009;133(1):78-85.
28. Salzman NH.The role of the microbiome in immune cell development. Ann Allergy Asthma Immunol. 2014;113:593-8.
29. Lin L, Zhang J. Role of intestinal microbiota and metabolites on gut homeostasis and human diseases. BMC Immunology. 2017;18:2.
30. Bäckhed, F. Bäckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI.Host-Bacterial Mutualism in the HumanIntestineScience. 2005;307(5717):1915-20.
31. Nuriel-Ohayon M, Neuman H, Koren O. Microbial changes during pregnancy, birth, and infancy. Front Microbiol. 2016;7:1031.
32. Neish SA, Denning, TL. Advances in understanding the interaction between the gut microbiota and adaptative mucosal immune responses. Biol Rep. 2010;2:27.
33. Round JL, Mazmanian SK. The gut microbiota shapes intestinal immune responses during health and disease. Nat Rev Imunnol. 2009; 9: 213-23.
34. Munblit D, Verhasselt V:Allergy prevention by breastfeeding:possible mechanisms and evidence from human cohorts. Curr Opin Allergy Clin Immunol. 2016;16:427-33.
35. Lack GA, Fox D, Northstone K, Golding J. Factors associated with the development of peanut allergy in childhood. N Engl J Med. 2003;348:977-85.
36. Flohr C, Perkin M, Logan K, Marrs T, Radulovic S, Campbell LE, et al.Atopic dermatitis and disease severity are the main risk factors for food sensitization in exclusively breastfed infants.J Invest Dermatol. 2014;134:345-50.
37. CHill D J, Hosking CS, De Benedictis FM, Oranje AP, Diepgen TL, Bauchau V, et al.Confirmation of the association between high levels of immunoglobulin E food sensitization and eczema in infancy: An international study. Clin Exp Allergy. 2008;38:161-8.
38. Tsakok T, Marrs, T, Mohsin M, Baron S, Du Toit G, Till S, et al. Does atopic dermatitis cause food allergy? A systematic review.J Allergy Clin Immunol. 2016;137:1071-8.
39. Nowak-Węgrzyn A, Chatchatee P. Mechanisms of tolerance induction. Ann Nutr Metab. 2017; 70(suppl 2):7-24.
40. Li J, Maggadottir SM, Hakonarson H. Are genetic tests informative in predicting food allergy? Curr Opin Allergy Clin Immunol. 2016;16:257-64.
41. Bush RK, Hefle SL. Food allergens. Crit Rev Food Sci Nutr. 1996;36(Sup):S119.
42. Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, et al. EAACI Molecular Allergology User's Guide. Pediatr Allergy Immunol. 2016;27(S23):1-250.
43. Rosario-Filho NA, Jacob CM, Sole D, Condino-Neto A, Arruda LK, Costa-Carvalho B, et al.Pediatric allergy and immunology in Brazil. Pediatr Allergy Immunol. 2013;24(4):402-9.
44. Solé D, Silva LR, Rosário NA, Sarni ROS, Pastorino AC, Jacob CMA, et al. Consenso Brasileiro sobre Alergia Alimentar: 2007 - Documento conjunto da Associaçao Brasileira de Alergia e Imunopatologia e Sociedade Brasileira de Pediatria.Rev Bras Alerg Imunopatol. 2008;31:64-89.
45. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, van Hage M, Baena-Cagnani CE, et al. A WAO - ARIA - GA²LEN consensus document on molecular-based allergy diagnostics.World Allergy Organ J. 2013;6(1):17.
46. Rajan JP, Simon RA, Bosso JV. Prevalence of sensitivity to food and drug additives in patients with chronic idiopathic urticaria. J Allergy Clin Immunol Pract. 2014;2(2):168-71.
47. Feketea G, Tsabouri S.Common food colorants and allergic reactions in children: Myth or reality? Food Chem. 2017;230:578-88.
48. Asero R.Multiple intolerance to food additives.J Allergy Clin Immunol. 2002;110:531.
49. Sicherer SH, Sampson HA. Food allergy: epidemiology, pathogenesis, diagnosis, and treatment. J. Allergy Clin Immunol. 2014;133:291-307.
50. Visness CM, London SJ, Daniels JL, Kaufman JS, Yeatts KB, Siega-Riz AM, et al. Association of obesity with IgE levels and allergy symptoms in children and adolescents: results from the National Health and Nutrition Examination Survey 2005-2006. J Allergy Clin Immunol. 2009;123:1163-9.
51. Valenta R, Hochwallner H, Linhart B, Pahr S. Food allergies: the basics. Gastroenterology. 2015;148(6):1120-31.
52. Savage J, Johns CB.Food allergy:epidemiology and natural history. Immunol Allergy Clin North Am. 2015;35(1):45-59.
53. Van Odjik J, Kull I, Borres MP, Brandtzaeg P, Edberg U, Hanson LA, et al. Breastfeeding and allergic disease: a multidisciplinary review of the literature (1966-2001) on the mode of early feeding in infancy and its impact on later atopic manifestations. Allergy. 2003;58 833-43.
54. Koplin JJ, Allen KJ, Gurrin LC, Peters RL, Lowe AJ, Tang ML, et al. The impact of family history of allergy on risk of food allergy: a population-based study of infants. Int J Environ Res Public Health. 2013;10(11):5364-77.
55. Linneberg A, Fenger RV, Husemoen LL, Thuesen BH, Skaaby T, Gonzalez-Quintela A, et al. Association between loss-of-function mutations in the filaggrin gene and self-reported food allergy and alcohol sensitivity. Int Arch Allergy Immunol. 2013;161(3):234-42.
56. Tan HT, Ellis JA, Koplin JJ, Martino D, Dang TD, Suaini N, et al. Filaggrin loss-of-function mutations do not predict food allergy over and above the risk of food sensitization among infants. J Allergy Clin Immunol. 2012;130(5):1211-3.
57. Hancock DB, Romieu I, Chiu GY, Sienra-Monge JJ, Li H, Estela Del Rio-Navarro B, et al. STAT6 and LRP1 polymorphisms are associated with food allergen sensitization in Mexican children. J Allergy Clin Immunol. 2012;129(6):1673-6.
58. Wang Y, Allen KJ, Koplin JJ.Dietary intervention for preventing food allergy. Curr Opin Pediatr. 2017 Dec;29(6):704-10. doi: 10.1097/ MOP.0000000000000552.
59. Muraro A, Halken S, Arshad SH, Beyer K, Dubois AE, Du Toit G, et al. EAACI Food Allergy and Anaphylaxis Guidelines Group. EAACI food allergy and anaphylaxis guidelines.Primary prevention of food allergy. Allergy. 2014;69(8):1046-57.
60. Australasian Society of Clinical Immunology and allergy. ASCIA guidelines for infant feeding and allergy prevention.2016.Disponível em: http://www.allergy.org.au/patients/allergy-prevention/asciaguidelines-for-infant-feeding-and-allergy-prevention.Acessado em 14/10/2017.
61. Zhang GQ, Liu B, Li J, Luo CQ, Zhang Q, Chen JL, et al.Fish intake during pregnancy and infancy and allergic outcomes in children: a systematic review and meta-analysis. Pediatr Allergy Immunol. 2017;28:152-61.
62. Beckhaus AA, Garcia-Marcos L, Forno E, Pacheco-Gonzalez RM, Celedón JC, Castro-Rodriguez JA. Maternal nutrition during pregnancy and the risk of asthma, wheeze, and atopic diseases during childhood: a systematic review and meta-analysis. Allergy. 2015;70:1588-604.
63. Lack GA, Fox D, Northstone K, Golding J. Avon Longitudinal Study of Parents and Children Study Team. Factors associated with the development of peanut allergy in childhood. N Engl J Med. 2003;348:977-85.
64. Victora CG, Barros AJD, França GVA, França GV, Horton S, Krasevec J, et al. Breastfeeding in the 21st century: epidemiology, mechanisms, and lifelong effect. Lancet. 2016;387:475-90.
65. Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, et al. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014;69:1008-25.
66. von Berg A.Allergic manifestation 15 years after early intervention with hydrolyzed formulas - the GINI Study. Allergy. 2016;71(2):210-9.
67. Boyle RJ, Ierodiakonou D, Khan T, Chivinge J, Robinson Z, Geoghegan N, et al. Hydrolysed formula and risk of allergic or autoimmune disease: systematic review and meta-analysis. BMJ. 2016;352:i974.
68. Cabana MD. The role of hydrolyzed formula in allergy prevention. Ann Nutr Metab. 2017;70(Suppl2):38-45.
69. Katz Y, Rajuan N, Goldberg MR, Eisenberg E, Heyman E, Cohen A, et al. Early exposure to cow's milk protein is protective against IgE-mediated cow's milk protein allergy. J Allergy Clin Immunol. 2010;126:77-82.
70. Du Toit G, Katz Y, Sasieni P, Mesher D, Maleki SJ, Fisher HR, et al. Early consumption of peanuts in infancy is associated with a low prevalence of peanut allergy. J Allergy Clin Immunol. 2008;122:984-91.
71. Luccioli S, Zhang YT, Verrill L, Ramos-Valle M, Kwegyir-Afful E. Infant feeding practices and reported food allergies at 6 years of age. Pediatric. 2014;134:S21-S28.
72. Perkin MR, Logan K, Tseng A, Raji B, Ayis S, Peacock J, et al. Randomized trial of introduction of allergenic foods in breast-fed infants. N Engl J Med. 2016;374:1733-43.
73. Nowak-Węgrzyn A, Chatchatee P. Mechanisms of tolerance induction. Ann Nutr Metab. 2017;70(suppl 2):7-4.
74. Du Toit G, Roberts G,SayrePH, Bahnson HT, Radulovic S, Santos AF, et al. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med. 2015;372:803-13.
75. Du Toit G, Sayre PH, Roberts G, Sever ML, Lawson K, Bahnson HT, et al. Effect of avoidance on peanut allergy after early peanut consumption. N Engl J Med. 2016;374:1435-43.
76. Koplin JJ, Osborne NJ, Wake M, Martin PE, Gurrin LC, Robinson MN, et al. Can early introduction of egg prevent egg allergy in infants? A population-based study. J Allergy Clin Immunol. 2010;126:807-13.
77. Palmer DJ, Metcalfe J, Makrides M, Gold MS, Quinn P, West CE, et al. Early regular egg exposure in infants with eczema: a randomized controlled trial.J Allergy Clin Immunol.2013;132:387392.e1.
78. Palmer DJ, Sullivan TR, Gold MS, Prescott SL, Makrides M. Randomized controlled trial of early regular egg intake to prevent egg allergy. J Allergy Clin Immunol. 2017;139:1600-1607.e2.
79. Bellach J, Schwarz V, Ahrens B, Trendelenburg V, Aksunger O, Kalb B, et al. Randomized placebo-controlled trial of hen's egg consumption for primary prevention in infants. J Allergy Clin Immunol. 2017;139:1591-1599.e2.
80. Wei-Liang Tan J, Valerio C, Barnes EH, Turner PJ, Van Asperen PA, Kakakios AM, et al. A randomized trial of egg introduction from 4 months of age in infants at risk for egg allergy. J Allergy Clin Immunol. 2017;139:1621-1628.e8.
81. Natsume O, Kabashima S, Nakazato J, Yamamoto-Hanada K, Narita M, Kondo M, et al.Two-step egg introduction for prevention of egg allergy inhigh-riskinfants with eczema (PETIT):arandomised, double-blind, placebo-controlled trial. Lancet. 2017;389:276-86.
82. Nermes M, Salminen S, Isolauri E. Is there a role for probiotics in the prevention or treatment of food allergy? Curr Allergy Asthma Rep. 2013;13:622-30.
83. Bertelsen RJ, Brantsaeter AL, Magnus MC. Probiotic milk consumption in pregnancy and infancy and subsequent childhood allergic diseases. J Allergy Clin Immunol. 2014;133:165-71.
84. Marrs T, Bruce KD, Logan K, Rivett DW, Perkin MR, Lack G, et al.Is therean associationbetween microbialexposure and food allergy? A systematic review. Pediatr Allergy Immunol. 2013;24:311-20.
85. West CE, Dzidic M, Prescott SL, Jenmalm MC. Bugging allergy; role of pre-, pro- and symbiotics in allergy prevention. Allergol Int. 2017;66(4):529-38.
86. Osborne NJ, Ukoumunne OC, Wake M, Allen KJ. Prevalence of eczema and food allergy is associated with latitude in Australia. J Allergy Clin Immunol. 2012;129:865-7.
87. Weisse K, Winkler S, Hirche F, Herberth G, Hinz D, Bauer M, et al. Maternal and newborn vitamin D status and its impact on food allergy development in the German LINA cohort study. Allergy. 2013;68(2):220-8.
88. Allen KJ.VITALITY trial:protocol for a randomised controlled trial to establish the role of postnatal vitamin D supplementation in infant immune health. BMJ Open. 2015;5(12):e009377.
89. Koplin JJ, Dharmage SC, Ponsonby AL, Tang ML, Lowe AJ, Gurrin LC, et al. Environmental and demographic risk factors for egg allergy in a population-based study of infants. Allergy. 2012;67(11):1415-22.
90. Kalliomäki M, Salminen S, Arvilommi H, Kero P, Koskinen P, Isolauri E. Probiotics in primary prevention of atopic disease: a randomized placebo-controlled trial. Lancet. 2001;357:1076-9.
91. Kalliomäki M, Salminen S, Poussa T, Isolauri E. Probiotics during the first 7 years of life: a cumulative risk reduction of eczema in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2007;119(4):1019-21.
92. Mazzocchi A, Venter C, Maslin K, Agostoni C.The role of nutritional aspects in food allergy: prevention and management. Nutrients. 2017;9,850:5-12.
93. Canani RB, Di Costanzo M, Pezzella V, Cosenza L, Granata V, Terrin G, et al.The potential therapeutic efficacy of lactobacillus gg in children with food allergies. Pharmaceuticals. 2012;5:655-64.
94. Zuccotti G, Meneghin F, Aceti A, Barone G, Callegari ML, Di Mauro A, et al. Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis. Allergy. 2015;70(11):1356-71.
95. Braegger C, Chmielewska A, Decsi T, Kolacek S, Mihatsch W, Moreno L, et al. ESPGHAN Committee on Nutrition. Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr. 2011;52(2):238-50.
96. Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, et al.World Allergy Organization-McMaster University Guidelines for allergic disease prevention (GLAD-P): probiotics. World Allergy Organ J. 2015;8(1):4.
97. Johansson SG, Hourihane JO, Bousquet J, Bruijnzeel-Koomen C, Dreborg S, Haahtela T, et al. A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force. Allergy. 2001;56:813-24.
98. Chehade M. Mayer L. Oral tolerance and its relation to food hypersensitivities. J Allergy Clin Immunol. 2005;115:13.
99. Nowak-Węgrzyn A, Sampson HA, Wood RA, Sicherer SH. Food protein-induced enterocolitis syndrome caused by solid food proteins. Pediatrics. 2003;111:829-35.
100. Nowak-Węgrzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary -Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017;139:1111-26.
101. Sampson HA, Aceves S, Bock SA, James J, Jones S, Lang D, et al. Food allergy: a practice parameter update-2014. J Allergy Clin Immunol. 2014;134(5):1016-25.
102. Chang A, Robison R, Cai M, Singh AM. Natural history of foodtriggered atopic dermatitis and development of immediate reactions in children. J Allergy Clin Immunol Pract. 2016;4(2):229-36.e1
103. Nowak-Węgrzyn A, Szajewska H, Lack G. Food allergy and the gut. Nat Rev Gastroenterol Hepatol. 2017;14:241-57.
104. Moawad FJ. Eosinophilic esophagitis -Incidence and prevalence. Gastrointest Endoscopy Clin N Am. 2018;28(1):15-25.
105. Ferreira CT, Vieira MC, Vieira SM, Silva GS, Yamamoto DR, Silveira TR. Eosinophilic esophagitis in 29 pediatric patients. Arq Gastroenterol. 2008;45(2):141-6.
106. Rodrigues M, D'Amico MF, Patiño FR, Barbieri D, Damiao AO, Sipahi AM. Clinical manifestations, treatment, and outcomes of children and adolescents with eosinophilic esophagitis. J Pediatr (Rio J). 2013;89:197-203.
107. Liacouras CA, Spergel J, Gober LM. Eosinophilic esophagitis: clinical presentation in children. Gastroenterol Clin North Am. 2014;43(2):219-29.
108. Davis BP. Pathophysiology of Eosinophilic Esophagitis. Clin Rev Allergy Immunol. 2018; Jan 13. doi: 10.1007/s12016-0178665-9.
109. Hirano I, Moy N, Heckman MG, Thomas CS, Gonsalves N, Achem SR. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut. 2013;62(4):489-95.
110. Lucendo AJ, Molina-Infante J, Arias A, von Arnim U, Bredenoord AJ, Bussmann C, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adult. United European Gastroenterol J. 2017;5(3):335-58.
111. Spergel JM, Andrews T, Brown-Whitehorn TF, Beausoleil JL, Liacouras CA. Treatment of eosinophilic esophagitis with specific food elimination diet directed by a combination of skin prick and patch tests. Ann Allergy Asthma Immunol. 2005;95(4):336-43.
112.Kagalwalla AF, Sentongo TA, Ritz S, Hess T, Nelson SP, Emerick KM, et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2006;4(9):1097-102.
113. Arias A, Perez-Martinez I, Tenias JM, Lucendo AJ. Systematic review with meta-analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in populationbased studies. Aliment Pharmacol Ther. 2016;43(1):3-15.
114. Teitelbaum JE, Fox VL, Twarog FJ, Nurko S, Antonioli D, Gleich G, et al. Eosinophilic esophagitis in children: immunopathological analysis and response to fluticasone propionate. Gastroenterology. 2002;122(5):1216-25.
115. Konikoff MR, Noel RJ, Blanchard C, Kirby C, Jameson SC, Buckmeier BK, et al. A randomized, double-blind, placebocontrolled trial of fluticasone propionate for pediatric eosinophilic esophagitis. Gastroenterology. 2006;131(5):1381-91.
116. Aceves SS, Bastian JF, Newbury RO, Dohil R. Oral viscous budesonide: a potential new therapy for eosinophilic esophagitis in children. Am J Gastroenterol. 2007;102(10):2271-9.
117. Mansoor E, Saleh MA, Cooper GS. Prevalence of Eosinophilic Gastroenteritis and Colitis in a population-based study, from 2012 to 2017. Clin Gastroenterol Hepatol. 2017 Jun 8 pii:S1542- 3565(17)30691-2.
118. Conner JR, Kirsch R. The pathology and causes of tissue eosinophilia in the gastrointestinal tract. Histopathology. 2017;71(2):177-99.
119. Fahey LM, Liacouras CA. Eosinophilic Gastrointestinal Disorders. Pediatr Clin North Am. 2017;64(3):475-85.
120. Lightdale JR, Gremse DA. Gastroesophageal reflux: management guidance for the pediatrician. Pediatrics. 2013;131:e1684-95.
121. Salvatore S, Vandenplas Y. Gastroesophageal reflux and cow milk allergy: is there a link? Pediatrics. 2002;110(5):972-84.
122. Cavataio F, Carroccio A, Iacono G. Milk induced reflux in infants less than one year of age. J Pediatr Gastroenterol Nutr. 2000:30(Suppl):S36-44.
123. Borrelli O, Mancini V, Thapar N, Giorgio V, Elawad M, Hill S, et al. Cow's milk challenge increases weakly acidic reflux in children with cow's milk allergy and gastroesophageal reflux disease. J Pediatr. 2012;161(3):476-481.e1
124. Vandenplas Y, De Greef E; ALLAR study group. Extensive protein hydrolysate formula effectively reduces regurgitation in infants with positive and negative challenge tests for cow's milk allergy. Acta Paediatr. 2014;103(6):e243-50.
125. Kia L, Hirano I. Distinguishing GERD from eosinophilic oesophagitis: concepts and controversies. Nat Rev Gastroenterol Hepatol. 2015;12:379-86.
126. Benninga MA, Nurko S, Faure C, Hyman PE, Roberts ISJ, Schechter NL. Childhood Functional Gastrointestinal Disorders. Neonate/toddler Gastroenterol. 2016;150:1443-55.
127. Caubet J-C, Szajewska H, Shamir R, Nowak-Węgrzyn A. Non- IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol. 2017;28:6-17.
128. Heine RG. Allergic gastrointestinal motility disorders in infancy and early childhood. Pediatr Allergy Immunol. 2008:19: 383-91.
129. Savilahti E. Food-induced malabsorption syndromes. J Pediatr Gastroenterol Nutr. 2000:30(Suppl): S61-6.
130. Leonard AS. Non-IgE-mediated Adverse Food Reactions. Curr Allergy Asthma Rep. 2017;17:84.
131. Iyngkaran N, Robinson MJ, Sumithran E, Lam SK, Puthucheary SD, Yadav M. Cow`s milk protein-sensitive enteropathy. An important factor in prolonging diarrhea of acute infective enteritis in early infancy. Arch Dis Child. 1978;53:150-3.
132. Iyngkaran N, Yadav M, Boey CG, Lam KL. Severity and extent of upper small bowel mucosal damage in cow's milk protein-sensitive enteropathy. J Pediatr Gastroenterol Nutr. 1988;7:667-74.
133. Maloney J, Nowak-Węgrzyn A. Educational clinical case series for pediatric allergy and immunology: allergic proctocolitis, food protein-induced enterocolitis syndrome and allergic eosinophilic gastroenteritis with protein losing gastroenteropathy as manifestations as manifestations of non-IgE-mediated cow's milk allergy. Pediatr Allergy Immunol. 2007;18:360-7.
134. Michelet M, Schluckebier D, Petit LM, Caubet JC. Food proteininduced enterocolitis syndrome - a review of the literature with focus on clinical management. J Asthma Allergy. 2017;10:197-207.
135. Kimura M, Shimomura M, Morishita H, Meguro T. Prognosis of infantile food protein-induced enterocolitis syndrome in Japan. Pediatr Int. 2017;59(8):855-60.
136. Mehr S, Frith K, Barnes EH, Campbell DE; FPIES Study Group. Food protein-induced enterocolitis syndrome in Australia: a population-based study, 2012-2014. J Allergy Clin Immunol. 2017 Apr 18. pii: S0091-6749(17)30588-2.
137. Bingemann TA, Sood P, Järvinen KM. Food Protein- Induced Enterocolitis Syndrome. Immunol Allergy Clin N Am. 2018;38:141-52.
138. Sánchez-Salguero CA. FPIES: The dark side of food allergy. Allergol Immunopathol (Madr). 2017;45(3):209-11.
139. Monti G, Castagno E, Liguori SA, et al. Food protein-induced enterocolitis syndrome by cow's milk proteins passed through breast milk. J Allergy Clin Immunol. 2011;127:679-80.
140. Tan J, Campbell D, Mehr S. Food protein-induced enterocolitis syndrome in an exclusively breast-fed infant - an uncommon entity. J Allergy Clin Immunol. 2012;129:873.
141. Tan JA, Smith WB. Non-IgE-mediated gastrointestinal food hypersensitivity syndrome in adults. J Allergy Clin Immunol Pract. 2014;2(3):355-7.
142. Feuille E, Nowak-Węgrzyn A. Definition, etiology, and diagnosis of food protein enterocolitis syndrome. Curr Opin Clin Allergy Immunol. 2014;14:222-8.
143. Manti S, Leonardi S, Salpietro A, Del Campo G, Salpietro C, Cuppari C. A systematic review of food protein-induced enterocolitis syndrome from the last 40 years. Ann Allergy Asthma Immunol. 2017;118(4):411-8.
144. Leonard SA, Nowak-Węgrzyn A. Manifestations, diagnosis, and management of food protein-induced enterocolitis syndrome. Pediatr Ann. 2013;42:135-40.
145. Nowak-Węgrzyn A, Jarocka-Cyrta E, Moschione Castro A. Food protein-induced enterocolitis syndrome. J Investig Allergol Clin Immunol. 2017;27(1):1-18.
146. Lozinsky AC, Morais MB. Colite eosinofílica em lactentes. J Pediatr (Rio J). 2014;90:16-21.
147. Arvola T, Ruuska T, Keränen J, Hyöty H, Salminen S, Isolauri E. Rectal bleeding in infancy: clinical, allergological, and microbiological examination. Pediatrics. 2006;117:e760-8.
148. Constipation Guideline Committee of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Evaluation and treatment of constipation in infants and children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2006;43:e1-13.
149. Tabbers MM, DiLorenzo C, Berger MY, Faure C, Langendam MW, Nurko S, et al. Evaluation and treatment of functional constipation in infants and children: evidence-based recommendations from ESPGHAN and NASPGHAN. J Pediatr Gastroenterol Nutr. 2014;58(2):258-74.
150. Koletzko S, Niggemann B, Arato A, Dias JA, Heuschkel R, Husby S, et al. Diagnostic approach and management of cow's-milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines. J Pediatr Gastroenterol Nutr. 2012;55(2):221-9.
151. Borrelli O, Barbara G, Di Nardo G, Cremon C, Lucarelli S, Frediani T, et al. Neuroimmune interaction and anorectal motility in children with food allergy-related chronic constipation. Am J Gastroenterol. 2009;104(2):454-63.
152. Tahan S, Motta MEFA, Goshima S. Chronic constipation secondary to cow's milk allergy affects nutritional status in children. J Pediatr Gastroenterol Nutr. 2004;39:S235.
153. Sicherer SH. Determinants of systemic manifestations of food allergy. J Allergy Clin Immunol. 2000;106:S251-7.
154. Burks W. Skin Manifestations of Food Allergy. Pediatrics. 2003;111:1617-24.
155.Wandalsen GF, Cocco RR, Sole D. Os diversos espectros da alergia ao leite de vaca. J Pediatr (Rio J). 2003;79:561-2.
156. Ebisawa M, Ito K, Fujisawa T; Committee for Japanese Pediatric Guideline for Food Allergy, The Japanese Society of Pediatric Allergy and Clinical Immunology, et al. Japanese guidelines for food allergy 2017. Allergol Int. 2017;66:248-64.
157. Sampson HA. Anaphylaxis and emergency treatment. Pediatrics. 2003;111:1601-8.
158. Sampson HA. Food Allergy. Part 2: Diagnostic and management. J Allergy Clin Immunol. 1999;103:981-9.
159. Simons FE, Ebisawa M, Sanchez-Borges M, Thong BY, Worm M, Tanno LK, et al. 2015 update of the evidence base: World Allergy Organization anaphylaxis guidelines. World Allergy Organ J. 2015;8(1):32.
160. Sampson HA, Munoz-Furlong A, Campbell RL, Adkinson NF Jr, Bock SA, Branum A, et al. Second symposium on the definition and management of anaphylaxis: summary report. Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol. 2006;117:391-7.
161. Scherf KA, Brockow K, Biedermann T, Koehler P, Wieser H. Wheat-dependent exercise-induced anaphylaxis. Clin Exp Allergy. 2016;46(1):10-20.
162. Feldweg AM. Food-Dependent, Exercise-induced anaphylaxis: diagnosis and management in the outpatient setting. J Allergy Clin Immunol Pract. 2017;5(2):283-8.
163. Bahna SL. Unusual presentations of food allergy. Ann Allergy Asthma Immunol. 2001;86(4):414-20.
164. Weber RW, Vaughan TR. Food and migraine headache. Immunol Clin North Am. 1991;11:831-41.
165. Jyonouchi H. Food allergy and autism spectrum disorders: is there a link? Curr Allergy Asthma Rep. 2009;9:194-201.
166. Miyazaki C, Koyama M, Ota E, Swa T, Amiya RM, Miunde LB, et al. Allergies in children with autism spectrum disorder: a systematic review and meta-analysis. Rev J Autism Dev Disord. 2015;2:374-401.
167. Zheng Z, Zhang Li, Zhu T, Jichong Huang J, Qu Y, Mu D. Association between asthma and autism spectrum disorder: a meta-analysis. PLOS ONE | DOI:10.1371/journal.pone.0156662 June 3, 2016.