Número Atual: Janeiro-Fevereiro 2016 - Volume 4 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Solange Oliveira Rodrigues Valle, MD, PhD
- Antônio Abílio Motta, MD, PhD
- Claudia Soïdo Falcao do Amaral, MD, MSc
- Luis Felipe Chiaverini Ensina, MD, MSc
- Márcia Carvalho Mallozi, MD, PhD
- Maria das Graças de Melo Teixeira Spengler, MD
- Maria Fernanda Ferraro, MD, PhD
- Mário Cezar Pires, MD, PhD
- Maurício Martins, MD, MSc
- Nelson Guilherme Bastos Cordeiro, MD, MSc
- Alfeu Tavares França, MD, PhD
ARTIGO ESPECIAL
O que há de novo na urticária crônica espontânea?
What is new in chronic spontaneous urticaria?
Solange Oliveira Rodrigues Valle, MD, PhD1; Antônio Abílio Motta, MD, PhD2; Claudia Soïdo Falcao do Amaral, MD, MSc3; Luis Felipe Chiaverini Ensina, MD, MSc4; Márcia Carvalho Mallozi, MD, PhD5; Maria das Graças de Melo Teixeira Spengler, MD6; Maria Fernanda Ferraro, MD, PhD7; Mário Cezar Pires, MD, PhD8; Maurício Martins, MD, MSc9; Nelson Guilherme Bastos Cordeiro, MD, MSc10; Alfeu Tavares França, MD, PhD11
DOI: 10.5935/2318-5015.20160002
1. Universidade Federal do Rio de Janeiro, UFRJ, Rio de Janeiro, RJ
2. Faculdade de Medicina da Universidade de Sao Paulo, FMUSP, Sao Paulo, SP
3. Santa Casa da Misericórdia do Rio de Janeiro, Rio de Janeiro, RJ
4. Universidade Federal de Sao Paulo, UNIFESP, Sao Paulo, SP. Universidade de Santo Amaro, Sao Paulo, SP
5. Universidade Federal de Sao Paulo, UNIFESP, Sao Paulo, SP
6. Universidade para o Desenvolvimento do Estado e da Regiao do Pantanal, UNIDERP, Campo Grande, MS
5. Clínica Privada
8. Hospital Padre Bento, Guarulhos, SP
9. Pontifícia Universidade Católica do Paraná, PUCPR, Curitiba, PR
10. Policlínica Geral do Rio de Janeiro, Rio de Janeiro, RJ. Faculdade de Medicina de Petrópolis, Petrópolis, RJ
11. Hospital Sao Zacharias, Rio de Janeiro, RJ. Universidade Federal do Rio de Janeiro, UFRJ, Rio de Janeiro, RJ
Endereço para correspondência:
Solange Oliveira Rodrigues Valle
E-mail: solangervalle@gmail.com
Submetido em 31/10/2016
Aceito em 24/11/2016
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A urticária crônica espontânea (UCE) é a forma mais frequente das urticárias crônicas (UC) e ocasiona um grande impacto negativo na qualidade de vida dos pacientes e seus familiares. A patogênese da UC é complexa e nao está totalmente esclarecida. Entretanto, houve um grande avanço na última década em relaçao ao mecanismo de ativaçao dos mastócitos, que sao as células que desempenham papel central na fisiopatologia da doença. Na maioria dos casos, a história clínica completa e o exame físico sao considerados suficientes para fazer o diagnóstico da UCE, a menos que a história sugira a necessidade de outros exames. Além disso, os médicos precisam estar atentos para os potenciais diagnósticos diferenciais. Uma variedade de ferramentas e questionários está disponível para auxiliar os médicos no diagnóstico e monitoramento dos pacientes com UC. O principal objetivo do tratamento é o controle dos sintomas. Os anti-histamínicos de segunda geraçao nas doses habituais sao recomendados como tratamento de primeira linha. Entretanto, pacientes que sao refratários às doses habituais podem necessitar do aumento da dose. Ainda assim, muitos apresentam sintomas de urticária. Nestes casos, recomenda-se adicionar outros medicamentos, como o montelucaste, ciclosporina e omalizumabe. Entre esses mencionados acima, o omalizumabe é o único licenciado para o tratamento da UCE. Neste artigo, revisamos as principais e atuais publicaçoes sobre a urticária crônica espontânea.
Descritores: Mastócitos, angioedema, urticária, qualidade de vida.
INTRODUÇAO
A urticária tem sido descrita como uma entidade distinta desde Hipócrates. É uma enfermidade comum e heterogênea, sendo facilmente reconhecida pelos pacientes e médicos. Convencionalmente, a urticária pode ser dividida, quanto à sua duraçao, em duas formas: aguda e crônica. Esta divisao é arbitrária, porém de valor prático. A forma crônica é altamente complexa quando as manifestaçoes clínicas, as causas e os tratamentos sao considerados. Representa um desafio para o médico e para o paciente. No médico, causa frustraçao e distúrbio do seu bem estar intelectual pelas dificuldades na sua identificaçao etiológica e tratamento. No paciente, estas mesmas dificuldades podem repercutir ocasionando uma instabilidade emocional e, também, deterioraçao da qualidade de vida inerente ao quadro clínico da doença e seu tratamento1.
O presente artigo faz uma revisao direcionada da urticária crônica espontânea (UCE), que é o subtipo mais frequente da urticária crônica (UC).
CONCEITO
A urticária crônica é caracterizada pela ocorrência de urticas e/ou angioedema por um período igual ou maior que 6 semanas2.
As urticas sao pápulas e/ou placas que aparecem de forma súbita e se caracterizam pela coloraçao clara ou avermelhada, de tamanhos variados, quase sempre circundadas por um eritema reflexo, associadas a intenso prurido ou, algumas vezes, sensaçao de ardência. Essas lesoes têm natureza transitória e a pele retoma seu aspecto normal geralmente dentro de 1 a 24 horas. O angioedema se apresenta como um edema localizado, bastante pronunciado, repentino, nao uniforme, acompanhado ou nao de eritema. O edema tem origem na derme profunda ou tecido subcutâneo/submucoso e pode estar associado a prurido ou dor local. Sua resoluçao se dá de forma mais lenta, podendo persistir por até 72 horas2,3. O angioedema acompanha as lesoes de urticária em cerca de 40-50% dos casos.
CLASSIFICAÇAO
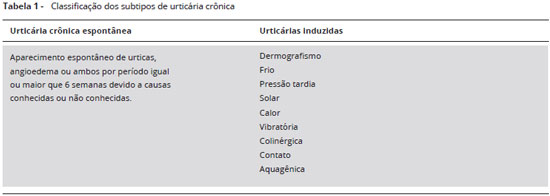
A UC pode ser classificada em dois tipos: UCE na qual a ocorrência dos sintomas se dá de forma espontânea, e urticária crônica induzida (UCIND), na qual é necessária a presença de um fator desencadeante específico para que surjam os sintomas. As UCIND incluem, além das urticárias físicas (dermografismo sintomático, urticária solar, urticária ao frio, ao calor, urticária por pressao tardia e angioedema vibratório), as urticárias de contato, a colinérgica e a aquagênica (Tabela 1)4-6. Alguns pacientes podem apresentar simultaneamente mais de um tipo de urticária ou sobreposiçao de subtipos de UCIND.
EPIDEMIOLOGIA
A prevalência estimada de urticária crônica na populaçao geral varia de 0,5% a 5%, e a incidência tem sido estimada em 1,4% ao ano7. Destes, mais de 60% apresentam UCE.
A ocorrência de UCE é menos comum na populaçao pediátrica. Estudo realizado no Reino Unido revelou prevalência de 0,1-0,3% entre as crianças8. Indivíduos de todas as idades podem desenvolver UCE, no entanto, o pico de incidência ocorre entre 20 e 40 anos de idade. A prevalência de UCE é até duas vezes maior no sexo feminino.
A evoluçao natural da UC é imprevisível. Na UCE ocorre remissao espontânea com recidivas na maioria dos casos. Poucos estudos epidemiológicos avaliaram a duraçao dos sintomas. Gaig e cols. encontraram que em 70% dos casos os sintomas de UC persistiram por até 1 ano, enquanto em 11% dos casos a duraçao foi superior a 5 anos9. Em estudo prospectivo com 139 pacientes acompanhados por mais de 5 anos, a duraçao da urticária se correlacionou com a gravidade dos sintomas, com a presença de angioedema e com marcadores de autoimunidade positivos (teste cutâneo com soro autólogo e anticorpos antitireoide). Nesse estudo, 70% dos pacientes tiveram sintomas por mais de 1 ano, enquanto em 14% deles a duraçao foi maior que 5 anos10.
FISIOPATOLOGIA
Em relaçao à patologia, a pápula da urticária é clinicamente caracterizada por um edema central devido ao aumento da permeabilidade local dos capilares cutâneos e vênulas pós-capilares. O eritema da pápula é devido à vasodilataçao, causada pela açao direta da histamina nas vênulas pós-capilares e o eritema circundante é o resultado do reflexo axônico, sendo esta reaçao descrita por Lewis (tríplice reaçao de Lewis). As lesoes costumam apresentar aumento de temperatura local por aumento do fluxo sanguíneo e o prurido é uma característica da urticária. O angioedema afeta a mucosa e a pele mais fina, com predileçao por junçao mucocutânea, incluindo pálpebras e lábios. O aumento da permeabilidade vascular é abrupto, maciço e localizado profundamente na derme, no tecido subcutâneo e na submucosa. O angioedema em geral é mais doloroso do que eritematoso e/ou pruriginoso11.
A fisiopatologia da UC ainda nao é bem conhecida. O mastócito é a célula mais importante na fisiopatologia da urticária e de alguns tipos de angioedema. Esta célula está distribuída em todo tecido conjuntivo próximo a arteríolas e vênulas terminais. Uma vez ativada ela libera várias substâncias com atividades pró-inflamatórias e inflamatórias, como histamina, prostaglandinas, leucotrienos entre outros.
Vários fatores sao relatados como "gatilhos", que levariam a esta desgranulaçao inapropriada, porém estes mecanismos ainda precisam ser melhor elucidados, por exemplo, como explicar que alguns pacientes após exercício físico, contato com alguma forma de frio (gelo, vento, ar), exposiçao ao sol ou estresse logo em seguida apresentam urticária12.
A fisiopatologia da urtica e de alguns tipos de angioedema decorre da desgranulaçao mastócitária, que pode ocorrer por mecanismos imunológicos e nao imunológicos. Como exemplo de mecanismo imunológico, temos a fixaçao de IgE específica aos receptores de alta afinidade para IgE dos mastócitos (FcεRI) e posterior combinaçao com o antígeno (p. ex., antígeno proteico) levando à liberaçao de diversos mediadores farmacológicos com atividades inflamatórias, como histamina, leucotrienos e prostaglandinas. Por outro lado vários medicamentos, como vancomicina, polimixina B, opiáceos, contrastes (iodados, etc.) podem desgranular diretamente o mastócito sem a participaçao de mecanismos imunológicos, levando ao mesmo processo inflamatório.
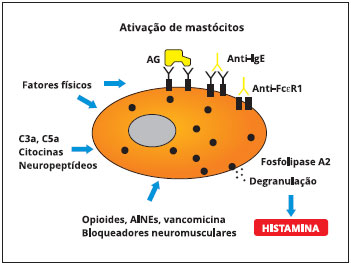
Figura 1 Ativaçao de mastócitos
Sabroe e Graves identificaram três grupos de pacientes com urticária crônica. No primeiro grupo, encontra-se anticorpo da classe IgG contra receptores FcεRI, ou contra a própria IgE (urticária autorreativa). Estes pacientes têm o teste do soro autólogo positivo. Em um segundo grupo sugerido pelos autores, haveria a presença de um fator liberador de histamina, que agiria direta e especificamente nos mastócitos sem a participaçao de basófilos circulantes. Um terceiro grupo de pacientes nao teria nem IgG específica contra IgE ou seu receptor e nao teria o fator liberador de histamina, sendo o mecanismo fisiopatológico desconhecido13.
O sistema Complemento pode ser ativado por três vias: a via clássica, que depende da formaçao de imunocomplexos circulantes, como na doença do soro; a via alternativa, que nao depende da formaçao de imunocomplexos e, quando ativada, pode levar à desgranulaçao do mastócito; e a via da lectina, que também está relacionada com o sistema imune inato. Este sistema é constituído por proteínas plasmáticas que desempenham importantes funçoes no mecanismo de defesa do organismo ou inflamaçao, como lise celular e formaçao de fragmentos peptídicos que promovem a desgranulaçao de mastócitos e basófilos ocasionando vasodilataçao, quimiotaxia, aderência celular e estimulaçao ou inibiçao da resposta imune. Esses fragmentos resultam da ativaçao da clivagem proteica, sendo que os derivados de C2 e C4 produzem intenso efeito inflamatório.
O infiltrado inflamatório tem papel importante na UCE, mas o mesmo nao ocorre na urticária induzida que tem pouco ou nenhum infiltrado perivascular. O infiltrado perivascular na derme da lesao cutânea da UCE contém principalmente linfócitos T. A presença de infiltrado perivascular neutrofílico sem vasculite é observado na minoria dos pacientes (15%) com urticária crônica. A histologia neutrofílica é frequentemente observada na rara síndrome de Schnitzler (urticária, artralgia, febre, dor óssea e paraproteinemia IgM kappa). Embora nao seja uma característica predominante na UCE, os neutrófilos sao encontrados nas pápulas recentes (< 4 horas de duraçao). O papel dos outros mediadores que nao a histamina na geraçao de pápulas na UCE tem recebido pouca atençao. Há alguma evidência para os produtos do metabolismo do ácido araquidônico, leucotrienos, secretados pelos mastócitos humanos, sao vasoativos na pele de seres humanos saudáveis e de pacientes com UC.
Evidências recentes em diferentes modelos murinos sugerem que os receptores H4 possam também estar envolvidos no prurido e, em modelos experimentais, os antagonistas do receptor H4 mostraram-se promissores para o alívio do prurido evocado pela histamina. Os neurônios C também expressam receptores seletivos para a protease triptase derivada dos mastócitos, que podem contribuir para o prurido intenso experimentado por muitos pacientes com mastocitose, em que os níveis de triptase no soro sao elevados14.
Teoria autoimune
A suspeita de que a urticária crônica (UC) poderia representar uma doença autoimune baseia-se nos seguintes fatos: (a) a presença de auto anticorpos tireoideanos em vários pacientes com UC; (b) a presença de anticorpos da classe IgG contra o receptor FcεRI ou contra IgE; (c) teste do autossoro e Basoteste positivos com o soro dos pacientes com UC; (d) associaçao com alguns subtipos de HLA em alguns pacientes, como DR4 e DQ812.
Vários trabalhos da literatura mostram que esta teoria é convincente, porém sem evidências conclusivas de que a UC seria uma doença autoimune específica por si só, sendo que a UC nao preenche todos os critérios clínicos laboratoriais necessários para ser considerada uma doença autoimune.
Sistema de coagulaçao
A ativaçao da coagulaçao e fibrinólise ocorre nos pacientes com UCE tendo relaçao com a gravidade e atividade da doença. Farres e cols. demonstraram que a ativaçao do Fator VII da coagulaçao, um fator da via extrínseca, é significantemente reduzida após terapêutica específica, confirmando a relaçao desta via extrínsica de coagulaçao na fisiopatologia da UCE. Porém, novos estudos controlados precisam ser realizados para confirmar esta teoria, para que eventualmente uma terapia com anticoagulante seja possível na UCE refratária.
Os níveis plasmáticos de D-dímero e FVIIa estao significantemente aumentados nos pacientes com UCE, principalmente naqueles refratários ao tratamento convencional. A degradaçao da fibrina (fibrinólise) leva ao aumento do D-dímero que é o produto final deste mecanismo. Atualmente o D-dímero é considerado como um marcador da UCE de difícil controle (refratária)15.
DIAGNOSTICO
O diagnóstico da UCE é essencialmente clínico. A anamnese minuciosa e o exame físico detalhado sao importantes para descartar outros quadros urticariformes, encontrar um eventual agente desencadeante e avaliar participaçao de fatores agravantes.
A investigaçao laboratorial recomendada de rotina é feita com o hemograma, VHS e proteína C-reativa. Outros exames devem ser solicitados apenas se a anamnese, exame físico, ou os exames de rotina indicarem2.
DIAGNOSTICO DIFERENCIAL
Apesar da vasta gama de doenças dermatológicas que cursam com lesoes urticariformes, a natureza efêmera, nao descamativa, bem como a ausência de sintomas sistêmicos, a diferem de quase todas as demais doenças.
Algumas doenças cutâneas podem simular UCE. Entre as mais frequentes, temos as doenças relacionadas a seguir.
Vasculite urticariforme
É um dos principais diagnósticos diferenciais da UCE. As lesoes permanecem por mais de 24 horas com sensaçao de queimaçao e menos frequentemente de prurido. Hiperpigmentaçao residual é frequente. A biópsia de uma lesao recente é necessária para o diagnóstico.
Urticárias induzidas
Nas UCIND por estímulo físico como frio, pressao, calor, sol, dermografismo, vibraçao; de contato; nas decorrentes de aumento da temperatura corporal como a colinérgica e mais raramente naquelas de contato com a água (aquagênica), a lesao surge no local que recebeu o estímulo específico. É comum a associaçao da UCE com urticárias induzidas. Testes de provocaçao específicos facilitam o diagnóstico das urticárias induzidas.
Dermatite urticariforme
Caracteriza-se por presença de pápulas eritematosas e placas urticariformes, muitas vezes eczematosas, extremamente pruriginosas com distribuiçao habitualmente simétrica, de longa duraçao e com predileçao para área do tronco. Mais frequente em pacientes idosos.
Urticária pigmentosa (mastocitose)
Há lesao urticariforme sobre as máculas e pápulas. Podem ser induzidas pela fricçao, persistindo hiperpigmentaçao cutânea como sequela.
Erupçao exantematosa por drogas
Caracterizada por exantema máculo-papular pruriginoso com distribuiçao simétrica e predomínio na regiao do tronco, com duraçao maior que 24 horas. A história clínica é a chave para o diagnóstico.
Placas e pápulas urticariformes pruriginosas da gravidez
Há pequenas pápulas urticariformes que coalescem formando placas principalmente na área do tronco, com distribuiçao simétrica, extremamente pruriginosas, surgindo no 3° trimestre da gestaçao ou pós parto.
FERRAMENTAS PARA AVALIAÇAO DA URTICARIA
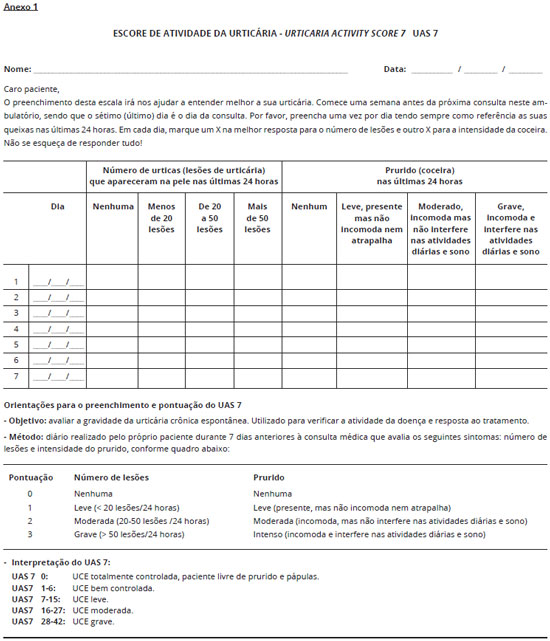
A avaliaçao diária da intensidade da urticária é útil tanto para o paciente quanto para o médico, permitindo um parâmetro mais exato da doença. Zuberbier propôs o Urticaria Activity Score (UAS), o qual tem sido utilizado em ensaios clínicos e nos consultórios médicos para monitorizar a evoluçao da doença e a eficácia do tratamento. O escore avalia o número de lesoes e a intensidade do prurido. A soma da pontuaçao obtida pela avaliaçao das lesoes e do prurido varia de 0 a 6. O escore 0 corresponde à doença controlada, enquanto 6 corresponde à doença de grande intensidade16. Posteriormente foi introduzido o UAS 7, que é realizado pelo próprio paciente sete dias antes da consulta. O resultado corresponde ao somatório dos setes dias e o escore varia de zero a 42. O UAS 7 permite categorizar a intensidade da doença: sem sintomas (0); bem controlada (1-6); leve (7-15); moderada (16-27) e grave (28-42). Embora o UAS 7 tenha se mostrado uma ferramenta útil e se tornado o padrao-ouro para a medida da atividade da doença em pacientes com urticária crônica espontânea, este apresenta algumas limitaçoes (Anexo 1).
O escore funciona apenas como um instrumento de avaliaçao prospectiva e, portanto, nao pode ser utilizado em uma primeira consulta. A sua avaliaçao torna-se um problema caso o paciente nao se recorde de preenchê-lo diariamente. O UAS nao contempla a presença de angioedema. Além disso, este instrumento nao foi planejado para avaliar o controle da doença17.
Devido a estas limitaçoes, Weller e cols. decidiram por desenvolver uma ferramenta nova, curta e simples com o objetivo de quantificar o controle da doença em todos os pacientes com todos os tipos de urticária crônica e auxiliar nas decisoes terapêuticas. O instrumento foi denominado Urticaria Control Test (UCT)17.
O UCT possui duas versoes de acordo com o estudo de desenvolvimento e validaçao original: uma versao curta, com quatro perguntas, e uma versao longa, com oito perguntas. Os pesquisadores observaram que a versao longa se correlacionou muito bem com a versao curta, sem alterar a perfomance do UCT. O questionário final de 4 itens é autopreenchível, de fácil compreensao e apresenta boa confiabilidade17.
O questionário refere-se às quatro últimas semanas e possui 5 opçoes de respostas que vao de: 0- Bastante; 1- Muito; 2- Mais ou menos; 3- Pouco; 4- Nada. O escore total na versao curta varia de no mínimo 0 (zero) e no máximo 16 (dezesseis), definindo, respectivamente, pior e melhor controle da enfermidade17(Anexo 2).
QUALIDADE DE VIDA
A urticária crônica frequentemente produz grave impacto na qualidade de vida (QV). O paciente apresenta instabilidade emocional e a natureza pública dos sintomas pode ser estressante. Nas suas formas graves, a urticária pode ser incapacitante por causar transtornos nas atividades diárias, principalmente no sono, que tem um profundo impacto negativo na QV relacionada à saúde destes pacientes1.
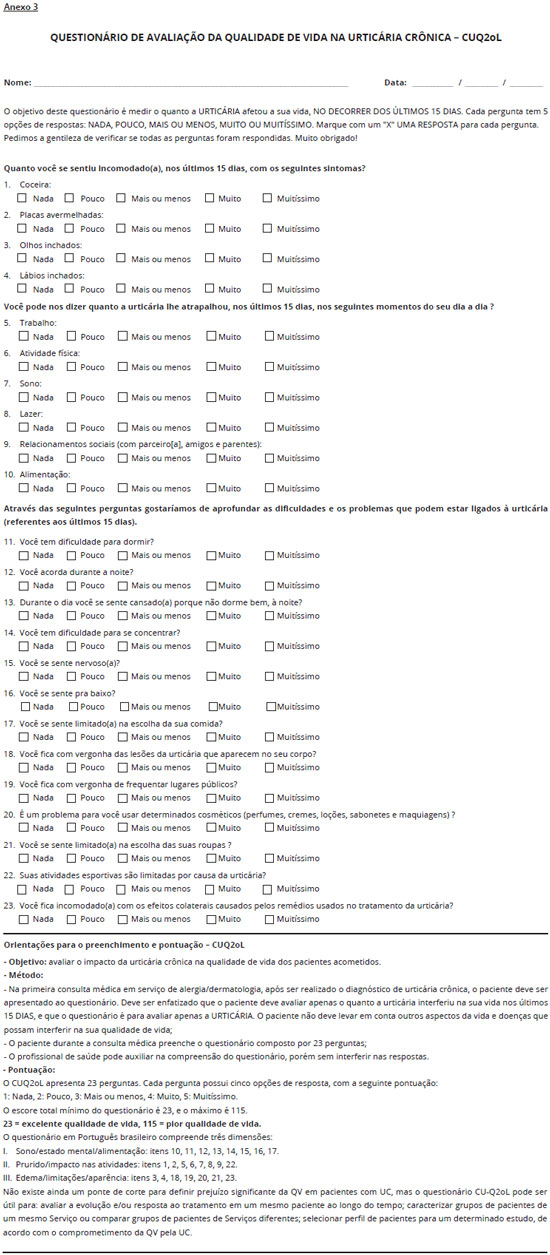
Deste modo é importante avaliarmos a QV dos nossos pacientes. O questionário de QV na UC foi traduzido e validado para o português do Brasil, segundo os critérios originalmente utilizados por Baiardini e cols.18,19. A versao validada em português brasileiro é aplicada utilizando escala de pontuaçao de 1 a 5, sendo: 1- Nada; 2- Pouco; 3- Mais ou menos; 4- Muito; 5- Muitíssimo. O escore total varia de 23 a 115, com pontuaçao total máxima 115, quando todos os itens receberem pontuaçao 5, e a mínima 23, quando todos os itens receberem pontuaçao 1. O escore total pode ser convertido em escala de 0 a 100, principalmente quando utilizado em pesquisa clínica. O questionário é autoaplicável, facilmente compreendido e respondido em média em 5 minutos (Anexo 3).
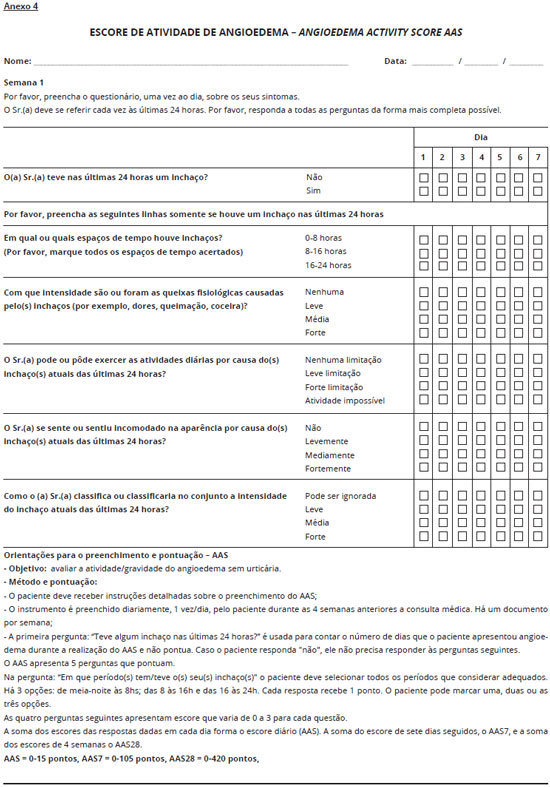
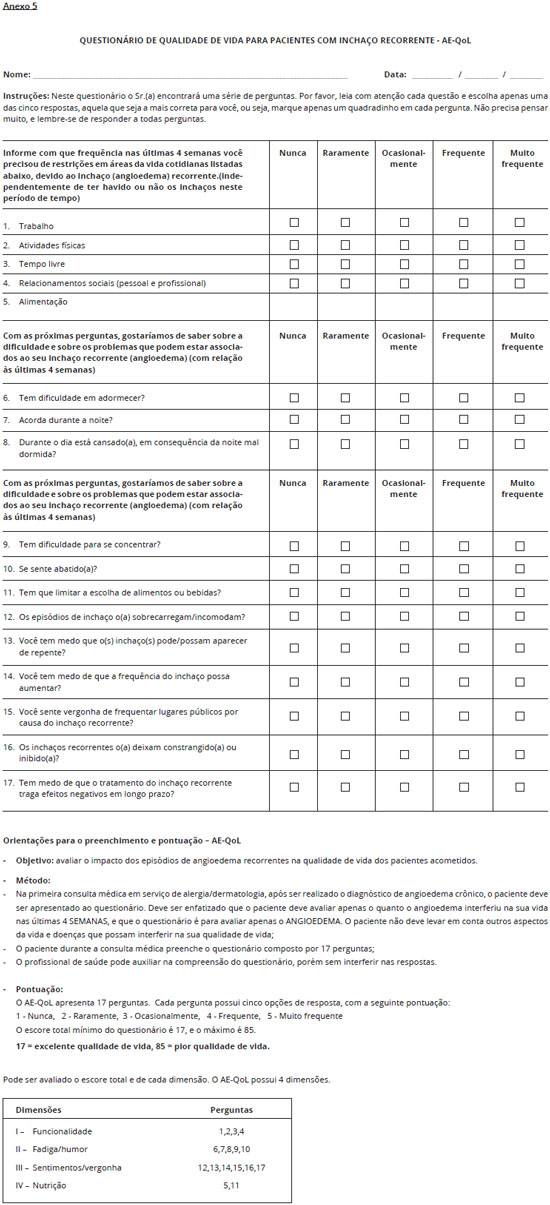
No caso do paciente apresentar angioedema deve-se aplicar o escore de atividade de angioedema (Anexo 4) e o questionário de qualidade de vida para o angioedema AE-QoL (Anexo 5).
TRATAMENTO
O tratamento da UCE objetiva o controle dos sintomas e a melhor qualidade de vida do paciente. Tem sido sugerida uma dupla abordagem: a primeira representa a tentativa de identificar e eliminar possíveis fatores desencadeantes, e a segunda representada pelo tratamento farmacológico20. O controle da UCE nao é fácil em funçao da dificuldade da identificaçao da etiologia da doença e pela fraca resposta terapêutica em grande parte dos pacientes.
A histamina é um mediador inflamatório potente21, pertence à classe das aminas biogênicas de baixo peso molecular e é sintetizada a partir do aminoácido histidina por açao da L-histidina descarboxilase. Sua açao é exercida em quatro tipos de receptores: HR1, HR2, HR3 e HR421,22. Estes pertencem à família de receptores acoplados à proteína G, responsável pela transduçao23,24. Desempenha papel central nas urticárias agudas e crônicas, embora outros mediadores de mastócitos, tais como leucotrienos e fatores ativadores de plaqueta (PAF), estejam também envolvidos na deflagraçao dos sintomas25.
Os receptores de histamina ligados à proteína G apresentam um estado constitutivo ativo e outro inativo. A histamina liberada, por exemplo, em uma reaçao alérgica imediata, funciona como um agonista com afinidade preferencial para o estado ativo, estabilizando o receptor para essa conformaçao. Por outro lado, os anti-histamínicos sao agonistas inversos, pois ao se ligarem ao receptor, promovem sua estabilidade na forma inativa21,22. Após estabilizarem o receptor nessa conformaçao, causam desvio no equilíbrio do receptor para o estado inativo, independente da ocupaçao do receptor pelo agonista, ou seja, mesmo que a histamina continue sendo liberada24.
Os anti-histamínicos H1 sao os medicamentos mais utilizados no tratamento da UC. Sao responsáveis pela reduçao na duraçao da crise, no tamanho das placas de urticária, do eritema, e principalmente do prurido.
Os anti-histamínicos H1 de segunda geraçao, embora nao sejam livres de efeitos adversos, apresentam menos efeitos anticolinérgicos e sedantes por nao atravessarem a barreira hematoencefálica26,27. Apresentam potência elevada e maior meia-vida, podendo ser administrados uma ou duas vezes ao dia27. Além disso, têm demonstrado maior perfil de segurança com mínimos efeitos adversos27,28. Os anti-histamínicos H1 de primeira geraçao sao eficazes, ainda muito utilizados na prática clínica diária, por serem medicamentos antigos, transmitirem ideia de segurança e promoverem sedaçao nos pacientes que nao conseguem dormir devido ao prurido. Seu uso vem sendo questionado em funçao da presença de inúmeros efeitos adversos envolvidos com esta classe de medicamentos, incluindo sonolência, alteraçoes das funçoes cognitivas e de memória, cansaço, boca seca, retençao urinária, taquicardia, entre outros2,22.
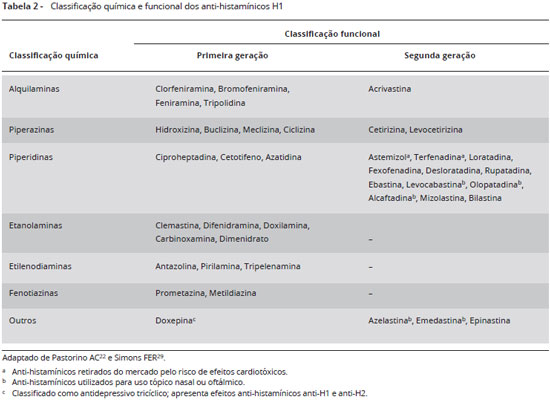
A classificaçao funcional e química dos anti-histamínicos H1 está representada na Tabela 222,29.
Os anti-histamínicos H1 nao sedantes ou de segunda geraçao, sao em geral, bem tolerados e têm sido recomendados como o tratamento de primeira linha para o controle dos sintomas da UCE7,20. Esta classe de anti-histamínicos é mais indicada em funçao do seu maior perfil de segurança em relaçao aos anti-histamínicos H1 de primeira geraçao2. Entretanto, alguns pacientes nao respondem ao tratamento. Um levantamento bibliográfico que objetivou verificar, entre outros fatores, a resposta aos anti-histamínicos H1 de segunda geraçao nos pacientes com urticária crônica, concluiu que cerca de 50% destes com UCE nao apresentam controle dos sintomas com as doses licenciadas de tais medicamentos20. Vários autores sugerem, que nestes casos refratários ao tratamento, seja aumentada a dose do anti-histamínico em até quatro vezes o valor licenciado antes de haver troca da medicaçao ou associaçao com outras drogas, inclusive com classes diferentes de anti-histamínicos2,21,22. Ainda assim, até um terço dos pacientes permanecem sintomáticos, sem controle adequado dos sintomas2,20,30. Clinicamente, os pacientes com UCE podem ser divididos em três grupos: o primeiro grupo inclui os pacientes que respondem às doses habituais dos anti-histamínicos H1; o segundo grupo inclui os que nao respondem às doses habituais dos anti-histamínicos H1, mas respondem a doses aumentadas; e o terceiro grupo inclui aqueles que nao respondem aos anti-histamínicos H1 independente da dose, justificando nestes casos a utilizaçao de outras medidas terapêuticas20.
Embora os estudos sejam concordantes em demonstrar a eficácia do aumento das doses dos anti-histamínicos H1 de segunda geraçao com alto nível de evidência e com ótimo perfil de segurança em pacientes com UCE, tais medicamentos nao sao licenciados oficialmente para tal aumento. Bilastina, desloratadina, levocetirizina e rupatadina em doses quadruplicadas, sao os mais citados na literatura2.
Em relaçao à urticária crônica espontânea na criança, sao poucas as abordagens específicas. Um estudo recente tailandês concluiu que 19% dos pacientes pediátricos têm remissao espontânea da urticária crônica em menos de um ano, mas 50% dos pacientes pediátricos têm persistência do quadro por mais de um ano com média de duraçao de 16 meses31. Os anti-histamínicos H1 de segunda geraçao também sao o tratamento de escolha, sendo a cetirizina, levocetirizina e fexofenadina os mais indicados. Há relatos de aumento da dose em até quatro vezes do valor aprovado em bula31, entretanto, nao há consenso na literatura em relaçao ao aumento da dose dos anti-histamínicos na faixa etária pediátrica, e qual dose exatamente seria a mais segura, devendo os mesmos serem usados com cautela.
Os anti-histamínicos com açao anti-H2 nao sao recomendados para o tratamento da UCE2.
CORTICOSTEROIDES
Os glicocorticoides exercem suas açoes anti-inflamatórias e imunossupressoras na urticária, reduzindo o número e a resposta imune dos linfócitos, com predomínio na imunidade humoral. Assim, suprimem e/ou bloqueiam32:
- ácido araquidônico e seus metabólitos (prostaglandinas e leucotrienos) por inibiçao da fosfolipase A2;
- moléculas de adesao cruciais para a localizaçao e diapedese dos leucócitos;
- citocinas ativadoras da inflamaçao (IL1, IL2, IL3, IL6, TNF-α, GM-CSF, interferon γ);
- proliferaçao de fibroblastos;
- histamina dependente de IgE.
Vários consensos nao recomendam o uso prolongado do corticosteroide sistêmico no seu algoritmo de tratamento para urticária crônica, pelo entendimento de que os riscos, na maioria das vezes, superam os benefícios25,33.
Em determinadas situaçoes, como exacerbaçoes nao responsivas aos anti-histamínicos H1 de segunda geraçao, um curso rápido de corticosteroide pode, entretanto, ser necessário2,34. Tem sido recomendado ciclos de 3 a 10 dias de prednisona ou prednisolona, 1 mg/kg/dia nao ultrapassando a dose de 60 mg/dia35.
ANTILEUCOTRIENOS
Os leucotrienos cisteínicos (CysLTs) sao produzidos predominantemente por células do sistema imune inato, especialmente os basófilos, eosinófilos, mastócitos e monócitos/macrófagos. Além da atividade como broncoconstritores, os CysLTs também exercem funçao pró-inflamatória, consequente às suas interaçoes com receptores em linfócitos Th2, bem como em células estruturais, e, em menor extensao, em neutrófilos e células T CD8+. O reconhecimento do envolvimento de CysLTs na imunopatogênese de vários tipos de doenças inflamatórias agudas e crônicas levou ao desenvolvimento de antagonistas seletivos do receptor de cysLT-1 (cysLTR1), especificamente montelucaste, pranlucaste, e zafirlucaste. Estes agentes também têm sido referidos como possuindo atividades anti-inflamatórias secundárias, distintas do antagonismo de cysLTR1, que parecem ser particularmente eficazes no acesso aos neutrófilos e monócitos/macrófagos, além de mecanismos subjacentes que incluem a interferência com nucleotideofosofodiesterases cíclicas, 5-lipoxigenase, e o fator pró-inflamatório de transcriçao, fator nuclear kappa B36.
A possibilidade da participaçao de outros mediadores, além da histamina na patogênese da UC, como os leucotrienos, justifica o uso de antileucotrienos, como demonstrado em pacientes com UC devida a aditivos alimentares e com desencadeamento positivo ao ácido acetilsalicílico37.
Em estudo com um grupo de 22 pacientes com urticária crônica, o escore de sintomas nao mostrou diferença significante entre montelucaste e placebo; apenas em um subgrupo de 5 pacientes com urticária resistente a anti-histamínicos, a adiçao de montelukaste mostrou uma reduçao nos sintomas38.
Recente revisao sistemática observou que a associaçao de antileucotrieno, montelucaste 10 mg, em pacientes adultos já em uso de anti-histamínicos, resultou em uma queda nos escores de sintomas39. Devido ao fato de uma proporçao, estimada em 25% a 30%, dos pacientes com UC nao responder ao tratamento de primeira linha com anti-histamínicos, a associaçao de antileucotrieno pode ser benéfica neste grupo de pacientes. O antileucotrieno isolado nao demonstra superioridade ao placebo ou à terapia com anti-histamínicos, e seu uso como monoterapia nao está indicado. Os efeitos colaterais e tolerabilidade neste grupo de drogas sao aceitáveis40.
CICLOSPORINA
A ciclosporina é um peptídeo lipofílico que faz parte da família dos inibidores da calcineurina. Foi inicialmente usada para profilaxia de rejeiçao de transplante de órgaos sólidos, e posteriormente para tratamento de artrite reumatóide e psoríase grave. Tem diversas outras indicaçoes, como dermatite atópica grave, doença de Behçet e urticária crônica. A ciclosporina é uma pró-droga, pois fica inativa até se ligar ao seu receptor citoplasmático (ciclofilina). O complexo ciclosporina-ciclofilina inibe competitivamente a atividade da fosfatase calcineurina na ligaçao à calmodulina, responsável pela desfosforilaçao do fator nuclear de linfócitos T ativado citosólico (FnATc). Fisiologicamente, a desfosforilaçao do FnATc permite sua translocaçao do citoplasma para o núcleo, que em conjunto com o FnAT, ativa as células T, propiciando a produçao de citocinas, como IL-2, IL-4, IL-5 e IFNy . Ao bloquear a defosforilaçao do FnATc, a ciclosporina impede sua entrada no núcleo e consequentemente interrompe a produçao e secreçao das citocinas nos linfócitos T41.
Desta forma, as células T sao particularmente sensíveis aos efeitos inibitórios da ciclosporina. Por outro lado, outras células sao afetadas pelas açoes da ciclosporina. Alguns estudos demonstraram que a inibiçao da calcineurina influencia diretamente a proliferaçao de queratinócitos. A ciclosporina inibe a liberaçao de citocinas, a ativaçao de linfócitos, a liberaçao de mediadores de mastócitos, a proliferaçao e a secreçao de citocinas por queratinócitos, exercendo importante efeito anti-inflamatório. Em contraste com outras drogas imunossupressoras com açao citotóxica, a ciclosporina nao suprime a medula óssea e nao apresenta risco conhecido de teratogenicidade em humanos41.
A ciclosporina é considerada droga de terceira linha, indicada nos casos em que nao há controle com doses elevadas dos anti-histamínicos nao clássicos42-45.
É recomendada a dose de ciclosporina de 3 a 5 mg/kg/dia até o controle sintomático, quando deve ser iniciada a reduçao gradativa da dose até a retirada. Antes do início da terapêutica, recomendam-se os seguintes exames: hemograma, funçao hepática e renal, incluindo depuraçao de creatinina, ácido úrico, magnésio, eletrólitos, lipidograma, parasitológico de fezes, urina I, sorologia para hepatites B e C, anti-HIV, teste de gravidez para mulheres em idade fértil, PPD ou quantiferon-TB, Rx tórax e outros exames em casos individualizados. Os níveis de pressao arterial sistêmica devem ser monitorados. Quanto às interaçoes medicamentosas, é importante considerar o uso de drogas que interferem na enzima P450 que podem tanto aumentar (diltiazem, verapamil, macrolídeos, fluoroquinolona, amiodarona, antifúngicos, cimetidina, fluoxetina), quanto reduzir (rifampicina, fenobarbital, carbamazepina, griseofulvina) os níveis de ciclosporina no plasma. O corticosteroide, por sua vez, gera aumento nos níveis de ciclosporina, assim como a furosemida e diuréticos tiazídicos. Vacinas com vírus vivos devem ser evitadas47-49.
A ciclosporina apresenta algumas contraindicaçoes absolutas, como hipertensao arterial de difícil controle, disfunçao renal, linfoma de células T; e outras relativas, como hipertensao arterial controlada, gravidez (categoria C) e/ou lactaçao, infecçao ativa, uso concomitante de outros imunossupressores, enxaqueca e gota. Pacientes sob risco de eventos adversos sao: idosos, obesos, diabéticos, hipertensos e usuários de álcool41.
Recomenda-se nao ultrapassar 8 a 12 meses de uso ininterrupto, mas há situaçoes em que se deve continuar. Faz-se o acompanhamento do tratamento pela aferiçao da pressao arterial a cada consulta, dosagem quinzenal da creatinina no primeiro mês, além de hemograma, dosagem de escórias nitrogenadas, elementos anormais e sedimentos urinários, eletrólitos, hepatograma, magnésio, ácido úrico e lipidograma mensais. Caso ocorra aumento da pressao arterial (diastólica > 90 mmHg ou sistólica > 140 mmHg), deve-se repetir após duas semanas a aferiçao. Se a pressao arterial persistir elevada, será necessário reduzir a dose em 25% a 50% e avaliar a introduçao de anti-hipertensivo. Em relaçao aos níveis de creatinina, caso haja elevaçao maior que 30% do valor basal, será preciso repetir o exame após duas semanas. Se os valores se mantiverem elevados, a dose deverá ser reduzida em 1 mg/kg. Após um mês com a dose reduzida, a creatinina deverá ser reavaliada: se tiver retornado aos valores normais, continuar a terapia com ciclosporina; caso o aumento tenha se perpetuado, suspender o tratamento47-49.
Os principais possíveis eventos adversos sao hipertensao arterial e nefrotoxicidade. Entre os fatores de risco para o dano renal estao: dose diária maior que 5 mg/kg, creatinina maior que 30% da basal, elevaçao da pressao arterial e idade avançada. O cardiologista e o nefrologista devem participar do tratamento41.
OMALIZUMABE
O omalizumabe é um anticorpo monoclonal humanizado anti-IgE desenvolvido inicialmente para o tratamento da asma alérgica de difícil controle, que posteriormente mostrou-se útil também para o tratamento da urticária crônica autoimune50. Estudos de prova de conceito, ensaios clínicos randomizados placebo-controlados, com alta qualidade de evidência, confirmaram a eficácia do omalizumabe no tratamento da urticária51-54.
Ensaios clínicos de fase II e III demonstraram a eficácia do omalizumabe em relaçao ao placebo em indivíduos que nao respondiam a doses licenciadas de anti-histamínicos. Estes estudos também permitiram observar a eficácia com diferentes doses do medicamento, que variaram de 75 mg a 600 mg. Curiosamente, a melhor resposta ocorreu com a dose de 300 mg, que passou a ser definida como a melhor dose terapêutica53,55,56.
Uma vez definida a dose terapêutica ideal, o omalizumabe 300 mg foi comparado ao placebo para o tratamento da UCE refratária aos anti-histamínicos em altas doses. A resposta ao tratamento através do UAS 7 foi avaliada em 12 e 24 semanas, com significativa melhora clínica no grupo tratado com omalizumabe em relaçao ao placebo51. Finalmente, estudos nao controlados de "vida real", onde pacientes com UCE refratária aos anti-histamínicos sao tratados com omalizumabe em doses que variam de acordo com a disponibilidade, mostram resposta em mais de 80% dos casos, com remissao completa em 43% a 81% dos casos57-60.
Nos ensaios clínicos, o perfil de segurança foi semelhante ao placebo, nao havendo diferença em relaçao à incidência de eventos adversos em geral. Dor de cabeça, artralgia e reaçao no local da injeçao foram os sintomas significativamente mais prevalentes nos pacientes tratados com omalizumabe52,53,55. Nos estudos de vida real, nao há relatos de eventos adversos graves57-60.
O mecanismo de açao do omalizumabe na UCE está relacionado diretamente à fisiopatologia da doença, onde autoanticorpos do tipo IgG contra a IgE e/ou contra receptores de alta afinidade para IgE ativam os mastócitos, levando à liberaçao de mediadores e desencadeando os sintomas. Da mesma forma, a ativaçao dos mastócitos pode ocorrer pela ligaçao de anticorpos IgE contra autoantígenos na sua superfície. Assim, o omalizumabe atua bloqueando estas diferentes vias de ativaçao dos mastócitos, diminuindo a liberaçao de histamina e mediadores e, consequentemente, reduzindo os sintomas da urticária61.
Atualmente, os diferentes consensos para o diagnóstico e tratamento das urticárias recomendam o omalizumabe em seus algoritmos de tratamento como terceira ou quarta etapas de tratamento, juntamente com a ciclosporina, quando nao há resposta ao uso de anti-histamínicos em doses elevadas. É importante ressaltar que as melhores evidências se referem ao omalizumabe no tratamento da UCE, embora a maior parte dos consensos apresente um algoritmo de tratamento que nao exclui as urticárias induzidas2,7,62,63.
No Brasil, o omalizumabe está indicado na dose de 300 mg a cada 4 semanas para o tratamento da UCE refratária aos anti-histamínicos em doses elevadas64. O tratamento pode ser mantido por períodos prolongados, nao havendo comprometimento da eficácia ou da segurança65,66. Nao é necessário nenhum exame laboratorial para o início do tratamento, nem mesmo a dosagem de IgE total, uma vez que a dose para a urticária é fixa, diferente do que observamos no tratamento da asma. Parasitoses nao sao contraindicaçao para o seu uso, mas recomenda-se tratar os indivíduos infectados. Anafilaxia relacionada ao tratamento com omalizumabe foi raramente observada em pacientes com asma (0,2%), mas nao com urticária. De qualquer forma é recomendada a observaçao do paciente após a primeira aplicaçao por duas horas e nas subsequentes por no mínimo 30 minutos, período durante o qual o risco de anafilaxia é maior64.
CONCLUSAO
A UCE é o subtipo mais frequente da UC. A ativaçao dos mastócitos desempenha papel central na fisiopatologia da doença. Pode estar associada com autoanticorpos circulantes, no entanto, nao se identifica uma causa em aproximadamente 50% dos pacientes. O diagnóstico se baseia na história clínica e exames laboratoriais direcionados. O avanço na compreensao da fisiopatologia da UC auxiliou para desenvolver e/ou melhorar o manejo da doença. O anticorpo monoclonal anti-IgE (omalizumabe) foi um grande avanço no tratamento. No entanto, uma compreensao mais ampla da doença com estudo de biomarcadores, associados ao atendimento personalizado com olhar psicossomático serao de grande valor no manejo do paciente.
REFERENCIAS
1. Dias GAC, Valle SOR, França AT. Impacto da urticária na qualidade de vida relacionada com a saúde. In: França AT & Valle SOR. Urticária e Angioedema: Diagnótico e Tratamento. Ed. Revinter; 2014. p.235‑43.
2. Zuberbier T, Aberer W, Asero R, Bindslev-Jensen C, Brzoza Z, Canonica GW, et al. The EAACI/GA2LEN/EDF/WAO Guideline for the definition, classification, diagnosis, and management of urticaria: the 2013 revision and update. Allergy. 2014;69:868‑87.
3. Criado RFJ, Philippi JC, Franco RS, Mello JF. Urticárias. Rev bras alerg imunopatol. 2005;28(6):273-83.
4. Moolani Y, Lynde C, Sussman G. Advances in understanding and managing chronic urticaria. F1000Res. 2016 Feb 16;5. pii: F1000 Faculty Rev-177.
5. Magerl M, Altrichter S, Borzova E, Giménez-Arnau A, Grattan CE, Lawlor F, et al. The definition, diagnostic testing, and management of chronic inducible urticarias - The EAACI/GA(2) LEN/EDF/UNEV consensus recommendations 2016 update and revision. Allergy. 2016;71:780-802.
6. Ferrer M, Bartra J, Giménez-Arnau A, Jauregui I, Labrador-Horrillo M, Ortiz de Frutos J, et al. Management of urticaria: not too complicated, not too simple. Clin Exp Allergy. 2015;45:731-43.
7. Bernstein JA, Lang DM, Khan DA. The diagnosis and management of acute and chronic urticaria: 2014 update. J Allergy Clin Immunol. 2014;133:1270-7.
8. Khakoo G1, Sofianou-Katsoulis A, Perkin MR, Lack G. Clinical features and natural history of physical urticaria in children. Pediatr Allergy Immunol. 2008;19:363-6.
9. Gaig P, Olona M, Muñoz Lejarazu D, Caballero MT, Domínguez FJ, Echechipia S, et al. Epidemiology of urticaria in Spain. J Invest Allergol Clin Immunol. 2004;14:214-20.
10. Toubi E1, Kessel A, Avshovich N, Bamberger E, Sabo E, Nusem D, et al. Clinical and laboratory parameters in predicting chronic urticaria duration: a prospective study of 139 patients. Allergy. 2004;59:869‑73.
11. Agondi RC, Motta AA. Urticária. In Kalil J, Motta AA, Agondi RC. Alergia e Imunologia: Aplicaçao Clínica. Ed. Atheneu; 2015.
12. Jain S. Pathogenesis of chronic urticaria: an overview. Dermatol Res Pract. 2014;2014:674709.
13. Sabroe RA, Greaves MW. The pathogenesis of chronic idiopathic urticaria. Arch Dermatol. 1997;133:1003-8.
14. Motta AA, Giavina-Bianchi P. Urticária. In Martins MA: Clínica Médica vol.7. Ed. Manole; 2016.
15. Farres MN, Refaat M, Melek NA, Ahmed EE, Shamseldine MG, Arafa NA. Activation of coagulation in chronic urticaria in relation to disease severity and activity. Allergol Immunopathol (Madr). 2015;43:162-7.
16. Zuberbier T. Urticaria. Allergy. 2003;58:1224-34.
17. Weller K, Groffik A, Church MK, Hawro T, Krause K, Metz M, et al. Development and validation of the Urticaria Control Test: a patient-reported outcome instrument for assessing urticaria control. J Allergy Clin Immunol. 2014;133:1365-72.
18. Dias GA, Pires GV, Valle SO, França AT, Papi JA, Dortas SD Jr, et al. Cross-cultural adaptation of the Brazilian-Portuguese version of the chronic urticaria quality-of-life questionnaire - CU-Q2oL. Allergy. 2011;66:1487-93.
19. Baiardini I, Bousquet PJ, Brzoza Z, Canonica GW, Compalati E, Fiocchi A, et al. Recommendations for assessing patient-reported outcomes and health-related quality of life in clinical trials on allergy: a GA(2) LEN taskforce position paper. Allergy. 2010;65:290-5.
20. Maurer M, Weller K, Bindslev-Jensen C, Giménez-Arnau A, Bousquet PJ, Bousquet J, et al. Unmet clinical needs in chronic spontaneous urticaria. A GA²LEN task force report. Allergy. 2011;66:317-30.
21. Criado PR, Criado RF, Maruta CW, Machado Filho CD. Histamina, receptores de histamina e anti-histamínicos: novos conceitos. An Bras Dermatol. 2010;85:195-210.
22. Pastorino AC. Revisao sobre a eficácia e segurança dos antihistamínicos de primeira e segunda geraçao. Rev bras alerg imunopatol. 2010;33(3):88-92.
23. Parsons ME, Ganellin CR. Histamine and its receptors. Br J Pharmacol. 2006;147:S127-35.
24. Leurs R, Church MK, Taglialatela M. H1-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects. Clin Exp Allergy. 2002;32:489-98.
25. Maurer M, Magerl M, Metz M, Zuberbier T. Revisions to the international guidelines on the diagnosis and therapy of chronic urticaria. J Dtsch Dermatol Ges. 2013;11:971-7.
26. Bartra J, Velero AL, del Curvillo A, Dávila I, Jáuregui I, Montoro J, et al. Interactions of the H1 antihistamines. J Investig Allergol Clin Immunol. 2006;16(Suppl 1):29-36.
27. Camelo-Nunes IC. Novos anti-histamínicos: uma visao crítica. J Pediatr (Rio J). 2006;82(5 Suppl):S173-80.
28. Benedictis FM, Benedictis D, Canonica GW. New oral H1 antihistamines in children: facts and unmeet needs. Allergy. 2008:63:1395‑404.
29. Simons FER. Advances in H1-Antihistamines. N Engl J Med. 2004;351:2203-17.
30. Staevska M, Popov TA, Kralimarkova T, Lazarova C, Kraeva S, Popova D, et al. The effectiveness of levocetirizine and desloratadine in up to 4 times conventional doses in difficult-to-treat urticaria. J Allergy Clin Immunol. 2010;125:676-82.
31. Kulthanan K, Tuchinda P, Chularojanamontri L, Chanyachailert P, Korkij W, Chunharas A, et al. Clinical Practice guideline for diagnosis and management of urticaria. Asian Pac J Allergy Immunol. 2016;34:190-200.
32. Schimmer BP, Parker KL. Hormônio adrenocorticotrópico; esteroides adrenocorticais e seus análogos sintéticos; inibidores da síntese e das açoes dos hormônios adrenocorticais. In: Goodman Gilman, editor. As bases farmacológicas da terapêutica. 10 ed. Ed. MC Graw-Hill; 2003. p.1241-61.
33. Zuberbier T, Aberer W, Asero R, Bindslev-Jensen C, Brzoza Z, Canonica GW, et al. Methods report on the development of the 2013 revision and update of the EAACI/GA2LEN/EDF/WAO guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2014;69:e1-e29.
34. Ferdman RM. Urticaria e angioedema. Clin Ped Emerg Med. 2007;8:72-80.
35. Morgan M, Khan DA. Therapeutic alternatives for chronic urticaria: an evidence-based review, part 1. Ann Allergy Asthma Immunol. 2008;100:403-11.
36. Theron AJ, Steel HC, Tintinger GR, Gravett CM, Anderson R, Feldman C. Cysteinyl leukotriene receptor-1 antagonists as modulators of innate immune cell function. J Immunol Res. 2014;2014:608930.
37. Pacor ML, Di Lorenzo G, Corrocher R. Efficacy of leukotriene receptor antagonist in chronic urticaria. A double-blind, placebo-controlled comparison of treatment with montelukast and cetirizine in patients with chronic urticaria with intolerance to food additive and/or acetylsalicylic acid. Clin Exp Allergy. 2001;31:1607-14.
38. Kosnik, M & Subic T. Add-on montelukast in anti-histamine resistant chronic idiopathic urticaria. Respir Med. 2011;105:584-8.
39. Mitchell S, Balp MM, Samuel M, McBride D, Maurer M. Systematic review of treatments for chronic spontaneous urticaria with inadequate response to licensed first-line treatments. Int J Dermatol. 2015;54:1088-104.
40. de Silva NL, Damayanthi H, Rajapakse AC, Rodrigo C, Rajapakse S. Leukotriene receptor antagonists for chronic urticaria: a systematic review. Allergy Asthma Clin Immunol. 2014;10:24.
41. Pires & Cestari. In: Dermatite Atópica. Ed. Diagraphic. 2005:1-161.
42. Mehta A, Godse K, Patil S, Nadkarni N, Gautam M. Treatment of refractory chronic urticaria. Indian J Dermatol. 2015;60:280-7.
43. Criado PR, Criado RFJ, Maruta CW, Reis VMS. Chronic urticaria in adults: state-of-art in the new millennium. An Bras Dermatol. 2015;90:74-89.
44. Máspero J, Cabrera H, Ardusso L, De Gennaro M, Fernández Bussy R, Galimany J, et al. Argentine guidelines for urticaria and angioedema. Medicina (B Aires). 2014;74 Suppl 1:1-53.
45. Kaplan AP. Therapy of chronic urticaria: a simple, modern approach. Ann Allergy Asthma Immunol. 2014;112:419-25.
46. Guaragna MA, Albanesi M, Stefani S, Franconi G, Di Stanislao C, Paparo Barbaro S. Chronic urticaria with high IgE levels: first results on oral cyclosporine treatment. Clin Ter. 2013;164:115-8.
47. Kessel, Toubi E. Cyclosporine in severe chronic urticaria: the option for long-term therapy. Allergy. 2010;65:1478-82.
48. Fradin MS, Ellis CN, Goldfarb MT, Voorhees JJ. Oral cyclosporine for severe chronic urticaria and angioedema. J Am Acad Dermatol. 1991;1:1065-67.
49. Toubi E, Blant A, Kessel A, Golan TD. Low dose cyclosporine in the treatment of severe chronic urticaria. Allergy. 1997;52:312-16.
50. Kaplan AP, Joseph K, Maykut RJ, Geba GP, Zeldin RK. Treatment of chronic autoimmune urticaria with omalizumab. J Allergy Clin Immunol. 2008;122:569-73.
51. Carrillo DC, Borges MS, García E, Egea E, Serrano CD. Omalizumab vs. placebo in the management of chronic idiopathic urticaria: a systematic review. World Allergy Organ J. 2014;7:72.
52. Kaplan A, Ledford D, Ashby M, Canvin J, Zazzali JL, Conner E, et al. Omalizumab in patients with symptomatic chronic idiopathic/spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol. 2013;132:101-9.
53. Maurer M, Rosén K, Hsieh H-J, Saini S, Grattan C, Gimenéz-Arnau A, et al. Omalizumab for the Treatment of Chronic Idiopathic or Spontaneous Urticaria. N Engl J Med. 2013;368:924-35.
54. Maurer M, Altrichter S, Bieber T, Biedermann T, Bräutigam M, Seyfried S, et al. Efficacy and safety of omalizumab in patients with chronic urticaria who exhibit IgE against thyroperoxidase. J Allergy Clin Immunol. 2011;128:202-5.
55. Saini SS, Bindslev-Jensen C, Maurer M, Grob JJ, Bülbül Baskan E, Bradley MS, et al. Efficacy and safety of omalizumab in patients with chronic idiopathic/spontaneous urticaria who remain symptomatic on H1 antihistamines: a randomized, placebo-controlled study. J Invest Dermatol. 2015;135:67-75.
56. Saini S, Rosen KE, Hsieh H-J, Wong DA, Conner E, Kaplan A, et al. A randomized, placebo-controlled, dose-ranging study of single-dose omalizumab in patients with H1-antihistamine-refractory chronic idiopathic urticaria. J Allergy Clin Immunol. 2011;128:567-73.
57. Sussman G, Hebert J, Barron C, Bian J, Caron-Guay RM, Laflamme S, et al. Real-life experiences with omalizumab for the treatment of chronic urticaria. Ann Allergy Asthma Immunol. 2014;112:170-4.
58. Rottem M, Segal R, Kivity S, Shamshines L, Graif Y, Shalit M, et al. Omalizumab therapy for chronic spontaneous urticaria: the Israeli experience. Isr Med Assoc J. 2014;16:487-90.
59. Labrador-Horrillo M, Valero A, Velasco M, Jáuregui I, Sastre J, Bartra J, et al. Efficacy of omalizumab in chronic spontaneous urticaria refractory to conventional therapy: analysis of 110 patients in reallife practice. Expert Opin Biol Ther. 2013;13:1225-8.
60. Ensina LF, Valle SOR, Juliani AP, Galeane M, Vieira dos Santos R, Arruda LK, et al. Omalizumab in chronic spontaneous urticaria: a Brazilian real-life experience. Int Arch Allergy Immunol. 2016;169:121-4.
61. Chang TW, Chen C, Lin C-J, Metz M, Church MK, Maurer M. The potential pharmacologic mechanisms of omalizumab in patients with chronic spontaneous urticaria. J Allergy Clin Immunol. 2015;135:337‑42.
62. Powell RJ, Leech SC, Till S, Huber PA, Nasser SM, Clark AT, et al. BSACI guideline for the management of chronic urticaria and angioedema. Clin Exp Allergy. 2015;45:547-65.
63. Chow SKW. Management of chronic urticaria in Asia: 2010 AADV consensus guidelines. Asia Pac Allergy. 2012;2:149-60.
64. Xolair [BULA]. Stein, Suiça. Novartis Pharma Stein. 22.07.2015.
65. Har D, Patel S, Khan DA. Outcomes of using omalizumab for more than 1 year in refractory chronic urticaria. Ann Allergy Asthma Immunol. 2015;115:126-9.
66. Ensina LF, de Lacerda AE, Machado LM de O, et al. Long-term omalizumab therapy for refractory chronic spontaneous urticaria: a real-life experience. Ann Allergy Asthma Immunol. 2015;115:536.