Número Atual: Setembro-Outubro 2015 - Volume 3 - Número 5
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Eduardo Costa, MD, PhD
- Janaina Michelle Lima Melo, MD, PhD
- Marcelo Vivolo Aun, MD, PhD
- Pedro Francisco Giavina Bianchi Jr., MD, PhD
- Jose Laerte Boechat, MD, PhD
- Gustavo Falbo Wandalsen, MD, PhD
- José Angelo Rizzo, MD, PhD
- Alvaro Augusto Cruz, MD, PhD
- Adelmir Souza-Machado, MD, PhD
- Flavio Sano, MD, PhD
- Faradiba Sarquis Serpa, MD, MSc
ARTIGO ESPECIAL
Guia para o manejo da asma grave
Guideline for the management of severe asthma
Eduardo Costa, MD, PhD1; Janaina Michelle Lima Melo, MD, PhD2; Marcelo Vivolo Aun, MD, PhD3; Pedro Francisco Giavina Bianchi Jr., MD, PhD3; Jose Laerte Boechat, MD, PhD4; Gustavo Falbo Wandalsen, MD, PhD5; José Angelo Rizzo, MD, PhD6; Alvaro Augusto Cruz, MD, PhD7; Adelmir Souza-Machado, MD, PhD8; Flavio Sano, MD, PhD9; Faradiba Sarquis Serpa, MD, MSc10
DOI: 10.5935/2318-5015.20150025
1. Universidade do Estado do Rio de Janeiro, UERJ, Rio de Janeiro, RJ
2. Hospital das Clínicas da Faculdade de Medicina de Ribeirao Preto, Universidade de Sao Paulo, FMRP-USP, Ribeirao Preto, SP
3. Faculdade de Medicina da Universidade de Sao Paulo, FMUSP, Sao Paulo, SP
4. Faculdade de Medicina da Universidade Federal Fluminense, UFF, Niterói, RJ
5. Universidade Federal de Sao Paulo, UNIFESP, Sao Paulo, SP
6. Universidade Federal de Pernambuco, UFPE, Recife, PE
7. Faculdade de Medicina da Bahia, Universidade Federal da Bahia, UFBA, Salvador, BA
8. Instituto de Ciências da Saúde, UFBA, Salvador, BA
9. Hospital Nipo-Brasileiro, Sao Paulo, SP
10. Escola Superior de Ciências, Santa Casa de Misericórdia de Vitória, EMESCAM, Vitória, ES
1-10. Grupo de Assessoria em Asma da Associaçao Brasileira de Alergia e Imunologia - ASBAI
Endereço para correspondência:
Eduardo Costa
E-mail: educostamd@gmail.com
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
Submetido em: 09/10/2016, aceito em: 03/11/2016.
RESUMO
O conceito e a abordagem da asma grave sofreram modificaçoes ao longo das últimas décadas. Atualmente sao considerados asmáticos graves os pacientes que necessitam das etapas 4 ou 5 de tratamento da Global Initiative for Asthma (GINA) para evitar o descontrole da doença ou que permanecem nao controlados apesar dessa terapêutica. O diagnóstico de asma grave deve ser estabelecido após avaliaçao de condiçoes que contribuem para o nao controle da doença, como a adesao e o acesso ao tratamento, a técnica inalatória, os diagnósticos diferenciais e as comorbidades prevalentes nessa populaçao. Além da terapia com corticosteroides inalados em alta dose associados a beta-2 agonistas de longa açao, antagonistas do receptor muscarínico de longa açao e agentes biológicos dirigidos contra moléculas bioativas envolvidas na fisiopatologia da doença têm demonstrado eficácia no controle da asma. A introduçao das terapias alvo com agentes biológicos na etapa 5 da GINA permite um tratamento de precisao, baseado no fenótipo e/ou endótipo da asma, e representa uma nova e grande janela de oportunidade no controle da asma grave. Nesse contexto, este guia foi desenvolvido com o objetivo de contribuir para uma melhor abordagem da asma grave por parte do especialista.
Descritores: Asma, diagnóstico, terapêutica.
INTRODUÇAO
A asma é uma doença comum e heterogênea, caracterizada por inflamaçao da via aérea, hiper-responsividade brônquica e evoluçao clínica extremamente variável. Estima-se que há mais de 300 milhoes de asmáticos no mundo e 5 a 10% apresentam formas graves, que estao associadas a maior mortalidade e maior consumo de recursos medicamentosos e hospitalares, com impacto significante em suas famílias, na força de trabalho e nos sistemas de saúde1.
Identificar e abordar adequadamente a asma grave faz parte do conjunto de habilidades de especialistas em medicina respiratória, principalmente alergistas/imunologistas, e pneumologistas. Este documento, produzido pelo Grupo de Assessoria em Asma da Associaçao Brasileira de Alergia e Imunologia (ASBAI), pretende sistematizar o conhecimento de forma prática e objetiva, para estimular e subsidiar o especialista na abordagem eficiente do paciente com asma grave em nosso meio.
Definiçao de asma grave
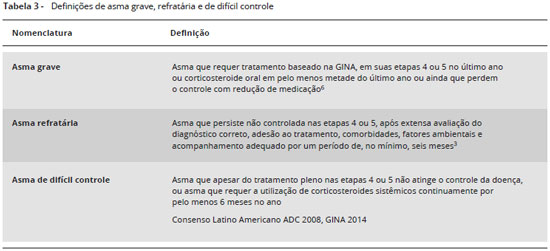
Desde a implantaçao da Iniciativa Global para a Asma (Global Initiative for Asthma - GINA), na década de 1990, a classificaçao de gravidade de asma sofreu diversas modificaçoes. Inicialmente era classificada em intermitente, persistente leve, moderada e grave de acordo com a frequência de sintomas diurnos e noturnos, uso de beta-2 agonista de resgate e parâmetros de funçao pulmonar (volume expiratório forçado no primeiro segundo - VEF1 e pico de fluxo expiratório - PFE), independentemente do tratamento utilizado2. A partir da atualizaçao de 2006, passou a se avaliar o controle da asma em pacientes sob tratamento de manutençao, de forma a diferenciar o que seria a asma persistente grave, ainda virgem de tratamento, da asma nao controlada, que seria aquela que permanecia sintomática e com funçao pulmonar alterada apesar de tratamento adequado. Num workshop realizado em Paris, em 2007, começou-se a abordar a asma grave como asma refratária, ou seja, aquela que persiste nao controlada após extensa avaliaçao do diagnóstico correto, comorbidades, fatores ambientais e acompanhamento adequado por um período de, no mínimo, seis meses3. Em 2008, foi publicada em periódico a última versao da GINA que incluiu as tabelas de classificaçao de gravidade e do controle da asma. A partir de 2009, as atualizaçoes periódicas ocorreram na versao on line, sendo a última publicada em 20161. Essas versoes incluem, apenas, a tabela de classificaçao do controle da asma, e nao abordam de maneira específica e detalhada a asma grave.
Dessa forma, em 2010, a Organizaçao Mundial de Saúde, por meio de seu painel de consultores, publicou uma uniformizaçao da definiçao do que seria asma grave6. Primeiramente, foi postulado que os chamados "componentes da gravidade da asma" seriam o seu nível de controle (baseado na GINA) nas últimas 2 a 4 semanas, ocorrência de exacerbaçoes nos últimos 6 a 12 meses (incluindo frequência, gravidade e necessidade de corticosteroide sistêmico), etapa (step) do tratamento de manutençao (incluindo aferiçao da técnica de uso dos dispositivos de medicaçao e aderência), resposta a esse tratamento e risco futuro5. Após toda esta avaliaçao, o paciente poderia ser classificado como portador de asma grave em uma das três categorias:
1. Asma grave nao tratada - pacientes sem utilizaçao correta de medicaçao, seja por prescriçao inadequada, seja por má técnica ou aderência.
2. Asma grave difícil de tratar - pacientes com efeitos adversos das medicaçoes, dificultando a otimizaçao do tratamento.
3. Asma grave resistente ao tratamento - incluiria as chamadas asma refratária ou cortico-resistente (asma que nao é controlada apesar do tratamento plenamente otimizado em alto nível) e a asma que só permanece controlada com doses mais altas e contínuas de medicaçao.
Contudo, após essa diretriz para uniformizaçao da nomenclatura, alguns grupos continuavam discordando da inclusao do grupo "asma grave nao tratada" na definiçao de asma grave, pois essa deveria contemplar apenas os casos antes denominados "de difícil controle". Em 2011, um grupo europeu sugeriu o termo "asma grave refratária", que excluiria a asma inadequadamente tratada1.
Nessa mesma linha e, novamente, tentando organizar a nomenclatura, as sociedades American Thoracic Society (ATS) e European Respiratory Society (ERS) publicaram diretrizes sobre definiçao, abordagem e tratamento da asma grave em pacientes acima dos 6 anos de idade6. Nessa diretriz, ficou definido que asma grave é aquela que requer tratamento baseado na GINA, em suas etapas (steps) 4 ou 5 (corticosteroide inalado em alta dose, associado a outro controlador, que poderia ser beta-2 de longa açao, anti-leucotrieno ou teofilina) no último ano ou corticosteroide oral em pelo menos metade do último ano6. Pacientes seriam considerados asmáticos graves se necessitassem desse nível de tratamento para evitar descontrole da doença ou permanecessem descontrolados apesar dessa terapêutica. Também baseados nessa diretriz6, definir-se-ia asma nao controlada aquela que apresentasse uma das situaçoes a seguir:
- Controle pobre da asma (Asthma Control Questionnaire ACQ maior que 1,5; Asthma Control Test ACT menor que 20; ou "nao controlada" pelas diretrizes GINA ou National Asthma Education and Prevention NAEPP).
- Duas ou mais exacerbaçoes no último ano (uso de corticosteroide sistêmico por mais de 3 dias).
- Uma exacerbaçao grave no último ano (hospitalizaçao, internaçao em Unidade de Terapia Intensiva ou necessidade de Ventilaçao Mecânica).
- Limitaçao ao fluxo aéreo (VEF1 < 80% do predito após broncodilatador na presença de relaçao VEF1/CVF reduzida).
Na sua versao mais atualizada, a GINA também sugeriu que o termo "asma grave" só deveria ser utilizado após extensa avaliaçao do diagnóstico e otimizaçao terapêutica, incluindo aferiçao da aderência e técnica inalatória dos dispositivos, causas frequentes de nao controle da doença na prática clínica1.
Desta forma, no presente documento, sugerimos nao incluir a asma nao adequadamente tratada no grupo grave. Apenas pacientes tratados nas etapas 4 e 5 da GINA devem ser incluídos.
Além disso, na prática clínica diária dos especialistas brasileiros, ainda nao é frequente o uso dos questionários ACT e ACQ no atendimento. Com isso, sugerimos utilizar a classificaçao de controle da GINA (definida como "nao controlada") para avaliar os possíveis pacientes a serem incluídos no grupo de asmáticos graves. Além disso, pacientes que tenham apresentado duas ou mais exacerbaçoes (usos de corticosteroide sistêmico por mais de 3 dias) ou uma exacerbaçao grave no último ano (hospitalizaçao, internaçao em Unidade de Terapia Intensiva ou necessidade de Ventilaçao Mecânica) também seriam considerados como graves, bem como aqueles com limitaçao persistente ao fluxo aéreo (VEF1 < 80% após 400 µg de salbutamol na espirometria).
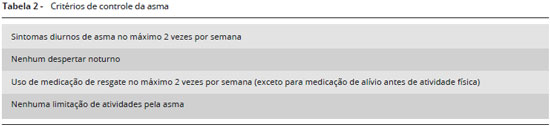
Desse modo, neste documento, sugerimos definir como asma grave os pacientes que apresentem asma em tratamento nas etapas 4 ou 5 da GINA e que necessitem deste nível de tratamento para evitar descontrole da doença ou aqueles que permanecem descontrolados apesar dessa terapêutica. Consideramos como nao controle da asma qualquer um dos 4 critérios expostos na Tabela 1.
AVALIAÇAO DO CONTROLE DA ASMA
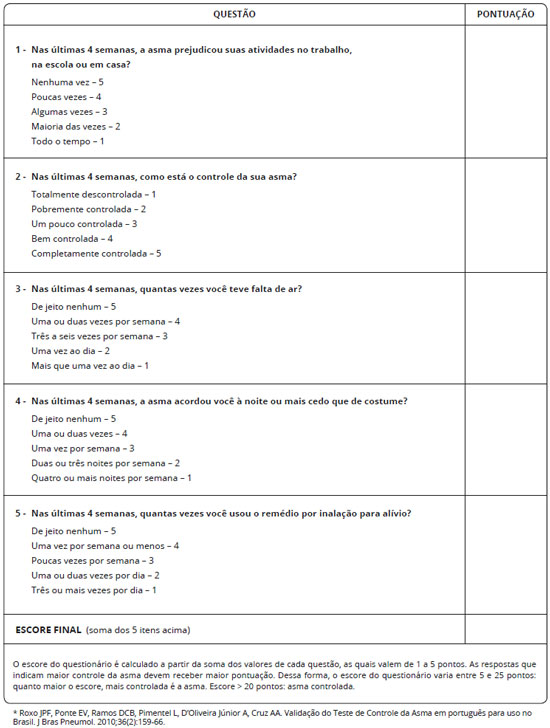
Baseados nos termos acima, sugerimos que o controle da asma seja abordado com base nos critérios da GINA1. Demais ferramentas de avaliaçao do controle, baseadas em questionários como o ACT ou o ACQ, podem ser utilizadas, mas por terem menor uso na prática clínica nao devem substituir os critérios GINA, de modo que possamos uniformizar a definiçao. Entretanto, encorajamos o uso mais frequente do ACT ou ACQ na prática clínica como ferramentas simples e objetivas, que podem ajudar no manejo do paciente com asma ao longo do tempo. Questoes que compoem o ACT, e a interpretaçao dos resultados sao apresentadas nas Figuras 1 e 2. Assim, serao considerados controlados os pacientes que preencham todos os critérios descritos na Tabela 2, nas últimas 4 semanas.

Figura 1 - Teste de Controle da Asma (ACT) para faixa etária de 4 a 11 anos validado para o português*
Pacientes que nao preencherem 1 ou 2 desses critérios devem ser considerados parcialmente controlados e aqueles com 3 ou 4 dos itens nao atendidos sao considerados nao controlados. Comprometimento da funçao pulmonar persistente (VEF1 abaixo de 80% na presença de uma relaçao VEF1/CVF reduzida), além de ser considerado critério de nao controle, também é considerado como risco futuro para exacerbaçoes. Recomenda-se medir o VEF1 no início do tratamento, 3 a 6 meses depois de iniciado o tratamento para registrar o melhor valor pessoal, e depois periodicamente, para avaliaçao contínua do risco1.
COMO ESTABELECER O DIAGNOSTICO DE ASMA DE DIFICIL CONTROLE
Até a atualizaçao de GINA de 2014, incluíamos nos chamados pacientes com "asma de difícil controle" (ADC) aqueles asmáticos que, apesar do tratamento pleno (etapas 4 ou 5) nao alcançavam o controle da doença, ou aqueles que utilizavam corticosteroides sistêmicos continuamente por pelo menos 6 meses no ano. Esses também eram os critérios do último consenso latinoamericano sobre ADC7. Nessas condiçoes, pacientes com critérios para gravidade pelas publicaçoes mais antigas, mas que estavam controlados em quaisquer níveis de tratamento, poderiam ser denominados como portadores de "asma grave controlada".
Após a publicaçao das diretrizes americanas e europeias sobre definiçao e abordagem da asma grave6, sugere-se definir como graves apenas os pacientes nao controlados nas etapas 4 ou 5 ou que ficam descontrolados com reduçao de medicaçao, ou seja, o que antes se definia como ADC ou asma refratária. Com essa nova definiçao, pode-se considerar a atual asma grave sinônimo da definiçao mais antiga de asma refratária e de ADC. Portanto, pacientes que preencham critérios para asma nao controlada (3 ou 4 itens da Tabela 2) terao preenchido o primeiro critério da definiçao de asma grave (Tabela 1). Concluímos, com isso, que os três termos (asma grave, asma refratária e ADC) definem a mesma entidade clínica e podem ser utilizados (Tabela 3). Neste documento utilizaremos o termo asma grave.
AVALIAÇAO DO PACIENTE COM ASMA GRAVE NA PRATICA CLINICA
A abordagem do paciente com asma grave deve incluir 4 etapas: confirmar o diagnóstico de asma; definir, se possível, o fenótipo da asma; diferenciar asma grave de asma leve ou asma nao tratada; definir se a asma está controlada ou nao controlada.
Confirmar o diagnóstico de asma
Antes de pensar em asma grave, é obrigatório confirmar o diagnóstico de asma. Os médicos devem suspeitar do diagnóstico antes de aceitá-lo, pois postula-se que até 30% dos pacientes definidos como asmáticos graves tenham condiçoes nao asmáticas que mimetizam a doença6. Sao vários os diagnósticos diferenciais existentes e, dada a alta prevalência da asma, muitas vezes ela é a primeira hipótese diagnóstica do pediatra ou clínico geral, mas sem a devida confirmaçao. Estudos nacionais também confirmam esses achados8,9. Portanto, é fundamental confirmar a existência da asma e, para tal, deve-se seguir a sequência abaixo:
- História clínica detalhada, incluindo o questionamento de sintomas clássicos (dispneia, sibilância, opressao torácica e tosse), a relaçao destes com exercício ou risadas, despertares noturnos, desencadeantes de crises, etc.
- Confirmaçao da limitaçao reversível ao fluxo aéreo pela espirometria; essa etapa pode incluir a retirada de medicaçao anti-asmática, que pode "mascarar" a obstruçao reversível.
- Broncoprovocaçao inespecífica com metacolina, histamina ou exercício, para os casos em que a espirometria, mesmo após a reduçao ou suspensao da medicaçao, tenha sido inconclusiva.
Antes do cumprimento da primeira etapa, nao recomendamos passar à seguinte, ou seja, é obrigatório confirmar o diagnóstico de asma, mesmo que isso inclua a reduçao paulatina até a suspensao do tratamento temporariamente, antes de tentar controlar uma "falsa asma grave" com maiores doses de medicaçao. A última atualizaçao da GINA propoe estratégias para reduçao da medicaçao nas diferentes etapas do tratamento1. Por exemplo, na etapa 5, quando se usa corticosteroide inalado em dose alta + LABA associado a corticosteroide oral, deve-se primeiro reduzir a dose até retirar o corticosteroide oral, antes de iniciar a reduçao da medicaçao inalada. No uso de corticosteroide inalado em alta dose + LABA, sugere-se reduzir o corticoide inalado em 50% e manter a dose de LABA. A partir daí sao reduzidos os dois conjuntamente até alcançar um esquema de dose única diária da associaçao. No uso de corticosteroide inalado em dose média ou baixa duas vezes ao dia, prefere-se reduzir a administraçao para uma vez ao dia antes de suspender.
Caracterizar o fenótipo da asma
A caracterizaçao dos fenótipos da asma grave é importante para tomada de decisoes terapêuticas e pode predizer provável resposta a determinado tipo de tratamento. Nesse contexto, sao considerados fatores clínicos, demográficos, patológicos e funcionais.
A diferenciaçao fenotípica clássica da asma gira em torno da presença ou nao da atopia, ou seja, as chamadas asma alérgica (ou extrínseca) e asma nao alérgica (ou intrínseca). Contudo, apenas esses dois fenótipos nao distinguem muitas das apresentaçoes clínicas da asma.
O estudo pioneiro e talvez mais relevante no campo dos fenótipos da asma foi publicado em 2008, por meio de análise por clusters em asmáticos atendidos em centros primários e secundários de atençao à saúde10. Nesse estudo, definiu-se dois principais fenótipos clínicos, tanto no nível primário como no secundário: asma atópica (alérgica) de início precoce e asma nao eosinofílica, de início tardio em mulheres obesas. No nível primário, ainda definiu-se um terceiro cluster, denominado asma de evoluçao benigna. No atendimento secundário foram encontrados outros dois clusters com asma mais grave e difícil alcance de normalizaçao da funçao pulmonar: o primeiro de pacientes atópicos, com início precoce da doença, muito sintomáticos e com inflamaçao eosinofílica de pequena monta; o segundo grupo seria quase o oposto, com pacientes oligossintomáticos, de início tardio e de perfil eosinofílico10.
Outro estudo, publicado em 2010, também usou análise de clusters para diferenciar fenótipos de asma grave, e encontrou 5 diferentes grupos que incluiam asma grave e nao grave. Embora com algumas diferenças em relaçao ao estudo de Haldar et al., os fenótipos atópico de início precoce e obeso de início tardio também foram descritos, e os fenótipos caracteristicamente associados à asma de maior gravidade foram: asma alérgica grave com evoluçao variável, asma grave de início tardio (que incluiu o subgrupo de mulheres com asma associada à obesidade) e asma com limitaçao fixa ao fluxo aéreo, que na atualidade pode corresponder aos casos de superposiçao asma/doença pulmonar obstrutiva crônica (DPOC)11.
Recentemente, a quantificaçao de eosinófilos no escarro induzido, a dosagem de óxido nítrico no ar exalado ou, ainda, a medida do pH e dosagens de produtos do metabolismo oxidativo e interleucinas no condensado do ar expirado e, até mesmo, a eosinofilia no sangue periférico, passaram a ser utilizados e/ou têm sido estudados como biomarcadores, para auxiliar na caracterizaçao do paciente asmático. Assim, define-se o fenótipo pelas características clínicas e o chamado endótipo, pelas características dos biomarcadores12.
Embora haja uma tendência clássica de se diferenciar apenas a asma alérgica da nao alérgica, talvez os perfis inflamatórios eosinofílico ou nao eosinofílico (neutrofílico ou paucicelular) sejam mais importantes do ponto de vista de intervençao terapêutica. A asma eosinofílica tende a ter melhor resposta aos corticosteroides inalados e sistêmicos, ao passo que pacientes nao eosinofílicos costumam ser mais refratários à corticoterapia. Essa diferenciaçao fenotípica e endotípica parece ser cada vez mais importante para o futuro do tratamento da asma, principalmente com a chegada dos novos imunobiológicos12. No mercado brasileiro, até o presente momento, apenas o omalizumabe (anti-IgE) está disponível para asma alérgica grave, mas em alguns países o mepolizumabe (anti-IL5) já está aprovado e já foi incluído na atualizaçao de 2016 da GINA, para asma eosinofílica nao alérgica na etapa 5 do tratamento. Portanto, devemos ficar atentos às novas estratégias terapêuticas que estarao disponíveis em breve, pois, sem dúvida, o tratamento da asma grave baseado apenas em corticoterapia inalatória e beta-2 de longa açao nao contempla alguns fenótipos e endótipos mais graves dessa síndrome.
Diferenciar asma grave de asma leve ou asma nao tratada
Na abordagem de um paciente com diagnóstico confirmado de asma e que persiste muito sintomático, antes de defini-lo como asmático grave, é necessário rever o tratamento vigente. Só deverá ser considerado asmático grave aquele que tiver qualquer dos itens da Tabela 1, na vigência de tratamento pleno (etapas 4 ou 5 da GINA). Além disso, é necessário rever rotineiramente a adesao e técnica de uso dos dispositivos inalatórios, pois falha nestes quesitos implicará em doses menores de medicaçao realmente utilizada, ou seja, o paciente pode nao estar verdadeiramente nas etapas finais de acordo com a GINA.
Pacientes muito sintomáticos, com exacerbaçoes ou funçao pulmonar comprometida, mas que estejam tratados com monoterapia ou doses baixas a médias de corticosteroides inalados devem ser considerados como asmáticos leves ou moderados inadequadamente tratados. Para estes pacientes devem ser prescritas doses altas de corticosteroides inalados, associadas a outro controlador (beta-2 de longa açao, montelucaste ou teofilina) para avaliaçao da resposta clínica e funcional. Persistindo a sintomatologia e/ou a limitaçao funcional, pode-se lançar mao de curso de corticosteroide oral 1 mg/Kg/dia por 7 a 14 dias, com nova reavaliaçao clínica e funcional, antes de incluí-los no subtipo asma grave.
Definir se a asma está controlada ou nao controlada
Este ponto também é fundamental. Os critérios para asma nao controlada estao definidos na Tabela 1 e o primeiro item da Tabela 1 está detalhado na Tabela 2. Qualquer item da Tabela 1 configura asma nao controlada (desde que o diagnóstico de asma esteja totalmente definido pelo quadro clínico e funcional). A presença de um item, associado ao tratamento pleno da asma com doses altas de medicaçao (etapas 4 ou 5 da GINA) define asma grave, refratária ou ADC, objeto deste documento. Definida a real gravidade da doença, é importante investigar possíveis causas de nao controle da doença e avaliar a necessidade de encaminhamento ao especialista/centro de referência em asma grave.
Investigaçao das possíveis causas de nao controle da asma
A principal causa de nao controle da asma é a má adesao ao tratamento, que inclui a técnica inadequada de uso dos dispositivos inalatórios1,6,8. A má adesao ao tratamento pode chegar a mais de 50% nos pacientes com asma13 e a técnica imprópria da inalaçao também configura séria dificuldade no manejo da doença e está associada à má adesao ao seguimento ambulatorial14,15. Um estudo recente mostrou que até 45% dos pacientes utilizavam a medicaçao com técnica inadequada, o que implicava em maior frequência de idas à emergência por exacerbaçao. Por fim, também dentro do contexto da adesao ao tratamento, está a adesao às medidas de controle ambiental. A exposiçao a alérgenos e irritantes pode configurar causa importante de descontrole da asma, notadamente no caso dos alérgenos ocupacionais, e deve ser aferida pelo médico assistente8.
Após abordar técnica inalatória, aderência ao tratamento e controle ambiental, o próximo passo deve ser avaliar as comorbidades e os fenótipos da asma. Sao muitas as comorbidades da asma e, quando nao controladas, contribuem para uma má evoluçao da doença. As principais comorbidades e diagnósticos diferencias da asma sao rinossinusite, doença do refluxo gastroesofágico (DRGE), obesidade, disfunçao de pregas vocais, reaçoes adversas a medicamentos (principalmente, anti-inflamatórios nao esteroidais, beta-bloqueadores e inibidores da ECA), DPOC e sua síndrome de sobreposiçao com asma (ACOS), imunodeficiências (primárias ou secundárias), granulomatose eosinofílica com poliangeite (que tradicionalmente era denominada de síndrome de Churg-Strauss), e aspergilose broncopulmonar alérgica (ABPA)1,6,8. Um estudo nacional mostrou que, em uma coorte de pacientes com asma grave, mais de 90% tinham sintomas nasais e 73% quadro sugestivo de DRGE associado16.
A iniciativa ARIA (Rinite Alérgica e seu Impacto na Asma) preconiza a necessidade de tratar a rinite de modo a auxiliar no controle da asma, conduta sustentada por diversos estudos17,18. Quanto à DRGE, embora resultados de ensaios clínicos sejam conflitantes quanto ao impacto do tratamento da DRGE na asma, a GINA sugere a realizaçao de curso empírico de inibidor de bomba de prótons por 90 dias em pacientes com quadro clínico sugestivo de DRGE associado à asma1.
A obesidade é uma das atuais epidemias mundiais e seu aumento vem ocorrendo em paralelo ao aumento da asma no mundo ocidental. Além de epidemiologicamente associadas, sao comorbidades que podem levar ao descontrole mútuo. Alguns medicamentos para asma, notadamente os corticosteroides sistêmicos, acarretam aumento do peso corporal. Além disso, pacientes sintomáticos costumam ter dificuldade de realizar atividades físicas, o que contribui para o sobrepeso. Por outro lado, a obesidade exacerba a dispneia e acarreta perda de funçao pulmonar e piora dos sintomas respiratórios em asmáticos1. Pacientes asmáticos com obesidade muitas vezes constituem um fenótipo particular de asma, que responde menos aos corticosteroides inalados, o que dificulta seu tratamento6,11. Dessa forma, pacientes asmáticos com sobrepeso e obesidade devem ser abordados de forma multidisciplinar objetivando a perda ponderal, que pode ser o principal componente do tratamento. As demais comorbidades também devem ser aventadas através de história clínica e exames complementares e abordadas particularmente visando auxiliar no controle da asma.
Por fim, é imprescindível lembrar que a asma é uma síndrome heterogênea com diversos fenótipos e nao é possível nos dias atuais tratar todos os pacientes de uma mesma forma6. Nao há até o momento nenhuma classificaçao mundialmente aceita sobre quais sao os fenótipos da asma, mas alguns devem ser destacados. Embora nao se conheça a patogênese da chamada asma nao alérgica (ou nao atópica), ela parece ser distinta da clássica asma alérgica (ou atópica), de início na infância, que cursa com outras doenças atópicas e costuma ter melhor evoluçao clínica e resposta ao tratamento19. Pensando especificamente nos tratamentos disponíveis comercialmente, pacientes alérgicos com asma grave podem se beneficiar do uso de anti-IgE e os com asma leve a moderada de imunoterapia alérgeno-específica, o que nao ocorre com os nao atópicos.
Especificamente com relaçao ao mecanismo fisiopatológico envolvido, tem sido considerado altamente relevante classificar o paciente em asmático eosinofílico ou nao eosinofílico, sendo que este último pode ter asma neutrofílica ou até mesmo pauci-celular6. Essa classificaçao se baseia principalmente nos achados da citologia do escarro induzido, procedimento de aplicaçao clínica ainda nao disponível de forma ampla. Em geral considera-se uma inflamaçao eosinofílica a presença de mais de 2 a 3% de eosinófilos no escarro induzido, e uma inflamaçao neutrofilica a presença de mais de 60 a 76% desse tipo celular20. A quantidade de eosinófilos no sangue periférico vem também sendo usada para definir o fenótipo de asma eosinofílica, assim como a fraçao exalada de óxido nítrico (FENO) e a periostina, marcadores de inflamaçao do tipo 2. Estudos inicialmente em animais e, mais recentemente, em humanos têm sugerido o papel de células inatas tipo 2 na induçao e manutençao de inflamaçao eosinofílica independente da resposta Th2 específica para alérgenos21,22. Sabe-se que a inflamaçao eosinofílica de padrao Th2 responde melhor ao tratamento com corticosteroides (sistêmicos ou inalados), assim como os novos anticorpos monoclonais anti-IL-5 e, possivelmente, anti-IL4R e anti-IL-136 podem se tornar uma boa opçao para a asma grave eosinofílica tipo 2, nao relacionada à atopia.
Outro fenótipo que merece atençao especial e abordagem específica é a asma de início tardio no paciente obeso. Esse quadro é mais frequente em mulheres, é predominantemente nao eosinofílico, de má resposta ao tratamento com corticosteroides e evoluçao clínica desfavorável. Mecanismos complexos envolvendo a participaçao de células inatas tipo 3 na inflamaçao nao eosinofílica, assim como efeitos mecânicos da obesidade sobre o aparelho respiratório e modificaçoes epigenéticas associadas à dieta e vitamina D estao em estudo22. Nesses pacientes, a perda ponderal é fundamental para o controle da asma e parece ser ainda mais eficiente do que a perda ponderal no obeso com asma de início precoce6.
Avaliar o encaminhamento do paciente para um centro de referência em asma grave
O paciente com suspeita de asma grave deve ser avaliado por especialista em asma, que comumente se trata de alergista/imunologista, ou pneumologista. O diagnóstico de asma pode ser confirmado pelo generalista, clínico ou pediatra, baseando-se no quadro clínico e na espirometria compatíveis, mas a definiçao da gravidade, dificuldade de controle e o manejo das altas doses de medicaçao devem ser responsabilidade do especialista. Pacientes que necessitam ser tratados até a etapa 3 da GINA podem ser manejados por generalista, mas pacientes na etapa 4 devem ser avaliados por especialista pelo menos em uma ocasiao. Aqueles que nao controlarem a asma na etapa 4 ou estiverem na etapa 5 (associaçao de corticosteroide oral ou omalizumabe) devem ser avaliados e acompanhados por alergista/imunologista ou pneumologista, se possível em centro de referência para tal.
Além disso, pacientes que apresentam quadro clínico atípico (dúvida diagnóstica) ou comorbidades nao controladas também devem ser avaliados por especialista6. Notadamente na ACOS (sobreposiçao asma-DPOC) o acompanhamento deve ser feito por especialista1.
No encaminhamento ao especialista em asma, o generalista deve enviar relatório com seus achados clínicos de história e exame físico mais relevantes para o diagnóstico e a evoluçao do quadro, incluindo as modalidades terapêuticas já usadas, se possível, com doses das medicaçoes. É importante estar registrado no prontuário exatamente quando foi feito o diagnóstico de asma, e quais foram os elementos utilizados para este diagnóstico.
Como exames subsidiários, é fundamental o envio da(s) espirometria(s) que confirma(m) o diagnóstico de asma e afere(m) a gravidade do distúrbio ventilatório. Pacientes que nunca realizaram exame de espirometria nao devem ser diagnosticados como asma e, portanto, devem ter o exame em maos confirmando as alteraçoes que justifiquem o encaminhamento. Radiografia simples de tórax, nas incidências póstero-anterior e perfil, também deve ser encaminhada, pois embora nao auxilie no diagnóstico da asma, ajuda a excluir outras condiçoes respiratórias que possam estar levando a erro diagnóstico.
Alguns exames laboratoriais podem auxiliar a abordagem do especialista na análise das comorbidades e na diferenciaçao dos fenótipos da asma, principalmente entre alérgica e nao alérgica6 (Tabela 4).
OPÇOES TERAPEUTICAS PARA O PACIENTE COM ASMA GRAVE
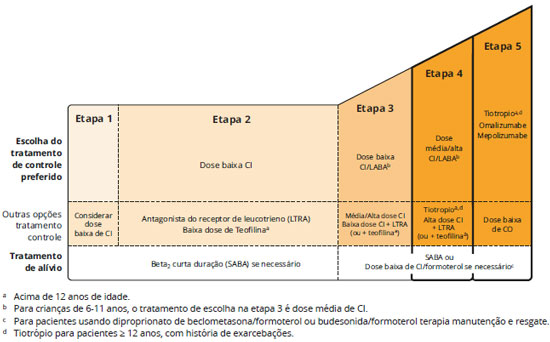
O diagnóstico de asma grave é feito pela falta de controle satisfatório da asma, apesar do tratamento farmacológico com corticosteroide inalado em doses altas associado com outro medicamento de controle (broncodilatador de longa açao - Long Acting Beta-2 Agonist LABA ou antagonista de receptor de leucotrieno). Além desses medicamentos, outras opçoes de tratamento sao disponíveis. Os antimuscarínicos de longa açao (Long Acting Muscarinic Antagonists LAMA) já demonstraram açao superior a do placebo na prevençao de exacerbaçoes e na melhora da funçao pulmonar nesse grupo de pacientes graves20, e sao recomendados pela GINA4 nas etapas 4 e 5 do tratamento, para pacientes com idade igual ou superior a 12 anos.
O anticorpo monoclonal anti-IgE (omalizumabe) faz parte da etapa 5 do tratamento e é recomendado para pacientes sem controle clínico adequado na etapa 4, com idade igual ou superior a 6 anos4. Uma metanálise recente concluiu que o omalizumabe é efetivo na reduçao das exacerbaçoes e hospitalizaçoes em pacientes com asma grave e aumenta a possibilidade de reduçao ou suspensao do corticosteroide inalado23. O uso de outros agentes biológicos é discutido no item Agentes biológicos para o tratamento da asma. Outras opçoes terapêuticas incluem corticosteroide oral em baixas doses (≤ 7,5 mg/dia de prednisona ou equivalente)1, a teofilina de liberaçao lenta6 e a termoplastia brônquica24 (Figura 3).
Estudo de fase 2 publicado recentemente demonstrou melhora de desfechos funcionais e clínicos quando comparou-se o roflumilast, um inibidor seletivo da fosfodiesterase 4 (já liberado para uso em DPOC), associado ao montelucaste adicionados ao corticosteroide inalatório + LABA em comparaçao ao montelucaste puro adicionado ao corticosteroide inalatório + LABA25. Estudos de fase 3 serao necessários para confirmar esses achados em número maior de pacientes.
Quando aumentar a dose do corticosteroide inalado
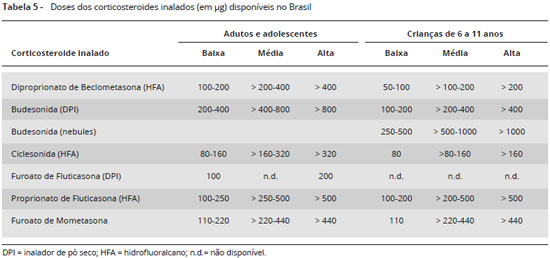
Em linhas gerais, recomenda-se aumentar a dose do corticosteroide inalado até que o controle da asma seja alcançado1. Outros aspectos do tratamento, como adesao, técnica inalatória e controle de comorbidades devem sempre ser considerados. As doses de corticosteroide inalado consideradas altas variam com a idade, com o dispositivo empregado e com a molécula de corticosteroide. Os limites de doses variam entre os consensos. Em adultos, doses superiores a 500 µg de propionato de fluticasona (inalador de pó ou aerossol dosimetrado) sao consideradas elevadas pela GINA1, enquanto doses de 1.000 µg ou superiores sao consideradas elevadas pelo consenso de asma grave da ATS/ERS6. Há grande variabilidade individual na resposta às diferentes doses de corticosteroide inalado e há evidências que alguns pacientes possam se beneficiar de doses superiores às usualmente preconizadas, inclusive com algum efeito poupador de corticosteroide oral6. Nos casos de uso de doses muito elevadas de corticosteroide inalado deve-se monitorizar possíveis efeitos adversos sistêmicos.
Por quanto tempo usar corticosteroide inalado em dose alta
As recomendaçoes gerais do tratamento da asma preconizam reavaliaçao rotineira do esquema de tratamento farmacológico a cada três ou quatro meses6. Doses altas de corticosteroide inalado devem ser empregadas pelo menor tempo necessário e deve-se buscar a menor dose suficiente para manutençao do controle da doença e reduçao do risco de exacerbaçoes4. A possibilidade de eventos adversos sistêmicos aumenta com o uso prolongado de altas doses de corticosteroide inalado, e tais efeitos, como supressao do eixo hipotálamo-hipófise-adrenal, reduçao da velocidade de crescimento (em crianças), estimulaçao da absorçao óssea aumentando o risco de osteopenia/osteoporose, aumento da pressao ocular e desenvolvimento de catarata subcapsular, devem ser monitorados.
É importante salientar que o benefício clínico do aumento da dose do corticosteroide inalatório se dá até determinada dose, a partir da qual atinge-se um platô e aumenta a chance da ocorrência de efeitos colaterais.
Nas últimas atualizaçoes da GINA as doses dos corticosteroides inalados sofreram ajustes, conforme a Tabela 5.
Quando indicar o uso de tiotrópio
O tiotrópio é um antagonista do receptor muscarínico de longa açao (LAMA), recentemente incorporado nas diretrizes de tratamento da Global Initiative for Asthma - GINA 2015 como uma terapia alternativa. Na atualizaçao de 2016 o tiotrópio está indicado para adolescentes com 12 anos de idade ou mais, e adultos nas etapas 4 e 5 do tratamento, com antecedentes de exacerbaçoes1,26 (Figura 3).
Diversos estudos clínicos demostraram a eficácia e segurança do tiotrópio em dose única de 5 µg/dia no tratamento de manutençao de adultos com asma, associado com corticosteroide inalado (CI) ou CI + LABA, com melhora dos sintomas, escores de qualidade de vida, funçao pulmonar (melhora do VEF1 e pico de fluxo expiratório) e exacerbaçoes27-32.
Estudo retrospectivo de vida real no Reino Unido avaliou 2.042 pacientes idosos com asma nao controlada, tratados com LAMA desde 2002, predominantemente como terapêutica adjuvante, particularmente tabagistas ou ex-tabagistas. A adiçao de tiotrópio forneceu uma significativa diminuiçao da incidência de exacerbaçoes e prescriçoes de antibióticos para infecçoes do trato respiratório inferior e um significativo aumento do controle da asma durante o ano seguinte33.
Hamelmann et al. em estudo duplo-cego placebo controlado com adolescentes de 12 a 17 anos, randomizados para receber duas dosagens de tiotrópio, 5 µg (2 puffs de 2,5 µg) ou 2,5 µg (2 puffs de 1,25 µg) uma vez ao dia, ou placebo (2 puffs) observaram melhora significante na funçao pulmonar com boa segurança e tolerância quando adicionado a pelo menos CI no tratamento de manutençao. Respostas melhores foram obtidas com doses de 5 µg34. Estes resultados sao consistentes com estudos previamente publicados de fase II em crianças e adolescentes. É descrita melhora no controle da asma avaliada por meio do ACQ-6 e ACQ-7, sem significância estatística35-37. O tiotrópio tem alto custo em nosso meio e ainda nao está incluído na lista de medicamentos para asma do componente especializado da Assistência Farmacêutica do SUS.
Agentes biológicos para o tratamento da asma
Nas últimas décadas, diversas moléculas bioativas envolvidas na fisiopatologia da asma foram identificadas como potenciais alvos terapêuticos. A avaliaçao desses novos tratamentos identificou vias particulares que, em pacientes selecionados, têm demonstrado benefícios em estudos de fase 2 e 3 no controle da asma, levando à utilizaçao do termo medicina de precisao. A relaçao custo-efetividade é uma consideraçao importante em relaçao à utilizaçao de tratamentos com agentes biológicos na vida real. Decidir o lugar que essas terapias devem ocupar nas diretrizes terapêuticas é fundamental, visto que as mesmas podem requerer análises de biomarcadores para indicaçoes mais precisas38.
Atualmente o omalizumabe (anticorpo monoclonal anti-IgE) e o mepolizumabe (anti-IL5) estao incluídos nas diretrizes da GINA para uso na etapa 5 em pacientes com asma grave eosinofílica alérgica e nao alérgica, respectivamente1. Apenas o primeiro está disponível e aprovado pela Agência Nacional de Vigilância Sanitária (ANVISA) para uso no Brasil, mas ainda nao o foi pela Comissao Nacional de Incorporaçao de Tecnologias no SUS (CONITEC), apesar de ter evidência A na asma grave. Por isso ainda nao está disponível gratuitamente no Sistema Unico de Saúde (SUS).
Agentes biológicos em uso na prática clínica e em investigaçao na asma
Omalizumabe (anti-IgE)
É um anticorpo monoclonal humanizado anti-IgE que se liga à porçao Fc da IgE livre, de forma que previne a ligaçao da IgE ao receptor de alta afinidade para IgE (FcεRI) na membrana de mastócitos e basófilos. Foram descritos alguns mecanismos de açao: sequestro da IgE livre no sangue e de alérgenos ligados a IgE livre pela formaçao de imunocomplexos sem atividade patogênica; desligamento da IgE específica fixada à membrana celular; e reduçao da expressao dos receptores de alta afinidade FcεRI. Foi o primeiro biológico para tratamento da asma aprovado pelo FDA, em 2003. É indicado na etapa 5 da GINA e nas etapas 5 e 6 do NHLBI EPR-3 (National Heart Lung and Blood Insitute -Expert Panel Report 3), para pacientes com idade igual ou superior a 6 anos, com nível de IgE sérica total sérica entre 30 e 1.500 UI/mL. É administrado por via subcutânea, com dose e frequência determinadas a partir do nível basal da IgE sérica total e do peso corpóreo1,39,40.
Estudos clínicos e de vida real demonstraram que o omalizumabe (Xolair®) foi seguro, bem tolerado e eficaz na reduçao de escore de sintomas de asma. Observou-se reduçao no número de exacerbaçoes, visitas a emergência e hospitalizaçoes, menor uso de medicaçao de resgate e melhora na qualidade de vida. Entretanto, a funçao pulmonar nao apresentou melhora significativa41-44. Em seçao adiante serao descritos detalhes de sua indicaçao e forma de uso.
Mepolizumabe (anti-IL5)
Diversos estudos avaliaram a eficácia do mepolizumabe em desordens eosinofílicas e na asma, onde a presença de eosinófilos no sangue e no escarro permanecem apesar do tratamento contínuo com corticosteroide. Na asma, estudos mostraram reduçao do número de exacerbaçoes; da necessidade do uso de corticosteroide oral; reduçao do número de eosinófilos no sangue e escarro e melhora na pontuaçao do questionário de qualidade de vida. No entanto, nao houve efeitos significativos de mepolizumabe sobre os sintomas, no VEF1 após o uso do broncodilatador, ou hiper-responsividade das vias aéreas38,45-47. O mepolizumabe (Nucala®) foi recentemente aprovado pelo FDA para o tratamento de manutençao de pacientes com 12 anos ou mais de idade, com asma grave nao controlada com a terapia atual, apresentando exacerbaçoes graves e que tenham fenótipo eosinofílico. Na atualizaçao da GINA 2016, foi incluído na etapa 5 de tratamento para asma grave1.
Reslizumabe (anti-IL5)
O reslizumabe é um anticorpo monoclonal de IgG4/k humanizado também dirigido contra a IL5, com resultados semelhantes aos descritos com o uso de mepolizumabe, incluindo diminuiçao de eosinófilos no escarro e sangue, bem como melhora no AQLQ. No entanto, ao contrário do mepolizumabe, mostrou melhora no VEF1 e na capacidade vital forçada (CVF). Os resultados da fase 3, com 953 adultos e adolescentes utilizando reslizumabe intravenoso mensalmente, demonstraram diminuiçao significativa na frequência das exacerbaçoes38,48. Recentemente, o reslizumabe (Cinqair®) foi aprovado pelo FDA para o tratamento de manutençao de pacientes com 18 anos ou mais de idade, com asma grave nao controlada com a terapia atual, apresentando exacerbaçoes graves e que tenham fenótipo eosinofílico, mas ainda nao está na diretriz da GINA.
Dupilumabe (anti-IL4/IL13)
O dupilumabe é um anticorpo monoclonal completamente humano contra a subunidade alfa do receptor da IL-4. Bloqueia a sinalizaçao intracelular por IL-4 e IL-13 devido à açao sobre a subunidade alfa do receptor tipo 2, que é ativado pelas duas citocinas. Em pelo menos 50% dos casos, pacientes com asma têm ativaçao de linfócitos Th2 com participaçao de IL-4 e IL-13. Estudos fase 2 demonstraram que o dupilumabe reduziu as exacerbaçoes em 87% se comparado ao grupo placebo, sendo eficaz como monoterapia e quando associado a CI e LABA. Além disso, houve aumento de mais de 200 mL no VEF1 em relaçao ao placebo, melhora nos escores de sintomas e de qualidade de vida e maior eficácia em relaçao aos estudos com lebrikizumabe (anti-IL-13). Os eventos adversos foram similares ao grupo placebo38,49.
Lebrikizumabe (anti-IL13)
Estudos placebo controlados demonstraram melhora nos valores de VEF1 de 5,5% nos pacientes em uso de CI associado a lebrikizumabe na dose de 250 mg mensal subcutâneo, quando comparados ao grupo placebo. A periostina, que é gerada por açao da IL-13 em células epiteliais e fibroblastos nos pulmoes, foi um biomarcador útil para identificar os pacientes que pertencem ao fenótipo T2/Th2 e preditiva de um possível benefício do uso de anti-IL-13 como terapia adicional38,50.
Resultados de 2 estudos multicêntricos de fase 3 foram recentemente publicados51. No 1° estudo (LAVOLTA I) o tratamento reduziu significativamente a taxa de exacerbaçoes de asma em pessoas com níveis mais elevados de periostina no soro ou maior número eosinófilos no sangue. Houve também uma melhora significativa da funçao pulmonar (avaliada pelo VEF1 basal) nos pacientes com esses biomarcadores aumentados. No entanto, os efeitos observados foram inferiores aos reportados anteriormente em estudos de fase 2. No estudo LAVOLTA II, obteve-se significância estatística apenas na reduçao do uso de medicaçao de resgate nos grupos com biomarcadores elevados. Nao houve reduçao de exacerbaçoes e nem melhora funcional mesmo nos grupos com periostina ou eosinófilos aumentados. A média de dose de CI dos participantes do primeiro estudo era um pouco menor que os do segundo estudo, o que pode ter permitido um efeito clinico adicional significativo do lebrikizumabe, nao alcançado no segundo estudo.
Benralizumabe (anti-IL5R)
Anticorpo monoclonal dirigido contra a cadeia α do receptor de IL-5, benralizumabe é único no sentido de que nao só bloqueia o efeito da IL5 em eosinófilos, mas de fato ocasiona morte de eosinófilos, por meio de citotoxicidade mediada por células52. Estudo clínico na fase 1 comprovou reduçao da contagem de eosinófilos no sangue, na medula óssea e nas vias respiratórias, e na fase 2, reduçao do número e gravidade de exacerbaçoes. Atualmente pacientes com asma grave sao recrutados para estudo de fase 338,53.
Altrakincept (anti-IL4)
É um análogo recombinante humano solúvel do receptor da IL-4 (IL4R) que consiste na porçao extracelular da cadeia α do receptor de IL4, que bloqueia a ligaçao da IL-4 a receptores de membrana. Nos primeiros estudos clínicos, altrakincept demostrou boa segurança e tolerabilidade. Quando estudado em pacientes com asma moderada, manteve a funçao pulmonar após a retirada do CI38.
Quilizumabe (anti-M1)
É um anticorpo monoclonal IgG1 humanizado anti segmento M1-prime, presente apenas na IgE de membrana. Em dois estudos clínicos de fase 2, o tratamento foi bem tolerado e houve reduçao nos níveis de IgE sérica total e específica. É possível que seja uma alternativa para pacientes com IgE sérica basal acima do valor indicado para uso de omalizumabe. Quando comparado ao grupo placebo, os pacientes em uso de quilizumabe apresentaram reduçao de 50% no número de eosinófilos no escarro, e de 20% nos eosinófilos séricos54.
Entretanto, ensaio clínico comparando 3 doses de quilizumabe com placebo em 578 pacientes adultos com asma grave demonstrou apenas reduçao dos níveis séricos de IgE total e específica, sem reduçao significativa de sintomas e exacerbaçoes, assim como nao houve melhora do VEF155.
TERAPIA ANTI-IGE
O tratamento atual para asma, sugerido pela Global Initiative for Asthma (GINA), inclui medicamentos de alívio e de manutençao, em particular corticosteroides, que reduzem o recrutamento e ativaçao de células inflamatórias. Os tratamentos disponíveis sao efetivos na maioria dos pacientes com asma. Entretanto, existem pacientes que continuam sintomáticos, uma vez que a broncoconstricçao e inflamaçao brônquica nao sao completamente controladas com o uso de corticosteroide inalatório ou sistêmico, associados a outras drogas como beta-2 agonistas de longa duraçao e antileucotrienos, por exemplo. A maior gravidade da asma nesses pacientes, associada ao nao controle da doença, reflete-se nao só no aumento da morbidade e mortalidade, mas também nos custos econômicos e sociais1.
Nesse contexto, a terapia anti-IgE com omalizumabe (Xolar®) está incluída na etapa 5 de tratamento da GINA, para pacientes com diagnóstico de asma alérgica nao controlada na etapa 4 do tratamento e deve ser considerada em pacientes que preencham todos os critérios abaixo1,56:
- Crianças > 6 anos e adultos.
- Diagnóstico confirmado de asma.
- Asma nao controlada na etapa 4 de tratamento da GINA1: Paciente em uso de dose média ou alta de corticosteroide inalatório, associado a beta-2 agonista de longa açao (LABA), ou a outros fármacos como por exemplo antileucotrieno, tiotrópio ou teofilina de açao prolongada. Estes fármacos podem ser também utilizados como terceira droga controladora, em associaçao a corticosteroide inalatório + LABA. Corticosteroide oral é etapa 5, juntamente com omalizumabe.
- Nível de IgE sérica total entre 30 a 1.500 UI/mL.
- Sensibilizaçao alérgica comprovada por teste cutâneo e/ou dosagem de IgE específica para pelo menos um alérgeno inalatório.
- Peso corpóreo entre 20 e 150 kg.
Estudos sugerem que o omalizumabe pode ser eficaz também na aspergilose broncopulmonar alérgica57, em casos de asma nao alérgica e de asma ocupacional grave, mas nao está licenciado para uso nestas condiçoes. Recomendaçao formal para uso nestes casos nao consta em bula (uso off-label)58-60. A Figura 4 resume graficamente os passos para seleçao de pacientes candidatos à terapia anti-IgE.
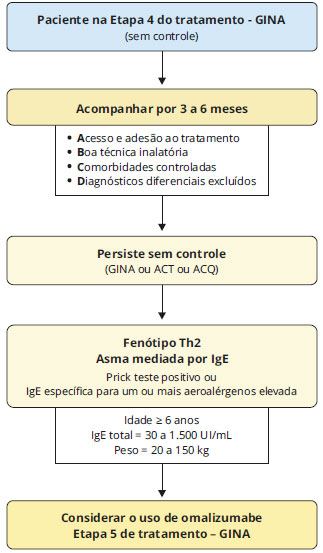
Figura 4 - Fluxograma para seleçao de pacientes candidatos ao uso de omalizumabe
Cálculo da dose de omalizumabe
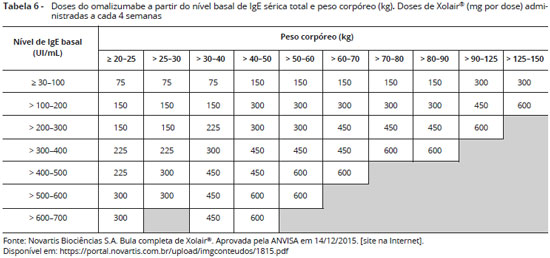
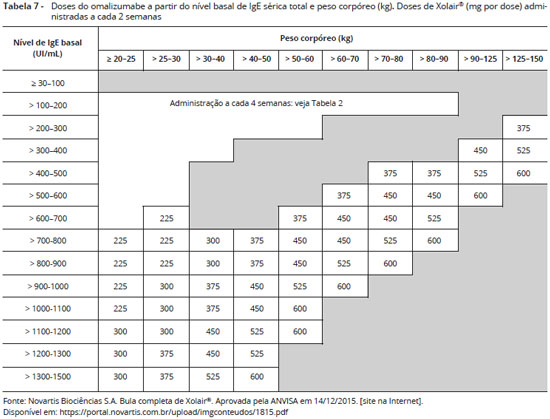
A dose e frequência apropriadas de omalizumabe sao calculadas a partir do nível basal de IgE sérica total (medido antes do início do tratamento) e pelo peso corpóreo (Kg) do paciente (0,016 mg/kg por UI/mL de IgE sérica total por mês). Baseado nestes parâmetros, 75 a 600 mg de omalizumabe podem ser necessárias em cada administraçao. Cada frasco ampola contém 150 mg de omalizumabe e podem ser necessárias de 1 a 4 ampolas, aplicadas em 1 a 4 injeçoes por via subcutânea, a cada 2 a 4 semanas (Tabelas 6 e 7). Pacientes com níveis de IgE sérica total ou peso corpóreo fora dos limites da tabela nao devem receber a medicaçao56.
O reteste do nível de IgE sérica total sérica durante o tratamento nao deve ser usado como um guia de determinaçao da dose, já que o mesmo permanece elevado pois o clearance dos complexos omalizumabe-IgE é mais lento do que o da IgE livre61,62. A determinaçao da dose após interrupçoes no tratamento menores do que 1 ano deve se basear nos níveis de IgE sérica total aferidos no início do tratamento. Se a interrrupçao for superior a 1 ano, o nível de IgE total deve ser reavaliado. Reajuste na dose prescrita está indicado quando ocorrem alteraçoes significativas no peso corpóreo (> 10%)56,62.
Como e quando avaliar a resposta à terapia anti-IgE
A melhora clínica em pacientes asmáticos tratados com omalizumabe pode tornar-se evidente somente após 12 semanas de tratamento, sendo este o tempo mínimo necessário para qualquer avaliaçao. Desta forma, recomenda-se que a avaliaçao da resposta à terapia seja feita 16 semanas após o início do tratamento, já que a análise de dados clínicos demostra um platô nos resultados de eficácia entre 12-16 semanas62.
Diversos estudos clínicos demostraram que o omalizumabe é capaz de reduzir os sintomas relacionados à asma, diminuir a necessidade de uso de corticosteroide e melhorar a qualidade de vida dos pacientes asmáticos63-66. A resposta à terapia deve ser avaliada primariamente baseando-se na reduçao das exacerbaçoes de asma. Reduçao dos sintomas da doença, do uso de medicaçao de resgate, do número de idas à emergência e de hospitalizaçoes e melhora dos escores clínicos de qualidade de vida sao parâmetros importantes na avaliaçao da resposta ao uso de omalizumabe62.
Bousquet et al. demonstraram que a avaliaçao da resposta ao omalizumabe com 16 semanas de terapia, por meio da utilizaçao de critérios clínicos da Global Evaluation of Treatment Effectiveness (GETE), constitui-se em um preditor eficaz de continuidade de resposta ao omalizumabe na maioria dos pacientes. A GETE é uma medida composta por múltiplos aspectos da avaliaçao clinica de um indivíduo com asma, incluindo entrevista com o paciente, revisao de prontuário, espirometria, diário de sintomas, uso de medicaçao de resgate e medida do pico de fluxo expiratório. Nesse mesmo estudo, os autores observaram que um percentual de pacientes apresentou resposta ao tratamento entre 16 e 32 semanas, o que sugere que alguns pacientes podem ser respondedores tardios67.
Até o momento, nao foram estabelecidos critérios para identificar pacientes que responderao ao omalizumabe baseando-se em características pré tratamento. Níveis elevados de alguns biomarcadores como periostina sérica, óxido nítrico exalado e eosinofilia periférica foram relacionados com uma melhor resposta ao omalizumabe. Entretanto, sao exames inespecíficos e, com exceçao dos eosinófilos sanguíneos, inacessíveis na prática diária. Eosinofilia acima de 300 cels/µL foi relacionada a melhor resposta ao uso de omalizumabe68.
Dados preliminares sugerem que o tratamento com omalizumabe seria mais efetivo em pacientes com nível de IgE sérica total baixo e relativa alta proporçao de IgE específica para aeroalérgenos. Entretanto, nem o nível de IgE sérica total ou de IgE específica podem ser considerados preditivos de resposta ao tratamento69-71.
É importante destacar que pacientes com características que sugerem maior gravidade da asma parecem se beneficiar de forma mais expressiva da adiçao do omalizumabe ao seu regime terapêutico. Estas características incluem: história de ida a emergência no último ano, utilizaçao de altas doses de corticoterapia inalatória (acima de 800 ug de beclometasona ou equivalente) e VEF1 menor ou igual a 65% do valor predito. Os maiores benefícios foram observados em pacientes que apresentavam duas ou mais destas características67.
Medidas objetivas obtidas por meio da avaliaçao do pico de fluxo expiratório (PFE) e do volume expiratório forcado no 1° segundo (VEF1) de forma seriada podem ser utilizadas. Entretanto, devemos atentar para o fato de que a melhora destes parâmetros em pacientes usando omalizumabe costuma ser pequena, apesar de significativa62.
Thomson et al. desenvolveram um algoritmo para avaliaçao de resposta ao uso de omalizumabe que considera como principais indicadores de resposta um aumento na pontuaçao no ACT em pelo menos 2 pontos ou aumento de pelo menos 0,5 ponto no Mini-AQLQ (Mini-Asthma Quality Life Questionary), associados a GETE excelente ou boa. O número de exacerbaçoes, hospitalizaçoes e medida de pico de fluxo foram consideradas como indicadores complementares de resposta72.
Em uma casuística brasileira, os pacientes respondedores apresentaram aumento significativo na pontuaçao do ACT entre o início do tratamento (12,4) e as 16ª e 32ª semanas (15,7 e 17,9 respectivamente) e aumento na média do VEF1 (% previsto) de 37,5% no início do tratamento para 44% na 16ª semana73.
Recomenda-se que no início do tratamento e nas avaliaçoes subsequentes, sejam registrados o máximo de dados que contribuem de forma objetiva, ao longo do tempo, para avaliaçao da resposta à terapia com omalizumabe:
- Número de exacerbaçoes (tratadas em domicílio, idas a emergência ou hospitalizaçoes);
- Frequência de uso de beta-2 de curta açao para resgate;
- Dose de corticosteroide inalado e/ou oral;
- Estado de controle da asma segundo a GINA e/ou pontuaçao no ACT;
- VEF1 ou PFE;
- Pontuaçao no Questionário de Qualidade de Vida (Mini-AQLQ).
Identificar os pacientes respondedores à terapia com omalizumabe é crucial do ponto de vista clínico e econômico. A taxa de resposta à terapia em estudos pivotais e de vida real variou de 53 a 89.1%74-77. Nesses estudos, os desfechos utilizados para avaliaçao de resposta foram o número de exacerbaçoes clinicamente significantes, a Avaliaçao Global da Efetividade do Tratamento (GETE), uso de corticoterapia sistêmica, uso de medicaçao de resgate, avaliaçao do Controle da Asma por meio do ACT, dose de corticosteroide inalatório e avaliaçao da qualidade de vida.
Omalizumabe como tratamento de manutençao na asma
O omalizumabe é utilizado como terapia adjuvante a longo prazo e o tempo de tratamento e critérios para descontinuaçao baseados em evidências, ainda nao estao estabelecidos.
Molimard et al. avaliaram dados de crianças e adultos que descontinuaram o uso de omalizumabe e observaram que 55,7% perderam o controle da asma em um tempo médio de 13 meses após interrupçao do tratamento64. Outros autores observaram que após suspensao de tratamento de 6 anos de duraçao, a asma permaneceu estável ou melhorou nos 3 anos seguintes em 12 de 18 pacientes78. Após interrupçao da terapia o nível de IgE livre e a resposta dos testes cutâneos retornam gradualmente aos valores basais79.
Eventos adversos com o uso de omalizumabe
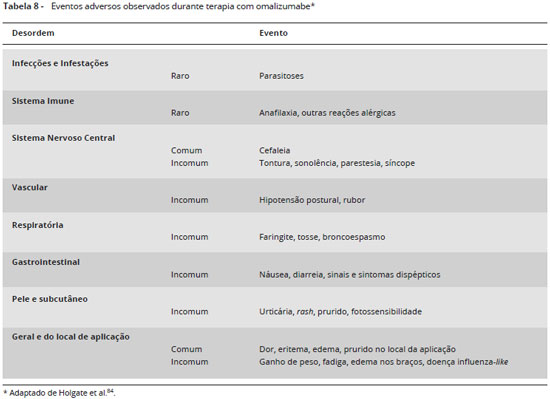
A terapia com omalizumabe mostrou-se segura a curto e longo prazo em diferentes estudos clínicos e de vida real, com ocorrência de eventos adversos semelhante aos grupos placebo76,80,81. A maioria dos eventos adversos relatados foram de intensidade leve a moderada e de curta duraçao e ocorreram em 6,7% a 55,6% dos pacientes82,83. Os eventos adversos mais comuns foram cefaleia e reaçao no local da aplicaçao84 (Tabela 8).
A incidência de anafilaxia nos estudos clínicos foi de 0,14% nos pacientes tratados com omalizumabe, e de 0,07% no grupo placebo80. A maioria, 61% dos episódios de anafilaxia, ocorreu até duas horas após a administraçao do omalizumabe, e em 68% dos casos nas 3 primeiras doses85,86. Recomenda-se, entao, que o paciente permaneça em observaçao por duas horas após as primeiras 3 aplicaçoes e por 30 minutos nas aplicaçoes subsequentes. O paciente deve receber orientaçoes sobre a possibilidade de ocorrência de reaçao anafilática tardia e o procedimento a ser adotado84,87. As aplicaçoes devem ser realizadas em ambiente hospitalar, com medicamentos e equipamentos de urgência disponíveis para atender eventuais eventos adversos graves.
As recomendaçoes da Academia Americana de Alergia e Imunologia e do Colégio Americano de Alergia e Imunologia para aplicaçao de omalizumabe sao87:
- Obter consentimento informado do paciente apresentando os riscos e benefícios do tratamento;
- Orientar o paciente quanto a sinais e sintomas de anafilaxia;
- Verificar sinais vitais e PFE ou VEF1 antes das aplicaçoes;
- Manter observaçao após aplicaçao por 2 horas nas 3 primeiras aplicaçoes, e 30 minutos nas subsequentes.
Em uma análise de 67 estudos clínicos incluindo 11.459 pacientes dos quais 7.789 em uso de omalizumabe, nenhuma associaçao foi observada entre risco de malignidade e tratamento com omalizumabe88.
A ocorrência de eventos cardiovasculares e cerebrovasculares incluindo infarto, angina instável, ataque isquêmico transitório e acidente vascular encefálico em pacientes em uso omalizumabe foram objeto de investigaçao e diferentes análises de estudos clínicos confirmaram que o uso de omalizumabe nao predispoem a risco aumentado de eventos tromboarteriais89.
O risco de desenvolver infestaçao por helmintos também foi objeto de estudo e os pacientes em uso de omalizumabe apresentaram uma maior tendência a apresentar helmintíase, mas a diferença nao foi significante quando comparada ao grupo placebo90. Mesmo assim, recomenda-se cautela em pacientes com alto risco de infecçoes por helmintos em particular residentes ou em viajem para áreas endêmicas. Consideramos aconselhável, em áreas de alta prevalência, a avaliaçao de parasitoses antes do início do tratamento e periodicamente durante o mesmo.
Existem poucos estudos sobre a segurança do uso de omalizumabe na gestaçao e amamentaçao. Um estudo observacional com 27 mulheres grávidas que usaram omalizumabe antes ou durante a gravidez nao encontrou diferença significante nos desfechos desfavoráveis quando comparado às taxas de ocorrência dos eventos na populaçao geral86. Omalizumabe pertence à categoria de risco B na gravidez, e nao está licenciado para uso na gestaçao e amamentaçao, sendo o uso off-label nestas condiçoes.
CONSIDERAÇOES FINAIS
A avaliaçao adequada da gravidade da asma e do nao controle da doença com a terapia padrao nas etapas 4 e 5 da GINA, além da avaliaçao correta do nível de aderência ao tratamento e ao controle do ambiente, assim como a identificaçao dos principais fenótipos e comorbidades que impactam o seu controle sao as premissas fundamentais para a correta abordagem da asma grave. A terapia com imunobiológicos focada em alvos específicos, de acordo com o fenótipo e/ou endótipo da doença, já em prática com o omalizumabe para asma alérgica grave e aprovada recentemente com mepolizumabe para asma eosinofílica, representa uma nova e grande janela de oportunidade para a abordagem dos casos mais desafiadores da doença.
Inúmeros estudos com diferentes imunobiológicos para distintos alvos envolvidos na imunopatologia da asma estao em andamento, o que promete novas e mais eficazes opçoes terapêuticas para essa complexa enfermidade chamada asma.
REFERENCIAS
1. GINA Report, Global strategy for Asthma management and prevention. [site na Internet]. Disponível: http://www.ginasthma.org/local/uploads/files/GINA_Report_2016_Aug11.pdf. Acesso em 25/08/2016.
2. Bel EH, Sousa A, Fleming L, Bush A, Chung KF, Versnel J, et al. Diagnosis and definition of severe refractory asthma: an international consensus statement from the Innovative Medicine Initiative (IMI). Thorax. 2011;66:910-7.
3. Chanez P, Wenzel SE, Anderson GP, Anto JM, Bel EH, Boulet LP, et al. Severe asthma in adults: what are the important questions? J Allergy Clin Immunol. 2007;119:1337-48.
4. Bateman ED, Hurd SS, Barnes PJ, Bousquet J, Drazen JM, FitzGerald M, et al. Global strategy for asthma management and prevention: GINA executive summary. Eur Respir J. 2008;31:143-78.
5. Bousquet J, Mantzouranis E, Cruz AA, Aït-Khaled N, Baena-Cagnani CE, Bleecker ER, et al. Uniform definition of asthma severity, control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma. J Allergy Clin Immunol. 2010;126:926-38.
6. Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014;43:343-73.
7. Latin-American Consensus on Difficult-to-Control Asthma. 2008 Update. Drugs Today (Barc). 2008;44 Suppl 3:1-43.
8. Giavina-Bianchi P, Aun MV, Bisaccioni C, Agondi R, Kalil J. Difficult-to-control asthma management through the use of a specific protocol. Clinics (Sao Paulo). 2010;65(9):905-18.
9. Pinto LH, Aun MV, Cukier-Blaj S, Stelmach R, Cukier A, Kalil J, et al. Vocal cord dysfunction diagnosis may be improved by a screening check list. Allergol Int. 2015 Dec 13. pii:S1323-8930(15)00206-3. doi: 10.1016/j.alit.2015.11.001. [Epub ahead of print])
10. Haldar P, Pavord ID, Shaw DE, Berry MA, Thomas M, Brightling CE, et al. Cluster analysis and clinical asthma phenotypes. Am J Respir Crit Care Med. 2008;178(3):218-24.
11. Moore WC, Meyers DA, Wenzel SE, et al. Identification of asthma phenotypes using cluster analysis in the severe asthma research program. Am J Respir Crit Care Med. 2010;181:315-23.
12. Charriot J, Vachier I, Halimi L, Gamez AS, Boissin C, Salama M, et al. Future treatment for asthma. Eur Respir Rev. 2016;25(139):77-92.
13. Robinson DS, Campbell DA, Durham SR, Pfeffer J, Barnes PJ, Chung KF, et al. Systematic assessment of difficult-to-treat asthma. Eur Respir J. 2003;22:478-83.
14. Bracken M, Fleming L, Hall P, Van Stiphout N, Bossley C, Biggart E, et al. The importance of nurse-led home visits in the assessment of children with problematic asthma. Arch Dis Child. 2009;94:780-4.
15. Al-Jahdali H, Ahmed A, Al-Harbi A, Khan M, Baharoon S, Bin Salih S, et al. Improper inhaler technique is associated with poor asthma control and frequent emergency department visits. Allergy Asthma Clin Immunol. 2013;9(1):8.
16. Bisaccioni C, Aun MV, Cajuela E, Kalil J, Agondi RC, Giavina-Bianchi P. Comorbidities in severe asthma: frequency of rhinitis, nasal polyposis, gastroesophageal reflux disease, vocal cord dysfunction and bronchiectasis. Clinics (Sao Paulo). 2009;64(8):769-73.
17. Bousquet J, Khaltaev N, Cruz AA, Denburg J, Fokkens WJ, Togias A, et al. Allergic rhinitis and its impact on asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008;63:8-160.
18. Agondi RC, Machado ML, Kalil J, Giavina-Bianchi P. Intranasal Corticosteroid Administration Reduces Nonspecific Bronchial Hyperresponsiveness and Improves Asthma Symptoms. J Asthma. 2008;45(9):754-7.
19. Giavina-Bianchi P. Defining phenotypes in rhinitis: a step toward personalized medicine. J Allergy Clin Immunol. 2015;135(1):151-2.
20. Chung KF. Asthma phenotyping: a necessity for improved therapeutic precision and new targeted therapies. Journal of Internal Medicine. 2016,279:192-204.
21. Van Rijt L, Von Richthofen H, Van Ree R. Type 2 innate lymphoid cells: at the cross-roads in allergic asthma. Semin Immunopathol. 2016;38:483-96.
22. Ozyigt LP, Morita H, Akdis M. Innate lymphocyte cells in asthma phenotypes. Clinical and Translational Allergy. 2015;5:23-30.
23. Normansell R, Walker S, Milan S, Walters E, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014;13(1):CD003559. doi: 10.1002/14651858.CD003559.
24. Castro M, Rubin A, Laviolette M, Fiterman J, Lima M, Shah P, et al. Effectiveness and safety of bronchial thermoplasty in the treatment of severe asthma. Am J Respir Crit Care Med. 2010;181:116-24.
25. Bateman E, Goehring U, Richard F, Watz H. Roflumilast combined with montelukast versus montelukast alone as add-on treatment in patients with moderate-to-severe asthma. J Allergy Clin Immunol. 2016;138:142-9.
26. Reddel HK, Bateman ED, Becker A, Boulet LP, Cruz AA, Drazen JM, et al. A summary of the new GINA strategy: a roadmap to asthma control. Eur Respir J. 2015;46(3):622-39.
27. Kerstjens H, Engel M, Dahl R, Paggiaro P, Beck E, Vandewalker M, et al. Tiotropium in asthma poorly controlled with standard combination terapy. N Engl J Med. 2012;367:1198-207.
28. Rodrigo GJ, Castro-Rodríguez JA. What is the role of tiotropium in asthma? a systematic review with meta-analysis. Chest. 2015b;147(2):388-96.
29. Busse WW, Dahl R, Jenkins C, Cruz AA. Long-acting muscarinic antagonists: a potential add-on therapy in the treatment of asthma? Eur Respir Rev. 2016;25(139):54-64.
30. Kerstjens HA, Casale TB, Bleecker ER, Meltzer EO, Pizzichini E, Schmidt O et al. Tiotropium or salmeterol as add-on therapy to inhaled corticosteroids for patients with moderate symptomatic asthma: two replicate, double-blind, placebo-controlled, parallel-group, active-comparator, randomised trials. Lancet Respir Med. 2015;3(5):367-76.
31. Mcivor RA. Emerging therapeutic options for the treatment of patients with symptomatic asthma. Ann Allergy Asthma Immunol. 2015;115(4):265-71.
32. Paggiaro P, Halpin DM, Buhl R, Engel M, Zubek VB, Blahova Z, et al. The Effect of Tiotropium in Symptomatic Asthma Despite Low- to Medium-Dose Inhaled Corticosteroids: A Randomized Controlled Trial. J Allergy Clin Immunol Pract. 2016;4(1):104-13.
33. Price D, Kaplan A, Jones R, Freeman D, Burden A, Gould S, et al. Long-acting muscarinic antagonist use in adults with asthma: real-life prescribing and outcomes of add-on therapy with tiotropium bromide. J Asthma Allergy. 2015;8:1-13.
34. Hamelmann E, Bateman ED, Vogelberg C, Szefler SJ, Vandewalker M, Moroni-Zentgraf P, et al. Tiotropium add-on therapy in adolescents with moderate asthma: A 1-year randomized controlled trial. J Allergy Clin Immunol. 2016;138(2):441-50.
35. Anderson WC, Szefler SJ. New and future strategies to improve asthma control in children. J Allergy Clin Immunol. 2015;136(4):848-59.
36. Rodrigo GJ, Castro-Rodríguez JA. Tiotropium for the treatment of adolescents with moderate to severe symptomatic asthma: a systematic review with meta-analysis. Ann Allergy Asthma Immunol. 2015a;115(3):211-6.
37. Vogelberg C, Engel M, Moroni-Zentgraf P, Leonaviciute-Klimantaviciene M, Sigmund R, Downie J, et al. Tiotropium in asthmatic adolescents symptomatic despite inhaled corticosteroids: a randomised dose-ranging study. Respir Med. 2014;108(9):1268-76.
38. Darveaux J, Busse WW. Biologics in asthma--the next step toward personalized treatment. J Allergy Clin Immunol Pract. 2015;3(2):152-60.
39. Caminati M, Senna G, Guerriero M, Dama AR, Chieco-Bianchi F, Stefanizzi G, et al. Omalizumab for severe allergic asthma in clinical trials and real-life studies: what we know and what we should address. Pulm Pharmacol Ther. 2015;31:28-35.
40. Humbert M, Busse W, Hanania NA, Lowe PJ, Canvin J, Erpenbeck VJ, et al. Omalizumab in asthma: an update on recent developments. J Allergy Clin Immunol Pract. 2014;2(5):525-36.
41. Abraham I, Alhossan A, Lee CS, Kutbi H, MacDonald K. "Real-life" effectiveness studies of omalizumab in adult patients with severe allergic asthma: systematic review. Allergy. 2015;71(5):593-610.
42. Hendeles L, Khan YR, Shuster JJ, Chesrown SE, Abu-Hasan M. Omalizumab therapy for asthma patients with poor adherence to inhaled corticosteroid therapy. Ann Allergy Asthma Immunol. 2015;114(1):58-62.
43. D'Amato G, Stanziola A, Sanduzzi A, Liccardi G, Salzillo A, Vitale C, et al. Treating severe allergic asthma with anti-IgE monoclonal antibody (omalizumab): a review. Multidisciplinary Respiratory Medicine. 2014;9:23-8.
44. Caminati M, Senna G, Guerriero M, Dama AR, Chieco-Bianchi F, Stefanizzi G, et al. Omalizumab for severe allergic asthma in clinical trials and real-life studies: what we know and what we should address. Pulm Pharmacol Ther. 2015;31:28-35.
45. Ortega H, Chupp G, Bardin P, Bourdin A, Garcia G, Hartley B, et al. The role of mepolizumab in atopic and nonatopic severe asthma with persistent eosinophilia. Eur Respir J. 2014;44(1):239-41.
46. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371(13):1198-207.
47. Haldar P, Brightling CE, Singapuri A, Hargadon B, Gupta S, Monteiro W, et al. Outcomes after cessation of mepolizumab therapy in severe eosinophilic asthma: a 12-month follow-up analysis. J Allergy Clin Immunol. 2014;133(3):921-3.
48. Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med. 2015;3(5):355-66.
49. Wenzel SE, Wang L, Pirozzi G. Dupilumab in persistent asthma. N Engl J Med. 2013;369(13):1275-6.
50. Corren J, Lemanske RF, Hanania NA, Korenblat PE, Parsey MV, Arron JR, et al. Lebrikizumab treatment in adults with asthma. N Engl J Med. 2011;365(12):1088-98.
51. Hanania NA, Korenblat P, Chapman KR, BAteman ED, Kopecky P, Paggiaro P, et al. Efficacy and safety of lebrikizumab in patients with uncontrolled asthma (LAVOLTA I and LAVOLTA II): replicate, phase 3, randomised, double-blind, placebo-controlled trials. The Lancet Respiratory Medicine. 2016;4(10):781-96.
52. Ghazi A, Trikha A, Calhoun WJ. Benralizumab-a humanized mAb to IL-5Rα with enhanced antibody-dependent cell-mediated cytotoxicity--a novel approach for the treatment of asthma. Expert Opin Biol Ther. 2012;12(1):113-8.
53. Nowak RM, Parker JM, Silverman RA, Rowe BH, Smithline H, Khan F et al. A randomized trial of benralizumab, an anti-interleukin 5 receptor α monoclonal antibody, after acute asthma. Am J Emerg Med. 2015;33(1):14-20.
54. Gauvreau GM, Harris JM, Boulet LP, Scheerens H, Fitzgerald JM, Putnam WS, et al. Targeting membrane-expressed IgE B cell receptor with an antibody to the M1 prime epitope reduces IgE production. Sci Transl Med. 2014;6(243):243ra85.
55. Harris J, Maciuca R, Bradley MS, Cabanski CR, Scheerens H, Lim J, et al. A randomized trial of the efficacy and safety of quilizumab in adults with inadequately controlled allergic asthma. Respir Research. 2016;17:29-39.
56. Novartis Biociências S.A. Bula completa de Xolair®. Aprovada pela ANVISA em 14/12/2015. [site na Internet] Disponível em: https://portal.novartis.com.br/upload/imgconteudos/1815.pdf. Acesso em 05/10/2016.
57. Voskamp AL, Gillman A, Symons K, Sandrini A, Rolland JM, O'Hehir RE, et al. Clinical efficacy and immunologic effects of omalizumab in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2015;3(2):192-9.
58. Lavaud F, Bonniaud P, Dalphin JC, Leroyer C, Muller D, Tannous R, et al. Usefulness of omalizumab in ten patients with severe occupational asthma. Allergy. 2013;68(6):813-15.
59. Domingo C, Pomares X, Angril N, Rudi N, Amengual MJ, Mirapeix RM. Effectiveness of omalizumab in non allergic severe asthma. J Biol Regul Homeost Agents. 2013;27(1):45-53.
60. Holgate ST. New strategies with anti-IgE in allergic diseases. World Allergy Organization Journal. 2014;7:17-22.
61. Lowe PJ, Tannenbaum S, Gautier A, Jimenez P. Relationship between omalizumab pharmacokinetics, IgE pharmacodynamics and symptoms in patients with severe persistent allergic (IgE-mediated) asthma. Br J Clin Pharmacol. 2009;68(1):61-76.
62. Holgate ST. How to evaluate a patient's response to anti-IgE. Eur Respir Rev. 2007;16:78-84.
63. Barnes N, Menzies-Gow A, Mansur AH, Spencer D, Percival F, Radwan A, Niven R. Effectiveness of omalizumab in severe allergic asthma: a retrospective UK real-world study. J Asthma. 2013;50(5):529-36.
64. Molimard M, Buhl R, Niven R, Le Gros V, Thielen A, Thirlwell J, et al. Omalizumab reduces oral corticosteroid use in patients with severe allergic asthma: real-life data. Respir Med. 2010;104(9):1381-5.
65. Rubin AS, Souza-Machado A, Andradre-Lima M, Ferreira F, Honda A, Matozo TM, QUALITX Study Investigators. Effect of omalizumab as add-on therapy on asthma-related quality of life in severe allergic asthma: a Brazilian study (QUALITX). J Asthma. 2012;49:288-93.
66. Bousquet J, Siergiejko Z, Swiebocka E, Humbert M, Rabe KF, Smith N, et al. Persistency of response to omalizumab therapy in severe allergic (IgE-mediated) asthma. Allergy. 2011; 66:671-78.
67. Bousquet J, Wenzel S, Holgate S, Lumry W, Freeman P, Fox H. Predicting response to omalizumab, an anti-IgE antibody, in patients with allergic asthma. Chest. 2004;125:1378-86.
68. Busse W, Spector S, Rosén K, Wang Y, Alpan O. High eosinophil count: a potential biomarker for assessing successful omalizumab treatment effects. J Allergy Clin Immunol. 2013;132(2):485-6.e11.
69. Johansson SGO, Nopp A, Oman H, Ankerst J, Cardell LO, Gronneberg R, et al. The size of the disease relevant IgE antibody fraction in relation to 'total-IgE' predicts the efficacy of anti-IgE (Xolair) treatment. Allergy 2009;64:1472-7.
70. Ankerst J, Nopp A, Johansson SG, Adédoyin J, Oman H. Xolair is effective in allergics with a low serum IgE level. Int Arch Allergy Immunol. 2010;152(1):71-4.
71. Wahn U, Martin C, Freeman P, Blogg M, Jimenez P. Relationship between pretreatment specific IgE and the response to omalizumab therapy. Allergy. 2009;64:1780-7.
72. Thomson N, Niven R, Heaney L, Greening A. Development of an algorithm for the assessment of response to treatment with omalizumab. Thorax. 2007;62(Suppl. 3):A99,P94.
73. Serpa FS, Piana MP, Neto FB, Campinhos FL, Silveira MG, Chiabai J, et al. Eficácia da terapia Anti-IgE no controle da asma. Braz J Allergy Immunol. 2014;2(4):147-53.
74. Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Cioppa GD, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001;108:184-90.
75. Humbert M, Beasley R, Ayres J, Slavin R, Hebert J, Bousquet J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy. 2005;60:309-16.
76. Braunstahl GJ, Chen CW, Maykut R, Georgiou P, Peachey G, Bruce J. The eXpeRience registry: the 'real-world' effectiveness of omalizumab in allergic asthma. Respir Med. 2013;107(8):1141-51.
77. Niven R, Radwan A. APEX Study Investigators. The APEX study: a retrospective review of responses of severe allergic asthma patients to omalizumab on continuous or non-continuous oral corticosteroids in UK clinical practice. Eur Respir J. 2011;38(Suppl. 55):272 [abstract].
78. Nopp A, Johansson SG, Adédoyin J, Ankerst J, Palmqvist M, Oman H. After 6 years with Xolair; a 3-year withdrawal follow-up. Allergy. 2010;65(1):56-60.
79. Corren J, Shapiro G, Reimann J, Deniz Y, Wong D, Adelman D, et al. Allergen skin tests and free IgE levels during reduction and cessation of omalizumab therapy. J Allergy Clin Immunol. 2008;121(2):506-11.
80. Corren J, Casale TB, Lanier B, Buhl R, Holgate S, Jimenez P. Safety and tolerability of omalizumab. Clin Exp Allergy. 2009;39(6):788-97.
81. Hanania NA, Alpan O, Hamilos DL, Condemi JJ, Reyes-Rivera I, Zhu J, et al. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann Intern Med. 2011;154(9):573-82.
82. Cazzola M, Camiciottoli G, Bonavia M, Gulotta C, Ravazzi A, Alessandrini A, et al. Italian real-life experience of omalizumab. Respir Med. 2010;104:1410-6.
83. Vennera MDC, Perez de Llano L, Bardagı S, Ausin P, Sanjuas C, Gonzalez H, et al. Omalizumab therapy in severe asthma: experience from the Spanish registry e some new approaches. J Asthma. 2012;49:416-22.
84. Holgate S, Buhl R, Bousquet J, Smith N, Panahloo Z, Jimenez P. The use of omalizumab in the treatment of severe allergic asthma: A clinical experience update. Respir Med. 2009;103(8):1098-113.
85. Limb SL, Starke PR, Lee CE, Chowdhury BA. Delayed onset and protracted progression of anaphylaxis after omalizumab administration in patients with asthma. J Allergy Clin Immunol. 2007;120:1378-81.
86. Tan RA, Corren J. Safety of omalizumab in asthma. Expert Opinion on Drug Safety. 2011;10(3):463-71.
87. Cox L, Platts-Mills TAE, Finegold I, Schwartz LB, Simons FER, Wallace DV. American Academy of Allergy, Asthma and Immunology/American College of Allergy, Asthma and Immunology Joint Task Force Report on omalizumab-associated anaphylaxis. J Allergy Clin Immunol. 2007;120(6):1373-7.
88. Busse W, Buhl R, Vidaurre CF, Blogg M, Zhu J, Eisner MD, et al. Omalizumab and the risk of malignancy: Results from a pooled analysis. J Allergy Clin Immunol. 2012;129(4):983-9.
89. Aidan AL, James EF, Abdelkader R, Mary KM, Mary SB, Hassan NT, et al. Baseline characteristics of patients enrolled in EXCELS: a cohort study. Ann Allergy Asthma Immunol. 2009;103(3):212-9.
90. Cruz AA, Lima F, Sarinho E, Ayre G, Martin C, Fox H, et al. Safety of anti-immunoglobulin E therapy with omalizumab in allergic patients at risk of geohelminth infection. Clin Exp Allergy. 2007;37(2):197-207.