Número Atual: Abril-Junho 2024 - Volume 8 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Gabriela Spessatto
- Aline Didoni Fajardo
- Juliana Gonçalves Primon
- Thalita Gonçalves Picciani
- Guilherme da Silva Martins
- Bruno Hernandes David João
- Larissa Machado Carvalho
- Angelica Fonseca Noriega
- Maitê Milagres Saab
- Tayna Padilha Miranda
- Cristine Secco Rosário
- Laura Maria Lacerda Araujo
- Carlos Antônio Riedi
- Roberta Corrêa da Cunha
- Denise Eli
- Débora Carla Chong Silva
- Herberto J. Chong-Neto
- Nelson Augusto Rosário Filho
Comunicação Clínica e Experimental
Asma grave de endótipo misto com resposta a tezepelumabe: relato de caso de um adolescente
Severe mixed-endotype asthma responsive to tezepelumab: a case report of an adolescent
Gabriela Spessatto1; Aline Didoni Fajardo2; Juliana Gonçalves Primon2; Thalita Gonçalves Picciani2; Guilherme da Silva Martins1; Bruno Hernandes David João1; Larissa Machado Carvalho2; Angelica Fonseca Noriega2; Maitê Milagres Saab1; Tayna Padilha Miranda1; Cristine Secco Rosário3; Laura Maria Lacerda Araujo4; Carlos Antônio Riedi7; Roberta Corrêa da Cunha5; Denise Eli6; Débora Carla Chong Silva7; Herberto J. Chong-Neto7; Nelson Augusto Rosário Filho8
1. Residente de Pneumologia Pediátrica do Complexo Hospital de Clínicas da Universidade Federal do Paraná (UFPR) - Curitiba, PR, Brasil
2. Residente de Alergia e Imunologia Pediátrica do Complexo Hospital de Clínicas da Universidade Federal do Paraná (UFPR) - Curitiba, PR, Brasil
3. Doutora em Saúde da Criança e do Adolescente - Curitiba, PR, Brasil
4. Professor Adjunto de Pediatria, UFPR - Curitiba, PR, Brasil
5. Fisioterapeuta, Mestranda em Saúde da Criança e do Adolescente - Curitiba, PR, Brasil
6. Farmacêutica e bioquímica, Mestre em Saúde da Criança e do Adolescente - Curitiba, PR, Brasil
7. Professor Associado de Pediatria, UFPR - Curitiba, PR, Brasil
8. Professor Titular de Pediatria, UFPR - Curitiba, PR, Brasil
Endereço para correspondência:
Herberto Jose Chong Neto
E-mail: hchong@ufpr.br
Submetido em: 15/05/2024
Aceito em: 23/05/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A maioria das crianças e adolescentes com asma grave apresenta fenótipo de inflamação eosinofílica, com risco de exacerbações, uso de corticosteroides sistêmicos e redução na qualidade de vida. Crianças com inflamação tipo 2 respondem bem aos tratamentos convencionais, no entanto, há um grupo pequeno que falha na resposta terapêutica habitual e necessita medicamentos adicionais, como imunobiológicos, para o controle da doença. O conhecimento da fisiopatologia da inflamação brônquica e a avaliação de seus biomarcadores é fundamental para escolha adequada do imunobiológico. Relatamos o caso de um paciente de 13 anos, com asma grave do tipo 2 alérgico, sem indicação de omalizumabe, e que em uso de mepolizumabe não apresentou controle da doença depois de 12 meses de tratamento. A avaliação do endótipo com citologia de escarro identificou fenótipo inflamatório misto, direcionando a substituição por outro imunobiológico, o tezepelumabe, atingindo o controle das exacerbações, por provável redução da hiper-responsividade brônquica. A avaliação do endótipo da asma com os biomaracadores disponíveis permitiu um tratamento preciso e individualizado para o paciente.
Descritores: Asma grave, hiper-responsividade brônquica, Inflamação tipo 2, linfopoietina do estroma tímico.
Introdução
Asma grave é a asma que requer tratamento com altas doses de corticosteroide inalado associado a um segundo medicamento de controle (e/ou corticosteroide sistêmico) para impedir que se torne "descontrolada" ou permaneça "descontrolada" apesar do tratamento1. A maioria das crianças com asma atinge o controle dos sintomas com doses baixas a médias de CI (corticoide inalatório); no entanto, há um grupo pequeno, mas significativo, de crianças com asma grave que necessita de doses maiores de CI com medicamento controlador adicional para manter o controle dos sintomas ou permanecem descontrolados, apesar dessa terapia2.
Segundo o International Study of Asthma and Allergies in Childhood (ISAAC), a prevalência global de asma grave em adolescentes é de 6,9%, variando de 3,8% na Ásia Pacífico, Norte e Leste da Europa a 11,3% na América do Norte3.
As crianças com asma grave apresentam maior risco de resultados adversos, incluindo efeitos colaterais relacionados a medicamentos, exacerbações com risco de vida e qualidade de vida prejudicada4. O impacto econômico da asma grave nos Estados Unidos é significativo e gerou em 2007 o custo de US$ 56 bilhões, sendo 50% desses custos devido a custos indiretos, como consultas médicas, hospitalizações, medicações e dias perdidos na escola e no trabalho5. Entre as crianças de 5 a 17 anos, a asma é uma das causas mais comuns de perda de aulas, comprometimento do desempenho acadêmico, assim como da participação em atividades relacionadas à escola6.
Na última década, com o maior conhecimento da fisiopatologia da asma, biomarcadores têm sido utilizados para determinar o endótipo do paciente asmático de acordo com o perfil de inflamação. Níveis séricos de imunoglobulina E (IgE) total elevada, presença de IgE específica no soro ou por teste cutâneo de leitura imediata, elevação de óxido nítrico exalado (FeNO), eosinofilia no sangue periférico ou no escarro, são biomarcadores de inflamação do tipo 2, fenótipo da maioria das crianças com asma. Estes biomarcadores estão aumentados na inflamação do tipo 2, pois esta é dependente de citocinas inflamatórias como IL-4, IL-5 e IL-13 produzidas por células da imunidade inata, como a células linfoides do tipo 2 (ILC-2) e células da imunidade adaptativa, como os linfócitos Th2 (T helper 2), acionadas logo após a liberação de alarminas como a linfopoietina do estroma tímico (TSLP)1,7. Por outro lado, inflamação não Tipo 2, de perfil granulocítico misto também pode ocorrer, com a participação de linfócitos Th1, Th17 e neutrófilos, além dos eosinófilos7.
Em estudo randômico, duplo-cego e controlado com placebo, de adolescentes e adultos, o tezepelumabe ao longo de 52 semanas foi o primeiro biológico a reduzir de 39% na taxa anual de exacerbações em pacientes com inflamação não Tipo 2 com menos de 150 eosinófilos/µL8.
Relato de caso
Paciente masculino, 13 anos, estudante, natural e procedente de Curitiba. Iniciou com episódios de sibilância aos seis meses de vida. Em seguimento pela asma desde os 8 anos com diagnóstico de asma alérgica grave persistente, apresentava 2 a 3 exacerbações ao ano com idas à emergência e com necessidade de uso de corticosteroide oral (CO). Internou por asma aos 10, 11 e 12 anos de idade em Unidade de Terapia Intensiva com necessidade de intubação orotraqueal. Em uso de budesonida 800 µg + formoterol 24 µg desde os 8 anos, sem melhora. Associado montelucaste 5 mg aos 9 anos e tiotrópio 5 µg ao dia aos 10 anos mantendo exacerbações com visita à emergência, uso de CO e internação. Também possuía diagnóstico de rinite alérgica em tratamento com budesonida 32 µg 2x ao dia. Sem histórico de fumantes em domicílio e sem animais domésticos. Histórico familiar positivo para asma (mãe).
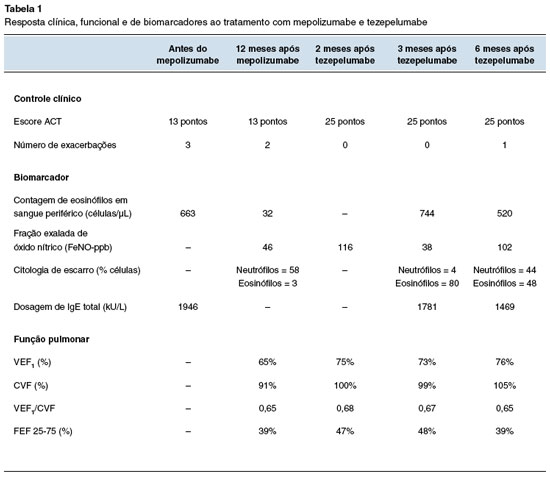
Realizou investigação de diagnósticos diferenciais com dosagem de cloro no suor, de imunoglobulinas séricas e tomografia de tórax, que foram normais. Espirometria evidenciou distúrbio ventilatório obstrutivo leve com prova broncodilatadora positiva. Capacidade vital forçada (CVF) = 2,54 L (91%); Volume expiratório forçado no primeiro segundo (VEF1) = 1,64 L (65%); Relação VEF1/CVF = 0,65; Fluxo expiratório forçado médio 25/75 (FEF25%75%) = 0,78 L (39%). Demais exames demonstraram fenótipo alérgico: IgE total = 1726 kU/L, eosinófilos 663 células/µL, teste cutâneo para Dermatophagoides pteronyssinus = 7x5 mm de diâmetro.
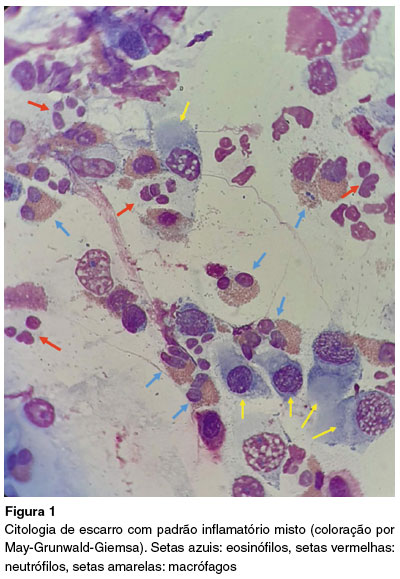
Aos 12 anos foi associado mepolizumabe 100 mg a cada 4 semanas, persistindo com mal controle da doença: Asthma Control Test (ACT) = 13 pontos, 2 exacerbações com uso de corticosteroide sistêmico em domicílio e uma internação em UTI com uso de ventilação não invasiva em um ano. Após 12 meses de tratamento com mepolizumabe, persistiu com doença não controlada, fração exalada de óxido nítrico (FeNO) = 46 ppb e análise da citologia de escarro que demonstrou padrão misto (neutrófilos = 58%; eosinófilos = 3%) (Figura 1).
Aos 13 anos foi iniciado o anti-TSLP (tezepelumabe) 210 mg por via subcutânea cada 4 semanas, com boa resposta, sem novas exacerbações, nem tão pouco necessidade de uso de CO. Nas consultas de seguimento, após 2 meses de uso da medicação, encontrava-se com doença controlada (ACT = 25 pontos) e espirometria demonstrando melhora da função pulmonar: CVF = 2,80 L (100%); VEF1 = 1,88 L (75%); relação VEF1/CVF = 0,68; FEF 25%-75% = 0,94 L (47%). FeNO = 116 ppb.
Com 3 meses de uso de tezepelumabe, seguiu com doença controlada e função pulmonar estável. Nova análise de marcadores demonstrou aumento de eosinófilos periféricos e no escarro, com redução do FeNO e estabilidade na IgE sérica total.
Na avaliação de 6 meses após iniciar tezepelumabe, havia apresentado uma exacerbação leve no período interconsulta, resolvida com uso de salbutamol, sem necessidade de CO. Cerca de 2 semanas após, apresentou infecção pelo vírus Influenza, resolvida com medicações sintomáticas, não havendo nova exacerbação. Os marcadores demonstraram aumento do FeNO, com manutenção de níveis elevados de IgE total e de eosinófilos no sangue periférico. Realizou nova espirometria, com estabilidade das provas de função pulmonar (Tabela 1).
Discussão
Asma grave pode atingir 10% da população de asmáticos, com impacto significativo na vida da criança/adolescente e seus familiares, além do aumento da morbidade1. Este adolescente com sintomas de asma desde a infância precoce vinha utilizando doses altas de corticosteroides inalatórios associado a duas outras medicações controladoras (um LABA e um LAMA), sem sucesso. Com seu perfil de inflamação tipo 2, e sem resposta ao tratamento no passo 4 da GINA, optou-se para associar um biológico2.
Como o perfil inflamatório do paciente era do tipo 2 alérgico, a escolha do biológico guiada pela GINA poderia ser o omalizumabe, entretanto os níveis séricos de IgE estavam acima do indicado para seu uso2 e optou-se para mepolizumabe, o qual falhou em controlar a doença e o adolescente apresentou exacerbações com necessidade de corticosteroide oral e internação em UTI.
Após 12 meses de tratamento com mepolizumabe, observou-se queda significativa da contagem de eosinófilos em sangue periférico, sugerindo a ação biológica do anti-IL5, porém sem correlação com as manifestações clínicas, visto que o paciente permaneceu com exacerbações e doença mal controlada.
Com avaliação mais aprofundada do endótipo deste paciente, a citologia de escarro identificou padrão inflamatório misto, quando substituiu-se mepolizumabe por tezepelumabe. Esse demonstrou resposta favorável ao tratamento de asma com endótipo T2 alto e baixo8, e o paciente apresentou melhora clínica, apesar do curto tempo de observação, teve somente uma exacerbação leve, mas sem visita à emergência e necessidade de CO.
O tezepelumabe é um anticorpo que bloqueia a linfopoetina estromal tímica (TSLP), alarmina derivada das células epiteliais, e que está implicada na inflamação das vias aéreas. A TSLP é liberada após lesão epitelial promovendo ativação de células e citocinas inflamatórias do tipo 2 (células dendríticas, células linfoides inatas do grupo 2, linfócitos Th2, mastócitos, IL-4, IL-5 e IL-13), além de efeito na regulação de fatores relacionados à inflamação neutrofílica, decorrentes da ativação de células Th1 e/ou Th17, e da liberação de suas citocinas como o IFNg e a IL-17. Também possui ação direta na musculatura lisa, contribuindo com o remodelamento das vias aéreas pelo aumento da produção de colágeno pelos fibroblastos e pela proliferação de miócitos9.
Em estudos de fase 2 e 3, o tezepelumabe reduziu significativamente as exacerbações quando comparado ao placebo em pacientes com asma grave não controlada, independente dos biomarcadores de inflamação do tipo 2. No caso descrito, após 6 meses de uso da medicação e com melhora clínica, não ocorreu redução dos biomarcadores da inflamação T2, observando-se um aumento dos eosinófilos sanguíneos e modificação do padrão misto do escarro para padrão eosinofílico. O FeNO apresentou resultados variáveis, com elevação na primeira avaliação após 2 meses de tezepelumabe, queda com 3 meses, e novo aumento aos 6 meses de tratamento. A função pulmonar apresentou melhora significativa com 2 meses de tratamento e manteve-se estável na avaliação dos 3 e 6 meses.
A baixa ação nos biomarcadores de inflamação T2 associada à melhora clínica e de função pulmonar, sugere que o perfil inflamatório mais importante para este paciente foi o neutrofílico, mas não explica a ineficiência do anti-TSLP na inflamação eosinofílica, como observado em estudos pivotais8. TSLP pode atuar em outras células, como a da musculatura lisa dos brônquios, mastócitos, entre outras, que podem estar relacionadas à hiper-responsividade brônquica (HRB)10.
A HRB é um processo fisiopatológico da asma e definida como uma predisposição das vias aéreas ao estreitamento (broncoconstrição) em reposta a estímulos que produziram pouco ou nenhum efeito em um indivíduo saudável11. É um marcador de asma sintomática, independente do padrão eosinofílico, levando a exacerbações e pior controle da doença10.
A melhora clínica comprova a ação do tezepelumabe na redução das exacerbações independente dos biomarcadores de inflamação T2 e reduz a hiper-responsividade brônquica (HRB)8,9. Andreasson e cols. descreveram o efeito da TSLP na HRB. Este estudo avaliou a relação da HRB, pela broncoprovocação com manitol, e a relação com os níveis de TSLP séricos, de escarro e do lavado broncoalveolar de pacientes asmáticos com e sem inflamação tipo 2. Os resultados mostraram que a TSLP dosada no escarro foi associada ao grau de hiper-responsividade, nos pacientes com asma eosinofílica e asma não eosinofílica, corroborando o papel da TSLP e da HRB para além da inflamação tipo 212.
Da mesma forma, o estudo de fase 2, de Diver e cols., demonstrou que a redução da HRB ao teste com manitol foi significativamente maior no grupo tezepelumabe x grupo placebo (p = 0,03). Ainda, ao final do tratamento, um número maior de pacientes que utilizaram tezepelumabe apresentou o teste de broncoprovocação com manitol negativo, quando comparados ao grupo placebo (43% x 25%). Tais resultados foram independentes da contagem periférica de eosinófilos e da presença de marcadores de inflamação tipo 29.
O mecanismo exato pelo qual o tezepelumabe reduz exacerbações em pacientes com inflamação não-T2 ainda não é totalmente conhecido. Os estudos têm demonstrado que uma ampla gama de células expressa receptores de TSLP, tais como ILC-3 e IL-17, envolvidas na via da inflamação não tipo 2, além de efeito direto na ativação de mastócitos e na mediação entre células estruturais da musculatura e células imunológicas, que estão diretamente envolvidas no mecanismo de HRB13,14. A ativação de mastócitos pela TSLP leva à broncoconstrição, secreção de muco e liberação de colágeno pelos fibroblastos, fatores que podem estar relacionados a alterações estruturais da doença e declínio da função pulmonar11,15.
Infelizmente não foi realizada broncoprovocação neste caso, mas observando a relação da HRB e TSLP, é provável que uma redução da HRB de nosso paciente tenha sido o principal fator para o controle da doença, independentemente da redução dos marcadores inflamatórios do tipo 2.
Conclusão
O tezepelumabe, um anticorpo monoclonal humano que se liga especificamente à TSLP, pode ser a escolha de um biológico para tratamento da asma grave a partir de 12 anos de idade, com maior resposta nos pacientes que apresentem perfil de inflamação do tipo 2, e o único que também pode melhorar a asma de pacientes com inflamação não tipo 2. Nosso paciente não apresentou redução dos biomarcadores de inflamação T2, mas obteve o controle da doença. Neste caso, o papel da inflamação não T2 foi predominante, e a ação do anti-TSLP em outras células inflamatórias, que não o eosinófilo, foi predominante e provavelmente reduziu a HRB.
Referências
1. Chong-Neto HJ, Wandalsen GF, Pastorino AC, Dela Bianca C, Chong-Silva DC, Riedi CA, et al. Guia prático de abordagem da criança e do adolescente com asma grave: documento conjunto da Associação Brasileira de Alergia e Imunologia e Sociedade Brasileira de Pediatria. Arq Asma Alerg Imunol. 2020;4(1):3-34.
2. Global Initiative for Asthma (GINA). Global Strategy for Asthma Management and Prevention. 2022 - up date [Internet]. Disponível em: <https://ginasthma.org/wp-content/uploads/2022/07/GINA-Main-Report-2022-FINAL-22-07-01-WMS.pdf>. Acessado em: fevereiro/2024.
3. Lai CK, Beasley R, Crane J, Foliaki S, Shah J, Weiland S. Global variation in the prevalence and severity of asthma symptoms: phase three of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax. 2009;64(4):476-83.
4. Fleming L, Wilson N, Bush A. Difficult to control asthma in children. Curr Opin Allergy Clin Immunol. 2007;7(2):190-5.
5. Centers for Disease Control and Prevention. Asthma in the US. [Internet]. Disponível em: <https://www.cdc.gov/vitalsigns/pdf/2011-05-vitalsigns.pdf>. Acessado em fevereiro/2024.
6. Moonie SA, Sterling DA, Figgs L, Castro M. Asthma status and severity affects missed school days. J Sch Health. 2006;76(1):1824.
7. Busse WW. Biological treatments for severe asthma: A major advance in asthma care. Allergol Int. 2019;68(2):158-66.
8. Menzies-Gow A, Corren J, Bourdin A, Chupp G, Israel E, Wechsler ME, et al. Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma. N Engl J Med. 2021;384(19):1800-9.
9. Diver S, Khalfaoui L, Emson C, Wenzel SE, Menzies-Gow A, Wechsler ME, et al. Effect of tezepelumab on airway inflammatory cells, remodelling, and hyperresponsiveness in patients with moderate-to-severe uncontrolled asthma (CASCADE): a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet Respir Med. 2021;9(11):1299-312.
10. Sverrild A, Andreasen AH, Westergaard CG, von Bulow A, Udesen PB, Thomsen SF, et al. Hyperresponsiveness to inhaled mannitol identifies a cluster of noneosinophilic asthma patients with high symptom burden. J Allergy Clin Immunol Pract. 2021;9:4029-36.
11. Bradding P, Porsbjerg C, Côté A, Dahlén SE, Hallstrand TS, Brightling CE. Airway hyperresponsiveness in asthma: The role of the epithelium. J Allergy Clin Immunol. 2024;153(5):1181-93.
12. Andreasson LM, Dyhre-Petersen N, Hvidtfeldt M, Jørgensen GØ, Von Bülow A, Klein DK, et al. Airway hyperresponsiveness correlates with airway TSLP in asthma independent of eosinophilic inflammation. J Allergy Clin Immunol. 2024 Apr;153(4):988-97.
13. Gauvreau GM, Sehmi R, Ambrose CS, Griffiths JM. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets. 2020;24(8):777-92.
14. Panettieri R Jr, Lugogo N, Corren J, Ambrose CS. Tezepelumab for Severe Asthma: One Drug Targeting Multiple Disease Pathways and Patient Types. J Asthma Allergy. 2024;17:219-36.
15. Caminati M, Buhl R, Corren J, Hanania NA, Kim H, Korn S, et al. Tezepelumab in patients with allergic and eosinophilic asthma. Allergy. 2024;79(5):1134-45.