Número Atual: Abril-Junho 2024 - Volume 8 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Uso do icatibanto em gestante com AEH-FXII: relato de caso
Icatibant in a pregnant woman with HAE-FXII: a case report
Caroline Rosa Emergente Coutinho1; Daniel Carlos Santos Macedo1; Erika P. Souza1; Larissa Oliveira F. Silva Lima1; Adriana Santos Moreno2; Marina M. Dias2; Luisa Karla Arruda2; Eli Mansour1
1. Universidade Estadual de Campinas (UNICAMP), Imunologia Clínica e Alergia, Departamento de Clinica Médica, Faculdade de Ciências Médicas - Campinas, SP, Brasil
2. Universidade de São Paulo, Departamento de Clínica Médica, Faculdade de Medicina de Ribeirão Preto - Ribeirão Preto, SP, Brasil
Endereço para correspondência:
Caroline Rosa Emergente Coutinho
E-mail: c.rosacoutinho@gmail.com
Submetido em: 25/04/2024
Aceito em: 30/06/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
O angioedema hereditário (AEH) por variantes patogênicas no gene que codifica o Fator XII da coagulação (AEHFXII) é o tipo mais comum de AEH com inibidor de C1 normal (AEH-nC1NH). O AEH-FXII é altamente influenciado pela exposição ao estrogênio. Pacientes com esta condição tendem a ter piora do angioedema em períodos de elevação deste hormônio, como na gestação. Atualmente, não há tratamentos específicos aprovados para o manejo do AEH-FXII, e durante a gravidez o tratamento pode ser ainda mais desafiador, visto que os medicamentos recomendados como primeira linha nem sempre estão disponíveis. Neste relato, descrevemos o caso de uma gestante portadora de AEH-FXII que recebeu icatibanto em dose única durante crise de angioedema de vias aéreas superiores no terceiro trimestre, com desfecho favorável para a paciente e para o feto.
Descritores: Angioedema hereditário, antagonistas de receptor B2 da bradicinina, gravidez, fator XII.
Introdução
O angioedema hereditário (AEH) é uma doença genética rara, de herança autossômica dominante, que se manifesta por crises recorrentes e imprevisíveis de angioedema (AE) em subcutâneo e mucosas. O acometimento do trato gastrointestinal resulta em crises de dor abdominal intensa e potenciais intervenções cirúrgicas desnecessárias. A morte por asfixia devido a edema de vias aéreas superiores é o evento mais temido, e mais de 60% dos pacientes com AEH relatam ao menos um evento de AE de laringe. Variantes em SERPING1, o gene que codifica o Inibidor de C1 (C1-INH) resultam no AEH com deficiência do C1-INH (AEH-C1INH) que pode ser do tipo 1, quando ocorre deficiência quantitativa do C1-INH, ou do tipo 2, quando o defeito do C1-INH é funcional. AEH com C1-INH normal (AEH-nC1INH) está associado a variantes em outros genes, com sete tipos descritos atualmente. Em uma proporção de pacientes com AEH, nenhum defeito genético foi identificado, portanto parte dos portadores tem causa desconhecida. O AEH-nC1INH é considerado mais raro que o AEH-C1INH, sendo a causa mais comum a presença de variantes no gene F12. O AEH-FXII também tem herança autossômica dominante13.
O C1-INH inibe, em diferentes pontos, os sistemas de contato e calicreína-cininas. A ausência ou disfunção deste inibidor resulta num sistema em cascatas de ativação desinibida e a liberação final de bradicinina (BK). A liberação da BK resulta no aumento da permeabilidade vascular e no AE, pela sua ligação ao seu receptor B2 (BDKRB2). A ativação dos sistemas de contato e calicreína-cininas é iniciada com a conversão do FXII na sua forma ativa, FXIIa. O FXIIa cliva a pré-calicreína em calicreína e esta induz a liberação da BK a partir do cininogênio de alto peso molecular. No AEH-FXII, o FXII está mais sensível à ativação pela plasmina. Além do AEH-FXII, outras formas de AEH-nC1INH também são mediados pela BK, mas algumas formas do AEH-nC1INH são devido a uma maior fragilidade vascular, como é o caso do AEH-nC1INH por variante no ANGPT1, o gene da angiopoietina 1 (AEH-ANGPT1)1,2,4.
Tratamentos eficazes estão aprovados para crise e para profilaxia de curto e longo prazo apenas para pacientes com AEH-C1INH. Em nosso meio, os medicamentos de primeira linha para o manejo das crises são o inibidor do BDKRB2, o icatibanto subcutâneo (SC), e o concentrado de C1-INH derivado de plasma humano endovenoso (pdC1-INH), enquanto o plasma fresco congelado é terapia de segunda linha e deve ser usado apenas por via endovenosa (EV), na ausência das terapias de primeira linha já citadas. A profilaxia de curto prazo é realizada com pdC1-INH EV como primeira linha, ou andrógenos atenuados como danazol e oxandrolona, sendo estes de segunda linha. O tratamento de primeira linha para a profilaxia de longo prazo, embora de difícil acesso, é com pdC1-INH EV, pdC1-INH subcutâneo (SC), lanadelumabe SC e berotralstat oral. Estes dois últimos são inibidores da calicreína. Pela disponibilidade limitada de terapias de primeira linha para profilaxia de crises, os andrógenos atenuados e o ácido tranexâmico, que são opções de segunda linha, ainda são comumente usados2,57.
Até o momento, nenhum tratamento específico foi aprovado para o AEH-FXII e as estratégias terapêuticas atuais se baseiam nos tratamentos que demonstraram ser eficazes em pacientes com AEH-C1INH8. O manejo dos pacientes com AEH-FXII também inclui a interrupção de potenciais fatores desencadeantes, como os anticoncepcionais contendo estrogênio, a terapia de reposição hormonal e os inibidores da enzima conversora da angiotensina (iECA)9,10.
O planejamento correto da gravidez em pacientes com AEH é importante para minimizar riscos à gestante e ao feto. Durante a gestação, mudanças na gravidade e na frequência das crises são imprevisíveis, podendo diminuir ou aumentar. Nas pacientes com AEH-FXII, os sintomas costumam piorar em condições de hiperestrogenismo, como a gestação. As crises de angioedema em gestantes costumam acometer principalmente o abdômen e as extremidades. Crises afetando as vias aéreas são menos frequentes, mas devem ser tratadas com urgência e preferencialmente com o pdC1-INH11,12.
O icatibanto é um medicamento cuja segurança na gestação é desconhecida. Mesmo assim, pode ser utilizado em gestantes quando o pdC1-INH não está disponível ou quando a ação deste último é duvidosa para determinada paciente. Por razões éticas, não existem estudos controlados e randomizados sobre o uso destes medicamentos para o tratamento das crises de AEH na gestação. Porém, diversos estudos observacionais têm demonstrado eficácia e segurança do icatibanto para tratar as crises durante a gravidez. Portanto, até que mais dados estejam disponíveis, o uso do icatibanto durante a gestação não é recomendado como primeira opção, mas pode ser considerado na ausência da medicação de primeira linha, quando os benefícios superarem os riscos1315.
Relato de caso
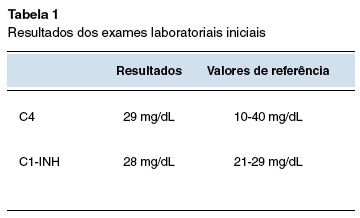
Paciente do sexo feminino apresentava crises frequentes de dor abdominal de forte intensidade desde a infância, que pioraram aos 22 anos de idade. Além das manifestações abdominais, apresentava angioedema de extremidades e face. Inicialmente os episódios recorriam a cada 2 a 3 meses, em associação a traumas ou espontaneamente. A piora na gravidade dos sintomas coincidiu com o início do uso de anticoncepcional combinado. Com 24 anos foi diagnosticada com angioedema hereditário com variante patogênica em F12 (AEH-FXII). Os exames laboratoriais da ocasião revelaram valores normais de C4 e C1-INH (Tabela 1), e no teste genético foi encontrada a variante patogênica no exon 9 do gene F12, p.Thr328Lys (c.983C>A) em heterozigose. A história familiar é negativa, porém o pai, assintomático, é portador da mesma variante.
Com o diagnóstico de AEH-FXII o uso do anticoncepcional combinado contendo estrogênio foi suspenso e, como a paciente não tinha desejo de engravidar na ocasião, permaneceu em uso de anticoncepcional contendo apenas progesterona. Com esta conduta, a paciente permaneceu aproximadamente 10 anos completamente assintomática.
Com a intenção de engravidar, a paciente interrompeu a contracepção e aos 34 anos teve sua primeira gestação. Com 12 semanas de gestação, as crises recomeçaram e aumentaram em gravidade e frequência ao longo do tempo. O acesso a pdC1-INH foi negado, e foi então indicado tratamento profilático com ácido tranexâmico 500 mg/dia, com controle parcial e insatisfatório dos sintomas. Doses superiores a 500 mg/dia não foram toleradas por sintomas gástricos.
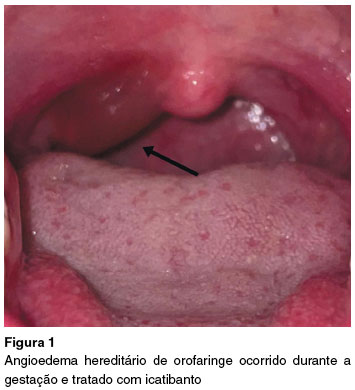
Com 30 semanas de gestação, apresentou uma crise de angioedema em orofaringe (Figura 1), sem outros sintomas associados. Devido ao risco de progressão e potencial obstrução das vias aéreas superiores e pela indisponibilidade do pdC1-INH, de primeira linha na gestação, foi optado por realizar o tratamento da crise com icatibanto SC, na dose de 30 mg, com a concordância da paciente após informações sobre riscos e benefícios. A escolha pelo icatibanto se deveu ao fato de que este medicamento estava disponível com a paciente para uso, desde o diagnóstico, previamente à gestação. O medicamento foi administrado após cerca de 4 horas do início da crise, com melhora referida após 2 horas e resolução completa após 10 horas da administração. A paciente não apresentou nenhum evento adverso local ou sistêmico, imediato ou tardio. O parto ocorreu com 35 semanas e 2 dias de gestação, por sangramento secundário à placenta prévia centro total que já havia sido diagnosticada no início da gestação. O parto e o pós-parto foram livres de eventos, tanto para a mãe quanto para o recém-nascido.
Discussão
Gestantes com AEH podem ter uma piora considerável na frequência e na gravidade de sua doença. A exposição ao estrogênio, endógeno ou exógeno, tem influência tanto sobre as pacientes com AEH-C1INH tipos I e II, quanto nos portadores de AEH-FXII, porém ainda não se entende completamente esta relação. O AEH-FXII já foi considerado estrogênio-dependente, visto que algumas pacientes portadoras de variantes patogênicas em F12 só passam a ter manifestações clínicas diante da exposição a este hormônio, como durante a gestação ou uso de anticoncepcionais que contenham estrogênio. Este hormônio pode agir em várias etapas da ativação em cascata dos sistemas de contato e calicreína-cininas, tanto em nível genômico quanto por vários receptores de membrana endoteliais. Entre os efeitos observados, estimula a liberação de algumas citocinas e da proteína do choque térmico, a Hsp90, que são capazes de atuar nas células endoteliais, levando à conversão de pré-calicreína em calicreína, com posterior clivagem do HMWK e liberação de BK. Além disso, a calicreína também ativa o FXII, tanto de forma direta, quanto através da indução da degradação de plasminogênio em plasmina e consequente ativação por esta última. O estrogênio pode aumentar a expressão do receptor B2 da BK, além de intervir na atividade da enzima conversora de angiotensina, reduzindo a degradação de BK1,16.
Apesar da terapia de escolha para o tratamento das crises durante a gestação ser o pdC1-INH7, nesta paciente optou-se pelo uso do icatibanto, pela gravidade da crise e pela localização do angioedema em orofaringe, com potencial risco de progressão e obstrução das vias aéreas superiores. Além disso, a medicação de primeira linha, na ocasião, não estava disponível.
O icatibanto é classificado na categoria C, devido aos eventos adversos demonstrados em estudos com animais13. Os eventos adversos descritos em animais incluem parto prematuro, aborto, morte fetal e perda pré-implantação, sem evidências de teratogenicidade. Estudos observacionais em seres humanos relataram partos pré-termos em gestantes que receberam o icatibanto durante crises de AEH, sem outros registros de eventos adversos. No entanto, o conjunto de dados levantados é muito pequeno para se chegar a conclusões sobre a relação entre o uso da medicação e o aumento de incidência de prematuridade14. Uma preocupação relacionada à utilização de icatibanto durante a gravidez é o fato de que as células da decídua humana expressam os receptores BDKRB2 e os efeitos da inibição destes receptores, mesmo durante períodos transitórios, ainda são desconhecidos15. Apesar de alguns estudos observacionais relatarem casos de parto pré-termo em gestantes que fizeram uso do icatibanto, no caso da paciente descrita neste relato, o parto pré-termo não pôde ser atribuído à esta medicação, visto que este desfecho foi secundário às complicações da placenta prévia, cujo diagnóstico já havia sido realizado no primeiro trimestre da gestação.
Atualmente não existem medicamentos aprovados para o AEH-FXII, por falta de dados sólidos de ensaios clínicos. O tratamento destes pacientes baseia-se na experiência clínica com o AEH-C1INH já consolidada. A interrupção dos estrogênios exógenos é o primeiro passo no manejo de mulheres com suspeita de AEH-FXII antes do início de quaisquer outras terapêuticas. Os medicamentos disponíveis e utilizados nos pacientes com AEH-C1INH para crise ou profilaxia, como o icatibanto, pdC1-INH (EV e SC), ácido tranexâmico, o lanadelumab injetável e, mais recentemente, berotralstat oral, modulam direta ou indiretamente o metabolismo da bradicinina e, portanto, podem ser úteis na condução dos pacientes com AEH-FXII. Vale ressaltar que o ácido tranexâmico é mais eficaz no AEH-FXII que no AEH-C1INH para profilaxia17.
O AEH, em todas as suas formas, impacta significativamente a qualidade de vida, a educação e o desempenho profissional dos pacientes. A dificuldade de diagnóstico precoce frequentemente está associada a múltiplas visitas ao pronto-socorro, erros diagnósticos, intervenções cirúrgicas desnecessárias, aumento da ansiedade e depressão, resultando em maior risco à vida3,17. Alguns estudos nacionais estimam que a demora no diagnóstico em pacientes com AEH varie entre 14-18 anos no Brasil. Uma combinação do desconhecimento por parte dos médicos dessa condição clínica e a dificuldade de acesso a exames de triagem e diagnóstico favorecem esse atraso. É imperativo o desenvolvimento de ações coordenadas para aumentar a conscientização do AEH, tanto pelos profissionais da saúde, especialistas e não especialistas, quanto pela população7,18.
Conclusão
Atualmente não existe tratamento direcionado especificamente para o manejo de pacientes com AEH-FXII. As terapêuticas empregadas baseiam-se no tratamento instituído para o AEH-C1INH. Apesar da indisponibilidade de estudos controlados sobre o uso do icatibanto na gestação, este medicamento tem sido descrito como uma opção terapêutica eficaz e segura nestas pacientes. Nos diversos relatos descritos até o momento, não há evidência de efeitos adversos relacionadas à paciente ou ao feto. Portanto, é possível considerar o uso deste, na ausência da opção de primeira linha, considerando riscos e benefícios de forma individualizada e compartilhada.
Referências
1. Campos RA, Serpa FS, Mansour E, Alonso MLO, Arruda LK, Aun MV, et al. Diretrizes brasileiras do angioedema hereditário 2022 - Parte 1: definição, classificação e diagnóstico. Arq Asma Alerg Imunol. 2022;6(2):151-69.
2. Maurer M, Magerl M, Betschel S, Aberer W, Ansotegui IJ, Aygören-Pürsün E, et al. The international WAO/EAACI guideline for the management of hereditary angioedema - The 2021 revision and update. Allergy. 2022. doi:10.1111/all.15214.
3. Gutierrez M, Veronez CL, Rodrigues Valle SO, Gonçalves RF, Ferriani MPL, Moreno AS, et al. Unnecessary Abdominal Surgeries in Attacks of Hereditary Angioedema with Normal C1 Inhibitor. Clin Rev Allergy Immunol. 2021;61:60-5.
4. Dias MM, Moreno AS, Maia LSM, Nunes FL, Campos WN, Ferriani MPL, et al. A cost-effective algorithm for diagnosis of hereditary angioedema with normal C1 inhibitor: Applying molecular approach to clinical practice. The Journal of Allergy and Clinical Immunology: In Practice. 2020;8:419-421.e4.
5. Arruda LK, Ferriani MPL. Treatment of hereditary angioedema: When the goal is having a normal life. J Allergy Clin Immunol. 2021;148:802.
6. Cohn DM, Arruda LK. Preventing Deaths from Angioedema: It's Time to Look Ahead. J Allergy Clin Immunol Pract. 2020;8:17756.
7. Campos RA, Serpa FS, Mansour E, Alonso MLO, Arruda LK, Aun MV, et al. Diretrizes brasileiras de angioedema hereditário 2022 - Parte 2: terapêutica. Arq Asma Alerg Imunol. 2022;6(2):17096.
8. Garcia JFB, Takejima P, Veronez CL, Aun MV, Motta AA, Kalil J, et al. Use of pdC1-INH concentrate for long-term prophylaxis during pregnancy in hereditary angioedema with normal C1-INH. J Allergy Clin Immunol Pract. 2018;6:14068.
9. Bork K, Machnig T, Wulff K, Witzke G, Prusty S, Hardt J. Clinical features of genetically characterized types of hereditary angioedema with normal C1 inhibitor: a systematic review of qualitative evidence. Orphanet J Rare Dis. 2020;15:289.
10. Veronez CL, Moreno AS, Constantino-Silva RN, Maia LSM, Ferriani MPL, Castro FFM, et al. Hereditary Angioedema with Normal C1 Inhibitor and F12 Mutations in 42 Brazilian Families. The Journal of Allergy and Clinical Immunology: In Practice. 2018;6:120916.e8.
11. Loli-Ausejo D, Hernández-Martín I, Cabañas R, Entrala A, Gutiérrez-Alvariño M, Martínez-Sánchez N, et al. Tranexamic Acid Plus Bemiparin Sodium as Long- Term Prophylaxis in a Patient With FXII-HAE During Pregnancy: A Case Report. J Investig Allergol Clin Immunol. 2020;30:4645.
12. Gabriel N, Marcelino F, Ferriani MPL, Arruda LK, Campos RA, Gonçalves RF, et al. Pregnancy in Patients With Hereditary Angioedema and Normal C1 Inhibitor. Front Allergy. 2022;3:846968.
13. Simac DV, Stimac T, Novak S. Is Icatibant Safe for the Treatment of Hereditary Angioedema During Pregnancy? Curr Allergy Asthma Rep. 2022;22:135-40.
14. Riedl MA. Hereditary Angioedema During Pregnancy: Considerations in Management. Immunol Allergy Clin North Am. 2023;43(1):14557.
15. Kaminsky LW, Kelbel T, Ansary F, Craig T. Multiple doses of icatibant used during pregnancy. Allergy Rhinol (Providence). 2017;8:17881.
16. Gompel A, Fain O, Boccon-Gibod I, Gobert D, Bouillet L. Exogenous hormones and hereditary angioedema. Int Immunopharmacol. 2020;78:106080.
17. Jones D, Zafra H, Anderson J. Managing Diagnosis, Treatment, and Burden of Disease in Hereditary Angioedema Patients with Normal C1-Esterase Inhibitor. JAA. 2023;16:44760.
18. Chong-Neto HJ, Aroni BP, Mansour E, Toledo E, Serpa FS, Arruda LK, et al. Are pediatricians familiar with hereditary angioedema? World Allergy Organ J. 2023 Jun 10;16(6):100783.



