Número Atual: Abril-Junho 2024 - Volume 8 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Aline Didoni Fajardo
- Juliana Gonçalves Primon
- Thalita Gonçalves Picciani
- Gabriela Spessatto
- Guilherme da Silva Martins
- Bruno Hernandes David João
- Larissa Machado Carvalho
- Angelica Fonseca Noriega
- Maitê Milagres Saab
- Tayna Padilha Miranda
- Cristine Secco Rosário
- Laura Maria Lacerda Araujo
- Carlos Antônio Riedi
- Débora Carla Chong Silva
- Renata Calixto
- Ruppert Hahnstadt
- Herberto J. Chong-Neto
- Nelson Augusto Rosário Filho
Artigo Original
Eficácia e segurança da imunoterapia sublingual para ácaros em crianças e adolescentes com rinite alérgica
Efficacy and safety of house dust mite sublingual immunotherapy in children and adolescents with allergic rhinitis
Aline Didoni Fajardo1; Juliana Gonçalves Primon1; Thalita Gonçalves Picciani1; Gabriela Spessatto2; Guilherme da Silva Martins2; Bruno Hernandes David João2; Larissa Machado Carvalho1; Angelica Fonseca Noriega1; Maitê Milagres Saab2; Tayna Padilha Miranda2; Cristine Secco Rosário3; Laura Maria Lacerda Araujo4; Carlos Antônio Riedi5; Débora Carla Chong Silva5; Renata Calixto6; Ruppert Hahnstadt6; Herberto J. Chong-Neto5; Nelson Augusto Rosário Filho7
1. Complexo Hospital de Clínicas da Universidade Federal do Paraná (UFPR), Residência em Alergia e Imunologia Pediátrica - Curitiba, PR, Brasil
2. Complexo Hospital de Clínicas da Universidade Federal do Paraná (UFPR), Residência em Pneumologia Pediátrica - Curitiba, PR, Brasil
3. Doutora em Saúde da Criança e do Adolescente - Curitiba, PR, Brasil
4. Universidade Federal do Paraná (UFPR), Departamento de Pediatra - Curitiba, PR, Brasil
5. Universidade Federal do Paraná (UFPR), Departamento de Pediatra, Professor Associado - Curitiba, PR, Brasil
6. FDA Allergenic Farmacêutica Ltda. - Rio de Janeiro, RJ, Brasil
7. Universidade Federal do Paraná (UFPR), Departamento de Pediatra, Professor Titular - Curitiba, PR, Brasil
Endereço para correspondência:
Herberto Jose Chong Neto
E-mail: hchong@ufpr.br
Submetido em: 03/05/2024
Aceito em: 12/05/2024.
Conflitos de interesse: este estudo teve o fornecimento gratuito dos extratos para imunoterapia sublingual pela empresa FDA Allergenic Farmacêutica Ltda., e não recebeu pagamento para sua realização.
RESUMO
OBJETIVO: Descrever a eficácia e segurança da imunoterapia com alérgenos sublingual (SLIT) com ácaros em pacientes com rinite alérgica durante um período de 12 meses.
MÉTODOS: Estudo experimental aberto, prospectivo que envolveu crianças e adolescentes de 4 a 18 anos com rinite alérgica/asma segundo as diretrizes Allergic Rhinitis and its Impact on Asthma (ARIA), acompanhados nos ambulatórios do Hospital de Clínicas da Universidade Federal do Paraná. Todos os pacientes receberam gotas (750 UBE/dia) de SLIT para Dermatophagoides pteronyssinus (DP) e Blomia tropicalis (BLO) na concentração de 5.000 UBE/mL durante 12 meses. Foram aplicados escores de medicação (RTSS), testes cutâneos para aeroalérgenos entre janeiro de 2022 e janeiro de 2023.
RESULTADOS: Vinte participantes com pelo menos 4 (variação de 2 a 10) anos de diagnóstico de RA. A adesão média à SLIT foi de 89%. Houve redução no diâmetro médio da pápula DP de 7 ± 2,9 mm para 4,2 ± 2,1 mm após 12 meses (p = 0,0002), bem como na mediana do diâmetro médio da pápula BLO de 3,7 mm a 3 mm (p = 0,0001). Os pacientes apresentaram redução no consumo de medicamentos de resgate, no escore de sintomas e no escore combinado de sintomas e medicamentos (p < 0,05). A pontuação da escala visual analógica reduziu de 9,3 ± 0,7 para 5,2 ± 1,4 ao final do estudo (p < 0,05). Não houve diferença no controle da asma (p = 0,16). A taxa de efeitos adversos leves foi baixa e não diferiu ao longo do estudo (p = 0,62), e não houve reações anafiláticas.
CONCLUSÃO: A SLIT pode trazer benefícios em curto prazo em pacientes com RA, reduzindo a necessidade de medicação e melhorando os sintomas nasais. Foi bem tolerada e segura, sem eventos adversos graves.
Descritores: Imunoterapia alérgeno-específica, imunoterapia sublingual, rinite alérgica.
Introdução
Rinite alérgica (RA) com ou sem conjuntivite associada, é uma doença comum que afeta entre 10 e 40% da população mundial e que produz impacto relevante na qualidade de vida dos pacientes. Em alguns países, mais de 50% dos adolescentes apresentam sintomas de RA13. No Brasil, acomete aproximadamente 20% da população pediátrica4.
Apesar de não ser uma doença grave, a RA causa um impacto socioeconômico importante. Os custos diretos incluem despesas com assistência médica, exames complementares e medicamentos, e os indiretos, queda de produtividade e absenteísmo na escola e no trabalho. Entre as crianças, a doença também afeta significativamente a qualidade de vida, podendo causar irritabilidade e diminuição do desempenho cognitivo1,5,6. Em longo prazo, a obstrução nasal crônica gera alterações no padrão de crescimento facial, além de complicações funcionais e alterações estéticas7.
As principais recomendações para pacientes com RA são evitar alérgenos, terapia medicamentosa para controle dos sintomas (principalmente anti-histamínicos e corticosteroides nasais tópicos) e, para pacientes com doença de difícil controle, imunoterapia específica1,5,8. Imunoterapia com injeções subcutâneas têm sido utilizada por décadas. O mecanismo exato de ação não é completamente compreendido, mas incluem mudanças nos níveis de anticorpos no soro e alterações celulares, incluindo redirecionamento da resposta celular de Th2 para Th1, entre outros mecanismos regulatórios. A percepção de que o rico leito vascular localizado sob a língua poderia servir como uma nova abordagem para a entrega de alérgenos levou ao desenvolvimento de comprimidos de dissolução rápida ou extrato aquoso líquido que poderiam ser absorvidos com eficiência911.
A imunomodulação resultante do tratamento induz tolerância imunológica com redução significativa dos sintomas e da necessidade do uso de medicamentos12.
A decisão de iniciar a imunoterapia com alérgenos deve basear-se na avaliação clínica e no exame físico do paciente, complementados por testes apropriados in vivo ou in vitro para identificar a sensibilidade do alérgeno específico ao(s) alérgeno(s) relevante(s) e uma discussão detalhada sobre objetivos, riscos versus benefícios e compromisso de longo prazo com o plano de tratamento. Como imunoterapia com alérgenos sublingual (SLIT) envolve terapia diária de longo prazo, requer compromisso do paciente ou cuidador para ajudar a maximizar a adesão12,13.
O controle dos sintomas da RA permanece satisfatório em longo prazo mesmo após o término da ITA, reduzindo ou até mesmo abolindo o emprego de fármacos. Portanto, pode-se considerar esta terapêutica potencialmente capaz de promover a remissão total da doença13.
Os guidelines Allergic Rhinitis and its Impact on Asthma (ARIA), da Academia Europeia de Alergia, Asma e Imunologia (EAACI), o da Associação Brasileira de Alergia e Imunologia (ASBAI) e o da Academia Americana de Alergia, Asma e Imunologia (AAAAI) reconhecem como válida a imunoterapia realizada com extratos alergênicos, desde que esses sejam de boa qualidade, de preferência padronizados, e resguardando-se o cuidados com relação à mistura antigênica, já que alguns alérgenos podem conter enzimas proteolíticas que inativam os demais componentes da mistura1,2,5,9.
O objetivo principal deste estudo é verificar se a SLIT constitui um tratamento eficaz e seguro para pacientes pediátricos com rinite alérgica com ou sem conjuntivite. Tendo como objetivos secundários avaliar a segurança da SLIT e o grau de reatividade cutânea antes e após a imunoterapia utilizada.
Métodos
Estudo experimental aberto, prospectivo, realizado no período de janeiro de 2022 até dezembro de 2023. Foi aprovado pelo Comitê de Ética em Pesquisa do Hospital de Clínicas da Universidade Federal do Paraná (CNAES 74790323.6.0000.0096).
Os dados foram analisados seguindo os registros dos prontuários dos pacientes com rinite e/ou rinoconjuntivite alérgica moderada/grave persistente, que foram submetidos a SLIT com Dermatophagoides pteronyssinus (DP) e Blomia tropicalis (BLO) durante 12 meses no ambulatório de Alergia e Imunologia Pediátrica do Hospital de Clínicas da UFPR (CHC-UFPR). O diagnóstico de RA seguiu a diretriz Allergic Rhinitis and its Impact on Asthma (ARIA).
Foram envolvidos crianças e adolescentes de 4 a 18 anos de idade com rinite alérgica moderadagrave, rinoconjuntivite com ou sem asma associada, com sensibilização exclusiva ao DP e BLO, cujo tratamento medicamentoso acompanhado de medidas específicas de controle ambiental, não tenham sido suficientes para o controle dos sintomas. Asma leve ou moderada com VEF1 acima de 80% do basal.
Foram excluídos pacientes com doenças graves do sistema imunológico, como autoimunes, doenças infecciosas em atividade, como tuberculose, doenças cardíacas, hipertensão arterial grave, mesmo controlada, doenças renais graves, uso de betabloqueadores e inibidores de conversão de angiotensina (ECA), uso de imunossupressores, dermatite atópica grave, neoplasias, doenças psiquiátricas que inviabilizem a perfeita consciência do indivíduo.
Os pacientes (ou seus responsáveis) mantiveram um registro diário dos sintomas e do uso da medicação durante a avaliação de acompanhamento. Foram calculados os valores das pontuações médias dos escores utilizados em visitas mensais. A busca foi feita por banco de dados dos pacientes com esse diagnóstico, os quais foram analisados de acordo com as seguintes variáveis: sexo (masculino ou feminino), idade (em anos), doença de base que motivou início da SLIT, presença de asma concomitante, dosagem sorológica de IgE total, avaliação da escala visual analógica (realizada em todas as visitas), teste cutâneo alérgico por puntura com extrato de DP e BLO (realizado no início do tratamento e após 12 meses do mesmo), avaliação da adesão pela percepção do médico, quantidade de medicação necessária para controle da doença, escore de sintomas, efeitos adversos, evolução clínica (após 12 meses de tratamento). A segurança da SLIT nos participantes e o grau de reatividade cutânea aos ácaros domésticos DP e BLO foram registrados através da comparação do diâmetro médio das pápulas ao teste cutâneo de puntura antes e após 12 meses de SLIT. Foi verificada a frequência de efeitos adversos relacionados à imunoterapia sublingual com questionário aplicado durante as visitas. A adesão ao tratamento foi avaliada por meio da percepção médica.
Os dados clínicos, evolução dos sintomas, efeitos adversos, uso de medicação concomitante, teste de puntura e registro de adesão foram descritos e uma avaliação analítica dos dados foi realizada.
A escala visual analógica (EVA), questionário simples padronizado pela ARIA, no qual constam sintomas de rinite como obstrução, prurido, espirros, rinorreia e sintomas oculares, foi utilizada. Além da percepção geral sobre tais sintomas na qualidade de vida, são conjuntamente mensurados numa régua com figuras e o (a) paciente é convidado a marcar a sua situação ao longo dessa régua que varia de zero (totalmente assintomático) a 10 (sintomas péssimos, totalmente não controlados).
Atribuiu-se uma nota de acordo com a intensidade dos sintomas e necessidade de uso de medicamentos, em diários solicitados ao (à) paciente ou seus (suas) responsáveis e em intervalos regulares esses escores foram analisados. As visitas foram agendadas a cada três meses a partir da fase de indução da SLIT. Os testes de puntura para DP e BLO foram realizados com extratos alergênicos padronizados com controle positivo e controle negativo. Foi utilizada uma gota de cada alérgeno na superfície volar do antebraço, e a puntura foi realizada com lanceta. Após 15 minutos foi realizada a leitura e foi considerado teste positivo pápulas maiores ou iguais a 3 mm de diâmetro médio. Esses testes foram utilizados para monitoramento de eficácia do tratamento, no início e após 12 meses. A diminuição da pápula foi utilizada como parâmetro secundário para avaliar a eficácia do tratamento. Os extratos foram fornecidos pelo fabricante FDA Allergenic Farmacêutica, Rio de Janeiro, Brasil.
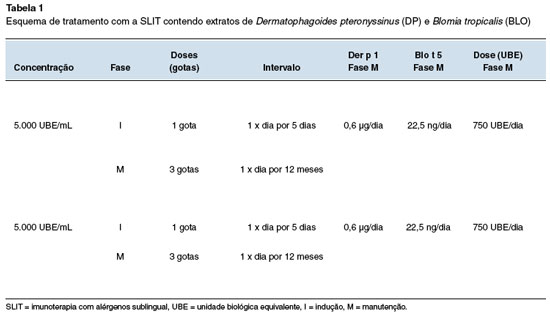
O extrato líquido administrado neste estudo consistiu em mistura padronizada de proporções iguais de extratos de DP/BLO de concentração de 5.000 UBE/mL.
A medicação do estudo foi titulada de forma incremental diária, como fase de indução por um período de 5 dias, até a dose de 750 UBE/dia, como manutenção, durante 12 meses. O extrato foi fornecido pelo fabricante FDA Allergenic Farmacêutica, Rio de Janeiro, Brasil (Tabela 1).
Após inclusão no estudo, os participantes receberam os frascos das vacinas, que foram administradas em casa pelo próprio paciente ou responsável. A cada 21 dias, os pais ou responsáveis pelos participantes retiravam os novos frascos pessoalmente no serviço.
A dose de indução da vacina foi 1 gota sublingual da mistura padronizada em proporções iguais de DP/BLO por cinco dias, seguida de 3 gotas sublinguais diárias por 12 meses. A primeira dose foi administrada por médico no serviço e o paciente aguardava 1 hora em observação.
Em uma série de visitas de acompanhamento e ao final do tratamento (ou na última visita) os seguintes dados foram registrados: alterações no tratamento SLIT (alterações de dose, interrupção precoce, etc.); alterações nos medicamentos para controle dos sintomas; progressão dos sintomas; e qualquer evento adverso. A adesão e satisfação do paciente também foram registradas em cada visita de acompanhamento, na percepção dos médicos. Dados como faltas nas consultas de acompanhamento pré-estabelecidas e atraso para retirada da SLIT foram apontadas como falta de adesão do paciente ao tratamento.
Desfecho primário
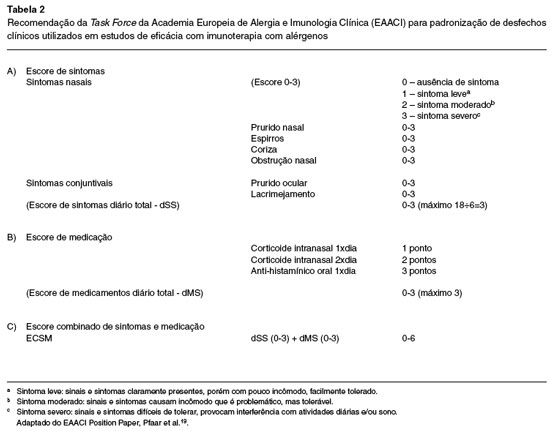
O parâmetro primário para avaliação de eficácia foi o escore combinado de sintomas (ES) e uso de medicamentos de resgate (EM), denominado Escore Combinado de Sintomas e Uso de Medicamentos (ECSM), conforme proposto no position paper sobre desfechos clínicos com produtos alergênicos publicado pela Academia Europeia de Alergia e Imunologia Clínica (EAACI) em 201414. O ECSM foi calculado através da fórmula:
onde: ES (Escore de Sintomas) era o somatório de pontuação de 0 a 3 (ausente, leve, moderado ou severo) de quatro sintomas nasais (coceira, rinorreia, obstrução nasal e espirros) e dois oculares (prurido ocular e lacrimejamento). O máximo de pontuação possível para o ES é 18.
EM (Escore de Medicamentos) foi o somatório dos pontos relacionados ao uso diário de spray nasal com corticoide (1 ou 2 aplicações - 1 ou 2 pontos, respectivamente) e loratadina (3 pontos), conforme apresentado na Tabela 2.
A loratadina (10 mg) só foi indicada quando o uso do corticoide nasal não foi suficiente para controlar os sintomas. As informações sobre o uso de medicamentos foram registradas no cartão para registro diário do uso de medicamentos de resgate.
Para avaliação da segurança, os participantes ou seus responsáveis registraram diariamente o aparecimento ou não de efeitos adversos locais e sistêmicos.
Os resultados de segurança foram avaliados pelo número de pacientes que tiveram quaisquer eventos adversos relacionados ao tratamento (EART) levando à descontinuação do tratamento.
Os eventos adversos (EA) foram avaliados e categorizados de acordo com a definição da Organização Mundial de Alergia (WAO)15.
EA locais: coceira oral, edema dos lábios ou da língua e náusea/dor de estômago/diarreia.
EA sistêmicos: urticária, exacerbação dos sintomas de rinite e/ou asma, angioedema e hipotensão.
Foram pré-estabelecidas oito visitas de acompanhamento no início do tratamento. Pacientes que tiveram um atraso maior do que 15 dias para visitas e retirada da imunoterapia sublingual, foram excluídos da pesquisa, sendo apontados como falta de adesão do paciente na percepção do médico assistente.
Para análise estatística, as variáveis categóricas foram apresentadas em distribuição de frequência e proporções. Foi utilizado o teste qui-quadrado para comparação entre proporções. As variáveis contínuas foram expressas em média e desvio-padrão, ou mediana e variação.
Para comparação entre as médias foi utilizado o teste t de Student, e para comparação das medianas foi utilizado teste de Wilcoxon. Para realização de estatística foi utilizado o software Stat Plus versão 5.9.5.0 (Analyst Soft Inc. USA). Para descartar a hipótese de nulidade foi considerado um valor de p < 0,05.
Resultados
Foram analisados os dados de 20 pacientes com idades entre 4 e 18 anos com diagnóstico de RA moderada grave persistente, induzida por ácaros da poeira doméstica, com sintomas que variaram de 2 a 10 anos duração.
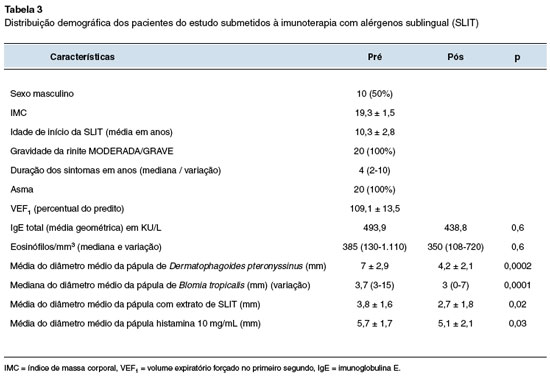
Dados demográficos basais e características clínicas da população de crianças e adolescentes em uso de SLIT estão apresentados na Tabela 3.
Todos os pacientes que apresentavam asma como comorbidade eram sensibilizados por DP e BLO, e todos apresentavam função pulmonar normal.
Os níveis de IgE e eosinofilia após um ano de SLIT não sofreram alterações significativas durante o tratamento (p = 0,6).
Houve redução da média do diâmetro médio da pápula de DP após 12 meses. O mesmo ocorreu com a mediana do diâmetro médio de BLO.
Além disso, a puntura com o próprio extrato alergênico também mostrou redução ao final do tratamento (Tabela 3).
O controle da asma foi avaliado em dois momentos, durante este primeiro ano de tratamento, pelo ACT (Asthma Control Test) como ferramenta de avaliação de controle. A primeira avaliação se deu na indução (ACT 20,5 ± 2,1) e a segunda avaliação com pelo menos seis meses de SLIT (ACT 21,1 ± 2). Não houve diferença estatística em comparação aos meses analisados (p = 0,16).
Nenhuma morte, choque anafilático ou evento com risco de vida foi relatado durante o estudo.
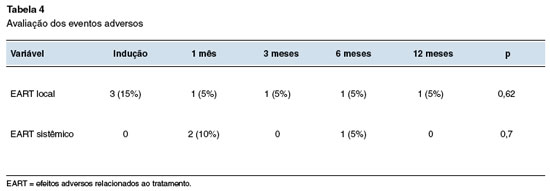
A Tabela 4 mostra o resumo da segurança. Nenhum EART grave foi relatado neste estudo.
Dez EART ocorreram no grupo estudado ao longo de 12 meses, 5 com sintomas orais ou prurido no local da aplicação, dois tiveram angioedema de lábio, e três agravamento de sintomas alérgicos/exacerbação da asma. A taxa total de EART foi de 15% na indução, 15% no primeiro mês de SLIT, 5% no terceiro mês, 10% no sexto mês, e 5% na última avaliação do grupo que foi realizada com doze meses, respectivamente.
Não houve diferença estatisticamente significativa com relação aos EART entre os meses analisados (p > 0,05).
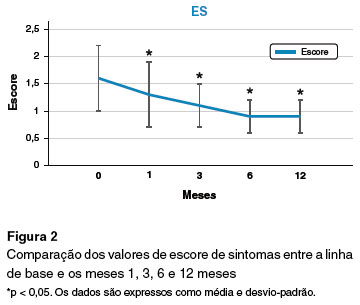
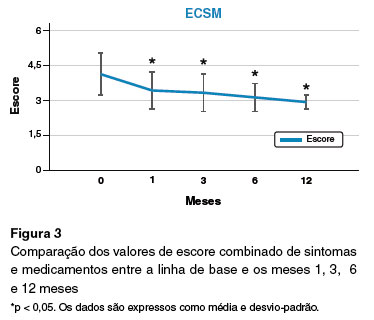
A análise do desfecho primário após um ano de SLIT mostrou que os pacientes apresentaram melhorias significativas no EM, ES e ECSM (Figuras 1, 2 e 3).
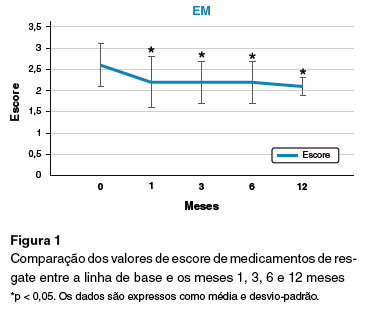
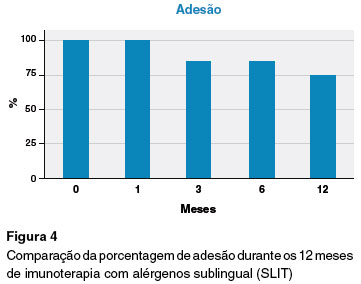
A adesão média ao tratamento nos 12 meses analisados foi superior a 89%, sendo esta percentagem de adesão a esperada para SLIT. O atraso máximo tolerado para as entrevistas ou retirada da medicação foi de 15 dias (Figura 4).
A pontuação da EVA diminuiu desde o início até o final do acompanhamento do grupo (p < 0,05) (Figura 5).

Discussão
A imunoterapia com alérgenos (AIT) é uma opção de tratamento de base imunológica modificadora para alergias mediadas por IgE, como rinoconjuntivite alérgica e asma alérgica. No entanto, os estudos sobre a eficácia em longo prazo da SLIT para RA, especialmente em pacientes pediátricos, ainda permanecem escassos.
Estudos anteriores provaram a eficácia da SLIT no alívio dos sintomas da RA e na diminuição do uso das medicações16. Pontuação total de sintomas, pontuação total de medicação e escala visual analógica (EVA) foram recomendados como possíveis desfechos para avaliação da eficácia em estudos com SLIT. A maioria das metanálises sobre SLIT em crianças provou sua eficácia na redução da pontuação de sintomas e uso de medicamentos em comparação com grupo de placebo em doenças respiratórias alérgicas17. No presente estudo, observamos que EM, ES e ECSM tiveram uma diminuição significativa em comparação com o escore basal, comprovando a eficácia da SLIT, o que está de acordo com outros estudos17, apoiando ainda mais os benefícios clínicos de curto prazo da SLIT para pacientes com RA induzida por ácaros da poeira doméstica.
Apesar de não ter sido empregado na prática como um bom biomarcador de resposta, o diâmetro médio da pápula de DP e BLO reduziu significativamente, mostrando que houve redução rápida da sensibilização alérgica pela SLIT.
A imunoterapia com alérgenos (AIT) tem seus mecanismos de ação incluindo efeitos de dessensibilização muito precoces, modulação das respostas das células T e B e isotipos de anticorpos relacionados, bem como inibição da migração de eosinófilos, basófilos e mastócitos para os tecidos e liberação de seus mediadores25. Na presente pesquisa, o período de 12 meses foi curto para observar essa diminuição, assim é necessário dar abertura a novos trabalhos para corroborar e complementar tal informação.
A IgE específica mostra um aumento precoce e diminui relativamente tarde. Estes eventos ocorrem paralelamente a aumentos de IgG4 que aumentam continuamente enquanto o tratamento continua. Após vários meses, a proporção IgE/IgG4 específica do alérgeno diminui. Após alguns meses, ocorre diminuição dos mastócitos e eosinófilos teciduais e da liberação de seus mediadores e da resposta de fase tardia da pele25.
A SLIT pode induzir EA mais leves, principalmente prurido ou edema da mucosa oral e faringe, enquanto efeitos colaterais graves são raros. No entanto, o relato de EA após imunoterapia é muito heterogêneo na literatura.
O sistema de classificação padronizado pela Organização Mundial de Alergia (WAO) para ambas reações locais após SLIT, ou com sintomas leves de reações sistêmicas, deve ser utilizado em futuros protocolos de estudo de imunoterapia18. O presente estudo encontrou poucos efeitos adversos locais, e três relatos de efeitos adversos sistêmicos, que não necessitaram de medicações para controle.
A SLIT é autoadministrada e, portanto, muitos efeitos adversos provavelmente não são relatados19. Neste estudo, as avaliações de sintomas para pacientes pediátricos foram conduzidas por seus responsáveis legais para unificar a avaliação.
A EVA tem sido amplamente utilizada para avaliar a gravidade geral da RA e é recomendada como resultado secundário em estudos SLIT. Del Cuvillo e cols. propuseram um método de classificação que avaliou a gravidade dos pacientes com RA com base nos escores EVA, que também são mencionados em diretriz chinesa para diagnóstico e tratamento de RA20,21. Em um estudo retrospectivo, os pacientes que completaram 3 e 4 anos de duração da SLIT apresentaram uma diminuição significativa do EVA em comparação com aqueles que completaram um curso de SLIT de 2 anos21. Nosso estudo não foi controlado com grupo placebo, porém os resultados são consistentes com os dados da literatura na melhoria dos escore de sintomas nasoculares.
Um estudo retrospectivo da vida real realizado por Bahceciler e cols. incluiu 90 crianças submetidas a SLIT, sugerindo que SLIT de curta e longa duração resultou em esquivamento do uso de corticoide inalado (CI) em paciente com asma alérgica22. Embora vários estudos tenham avaliado a eficácia da SLIT na prevenção de CI em pacientes com asma, há escassez de estudos sobre a eficácia da SLIT em pacientes com asma alérgica. Nosso estudo não observou queda significativa dos sintomas nos asmáticos nos dois semestres analisados, embora a RA fosse moderada a grave, a função pulmonar era normal e o ACT não apresentou diferença estatística em comparação aos meses analisados (p = 0,16).
No presente estudo os pacientes em uso de SLIT foram acompanhados por 12 meses, porém seu curso de tratamento não se encerrou, tendo planejamento de 3-4 anos, reforçando a importância da SLIT em longo prazo na manutenção de efeitos duradouros. Lin e cols. inscreveram quinhentos indivíduos para receber 1-3 anos de SLIT, revelando que o curso de 3 anos de SLIT em pacientes com RA foi mais eficaz do que 1 ano ou 2 anos23. Hamada e cols. documentaram uma diminuição significativa na secreção nasal, espirros, sintomas de obstrução nasal e ECSM em pacientes recebendo 4-5 anos de SLIT em comparação com aqueles que recebem SLIT por 1 ano10, mostrando assim que os desfechos clínicos tendem a ser ainda mais satisfatórios com o curso prolongado da SLIT.
Como a SLIT exige a administração diária do alérgeno durante pelo menos 3 anos para alcançar a eficácia clínica, a adesão é um grande problema, do ponto de vista dos pacientes, prestadores e pagadores. No entanto, a adesão à SLIT é caracterizada por taxas de descontinuação muito variadas. Com base em estudos controlados e observacionais que forneceram informações de adesão em relação aos diferentes tempos de tratamento, as taxas globais de descontinuação foram aproximadas do primeiro ao terceiro ano de tratamento para SCIT (imunoterapia subcutânea) (22%, 34% e 26%) e SLIT ( 42%, 29% e 27%)17. No nosso estudo nenhum paciente descontinuou a SLIT, porém, já demonstraram falha de adesão.
Como conclusão, pelos resultados observados neste estudo, a SLIT deve ser continuada para determinação de desfechos mais amplos, além disso, a pesquisa existente demonstrou consistentemente que SLIT pode alcançar benefícios em curto prazo em pacientes com RA moderada a grave, melhorando os sintomas nasais, reduzindo necessidade de medicamentos e melhoria na qualidade de vida, exibindo um efeito modificador da doença. A SLIT foi bem tolerada por todos os pacientes e não houve eventos de anafilaxia relacionada ao tratamento.
Agradecimentos
À FDA Allergenic Farmacêutica Ltda., Rio de Janeiro, Brasil, pelo apoio à pesquisa.
Referências
1. Brozek JL, Bousquet J, Agache I, Agarwal A, Bachert C, Bosnic-Anticevich S, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines-2016 revision. J Allergy Clin Immunol. 2017;140(4):950-8.
2. Alvaro-Lozano M, Akdis CA, Akdis M, Alviani C, Angier E, Arasi S, et al. EAACI allergen immunotherapy user's guide. Pediatr Allergy Immunol. 2020;31(25):1-101.
3. Wilson DR, Torres Lima M, Durham SR. Sublingual immunotherapy for allergic rhinitis: systematic review and meta-analysis. Allergy. 2005;60(1):4-12.
4. Chong Neto HJ, Rosário CS, Rosário BA, Chong FH, Grasselli EA, Silva FC, et al. Allergic rhinitis in preschool children from southern Brazil. Allergy. 2014;69(4):545-7.
5. Dykewicz MS, Wallace DV, Amrol DJ, Baroody FM, Bernstein JA, Craig TJ, et al. Rhinitis 2020: A practice parameter update. J Allergy Clin Immunol. 2020;146(4):721-67.
6. Devillier P, Fadel R, De Beaumont O. House dust mite sublingual immunotherapy is safe in patients with mild-to-moderate, persistent asthma: a clinical trial. Allergy. 2016;71(2):249-57.
7. Carvalho A, Sgnori DJ, Rosário Fº NA. Prevalência do padrão facial em crianças com rinite alérgica persistente. Orthod SciPract. 2020;13(51):907.
8. Aarestrup FM, Taketomi EA, Santos Galvão CES, Gagete E, Arruda ACNM, Alves GB, et al. Good clinical practice recommendations in allergen immunotherapy: Position paper of the Brazilian Association of Allergy and Immunology - ASBAI. World Allergy Organ J. 2022;15(10):100697.
9. Canonica GW, Cox L, Pawankar R, Baena-Cagnani CE, Blaiss M, Bonini S, et al. Sublingual immunotherapy: World Allergy Organization position paper 2013 update. World Allergy Organ J. 2014;7(1):6.
10. Bufe A, Eberle P, Franke-Beckmann E, Funck J, Kimmig M, Klimek L, et al. Safety and efficacy in children of an SQ-standardized grass allergen tablet for sublingual immunotherapy. J Allergy Clin Immunol. 2009;123(1):167-73.
11. Nolte H, Bernstein DI, Nelson HS, Kleine-Tebbe J, Sussman GL, Seitzberg D, et al. Efficacy of house dust mite sublingual immunotherapy tablet in North American adolescents and adults in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2016;138(6):1631-8.
12. Aarestrup FM, Lira GV de AG, Taketomi EA, Gagete E, Rosário Filho NA, Rizzo MC, et al. Brazilian guidelines for allergen immunotherapy in the treatment of allergic rhinitis. Rev Assoc Med Bras [Internet]. 2023;69(5):e2023D695.
13. Radulovic S, Wilson D, Calderon M, Durham S. Systematic rewiews of sublingual immunotherapy (SLIT). Allergy. 2011;66(6):740-52.
14. Pfaar O, Kleine-Tebbe J, Hörmann K, Klimek L. Allergen-specific immunotherapy: which outcome measures are useful in monitoring clinical trials? 2011. Immunol Allergy Clin North Am. 2011;31(2):289309.
15. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Rivas MF, Fineman S, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
16. Lin SY, Erekosima N, Kim JM, Ramanathan M, Suarez-Cuervo C, Chelladurai Y, et al. Sublingual immunotherapy for the treatment of allergic rhinoconjunctivitis and asthma: a systematic review. JAMA. 2013;309(12):127888.
17. Canonica GW, Cox L, Pawankar R, BaenaCagnani CE, Blaiss M, Bonini S, et al. Sublingual immunotherapy: World Allergy Organization position paper 2013 update. World Allergy Organ J. 2014;7(1):6.
18. Pfaar O, Bachert C, Bufe A, Buhl R, Ebner C, Eng P, et al. Guideline on allergen-specific immunotherapy in IgE-mediated allergic diseases: S2k Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Society for Pediatric Allergy and Environmental Medicine (GPA), the Medical Association of German Allergologists (AeDA), the Austrian Society for Allergy and Immunology (ÖGAI), the Swiss Society for Allergy and Immunology (SGAI), the German Society of Dermatology (DDG), the German Society of Oto- Rhino-Laryngology, Head and Neck Surgery (DGHNO-KHC), the German Society of Pediatrics and Adolescent Medicine (DGKJ), the Society for Pediatric Pneumology (GPP), the German Respiratory Society (DGP), the German Association of ENT Surgeons (BV-HNO), the Professional Federation of Paediatricians and Youth Doctors (BVKJ), the Federal Association of Pulmonologists (BDP) and the German Dermatologists Association (BVDD). Allergo J Int. 2014;23(8):282-319.
19. Position paper: Immunotherapy with hymenoptera venoms. (EAACI) The European Academy of Allergology and Clinical Immunology. Allergy. 1993;48(14 Suppl):36-46.
20. Del Cuvillo A, Santos V, Montoro J, Bartra J, Davila I, Ferrer M, et al. Allergic rhinitis severity can be assessed using a visual analogue scale in mild, moderate and severe. Rhinology. 2017;55(1):34-38.
21. Chen S, Zeng X, Wang L, Chen B, Chen L, Wu S, et al. [Effects of house dust mite sublingual immunotherapy in children with allergic rhinitis and asthma]. Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2015 Aug;50(8):627-31. Chinese.
22. Bahceciler NN, Galip N, Babayigit A. Steroid sparing effect of sublingual immunotherapy: real life study in mono/polisensitized children with asthma. Immunotherapy. 2017;9(15):12639.
23. Lin Z, Liu Q, Li T, Chen D, Chen D, Xu R. The effects of house dust mite sublingual immunotherapy in patients with allergic rhinitis according to duration. Int Forum Allergy Rhinol. 2016;6(1):82-7.
24. Hamada S, Kobayashi Y, Sakamoto D, Shimamura A, Kuroda K, Kawachi R, et al. Long- term sublingual immunotherapy provides better effects for patients with Japanese cedar pollinosis. Auris Nasus Larynx. 2021;48(4):646-52.
25. Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy and immune tolerance to allergens. World Allergy Organ J. 2015;8(1):17.