Número Atual: Abril-Junho 2024 - Volume 8 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Gabriela Andrade Coelho Dias
- Rosana Câmara Agondi
- Larissa Silva Brandão
- Eli Mansour
- Priscilla Filippo A. M. Santos
- Fernanda Lugão Campinhos
- Paula Natassya Argolo
- Bruna Gehlen
- Rozana de Fátima Gonçalves
- Leila Vieira Borges Trancoso-Neves
- Janaína Michele Lima Melo
- Eduardo Souza Lima
- Luis Felipe Chiaverini Ensina
- Solange Oliveira Rodrigues Valle, Régis de Albuquerque Campos
ARTIGO ESPECIAL
Atualização do Guia Prático da Associação Brasileira de Alergia e Imunologia para o Diagnóstico e Tratamento da Urticária baseado na diretriz internacional
An update on the Brazilian Association of Allergy and Immunology Practical Guide for the Diagnosis and Management of Urticaria based on the international guideline
Gabriela Andrade Coelho Dias1; Rosana Câmara Agondi2; Larissa Silva Brandão3; Eli Mansour4; Priscilla Filippo A. M. Santos5; Fernanda Lugão Campinhos6; Paula Natassya Argolo2; Bruna Gehlen2; Rozana de Fátima Gonçalves7; Leila Vieira Borges Trancoso-Neves8; Janaína Michele Lima Melo9; Eduardo Souza Lima10; Luis Felipe Chiaverini Ensina3; Solange Oliveira Rodrigues Valle11, Régis de Albuquerque Campos12
1. Universidade do Estado do Rio de Janeiro (UERJ), Serviço de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
2. Hospital das Clínicas da Faculdade de Medicina de São Paulo, Serviço de Imunoalergia - São Paulo, SP, Brasil
3. Universidade Federal de São Paulo (UNIFESP), Ambulatório de Alergia, Imunologia Clínica e Reumatologia - São Paulo, SP, Brasil
4. Faculdade de Ciências Médicas, Universidade Estadual de Campinas (UNICAMP), Alergia e Imunologia, Departamento de Clínica Médica - Campinas, SP, Brasil
5. Universidade do Estado do Rio de Janeiro (UERJ), Serviço de Dermatologia - Rio de Janeiro, RJ, Brasil
6. Hospital Santa Casa de Misericórdia de Vitória, Centro de Referência em Asma, Alergia e Imunologia - Vitória, ES, Brasil
7. Alergodiagnóstico - Belo Horizonte, MG, Brasil
8. Complexo Universitário Prof. Edgar Santos da Universidade Federal da Bahia, Ambulatório de Urticária - Salvador, BA, Brasil
9. Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, Serviço de Alergia e Imunologia - Ribeirão Preto, SP, Brasil
10. Faculdade de Ciências Médicas e da Saúde de Juiz de Fora (SUPREMA), Ambulatório de Alergia e Imunologia - Juiz de Fora, MG, Brasil
11. Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro, Serviço de Imunologia - Rio de Janeiro, RJ, Brasil
12. Faculdade de Medicina da Bahia, Universidade Federal da Bahia, Departamento de Medicina Interna, Apoio Diagnóstico e Pós-graduação em Ciências da Saúde - Salvador, BA, Brasil
Endereço para correspondência:
Gabriela Andrade Coelho Dias
E-mail: gabrielaacdias@gmail.com
Submetido em 05/05/2024
Aceito em 10/06/2024.
RESUMO
A urticária é uma condição caracterizada pela presença de urticas, angioedema, ou ambos, que pode ser classificada de acordo com o tempo de duração em aguda, quando persiste por menos de 6 semanas, ou crônica, quando por mais de 6 semanas e afeta significativamente a qualidade de vida. A atualização das recomendações quanto ao seu diagnóstico e tratamento é elaborada por especialistas de todo o mundo, que se reúnem a cada quatro anos em Berlim para revisar todas as novas evidências que justifiquem modificações na diretriz internacional. Este artigo discute as principais recomendações propostas na versão atual da diretriz internacional.
Descritores: Urticária, angioedema, diagnóstico, prática clínica baseada em evidências.
Introdução
O objetivo deste guia é discutir de forma prática as principais recomendações da versão atual das Diretrizes Internacionais para a Definição, Classificação, Diagnóstico e Manejo da Urticária. Esta atualização e revisão das diretrizes foi desenvolvida seguindo os métodos recomendados pela Cochrane e o GRADE (Grading of Recommendations Assessment, Development and Evaluation working group). A conferência foi realizada em formato híbrido em Berlim e online no dia 03 de dezembro de 2020, reconhecida e aceita pela União Europeia de Especialistas Médicos (UEMS) e publicada no início de 2022. Foi uma iniciativa conjunta da Seção de Dermatologia da Academia Europeia de Alergologia e Imunologia Clínica (EAACI), da Rede Europeia Global de Alergia e Asma (GA2LEN) e de seus Centros de Referência e Excelência para Urticária e Angioedema (UCAREs e ACAREs), o Fórum Europeu de Dermatologia (EDF) e Associação de Alergia, Asma e Imunologia Clínica da Ásia-Pacífico (APAAACI), com a participação de 64 delegados de 50 sociedades nacionais e internacionais e de 31 países1,2.
Esta versão atualizada da diretriz internacional para urticária inclui conceitos relacionados à definição e à classificação da urticária e descreve abordagens diagnósticas e terapêuticas baseadas em evidências e guiadas por especialistas para os diferentes subtipos de urticária.
Definição
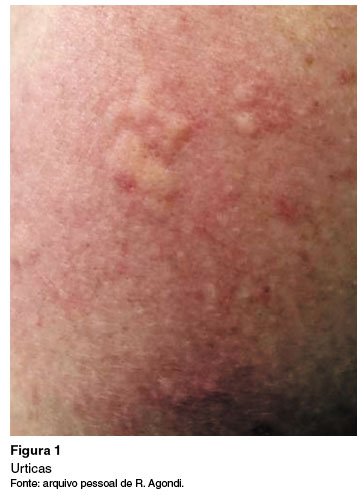
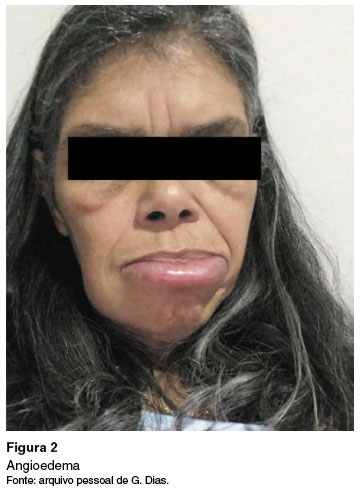
A urticária é uma doença inflamatória comum e heterogênea da pele, caracterizada pelo aparecimento de urticas, lesões edemaciadas de tamanho variável, quase sempre circundada por eritema, pruriginosas e de natureza fugaz, com ≤ 24 horas de duração, e não evoluem com lesões residuais1,3 (Figura 1). O angioedema, por sua vez, se apresenta como edema súbito e pronunciado da derme inferior e do subcutâneo, ou mucosas, com sensação de dor, ardor ou prurido no local, com resolução mais lenta que as urticas, podendo durar até 72 horas (Figura 2)1.
Classificação
A urticária pode ser classificada baseada na sua duração, em aguda ou crônica, como também no papel dos desencadeantes específicos, em espontânea ou induzida. A urticária aguda (UA) é definida como a ocorrência de urticas e/ou angioedema por 6 semanas ou menos. A urticária crônica (UC) é definida pela ocorrência de urticas e/ou angioedema por mais de 6 semanas. Os sintomas na urticária crônica podem ocorrer diariamente ou quase diariamente, ou com um curso intermitente ou recorrente1.
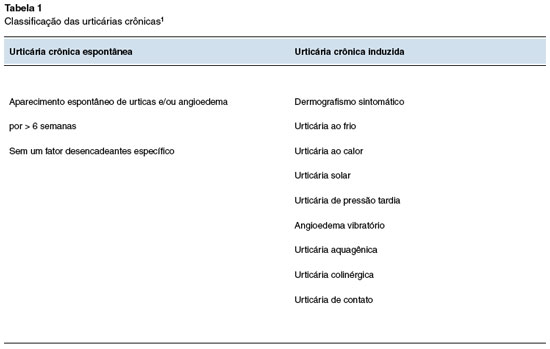
A UC pode ocorrer espontaneamente, denominada urticária crônica espontânea (UCE), ou ser induzida por estímulos específicos, denominada de urticária crônica induzida (UCInd). A UCInd é subclassificada em urticária dermográfica, urticária ao frio, urticária ao calor, urticária de pressão tardia, urticária solar, angioedema vibratório, urticária colinérgica, urticária aquagênica e urticária de contato (Tabela 1)1,3. Dois ou mais diferentes subtipos de urticária crônica podem coexistir em um mesmo indivíduo3.
Epidemiologia e curso natural
A urticária é uma doença frequente, que ocorre devido à ativação de mastócitos e se apresenta com urticas, angioedema ou ambos. A prevalência da urticária aguda ao longo da vida é de aproximadamente 20%. A urticária crônica espontânea ou induzida é incapacitante, prejudica a qualidade de vida e afeta o desempenho no trabalho e na escola. A prevalência da UC varia entre 0,1 a 1,0%, sendo que em estudo recente foi encontrada prevalência de UC diagnosticada de 0,41% na população brasileira4.
A média de duração da urticária aguda é uma semana, sendo que a taxa de progressão da urticária aguda para crônica varia de 5% a 39%, na maioria dos estudos. A média de duração da urticária crônica é de 1 a 4 anos, sendo que a remissão espontânea ocorre em torno de 45% após 5 anos de doença. Em pacientes acompanhados em um centro de referência e excelência de urticária no Brasil a duração da UC no momento do diagnóstico foi de 24 meses, sendo a duração da doença em pacientes que entraram em remissão de 72 meses5. Outro centro brasileiro, relatou tempo médio de duração de 10,2 anos nos pacientes em acompanhamento6.
A recorrência dos sintomas da urticária ocorre em cerca de 1/3 dos pacientes. A UCInd apresenta duração maior que a UCE, variando entre os seus diversos subtipos3.
Aspectos fisiopatológicos
A urticária é predominantemente uma doença na qual o mastócito desempenha um papel central. A histamina e outros mediadores, como citocinas, liberados por mastócitos cutâneos ativados, levam à ativação de terminações nervosas sensoriais, vasodilatação e extravasamento de plasma, como também, recrutamento de células, como linfócitos T, eosinófilos e neutrófilos, para as áreas de lesão. Os estímulos que ativam os mastócitos na urticária são heterogêneos e incluem, por exemplo, citocinas derivadas de linfócitos T e autoanticorpos. Histologicamente, as urticas são caracterizadas por edema da derme superior e da derme média, com dilatação e aumento da permeabilidade de vênulas pós-capilares na derme superior1,3.
A reação de hipersensibilidade do tipo I está relacionada principalmente com as urticárias agudas, e ocorre pela interação específica entre anticorpos IgE fixados na superfície do mastócito e o alérgeno específico, levando à sua ativação. Medicamentos, alimentos e veneno de insetos são causas importantes deste tipo de reação3.
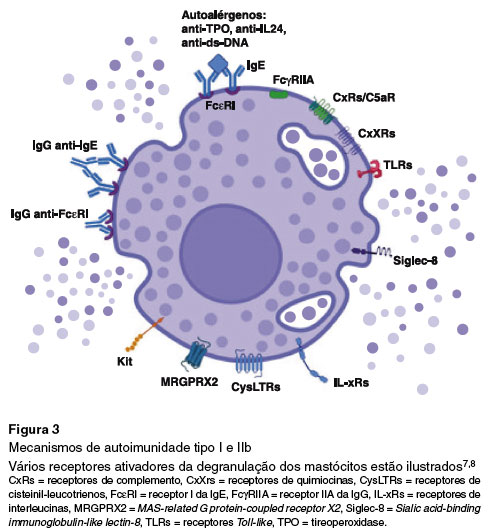
Embora a patogênese da UC não esteja esclarecida, na UCE, dois mecanismos patogênicos são propostos para a ativação dos mastócitos, e ambos envolvem mecanismos autoimunes. O primeiro é denominado UCE autoimune ou autoimunidade tipo IIb (UCEaiTIIb) e se caracteriza pela presença de imunoglobulinas G (IgG) anti-receptor de alta afinidade de IgE (FcεRI) ou IgG anti-IgE. O segundo mecanismo autoimune proposto é denominado UCE autoalérgica ou autoimunidade tipo I (UCEaiTI) e envolve a presença de IgE específica para autoalérgenos, sendo que os mais estudados e reconhecidos são tireoperoxidase (IgE anti-TPO) e interleucina-24 (IgE anti-IL-24)1,3 (Figura 3).
Diagnóstico da urticária
Diagnóstico da urticária aguda
A urticária aguda geralmente não necessita de avaliação diagnóstica complementar (Tabela 2). Na maior parte das vezes está associada a infecções virais (principalmente em crianças), mas pode também ocorrer espontaneamente, sem relação com um desencadeante específico (idiopática)9. As exceções ocorrem nos casos em que existe a suspeita de associação com alergia mediada por IgE. No caso da suspeita de alergia mediada por IgE, a realização de testes alérgicos cutâneos ou dosagem sérica de IgE específica devem ser considerados. Em nosso meio, alimentos, medicamentos e veneno de insetos himenópteros são causas relevantes de urticária IgE mediada10.
Os analgésicos e anti-inflamatórios não esteroidais (AINEs) são causa frequente de urticária aguda por mecanismos não IgE mediados. Muitas vezes a urticária por AINEs se manifesta apenas com angioedema, sem o aparecimento de urticas. É fundamental a investigação adequada destes casos, para que o paciente seja corretamente orientado e não ocorram novas reações11,12.
Cuidado especial deve ser considerado nos casos de urticária induzida por medicamentos, para que o paciente não seja erroneamente rotulado de alérgico a determinado medicamento sem uma investigação adequada11,13.
Diagnóstico da urticária crônica espontânea (UCE)
Os pilares do diagnóstico da UCE são a história clínica detalhada e o exame físico com evidência de urticas e/ou angioedema. Entretanto, uma investigação laboratorial básica poderá ser realizada com exames como hemograma completo, PCR e/ou VHS, dosagem de IgE total e IgG anti-TPO em todos os pacientes com UCE. Estes exames são importantes para excluir possíveis doenças associadas à urticária, tais como infecções crônicas, doenças linfoproliferativas, autoimunes e autoinflamatórias1. Além disso, a PCR é considerada um marcador útil para avaliar a atividade da urticária, já que níveis elevados de PCR podem estar diretamente associados a urticária mais grave14. A dosagem de IgE total e IgG anti-TPO são úteis na avaliação do endótipo autoimune e resposta ao tratamento. Contudo, apesar de não ser indicado uma investigação laboratorial extensa, outros exames poderão ser necessários, de acordo com a história clínica, exame físico e resultados dos exames de diagnóstico de rotina recomendados (Tabela 2)1.
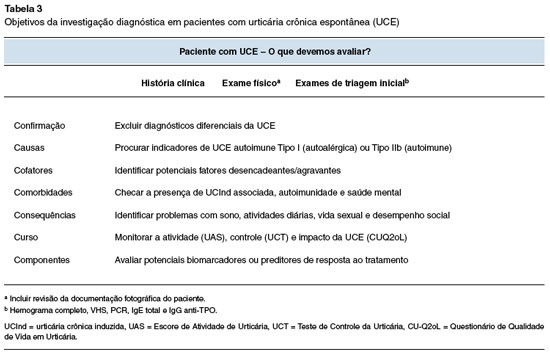
Na UCE, recomenda-se que a investigação diagnóstica seja baseada em sete objetivos principais (conhecidos como 7C): confirmar o diagnóstico e excluir diagnósticos diferenciais; procurar as causas subjacentes; identificar cofatores, ou seja, condições relevantes que modifiquem a atividade da doença; verificar comorbidades; identificar as consequências da UCE; avaliar preditores do curso da doença e resposta ao tratamento; e para monitorar o controle, atividade e o impacto da doença (Tabela 3)1,15.
Identificação de causas e fatores subjacentes
A determinação da causa subjacente da UCE permanece indefinida e desafiadora. Com base em evidências recentes, as principais hipóteses para a patogênese da UCE incluem autoimunidade (UCEaiTI e UCEaiTIIb). Na UCE, mecanismos ainda desconhecidos são relevantes para a desgranulação dos mastócitos na pele15,16.
A história e o exame físico podem fornecer pistas sobre as causas subjacentes. Entretanto, os resultados dos exames básicos realizados na pesquisa da UCE podem apontar para UCEaiTI ou UCEaiTIIb. Níveis elevados de PCR e reduzidos de eosinófilos e basófilos são indicativos de provável UCEaiTIIb. Dosagens de IgG-anti-TPO e IgE total devem ser incluídas na avaliação de pacientes com UCE, visto que pacientes com UCEaiTIIb são mais propensos a terem IgE total baixa e níveis elevados de IgG-anti-TPO1,16.
O teste de ativação de basófilos (BAT) quando positivo pode indicar UCEaiTIIb também, apresentando um valor preditivo positivo para o diagnóstico de 69%1,17,18. Entretanto, o BAT não é utilizado na prática, pois não é um exame de fácil acesso na maioria dos Centros Nacionais de Referência em Urticária.
O conhecimento sobre as condições relevantes que podem modificar a atividade da doença e fatores que agravam a UCE podem auxiliar médicos e pacientes a compreender a doença. Portanto, em toda consulta, os pacientes devem ser questionados sobre os fatores exacerbadores de UCE.
Os medicamentos podem exacerbar a UCE em um terço dos pacientes. Os AINEs são os mais comuns, com exceção dos inibidores seletivos e preferenciais da COX-2 e/ou paracetamol, que são considerados opções mais seguras em pacientes com UCE. Quando indicado, os pacientes devem ser aconselhados a evitarem os AINEs, para prevenção das exacerbações1,19,20.
Alguns alimentos podem exacerbar a UCE, funcionando como "pseudoalérgenos", uma vez que esses compostos de baixo peso molecular podem se ligar aos receptores MRGPRX2 nos mastócitos e ativá-los, culminando na liberação de seus mediadores21. Com base na resposta, as dietas com baixo teor de pseudoalérgenos e/ou alimentos ricos em histamina como peixes, frutos do mar, alimentos fermentados (bacon, queijo) e alguns vegetais (espinafre, berinjela, tomate) podem ser consideradas como uma medida diagnóstica e terapêutica adicional individualizada. Entretanto, vale salientar que essas dietas ainda são controversas, não devendo ser recomendadas como rotina, pois podem reduzir a qualidade de vida já comprometida nos pacientes com UCE. Se há suspeita de piora da UCE com um determinado alimento, recomenda-se que a dieta de exclusão para elucidar o diagnóstico seja mantida apenas por um período de 3-4 semanas1,15,22.
O estresse pode agravar os sintomas cutâneos em cerca de um terço dos pacientes com UCE. Os neuropeptídeos liberados pelo estresse podem ativar mastócitos através do receptor MRGPRX221. Os pacientes devem ser avaliados quanto ao impacto do estresse em sua doença e conscientizados de que a redução do estresse pode ser uma medida útil a ser adotada para o controle da urticária1,19.
Infecções virais agudas e bacterianas crônicas podem exacerbar UCE e modificar a atividade da doença. Contudo, há evidências que sugerem que as infecções virais crônicas, como a hepatite B ou C, não modulam a atividade da UCE. Assim, a busca de rotina por infecções por vírus crônicos não é recomendada. Quanto às infecções bacterianas crônicas, existem estudos sobre Helicobacter pylori (HP) com resultados heterogêneos e contraditórios. O efeito da erradicação do HP no curso da UCE ainda é controverso e a investigação da infecção do HP deve ser realizada de acordo com a história clínica. O papel da infecção fúngica na UCE ainda é mal definido, e sua prevalência e relevância precisam ser melhor estudadas19.
Identificação das comorbidades e consequências da UCE
Na UCE, as comorbidades mais comuns são as UCInd, doenças autoimunes (especialmente a doença autoimune da tireoide) e atopia. Doenças mentais, como os transtornos de depressão e ansiedade, disfunção sexual e distúrbios do sono são bastante frequentes. Os achados da história clínica, exame físico ou dos exames laboratoriais básicos que apontem uma comorbidade devem ser sempre avaliados19.
Identificação de preditores do curso de doença e resposta ao tratamento
Até o momento, não existem preditores definitivos da duração da doença, atividade ou resposta ao tratamento19. No entanto, na UCE, a duração, atividade da doença e resposta ao tratamento estão ligadas a características clínicas e marcadores laboratoriais que podem ajudar os médicos a aconselharem seus pacientes sobre a gravidade e a duração esperada da sua doença e resposta ao tratamento. História de UCInd associada; atividade elevada de doença (níveis de PCR e D-dímero elevados), e/ou presença de angioedema, por exemplo, indicam longa duração da UCE e pior resposta aos anti-histamínicos. Por outro lado, baixos níveis de IgE estão relacionados a menor resposta ao omalizumabe, enquanto BAT positivo e níveis de IgE baixos podem indicar boa resposta à ciclosporina14. Entretanto cabe ressaltar que níveis baixos de IgE total não contraindicam o tratamento com omalizumabe.
Diagnóstico das urticárias induzidas
As urticárias crônicas induzidas (UCInd) incluem as urticárias físicas e não físicas. As UCInds podem ser diagnosticadas por meio da história clínica, exame físico e da reprodução das lesões através dos testes de provocação23 (Tabela 2).
Dermografismo sintomático (ou urticária dermográfica)
Caracteriza-se pela ocorrência de urticas lineares e pruriginosas após pressão aplicada sobre a pele, que pode ser causada durante a fricção, o ato de coçar ou esfregar. Raramente é acompanhado de angioedema.
Essa é a forma mais comum de UCInd, presente em 2 a 5% da população geral, alcançando 30 a 50% dos casos de UCInd, além de estar frequentemente associada à UCE. Seu diagnóstico é confirmado por meio de uma pressão exercida sobre a pele com um objeto sem corte, de maneira suave, como uma espátula ou uma tampa de caneta romba, preferencialmente de forma padronizada com o FricTest® ou dermografômetro. O teste é considerado positivo se uma urtica pruriginosa ocorrer no local em até 10 minutos da provocação23.
Urticária de pressão tardia (UPT)
Pacientes com UPT desenvolvem urticas e/ou angioedema a partir de 4 a 6 horas de um estímulo de pressão sustentado na pele. As lesões podem surgir em 4 até 12-24 horas e podem durar até 72 horas.
Os testes de provocação incluem:
- apoio de alças de 3 cm com pesos de 7 kg sobre o ombro do paciente por 10 a 15 minutos; ou
- teste de Warin, o qual consiste na aplicação, durante 5 minutos, de uma bolsa, pesando 4 kg, e uma esfera de 1,5 cm de diâmetro sob a alça de 3 cm de largura para exercer pressão localizada, no 1/3 médio do antebraço;
- aplicação de hastes com peso posicionadas verticalmente sobre a pele e sobre anteparo em região dorsal, coxa ou antebraço;
- dermografômetro, aplicado perpendicularmente com 100 g/mm2 (981 kPa), durante 70 segundos, sobre a pele da região inferior da borda da escápula.
O resultado é considerado positivo quando há o desenvolvimento de urticas e/ou angioedema no local de pressão após 4-6 horas23.
Urticária ao frio
Urticária ao frio é definida pelo surgimento de urticas após exposição ao frio, seja por objetos sólidos, ar ou líquidos frios.
Os métodos de provocação para urticária ao frio incluem o clássico "teste do cubo do gelo" e o TempTest® 2,4.
- O "Teste do cubo de gelo" é realizado com a aplicação de um cubo de gelo, envolto em plástico, no antebraço do paciente durante 5 minutos. A leitura é realizada após 10 minutos, onde se observa, no local da aplicação do gelo, o surgimento de uma urtica.
- O TempTest® é um aparelho validado para o diagnóstico de pacientes com urticária ao frio e urticária ao calor, para medir seus limiares de temperatura e atividade da doença. Os testes de provocação de temperatura são realizados colocando o antebraço do paciente no elemento de temperatura do TempTest® durante 5 minutos. Uma resposta positiva é definida pelo surgimento de uma urtica de 2 mm de largura (a largura do elemento da temperatura TempTest®) 10 min após a provocação23.
Urticária ao calor
A urticária ao calor é uma forma rara de urticária induzida caracterizada por urticas que surgem logo após a exposição ao calor.
O diagnóstico é confirmado por meio da aplicação de um estímulo quente na pele da superfície volar do antebraço, por exemplo, com um cilindro de metal/vidro cheio de água quente ou banhos de água quente até 44 ºC, durante 5 minutos, com um período de observação de 10 minutos, ou pela utilização do TempTest® 23.
Urticária solar
Pacientes com urticária solar desenvolvem urticas rapidamente após a exposição da pele à luz solar (UVA, 320-400 nm; ou comprimentos de onda visíveis, 400-600 nm). Com menor frequência, as lesões são induzidas por UVB, 280-320 nm, ou radiação infravermelha > 600 nm.
Os testes de provocação são:
- lâmpada de projetor de slides (para luz visível);
- luz negra fluorescente (comprimentos de onda UVB e UVA);
- luz solar fluorescente (comprimentos de onda UVB e UVA); ou
- lâmpada infravermelha (comprimentos de onda infravermelhos).
A dose eritematosa mínima (DEM) de urticária pode ser determinada expondo uma área de 1 cm2 de pele a uma distância de 10 cm da fonte de luz, com leitura em 10 minutos23.
Urticária/Angioedema vibratório
Pacientes com urticária/angioedema vibratório apresentam prurido e urticas minutos após a pele ser exposta a estímulos vibratórios.
O teste de provocação para diagnóstico é realizado com vórtice misturador, apoiando o antebraço do paciente sob o punho e o cotovelo, de modo que a pele do antebraço, mão ou dedo repouse no copo de borracha do vórtice. O misturador vibra em uma velocidade constante entre 780 e 1380 rpm durante pelo 5 minutos, com leitura em 10 minutos23.
Urticária aquagênica
A urticária aquagênica é uma condição rara, desencadeada pelo contato com água, independentemente da sua temperatura. O diagnóstico é confirmado através da aplicação de uma compressa embebida em água a 35-37 ºC ou soro fisiológico colocado no tronco do paciente. Retira-se a compressa ou a toalha após 40 minutos ou mais precocemente, caso o paciente relate prurido ou se houver surgimento de pápulas no local do teste. O teste é positivo se as lesões se desenvolverem na área de contato dentro de 10 minutos após a retirada da toalha ou antes23.
Urticária colinérgica
Caracterizada pelo surgimento de urticas puntiformes, relacionadas à elevação da temperatura corporal a partir de exercício físico ou aplicação local de calor, além do estresse emocional, comidas apimentadas ou bebidas quentes.
O teste de provocação para confirmar urticária colinérgica também possui como objetivo descartar a anafilaxia induzida pelo exercício. É consenso que um aumento na temperatura corporal acima de 1ºC da linha de base, conforme indicado por um teste de aquecimento passivo, onde a pessoa permanece sentada por ≤ 15 min em um banho com água a 42 ºC, confirma o diagnóstico de urticária colinérgica.
Um protocolo padronizado para diagnosticar e medir os limiares de urticária colinérgica, usando a ergometria com controle da frequência cardíaca, tem sido proposto. O paciente se posiciona na bicicleta ou esteira ergométrica e inicia o exercício físico sendo instruído de maneira que a pulsação se eleve em 15 batimentos por minuto a cada 5 minutos, alcançando 90 batimentos por minuto acima do nível basal após 30 minutos. O tempo para o surgimento da urticária é inversamente proporcional à intensidade da doença, ou seja, quanto menor o tempo para o surgimento das lesões, mais grave é considerada a urticária colinérgica23,24.
Diagnóstico diferencial da urticária
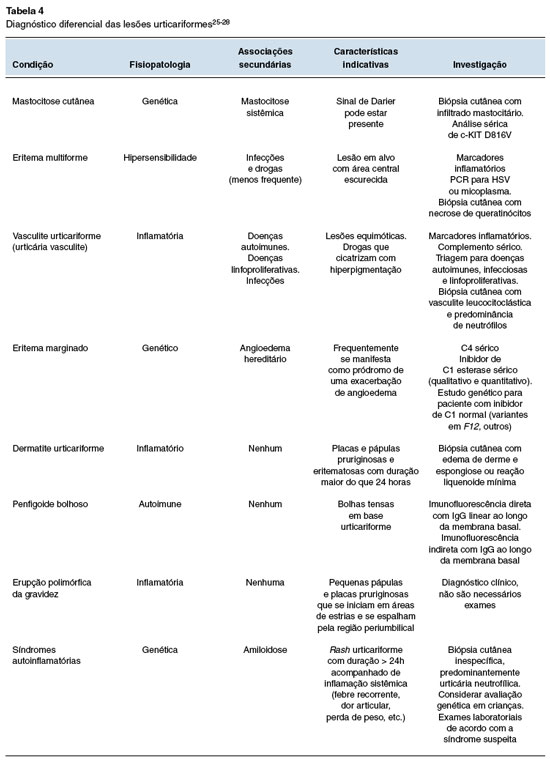
Lesões urticariformes e angioedema podem ser manifestações de outras condições além da urticária aguda e crônica espontânea (Tabela 4).
Um aspecto fundamental na definição do diagnóstico diferencial está relacionado ao aspecto das lesões. Em contraste com as urticas na urticária aguda ou crônica, outras lesões urticariformes podem parecer mais endurecidas, descoloridas ou escurecidas, durando mais do que 24 horas na maior parte das vezes, e evoluindo com lesão residual, geralmente hiperpigmentadas. Provocam uma sensação de dor ou ardor, com pouco ou nenhum prurido. Raramente estão acompanhadas pelo angioedema. Sintomas sistêmicos como artralgia, febre, mal-estar e perda de peso podem estar associados e devem ser investigados25.
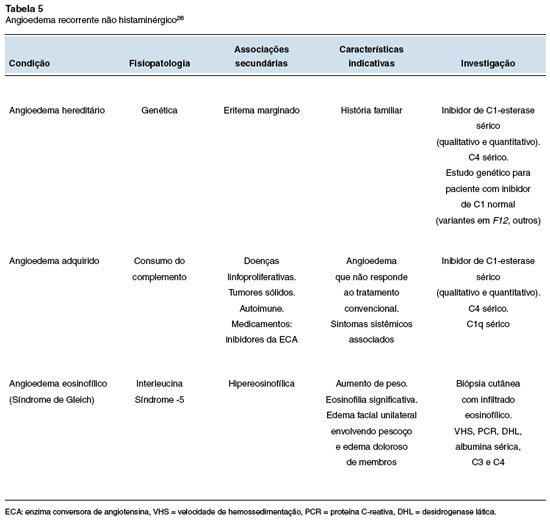
Em relação ao angioedema recorrente isolado, são sinais de alerta para o diagnóstico diferencial a ausência de resposta aos anti-histamínicos H1, corticosteroides e adrenalina (sugerindo mecanismo mediado por bradicinina), a observação de quadros semelhantes em outros membros da família (angioedema hereditário), assim como a presença de outros sintomas ou doenças, especialmente linfoproliferativas e colagenoses (angioedema adquirido). Considerar sempre a relação com o uso de medicamentos em casos de angioedema isolado recorrente, especialmente os inibidores da enzima conversora da angiotensina (mecanismo bradicinérgico) e os anti-inflamatórios não-esteroidais (mecanismo histaminérgico). A Tabela 5 mostra os principais diagnósticos a serem considerados em casos de angioedema isolado recorrente26.
Outras condições que podem cursar com edema e devem ser consideradas no diagnóstico diferencial do angioedema: infecções (celulite), síndrome de Melkersson-Rosenthal, dermatite de contato, doenças da tireoide e dermatomiosite26.
Avaliação da atividade, impacto e controle da urticária
A avaliação precisa do estado clínico, atividade e evolução da doença é imprescindível para a compreensão e controle adequado da urticária crônica, com redução do impacto na qualidade de vida em diferentes domínios da vida do paciente e aumento do seu bem-estar. Por isso, em 2011, a Global Allergy and Asthma European Network (GA2LEN) recomendou a utilização dos Patient Report Outcomes Measures (PROM) na avaliação da urticária crônica na prática clínica diária e nos estudos clínicos como desfecho primário29. Recomenda-se que o paciente seja avaliado quanto à atividade, impacto e controle da doença a cada visita médica30.
A urticária crônica compromete gravemente a qualidade de vida dos pacientes, devido a seus sintomas imprevisíveis, debilitantes e desconfortáveis que podem persistir por anos31.
Atualmente, ainda não existem dados suficientes que validem a utilização de biomarcadores laboratoriais isoladamente para identificar e medir a atividade da doença. Logo, o uso dos PROM são cruciais na avaliação e monitoramento do paciente. O uso destas ferramentas na prática clínica é importante por fornecerem dados objetivos, que deverão ser utilizados na tomada de decisão quanto ao tratamento mais adequado29,31,32.
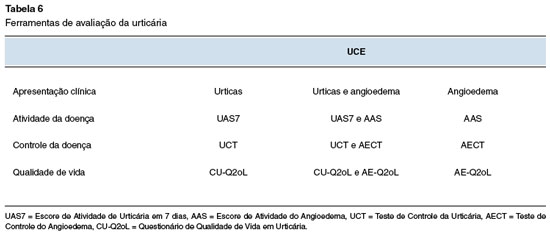
Existem seis instrumentos para avaliação da urticária crônica, que são: Urticaria Activity Score 7 (UAS7), Chronic Urticaria Quality of Life Questionnaire (CU-Q2oL), Urticaria Control Test (UCT), Angioedema Activity Score (AAS), Angioedema Quality of Life Questionnaire (AE-QoL) e Angioedema Control Test (AECT). Estes instrumentos são validados ou estão em processo de validação para o idioma português (cultura brasileira) (Tabela 6)33-38.
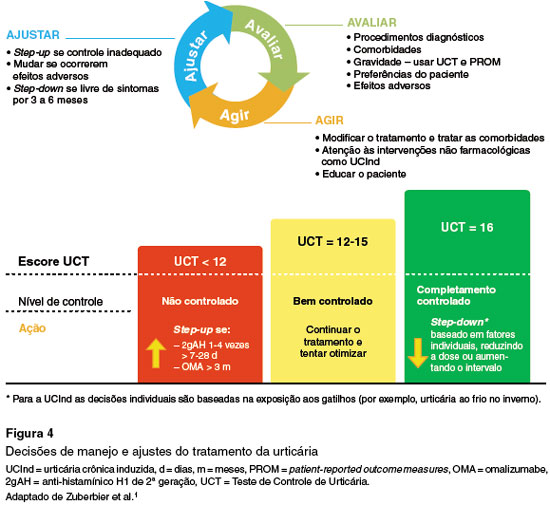
A principal ferramenta utilizada para aferir a atividade da urticária é o escore de atividade da urticária em 7 dias, Urticaria Activity Score (UAS7), um questionário baseado na avaliação prospectiva, por parte dos pacientes, dos sintomas (prurido e urticas) ao longo de sete dias consecutivos. O resultado corresponde ao somatório dos 7 dias, e o escore varia de 0 a 42. O UAS7 permite categorizar a intensidade da doença em: sem sintomas (0); bem controlada (1-6); leve (7-15); moderada (16-27) e grave (28-42)33. Considera-se adequado um UAS7 ≤ 6, mas preferencialmente igual a zero, que é o objetivo do tratamento dos pacientes com UC1.
Embora o UAS7 tenha se mostrado uma ferramenta útil, e se tornado o padrão ouro para a medida da atividade da doença em pacientes com UCE, apresenta algumas limitações: não contempla a presença de angioedema, não avalia a urticária crônica induzida (UCInd) e o controle da doença. Além disso, depende do comprometimento do paciente em preencher os dados corretamente32.
O UCT foi desenvolvido especificamente para avaliar o estado de controle da UC, complementando as deficiências do UAS7. É um questionário retrospectivo, que avalia o controle da urticária baseando-se na percepção do paciente nas 4 semanas prévias. O escore total mínimo é 0, e o máximo 16. Quanto maior a pontuação, melhor é o controle da doença, sendo o cut-off 12, ou seja, no escore igual ou acima de 12, a doença é considerada controlada31. O UCT avalia tanto a UCE como a UCInd, e considera também o angioedema. É uma ferramenta de fácil utilização na prática clínica e pode ser aplicado durante a consulta médica de rotina35,39.
O CU-Q2oL é uma outra ferramenta capaz de mensurar com eficácia o impacto da UC na qualidade de vida. O questionário possui 23 itens e deve ser respondido considerando-se as duas semanas anteriores à consulta. Cada pergunta apresenta 5 opções de resposta, de 1 (nada) a 5 (muitíssimo), com escore que varia de 23 a 115, sendo quanto maior, pior a qualidade de vida, com versão validada para o português. (cultura brasileira)34,40. Algumas limitações do CU-Q2oL são: permite avaliar apenas a UCE, mas não as UCInd; validado para utilização apenas em adultos; falta de categorização de gravidade e de perguntas mais específicas sobre o impacto do angioedema32.
O AAS é uma ferramenta simples e capaz de determinar a atividade da doença em pacientes com angioedema recorrente. Ele deve ser preenchido diariamente pelos pacientes através de cinco perguntas que devem ser respondidas se ocorrer angioedema nas últimas 24 horas. As perguntas se referem à duração dos sintomas, principais queixas, limitação das atividades diárias, prejuízo na estética corporal e intensidade dos sintomas, além de indiretamente observar os intervalos entre as crises. A resposta de cada questão varia de 0 a 3 pontos sendo 15 a pontuação máxima e reflete intensa atividade do angioedema41.
O paciente deve realizar o AAS por pelo menos 28 dias, pois a ocorrência de angioedema pode ser mais episódica do que a urtica. O paciente que apresenta UCE que se manifesta com urtica e angioedema dever ser orientado sobre as diferenças entre as duas lesões, pois se houver erro na avaliação, o AAS não irá aferir adequadamente a atividade do angioedema41.
O AE-QoL é o primeiro instrumento validado para medir o impacto na qualidade de vida de pacientes com angioedema recorrente. Apresenta 17 perguntas, cada uma com 5 opções de resposta, de 1 (nunca) a 5 (muito frequentemente), com escore que varia de 17 a 85, com uma pontuação maior indicando maior comprometimento da qualidade de vida relacionada à saúde, com versão validada para o português (cultura brasileira)36,37. As principais limitações do AE-QoL são: extensão, por ser longo pode dificultar a sua aplicação na prática diária; fornece apenas informações sobre o angioedema, devendo ser complementado com ferramentas específicas para urticária; e o paciente pode confundir angioedema com urtica, comprometendo a avaliação32.
Recentemente, foi desenvolvido o AECT, primeira ferramenta para avaliação do controle da doença em pacientes com qualquer tipo de angioedema recorrente. É composto por quatro questões, relacionadas à frequência, qualidade de vida, imprevisibilidade da doença e tratamento, com escore de 0 a16, onde 16 é controle total, sendo que um escore ≥ 10 significa bom controle, e < 10 a falta de controle. No Brasil, o AECT está em processo de validação38.
Tratamento
Objetivos do tratamento
O principal objetivo do tratamento da UC é alcançar, sempre que possível, o controle completo dos sintomas, permitindo que o paciente possa ter a melhor qualidade de vida e, consequentemente, exercer suas atividades diárias sem prejuízos ou limitações1. O tratamento deve seguir os princípios básicos de tratar o quanto for necessário e o mínimo possível, desde que os sintomas se mantenham controlados. Do ponto de vista prático, considera-se que a urticária está sob controle com UCT ≥ 12 e/ou UAS7 ≤ 6), e UCT = 16 e UAS7 = 0 é a ausência de sintomas42. Uma vez atingido o controle da doença, a redução do tratamento deverá ser considerada, para diminuir a carga terapêutica e avaliar a remissão espontânea. O tratamento deve ser mantido até que a urticária entre em total remissão. Para isso é importante que o paciente seja reavaliado regularmente (Figura 4).
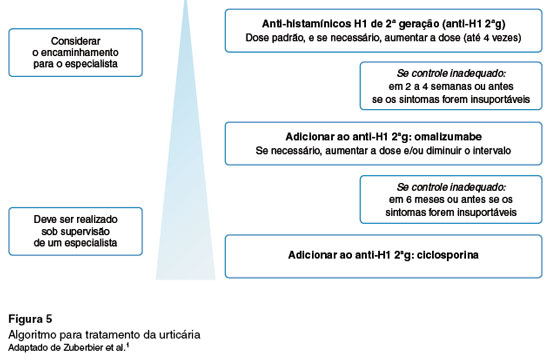
Primeira linha de tratamento: anti-histamínicos não-sedantes de segunda geração
Recomenda-se os anti-histamínicos não-sedantes de segunda geração como terapia de primeira linha na urticária. Pacientes refratários devem ser tratados com doses aumentadas em até quatro vezes a dose padrão.
A terapia de primeira linha para o tratamento da urticária aguda e crônica são os anti-histamínicos H1 de segunda geração (anti-H1 2ªg), com um excelente perfil de segurança em todos os grupos etários, apresentando nenhum ou mínimo efeito sedativo e livres de efeitos anticolinérgicos43,44.
Em comparação com os anti-histamínicos de primeira geração (anti-H1 1ªg), os anti-H1 2ªg têm efeitos anti-inflamatórios por inibir a liberação de citocinas de mastócitos e basófilos, meia-vida mais longa e menor lipossolubilidade, ultrapassando minimamente a barreira hematoencefálica45. Além disso, os anti-H1 1ªg não são recomendados, devido ao seu perfil de segurança, pois podem apresentar efeitos anticolinérgicos e sedativos, assim como interação com álcool e outros fármacos, como analgésicos e hipnóticos. Também podem interferir no sono REM, afetar o aprendizado e desempenho nas atividades do cotidiano como, por exemplo, dirigir1,46. De modo geral, a meia-vida no sistema nervoso central dos anti-H1 1ªg é maior que no sangue periférico, e desse modo a duração dos efeitos adversos desses medicamentos é maior do que o efeito anti-histamínico46.
Há evidências que suportam o uso da maioria dos anti-H1 2ªg no tratamento da urticária, mas não há estudos bem delineados que comparem a eficácia e segurança entre as diferentes drogas. Estudos mostraram o benefício e a segurança dos anti-histamínicos bilastina, cetirizina, levocetirizina, desloratadina, ebastina, fexofenadina e rupatadina em doses de até quatro vezes as doses padrão indicadas em bula1.
Na urticária aguda o tempo recomendado de tratamento com os anti-H1 2ªg é de duas a três semanas. Entretanto, casos mais graves podem necessitar de doses de anti-histamínico maior do que a licenciada e curso de corticosteroide sistêmico, tais como prednisona ou prednisolona na dose de 1 mg/kg/dia por sete a 10 dias1,47. Em todos os tipos de urticária crônica, o anti-H1 2ªg deve ser mantido pelo tempo suficiente para controle total dos sintomas até que a urticária entre em remissão1.
O início do tratamento com anti-H1 2ªg deve ser com a dose licenciada em bula, e se essa não for suficiente para controlar os sintomas, deve ser duplicada ou até quadruplicada. Um período de duas a quatro semanas geralmente é suficiente para observar o benefício da dose prescrita (Figura 5). Não existem evidências de que associar diferentes anti-histamínicos proporcione melhor controle da urticária. É importante salientar que o uso de um mesmo anti-histamínico em doses altas demonstrou ser superior à combinação de diferentes anti-histamínicos no controle do prurido1,48,49.
Aproximadamente 61% dos pacientes com UCE não respondem às doses licenciadas de anti-H1 2ªg, e, destes, 63% não se beneficiam de doses mais altas, necessitando terapia de segunda linha com o imunobiológico anti-IgE, omalizumabe1,3,50.
Segunda linha de tratamento: omalizumabe
Recomenda-se adicionar o omalizumabe ao tratamento de pacientes com urticária crônica refratários aos anti-histamínicos de segunda geração em dose quadruplicada.
O omalizumabe é o primeiro medicamento biológico licenciado para o tratamento de pacientes adultos e adolescentes (≥ 12 anos) com UCE refratária aos anti-H1 2ªg1.
É um anticorpo monoclonal (IgG1) humanizado recombinante, que se liga ao terceiro domínio da cadeia pesada (CH3 ou Ce3) da IgE livre, mesmo local pelo qual a IgE liga-se ao receptor de alta afinidade (FcεRI), na superfície de mastócitos e basófilos, impedindo a liberação de mediadores inflamatórios50,51.
O mecanismo de ação do omalizumabe ainda não está completamente esclarecido, entretanto, a ligação do omalizumabe (IgG1) às moléculas de IgE circulantes impede que estas moléculas se liguem aos seus receptores de alta afinidade nos mastócitos e basófilos. Com isso, os mastócitos não são ativados, não liberam mediadores pró-inflamatórios e não atraem mais células, como eosinófilos, para o local. Para os pacientes que respondem ao omalizumabe, podemos observar o retorno destas células para a periferia, normalizando os níveis de eosinófilos e basófilos, ou seja, revertendo a eosinopenia e basopenia observadas na atividade da doença. Além disso, com a ligação das IgEs circulantes pelas moléculas do omalizumabe, há a redução de expressão dos receptores de alta afinidade nos mastócitos e basófilos, reduzindo ainda mais a atividade destas células. Consequentemente, os pacientes com UCE autoalérgica ou tipo I apresentariam resposta mais rápida ao omalizumabe (respondedores precoces), e, por outro lado, os pacientes com UCE autoimune ou tipo IIb seriam os respondedores tardios, por depender mais provavelmente da redução da expressão de receptores de alta afinidade nas membranas de mastócitos e basófilos, sendo mais lento para mastócitos, levando cerca de 70 dias para atingir redução comparável aos indivíduos sem a doença52.
O omalizumabe está disponível na apresentação de solução injetável em frasco-ampola (150 mg/frasco) e seringa preenchida (75 mg e 150 mg). A dose recomendada é de 300 mg a cada 4 semanas, sendo a aplicação por via subcutânea na região do deltoide, abdominal ou coxa. Pacientes sem história de anafilaxia podem autoadministrar ou receber administração por um cuidador a partir da 4ª dose em diante, sob recomendação médica. A dose recomendada é independente dos níveis de IgE sérica, assim como do peso do paciente1.
Não existe recomendação para o monitoramento laboratorial de rotina para o início do tratamento com o omalizumabe na UCE. Entretanto, a dosagem da IgE sérica total antes do tratamento é recomendada, pois níveis abaixo de 40 UI/mL desse anticorpo sugerem resposta insatisfatória ao tratamento53,54.
Atualmente é possível identificar dois grupos distintos de respondedores ao tratamento com omalizumabe na UCE. Os respondedores rápidos, que controlam os sintomas entre 4 e 6 semanas após o início do tratamento, e os tardios, que respondem geralmente entre 12 e 16 semanas55. Logo, a ausência de resposta ao tratamento com omalizumabe não deve ser considerada antes de no mínimo 6 meses de tratamento54. Entretanto, aproximadamente 30% dos pacientes em uso de omalizumabe permanecem não controlados com as doses licenciadas da medicação, mesmo após um período de tratamento superior a 6 meses53.
O manejo ideal dos pacientes refratários ao omalizumabe não foi estabelecido. O último guideline internacional sugere o incremento da dose gradualmente para 450 mg/4 semanas até 600 mg/2 semanas, de acordo com a avaliação da atividade e controle da doença. Doses superiores não estão recomendadas pela ausência de evidências clínicas. Outra possibilidade é a diminuição do intervalo de aplicação da medicação para 2 semanas50.
Não há biomarcadores que indiquem remissão da urticária, e o tempo total de duração da terapia com o omalizumabe não é bem estabelecido na UCE, devendo-se retirar o biológico após controle completo dos sintomas, para avaliar a possibilidade de remissão da doença. Portanto, após o controle total da UCE (UCT = 16) por período igual ou superior a 6 meses, a decisão de descontinuação deve ser individualizada.
Estratégias que podem ser adotadas para a descontinuação da terapia com o omalizumabe na UCE:
1. interromper a terapia imediatamente após o controle completo dos sintomas, manter o paciente sob vigilância, e retratá-lo em caso de recidiva da doença;
2. aumentar os intervalos das doses semanalmente até o intervalo de 8 semanas, e interromper o tratamento.
O omalizumabe é uma droga segura, com poucos efeitos colaterais, sendo os mais frequentes: dor no local da aplicação, cefaleia e artralgia56,57. Casos muito raros de anafilaxia foram descritos e ocorreram nos primeiros três meses de tratamento58,59. Logo, a administração das três primeiras doses deve ser realizada em ambiente médico-hospitalar. A partir da 4ª dose a administração pode ser domiciliar53.
O omalizumabe não está licenciado para o tratamento da urticária crônica induzida (UCInd). No entanto, várias publicações, inclusive uma revisão sistemática de mais de 40 estudos incluindo vários ensaios clínicos randomizados e controlados iniciados por investigadores, demostraram que o tratamento com omalizumabe em pacientes com UCInd resulta em resposta substancial ou completa na maioria dos casos60. A maior eficácia foi observada para urticária ao frio, dermografismo sintomático, urticária solar, urticária ao calor, urticária de pressão tardia e urticária colinérgica60. Poucas evidências estão disponíveis em relação às urticárias vibratória, aquagênica e de contato, provavelmente por serem condições mais raras60. Diferente da UCE, a dose para o tratamento da UCInd não está totalmente definida. Muitos estudos demonstraram que uma dose menor de 150 mg/4 semanas foi suficiente para obter uma boa resposta, e em outros, doses mais altas geralmente parecem ser mais eficazes60,61. Portanto, mais estudos clínicos controlados são necessários.
Terceira linha de tratamento: ciclosporina A
Recomenda-se adicionar a ciclosporina A para o tratamento de pacientes com urticária crônica que não respondam a altas doses de anti-histamínico H1 de segunda geração e omalizumabe.
A ciclosporina A (CsA) inibe a atividade da calcineurina, diminuindo a produção de IL-2, IL-3, IL-4, TNF-α e outras citocinas inflamatórias, inibindo os linfócitos T ativados. A IL-4 está relacionada à produção de IgE, e a ciclosporina pode diminuir a degranulação dos mastócitos, diminuindo, assim, a liberação de histamina mediada por IgE62.
A CsA pode ser usada para o tratamento da UCE grave, refratária aos anti-histamínicos e omalizumabe. Apesar do seu uso ser off-label no tratamento da urticária, existem evidências de boa qualidade que sustentam esta indicação, mostrando eficácia em cerca de 65%63.
A dose preconizada é de 3 a 5 mg/kg/dia e os efeitos adversos são dose e tempo de tratamento dependentes, ocorrendo em mais de 50% dos pacientes tratados com doses moderadas (4 a 5 mg/Kg/dia)47. Os principais efeitos colaterais que devem ser monitorados são a hipertensão, neuropatia periférica e aumento da creatinina sérica64. A ciclosporina não deve ser usada por período prolongado e em doses elevadas, uma vez que existe o risco de malignidade, como câncer de pele não melanoma e maior incidência de infecções64.
Não há um consenso quanto à melhor estratégia a ser adotada: iniciar o tratamento com uma dose mais baixa e aumentar se necessário, ou iniciar com uma dose mais alta e reduzir de acordo com o controle dos sintomas. No entanto, pela experiência dos autores, é mais seguro o tratamento com doses mais baixas, que podem ser aumentadas na ausência de resposta satisfatória.
É importante notar que não existem estudos comparativos diretos que avaliem a eficácia da CsA em relação ao omalizumabe, mas uma análise retrospectiva de pacientes tratados com uma ou outra droga demonstrou que a ciclosporina é menos eficiente no controle dos sintomas da UCE65. Por esta razão, mas principalmente devido ao risco potencial de efeitos adversos graves, recomenda-se que a CsA seja indicada apenas aos pacientes que não respondem ao tratamento com o omalizumabe1.
Em um estudo recente, realizado na Turquia, observou-se que os pacientes respondedores à CsA apresentavam com mais frequência PCR elevada, história familiar de urticária, teste do soro autólogo positivo, eosinopenia, basopenia, VHS elevado, níveis mais elevados de IgG anti-TPO, níveis mais baixos de IgE total e também maior atividade e pior controle da doença, que são características associadas à aiTIIb66.
As contraindicações absolutas e/ou relativas ao uso da CsA incluem: reações de hipersensibilidade, malignidade concomitante (exceto câncer de pele não melanoma), hipertensão não controlada, doença renal, infecção não controlada e gravidez/lactação64.
Antes de iniciar o tratamento, os pacientes devem ser avaliados em relação a parâmetros clínicos e laboratoriais que orientam quanto às possíveis contraindicações. De forma semelhante, estes parâmetros também são úteis na monitorização de potenciais efeitos colaterais relacionados ao uso, tais como hipertensão arterial, alteração de função renal e hepática65,67.
Os pacientes elegíveis para ciclosporina devem realizar avaliações da pressão arterial em duas ocasiões separadas e se submeter a exames laboratoriais que incluem a dosagem sérica da ureia e creatinina, hemograma completo, magnésio, lipídios, potássio e ácido úrico, além do hepatograma. Durante o tratamento, estes exames laboratoriais devem ser avaliados mensalmente, assim como cada vez que houver um ajuste de dose67.
Corticosteroides sistêmicos no tratamento da urticária
Os corticosteroides sistêmicos não são recomendados para uso por longo prazo no tratamento da urticária.
Os corticosteroides sistêmicos podem ser considerados em curso curto para o controle de exacerbação da urticária crônica.
Os corticoides tópicos não devem ser usados na urticária.
Os corticosteroides (CO) exercem efeitos amplos sobre várias células do organismo. No sistema imune são anti-inflamatórios e imunossupressores, dependendo da dose. O mecanismo de ação mais conhecido envolve a ligação dos CO com seu receptor intracelular, e ao se deslocar ao núcleo celular regula a transcrição, inibindo ou estimulando muitos genes. Este mecanismo, clássico, ocorre após algumas horas da administração dos CO sistêmicos. Estudos recentes têm demostrado um fato observado na prática, uma ação mais rápida destes medicamentos. Este mecanismo, não genômico e mais rápido, ainda não está completamente esclarecido e pode envolver uma ação do seu receptor sobre outras vias de sinalização ou, até mesmo, a ligação dos CO a outros receptores membrana68,69.
O tratamento de primeira linha da urticária na emergência são os anti-H1 2ªg. Em situações mais graves, com urticas disseminadas e/ou angioedema, a combinação com CO sistêmico é aceitável. Apesar desta associação ser frequentemente utilizada, carece de evidências robustas de eficácia, visto que alguns estudos não mostraram eficácia do uso do CO sistêmico na urticária aguda70,71. Na alta da emergência, prescrever anti-H1 2ªg, caso necessário, é o tratamento de escolha, na dose de um a quatro vezes ao dia, de acordo com a necessidade. CO oral pode ser associado, por 7 a 10 dias, na dose de 0,5 a 1 mg/kg/dia (20 a 60 mg de prednisona ou prednisolona em adultos). A associação do CO oral a baixas doses de anti-H1 2ªg não é recomendada, porém pode ser indicação na ausência de resposta à dose quadruplicada do anti-H1 2ªg. Além disso, cursos repetidos de CO devem ser evitados9,70.
Na urticária crônica, os CO sistêmicos podem ser usados por períodos curtos, conforme descrito acima, para o controle de exacerbações. Os CO não devem ser usados por períodos longos, pois seus riscos são muito superiores aos seus possíveis benefícios. O uso prolongado dos COS está associado a vários efeitos colaterais graves, entre eles a supressão eixo hipotálamo-hipófise-adrenal, osteoporose com risco de fraturas, distúrbios metabólicos e cardiovasculares como diabetes e oculares, além de maior risco de infecções1,72.
Outros tratamentos para a urticária
Não são recomendadas outras formas de terapias para UCE no momento. No entanto, se o paciente não responder às opções terapêuticas sugeridas pelo algoritmo de tratamento discutido acima, é possível considerar alternativas que incluem imunossupressores, como metotrexato (MTX), azatioprina, micofenolato de mofetil (MMF) e hidroxicloroquina, sendo seu uso off-label na UCE e os estudos com esses medicamentos são pequenos, não controlados e com evidência baixa para sua indicação73. Em ensaios clínicos randomizados, o MTX não demonstrou eficácia como terapia aditiva aos anti-histamínicos. A azatioprina mostrou-se eficaz em casos refratários, enquanto o MMF, em estudos menos robustos, apresentou melhora dos sintomas e redução de prurido e urticas em pacientes resistentes a anti-histamínicos e corticosteroides. Da mesma forma, a hidroxicloroquina, apresenta evidências de redução de sintomas, e melhora da qualidade de vida73,74.
A dapsona é um antibiótico da classe das sulfonas, que demonstrou alguma efetividade no tratamento da UCE. Estudos mostraram resposta positiva após 3 meses de uso combinado com cetirizina, com efeito médio duradouro de 1 ano, além de alívio do prurido e da gravidade. Outras terapias, como a terapia com soro autólogo e a imunoglobulina intravenosa (IVIG), tiveram resultados variados. No entanto, ensaios clínicos randomizados são necessários para validar a eficácia da IVIG na melhora da atividade da urticária74.
A identificação de diversas vias moleculares na fisiopatologia da UCE tem permitido um avanço mais preciso no desenvolvimento de novas terapias. Os imunobiológicos destacam-se como uma classe promissora nesse contexto. Um exemplo é o omalizumabe, um medicamento com ação anti-IgE, com eficácia comprovada e vasto uso na UCE. Vários biológicos, como dupilumabe e barzolvolimabe, e outros novos medicamentos, como os inibidores da tirosina quinase de Bruton (fenebrutinibe e remibrutinibe), surgiram como potenciais tratamentos e estão atualmente sob investigação em ensaios clínicos randomizados. Em breve haverá mais opções terapêuticas para pacientes com UCE refratária74.
Tratamento em populações especiais
Crianças
O tratamento da UC em crianças segue o mesmo algoritmo recomendado para os adultos, sendo os anti-H1 2ªg os medicamentos de escolha na dose de acordo com o peso e a idade. Se houver controle insuficiente dos sintomas após 2 a 4 semanas de tratamento, é recomendado o aumento da dose licenciada em até quatro vezes1.
Apesar do aumento de dose ser uma conduta que exiga cautela, a eficácia dessa medida já foi demonstrada na população pediátrica, com taxas de controle dos sintomas que variam de 35% a 92%7577. Existem poucos estudos randomizados placebo-controlados que testaram a segurança das doses aumentadas dos anti-H1 2ªg em até 4 vezes nas crianças, mas a maioria demonstrou perfis semelhantes de segurança nos diferentes grupos de dose7880.
Na escolha do anti-H1 2ªg, deve-se considerar a idade e peso da criança, além da apresentação do medicamento, uma vez que nem todos estão disponíveis em solução, gotas ou xarope. A idade mínima para uso também varia, sendo a menor idade disponível a partir dos 6 meses. Os anti-H1 2ªg recomendados e disponíveis no Brasil para essa faixa etária são: bilastina, cetirizina, desloratadina, fexofenadina, levocetirizina e loratadina (Tabela 7). É importante lembrar que ao utilizar doses aumentadas de loratadina, deve-se monitorar a função hepática regularmente1. Os anti-H1 1ªg não devem ser utilizados em nenhuma etapa do tratamento, pois atravessam a barreira hematoencefálica, levando a prejuízo na fase REM do sono e no aprendizado escolar, além de poderem causar excitabilidade paradoxal, ganho de peso e constipação1,62. Os corticosteroides também não devem ser utilizados de forma crônica devido aos seus efeitos colaterais, sendo indicados de forma restrita nas crianças, em ciclos curtos de acordo com o peso1.
Nos casos refratários aos anti-histamínicos, a terapia com anti-IgE (omalizumabe) 300 mg a cada 4 semanas é recomendada e aprovada em bula para crianças a partir de 12 anos com UCE, assim como nos adultos1. Apesar da literatura ainda carecer de estudos controlados de eficácia e segurança de omalizumabe em crianças com urticária crônica menores de 12 anos, estudos e série de casos com essa faixa etária observaram boa resposta deste tratamento, com pouco ou nenhum evento adverso reportado. Nestes estudos, a frequência de controle completo dos sintomas variou de 46% a 81%, com controle parcial de 10% a 46%, e tempo médio de resposta ao tratamento de 4 semanas a 3 meses. As doses utilizadas variaram de 75 mg a 450 mg a cada mês8286. Ainda que seja uma conduta off-label, a partir dessas experiências publicadas é possível utilizar omalizumabe nos casos de crianças com UCE refratária em crianças acima de seis anos em doses de 150 mg a 300 mg e considerar a mesma estratégia de aumentar dose ou encurtar os intervalos de aplicação para respondedores parciais.
Nos casos refratários ao uso de anti-histamínicos e omalizumabe, a CsA está indicada e alguns estudos sobre seu uso na população pediátrica demonstram eficácia e segurança, auxiliando também no desmame do uso crônico de corticosteroides. A dose de tratamento pode variar de 3-4 mg/kg/dia administrada 2 vezes ao dia, podendo ser reduzida gradualmente a partir do momento em que houver controle da urticária por 1 a 3 meses. Nos pacientes tratados com CsA nos estudos pediátricos, a resolução completa dos sintomas ocorreu entre 2 dias e 3 meses do início do tratamento, e pouco ou nenhum evento adverso foi observado87,88.
A maioria dos efeitos colaterais da CsA está relacionada com o aumento de dose e longa duração de tratamento (hipertensão, elevação da creatinina, sintomas gastrointestinais, cefaleia, hirsutismo, infecções e parestesia). Por isso, é importante monitorar eventos adversos pelo menos a cada 4 semanas, ajustar a dose de CsA quando houver controle da urticária e evitar utilizá-la por tempo prolongado89.
Assim como os adultos, nem todas as crianças apresentarão bom controle dos sintomas com as opções de tratamento recomendadas no algoritmo. Staubach e cols. publicaram dois casos de crianças com resposta insuficiente à CsA tratadas com sucesso com dupilumabe 300 mg off-label. Nessa publicação, os autores sugerem que em crianças com altos níveis de IgE não respondedoras ao omalizumabe e CsA, o uso de dupilumabe pode ser uma opção, em dose adaptada pelo peso de 200 mg ou 300 mg a cada 2 semanas90.
Não há evidência suficiente para recomendar o uso de outros imunossupressores nas crianças com urticária crônica. O metotrexato, por exemplo, possui eficácia incerta na UCE e não há dados disponíveis acerca do seu uso em crianças com UC91. Considerando os mecanismos de autoimunidade da urticária, também não há evidência clara de que o tratamento de doenças autoimunes da tireoide possa impactar o curso natural da urticária crônica em crianças. Porém, a terapia de reposição hormonal é indicada na prática clínica e pode ter algum efeito positivo na UC92.
É fato que ainda existem dados limitados sobre o uso de altas doses de anti-H1 2ªg, omalizumabe e ciclosporina em crianças com urticária crônica. Entretanto, os estudos existentes atualmente indicam que o tratamento de acordo com o algoritmo é efetivo e seguro nessa população se realizado com bom juízo, respeitando as doses para idade e monitorando eventos adversos.
Gestantes e lactante
A urticária crônica afeta principalmente mulheres em idade fértil, e a gravidez pode agravar a atividade de doença93,94.
Durante a gravidez, pode haver melhora da doença em metade das pacientes e piora em um terço. Algumas podem apresentar exacerbações, principalmente no primeiro e terceiro trimestres, o que demostra um predomínio da resposta Th1 e sinais pró-inflamatórios, que ativam o mastócito. Os fatores de risco relevantes para a piora da doença durante a gestação foram doença leve antes da gravidez e receber tratamento durante o período gestacional. Metade das pacientes que relataram melhora da doença durante o período, referiram piora após o parto; enquanto metade das pacientes que referiram piora no período não notaram diferença após o parto93.
A diretriz internacional para urticária orienta o mesmo tratamento padrão para gestantes e lactantes com UC, ou seja, iniciar com a dose licenciada de anti-H1 2ªg, aumentar a dose até quatro vezes, caso não haja resposta, e adicionar o omalizumabe em pacientes refratárias1.
Não há relatos de defeitos congênitos em gestantes que usaram anti-H1 2ªg, sendo preferível utilizar loratadina e cetirizina, com possível extrapolação para desloratadina, bilastina e levocetirizina. Eles são secretados no leite materno em baixa concentração. Os anti-histamínicos de primeira geração devem ser evitados tanto na gravidez quanto na lactação1. É importante discutir com as pacientes os riscos e benefícios do tratamento, já que não há dados de segurança para o aumento da dose de anti-H1 2ªg em gestante e lactante, mas não tratar a doença pode ser perigoso, já que o encaminhamento para a emergência por exacerbação da UC foi um fator de risco independente para o parto prematuro95,96.
O omalizumabe pode ser uma opção segura e eficaz em grávidas, mulheres que desejam engravidar e lactantes com UCE. Não há evidência de que o uso da medicação aumentou o risco de eventos adversos em grávidas e em seus filhos1,94,97,98. O omalizumabe é transferido através do leite materno em quantidade mínimas e não há relatos de complicações ao feto durante a amamentação99.
Mais estudos são necessários para estabelecer a segurança do tratamento em longo prazo da UCE nessa população especial94.
Idosos
A Organização Mundial da Saúde e as Nações Unidas definem idoso como idade ≥ 60 anos e idade ≥ 65 anos, respectivamente. Nos últimos anos, as pessoas estão vivendo mais devido às inovações tanto na tecnologia quanto na medicina moderna100. A urticária crônica é uma das condições pruriginosas mais comuns na população idosa e a prevalência da doença nessa população varia entre 0,2-2,8%. Entre todos os pacientes com UC, 4,1-5,5% são idosos100.
A média de idade no diagnóstico de urticária crônica foi de 72 ± 5,9 anos nessa população e o tempo de encaminhamento ao especialista foi de 22,8 ± 53 meses a partir do início dos sintomas101. A UCE foi o subtipo mais comum entre os idosos, e em relação às UCInd, o dermografismo sintomático foi relatado como o mais comum. Além disso, quando comparada a população adulta com a idosa, foi observada uma menor taxa de atopia nessa população, além de maior prevalência de comorbidades relacionadas à idade, incluindo síndrome metabólica, distúrbios autoimunes e malignidades, uma menor taxa de angioedema associado e menor positividade nos testes cutâneos de soro autólogo100.
Em relação às comorbidades, Lapi e cols. relataram que o risco de desenvolver UC está relacionado a inúmeros fatores. As doenças gastrointestinais, sendo a doença concomitante mais comum, juntamente com doenças coronarianas, doenças cerebrovasculares, síndrome metabólica, doenças autoimunes, doenças da tireoide, problemas psicológicos e malignidades, foram todas relatadas em altas taxas em UC nos idosos100.
Atualmente, os procedimentos diagnósticos e terapêuticos da urticária crônica no paciente idoso são os mesmos indicados para outras faixas etárias102. Logo, o tratamento da UC em pacientes idosos geralmente segue as mesmas diretrizes da população em geral100.
O processo de envelhecimento pode interferir na farmacocinética e na farmacodinâmica, resultando em diferentes respostas ao tratamento102, sendo que a polifarmacoterapia implica em interações medicamentosas que podem causar problemas na segurança medicamentosa, além de aumentar o risco de baixa adesão ao tratamento e, como consequência, eficácia terapêutica abaixo do ideal e resultados clínicos ruins103. Portanto, a seleção do medicamento e da dose para pacientes idosos deve ser considerada com cuidado devido a possíveis interações medicamentosas ou efeitos adversos104.
Os anti-H1 2ªg são recomendados como tratamento de primeira linha para UC em idosos, sendo a dose regular geralmente suficiente para atingir o controle clínico na maioria dos pacientes100. O aumento das doses de anti-histamínico até doses quadruplicadas, também demonstrou boa eficácia100. No entanto, idosos com múltiplas comorbidades ou disfunção renal/hepática, muitas vezes necessitam realizar ajuste de doses a depender da escolha do anti-histamínico. A bilastina se mostrou segura para esses pacientes104.
Para pacientes que falham com anti-histamínicos, o controle bem-sucedido dos sintomas foi obtido com o uso de omalizumabe100. Em casos recalcitrantes, outros diagnósticos relacionados a condições médicas subjacentes devem ser considerados100 e devemos salientar que esses diagnósticos diferenciais podem ser mais difíceis, devido à probabilidade de outras patologias peculiares a esta faixa etária102.
Não existem dados bem definidos que ajudem a prever o risco de recorrência de urticária após a interrupção do omalizumabe em pacientes idosos com urticária crônica espontânea, no entanto, o nível sérico basal de IgG anti-TPO e a relação IgG anti-TPO/IgE total podem servir como preditores de recorrência de UCE após a interrupção do omalizumabe em pacientes idosos105.
Conclusão
A urticária é uma doença inflamatória comum e heterogênea da pele, que se apresenta de forma aguda ou crônica. Na forma crônica, apesar de não apresentar alta mortalidade, há grande impacto na qualidade de vida e bem-estar dos pacientes. O conhecimento do seu diagnóstico diferencial auxilia na redução da taxa de diagnósticos incorretos, levando ao manejo adequado. O algoritmo de tratamento recomendado pelas diretrizes internacionais leva ao controle na maior parte dos pacientes, mas ainda há uma parcela de pacientes com doença refratária. Inúmeras pesquisas estão em curso atualmente com o objetivo de aprofundar o conhecimento sobre a fisiopatologia e desenvolver novos medicamentos.
Referências
1. Zuberbier T, Abdul Latiff AH, Abuzakouk M, Aquilina S, Asero R, Baker D, et al. The international EAACI/GA2LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022;77:734-66.
2. Ensina LF, Valle SOR, Campos RA, Agondi R, Criado P, Bedrikow RB, et al. Guia prático da Associação Brasileira de Alergia e Imunologia para o diagnóstico e tratamento das urticárias baseado em diretrizes internacionais. Arq Asma Alerg Imunol. 2019;3(4):382-92. doi:10.5935/2526-5393.20190052.
3. Kolkhir P, Giménez-Arnau AM, Kulthanan K, Peter J, Metz M, Maurer M. Urticaria. Nat Rev Dis Primer. 2022;8:61.
4. Balp M-M, Lopes Da Silva N, Vietri J, Tian H, Ensina LF. The Burden of Chronic Urticaria from Brazilian Patients' Perspective. Dermatol Ther. 2017;7:535-45.
5. Andrade Coelho Dias G, Cunha Coelho F, Filippo P, Lacerda Pedrazzi D, Nogueira Arraes AC, Perello MI, et al. Clinical experience of a chronic urticaria referral university center. Eur Ann Allergy Clin Immunol. 2020;52:74.
6. De Souza ACMCFF, Dortas Junior SD, Azizi GG, França AT, Lupi O, Valle SOR. Chronic urticaria: profile from a reference center. An Bras Dermatol. 2022;97:511-12.
7. Borriello F, Iannone R, Marone G. Histamine Release from Mast Cells and Basophils. In: Hattori Y, Seifert R (eds). Histamine and Histamine Receptors in Health and Disease. Springer International Publishing: Cham, 2017. p. 12139.
8. Asero R, Ferrer M, Kocaturk E, Maurer M. Chronic Spontaneous Urticaria: The Role and Relevance of Autoreactivity, Autoimmunity, and Autoallergy. J Allergy Clin Immunol Pract. 2023;11:23028.
9. Sabroe RA. Acute urticaria. Immunol Allergy Clin North Am. 2014;34:11-21.
10. Solé D, Ivancevich JC, Borges MS, Coelho MA, Rosário NA, Ardusso LRF, et al. Anaphylaxis in Latin America: a report of the online Latin American survey on anaphylaxis (OLASA). Clinics. 2011;66:943-7.
11. Jares EJ, Sánchez-Borges M, Cardona-Villa R, Ensina LF, Arias-Cruz A, Gómez M, et al. Multinational experience with hypersensitivity drug reactions in Latin America. Ann Allergy Asthma Immunol. 2014;113:282-9.
12. Modena B, White AA, Woessner KM. Aspirin and Nonsteroidal Antiinflammatory Drugs Hypersensitivity and Management. Immunol Allergy Clin North Am. 2017;37:727-49.
13. Rutnin N, Kulthanan K, Tuchinda P, Jongjarearnprasert K. Drug-induced urticaria: causes and clinical courses. J Drugs Dermatol JDD. 2011;10:1019-24.
14. Fok JS, Kolkhir P, Church MK, Maurer M. Predictors of treatment response in chronic spontaneous urticaria. Allergy. 2021;76:296581.
15. Metz M, Altrichter S, Buttgereit T, Fluhr JW, Fok JS, Hawro T, et al. The Diagnostic Workup in Chronic Spontaneous Urticaria-What to Test and Why. J Allergy Clin Immunol Pract, 2021;9:2274-83.
16. Kaplan A, Lebwohl M, Giménez-Arnau AM, Hide M, Armstrong AW, Maurer M. Chronic spontaneous urticaria: Focus on pathophysiology to unlock treatment advances. Allergy. 2023;78:389-401.
17. Kolkhir P, Muñoz M, Asero R, Ferrer M, Kocatürk E, Metz M, et al. Autoimmune chronic spontaneous urticaria. J Allergy Clin Immunol. 2022;149:1819-31.
18. Schoepke N, Asero R, Ellrich A, Ferrer M, Gimenez-Arnau A, EH Grattan C, et al. Biomarkers and clinical characteristics of autoimmune chronic spontaneous urticaria: Results of the PURIST Study. Allergy. 2019;74:2427-36.
19. Metz M, Altrichter S, Buttgereit T, Fluhr JW, Fok JS, Hawro T, et al. The Diagnostic Workup in Chronic Spontaneous Urticaria - What to Test and Why. J Allergy Clin Immunol Pract. 2021;9:227483.
20. Sánchez J, Sánchez A, Cardona R. Prevalence of Drugs as Triggers of Exacerbations in Chronic Urticaria. J Investig Allergol Clin Immunol. 2019;29:112-7.
21. Bansal CJ, Bansal AS. Stress, pseudoallergens, autoimmunity, infection and inflammation in chronic spontaneous urticaria. Allergy Asthma Clin Immunol. 2019;15:56.
22. Sánchez J, Sánchez A, Cardona R. Dietary Habits in Patients with Chronic Spontaneous Urticaria: Evaluation of Food as Trigger of Symptoms Exacerbation. Dermatol Res Pract. 2018;2018: 6703052.
23. Magerl M, Altrichter S, Borzova E, Giménez-Arnau A, Grattan CEH, Lawlor F, et al. The definition, diagnostic testing, and management of chronic inducible urticarias - The EAACI/GA(2) LEN/EDF/UNEV consensus recommendations 2016 update and revision. Allergy. 2016;71:780-2.
24. Fukunaga A, Washio K, Hatakeyama M, Oda Y, Ogura K, Horikawa T, et al. Cholinergic urticaria: epidemiology, physiopathology, new categorization, and management. Clin Auton Res. 2018 Feb;28(1):103-13.
25. Fok JS, Katelaris CH. Urticaria and mimickers of urticaria. Front Allergy. 2023;4:1274031.
26. Bernstein JA, Ziaie N, Criado R, Criado PR, Rea S, Davis M. Chronic Urticaria and Angioedema: Masqueraders and Misdiagnoses. J Allergy Clin Immunol Pract. 2023;11:225163.
27. Davis MDP, Van Der Hilst JCH. Mimickers of Urticaria: Urticarial Vasculitis and Autoinflammatory Diseases. J Allergy Clin Immunol Pract. 2018;6:1162-70.
28. Sekerel BE, Ilgun Gurel D, Sahiner UM, Soyer O, Kocaturk E. The many faces of pediatric urticaria. Front Allergy. 2023;4:1267663.
29. Baiardini I, Braido F, Bindslev-Jensen C, Bousquet PJ, Brzoza Z, Canonica GW, et al. Recommendations for assessing patient-reported outcomes and health-related quality of life in patients with urticaria: a GA(2) LEN taskforce position paper. Allergy. 2011;66:8404.
30. Valle SOR, Dortas-Junior SD, Dias GAC, Motta AA, do-Amaral CSF, Martins EAPR, et al. Ferramentas para avaliação e acompanhamento da urticária crônica. Arq Asma Alerg Imunol. 2018;2(2):209-24. doi:10.5935/2526-5393.20180021.
31. Moestrup K, Ghazanfar MN, Thomsen SF. Patient-reported outcomes (PROs) in chronic urticaria. Int J Dermatol. 2017;56:1342-48.
32. Weller K, Siebenhaar F, Hawro T, Altrichter S, Schoepke N, Maurer M. Clinical Measures of Chronic Urticaria. Immunol Allergy Clin North Am. 2017;37:35-49.
33. Stull D, McBride D, Tian H, Gimenez Arnau A, Maurer M, Marsland A, et al. Analysis of disease activity categories in chronic spontaneous/idiopathic urticaria. Br J Dermatol. 2017;177:1093-101.
34. Dias GAC, Pires GV, Valle SOR, França AT, Papi JA, Dortas SD, et al. Cross-cultural adaptation of the Brazilian-Portuguese version of the chronic urticaria quality-of-life questionnaire - CU-Q2oL. Allergy. 2011;66:1487-93.
35. Dortas Junior SD, Valle SOR, Weller K, Maurer M, Lupi O. Validity, reliability, and interpretability of the Brazilian urticaria control test. Allergy Asthma Proc. 2020;41:e61-e66.
36. de-Aquino BM, Lacerda AE, Marcelino FC, da-Silva BG, Nunes ICC, Solé D, et al. Tradução e adaptação transcultural para o idioma português (Brasil) do instrumento 'Angioedema Activity Score'. Arq Asma Alerg Imunol. 2018;2(3):351-6. doi:10.5935/2526-5393.20180042.
37. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development and construct validation of the angioedema quality of life questionnaire. Allergy. 2012;67:1289-98.
38. Weller K, Donoso T, Magerl M, Aygören-Pürsün E, Staubach P, Martinez-Saguer I, et al. Validation of the Angioedema Control Test (AECT) - A Patient-Reported Outcome Instrument for Assessing Angioedema Control. J Allergy Clin Immunol Pract. 2020;8:2050-2057.e4.
39. Weller K, Groffik A, Church MK, Hawro T, Krause K, Metz M, et al. Development and validation of the Urticaria Control Test: A patient-reported outcome instrument for assessing urticaria control. J Allergy Clin Immunol. 2014;133:1365-1372.e6.
40. Baiardini I, Pasquali M, Braido F, Fumagalli F, Guerra L, Compalati E et al. A new tool to evaluate the impact of chronic urticaria on quality of life: chronic urticaria quality of life questionnaire (CU-QoL). Allergy. 2005;60:1073-78.
41. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development, validation, and initial results of the Angioedema Activity Score. Allergy. 2013;68:1185-92.
42. Weller K, Zuberbier T, Maurer M. Chronic urticaria: tools to aid the diagnosis and assessment of disease status in daily practice. J Eur Acad Dermatol Venereol JEADV. 2015;29(Suppl 3):38-44.
43. Kubo N, Senda M, Ohsumi Y, Sakamoto S, Matsumoto K, Tashiro M, et al. Brain histamine H1 receptor occupancy of loratadine measured by positron emission topography: comparison of H1 receptor occupancy and proportional impairment ratio: H1 RECEPTOR OCCUPANCY OF LORATADINE. Hum Psychopharmacol Clin Exp. 2011;26:133-9.
44. Sharma M, Bennett C, Cohen SN, Carter B. H1-antihistamines for chronic spontaneous urticaria. Cochrane Database Syst Rev. 2014 Nov 14;2014(11):CD006137.
45. Lippert U, Möller A, Welker P, Artuc M, Henz BM. Inhibition of cytokine secretion from human leukemic mast cells and basophils by H1- and H2-receptor antagonists. Exp Dermatol. 2000;9:11824.
46. Church MK, Maurer M, Simons FER, Bindslev-Jensen C, van Cauwenberge P, Bousquet J, et al. Risk of first-generation H(1)-antihistamines: a GA(2)LEN position paper. Allergy. 2010;65:45966.
47. Maurer M, Zuberbier T, Metz M. The Classification, Pathogenesis, Diagnostic Workup, and Management of Urticaria: An Update. In: Traidl-Hoffmann C, Zuberbier T, Werfel T (eds). Allergic Diseases - From Basic Mechanisms to Comprehensive Management and Prevention. Springer International Publishing: Cham; 2021. p. 11733.
48. Guillén-Aguinaga S, Jáuregui Presa I, Aguinaga-Ontoso E, Guillén-Grima F, Ferrer M. Updosing nonsedating antihistamines in patients with chronic spontaneous urticaria: a systematic review and meta-analysis. Br J Dermatol. 2016;175:1153-65.
49. Zuberbier T. Pharmacological rationale for the treatment of chronic urticaria with second-generation non-sedating antihistamines at higher-than-standard doses. J Eur Acad Dermatol Venereol JEADV. 2012;26:9-18.
50. Giménez Arnau AM, Valero Santiago A, Bartra Tomás J, Jáuregui Presa I, Labrador Horrillo M, Miquel Miquel FJ, et al. Therapeutic Strategy According to Differences in Response to Omalizumab in Patients With Chronic Spontaneous Urticaria. J Investig Allergol Clin Immunol. 2019;29:338-48.
51. Easthope S, Jarvis B. Omalizumab: Drugs. 2001;61:253-60.
52. Kaplan AP, Giménez-Arnau AM, Saini SS. Mechanisms of action that contribute to efficacy of omalizumab in chronic spontaneous urticaria. Allergy. 2017;72:519-33.
53. Agache I, Akdis CA, Akdis M, Brockow K, Chivato T, Del Giacco S, et al. EAACI Biologicals Guidelines - Omalizumab for the treatment of chronic spontaneous urticaria in adults and in the paediatric population 12-17 years old. Allergy. 2022;77:17-38.
54. Türk M, Carneiro-Leão L, Kolkhir P, Bonnekoh H, Buttgereit T, Maurer M. How to Treat Patients with Chronic Spontaneous Urticaria with Omalizumab: Questions and Answers. J Allergy Clin Immunol Pract. 2020;8:113-24.
55. Ferrer M, Boccon-Gibod I, Gonçalo M, Inalöz HS, Knulst A, Lapeere H et al. Expert opinion: defining response to omalizumab in patients with chronic spontaneous urticaria. Eur J Dermatol. 2017;27:45563.
56. Saini SS, Bindslev-Jensen C, Maurer M, Grob J-J, Bülbül Baskan E, Bradley MS, et al. Efficacy and Safety of Omalizumab in Patients with Chronic Idiopathic/Spontaneous Urticaria Who Remain Symptomatic on H 1 Antihistamines: A Randomized, Placebo-Controlled Study. J Invest Dermatol. 2015;135:67-75.
57. Giménez-Arnau AM. Omalizumab for treating chronic spontaneous urticaria: an expert review on efficacy and safety. Expert Opin Biol Ther. 2017;17:375-85.
58. Omalizumab [Internet]. DrugBank. Disponível em: https://www.drugbank.ca/drugs/DB00043. Acessado em: 06/02/2024.
59. Xolair: EPAR-Product Information [Internet]. Última atualização: 21/12/2023. Disponível em: https://www.ema.europa.eu//en/documents/product-information/xolair-epar-product-information_en.pdf. Acessado em: 06/02/2024.
60. Maurer M, Metz M, Brehler R, Hillen U, Jakob T, Mahler V, et al. Omalizumab treatment in patients with chronic inducible urticaria: A systematic review of published evidence. J Allergy Clin Immunol. 2018;141:638-49.
61. McSweeney SM, Christou EAA, Maurer M, Grattan CE, Tziotzios C, McGrath JA. Physical urticaria: Clinical features, pathogenesis, diagnostic work-up, and management. J Am Acad Dermatol. 2023;89:324-37.
62. Chang J, Cattelan L, Ben-Shoshan M, Le M, Netchiporouk E. Management of Pediatric Chronic Spontaneous Urticaria: A Review of Current Evidence and Guidelines. J Asthma Allergy. 2021;14:18799.
63. Khan DA. Alternative agents in refractory chronic urticaria: evidence and considerations on their selection and use. J Allergy Clin Immunol Pract. 2013;1:433-440.e1.
64. Kessel A, Toubi E. Cyclosporine - A in severe chronic urticaria: the option for long-term therapy. Allergy. 2010;65:1478-82.
65. Savic S, Marsland A, McKay D, Ardern-Jones MR, Leslie T, Somenzi O, et al. Retrospective case note review of chronic spontaneous urticaria outcomes and adverse effects in patients treated with omalizumab or ciclosporin in UK secondary care. Allergy Asthma Clin Immunol. 2015 Jul 21;11(1):21.
66. Kocatürk E, Baskan EB, Küçük ÖS, Özdemir M, Örnek S, Can PK et al. Omalizumab versus cyclosporin-A for the treatment of chronic spontaneous urticaria: can we define better-responding endotypes? An Bras Dermatol. 2022;97:592-600.
67. Vena GA, Maurer M, Cassano N, Zuberbier T. Alternative treatments for chronic spontaneous urticaria beyond the guideline algorithm. Curr Opin Allergy Clin Immunol. 2017;17:278-85.
68. Cain DW, Cidlowski JA. Immune regulation by glucocorticoids. Nat Rev Immunol. 2017;17:233-47.
69. Levin ER, Hammes SR. Nuclear receptors outside the nucleus: extranuclear signalling by steroid receptors. Nat Rev Mol Cell Biol. 2016;17:783-97.
70. Alcântara CTD, Raeder DFT, Campinhos FL, Brandão LS, Campos RDA, Franca AT, et al. Practical guide to acute urticaria. Arq Asma Alerg Imunol. 2022;6:214-24.
71. Palungwachira P, Vilaisri K, Musikatavorn K, Wongpiyabovorn J. A randomized controlled trial of adding intravenous corticosteroids to H1 antihistamines in patients with acute urticaria. Am J Emerg Med. 2021;42:192-7.
72. Doumen M, Pazmino S, Bertrand D, Westhovens R, Verschueren P. Glucocorticoids in rheumatoid arthritis: Balancing benefits and harm by leveraging the therapeutic window of opportunity. Joint Bone Spine. 2023;90:105491.
73. Kocaturk E, Saini SS, Rubeiz CJ, Bernstein JA. Existing and Investigational Medications for Refractory Chronic Spontaneous Urticaria: Safety, Adverse Effects, and Monitoring. J Allergy Clin Immunol Pract. 2022;10:3099-116.
74. Yosipovitch G, Biazus Soares G, Mahmoud O. Current and Emerging Therapies for Chronic Spontaneous Urticaria: A Narrative Review. Dermatol Ther. 2023;13:1647-60.
75. Gabrielli S, Le M, Netchiporouk E, Miedzybrodzki B, Baum S, Greenberger S, et al. Chronic urticaria in children can be controlled effectively with updosing second-generation antihistamines. J Am Acad Dermatol. 2020;82:1535-7.
76. Ensina LF, Bastos PGA, de Lacerda AE, de Araujo CA, Camelo-Nunes I, Solé D. Comments on Balp et al. Pediatr Allergy Immunol. 2018 Sep;29(6):669-70.
77. Balp MM, Weller K, Carboni V, Chirilov A, Papavassilis C, Severin T, et al. Reply to Ensina et al. Pediatr Allergy Immunol. 2018 Sep;29(6):670-1.
78. Hide M, Suzuki T, Tanaka A, Aoki H. Efficacy and safety of rupatadine in Japanese adult and adolescent patients with chronic spontaneous urticaria: A double-blind, randomized, multicenter, placebo-controlled clinical trial. Allergol Int. 2019 Jan;68(1):59-67.
79. Gimenez-Arnau A, Pujol RM, Ianosi S, Kaszuba A, Malbran A, Poop G, et al. Rupatadine in the treatment of chronic idiopathic urticaria: a double-blind, randomized, placebo-controlled multicentre study. Allergy. 2007;62:539-46.
80. Nelson HS, Reynolds R, Mason J. Fexofenadine HCl is safe and effective for treatment of chronic idiopathic urticaria. Ann Allergy Asthma Immunol. 2000 May;84(5):517-22.
81. Consultas: Bulário Eletrônico ANVISA - Agência Nacional de Vigilância Sanitária. [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/. Acessado em: 02/09/2023.
82. Al-Shaikhly T, Rosenthal JA, Ayars AG, Petroni DH. Omalizumab for chronic urticaria in children younger than 12 years. Ann Allergy Asthma Immunol. 2019 Aug;123(2):208-10.
83. Corral-Magaña O, Gil-Sánchez JA, Bover-Bauzá C, Martinez-Cepas P, Montis-Palos MC, Martín-Santiago A. Chronic urticaria in children under 15 years of age: Clinical experience beyond the clinical trials. Pediatr Dermatol. 2021;38:385-9.
84. Song X-T, Chen Y-D, Yu M, Liu B, Zhao Z-T, Maurer M. Omalizumab in children and adolescents with chronic urticaria: A 16-week real-world study. Allergy. 2021;76:1271-3.
85. Briand C, Tetart F, Soria A, Staumont-Sallé D, Sterling B, Boralevi F, et al. Omalizumab in cold urticaria in children: Retrospective case series of 13 patients, review of the literature. Ann Dermatol Venereol. 2021;148: 269-71.
86. Japiassu LG, Bastos PGA, Araújo CA, Camelo-Nunes IC, Solé D, Ensina LF. Omalizumabe no tratamento da urticária crônica espontânea em pacientes pediátricos. Arq Asma Alerg Imunol. 2018;2:s78.
87. Neverman L, Weinberger M. Treatment of chronic urticaria in children with antihistamines and cyclosporine. J Allergy Clin Immunol Pract. 2014;2:434-8.
88. Boubouka CD, Charissi C, Kouimintzis D, Kalogeromitros D, Stavropoulos PG, Katsarou A. Treatment of autoimmune urticaria with low-dose cyclosporin A: A one-year follow-up. Acta Derm Venereol. 2011;91:50-4.
89. Kulthanan K, Chaweekulrat P, Komoltri C, Hunnangkul S, Tuchinda P, Chularojanamontri L, et al. Cyclosporine for Chronic Spontaneous Urticaria: A Meta-Analysis and Systematic Review. J Allergy Clin Immunol Pract. 2018;6:586-99.
90. Staubach P, Peveling-Oberhag A, Lang BM, Zimmer S, Sohn A, Mann C. Severe chronic spontaneous urticaria in children - treatment options according to the guidelines and beyond - a 10 years review. J Dermatol Treat. 2022;33:1119-22.
91. Caffarelli C, Paravati F, El Hachem M, Duse M, Bergamini M, Simeone G, et al. Management of chronic urticaria in children: a clinical guideline. Ital J Pediatr. 2019;45:101.
92. Kolkhir P, Metz M, Altrichter S, Maurer M. Comorbidity of chronic spontaneous urticaria and autoimmune thyroid diseases: A systematic review. Allergy. 2017;72:1440-60.
93. Kocatürk E, Podder I, Zenclussen AC, Kasperska Zajac A, Elieh-Ali-Komi D, Church MK, et al. Urticaria in Pregnancy and Lactation. Front Allergy. 2022;3:892673.
94. Liao S-L, Yu M, Zhao Z-T, Maurer M. Case Report: Omalizumab for Chronic Spontaneous Urticaria in Pregnancy. Front Immunol. 2021;12:652973.
95. Podder I, Dhabal A, Chakraborty SS. Efficacy and Safety of Up-dosed Second-generation Antihistamines in Uncontrolled Chronic Spontaneous Urticaria: A Review. J Clin Aesthetic Dermatol. 2023;16:44-50.
96. Kocatürk E, Al-Ahmad M, Krause K, Gimenez-Arnau AM, Thomsen SF, Conlon N, et al. Treatment patterns and outcomes in patients with chronic urticaria during pregnancy: Results of PREG-CU, a UCARE study. J Eur Acad Dermatol Venereol. 2023;37:356-64.
97. Vieira dos Santos R, Locks Bidese B, Rabello de Souza J, Maurer M. Effects of omalizumab in a patient with three types of chronic urticaria. Br J Dermatol. 2014;170:469-71.
98. Ensina L, Cusato-Ensina A, Camelo-Nunes I, Solé D. Omalizumab as Third-Line Therapy for Urticaria During Pregnancy. J Investig Allergol Clin Immunol. 2017;27:326-7.
99. Saito J, Yakuwa N, Sandaiji N, Uno C, Yagishita S, Suzuki T, et al. Omalizumab concentrations in pregnancy and lactation: A case study. J Allergy Clin Immunol Pract. 2020;8:3603-4.
100. Kulthanan K, Rujitharanawong C, Munprom K, Trakanwittayarak S, Phumariyapong P, Prasertsook S, et al. Prevalence, Clinical Manifestations, Treatment, and Clinical Course of Chronic Urticaria in Elderly: A Systematic Review. J Asthma Allergy. 2022;15:145590.
101. Khaliliya R, Confino-Cohen R, Lachover-Roth I, Meir-Shafrir K, Cohen-Engler A, Rosman Y. Chronic Urticaria in Elderly-New Insights. J Allergy Clin Immunol Pract. 2023;11:1290-4.
102. Patruno C, Fabbrocini G, Cillo F, Torta G, Stingeni L, Napolitano M. Chronic Urticaria in Older Adults: Treatment Considerations. Drugs Aging. 2023;40:165-77.
103. Nettis E, Cegolon L, Di Leo E, Canonica WG, Detoraki A, Baiardini I, et al. Omalizumab in elderly patients with chronic spontaneous urticaria: An Italian real-life experience. Ann Allergy Asthma Immunol. 2018;120:318-23.
104. Cho Y-T, Chan TC, Lee C-H, Chou W-Y, Hsiao P-F, Chen Y-J, et al. Taiwanese dermatological association consensus for the definition, classification, diagnosis, and management of urticaria: A 2021 update. J Formos Med Assoc Taiwan Yi Zhi. 2022;121:1191203.
105. Oztop N, Demir S, Unal D, Beyaz S, Terzioglu K, Olgac M, et al. Predictive factors of recurrence after omalizumab cessation in the elderly with urticaria: A real-life study. Allergy Asthma Proc. 2022;43:519-28.
Conflito de interesses: Gabriela Andrade Coelho Dias atua como speaker para Novartis®. Eli Mansour atua como speaker para Novartis®, CSL Behring®, Takeda® e Sanofi®. Regis Albuquerque Campos atua como speaker, participante do advisory board e de pesquisa clínica para Novartis®. Solange Oliveira Rodrigues Valle atua como speaker, e consultoria e pesquisa para a Novartis®. Luis Felipe Chiaverini Ensina atua como speaker e consultor para Novartis®, Sanofi® e Abbvie®; pesquisa clínica para Novartis® e Amgen®.