Número Atual: Janeiro-Março 2024 - Volume 8 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Eficácia da midostaurina na mastocitose sistêmica - um relato de caso
Efficacy of midostaurin in systemic mastocytosis: a case report
Stéphanie Kim Azevedo de Almeida; Igor Rafael Guedes Pereira Brandão; Marina França de Paula Santos; Jorge Kalil; Pedro Giavina Bianchi
Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, Serviço de Imunologia Clinica e Alergia - São Paulo, SP, Brasil
Endereço para correspondência:
Stéphanie Kim Azevedo de Almeida
E-mail: stephanie_kaa@hotmail.com
Não foram declarados conflitos de interesse associados à publicação deste artigo.
Submetido em: 12/09/2023
Aceito em: 12/11/2023.
RESUMO
Paciente do sexo feminino, com 63 anos de idade, portadora de mastocitose sistêmica há cerca de 20 anos, sendo agressiva há 10 anos. Crises quase diárias com manifestações do trato gastrointestinal e vasomotoras. Após diversas tentativas de tratamento, iniciou uso de midostaurina, um inibidor multiquinase. Depois de 6 meses de uso, observou-se bom controle dos sintomas, diminuição em quase 50% da triptase sérica e desaparecimento completo das lesões cutâneas.
Descritores: Mastocitose sistêmica agressiva, triptase, anafilaxia, lesão osteolítica, síndrome de má absorção, inibidor multiquinase, midostaurina.
Introdução
A mastocitose é um conjunto de doenças caracterizadas pela proliferação e acúmulo de mastócitos clonais e neoplásicos em diversos órgãos. Entre elas, a mastocitose sistêmica se destaca como a forma mais grave, com envolvimento extracutâneo, às vezes associada à disfunção orgânica de um ou mais órgãos, acometendo principalmente adultos1-2. A incidência estimada dessa condição é de 4-5 casos por ano para cada um milhão de pessoas3. As manifestações clínicas são desencadeadas pela liberação de mediadores vasoativos e pelos danos causados aos órgãos devido à infiltração de mastócitos neoplásicos4.
A maioria dos casos de mastocitose sistêmica está associada a mutações somáticas com ganho de função no KIT, em sua maioria pela mutação D816V. O receptor Tipo III KIT, também denominado CD117, é um receptor do tipo tirosina quinase que tem papel importante no desenvolvimento normal de mastócitos. A interação entre o KIT e seu ligante, o fator de células-tronco (steam cell factor), desempenha um papel fundamental na regulação da proliferação, maturação, adesão, quimiotaxia e sobrevivência de mastócitos4.
A forma agressiva da mastocitose sistêmica pode se manifestar com uma série de sintomas, incluindo síndrome de má-absorção com emagrecimento, hepatomegalia e/ou esplenomegalia com disfunção desses órgãos, citopenias graves, lesões osteolíticas, geralmente cursando com níveis séricos de triptase muito elevados. Essa condição está associada a um prognóstico ruim, com uma mediana de sobrevida global de apenas 3,5 anos5.
A abordagem terapêutica da mastocitose sistêmica deve ser individualizada. O tratamento sintomático visa ao controle de sintomas e recorrência de crises, realizado com bloqueadores dos receptores de histamina H1 e H2, bloqueadores dos receptores de leucotrienos e estabilizadores da membrana dos mastócitos. Corticosteroides tópicos e inibidores de calcineurina podem minimizar as lesões cutâneas4.
A midostaurina, um inibidor oral multiquinase que inibe o KIT-D816V, mostrou-se eficaz no controle da doença6. Além disso, esse medicamento também inibe a liberação de histamina dependente de IgE, por ação na proteína quinase C7. Os níveis séricos de triptase e o envolvimento da medula óssea são usados como padrão para monitorar o efeito da terapia8. Os efeitos colaterais mais comuns desse medicamento são náuseas, vômitos, diarreia e fadiga, enquanto o mais limitante é a mielossupressão. Estudos mostram que comumente a dose da medicação é reduzida por efeitos adversos1.
O imatinibe, um inibidor competitivo de diversas tirosina quinases, incluindo o KIT, não apresenta resultados tão bons quanto a midostaurina, pois esse medicamento inibe o crescimento do KIT V560G, porém não age nas células portadoras da mutação KIT D816V. Já o interferon-α (IFN-α) é associado a muitos efeitos colaterais, não sendo tolerado por muitos pacientes, além de apresentar apenas uma resposta parcial no controle da doença na grande maioria dos casos4.
Relato de caso
Paciente feminina, 63 anos, doméstica, natural e procedente de Osasco, SP. Aos 39 anos começou a apresentar lesões maculopapulares hipercrômicas difusas na pele, com predomínio em dorso, que se tornavam eritematosas com a fricção da pele, calor e estresse, às vezes acompanhadas de prurido. Aos 50 anos de idade, evoluiu com crises semanais de sintomas gastrointestinais caracterizados por diarreia e vômitos, associados a sintomas vasomotores, com flushing e hipotensão. O quadro piorava com uso de opioides e anti-inflamatórios não esteroidais (AINEs), tendo a paciente ido diversas vezes a serviços de pronto atendimento. Com 56 anos, a paciente foi internada por anafilaxia sem agente desencadeante definido, com necessidade de intubação orotraqueal. Negava ferroada por insetos da ordem Hymenoptera.
Após uma internação aos 58 anos, foi aventada hipótese de mastocitose sistêmica e realização de biópsia de pele da região do dorso, mostrando derme com áreas de denso infiltrado de células, sugestivas de mastócitos com CD117 (c-kit) positivo e CD2 negativo na imunohistoquímica. Para complementação diagnóstica, foi realizada biópsia de medula óssea na mesma ocasião, com achado de medula óssea hipercelular (90%), a custas de infiltrado de células fusiformes peritrabecular (40%), sugestivo de mastocitose, com CD117 (c-kit) positivo e CD2 negativo.
Após três meses, a paciente foi internada em hospital terciário com a equipe de Imunologia Clínica e Alergia para complementação do diagnóstico. Realizado PET-CT (Figura 1) para estadiamento, que mostrou hipermetabolismo glicolítico em esqueleto axial e apendicular, associado com alteração de textura óssea, com lesões de aspecto lítico intercaladas com lesões blásticas (SUVmax: 3,1 em tíbia proximal esquerda). A ultrassonografia de abdome com doppler evidenciou hepatopatia parenquimatosa com sinais de hipertensão portal e circulação colateral portossistêmica, além de esplenomegalia homogênea. Biópsia hepática mostrou fibrose septal e perissinusoidal com aumento de mastócitos, com CD20+, CD3+, CD30+ e CD117+. Sem alterações em endoscopia digestiva alta e colonoscopia. Realizado ainda mielograma com achados na imunohistoquímica de infiltrado de mastócitos CD117+, CD25+, CD2+.
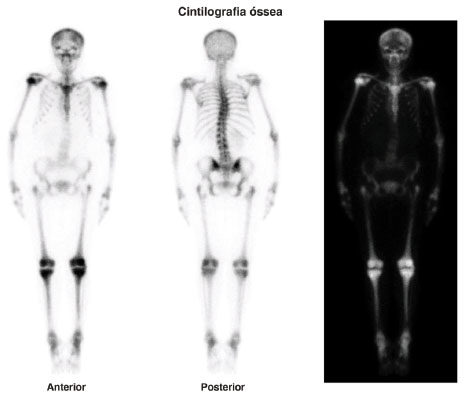
Figura 1
Imagens de varredura anterior e posterior de corpo inteiro com 99mTc-MDP evidenciando, além de áreas hipocaptantes no terço proximal dos fêmures compatível com próteses metálicas, hiperconcentração difusa do radiofármaco em esqueleto axial e apendicular, sugestivas de lesões por infiltração
O diagnóstico de mastocitose sistêmica agressiva foi confirmado, com acometimento hepático, medular, cutâneo e ósseo. Proposto tratamento para controle dos sintomas com loratadina 10 mg de 12 em 12 horas e ranitidina 150 mg de 12 em 12 horas, além de orientações sobre evitar medicamentos como opioides e AINEs e plano de ação para possíveis casos de anafilaxia. Entretanto a paciente mantinha crises de diarreia, vômitos, flushing e hipotensão quase diariamente, além de dor óssea limitante, com uso frequente de celecoxibe.
Durante o acompanhamento da mastocitose, a paciente apresentou um quadro cutâneo desafiador, conforme já publicado nos Arquivos de Asma, Alergia e Imunologia8, caracterizado pelo surgimento de lesões papulares eritematosas associada a prurido em região de membros superiores e inferiores, areolar, cervical e abdome, com um quadro muito semelhante também acometendo seu esposo. Exame de esfregaço com pesquisa de Sarcoptes scabiei foi positiva em ambos. Realizado tratamento com Ivermectina 6 mg, 2 comprimidos, 2 doses com intervalo de 14 dias, além de terapia tópica com loção de permetrina 50 mg/mL, com resolução completa do quadro (Figura 2).
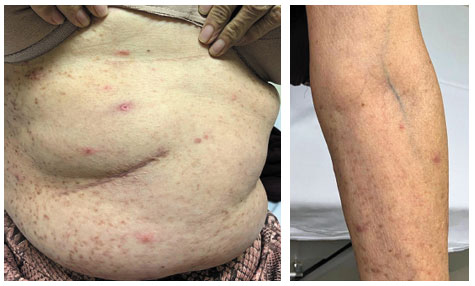
Figura 2
Pápulas eritematosas com microvesículas em região de abdome e membro superior esquerdo (escabiose), permeando as lesões máculo-papulares eritêmatoacastanhadas da mastocitose
Foi realizada tentativa terapêutica para mastocitose sistêmica agressiva pela equipe de Hematologia, primeiro, com inibidor de tirosina quinase, imatinibe 400 mg/dia, via oral, o qual foi suspenso após 4 meses por piora dos sintomas gastrointestinais, anemia, astenia e falta de apetite; e, posteriormente, com interferon-α 2b, 3 milhões de unidades, subcutânea, 2 vezes na semana, interrompido após 1 ano e 7 meses de uso por falta da medicação. A paciente fez um ciclo com prednisona 60 mg/dia, via oral, porém mantinha sintomas diários de flushing, hipotensão, cefaleia holocraniana e prurido cutâneo, além de crises de dores abdominais semanais.Triptase sérica nesse período de 200 µg/L.
Em outubro de 2022, com 61 anos, foi introduzido o inibidor multiquinase midostaurina 25 mg de 12 em 12 horas, via oral. Três meses após, paciente apresentou melhora significativa do quadro, com crises mais leves e menos frequentes e diminuição de lesões cutâneas. Realizadas tentativas de aumento de dose até 200 mg/dia de midostaurina, correspondendo à dose sugerida em bula para o tratamento da mastocitose avançada, porém a paciente apresentou intolerância gastrointestinal caracterizada por náuseas intensas. Optado por dose de 150 mg/dia, via oral, em duas tomadas, a qual a paciente tolerava.
Após 6 meses do uso contínuo da medicação, foi coletada nova triptase sérica que teve sua concentração diminuída para 118 µg/L. A paciente apresentou remissão completa das lesões cutâneas (Figura 3) e melhorou significativamente do ponto de vista clínico, com crises caracterizadas por sintomas leves de náuseas, dores abdominais, flushing e cefaleia holocraniana, com intervalo entre 10-15 dias, sem necessidade de idas a serviços de pronto atendimento (Tabela 1).
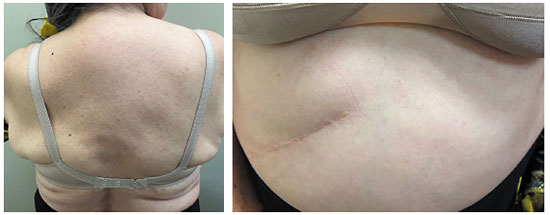
Figura 3
Pele de dorso e abdome mostrando remissão das lesões de mastocitose após tratamento com midostaurina
Discussão
A midostaurina tem se mostrado eficaz no tratamento de pacientes com mastocitose sistêmica agressiva, por sua ação como inibidor multiquinase, incluindo o receptor KIT mutado e a proteína quinase C. O caso relatado mostra, após 6 meses de uso da medicação, uma melhora importante dos sintomas, diminuição de triptase em quase 50%, e remissão completa das lesões cutâneas, com efeitos colaterais controlados com a diminuição de dose. Nosso caso ilustra, em curto prazo, a eficácia e segurança da terapêutica da mastocitose sistêmica agressiva com a midostaurina.
Apesar de ainda não termos ensaios clínicos randomizados com comparação direta, uma comparação das evidências científicas sugere uma superioridade da midostaurina na sobrevivência dos pacientes com mastocitose sistêmica avançada em comparação a outros agentes citorredutores utilizados tradicionalmente9. Um estudo francês de vida real constatou uma sobrevida global em um ano de 83%10. Além disso, há estudos que demonstram a capacidade da midostaurina em reverter danos aos órgãos, diminuir a esplenomegalia e a carga de mastócitos da medula óssea, além de proporcionar benefícios em relação aos sintomas relatados pelos pacientes e à qualidade de vida11. Náuseas, vômitos e diarreia são os efeitos adversos mais comumente encontrados com uso da medicação. Geralmente são controlados com uso de medicamentos sintomáticos e com a administração da midostaurina com as refeições11.
Referências
1. Pardanani A. Systemic mastocytosis in adults: 2021 Update on diagnosis, risk stratification and management. Am J Hematol. 2021;96(4):508-25.
2. Burgard C, Rosar F, Khreish F, Ezziddin S. Systemic Mastocytosis Treatment with Midostaurin: [18F]FDG PET/CT as a Potential Monitoring Tool for Therapy Outcome. Diagnostics (Basel). 2022;12(3):680.
3. Miettinen M, Lasota J. KIT (CD117): a review on expression in normal and neoplastic tissues, and mutations and their clinicopathologic correlation. Appl Immunohistochem Mol Morphol. 2005;13(3):205-20.
4. Velloso EDRP, Padulla GA, de Cerqueira AMM, de Sousa AM, Sandes AF, Traina F, et al. Diagnosis and treatment of systemic mastocytosis in Brazil: Recommendations of a multidisciplinary expert panel. Hematol Transfus Cell Ther. 2022;44(4):582-94.
5. Lim KH, Tefferi A, Lasho TL, Finke C, Patnaik M, Butterfield JH, et al. Systemic mastocytosis in 342 consecutive adults: survival studies and prognostic factors. Blood. 2009;113(23):5727-36.
6. Gotlib J, Kluin-Nelemans HC, George TI, Akin C, Sotlar K, Hermine O, et al. Efficacy and Safety of Midostaurin in Advanced Systemic Mastocytosis. N Engl J Med. 2016;374(26):2530-41.
7. Krauth MT, Mirkina I, Herrmann H, Baumgartner C, Kneidinger M, Valent P. Midostaurin (PKC412) inhibits immunoglobulin E-dependent activation and mediator release in human blood basophils and mast cells. Clin Exp Allergy. 2009;39(11):1711-20.
8. Perez IL, Giavina-Bianchi M, Mamede LQ, Antila HG, Pereira GF, Kalil J, et al. Escabiose mascarada por mastocitose sistêmica. Arq Asma Alerg Imunol. 2020;4(1):141-4.
9. Chandesris MO, Damaj G, Canioni D, Brouzes C, Lhermitte L, Hanssens K, et al.; CEREMAST Study Group. Midostaurin in Advanced Systemic Mastocytosis. N Engl J Med. 2016;374(26):2605-7.
10. Rossignol J, Nizard S, Blanc AS, Filipovics A, Lortet-Tieulent J, Bouktit H, et al. Therapeutic management and outcome of patients with advanced systemic mastocytosis treated with midostaurin: A comprehensive real-life study in the French national healthcare database. Hematol Oncol. 2022;40(5):1030-40.
11. Gotlib J, Kluin-Nelemans HC, George TI, Akin C, Sotlar K, Hermine O, et al. Efficacy and Safety of Midostaurin in Advanced Systemic Mastocytosis. N Engl J Med. 2016;374(26):2530-41.