Número Atual: Janeiro-Março 2024 - Volume 8 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Incidência de anafilaxia relacionada às vacinas do Programa Nacional de Imunizações
Incidence of vaccine-related anaphylaxis from Brazil's National Immunization Program
Debora Demenech Hernandes1; Jorge Kalil1; Carla Dinamerica Kobayashi2; Ana Karolina Barreto Berselli Marinho1
1. Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, Serviço de Imunologia Clinica e Alergia - São Paulo, SP, Brasil
2. Coordenação Geral de Farmacovigilância - Departamento do Programa Nacional de Imunização
Endereço para correspondência:
Debora Demenech Hernandes
E-mail: deboradhernandes@gmail.com
Submetido em: 08/03/2024
Aceito em: 14/03/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A incidência de anafilaxia pós-vacinal é um evento de saúde raro e carece de melhor detalhamento no Brasil. Neste estudo, objetivou-se descrever a incidência de anafilaxia como evento supostamente atribuído à vacinação e imunização (ESAVI) das vacinas do Programa Nacional de Imunizações (PNI).Foi realizado estudo retrospectivo com dados extraídos do sistema de notificação de ESAVI do PNI entre 01/2021 e 05/2023 com aceitação na Plataforma Brasil e aprovação ética. Foram identificados 84 casos encerrados com o descritor "anafilaxia" ou "choque anafilático" entre 290.101 eventos adversos notificados, concentrados principalmente nas regiões Sul e Sudeste. Crianças de 0 a 9 anos foram predominantemente afetadas, com maior incidência em mulheres e indivíduos brancos. A anafilaxia associou-se em números absolutos principalmente às vacinas COVID-19, destacando os fabricantes AstraZeneca/Fiocruz (vetor viral), Pfizer Comirnaty (RNAm) e CoronaVac (inativada), e a maior taxa de incidência foi com a vacina antirrábica (2,8 por milhão de doses aplicadas). A incidência global foi de 0,14/milhão de doses aplicadas. Entre os desfechos não foi relatado óbito. A subnotificação de casos é relevante e sublinha a importância de manter sistemas robustos de vigilância e manejo de reações alérgicas em programas de vacinação. Este estudo segue tendências mundiais da raridade da anafilaxia relacionada às vacinas. Os dados reforçam a segurança das vacinas COVID-19 e demais vacinas existentes no PNI, independente da demografia analisada.
Descritores: Vacinação, anafilaxia, programa de imunização, hesitação vacinal, hipersensibilidade imediata.
Introdução
Entre as reações de hipersensibilidade imediata, a anafilaxia se destaca como um evento de maior gravidade e potencialmente fatal em alguns casos, se não tratada adequadamente. Esta é parte da definição proposta pela World Allergy Organization (WAO), em 2020, que também trata da anafilaxia como evento de início súbito, grave, que pode envolver vias aéreas superiores e inferiores e/ou sistema cardiocirculatório, e ocorre com ou sem a presença de lesões cutâneas e com ou sem choque circulatório1.
A depender da definição utilizada, método e área geográfica, a prevalência de anafilaxia estimada ao longo da vida é de 0,3-5,1%, com chance de recorrência de 26,5-54% em um período de seguimento de 1,5-25 anos2. As causas mais comuns são medicamentos, alimentos e venenos de insetos da ordem dos himenópteros3.
A anafilaxia relacionada a vacinas é um evento raro, com incidência de 1 a cada 100.000 a 1 a cada 1.000.000 de doses aplicadas4. Em um levantamento realizado por McNeil e cols., a incidência foi de 1,31 casos para cada 1 milhão de doses de vacinas aplicadas (IC 95%: 0,90-1,84). Neste estudo, de 25 milhões de doses de vacinas aplicadas, foram encontrados 33 casos de anafilaxia, sem predomínio de faixa etária. As vacinas mais relacionadas foram a vacina influenza trivalente 1,35 (IC 95%: 0.65-2.47), seguida da influenza monovalente 1,83 (IC 95%: 0.22-6.63). Nestes pacientes, foi vista uma prevalência de 85% de comorbidades alérgicas5. Em relação às vacinas COVID-19, em uma revisão sistemática recente, a taxa de incidência de anafilaxia combinada de vacina mRNA Pfizer-BioNTech e a vacina Moderna foi de 5,58 por milhão de doses (IC 95%: 3,04-8,12), e isoladamente da Pfizer-BioNTech de 9,31 por milhão de doses aplicadas6.
Nas reações alérgicas (com mecanismo por reação de hipersensibilidade tipo I), além do antígeno vacinal, outros componentes da vacina podem estar implicados. Estes podem incluir os líquidos de suspensão, que podem conter resquícios dos meios de cultura para produção vacinal, como o ovo; adjuvantes para reforçar a resposta de produção de anticorpos, como o hidróxido de alumínio; estabilizadores, como a gelatina, açúcares e aminoácidos; conservantes, como o 2-fenoxietanol e o timerosal; antibióticos; leveduras e látex5,7,8. Além disso, substâncias que aumentam a solubilidade das vacinas têm sido utilizadas, particularmente nas vacinas COVID-19.
As vacinas da Pfizer-BioNTech e Moderna contêm polietilenoglicol (PEG), substância implicada em reações imediatas IgE mediadas relatada previamente ao uso em vacinas9; e a vacina da AstraZeneca/Fiocruz contém polissorbato 80, substância utilizada em muitos medicamentos e terapias biológicas, que pode sensibilizar o paciente e após estar envolvido em reações pós-vacinais8.
Em relação à investigação de um evento de saúde ocorrido após a vacinação, cabe ressaltar que nem sempre este evento ocorre devido efeito da vacina ou vacinação. Por este motivo, o evento que ocorreu após a aplicação do imunizante, ou seja, que apresenta uma relação temporal com a vacina recebe a denominação de Evento Supostamente Atribuível à Vacinação ou Imunização (ESAVI). Esta nomenclatura vem sendo mundialmente utilizada, pois nem sempre é possível estabelecer relação causal do evento pósvacinal no momento da notificação. Os ESAVI podem estar relacionados a outras variáveis, como desvio de qualidade do produto, relacionado a erro programático na aplicação da vacina, evento coincidente com outra situação de saúde, e, finalmente, relacionados às vacinas e seus componentes, que podem ser os componentes da própria vacina e inclusive o dispositivo utilizado para aplicar ou o equipamento de proteção individual de quem aplicou a vacina10. O estabelecimento de causalidade requer uma revisão sistemática das evidências individuais e populacionais sobre o evento, com base em uma metodologia estruturada11, seguindo os critérios propostos pela Organização Mundial da Saúde (OMS)12.
No caso da reação de hipersensibilidade imediata ser confirmada, de acordo com avaliação individualizada e conforme disponibilidade de imunizantes e dos serviços especializados, é possível definir a conduta em imunização que poderá ser: contraindicação para doses subsequentes, vacinação sob supervisão, troca de plataforma sem o componente implicado na reação, fracionamento de doses, ou vacinação sem precaução adicional13. O aumento de conhecimento sobre alérgenos e reações vacinais e a investigação apropriada também pode ter impacto na hesitação vacinal14, que é sabidamente um fenômeno complexo15, e desde 2019 é classificada pela OMS como uma das 10 ameaças à saúde global16.
O Programa Nacional de Imunizações (PNI), programa de destaque internacional com cinco décadas de existência, assegura um panorama de óbitos reduzidos por doenças preveníveis. Além disso, o Brasil é inovador na investigação de eventos adversos pós-vacinais17, o que corrobora a necessidade de realizar um levantamento e catalogar as reações anafiláticas, além de fornecer dados sobre a segurança das vacinas utilizadas na rotina aos profissionais de saúde e à população. Desta forma, este estudo buscou conhecer a incidência de anafilaxia como evento adverso das vacinas do PNI, assim como caracterizar demograficamente os casos de anafilaxia, descrever as comorbidades e sintomas notificados, classificar os casos conforme os critérios de Brighton, descrever a classificação de causalidade dos eventos anafiláticos assim como os desfechos e condutas ao encerramento das notificações.
Métodos
Estudo observacional, retrospectivo, descritivo, das notificações de ESAVI nacionais registradas no e-SUS Notifica. Foram concedidos dados anonimizados de todas as notificações ESAVI realizadas via e-SUS Notifica do período de janeiro de 2021 a maio de 2023 pela Coordenação Geral de Farmacovigilância do Departamento de Imunização e Doenças Imunopreviníveis do Ministério da Saúde. Para complementar as análises foram utilizados os dados públicos do DataSUS/SI-PNI18 referentes à quantidade total de doses aplicadas por imunizante no mesmo período. Para as vacinas COVID-19, foram utilizados os números de doses também publicamente disponíveis na plataforma "Vacinômetro", desenvolvida pelo Departamento de Monitoramento e Disseminação de Informações Estratégicas em Saúde (DEMAS) da Secretaria de Informação e Saúde Digital (SEIDIGI) do Ministério da Saúde, de acesso público online19.
A casuística foi composta por 290.101 notificações de ESAVI. Foi então realizada a busca pelos descritores "anafilaxia" e "choque anafilático" na coluna de "diagnóstico após investigação" e "encerramentos de investigação". Tais notificações foram incluídas na análise. Ressalta-se que todos os casos de anafilaxia foram encerrados com código do CID-10 choque anafilático não especificado (T78.2) ou alergia não especificada (T78.4 - nestes, o termo anafilaxia estava no campo reação da aba de investigação). Foram excluídas as notificações de ESAVI que não possuíssem tais descritores na coluna de encerramento. Destacase que a investigação do evento pelo PNI/Cifavi utiliza os critérios de Brighton e cols.20 para encerramento das notificações como anafilaxia.
A partir dos dados encontrados, foi realizada análise demográfica da população, que incluiu análise do estado da notificação, faixa etária, sexo, raça/cor, presença de comorbidades, dos sintomas relatados na notificação e das comorbidades, da incidência de casos encerrados como anafilaxia e/ou choque anafilático em números totais e por imunizante, da causalidade e da conduta atribuídas no encerramento das notificações, e ainda realizada uma reclassificação pelos critérios de Brighton.
Ressalta-se que os dados relativos às vacinas COVID-19 do Estado de São Paulo não foram contabilizados (tanto de ESAVI quanto das doses totais aplicadas), uma vez que as notificações de ESAVI do referido estado são realizadas em sistema de informação próprio, à parte dos dados nacionais. Desta forma, na pesquisa de doses aplicadas pelo DataSUS e Vacinômetro também foram retirados os dados referentes a São Paulo.
Este estudo foi aprovado pela Comissão de Ética para Análise de Projetos de Pesquisa (CAPPesq), sob o SGP (Sistema de Gestão em Pesquisa), parecer número 6.083.162 e Certificado de Apresentação para Apreciação Ética (CAAE) 69358023.3.0000.0068 na Plataforma Brasil, com dispensa de TCLE.
Resultados
Das 290.101 notificações inseridas no SI-PNI no período determinado, 84 notificações foram encerradas como anafilaxia ou choque anafilático, após excluídas 2 notificações por duplicidade e 12 por inconsistência de dados. Em relação ao local de notificação, por estado, 56 (66%) foram realizadas em estados do Sul, Sudeste e no Distrito Federal, como mostra a Figura 1. O Rio de Janeiro foi o estado com mais notificações (19%). Cabe ressaltar que as notificações do estado de São Paulo não incluem as vacinas COVID-19.
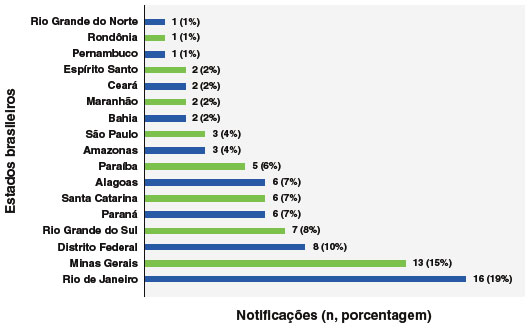
Figura 1
Distribuição de casos de anafilaxia relatados no Programa Nacional de Imunizações (PNI) no período de janeiro de 2021 a maio de 2023 (n=84)
A faixa etária predominante para eventos anafiláticos foi a de 0 a 9 anos de idade, com 24% (n = 20), especialmente a faixa etária de 0 a 5 anos (17,8%; 15 casos), seguido da faixa etária de 40 a 49 anos (19%; 16 casos), como mostra a Figura 2. Em relação ao sexo, 67% (n = 56) dos eventos ocorreram em pessoas do sexo feminino, e para a variável raça/cor, 49% (n = 41) dos casos se declararam brancos e 31% (n = 26) pardos, como mostra a Figura 3.
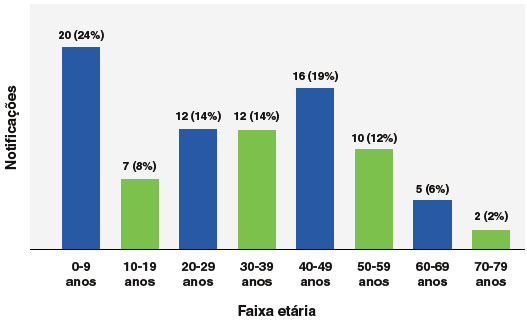
Figura 2
Distribuição etária de casos de anafilaxia relatados no Programa Nacional de Imunizações (PNI) no período de janeiro de 2021 a maio de 2023 (n=84)
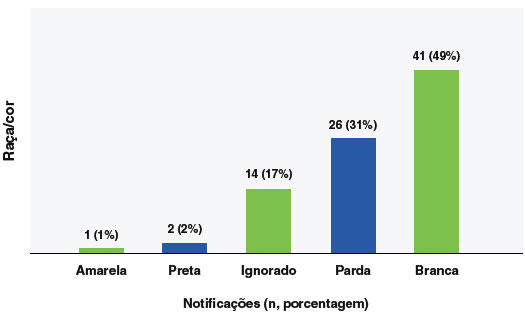
Figura 3
Distribuição por raça/cor dos casos de anafilaxia relatados no Programa Nacional de Imunizações (PNI) no período de janeiro de 2021 a maio de 2023 (n=84)
A comorbidade mais relatada foi alergia (n = 9/21), com os respectivos diagnósticos: asma em 2 notificações, história pessoal de alergia a agente analgésico em 2 notificações, história pessoal de alergia a drogas e medicamentos e a substâncias biológicas em 1 notificação, e alergia não especificada em 5 notificações.
Das 84 notificações encerradas como anafilaxia ou choque anafilático, 82% (n = 69) foram com vacinas aplicadas isoladamente e 18% (n = 15) com imunização combinada. Das isoladas, 65% (n = 54) ocorreram após as vacinas COVID-19 (Figura 2), com maior número absoluto de eventos com a vacina AstraZeneca/Fiocruz (25%; n=21), seguido da Pfizer Comirnaty (18%; n = 15), CoronaVac (17%; n = 14) e Pfizer Comirnaty pediátrica, com 5% (n = 4). Três episódios ocorreram com soro, antiaracnídeo (1%; n = 1) e antiescorpiônico (2%; n = 2), como mostra a Figura 4.

Figura 4
Porcentagem dos imunizantes envolvidos em casos encerrados como anafilaxia no Programa Nacional de Imunizações (PNI) no período de janeiro de 2021 a maio de 2023, excluindo casos de anafilaxia multidose (n=84)
Dentre as anafilaxias relatadas com vacinas aplicadas isoladamente, a maioria das anafilaxias em vacinação isolada ocorreu após a primeira dose/ dose única (75%; n = 52), seguida de 16% (n = 11) após a segunda dose, e 9% (n = 6) após a terceira dose/reforço.
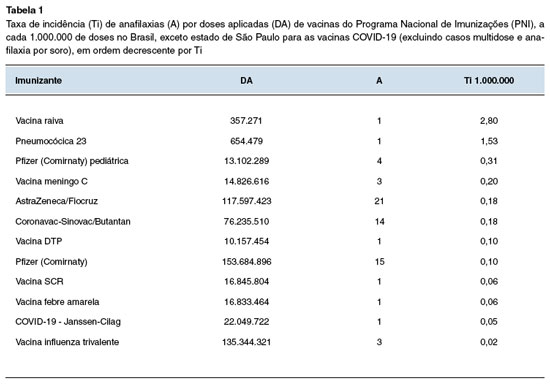
A incidência geral de anafilaxia pós-vacinal foi de 0,14 para 1 milhão de doses aplicadas (0,14/1.000.000). Em relação aos imunizantes isoladamente, a maior incidência ocorreu com a vacina raiva, com taxa de incidência de 2,80/1.000.000, como mostra a Tabela 1.
Em seguida, a vacina pneumocócica 23 representou a segunda maior incidência de casos encerrados como anafilaxia, com 1,53/1.000.000, seguida da Pfizer (Comirnaty) pediátrica, com 0,31 casos/1.000.000 de doses. Entre as vacinas COVID-19 para a população adulta, as vacinas AstraZeneca/Oxford e CoronaVac/Butantan ficaram com a mesma incidência de 0,18/1.000.000, seguidas da vacina Pfizer (0,10/1.000.000) e da vacina Janssen (0,05/1.000.000). A incidência de anafilaxia com vacinas COVID-19 englobando todas as citadas é de 0,14/1.000.000. Os resultados estão apresentados na Tabela 1.
Nas 84 notificações, foram relatados 65 sintomas diferentes. Os mais citados foram, respectivamente, anafilaxia (n = 23), tosse seca (n = 13), dispneia (n = 12), choque anafilático (n = 10), edema de glote (n = 8), reação alérgica (n = 7), prurido (n = 7), urticária (n = 6), edema (n = 6), edema facial (n = 6) e cefaleia (n = 5).
Pela descrição dos sintomas, foi possível classificar as notificações pelos critérios de Brighton para anafilaxia relacionada a vacinas. A maioria dos casos (49%, n = 41) teve nível de certeza 1, seguido pelo nível 4 em 38% (n = 32), nível 5 em 6% (n = 5), nível 3 em 5% (n = 4), e, finalmente, nível 2 em 2% (n = 2).
Em relação ao local de atendimento e cuidado oferecido ao paciente diante do evento, houve diferença de complexidade e estrutura física. A maioria dos casos ficou em observação em unidade de saúde por até 24 horas (37%, n = 31), seguido de atendimento em ambulatório/consultório (17%, n = 14), internação hospitalar por mais de 24 horas (15%; n = 13) e internação em unidade de terapia intensiva (2%; n = 2), e em 29% (n = 24) não foi reportada tal informação.
O desfecho dos casos foi relatado em 77% (n = 65) das notificações, das quais 81% foram relatadas cura sem sequelas, e em 19% deste total ainda estava em acompanhamento até o fechamento da análise deste estudo. Não houve relato de óbitos entre os casos de anafilaxia notificados.
As condutas em imunização (decisão para doses futuras) realizadas no encerramento dos casos estão demonstrados na Figura 5.

Figura 5
Conduta em imunização no encerramento dos casos de anafilaxia relatados no Programa Nacional de Imunizações (PNI) no período de janeiro de 2021 a maio de 2023 (n=84)
Discussão
Este foi o primeiro levantamento nacional de incidência de anafilaxias com dados de vacinas do PNI que se tem conhecimento. Um dado bastante relevante é o baixo número de notificações realizadas no período estudado, refletindo uma provável subnotificação de ESAVI. Dentre os fatores envolvidos, o período analisado englobou fase crítica da pandemia de COVID-19, que limitou em muitos cenários a busca por serviços de saúde. Além disso, houve uma redução da cobertura vacinal, excluindo-se o grande número de vacinas COVID-19, que pode ser fator que também reduziu reações por outros imunizantes. É possível também que tenha havido falha no reconhecimento dos sinais e sintomas de anafilaxia por parte dos profissionais de saúde, resultando em um menor número de diagnósticos e notificações. O treinamento e capacitação dos profissionais de saúde em diversos cenários sobre o reconhecimento oportuno das anafilaxias garantirá maior notificação, tratamento adequado aos pacientes e os desfechos favoráveis.
As 84 anafilaxias pós-vacinais concentraram-se majoritariamente nos estados do Sul, Sudeste e no Distrito Federal, com destaque para o Rio de Janeiro, responsável por 19% das notificações. Por se tratar de dados absolutos, tais prevalências podem estar associadas em razão destas regiões estarem entre as mais populosas do país e por diferenças regionais sobre o conhecimento de anafilaxia na rede de atenção à saúde, além da rotina de notificação heterogênea em diferentes estados e municípios do Brasil.
A faixa etária mais afetada foi a de crianças entre 0 e 9 anos, com a subfaixa de 0 a 5 anos sendo a mais representativa, ainda que muito rara. Nesta idade, pacientes são expostos com maior frequência às vacinas e possuem um sistema imune ainda imaturo, além de maior prevalência de alergias a componentes vacinais e maior incidência de infecções, que podem influenciar nas reações21. Além disso, nesta faixa etária há a observação constante de um cuidador, o que aumenta a chance de se notar uma reação adversa. A raridade de anafilaxia nesta faixa etária é mais um dado que endossa a segurança das vacinas recomendadas pelo PNI.
Houve uma predominância do sexo feminino como já visto em outra coorte5. Para corroborar com este dado, já foi demonstrado um dismorfismo sexual na resposta antigênica e de reação adversa a algumas vacinas a depender do sexo22,23. Desconhece-se, porém, o número de doses aplicadas por sexo e se haveria algum impacto na taxa de incidência relativa a cada grupo.
Em relação à raça/cor, houve maior prevalência em indivíduos brancos, seguida por pardos, confirmando as tendências5,24. Este perfil demográfico pode indicar uma maior tendência a notificar eventos adversos naquele grupo ou alguma susceptibilidade biológica ainda desconhecida.
Em relação às comorbidades, 25% das notificações mencionaram condições pré-existentes, sendo a alergia a mais reportada (10%). A atopia já foi reportada como parâmetro presente em indivíduos que produziram IgE contra componentes vacinais como toxina diftérica e tetânica, porém sem associação estatística25. Existe um ensaio clínico em curso26 avaliando reações vacinais entre populações atópicas e não atópicas que poderá trazer mais esclarecimento sobre esse fator de risco, em especial com vacinas COVID-19. De todo modo, os dados encontrados nesta pesquisa reforçam a importância da avaliação cuidadosa de pacientes atópicos antes da vacinação, especialmente em pacientes asmáticos, que devido à associação de mau controle asmático e reações anafiláticas graves apresentaram um pior desfecho em todas as idades27.
A anafilaxia pós-vacinal continua sendo uma reação adversa muito rara. A taxa de incidência encontrada no presente estudo de 0,14 episódios a cada 1 milhão de doses aplicadas é menor que a relatada previamente na literatura de 1,31 por milhão de doses, no qual a vacina com maior número de eventos foi a influenza inativada (em um período pré-pandêmico), porém com taxa de incidência similar às outras vacinas. Tal estudo ainda apontou a vacina contra raiva como a com maior taxa de incidência (86 por milhão de doses aplicadas)5, assim como no presente trabalho (2,8 por milhão de doses de vacina raiva).
As vacinas de raiva podem conter gelatina4, um dos principais antígenos relacionados com anafilaxia com mecanismo IgE específico comprovado de reações vacinais do tipo I. Em relação à síndrome de alfa-gal, ainda há controvérsia se a quantidade de gelatina contida nas vacinas seria capaz de elicitar uma reação28,29. A vacina antirrábica que estava envolvida na reação notificada era a vacina produzida pelo Instituto Butantan, que é a vacina preferencial no PNI, uma vacina inovadora produzida em cultivo celular vero e isenta de quaisquer produtos animais, e que apresenta um excelente perfil de segurança17.
O envolvimento predominante de casos de anafilaxia após vacinas COVID-19 exige cautela na interpretação. Estes foram os imunizantes mais aplicados no período, e apesar dos maiores números absolutos em anafilaxia, a taxa de incidência foi baixa (entre 0,0450,31 casos por milhão de doses aplicadas; média de 0,14 por milhão de doses aplicadas). Em comparação aos dados do CDC30, em que a taxa de incidência foi de 5 casos por milhão de doses de vacinas COVID-19, foi encontrada uma taxa expressivamente menor, que poderia ser justificada por uma subnotificação de casos ou então casos notificados mas que não foram investigados e encerrados como choque anafilático ou anafilaxia. Isso demonstra a necessidade de reforçar o sistema de vigilância e melhorar cada vez mais os sistemas de notificação e treinamento para profissionais de saúde que recebem estes pacientes.
Em relação às vacinas COVID-19 separadamente, a vacina AstraZeneca/Fiocruz foi a mais envolvida (25%) nas reações, seguida pela Pfizer Comirnaty (18%) e CoronaVac (17%). Estas vacinas possuem componentes como polissorbato 80 (Astrazeneca) e PEG 2000 (Pfizer), apontados em muitos relatos como causa de reação alérgica, em especial o PEG 2000. Posteriormente viu-se que mesmo em pacientes com história prévia de reação ao PEG a vacina não causa reações, e na recomendação GRADE (Grading of Recommendations Assessment, Development and Evaluation) o risco de reação mesmo para pacientes com reação prévia ao PEG é extremamente baixo, com nível forte de evidência e a vacinação é indicada31. Outros mecanismos de reação com ativação mastocitária envolvendo PEG já foram descritos, como a CARPA (complement activation-related pseudoallergy), na qual anticorpos IgG e IgM contra o PEG ativariam o complemento e levariam à desgranulação mastocitária28. Já a CoronaVac possui como excipiente o hidróxido de alumínio, que apresenta classicamente relação com reações locais tardias, não sendo habitualmente envolvido em reações imediatas13. Foram também muito discutidas as reações não imunológicas às vacinas, que podem mimetizar reações anafiláticas, como as respostas vaso-vagais, ansiedade e o Estresse Desencadeado por Resposta à Vacinação (EDRV), cuja reação pode apresentar sintomas físicos e emocionais com desfecho benigno4,17,28. Para a investigação, a anamnese e registro de prontuário do atendimento são essenciais e podem guiar o alergista na diferenciação do tipo de reação. Os testes cutâneos com a vacina e/ou componente apresentam baixa sensibilidade e alta especificidade em estratificar pessoas que possam ter uma reação grave na segunda dose, e não têm recomendação formal, podendo ser realizados a critério do especialista32. A segunda dose da vacina COVID-19 costuma ser bem tolerada, mesmo sem a troca de plataforma; também não há benefício claro estabelecido em realizar doses graduais ou pré-medicação31. A decisão deve ser condicionada à escolha realizada pelo paciente em um modelo de decisão compartilhada32.
Nos casos de anafilaxia após vacinação combinada, os testes cutâneos e diagnóstico por componentes podem ser a única forma de o paciente seguir com seu esquema vacinal, e o papel do alergista é crucial para evitar restrições de vacinas desnecessariamente e consequentemente deixar o indivíduo suscetível a doenças imunopreviníveis13. Porém, são necessárias mais evidências para guiar tais decisões.
A maioria (75%) dos eventos caracterizados como anafilaxia neste estudo ocorreu após a primeira dose das vacinas. Com vacinas COVID-19, outros autores identificaram anafilaxia após a primeira dose e foi aventada a hipótese de possíveis causas não alérgicas. Quando a conduta foi realizar a segunda dose sem troca de plataforma, foi observada menor frequência de anafilaxia, e quando ocorreram sintomas, os mesmos foram toleráveis33.
Importante destacar que a maioria dos casos de anafilaxia foram classificados como nível 1 de Brighton, indicando uma alta probabilidade de anafilaxia verdadeira e a importância da vigilância e da preparação para reações alérgicas graves em centros de vacinação. Ressalta-se que a reclassificação realizada neste estudo foi feita apenas com os dados da ficha de notificação. Desse modo, apesar de terem sido encontrados dois casos classificados em nível 5 de Brighton (ou seja, não são casos de anafilaxia) e outros 32 casos de nível 4 (ou seja, falta de informações necessárias para classificar como anafilaxia), estas fichas de notificação foram previamente investigadas pelo serviço de vigilância conforme fluxo de investigação do PNI, e houve acesso a informações complementares (por exemplo, prontuário), o que levou a investigação a ser encerrada de fato como anafilaxia. A discordância entre tais dados serve como alerta da importância da notificação correta pelo pro-fissional de saúde, adicionando no momento da notificação o máximo de informações clínicas possíveis, para auxiliar no desenvolvimento de estudos epidemiológicos a partir de dados de notificações. Basili e cols. reportaram não haver diferença estatística entre a classificação de certeza de anafilaxia entre Brighton e WAO entre vacinas COVID-1934, e, portanto, devido à escassez de dados de caracterização clínica dos eventos presentes nas notificações, neste estudo não foi realizada tal comparação.
Em relação à classificação de causalidade (OMS), a maioria dos eventos classificados como A1 tiveram a maior contraindicação de futuras doses da vacina implicada. Dentre os casos de anafilaxia avaliados não houve ocorrência de óbitos e a maioria dos casos resultou em cura sem sequelas, o que está de acordo com a literatura em que, apesar de ser um evento de potencial gravidade, o desfecho de óbito é raríssimo5,21,35.
Ainda, acredita-se que a previsão de inclusão do CID-11 para notificação que abrangerá múltiplos diferenciais para anafilaxia possa apoiar futuras pesquisas epidemiológicas de anafilaxia relacionadas às vacinas, visto que a classificação atual limita a descrição correta dos eventos, e por este motivo alguns casos podem não ser investigados36.
Dentre as limitações deste estudo, além das subnotificações exploradas no primeiro parágrafo desta discussão, destacamos a não inclusão dos dados de ESAVI do estado de São Paulo, por se tratar do estado mais populoso do país, provavelmente impactou no número absoluto de casos notificados como anafilaxia.
Conclusão
A taxa de incidência de anafilaxia associada a vacinas do PNI foi de 0,14 casos para 1 milhão de doses aplicadas no período, o que reforça a natureza rara de tais eventos e acrescenta em dados de segurança para as vacinas ofertadas pelo programa. A vacina com maior taxa de incidência foi a vacina da raiva, e as vacinas com maiores números absolutos de anafilaxias foram as vacinas COVID-19. A subnotificação foi provavelmente relevante e pode ter impactado em números absolutos os eventos.
Foi possível realizar uma caracterização demográfica dos casos encerrados como anafilaxia e ainda nota-se maior incidência em crianças, mulheres e da raça/cor branca. A principal comorbidade foi a alergia, o que pode reforçar a importância da avaliação pelo especialista em alergia na tomada de decisão em imunização.
A indicação ou contraindicação da dose subsequente ou indicação de esquema alternativo é uma decisão que deve ser tomada após análise rigorosa dos fatos e dos possíveis mecanismos de reação. Os dados deste estudo corroboram a necessidade da presença de aparelho robusto de vigilância e manejo de reações alérgicas em programas de vacinação.
Agradecimentos
Agradecemos à Martha Elizabeth Brasil da Nóbrega e à Coordenação-geral de Farmacovigilância do Departamento de Imunizações do Ministério da Saúde do Brasil, pelo apoio na realização deste estudo.
Referências
1. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, et al. World Allergy Organization Anaphylaxis Guidance 2020. World Allergy Organ J. 2020 Oct;13(10):100472.
2. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Rivas MF, Fineman S, et al. [World Allergy Organization Anaphylaxis Guidance 2020]. Arerugi. 2021;70(9):1211-34.
3. Giavina-Bianchi P. Polietilenoglicol: o suspeito da anafilaxia à vacina BNT162b2 mRNA COVID-19. Arq Asma Alerg Imunol. 2020;4(3):245-6. doi: 10.5935/2526-5393.20200042.
4. Dreskin SC, Halsey NA, Kelso JM, Wood RA, Hummell DS, Edwards KM, et al. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016 Sep 16;9(1):32.
5. McNeil MM, Weintraub ES, Duffy J, Sukumaran L, Jacobsen SJ, Klein NP, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol. 2016 Mar;137(3):868-78.
6. Alhumaid S, Al Mutair A, Al Alawi Z, Rabaan AA, Tirupathi R, Alomari MA, et al. Anaphylactic and nonanaphylactic reactions to SARS-CoV-2 vaccines: a systematic review and meta-analysis. Allergy Asthma Clin Immunol. 2021 Oct 16;17(1):109.
7. Sociedade Brasileira de Imunizações e Associação Brasileira de Alergia e Imunologia. Guia de Imunização SBIm/ASBAI 2020/2021 - Asma, Alergia e Imunodeficiências [Internet]. Outubro 2020. Disponível em: https://sbim.org.br/images/guias/guia-sbim-asbaimiolo-201013b-web.pdf. Acessado em: 05/03/2024.
8. Diniz LC, Giavina-Bianchi P, Goudouris ES, Prando CCM, Vasconcelos DM, Marinho AKBB. Alergias e vacinas contra a COVID-19. Arq Asma Alerg Imunol. 2021;5(1):30-2.
9. Giavina-Bianchi P, Kalil J. Polyethylene Glycol Is a Cause of IgEMediated Anaphylaxis. J Allergy Clin Immunol Pract. 2019 Jul- Aug;7(6):1874-5.
10. Organização Pan-Americana da Saúde. Manual de vigilância de eventos supostamente atribuíveis à vacinação ou imunização na Região das Américas [Internet]. 2022. Disponível em: https://iris.paho.org/handle/10665.2/55946. Acessado em: 05/03/2024.
11. Brasil, Ministério da Saúde, Secretaria de Vigilância em Saúde Departamento de Imunização e Doenças Transmissíveis, Coordenação-Geral do Programa Nacional de Imunizações. Nota Técnica Nº 255/2022-CGPNI/DEIDT/SVS/MS [Internet]. Disponível em: https://sbim.org.br/images/files/notas-tecnicas/nt-255-2022-cgpni-deidt-svs-ms.pdf. Acessado em: 05/03/2024.
12. World Health Organization. Causality assessment of an adverse event following immunization (AEFI): user manual for the revised WHO classification. Second edition, 2019 update. Geneva: World Health Organization; 2019. p. 88.
13. Marinho AKBB, Antunes AA, Guimarães BNA, Gerhardt CMB, Valente CFC, Anagusko CLY, et al. Reações de hipersensibilidade a vacinas. Arq Asma Alerg Imunol. 2023;7(1):3-22.
14. Peters MDJ. Addressing vaccine hesitancy and resistance for COVID- 19 vaccines. Int J Nurs Stud. 2022 Jul;131(104241):104241.
15. Lafnitzegger A, Gaviria-Agudelo C. Vaccine hesitancy in pediatrics. Adv Pediatr. 2022 Aug;69(1):163-76.
16. World Health Organization. Ten threats to global health in 2019 [Internet]. Disponível em: https://www.who.int/news-room/spotlight/ten-threats-to-global-health-in-2019. Acessado em: 05/03/2024.
17. Brasil, Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Imunizações e Doenças Transmissíveis. Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação [Internet]; 2021. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/manual_vigilancia_epidemiologica_eventos_vacinacao_4ed.pdf. Acessado em: 05/03/2024.
18. Brasil, Ministério da Saúde, DATASUS [Internet]. Disponível em: https://datasus.saude.gov.br/informacoes-de-saude-tabnet/. Acessado em: 05/03/2024.
19. Brasil, Ministério da Saúde. Vacinômetro COVID-19 [Internet]. Disponível em: https://infoms.saude.gov.br/extensions/SEIDIGI_DEMAS_Vacina_C19/SEIDIGI_DEMAS_Vacina_C19.html. Acessado em: 05/03/2024.
20. Gold MS, Amarasinghe A, Greenhawt M, Kelso JM, Kochhar S, Yu- Hor Thong B, et al. Anaphylaxis: Revision of the Brighton collaboration case definition. Vaccine. 2023 Apr 6;41(15):2605-14.
21. McNeil MM, DeStefano F. Vaccine-associated hypersensitivity. J Allergy Clin Immunol. 2018 Feb;141(2):463-72.
22. Cook IF. Sexual dimorphism of humoral immunity with human vaccines. Vaccine. 2008 Jul 4;26(29-30):3551-5.
23. Zimmermann P, Curtis N. Factors That Influence the Immune Response to Vaccination. Clin Microbiol Rev. 2019 Mar 13;32(2):e00084-18. doi: 10.1128/CMR.00084-18.
24. Warren CM, Snow TT, Lee AS, Shah MM, Heider A, Blomkalns A, et al. Assessment of allergic and anaphylactic reactions to mRNA COVID-19 vaccines with confirmatory testing in a US regional health system. JAMA Netw Open. 2021 Sep 1;4(9):e2125524.
25. Dannemann A, van Ree R, Kulig M, Bergmann RL, Bauer P, Forster J, et al. Specific IgE and IgG4 immune responses to tetanus and diphtheria toxoid in atopic and nonatopic children during the first two years of life. Int Arch Allergy Immunol. 1996 Nov;111(3):262-7.
26. ClinicalTrials.gov [Internet]. COVID19 SARS Vaccinations: Systemic Allergic Reactions to SARS-CoV-2 Vaccinations (SARS). Disponível em: https://clinicaltrials.gov/study/NCT04761822. Acessado em: 05/03/2024.
27. Tanno LK, Gonzalez-Estrada A, Olivieri B, Caminati M. Asthma and anaphylaxis. Curr Opin Allergy Clin Immunol. 2019 Oct;19(5):447-55.
28. Kelso JM. The adverse reactions to vaccines practice parameter 10 years on-what have we learned? Ann Allergy Asthma Immunol. 2022 Jul;129(1):35-9.
29. Zafar S, Wolff A, Schutzer S, McGintee E, Torre A. Are gelatincontaining vaccines safe to give in alpha-gal sensitized patients? J Allergy Clin Immunol. 2022 Feb;149(2):AB99.
30. Centers for Disease Control and Prevention, CDC [Internet]. Selected Adverse Events Reported after COVID-19 Vaccination. Disponível em: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/adverse-events.html. Acessado em: 06/03/2024.
31. Greenhawt M, Dribin TE, Abrams EM, Shaker M, Chu DK, Golden DBK, et al. Updated guidance regarding the risk of allergic reactions to COVID-19 vaccines and recommended evaluation and management: A GRADE assessment and international consensus approach. J Allergy Clin Immunol. 2023 Aug;152(2):309-25.
32. Blumenthal KG, Greenhawt M, Phillips EJ, Agmon-Levin N, Golden DBK, Shaker M. An update in COVID-19 vaccine reactions in 2023: Progress and understanding. J Allergy Clin Immunol Pract. 2023 Nov;11(11):3305-18.
33. Eastman J, Kelbel T, Holsworth A, Pebbles T, Hartog N. Cohort experience of second messenger RNA vaccine dose tolerance after an initial-dose reaction. Ann Allergy Asthma Immunol. 2022 Feb;128(2):217-8.
34. Basili JOV. Análise de Eventos Adversos Pós-Vacinais de Hipersensibilidade aos Imunizantes contra a Covid-19 [tese]. São Paulo (Brasil): USP, Faculdade de Medicina, Disciplina de Imunologia Clínica e Alergia; 2022.
35. Shimabukuro T, Nair N. Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine. JAMA. 2021 Feb 23;325(8):780-1.
36. Tanno LK, Chalmers RJG, Calderon MA, Aymé S, Demoly P, on behalf the Joint Allergy Academies. Reaching multidisciplinary consensus on classification of anaphylaxis for the eleventh revision of the World Health Organization's (WHO) International Classification of Diseases (ICD-11). Orphanet J Rare Dis. 2017 Mar 16;12(1):53.