Número Atual: Janeiro-Março 2024 - Volume 8 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Epidemiologia da anafilaxia no Brasil: Registro Brasileiro de Anafilaxia (RBA) da Associação Brasileira de Alergia e Imunologia (ASBAI)
Epidemiology of anaphylaxis in Brazil: The Brazilian Registry of Anaphylaxis (RBA) of the Brazilian Association of Allergy and Immunology (ASBAI)
Mara Morelo Rocha Felix1,2; Dirceu Solé2,3; Herberto José Chong-Neto2,4; Ekaterini Simões Goudouris2,5; Alexandra Sayuri Watanabe2,6; Norma de Paula M. Rubini1,2; Emanuel Sarinho2,7; Fátima Rodrigues Fernandes2,8; Fábio Chigres Kuschnir2,9; Grupo Brasileiro de Interesse em Anafilaxia (GBIA)10
1. Universidade Federal do Estado do Rio de Janeiro, Departamento de Medicina Geral - Rio de Janeiro, RJ, Brasil
2. Associação Brasileira de Alergia e Imunologia - São Paulo, SP, Brasil
3. Escola Paulista de Medicina - Universidade Federal de São Paulo, Departamento de Pediatria - São Paulo, SP, Brasil
4. Universidade Federal do Paraná, Departamento de Pediatria - Curitiba, PR, Brasil
5. Universidade Federal do Rio de Janeiro, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
6. Universidade de São Paulo, Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
7. Universidade Federal de Pernambuco, Programa de Pós-Graduação em Saúde da Criança e do Adolescente (PPGSCA) - Recife, PE, Brasil
8. Hospital Infantil Sabará, Fundação José Luiz Egydio Setúbal, Instituto PENSI - São Paulo, SP, Brasil
9. Universidade do Estado do Rio de Janeiro, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
10. Grupo Brasileiro de Interesse em Anafilaxia (GBIA): Alves Jr JB, Auad B, Barbosa E, Bittar RP, Brom LR, Capelo AV, Chong-Neto HJ, Curi MCLB, Diniz B, Felix MMR, Fernandes FR, Ferriani M, Figueira MC, Franco JM, Gagete E, Garcia Filho ER, Geller M, Goudouris ES, Kokron C, Kuschnir FC, Lacerda AE, Lima CMF, Mambriz AP, Oliveira LCL, Oliveira JCS, Pasinato J, Philippi JC, Plácido A, Ribeiro MR, Rosário C, Rosário NA, Rubini NPM, Santos A, Santos ACAFS, Santos PFAM, Sarinho ESC, Silva J, Simões I, Solé D, Souza Lima EM, Souza Lima I, Stefanelli PS, Stefani GP, Strozzi D, Watanabe AS, Weber C, Wolf PG
Endereço para correspondência:
Mara Morelo Rocha Felix
E-mail: maramorelo@gmail.com
Submetido em: 25/02/2024
Aceito em: 29/02/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: A anafilaxia é uma reação alérgica multissistêmica grave, de início agudo e potencialmente fatal. Poucos são os dados sobre sua epidemiologia no Brasil. O Registro Brasileiro de Anafilaxia da Associação Brasileira de Alergia e Imunologia (RBAASBAI) teve como objetivo ampliar o conhecimento sobre anafilaxia em indivíduos brasileiros.
MÉTODOS: Estudo observacional transversal com questionário online sobre dados demográficos, desencadeantes suspeitos, manifestações clínicas, atendimento durante a reação, investigação diagnóstica e aconselhamento após a reação de pacientes que experimentaram uma reação anafilática.
RESULTADOS: Entre junho/2021 e abril/2023, foram incluídos 237 pacientes (131 femininos): 99 crianças/adolescentes; 127 adultos e 11 idosos. Houve predomínio de meninos entre crianças/adolescentes (55,5%), e de mulheres entre os adultos (64,5%), e mediana de idade de 22 anos (< 1 a 77 anos). As manifestações cutâneas (92,8%) foram as mais frequentes, seguidas pelas respiratórias (70,1%), gastrointestinais (52,3%), neurológicas (36,3%) e cardiovasculares (35,3%). Os principais desencadeantes foram: alimentos (43,0%), medicamentos (26,2%), himenópteros (21,6%) e látex (2,5%); os alimentos entre crianças (leite, ovo, amendoim/castanhas), e os fármacos (anti-inflamatórios e antibióticos) entre os adultos. Quanto ao tratamento, 61,1% recebeu adrenalina (52,7% por profissional e 8,4% via autoinjetor de adrenalina -AIA). Uma adolescente (12 anos) faleceu após picada de abelha. A maioria recebeu plano escrito de emergência (78,1%) e foi ensinada a usar o AIA (70%).
CONCLUSÃO: Os alimentos foram os desencadeantes mais comuns entre crianças/adolescentes, e os fármacos entre adultos brasileiros. A adrenalina continua sendo subutilizada, reforçando a necessidade de maior disseminação do tratamento adequado da anafilaxia.
Descritores: Anafilaxia, hipersensibilidade alimentar, hipersensibilidade a drogas, hipersensibilidade a veneno, epinefrina.
Introdução
A anafilaxia é definida como uma reação alérgica multissistêmica grave, de início agudo e potencialmente fatal1-3. Clinicamente, alguns ou todos os seguintes sinais e sintomas podem estar presentes: urticária, angioedema, comprometimento respiratório e gastrintestinal e/ou hipotensão arterial1-4. A ocorrência de dois ou mais destes sintomas, imediatamente após a exposição a alérgeno suspeito, alerta para o diagnóstico e a necessidade de tratamento imediato1-3.
A incidência da anafilaxia vem crescendo nos últimos anos, entretanto há poucos dados sobre sua epidemiologia no Brasil. Na maioria das vezes é limitada a estudos de pequenos grupos populacionais, com resultados variáveis a depender dos critérios diagnósticos para a definição dos casos, local de estudo, população avaliada, tempo de estudo, entre outros5-9.
No estudo de doenças cuja prevalência é baixa, como acontece com a anafilaxia, os registros têm sido uma ferramenta muito empregada4,6,10-20. Permitem de modo ativo e padronizado, reunir e documentar os dados de pacientes em questões pré-definidas como manifestações clínicas, tratamento, e evolução, além de permitirem avaliar a eficácia da rotina do atendimento médico clínico e laboratorial, o monitoramento da segurança do paciente, bem como a avaliação econômica e a pesquisa de quantidades mínimas (terapêutica) necessárias para o seu controle17.Visando obter-se maior representatividade sobre determinada doença e com o intuito de ter-se uma visão mais ampla sobre a mesma, a maioria dos registros têm sido multicêntricos e/ou multipaíses6,10-20.
O Registro Brasileiro de Anafilaxia da Associação Brasileira de Alergia e Imunologia (RBA-ASBAI)20 foi desenvolvido a partir do Registro Português de Anafilaxia e Reações Adversas da Sociedade Portuguesa de Alergia e Imunologia Clínica (RPARASPAIC)10 com o intuito de coletar dados de saúde, em nível nacional, que nos permitam conhecer, de modo mais amplo, o perfil da anafilaxia que acomete indivíduos brasileiros. Estes dados serão fundamentais para que os médicos que cuidam destes pacientes, o poder público e a sociedade compreendam a importância deste problema, a partir do maior conhecimento sobre este problema.
Método
Trata-se de um estudo observacional transversal com o objetivo de avaliar as características da anafilaxia em indivíduos brasileiros, empregando-se o RBA-SBAI. O RBA-SBAI é um registro nacional de anafilaxia de preenchimento online, pelo médico atendente de paciente com história de anafilaxia21. Esse questionário contém dados sociodemográficos, desencadeantes suspeitos, manifestações clínicas, tipo de atendimento prestado durante a reação, investigação diagnóstica e aconselhamento após a reação.
O estudo teve aprovação do Comitê de Ética em Pesquisa (CEP) do Instituto Pensi (Nº 5.145.239). Em dezembro de 2021, esse CEP aprovou a dispensa de assinatura compulsória dos termos de consentimento (TCLE) e de assentimento (TALE) livre esclarecidos para a inclusão de casos no Registro Brasileiro de Anafilaxia.
A análise estatística foi realizada empregandose testes não paramétricos pelo software Jamovi® (Versão 2.3). As variáveis categóricas foram descritas por suas distribuições de frequência, e as contínuas por médias e desvios padrões (DP).Valores de p menores que 0,05 foram considerados estatisticamente significativos. Foram analisados os registros inseridos entre 28/06/2021 e 15/04/2023.
Resultados
Foram avaliados os dados de 237 pacientes, com predominância do sexo feminino (131; 55,3%). Foram incluídos pacientes de 17 dos 27 estados brasileiros com distribuição oscilando entre 0,4% e 25,8%, sendo a maioria dos pacientes de estados do Sul e Sudeste: SP (25,8%), PR (19,4%) e RJ (15,6%). Os pacientes foram assim categorizados: 99 crianças/adolescentes (< 18 anos); 127 adultos (18-64 anos) e 11 idosos (6577 anos). Houve predomínio do sexo masculino entre as crianças e os adolescentes (55,5%; p = 0,005) e de mulheres entre os adultos (64,5%; p = 0,002). A mediana de idade do grupo geral foi 22 anos e a média 25,6 ± 20,8 anos (mínima < 1 ano e máxima = 77). No sexo feminino, a média de idade foi 27,8 (DP ±20 anos) e mediana 29, enquanto no sexo masculino, estes valores foram respectivamente de 22,9 (DP ± 21,5 anos) e 16. Para 97/237 (39,2%) pacientes, esse foi o primeiro episódio, e para 61/237 (25,8%) pacientes, foi o terceiro ou mais.
A residência foi o local mais frequente em que ocorreu a reação (111/237; 46,8%), seguido por hospital ou unidade de saúde (37/237; 15,6%), parque/campo (27/237; 11,4%), restaurante (19/237; 8,0%), espaço público (16/237; 6,8%) e no trabalho (10/237; 4,0%). Cerca de 95% dos pacientes recebeu algum tipo de tratamento, sendo que 68,4% (162/237) em serviços de urgência, 18,6% (44/237) no local onde ocorreu a reação, 4,6% (11/237) em unidades de cuidados intensivos, 3,4% (8/237) em serviços de ambulatório, 3% (7/237) na internação e 2,1% (5/237) em outros.
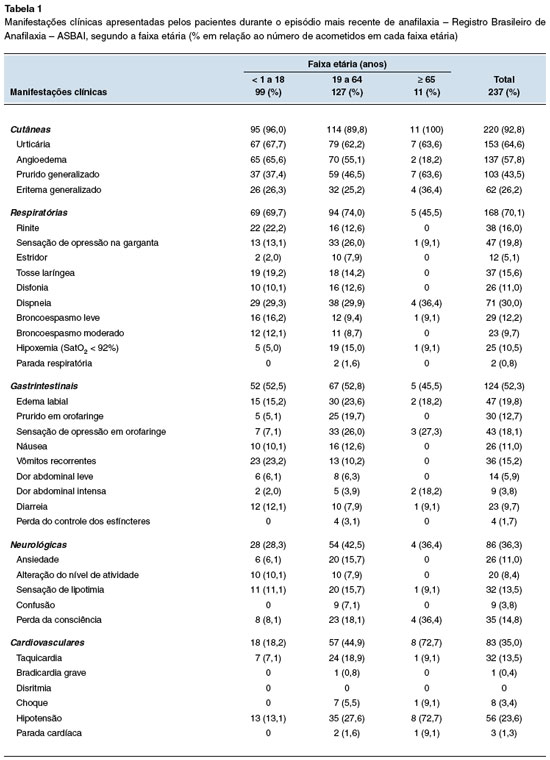
Os sintomas ocorreram nos primeiros 10 minutos após a exposição ao alérgeno em 38,8% dos pacientes, entre 10 e 30 minutos em 44,7%, entre 31 e 59 minutos em 7,2%, e após uma hora em 7,1%. A reação bifásica foi observada em 10 pacientes (4,2%). Houve predomínio das manifestações cutâneas (92,8%) seguidas pelas respiratórias (70,1%), gastrintestinais (52,3%), neurológicas (36,3%) e cardiovasculares (35,3%) (Tabela 1). Urticária foi a manifestação cutânea mais frequente e sem diferenças quanto à idade, já o angioedema predominou entre os menores de 65 anos (Tabela 1). As manifestações respiratórias predominaram entre os menores de 65 anos, sendo a dispneia a mais frequente e sem diferenças quanto ao grupo (Tabela 1). Rinite predominou entre os menores de 18 anos (Tabela 1). As manifestações gastrintestinais ocorreram de modo semelhante nas três faixas etárias, e as neurológicas foram mais frequentes entre os de 18 a 64 anos (Tabela 1). Hipotensão foi mais frequente entre os mais velhos (Tabela 1).
Para 133/137 (97,0%) pacientes que haviam apresentado um episódio prévio, esse anterior foi mais grave. Destes 133 pacientes, 55 eram crianças, 71 adultos, e 7 idosos (sem diferença estatística entre as faixas etárias). Apenas uma adolescente com 12 anos de vida teve desfecho fatal por picada de abelha, alérgeno já conhecido e por não ter sido tratada com adrenalina.
Entre os desencadeantes, destacamos os mais comuns como: alimentos (43,0%), medicamentos (26,2%), picada de Hymenopteros (21,6%) e látex (2,5%) (Tabela 2). Os alimentos predominaram entre os menores de 18 anos (27,4%), sendo o leite de vaca, ovo, amendoim e castanhas os mais comuns nesse grupo, e mariscos e trigo entre os de 19 a 64 anos (Tabela 2). A reação por fármacos predominou entre os adultos (anti-inflamatórios não esteroidais (AINEs), antibióticos e látex) (Tabela 2). Uma análise de variância (ANOVA) foi conduzida para investigar as diferenças nos desencadeantes "alimentos" e "medicamentos" entre os três grupos etários distintos: crianças, adultos e idosos. Os resultados da ANOVA revelaram diferenças significativas na variável "alimentos" entre os grupos etários (F = 7,3; p < 0,001) e "medicamentos" (F = 3,62; p < 0,001). Com relação aos insetos, houve predominância entre os adultos (formiga, vespa e abelha) seguidos pelas crianças (formiga, abelha). Para 78,9% dos pacientes não houve um cofator associado ao quadro, e 6,3% apontaram exercício, 5,4% medicamentos, 1,6% álcool e 1,6% estresse.
Com relação ao tratamento recebido, verificamos que 61,1% dos pacientes receberam adrenalina (52,7% administrada por profissional e 8,4% via kit). Apenas 25 pacientes portavam o kit. O uso de adrenalina na emergência foi maior em adultos do que em crianças (58,3% vs. 43,4%, p < 0,05), respectivamente. Anti-histamínicos foram utilizados por 87,3%, corticosteroides por 83,1%, broncodilatador por 27,4%, oxigenioterapia por 29,5%, e reposição volêmica por 30,8% dos pacientes. Dez pacientes foram entubados (9 adultos/1 idoso), mais frequentemente os que tinham história de episódio anterior mais grave, e oito foram reanimados (6 adultos/2 idosos), todos com história de episódio anterior mais grave (p = 0,039).
Quanto à investigação realizada por estes pacientes, destacamos que apenas 24 (10,1%) realizaram a dosagem de triptase sérica, que se mostrou elevada em dois; 149 realizaram outros exames complementares com a seguinte frequência: dosagem de IgE sérica específica (101/149; 67,7%), testes cutâneos (62/149; 41,6%) e/ou testes de provocação (13/149; 8,7%). A história clínica foi altamente sugestiva em nove pacientes.
Boa parcela dos pacientes já havia sido referenciada a especialista (42,6%) ou foi encaminhada neste episódio (50,2%). O autoinjetor de adrenalina (AIA) foi prescrito a 68,8% dos pacientes. Quanto ao aconselhamento, observou-se que a maioria foi ensinada a usar o AIA (70%), foi instruída sobre o desencadeante (95,8%), sobre a prevenção (96,2%) e sobre a conduta após a reação (97%). A maior parte recebeu plano escrito de emergência (78,1%), porém a minoria recebeu identificação (bracelete/medalha) de anafilaxia (20,7%). Quanto à imunoterapia, 30% recebeu aconselhamento para realizá-la.
Discussão
Nesse estudo relatamos os primeiros 237 pacientes que apresentaram quadro de anafilaxia e cujos dados foram inseridos no Registro Brasileiro de Anafilaxia - ASBAI por seus médicos alergologistas.
Por ser a anafilaxia uma reação alérgica muito grave e potencialmente fatal, é importante que se-jam conhecidos sua evolução clínica, os agentes desencadeantes, bem como a abordagem terapêutica realizada para que diretrizes sejam estabelecidas e possibilitem melhor atendimento a esses pacientes.
À semelhança do observado por outros investigadores ao analisarem dados de diferentes fontes (amostras populacionais, registros nacionais ou internacionais, entre outros) as manifestações cutâneas, sobretudo urticária e angioedema, foram as que predominaram5-19. É importante destacar que, embora a urticária seja um dos itens que compõem os vários critérios diagnósticos para a anafilaxia, al-guns pacientes podem manifestá-la, na ausência de sintomas cutâneos1,3.
Com relação aos agentes etiológicos, vimos uma relação importante de acordo com a faixa etária dos pacientes, sendo os alimentos os predominantes entre os menores, e os medicamentos entre os de maior idade, corroborando com achados de outros registros5,19. Tal fato pode ser justificado pela época em que os indivíduos são expostos. Alimentos cuja introdução ocorre em fase precoce da vida, como leite e ovo são passíveis de induzirem quadros já no início da vida, e os mariscos, cuja introdução alimentar é mais tardia, em fases mais avançadas da vida. O mesmo pode ser dito para os medicamentos. Cabe ressaltar os AINEs como causa principal de anafilaxia por medicamentos em adultos, assim como observado por Jares e cols. na América Latina19.
Com relação às picadas de insetos, é importante lembrar de alguns aspectos relacionados à sua exposição nas diferentes idades. Entre os adultos, predomina a exposição profissional (abelhas), e nas crianças e adolescentes por lazer (formiga, abelha). Outros estudos também mostraram a formiga como um desencadeante relevante na faixa etária pediátrica19.
Quanto ao local da reação, a maioria dos episódios ocorreu na própria residência. Isso pode ser explicado pela maior prevalência de reações por alimentos na nossa amostra e ressalta a importância da disponibilidade do AIA e do aconselhamento adequado após a primeira reação.
Embora o tratamento de eleição na fase aguda da anafilaxia seja a aplicação de adrenalina, verificamos que apenas 61,1% dos pacientes a receberam, e na sua maioria aplicada por profissional de saúde, com frequência menor entre as crianças e adolescentes, e apenas 13,7% empregaram o AIA (kit). O que justificaria tal diferença? Dificuldade em estabelecer-se o diagnóstico de anafilaxia entre os menores de 19 anos? Menor informação pelos médicos atendentes das crianças na emergência? Quadros mais brandos entre os de menor idade?
Apesar da difusão dos conhecimentos recentes e dos treinamentos de suporte à vida, que grande parte dos médicos tem realizado hoje em dia, permanece a baixa prescrição de adrenalina, intramuscular ou subcutânea, em detrimento à prescrição elevada de agentes anti-histamínicos e corticosteroides.
Um dado que chama a nossa atenção é o fato de que os pacientes com história prévia de episódios graves e necessidade de reanimação foram os que manifestaram os quadros mais graves e necessitaram de intubação e tratamento em unidade de tratamento intensivo, todos maiores de 19 anos.
A dosagem de triptase sérica tem sido um dos biomarcadores recomendados para o diagnóstico e seguimento da anafilaxia. Vários fatores interferem com esses níveis, sobretudo o momento da coleta em relação ao tempo de duração do episódio, o que pode justificar a baixa incidência de exame positivo por nós observado.
O acompanhamento especializado destes pacientes é muito importante para permitir a identificação do agente etiológico, além de educar o paciente quanto à doença, sinais de alerta, bem como fornecer um plano escrito em caso de emergência, assim como, se possível, o uso de AIA. Felizmente, a maioria dos pacientes registrados recebeu orientação adequada quanto ao plano de emergência e ao uso do AIA.
Nosso estudo apresenta limitações por ter sido realizado somente por alergistas, em uma amostra não aleatória da população, com provável viés de seleção. Sendo assim, não podemos generalizar esses resultados para toda a população brasileira. Outra fragilidade é o viés de memória, uma vez que o preenchimento destes questionários se baseou nos relatos dos pacientes. Apesar disso, é flagrante a abordagem inadequada a que esses pacientes são submetidos. Por outro lado, apresentamos aspectos positivos por tratar-se de um levantamento com abrangência nacional, incluindo indivíduos com diferentes hábitos alimentares e exposições ambientais, além da utilização de questionário padronizado preenchido por profissionais treinados para o reconhecimento da anafilaxia.
Em conclusão, a análise dos primeiros pacientes com anafilaxia inseridos no RBA-ASBAI nos aponta para a necessidade de maior divulgação dos casos de anafilaxia e educação mais abrangente para leigos e outros profissionais, especialmente para a prevenção de novos episódios e tratamento adequado em caso de recorrência.
Agradecimentos
A todos os médicos que atenderam aos pacientes e os incluíram no RBA-ASBAI, sobretudo os do Grupo Brasileiro de Interesse em Anafilaxia (GBIA).
Referências
1. Muraro A, Worm M, Alviani C, Cardona V, DunnGalvin A, Garvey LH, et al.; European Academy of Allergy and Clinical Immunology, Food Allergy, Anaphylaxis Guidelines Group. EAACI guidelines: Anaphylaxis (2021 update). Allergy. 2022 Feb;77(2):357-377.
2. Motosue MS, Li JT, Campbell RL. Anaphylaxis: Epidemiology and Differential Diagnosis. Immunol Allergy Clin North Am. 2022 Feb;42(1):13-25.
3. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020 Oct 30;13(10):100472.
4. ASCIA Anaphylaxis Clinical Update [site na Internet]. Disponível em: https://www.allergy.org.au/images/stories/hp/info/ASCIA_HP_Clinical_Update_Anaphylaxis_Dec2016.pdf. Acessado em: fevereiro/2021.
5. Bernd LAG, Fleig F, Alves MB, Bertozzo R, Coelho M, Correia JC, et al. Anafilaxia no Brasil - Levantamento da ASBAI. Rev Bras Alerg Imunopatol 2010;33(5):190-8.
6. Sole D, Ivancevich JC, Borges MS, Coelho MA, Rosario NA, Ardusso LRF, et al. Anaphylaxis in Latin America: a report of the online Latin American survey on anaphylaxis (OLASA). Clinics (Sao Paulo). 2011;66(6):943-7.
7. Nunes FA, Zanini F, Braga CS, da Silva AL, Fernandes FR, Solé D, et al. Incidence, triggering factors, symptoms, and treatment of anaphylaxis in a pediatric hospital. World Allergy Organ J. 2022 Aug 21;15(9):100689.
8. Bastos PGA, Camelo-Nunes IC, Cocco RR, Solé D, Ensina LFC. Anaphylaxis: data from a patient registry in a specialized service. Arq Asma Alerg Imunol. 2019;3(2):168-76.
9. Tanno LK, Molinari N, Annesi-Maesano I, Demoly P, Bierrenbach Al. Anaphylaxis in Brazil between 2011 and 2019. Clin Exp Allergy. 2022;52(9):1071-8.
10. Gaspar A, Santos N, Faria E, Câmara R, Rodrigues-Alves R, Carrapatoso I, et al.; Portuguese Society of Allergology and Clinical Immunology (SPAIC) Anaphylaxis Interest Group. Anaphylaxis: A Decade of a Nationwide Allergy Society Registry. J Investig Allergol Clin Immunol. 2021 Feb 21;32(1):23-32.
11. Jeong K, Ye YM, Kim SH, Kim KW, Kim JH, Kwon JW, et al. A multicenter anaphylaxis registry in Korea: Clinical characteristics and acute treatment details from infants to older adults. World Allergy Organ J. 2020;13(8):100449.
12. Poziomkowska-Gesicka I, Kurek M. Clinical Manifestations and Causes of Anaphylaxis. Analysis of 382 Cases from the Anaphylaxis Registry in West Pomerania Province in Poland. Int J Environ Res Public Health. 2020 Apr 17;17(8):2787.
13. Edelman SM, Kukkonen AK, Mäkelä MJ. Eliciting allergens and treatment of anaphylaxis: Report of the finnish national anaphylaxis registry. Allergy. 2019 Oct;74(10):2010-13.
14. Turner PJ, Gowland MH, Sharma V, Ierodiakonou D, Harper N, Garcez T, et al. Increase in anaphylaxis-related hospitalizations but no increase in fatalities: an analysis of United Kingdom national anaphylaxis data, 1992-2012. J Allergy Clin Immunol. 2015;135(4):956-63.
15. Miles LM, Gabrielli S, Clarke AE, Morris J, Eisman H, Gravel J, et al. When and how pediatric anaphylaxis cases reach the emergency department: Findings from the Cross-Canada Anaphylaxis Registry. J Allergy Clin Immunol Pract. 2020;8(4):1406-9.
16. Worm M, Moneret-Vautrin A, Scherer K, Lang R, Fernandez-Rivas M, Cardona V, et al. First European data from the network of severe allergic reactions (NORA). Allergy. 2014;69(10):1397-404.
17. Schraven SP, Mlynski R. Evaluation of Multicenter Registry Data. Laryngorhinootologie. 2019 Mar;98(S 01):S173-S196.
18. Kraft M, Knop MP, Renaudin JM, Scherer Hofmeier K, Pföhler C, Bilò MB, et al.; Network for Online Registration of Anaphylaxis (NORA). Secondary prevention measures in anaphylaxis patients: Data from the anaphylaxis registry. Allergy. 2020 Apr;75(4):901-10.
19. Jares EJ, Cardona V, Gómez RM, Bernstein JA, Rosario Filho NA, Cherrez-Ojeda I, et al. Latin American anaphylaxis registry. World Allergy Organ J. 2023;16(2):100748.
20. UK Anaphylaxis Registry [site na Internet]. Disponível em: https://www.bsaci.org/professional-resources/bsaci-registries/ukanaphylaxis-registry/. Acessado em: 10/12/2023.
21. ASBAI - Registro Brasileiro de Anafilaxia [site na Internet]. Disponível em: https://asbai.org.br/registro-brasileiro-de-anafilaxia/. Acessado em: 12/12/2023.