Número Atual: Janeiro-Março 2024 - Volume 8 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
Artigo de Revisão
Manejo dos eventos adversos do dupilumabe na dermatite atópica e no prurigo nodular
Management of the adverse effects of dupilumab in atopic dermatitis and prurigo nodularis
Mara Giavina-Bianchi1,2
1. Hospital Israelita Albert Einstein
2. Disciplina de Imunologia Clínica e Alergia da FMUSP
Endereço para correspondência:
Mara Giavina-Bianchi
E-mail: marahgbianchi@gmail.com
Submetido em: 30/03/2022
Aceito em: 12/11/2023.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A dermatite atópica (DA) e o prurigo nodular (PN) são doenças inflamatórias da pele que cursam com lesões variadas, como eczemas, pápulas e nódulos, acompanhados de intenso prurido e, nos casos graves, de importante prejuízo da qualidade de vida para os pacientes e seus familiares. O dupilumabe está aprovado no Brasil para o manejo das duas condições: DA moderada/grave e PN que não responde aos tratamentos tópicos. A eficácia e segurança do dupilumabe foram amplamente estabelecidas para ambas as condições em ensaios clínicos e estudos de vida real. Este artigo tem como objetivo revisar os principais eventos adversos (EAD) associados ao uso do dupilumabe em DA e PN, e auxiliar no seu manejo. Desde o início do uso da medicação, há alguns anos, os principais EAD reportados foram: a reação no local da injeção, a doença da superfície ocular (conjuntivite não infecciosa, blefarite, olhos secos), a eosinofilia e o eritema de face/pescoço. Outras manifestações também foram observadas em pacientes com DA em uso de dupilumabe, mas sem associação comprovada: psoríase, artralgia e alopecia areata. Apesar de muito infrequentemente levarem à suspensão do dupilumabe, é fundamental que os médicos prescritores deste medicamento para estas condições, dermatologistas e imunoalergistas, saibam detectar e manejar seus possíveis eventos adversos.
Descritores: Dermatite atópica, prurigo nodular, dupilumabe, eventos adversos, manejo.
Introdução
A dermatite atópica (DA) é uma doença inflamatória crônica da pele, com lesões eczematosas de localização típica segundo a idade e prurido intenso1,2. A prevalência de DA é de aproximadamente 15% em crianças e 5% em adultos, e está aumentando3,4. É a principal queixa dermatológica da infância e a segunda na adolescência que leva o paciente a procurar o especialista, conforme mostra estudo brasileiro5.
Viver com DA pode ser um fardo, principalmente para aqueles que necessitam de tratamento sistêmico em longo prazo, uma vez que os imunossupressores utilizados às vezes não controlam o quadro e podem levar a reações adversas graves. Prurido e lesões cutâneas causam distúrbios do sono, ansiedade, depressão, baixa autoestima e incapacidade para atividades física, escolar e laboral, comprometendo a qualidade de vida dos pacientes e familiares6. Há associação entre a gravidade da doença e a diminuição da qualidade de vida, tanto para o paciente como para sua família7.
O prurigo nodular (PN) é também uma doença inflamatória crônica da pele, muito pruriginosa e caracterizada por pápulas e/ou nódulos firmes, isolados ou confluentes, mais observado em pacientes de meia-idade e mulheres. Doenças sistêmicas como nefrite, diabetes tipo 2 e infecção por HIV podem estar associadas ao PN. A patogênese ainda não está totalmente clara, mas a desregulação imune e o circuito neural têm papel importante no ciclo vicioso de prurido e coçadura da pele8.
O tratamento tradicional das duas doenças inclui corticoides tópicos, inibidores da calcineurina tópicos, emolientes, fototerapia, gabapentinas e imunossupressores, com uma gama variada de efeitos adversos3,6. Há alguns anos, o dupilumabe provou ser muito eficaz e seguro para DA, com inúmeros estudos demonstrando sua eficácia e segurança tanto em ensaios clínicos como em vida real9-12. Recentemente, o dupilumabe foi aprovado também para PN nos EUA13 e no Brasil14. Dois ensaios clínicos randomizados de fase 3 (LIBERTY-PN PRIME e PRIME2) demonstraram melhora estatisticamente significante no prurido e nas lesões de PN com o dupilumabe versus placebo. Os eventos adversos foram consistentes com o perfil de segurança já conhecido15.
O dupilumabe foi o primeiro imunobiológico aprovado para o tratamento da DA moderada a grave e do PN sem resposta aos tratamentos tópicos no Brasil. É um anticorpo monoclonal totalmente humano da classe IgG4 que tem como alvo direto a cadeia alfa compartilhada dos receptores da IL-4 e IL-1316. Essas duas citocinas estão envolvidas na resposta imune Th2, induzindo sensibilização a alérgenos, promovendo inflamação atópica e diminuindo a função e a estrutura da barreira cutânea. O anticorpo inibe a ação dessas citocinas e promove a alterações na expressão gênica nas lesões de DA, melhorando sua assinatura molecular17. Diversos estudos mostraram a eficácia impactante e a segurança do dupilumabe no tratamento da DA, em diversas situações e faixas etárias10,18,19. Essa nova abordagem terapêutica personalizada baseia-se na patogênese da doença e é um marco no tratamento da DA, e mais recentemente, do PN.
Possíveis eventos adversos do dupilumabe
Dentre os eventos adversos associados ao uso do dupilumabe estão: a reação no local da injeção, a doença da superfície ocular (conjuntivite não infecciosa, blefarite, olhos secos), a eosinofilia, e o eritema de face/pescoço, que já são conhecidos há alguns anos, desde o início do uso da medicação. Um estudo holandês recente, em vida real, incluiu também a disfunção das glândulas de Meibomian como um novo evento adverso relacionado ao medicamento em pacientes com DA20.
Reação no local da injeção
As reações locais estiveram presentes em 11,4% de 1.888 pacientes em uso do dupilumabe, sendo mais comum o eritema, seguido de reação não especificada, dor e prurido no local da administração do imunobiológico. Não há relatos de descontinuação do medicamento devido a reações locais, e o tratamento, quando necessário, é sintomático, com analgésicos ou anti-inflamatórios orais e corticoides tópicos por alguns dias21.
Doença da superfície ocular (conjunvite, blefarite, olhos secos)
A Figura 1 ilustra os diagnósticos diferenciais da Doença da Superfície Ocular (DSO). Independente do uso de dupilumabe, pacientes com DA frequentemente apresentam outras doenças atópicas associadas, como a asma, rinite, alergia alimentar e conjuntivite alérgica, incluindo um fenótipo mais crônico e grave, denominado ceratoconjuntivite atópica. Estudo realizado nos EUA em pacientes adultos para avaliar a associação entre DA e conjuntivite, entre 2001-2015, comparou a frequência de conjuntivite em pacientes com DA e sem DA. O risco de conjuntivite foi quatro vezes maior em indivíduos com DA (OR = 4,38; IC 95%: 1,39-13,79; p = 0,012) e, especificamente, foi 8 vezes maior para conjuntivite alérgica (OR = 8,03; IC 95%: 1,76-36,58; p = 0,007). A conclusão é que adultos com DA têm um risco significativamente maior de conjuntivite alérgica, quando comparados aos indivíduos sem DA22. É fundamental que os médicos que assistem estes pacientes tenham conhecimento dessa questão e que aprendam a reconhecer e manejar a conjuntivite alérgica. Outros estudos em adultos no Irã23 e na Holanda24 também evidenciaram resultados semelhantes, assim como outras pesquisas em crianças25-27.
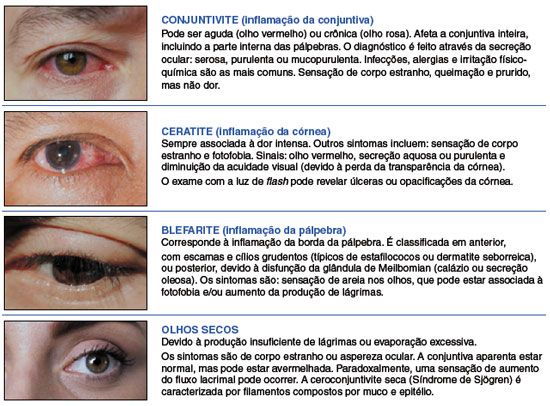
Figura 1
Exemplos de doenças da superfície ocular comuns em pacientes com dermatite atópica Adaptado de Guex-Crosier Y, et al.47.
A conjuntivite é uma inflamação da conjuntiva, membrana fina e transparente que reveste a parte anterior da esclera e a parte interna das pálpebras. A conjuntivite alérgica tem prevalência estimada em 20% da população mundial28. Os sintomas são prurido, lacrimejamento, hiperemia e edema da conjuntiva (quemose), além de turvação visual nos casos mais graves29. A associação DA e conjuntivite alérgica pode ser explicada por estas doenças apresentarem mecanismos fisiopatológicos semelhantes. Ambas envolvem a resposta imune Tipo II, na maioria das vezes desencadeada por processo alérgico, mas também apresentam alterações de barreira física. Além da disfunção na barreira cutânea, estudos sugerem a existência de problemas no epitélio da superfície ocular em indivíduos com DA, o que os tornaria mais suscetíveis à conjuntivite30,31.
Entretanto, a conjuntivite associada ao uso de dupilumabe tem fisiopatologia desconhecida. O tempo médio para o desenvolvimento da conjuntivite associada ao medicamento variou de 2 a 8 semanas durante os ensaios clínicos, e o número de casos novos foi crescente ao longo do tempo, estabilizando ao redor de 20-24 semanas32.
O tratamento inclui agentes tópicos como antihistamínicos, estabilizadores de mastócitos, antiinflamatórios não esteroidais e corticoides. Evitar os alérgenos também é fundamental, e o uso de lentes de contato deve ser evitado durante as crises para prevenir a contaminação por agentes infecciosos e complicação do quadro22.
Durante os estudos sobre a segurança e eficácia do dupilumabe na DA, a conjuntivite foi uma das reações adversas mais comumente notadas. Nos estudos pivotais, a incidência de conjuntivite foi estatisticamente maior no grupo tratado com dupilumabe (8,6-22,1%) do que no grupo placebo (2,1-11,1%). Estudo recente de vida real, que incluiu 29 centros franceses e 241 pacientes, mostrou taxa de conjuntivite maior, de 38%. Neste estudo, o desenvolvimento da conjuntivite esteve significativamente associado à história pessoal prévia de conjuntivite alérgica, e em 4% dos casos foi motivo para a descontinuação da medicação12. Nos estudos de PN, a conjuntivite foi o evento adverso mais frequente (12,6%; n = 15/119)8.
Portanto, médicos que utilizam o dupilumabe devem estar cientes dos sinais, sintomas e opções de tratamento nos casos de conjuntivite que podem vir a ocorrer. Uma sugestão de algoritmo do manejo da DSO por dupilumabe é apresentado na Figura 2.
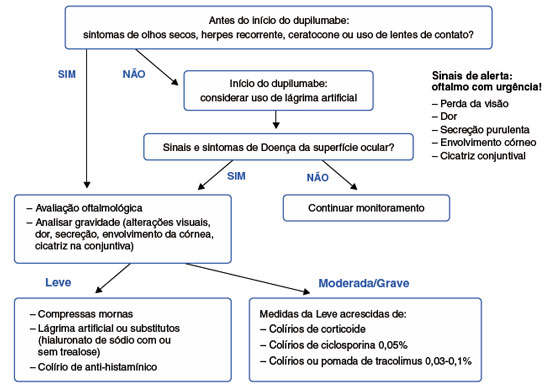
Figura 2
Algoritmo para o manejo da doença da superfície ocular associada ao uso do dupilumabe na dermatite atópica e prurigo nodular
Adaptado de Guex-Crosier Y, et al.47.
Eosinofilia
A eosinofilia não é incomum nos pacientes tratados com dupilumabe. Aproximadamente 20% dos casos de DA em mundo real sofrem um aumento de eosinófilos em relação ao valor basal. A hipereosinofilia (acima de 1.500/mm3) ocorre em 9-11% dos pacientes. O mecanismo proposto é de que o medicamento iniba a migração dos eosinófilos para o tecido, mas não a produção pela medula óssea, levando a um acúmulo no sangue. A eosinofilia é geralmente transitória e sem consequências clínicas.
Eritema de face e pescoço por dupilumabe
O eritema facial/cervical por dupilumabe consiste no aparecimento de eritema na face e/ou pescoço em paciente com DA que não apresentava lesões nestas áreas ou cujas lesões passaram a apresentar características distintas das pré-existentes. Não se sabe a causa ao certo, mas as possíveis etiologias são: rosácea, dermatite de contato, colonização por Malassezia furfur, efeitos adversos dos inibidores da calcineurina ou a suspensão dos corticoides tópicos levando a uma piora do quadro. É importante salientar que a grande maioria dos pacientes com DA e lesões pré-existentes na face, melhoraram com o dupilumabe. Um estudo com 162 indivíduos com DA em uso de dupilumabe e lesões na face mostrou melhora em 88,3%, enquanto 6,6% não tiveram alteração e 4,3% exacerbaram33. Em outra pesquisa, com 101 pacientes diagnosticados com eritema da face/ou pescoço, 45% reportaram sintomas cutâneos diferentes da dermatite pré-existente. Os tratamentos mais utilizados foram corticoides tópicos, inibidores da calcineurina tópicos, antifúngicos e ivermectina tópica ou oral. Nesse estudo, 11% dos 101 pacientes com eritema facial/cervical descontinuaram o dupilumabe devido a este evento adverso34. Em outro estudo com 916 indivíduos recebendo dupilumabe para DA, o eritema facial/cervical ocorreu em 82 pacientes (9%)35.
Outras manifestações observadas em pacientes com DA em uso de dupilumabe, mas sem associação comprovada, foram psoríase36,37, artralgia38 e alopecia areata35.
Psoríase
O surgimento de lesões psoriasiformes paradoxais (P-PR) em paciente utilizando dupilumabe foi relatado recentemente. O contrário, casos de eczema em pacientes tratados com imunobiológicos para psoríase, também foi descrito. Um estudo verificou 42 pacientes que desenvolveram P-PR, sendo 41 "de novo"e 1 com piora da psoríase pré-existente.Todos os pacientes responderam bem ao tratamento da DA com dupilumabe antes das P-PR surgirem, em média, 22,65 semanas após o início do imunobiológico. Os tratamentos utilizados foram corticoides tópicos em 38,5%, ou terapia sistêmica em 38,5%, ou suspensão do dupilumabe em 32,5% dos casos36. Outro artigo incluiu 112 pacientes com DA com P-PR, sendo 101 "de novo" e 11 com piora da psoríase pré-existente. No primeiro grupo, as lesões ocorreram mais no couro cabeludo e extremidades, em média 5 meses após o início do dupilumabe e, no segundo grupo, 4 meses após o início. No grupo "de novo", o dupilumabe foi suspenso em 38/101 (38%) dos casos. A suspensão e/ou tratamento levou à remissão completa da psoríase em 30/63 (48%); à remissão incompleta em 3/63 (5%); à recorrência em 1/63 (1,5%); à persistência em 5/63 (8%) e à piora em 6/63 (10%). No segundo grupo, 50% suspendeu o dupilumabe37.
Artralgia
Casos de artralgia como possível efeito adverso do tratamento com dupilumabe em pacientes com DA foram relatados, apesar de não terem ocorrido durante os ensaios clínicos. O intervalo do surgimento da artralgia foi de dias a meses após o início. Um estudo de vida real com 4.000 pacientes em uso de dupilumabe ao longo de 6 meses não mostrou um risco aumentado de artralgia, quando comparado a outros pacientes com DA em uso de ciclosporina ou micofenolato de mofetil. Portanto, o estudo conclui que não há motivos para uma crescente preocupação quanto ao surgimento de novos casos de artralgia associados ao tratamento com dupilumabe38.
Alopecia areata (AA)
Num estudo retrospectivo com 916 pacientes utilizando dupilumabe, 11 relataram alopecia areata como evento adverso (1,2%)35. No entanto, outros relatos de caso indicam que o dupilumabe pode, inclusive, ser eficaz no tratamento da AA com DA concomitante39,40.
Conclusão
A conjuntivite é uma das reações adversas mais frequentes no tratamento do paciente com dermatite atópica em uso do dupilumabe, e esses mesmos pacientes, com doença de intensidade moderada a grave, são os que estão estatisticamente mais propensos a desenvolver conjuntivite alérgica. É importante o médico ter ciência dessas questões e, se possível, aprender a manejar minimamente a conjuntivite até o oftalmologista ser consultado, conforme algoritmo apresentado. Vários relatos de casos demonstraram que espaçar as injeções de dupilumabe tende a diminuir esse efeito adverso41-45. Suspender, porém, o tratamento de um paciente que está evoluindo bem com o dupilumabe devido à conjuntivite não é nem um pouco desejável. Felizmente, é raro que isso aconteça, pois o diagnóstico e tratamento precoces da conjuntivite costumam ser medidas eficazes no seu controle, permitindo que o paciente prossiga com o tratamento da dermatite atópica e consiga o tão desejado controle da doença46.
Quanto aos demais eventos adversos relatados, vimos que a eosinofilia, apesar de relativamente comum, é transitória e não tem consequências clínicas. As reações locais, se ocorrerem, são facilmente manejáveis. O eritema facial/cervical ainda é uma incógnita, pois pode ter diferentes etiologias e há muitas opções de tratamentos empíricos. A reação paradoxal do surgimento "de novo" ou piora das lesões de psoríase foi descrita, e mesmo sendo infrequente, reforça a importância de se pesquisar antecedentes pessoais e familiares para doenças autoimunes nos pacientes com DA. A artralgia não parece ser uma preocupação, pois sua associação não foi confirmada ao uso dupilumabe. A alopecia areata associada à DA merece mais estudos, pois tanto pode ser pré-existente, quanto surgir após a introdução do dupilumabe, ou ainda, este pode auxiliar na repilação da AA.
Concluindo, temos evidências científicas abundantes mostrando a eficácia e segurança do dupilumabe, e, na prática diária, acompanhamos com satisfação a possibilidade da melhora que este medicamento trouxe à vida dos pacientes com DA moderada à grave e PN.
Referências
1. Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol. 2018;32(6):850-78.
2. Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018;32(5):657-82.
3. Kay J, Gawkrodger DJ, Mortimer MJ, Jaron AG. The prevalence of childhood atopic eczema in a general population. J Am Acad Dermatol. 1994;30(1):35-9.
4. Silverberg JI, Hanifin JM. Adult eczema prevalence and associations with asthma and other health and demographic factors: a US population-based study. J Allergy Clin Immunol. 2013;132(5):1132-8.
5. Giavina Bianchi M, Santos AP, Cordioli E. The majority of skin lesions in pediatric primary care attention could be managed by Teledermatology. PLoS One. 2019;14(12):e0225479.
6. Silverberg JI, Gelfand JM, Margolis DJ, Boguniewicz M, Fonacier L, Grayson MH, et al. Symptoms and diagnosis of anxiety and depression in atopic dermatitis in U.S. adults. Br J Dermatol. 2019;181(3):554-65.
7. Campos ALB, Araújo FM, Santos MALD, Santos AASD, Pires CAA. Impact of atopic dermatitis on the quality of life of pediatric patients and their guardians. Rev Paul Pediatr. 2017;35(1):5-10.
8. Cao P, Xu W, Jiang S, Zhang L. Dupilumab for the treatment of prurigo nodularis: A systematic review. Front Immunol. 2023;14:1092685.
9. Wollenberg A, Beck LA, Blauvelt A, Simpson EL, Chen Z, Chen Q, et al. Laboratory safety of dupilumab in moderate-to-severe atopic dermatitis: results from three phase III trials (LIBERTY AD SOLO 1, LIBERTY AD SOLO 2, LIBERTY AD CHRONOS). Br J Dermatol. 2020;182(5):1120-35.
10. Simpson EL, Bieber T, Guttman-Yassky E, Beck LA, Blauvelt A, Cork MJ, et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016;375(24):2335-48.
11. Stingeni L, Bianchi L, Antonelli E, Caroppo ES, Ferrucci SM, Ortoncelli M, et al. Moderate-to-severe atopic dermatitis in adolescents treated with dupilumab: A multicentre Italian real-world experience. J Eur Acad Dermatol Venereol. 2022;36(8):1292-9.
12. Faiz S, Giovannelli J, Podevin C, Jachiet M, Bouaziz JD, Reguiai Z, et al. Effectiveness and safety of dupilumab for the treatment of atopic dermatitis in a real-life French multicenter adult cohort. J Am Acad Dermatol. 2019;81(1):143-51.
13. Sanofi. Press Release: Dupixent® (dupilumab) approved by FDA as the first and only treatment indicated for prurigo nodularis [Internet]. Disponível em: https://www.sanofi.com/en/media-room/press-releases/2022/2022-09-28-22-05-26-2524764.
14. Brasil, Ministério da Saúde, Agência Nacional de Vigilância Sanitária (Anvisa). DUPIXENT (dupilumabe): nova indicação [Internet]. 2023. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/novos-medicamentos-e-indicacoes/dupixentdupilumabe-nova-indicacao-3#:~:text =)%3A%20nova%20 indica%C3%A7%C3%A3o-,DUPIXENT%20(dupilumabe)%3A%20nova%20indica%C3%A7%C3%A3o,estes%20tratamentos%20 n%C3%A3o%20s%C3%A3o%20aconselhados.
15. Yosipovitch G, Mollanazar N, Ständer S, Kwatra SG, Kim BS, Laws E, et al. Dupilumab in patients with prurigo nodularis: two randomized, double-blind, placebo-controlled phase 3 trials. Nat Med. 2023;29(5):1180-90.
16. Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013;368(26):2455-66.
17. Guttman-Yassky E, Bissonnette R, Ungar B, Suárez-Fariñas M, Ardeleanu M, Esaki H, et al. Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis. J Allergy Clin Immunol. 2019;143(1):155-72.
18. Simpson EL, Paller AS, Siegfried EC, Boguniewicz M, Sher L, Gooderham MJ, et al. Efficacy and Safety of Dupilumab in Adolescents With Uncontrolled Moderate to Severe Atopic Dermatitis: A Phase 3 Randomized Clinical Trial. JAMA Dermatol. 2019.
19. Blauvelt A, de Bruin-Weller M, Gooderham M, Cather JC, Weisman J, Pariser D, et al. Long-term management of moderate-tosevere atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017;389(10086):2287-303.
20. Musters AH, van Lookeren FL, van der Gang LF, Middelkamp-Hup MA, Bosma AL, Jessurun NT, et al. Real-world reported adverse events related to systemic immunomodulating therapy in patients with atopic dermatitis: Results from the TREAT NL (TREatment of ATopic eczema, the Netherlands) registry. J Eur Acad Dermatol Venereol. 2023.
21. Kim PJ, Lansang RP, Vender R. A Systematic Review and Meta- Analysis of Injection Site Reactions in Randomized-Controlled Trials of Biologic Injections. J Cutan Med Surg. 2023;27(4):358-67.
22. Wu KK, Borba AJ, Deng PH, Armstrong AW. Association between atopic dermatitis and conjunctivitis in adults: a population-based study in the United States. J Dermatolog Treat. 2019:1-5.
23. Shokouhi Shoormasti R, Pourpak Z, Fazlollahi MR, Kazemnejad A, Nadali F, Ebadi Z, et al. The prevalence of allergic rhinitis, allergic conjunctivitis, atopic dermatitis and asthma among adults of Tehran. Iran J Public Health. 2018;47(11):1749-55.
24. Thyssen JP, Toft PB, Halling-Overgaard AS, Gislason GH, Skov L, Egeberg A. Incidence, prevalence, and risk of selected ocular disease in adults with atopic dermatitis. J Am Acad Dermatol. 2017;77(2):280-6.e1.
25. Schneider L, Hanifin J, Boguniewicz M, Eichenfield LF, Spergel JM, Dakovic R, et al. Study of the Atopic March: Development of Atopic Comorbidities. Pediatr Dermatol. 2016;33(4):388-98.
26. Henriksen L, Simonsen J, Haerskjold A, Linder M, Kieler H, Thomsen SF, et al. Incidence rates of atopic dermatitis, asthma, and allergic rhinoconjunctivitis in Danish and Swedish children. J Allergy Clin Immunol. 2015;136(2):360-6.e2.
27. Stensballe LG, Klansø L, Jensen A, Haerskjold A, Thomsen SF, Simonsen J. The validity of register data to identify children with atopic dermatitis, asthma or allergic rhinoconjunctivitis. Pediatr Allergy Immunol. 2017;28(6):535-42.
28. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet. 1998;351(9111):1225-32.
29. Cronau H, Kankanala RR, Mauger T. Diagnosis and management of red eye in primary care. Am Fam Physician. 2010;81(2):137-44.
30. Yokoi K, Yokoi N, Kinoshita S. Impairment of ocular surface epithelium barrier function in patients with atopic dermatitis. Br J Ophthalmol. 1998;82(7):797-800.
31. Mantelli F, Mauris J, Argüeso P. The ocular surface epithelial barrier and other mechanisms of mucosal protection: from allergy to infectious diseases. Curr Opin Allergy Clin Immunol. 2013;13(5):563-8.
32. Akinlade B, Guttman-Yassky E, de Bruin-Weller M, Simpson EL, Blauvelt A, Cork MJ, et al. Conjunctivitis in dupilumab clinical trials. Br J Dermatol. 2019;181(3):459-73.
33. Ahn J, Lee DH, Na CH, Shim DH, Choi YS, Jung HJ, et al. Facial erythema in patients with atopic dermatitis treated with Dupilumab - a descriptive study of morphology and Aetiology. J Eur Acad Dermatol Venereol. 2022;36(11):2140-52.
34. Jo CE, Finstad A, Georgakopoulos JR, Piguet V, Yeung J, Drucker AM. Facial and neck erythema associated with dupilumab treatment: A systematic review. J Am Acad Dermatol. 2021;84(5):1339-47.
35. Napolitano M, Fabbrocini G, Patruno C. Dupilumab-associated cutaneous adverse events among adult patients with atopic dermatitis: A retrospective study. J Dermatol. 2023;50(7):880-7.
36. Li Y, Liu H, Zhang F. Biologics-Induced Immunophenotypic Cross- Switching in Patients with Psoriasis and Atopic Dermatitis. Indian J Dermatol. 2023;68(2):186-91.
37. Trave I, Salvi I, Burlando M, Cozzani E, Parodi A. "De Novo" Psoriasis and Relapse of Psoriasis Induced by Dupilumab: Three New Cases and Review of the Literature. J Clin Med. 2023;12(19):6291.
38. Schneeweiss MC, Wyss R, Schneeweiss S, Anand P, Jin Y, Dicesare E, et al. Joint pain in patients with atopic dermatitis receiving treatment with dupilumab: A US nationwide cohort study. J Am Acad Dermatol. 2024;90(1):134-7.
39. Yan X, Tayier M, Cheang ST, Liao Z, Dong Y, Yang Y, et al. Hair repigmentation and regrowth in a dupilumab-treated paediatric patient with alopecia areata and atopic dermatitis: a case report. Ther Adv Chronic Dis. 2023;14:20406223231191049.
40. Bur D, Kim K, Rogge M. Dupilumab Induced Hair Regrowth in Alopecia Totalis. J Drugs Dermatol. 2023;22(4):410-2.
41. Treister AD, Kraff-Cooper C, Lio PA. Risk Factors for Dupilumab- Associated Conjunctivitis in Patients With Atopic Dermatitis. JAMA Dermatol. 2018;154(10):1208-11.
42. Maudinet A, Law-Koune S, Duretz C, Lasek A, Modiano P, Tran THC. Ocular Surface Diseases Induced by Dupilumab in Severe Atopic Dermatitis. Ophthalmol Ther. 2019;8(3):485-90.
43. Ivert LU, Wahlgren CF, Ivert L, Lundqvist M, Bradley M. Eye Complications During Dupilumab Treatment for Severe Atopic Dermatitis. Acta Derm Venereol. 2019;99(4):375-8.
44. Barnes AC, Blandford AD, Perry JD. Cicatricial ectropion in a patient treated with dupilumab. Am J Ophthalmol Case Rep. 2017;7:120-2.
45. Levine RM, Tattersall IW, Gaudio PA, King BA. Cicatrizing Blepharoconjunctivitis Occurring During Dupilumab Treatment and a Proposed Algorithm for Its Management. JAMA Dermatol. 2018;154(12):1485-6.
46. Agnihotri G, Shi K, Lio PA. A Clinician's Guide to the Recognition and Management of Dupilumab-Associated Conjunctivitis. Drugs R D. 2019;19(4):311-8.
47. Guex-Crosier Y, Di-Lucca J, Häusermann P, Laffitte E, Saulite I, Schmid-Grendelmeier P, et al. Management of dupilumab-associated ocular surface diseases in atopic dermatitis patients. Swiss Med Wkly. 2021 Aug 20;151:w30020. doi: 10.4414/SMW.2021.w30020.



