Número Atual: Abril-Junho 2023 - Volume 7 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Imunoterapia de dessensibilização para Malassezia spp. - Relato de caso experimental
Desensitization immunotherapy for Malassezia spp.: experimental case report
Raphael Coelho Figueiredo1; Caroline Braga Barroso2; Livio Melo Barbosa2; Márcia Gabrielly Teles de-Macedo2; Peniel Leite Rocha2; Andréa Maria de Araújo Mendes2; Lara Milena Santos Silva3; Elaine de Lima de-Almeida1
DOI: 10.5935/2526-5393.20230031
1. Clínica de Alergia e Imunologia Clínica (CAAIC) - Imperatriz, MA, Brasil
2. Universidade Federal do Maranhão, Curso de Medicina - Centro de Ciências de Imperatriz - Imperatriz, MA, Brasil
3. Universidade Estadual da Região Tocantina do Maranhão - Curso de Medicina - UEMASUL - Imperatriz, MA, Brasil
Endereço para correspondência:
Raphael Coelho Figueiredo
E-mail: formimp@hotmail.com
Submetido em: 27/09/2022
Aceito em: 19/04/2023.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A pitiríase versicolor (PV) consiste em uma infecção fúngica ocasionada por leveduras de Malassezia spp., que apesar de manejo simples, é uma doença com elevadas chances de recidiva e cronificação, além da pouca variedade de terapias efetivas para tratar cepas resistentes. Existem relatos na literatura sobre utilização de dessensibilização para Malassezia spp., mas para o tratamento de dermatite atópica e não PV, conferindo caráter inovador ao relato em questão. O caso apresentado consiste em um paciente de 28 anos, do sexo masculino, com manifestações típicas de PV em região de face, cervical, dorsal e axilar, há 4 anos, com resistência aos esquemas terapêuticos tópicos e sistêmicos. Uma vez identificada a ineficácia das terapias tradicionais, foi iniciado o tratamento com dessensiblização para Malassezia spp., em aplicações semanais, com aumento progressivo da dosagem e posterior aumento no intervalo das aplicações. Após onze meses de realização do novo tratamento, o paciente evoluiu com melhora completa das lesões. Conclui-se que a utilização de técnicas imunoterápicas para o tratamento de PV foi considerado eficaz no caso relatado, apesar de ainda não haver evidências que amparem sua utilização em maior escala.
Descritores: Malassezia, tinha versicolor, dessensibilização imunológica, relatos de casos.
Introdução
A pitiríase versicolor (PV), também conhecida de tínea versicolor, constitui-se como uma infecção fúngica benigna, superficial e bastante comum, ocasionada por leveduras pertencentes ao gênero Malassezia spp., também denominada de Pityrosporum. Atualmente, já existe a descrição de 14 espécies de Malassezia, sendo que as principais relacionadas com a manifestação da PV são M. furfur, M. globosa e M. sympodialis1.
Essas pseudoleveduras são fungos dimórficos, saprofíticos e dependentes de lipídios, encontrados na flora normal da pele. Contudo, devido à influência de fatores endógenos e exógenos, tais como hiperidrose, uso de óleos tópicos na pele, imunossupressão, desordem endócrina, má nutrição e predisposição genética, dentre outros, esses fungos acabam convertendo para uma forma micelial patogênica, associada ao surgimento das manifestações clínicas típicas de PV2. Logo, aflige mais comumente adolescentes e adultos jovens, visto que, devido a estímulos androgênicos aumentados nessas fases da vida, as glândulas sebáceas alcançam seu ápice de funcionamento, predispondo à colonização fúngica3,4.
Essa dermatose é marcada por lesões dermatológicas que podem se manifestar na forma de manchas ou placas finamente escamosas com alterações variáveis na pigmentação cutânea, com regiões hipopigmentadas, hiperpigmentadas e/ou levemente eritematosas. Os locais mais afetados são pescoço, tronco e extremidades proximais, com uma menor frequência nas áreas intertriginosas e na face5. Desse modo, o aspecto clínico de alteração da coloração da pele é a principal queixa do paciente, principalmente por determinar grande estigma social6.
Antifúngicos tópicos são o tratamento de primeira linha para PV, além de imidazólicos ou terbinafina orais, quando se tratar de uma manifestação mais extensa7. Entretanto, apesar de ser de fácil manejo e tratamento na prática clínica, a PV possui altas chances de infecções recorrentes, de modo que sua recidiva após o tratamento pode chegar a 80% dos casos em 2 anos1,7. Logo, a recorrência após o tratamento com antifúngico adequado e a sua possível "cronificação" são consideradas algumas das maiores queixas dos pacientes8.
Assim sendo, deve-se pensar em novas terapias, uma vez que existe um baixo número de classes de antifúngicos disponíveis comparado ao aumento do número de infecções causadas por cepas resistentes9. Protocolos terapêuticos alternativos, como a imunoterapia subcutânea de dessensibilização à Malassezia ou administração de inibidores de fatores de adesão da levedura já foram relatados, embora ainda haja uma literatura restrita acerca do tema10.
A imunoterapia de dessensibilização caracterizase como uma técnica criada há mais de um século com o objetivo de estimular o sistema imune de pacientes alérgicos a modular uma resposta específica aos alérgenos aos quais são sensíveis, criando uma espécie de tolerância imunológica11. Para tal, baseiase na administração de doses com quantidades gradativamente maiores dos mesmos alérgenos, funcionando como uma vacina terapêutica específica12.
Para reduzir a reatividade dos extratos alérgenos, pode-se produzir alergoides, moléculas polimerizadas através de agentes químicos, como glutaraldeído ou formaldeído, ou agentes biológicos, como transglutaminase. Assim, espera-se conseguir interromper e modificar o curso natural da doença12.
Tendo isto em mente, o objetivo do presente trabalho é relatar um caso de PV recidivante tratado com imunoterapia de dessensibilização para Malassezia spp., terapêutica antifúngica pouco descrita na literatura e com potencial de inovação.
Relato de caso
Homem de 28 anos, monitor comercial, natural da cidade de Imperatriz - MA (Nordeste do Brasil), procurou o serviço de Alergologia devido à presença de manchas hipopigmentadas na região cervical, no dorso e na face, e hiperpigmentadas e eritematosas em axilas há 4 anos (Figura 1), com melhora clínica e posterior recidiva, após uso de antifúngicos tópicos e orais.
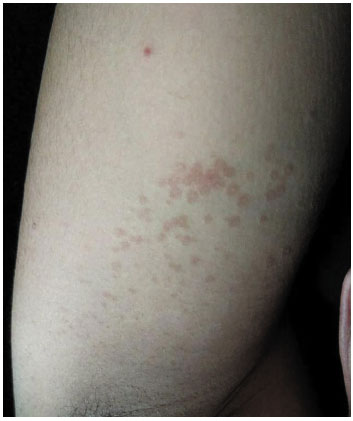
Figura 1
Lesões tipo máculas e pápulas eritematosas na região infraaxilar direita
A biópsia das lesões revelou epiderme com leve acantose e focal alteração vacuolar da camada basal, além de discreto infiltrado mononuclear, firmando o diagnóstico de dermatite perivascular superficial. O exame micológico direto tradicional e a cultura com antifungiograma, realizado em laboratório, evidenciou micose resistente a vários antifúngicos orais e tópicos, ocasionada por fungos do gênero Malassezia spp., denotando diagnóstico de PV. O caso, então, foi encaminhado ao profissional dermatologista. No atendimento dermatológico, o paciente ainda apresentava pápulas eritematosas na região cervical e na região infra-axilar bilateral com sinal de Zileri positivo, assim como máculas hiperpigmentadas bem delimitadas em região das virilhas e onicomicose na região ungueal. Na ocasião, o tratamento foi feito com terbinafina oral, isoconazol e fenticonazol tópicos, além de uma solução hidroalcoólica com sulfeto de selênio 2,5% em sua composição. Manteve-se o acompanhamento mensal das lesões e ajustes medicamentosos; no entanto, paciente permaneceu com lesões ativas de PV na região cervical e descamativas nas regiões axilar direita e esquerda.
O paciente foi acompanhado durante 1 ano com alergista, e 4 meses com dermatologista, afora os 4 anos de histórico das lesões, resultando em 5 anos e 4 meses de convívio com a PV ativa, com recidivas e sem resultados terapêuticos satisfatórios. Diante disso, foi recomendado ao paciente o retorno ao alergista, para avaliar os benefícios da dessensibilização para o caso.
Foi descartada a possibilidade de dermatite atópica pela característica, localização e evolução das lesões, assim como excluída dermatite de contato, após resultado negativo em patch test, bateria padrão brasileira (IPI ASAC Brasil®). Ademais, realizou-se investigação clínico-laboratorial para imunodeficiências, sendo negativa para os erros inatos da imunidade.
Então, foi coletado, em laboratório, o material de raspado da lesão. Para evitar a presença de outros patógenos na amostra coletada, desinfetou-se a superfície onde se realizou o raspado com solução de iodo (tintura de iodo 1% a 2%), que foi removida com álcool 70% e, posteriormente, deixado secar para, depois, realizar a coleta. Após cultura, foi isolado, em soro fisiológico 0,9%, à quantidade de 2 µg de Malassezia spp. para realização de teste cutâneo (prick test), a fim de avaliar a resposta IgE específica do paciente, em controle saudável. O resultado foi positivo para Malassezia spp. em 10 mm, diante de controle positivo de 7 mm e controle negativo de 2 mm, e no controle saudável negativo para Malassezia spp.
No início de abril de 2019, foi suspenso todo o tratamento farmacológico e iniciada a imunoterapia específica de dessensibilização para Malassezia spp., com extrato do fungo extraídos do paciente sensibilizado com PV. Os esquemas utilizados diferem no número de aplicações, de intervalos e de padrões de diluição, com base nos esquemas utilizados na imunoterapia alérgeno-específica para pacientes com sensibilização aos ácaros de poeira doméstica. O tratamento experimental foi aprovado pelo Comitê de Ética e Pesquisa com Seres Humanos do Hospital Universitário da Universidade Federal do Maranhão (HU-UFMA), sob o parecer nº: 5.375.840. Ademais, sua realização e publicação também foram autorizadas pelo paciente, formalizado através da assinatura de um Termo de Consentimento Livre e Esclarecido (TCLE).Todos os dados mantiveram-se confidenciais, sem identificação dos pacientes e sob responsabilidade dos pesquisadores, conforme a Resolução 466/2012 do Conselho Nacional de Saúde.
Adotou-se um cronograma com desenvolvimento mais lento (mais gradual), visto que se trata de uma terapia experimental com risco de reações sistêmicas. Realizou-se a diluição em solução aquosa (fenol + s. fisiológica 0,9%, fabricante IPI ASAC Brasil® ). Iniciouse com um cronograma de aplicações semanais com esquema de 4 injeções por visita, com graduação progressiva de doses em cada aplicação: 0,1 mL, 0,2 mL, 0,4 mL e 0,8 mL. A cada semana utilizou-se uma diluição diferente, preparadas com fator 10 de titulação, sendo estas: 1/10.000, 1/1.000, 1/100, 1/10, 1/1, totalizando 5 semanas de esquema semanal. Na semana 5 (diluição 1/1), realizou-se um aplicação adicional na dose de 1,0 mL, a fim de preparar o paciente para o início da fase de manutenção (Tabela 1). Durante a fase de manutenção, todas as aplicações foram em doses de 1 mL, com titulação de 1/1. O esquema utilizado consiste em injeções com intervalos quinzenais ou mensais, sendo realizadas oito aplicações nessa etapa, depois mantido aplicações de 1,0 mL da concentração 1/1 a cada 15/21/30 dias (Tabela 2).
O tratamento iniciou em 02/04/2019, e em um pouco mais de um mês após o início do tratamento (09/05/2019) o paciente evoluiu com melhora de cerca de 30% das lesões cutâneas. E, após quase onze meses (11/03/2020) de realização da dessensibilização, obteve resolução completa da PV recidivante na região cervical, no dorso, nas virilhas e na região infra-axilar bilateral (Figura 2), sem manifestação de nenhuma reação adversa até o momento. Ao final do esquema, devido à resolução do quadro, não se realizou teste cutâneo (prick test) para demonstrar a dessensibilização imunológica ao patógeno.
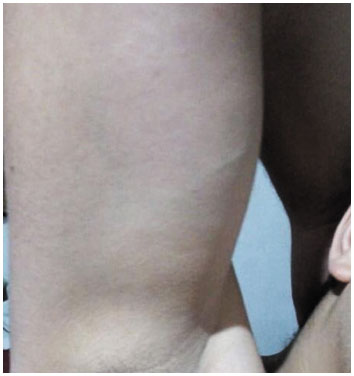
Figura 2
Região infra-axilar direita, após o tratamento, sem quaisquer lesões aparentes
Discussão
A PV, apesar de ser uma condição que geralmente não acarreta risco de morte ou comprometimento sistêmico, pode gerar bastante desconforto estético e social para o paciente. Infelizmente, falhas no tratamento de PV são comuns, devido à resistência fúngica, à longa duração do tratamento, e aos efeitos colaterais consideráveis dos antifúngicos13. Diante disso, a utilização de estratégias antifúngicas alternativas e inovadoras são importantes, principalmente em casos de PV recidivante, e serão a chave para a terapêutica futura14.
A imunoterapia subcutânea resulta em alterações em vários tipos de anticorpos específicos para o antígeno injetado, causando aumento nos níveis de IgG antígeno-específicos no soro, permanecendo aumentados durante o tratamento e várias semanas ou meses após o seu fim. A presença de células de levedura Malassezia presentes na pele estimulam uma maior produção de interleucina-8 (IL-8) e interleucina-115.
No caso apresentado, o paciente não respondeu bem ao tratamento implementado com agentes tópicos, como é preconizado pela literatura. Casos semelhantes a este foram observados em um estudo que avaliou os principais esquemas terapêuticos para PV reincidente baseados em antifúngicos tópicos e sistêmicos, e observou que estes não apresentavam sucesso completo, visto que as lesões permaneciam9,14.
Embora a presença de um estado inflamatório significativo não seja característica da PV, há evidências da interação entre a espécie e a resposta imune inata e específica. Dessa forma, uma vez que a resposta imunológica antifúngica é fisiologicamente marcada pela ativação do eixo IL-23/IL-17, além de controlar o crescimento fúngico, esta também pode estar envolvida em certas manifestações patológicas imunomediadas15.
Tal aspecto é relevante para o quadro clínico descrito neste relato de PV, pois o caráter recidivante mesmo após o tratamento convencional leva à necessidade de busca por novas abordagens terapêuticas. A nova abordagem ideal para o caso seria uma terapia menos tóxica para o paciente e com um espectro antimicrobiano mais direcionado. A literatura traz várias opções experimentais para doenças fúngicas, tais como anticorpos monoclonais, imunoterapia com citocinas, vacinas e peptídeos antimicrobianos, os quais surgiram como novos biofármacos capazes de prevenir ou tratar infecções fúngicas, dentre eles, destacam-se os peptídeos antifúngicos, devido a sua especificidade, seletividade e tolerância.
A melhor opção dentro do contexto do caso foi a dessensibilização para Malassezia spp. Contudo, foi identificado um número restrito de relatos ou de descrições de dessensibilização para o tratamento de fungos do tipo Malassezia, sendo estes mais direcionados para o tratamento de dermatite atópica10 e não para PV, conferindo, ao caso em questão, um valor experimental com resultados promissores.
Salienta-se, todavia, que apesar de sua efetividade, houve desafios para sua implementação, especialmente no que tange ao acesso a essa terapêutica e produção complexa, necessitando de laboratórios treinados em isolamento de fungos, imunologista com treinamento em diluições e dessensibilização, o que dificulta a ampliação de sua utilização.
Outra limitação é o fato de não conseguir mensurar o grau de proteção gerado pelo tratamento, sendo isso necessário para que se possa prever possíveis recidivas e o tempo necessário de dessensibilização para uma remissão duradoura. Porém, o paciente segue em observação clínica desde o término da dessensibilização em março de 2020, e até a publicação deste trabalho não houve recidiva.
Conclui-se que a utilização de técnicas de dessensibilização para o tratamento de PV foi considerada eficaz no caso relatado. No entanto, esse método ainda é uma abordagem restrita que não é viável de ser usada em uma escala maior. Nesse sentido, estudos mais extensos são necessários, a fim de confirmar a eficácia deste tratamento na resolução de casos de PV reincidentes e descartar possíveis efeitos colaterais pertinentes.
Referências
1. Goldstein ABG, Goldstein AO. Tinea versicolor (pitiríase versicolor). UpToDate [Internet]. 2020;1-43. Disponível em: https://www.uptodate.com/contents/tinea-versicolor-pityriasis-versicolor.
2. Framil VMDS, Melhem MSC, Szeszs MW, Corneta EC, Zaitz C. Pitiríase versicolor: Isolamento e identificação das principais espécies de Malassezia. An Bras Dermatol. 2010;85(1):111-4.
3. Alvarado Z, Pereira C. Fungal diseases in children and adolescents in a referral centre in Bogota, Colombia. Mycoses. 2018;61(8):543-8.
4. Grice EA, Dawson TL Jr. Host-microbe interactions: Malassezia and human skin. Curr Opin Microbiol. 2017;40:81-7.
5. Petry V, Tanhausen F, Weiss L, Milan T, Mezzari A, Weber MB. Identificação de espécies de Malassésia na pitiríase versicolor em um serviço de dermatologia do sul do brasil. An Bras Dermatol. 2011;86(4):803-6.
6. Feuilhade de Chauvin M. Examen mycologique en dermatologie. Ann Dermatol Venereol. 2018;145(10):623-32.
7. Gupta AK, Foley KA. Antifungal treatment for pityriasis versicolor. J Fungi. 2015;1(1):13-29.
8. Romero-Sandoval K, Costa AA, Teixeira Sousa MG, Furucho CR, Valente N, Criado PR, et al. Recurrent and disseminated pityriasis versicolor: A novel clinical form consequent to Malassezia-host interaction? Med Hypotheses. 2017;109:139-44.
9. Fernández de Ullivarri M, Arbulu S, Garcia-Gutierrez E, Cotter PD. Antifungal Peptides as Therapeutic Agents. Front Cell Infect Microbiol. 2020;10:105.
10. Velegraki A, Cafarchia C, Gaitanis G, Iatta R, Boekhout T. Malassezia Infections in Humans and Animals: Pathophysiology, Detection, and Treatment. PLoS Pathog. 2015;11(1):1-6.
11. Fitzhugh DJ, Lockey RF. History of Immunotherapy: The First 100 Years. Immunol Allergy Clin North Am. 2011;31(2):149-57.
12. Valenta R, Campana R, Focke-Tejkl M, Niederberger V. Vaccine development for allergen-specific immunotherapy based on recombinant allergens and synthetic allergen peptides: Lessons from the past and novel mechanisms of action for the future. J Allergy Clin Immunol. 2016;137(2):351-7.
13. Prohic A, Jovovic Sadikovic T, Krupalija-Fazlic M, Kuskunovic- Vlahovljak S. Malassezia species in healthy skin and in dermatological conditions. Int J Dermatol. 2016;55(5):494-504.
14. Nicola AM, Albuquerque P, Paes HC, Fernandes L, Costa FF, Kioshima ES, et al. Antifungal drugs: New insights in research & development. Pharmacol Ther. 2019;195:21-38.
15. Sparber F, Ruchti F, LeibundGut-Landmann S. Host Immunity to Malassezia in Health and Disease. Front Cell Infect Microbiol. 2020;10:198.