Número Atual: Abril-Junho 2023 - Volume 7 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
O omalizumabe no tratamento da urticária no contexto da pandemia de COVID-19
Omalizumab as urticaria treatment in the context of the COVID-19 pandemic
Luis Felipe Ensina1; Sérgio Duarte Dortas-Junior2; Rosana Câmara Agondi3; Faradiba Sarquis Serpa4; Solange Oliveira Rodrigues Valle2; Roberta Fachini Jardim Criado5; Joanemile Pacheco de-Figueiredo6; Juliano Coelho Philippi7; Fernanda Lugão Campinhos4; Chayanne Andrade de-Araújo1; Luisa Karla Arruda8
DOI: 10.5935/2526-5393.20230028
1. Universidade Federal de São Paulo, Disciplina de Alergia, Imunologia e Reumatologia - São Paulo, SP, Brasil
2. Universidade Federal do Rio de Janeiro - Rio de Janeiro, RJ, Brasil
3. Universidade de São Paulo, Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
4. Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória - Vitória, ES, Brasil
5. Faculdade de Medicina do ABC - Santo André, SP, Brasil
6. Universidade Federal da Bahia - Salvador, BA, Brasil
7. Consultório Privado - Cuiabá, MT, Brasil
8. Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo - Ribeirão Preto, SP, Brasil
Endereço para correspondência:
Luis Felipe Ensina
E-mail: 100alergia@gmail.com
Submetido em: 20/03/2023
Aceito em: 18/04/2023.
Conflito de interesses: L.F. Ensina recebeu honorários como speaker da Novartis, Sanofi e Abbvie; apoio para participar de reuniões científicas da Novartis e Sanofi; e participa de pesquisa clínica com Novartis, Sanofi e Amgen. S. Dortas Jr. recebeu honorários como speaker de AstraZeneca, Chiesi e Novarti; e apoio para participar de reuniões científicas da Sanofi, Takeda e CSL Behring. F.S. Serpa recebeu honorários como speaker da Novartis, Takeda e GSK; e apoio para participar de reuniões científicas da Takeda e GSK. S.O.R. Valle recebeu honorários como speaker de Novartis, Takeda, CSL Behring e AstraZeneca; consultoria da Takeda, CSL Behring e Novartis; e apoio para participar de reuniões científicas da Takeda e CSL Behring. R.F.J. Criado recebeu honorários como speaker da Novartis, Mantecorp e Sanofi; consultoria para Sanofi, Abbvie e Novartis; e apoio para participar de reuniões científicas da Sanofi e Takeda. L.K. Arruda recebeu honorários como speaker da Novartis, Sanofi, GSK, AstraZeneca e Takeda. R.C. Agondi, J.P. Figueiredo, J.C. Philippi, F.L. Campinhos e C.A. de Araújo declaram não ter conflitos de interesse.
RESUMO
O início da pandemia de COVID-19 foi marcado por incertezas diante do desconhecimento sobre a doença.Uma série de dúvidas relacionadas ao uso de imunobiológicos no contexto da pandemia foi levantada, inclusive em relação ao tratamento com omalizumabe em pacientes com urticária crônica (UC). Este estudo teve como objetivo analisar os dados relacionados à gravidade da COVID-19 e a evolução da urticária em pacientes em terapia com omalizumabe acompanhados por especialistas no Brasil. Foi realizada análise retrospectiva de dados de pacientes com UC tratados com omalizumabe entre julho/2020 e junho/2021 que apresentaram COVID-19. Foram avaliados dados relacionados às características clínicas dos pacientes e evolução da urticária durante a infecção pelo SARS-CoV2. Foram incluídos 28 pacientes em tratamento com omalizumabe, sendo 27 com urticária crônica espontânea (UCE), dos quais 25% tinham alguma urticária induzida associada. A maior parte dos pacientes (71%) estavam utilizando doses quadruplicadas de anti-histamínicos modernos de 2ª geração associados ao omalizumabe. Todos os pacientes estavam com os sintomas controlados. Entre os sintomas apresentados durante a COVID-19, os mais frequentes foram: febre (43%), cefaleia (36%), mal-estar (32%), hipo/anosmia (29%) e tosse (21%). Quatro pacientes foram hospitalizados, um deles em unidade de terapia intensiva. Um paciente relatou piora dos sintomas da UC durante a COVID-19. Cinco (18%) pacientes apresentaram piora dos sintomas da UC após a resolução da COVID-19. Todos os pacientes se recuperaram da COVID-19 sem sequelas graves. O OMA não pareceu aumentar o risco de COVID-19 grave e poderia ser usado com segurança em pacientes com UC.
Descritores: Urticária, omalizumab, COVID-19.
A COVID-19, doença causada pelo coronavírus SARS-CoV-2, foi descrita pela primeira vez em 2019, e tinha como principais manifestações febre, sintomas gripais, pneumonia, síndrome respiratória aguda grave, diarreia e diminuição do olfato, indicando que se trata de uma doença sistêmica1. Em 11 de março de 2020 a Organização Mundial de Saúde declarou a COVID-19 como uma pandemia2. Naquele momento, em que tanto o vírus como a doença ainda eram pouco conhecidos, e o número de mortes aumentava progressivamente, uma série de dúvidas surgiu em relação a quais seriam os pacientes de maior risco para doença grave, como os imunossuprimidos, pacientes com patologias crônicas e comorbidades graves3. Entre os diversos questionamentos, um dos mais relevantes para a especialidade foi se o uso de imunobiológicos poderia afetar o curso da COVID-19, e se pacientes em tratamento teriam um risco maior para COVID-19 mais grave4.
A urticária crônica (UC) é uma condição que impacta de forma significativa a qualidade de vida dos pacientes mal controlados. Cerca de 40% dos casos não responde aos anti-histamínicos e tem indicação para a terapia com o omalizumabe (OMA), um anticorpo anti-IgE indicado como primeira opção para estes casos5,6.
Foi previamente demonstrado que o tratamento com OMA pode restaurar as respostas mediadas por interferon-alfa tanto para o rinovírus como para influenza, através da redução da expressão do receptor de alta afinidade para IgE (FcεRI) na superfície de células, incluindo mastócitos, basófilos e células dendríticas plasmocitoides (pDCs), sugerindo um papel anti-viral para o OMA7-9. Assim, teoricamente, a não interrupção do tratamento com OMA poderia ser recomendada em pacientes com COVID-19 leve a moderada. Por outro lado, no início da pandemia a maior parte dos especialistas recomendava que em pacientes com COVID-19 grave, o OMA deveria ser suspenso por pelo menos duas semanas após a resolução da doença e recuperação do paciente4.
Devido à limitação nas informações e incerteza quanto ao uso do OMA durante a infecção aguda pelo SARS-CoV-2, analisamos os dados relacionados à gravidade da COVID-19 e a evolução da urticária em pacientes acompanhados por especialistas no Brasil.
Métodos
Um estudo retrospectivo foi realizado a partir da análise de prontuários de pacientes com UC em tratamento com OMA que apresentaram infecção pelo SARS-CoV-2 confirmada ou altamente suspeita, entre julho/2020 e junho/2021. Pacientes com COVID-19 altamente suspeita eram definidos por uma história epidemiológica fortemente sugestiva associada a sintomas gripais, enquanto os com infecção confirmada eram aqueles que apresentaram testes confirmatórios para COVID-19 positivos (RT-PCR, teste imunodiagnóstico rápido, e sorologia IgM e/ou IgG).
Para cada paciente, os seguintes dados foram coletados dos prontuários médicos: gênero, idade, subtipo de UC, tempo desde o início da UC, tratamento para a urticária no momento da infecção pelo SARS-CoV-2, sintomas de COVID-19, necessidade de hospitalização para o tratamento da COVID-19, uso de anti-inflamatórios não esteroidais (AINEs), e evolução da urticária após a COVID-19.
Os dados relacionados aos pacientes e a infecção pelo SARS-CoV-2 são descritos a seguir.
Resultados
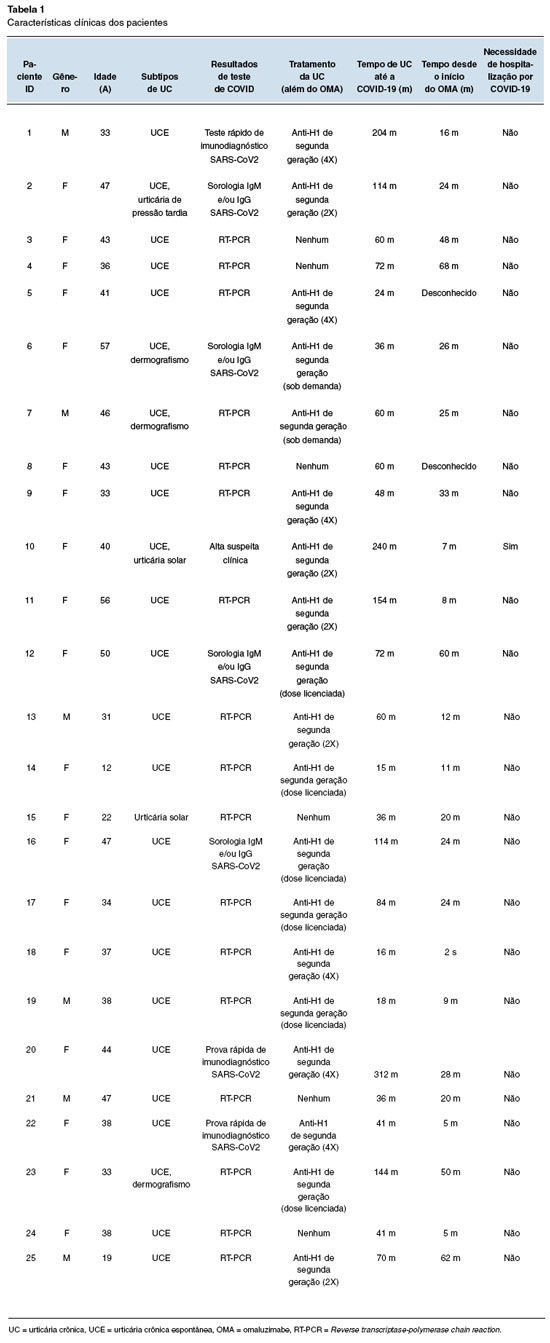
Foram incluídos 28 pacientes em tratamento com OMA (79% feminino) que apresentaram diagnóstico de COVID-19 de acordo com os critérios utilizados no estudo. A média de idade±desvio padrão foi de 38,5±10 anos. A quase totalidade dos pacientes tinha diagnóstico de UCE. Entre estes, 7 (25%) apresentavam alguma urticária crônica induzida (UCInd) associada: dermografismo (3), urticária solar (3) e urticária por pressão tardia (1). Apenas 1 paciente apresentava UCInd isolada (urticária solar). A duração média da urticária era de 7,6 anos (1,3 a 26 anos). A maior parte dos pacientes (71%) estava utilizando doses quadruplicadas de anti-histamínicos modernos de 2ª geração associados ao OMA, e 8 pacientes (29%) estavam em monoterapia com OMA. Todos os pacientes estavam com os sintomas controlados (UCT ≥ 12 e/ou UAS7 ≤ 6) antes da infecção pelo SARS-CoV-2.
Dezoito pacientes confirmaram o diagnóstico de COVID-19 pelo RT-PCR; quatro (14%) tiveram sorologia positiva IgM e/ou IgG para SARS-CoV-2; três (11%) apresentaram teste imunodiagnóstico rápido positivo para SARS-CoV-2.Três pacientes apresentaram sintomas altamente sugestivos após contato com pacientes com COVID-19, e no contexto da pandemia. Os sintomas mais frequentemente observados foram febre (43%), cefaleia (36%), mal-estar (32%), hipo/anosmia (29%), tosse (21%), dispneia (11%) e disgeusia (7%). Quatro pacientes foram hospitalizados, um deles em unidade de terapia intensiva. Sete pacientes foram tratados com AINEs, sem nenhum impacto direto no controle da urticária. Um paciente relatou piora dos sintomas da UC durante a COVID-19. Cinco (18%) pacientes apresentaram piora dos sintomas da UC após a resolução da COVID-19 (Tabela 1). Todos os pacientes se recuperaram da COVID-19 sem sequelas graves.
Discussão
O tratamento da UC tem como objetivo o controle completo dos sintomas, e a terapia com OMA pode controlar a doença em até 85% dos pacientes6,10. As infecções virais são uma causa frequente de urticária aguda, e podem ser um fator de exacerbação da urticária crônica11. Além disso, a infecção pelo SARS-CoV-2 também foi associada a manifestações de urticária aguda, sendo sua incidência de urticária em pacientes com COVID-19 entre 1,9% e 3,4%1,12. Em um estudo realizado na Turquia, não foi observada associação significativa entre RT-PCR positivo para SARS-CoV-2 e o tipo de tratamento (anti-histamínicos, OMA ou ambos) em um subgrupo de 15 pacientes com UCE que apresentou sintomas relacionados à COVID-19, sugerindo que o tratamento com OMA não teria relação com maior ou menor predisposição à infecção pelo SARS-CoV-213.
Nossos dados sugerem que pacientes em tratamento com OMA e controlados têm um risco baixo de exacerbações da UCE durante a COVID-19. Por outro lado, grande parte dos estudos demonstrou que a urticária se manifesta após o início dos sintomas da COVID-191. De forma interessante, cinco pacientes relataram piora dos sintomas após a resolução da COVID-19, mesmo sem alterações no tratamento da urticária. Mutean e cols. relataram que 44% dos pacientes com UCE e COVID-19 apresentam piora da gravidade da urticária durante a infecção, especialmente pacientes com COVID-19 moderada a grave14. Passante e cols. não observaram exacerbação da urticária da UCE na sua série de sete pacientes com sintomas leves de COVID-19 ou assintomáticos com testes positivos, que estavam em tratamento com OMA15. O OMA controla os sintomas da urticária reduzindo a ativação dos mastócitos e liberação de seus mediadores. É possível que os efeitos antivirais do OMA possam atenuar a infecção e a inflamação em casos leves de COVID-19, prevenindo a piora da urticária. No entanto, com a maior gravidade da infecção, o tratamento com OMA pode não ser suficiente para se sobrepor aos efeitos da infecção viral em desencadear ou piorar os sintomas da urticária.
Nossos dados também sugerem que o tratamento com OMA não aumenta o risco de COVID-19 grave. No entanto, quatro dos pacientes com teste positivo para COVID-19 foram hospitalizados, indicando doença moderada a grave. Uma análise retrospectiva de pacientes da Romênia com UCE demonstrou que 71% dos pacientes com UCE e infecção pelo SARS-CoV-2 apresentava COVID-19 moderada a grave, mas que o tratamento com OMA não estava associado à maior gravidade da COVID-1914. Kocatürk e cols. relataram que 90% dos pacientes com COVID-19 que estavam em tratamento com OMA +/- anti-histamínicos tiveram COVID-19 leve, e apenas 2 pacientes necessitaram de hospitalização16. Ayhan e cols. observaram 3 casos de UCE em tratamento com OMA que apresentaram COVID-19 leve17. Paulino e cols. também relataram um paciente com UCE em tratamento com OMA que manifestou apenas anosmia e artralgia durante a COVID-1918. Em geral, os dados atuais sugerem que o tratamento com OMA não é um fator de risco para COVID-19 mais grave em pacientes com UC.
Em conclusão, nossos resultados sugerem que a maioria dos pacientes pode continuar a terapia com OMA apesar da infecção pelo SARS-CoV-2. O OMA não pareceu aumentar o risco de COVID-19 grave e poderia ser usado com segurança em pacientes com UC. No entanto, mais estudos são necessários com números maiores de pacientes para que se recomende a favor ou contra o uso de OMA para pacientes com UC e COVID-19.
Referências
1. Dortas-Junior SD, Azizi GG, Bastos-Junior RM, Brum CRMA, Tavares JVV, et al. Urticária e COVID-19: foco nesta manifestação clínica. Arq Asma Alerg Imunol. 2021;5:100-3.
2. World Health Organization (WHO). Novel Coronavirus (2019- nCoV) [Internet]. Disponível em: https://www.who.int/emergencies/diseases/novel-coronavirus-2019. Acessado em: 27/03/2023.
3. Ejaz H, Alsrhani A, Zafar A, Javed H, Junaid K, Abdalla AE, et al. COVID-19 and comorbidities: Deleterious impact on infected patients. J Infect Public Health. 2020;13:1833-9.
4. Vultaggio A, Agache I, Akdis CA, Akdis M, Bavbek S, Bossios A, et al. Considerations on biologicals for patients with allergic disease in times of the COVID-19 pandemic: An EAACI statement. Allergy. 2020;75:2764-74.
5. Maurer M, Church MK, Gonçalo M, Sussman G, Sanchez-Borges M. Management and treatment of chronic urticaria (CU). JEADV. 2015;29(Suppl 3):16-32.
6. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer- Weber B, et al. The EAACI/GA2LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018;73:1393-414.
7. Gill MA, Liu AH, Calatroni A, Krouse RZ, Shao B, Schiltz A, et al. Enhanced plasmacytoid dendritic cell antiviral responses after omalizumab. J Allergy Clin Immunol. 2018;141:1735-43.
8. Cardet JC, Casale TB. New insights into the utility of omalizumab. J Allergy Clin Immunol. 2019;143:923-6.
9. Criado PR, Pagliari C, Criado RFJ, Marques GF, Belda W Jr. What the physicians should know about mast cells, dendritic cells, urticaria, and omalizumab during COVID-19 or asymptomatic infections due to SARS-CoV-2? Dermatol Ther. 2020;33:e14068.
10. Ensina LF, Valle SOR, Juliani AP, Galeane M, Santos RV dos, Arruda LK, et al. Omalizumab in Chronic Spontaneous Urticaria: A Brazilian Real-Life Experience. Int Arch Allergy Imm. 2016;169:121-4.
11. Imbalzano E, Casciaro M, Quartuccio S, Minciullo PL, Cascio A, Calapai G, et al. Association between urticaria and virus infections: A systematic review. Allergy Asthma Proc. 2016;37:18-22.
12. Recalcati S. Cutaneous manifestations in COVID-19: a first perspective. J Eur Acad Dermatol Venereol. 2020;34:e212-13.
13. Bostan E, Zaid F, Karaduman A, Dogan S, Gulseren D, Yalici- Armagan B, et al. The effect of COVID-19 on patients with chronic spontaneous urticaria treated with omalizumab and antihistamines: A cross-sectional, comparative study. J Cosmet Dermatol. 2021;20:3369-75.
14. Muntean IA, Pintea I, Bocsan IC, Dobrican CT, Deleanu D. COVID-19 Disease Leading to Chronic Spontaneous Urticaria Exacerbation: A Romanian Retrospective Study. Healthcare (Basel). 2021;9:1144.
15. Passante M, Napolitano M, Dastoli S, Bennardo L, Fabbrocini G, Nisticò SP, et al. Safety of omalizumab treatment in patients with chronic spontaneous urticaria and COVID-19. Dermatol Ther. 2021;34:e15111.
16. Kocatürk E, Salman A, Cherrez-Ojeda I, Criado PR, Peter J, Comert-Ozer E, et al. The global impact of the COVID-19 pandemic on the management and course of chronic urticaria. Allergy. 2021;76:816-30.
17. Ayhan E, Öztürk M, An I, Bekçlbasi M. COVID-19 infection under omalizumab therapy for chronic spontaneous urticaria: three cases. Int J Dermatol. 2021;60:253-4.
18. Paulino M, Costa C, Pedro E. Omalizumab treatment during SARSCoV- 2 infection. COVID-19 Pandemic: Case Studies & Opinions. 2020;1:153-4.