Número Atual: Abril-Junho 2023 - Volume 7 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Segurança da vacinação contra a COVID-19 em doentes referenciados dos cuidados de saúde primários por alergia ao veneno de himenópteros
COVID-19 vaccination safety in patients with hymenoptera venom allergy referred by primary health care
Ricardo José Brás1; Joana Cosme2,3; Rita Brás2; Elisa Pedro2; Amélia Spínola Santos2,3
DOI: 10.5935/2526-5393.20230026
1. Agrupamento de Centros de Saúde de Lisboa Norte, Unidade de Saúde Familiar Dona Amélia de Portugal - Lisboa, Portugal
2. Centro Hospitalar Universitário de Lisboa Norte, Serviço de Imunoalergologia, Hospital de Santa Maria - Lisboa, Portugal
3. Faculdade de Medicina da Universidade de Lisboa, Clínica Universitária de Imunoalergologia - Lisboa, Portugal
Endereço para correspondência:
Ricardo José Brás
E-mail: rjabras@hotmail.com
Submetido em: 18/04/2023
Aceito em: 01/07/2023.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: As reações de hipersensibilidade após vacinação contra a COVID-19 têm vindo a ser descritas, embora a anafilaxia seja rara. A hipersensibilidade ao veneno de himenópteros constitui a terceira causa mais frequente de anafilaxia em Portugal, embora não pareça aumentar o risco de anafilaxia à vacinação contra a COVID-19.
OBJETIVOS: Avaliar a segurança da vacinação contra a COVID-19 em doentes com história de alergia ao veneno de himenópteros referenciados dos Cuidados de Saúde Primários (CSP).
MÉTODOS: Estudo observacional retrospectivo com inclusão dos doentes com alergia ao veneno de himenópteros referenciados pelos CSP ao serviço de Imunoalergologia, para estratificação do risco de reações de hipersensibilidade à vacina contra o SARS-CoV-2, entre janeiro e dezembro de 2021
RESULTADOS: No total, incluíram-se 18 doentes, 72% do sexo feminino, média de idades de 61±18 [21-89] anos. Na caracterização do tipo da reação ao veneno de himenópteros, as reações locais exuberantes corresponderam a 33% de todas as reações referidas. Quanto a sintomas sistêmicos de anafilaxia, foram referidos sintomas mucocutâneos (33%), respiratórios (28%), cardiovasculares (33%) e gastrointestinais (11%). A abelha foi o inseto mais frequentemente implicado (61%). Relativamente aos valores de triptase basal, 3 doentes apresentaram níveis acima do cut-off estabelecido de 11,4 ng/mL, tendo indicação formal para iniciar esquema de vacinação em meio hospitalar. Durante o processo vacinal registrou-se um total de 46 administrações em 18 doentes, todas sem intercorrências. Apenas 5 doentes foram vacinados em meio hospitalar, tendo sido os restantes encaminhados para os CSP. Os doentes com mastocitose confirmada ou suspeita foram submetidos à pré-medicação com anti-histamínico anti-H1 e antiH2, bem como montelucaste, na véspera e no dia da vacinação.
CONCLUSÕES: A vacinação contra a COVID-19 é segura em doentes com reação de hipersensibilidade ao veneno de himenópteros. O protocolo utilizado mostrou ser eficaz na segregação de doentes entre CSP e cuidados secundários/terciários.
Descritores: Alergia, anafilaxia, hipersensibilidade ao veneno de himenópteros, triptase, vacinação COVID-19.
Introdução
A vacinação é um tipo de prevenção primária fulcral em Medicina, sendo considerada uma das estratégias de saúde pública de maior sucesso1. Desde o início da pandemia de SARS-CoV-2, a comunidade científica tem agregado esforços no sentido de reduzir eficazmente a morbimortalidade desta infeção, criando novos tipos de tratamentos em tempo recorde. No entanto, os resultados mais promissores têm sido obtidos no desenvolvimento de vacinas2.
Dada a rapidez com que as mesmas foram produzidas e aprovadas, foram levantadas questões, não só quanto à sua eficácia, como também quanto à sua segurança3. Todavia, as organizações internacionais foram consensuais na aprovação de vários tipos de vacina contra a COVID-19. Atualmente, estão aprovadas pela EMA (Agência Europeia do Medicamento) cinco vacinas para uso na Europa, bem como pelo INFARMED (Instituto Nacional da Farmácia e do Medicamento) em Portugal: as vacinas de vetor viral Vaxzevria® (Astra-Zeneca) e Janssen® (Johnson&Johnson), as vacinas de mRNA Comirnaty® (Pfizer-BioNTech) e Spikevax® (Moderna), e a vacina de nanopartículas de proteína spike recombinante do SARS-CoV-2 Nuvaxovid® (Novavax)4,5.
Nos estudos de fase III destas vacinas não houve notificação de qualquer caso de anafilaxia, porém tinham sido previamente excluídos os participantes com história prévia de reação alérgica a qualquer excipiente da vacina em questão, o que levantou algumas preocupações acerca da segurança das mesmas em doentes com alergias conhecidas6,7. Desde então já foram publicados múltiplos estudos que apontam para a segurança das vacinas contra a COVID-19, com uma incidência de anafilaxia a rondar os 7,91-10,67 casos por 1 milhão de doses8,9. Esta incidência é superior à reportada para algumas vacinas comumente administradas, como a da gripe (0,8)1, mas inferior à reportada para algumas vacinas do Programa Nacional de Vacinação, como a vacina do vírus do papiloma humano (13,65) ou a do Sarampo, Parotidite e Rubéola (19,8)9. Tal fato não exclui a necessidade dos profissionais de saúde estarem atentos a possíveis reações alérgicas associadas à vacinação, bem como à correta notificação das mesmas, nomeadamente a anafilaxia1.
Os critérios de referenciação para a vacinação em meio hospitalar têm sofrido alterações com a evolução do conhecimento médico e a publicação de estudos na área. Todos os protocolos são flexíveis e exigem ponderação individual. Têm sido criadas normas segundo as quais os doentes com mastocitose deverão ser referenciados para vacinação hospitalar10-13.
De acordo com estudos recentes realizados por Gaspar A. e cols., na última década a anafilaxia à picada de inseto foi a terceira causa de anafilaxia mais frequente em Portugal, correspondendo a 7,4% de todos os casos, seguindo-se à anafilaxia de causa alimentar (48,2%) e medicamentosa (36,9%)14,15. O diagnóstico de mastocitose em doentes com alergia ao veneno de himenópteros é um fator de risco para episódios de anafilaxia16. Neste contexto, o valor da triptase sérica basal em doentes com anafilaxia a veneno de himenópteros surge como um dado decisivo na escolha do local de referenciação para vacinação contra o SARS-CoV2, pese embora o seu pedido não seja comparticipado pelo Serviço Nacional de Saúde quando é prescrito nos cuidados de saúde primários (CSP). No entanto, já existem diversos estudos que demonstram a segurança da vacinação destes doentes em meio não hospitalar, sob protocolo de pré-medicação e vigilância médica nos 30 minutos pós-vacinação6,17,18.
O presente artigo tem como objetivo principal a avaliação da segurança da vacinação contra a COVID-19 em doentes referenciados dos CSP por alergia ao veneno de himenópteros, analisando a importância do doseamento de triptase sérica basal na estratificação do risco destes doentes.
Métodos
Desenho do estudo, população e coleta de dados
Estudo observacional retrospectivo, em que foram incluídos os doentes referenciados à consulta de Imunoalergologia a partir dos CSP para avaliação do risco de reação alérgica grave à vacinação contra o SARS-CoV-2 por história anterior de reação à picada de himenópteros, entre janeiro e dezembro de 2021.
A avaliação dos doentes foi realizada por consulta telefônica e/ou presencial quando não foi possível por parte do médico uma correta percepção da história clínica dos doentes sem a sua presença física.
A definição de anafilaxia baseou-se nos critérios da European Academy of Allergy and Clinical Immunology (EAACI)19, que define anafilaxia como "uma reação de hipersensibilidade sistêmica grave, potencialmente fatal, caracterizada por um início rápido, podendo incluir sintomas mucocutâneos, respiratórios, cardiovasculares ou gastrointestinais".
As reações de hipersensibilidade sistêmicas foram categorizadas de acordo com a classificação de Mueller20. Esta classificação divide as reações em quatro graus de acordo com a sua gravidade. O grau I corresponde ao doente apresentar prurido, urticária, ansiedade e/ou mal-estar. A reação passa a ser considerada de grau II se adicionalmente estiverem presentes dois sintomas dos seguidamente mencionados: tonturas, náuseas, vômitos, diarreia, dor abdominal, angioedema e/ou sensação de aperto torácico. Ao grau III correspondem os sintomas previamente mencionados e pelo menos dois dos seguintes sintomas: dispneia, disartria, pieira, estridor, rouquidão, prostração, confusão mental e/ou sensação de morte iminente. Por último, as reações de grau IV englobam os sintomas anteriores e pelo menos dois dos seguintes sintomas adicionais: perda de consciência, incontinência urinária e fecal e/ou cianose19.
A coleta de dados referentes aos doentes foi realizada com recurso ao seu processo clínico hospitalar e à Plataforma de Dados de Saúde (PDS), por forma a consultar dados relevantes referentes aos CSP, bem como o resultado da vacinação dos doentes encaminhados para meio não hospitalar após estratificação do risco.
Protocolo de estratificação de risco de reação de hipersensibilidade
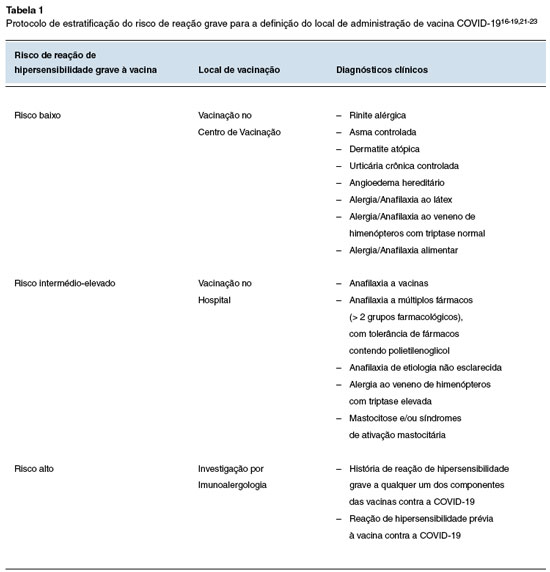
A estratificação do risco de reação de hipersensibilidade grave à vacina contra a COVID-19 realizou-se de acordo com o protocolo do Serviço de Imunoalergologia, com base nas normas da DGS, guidelines nacionais e internacionais16-18,20-24. Este protocolo resume-se na Tabela 1.
O doseamento de triptase basal foi requerido na primeira consulta de triagem COVID-19 a todos os doentes referenciados por suspeita de anafilaxia a veneno de himenópteros e cujo valor de triptase basal não era conhecido. Para valores inferiores a 11,4 ng/mL, os doentes foram considerados de baixo risco e encaminhados para vacinação em meio extrahospitalar, enquanto os doentes com triptase maior ou igual a 11,4 ng/mL tiveram indicação para vacinação em meio hospitalar, e posterior investigação para exclusão de mastocitose ou síndrome de ativação mastocitária. Estes doentes realizaram pré-medicação com anti-histamínico H1 e anti-histamínico H2 1 hora antes de serem vacinados, bem como montelucaste 24 horas e 1 hora antes da vacinação6.
Resultados
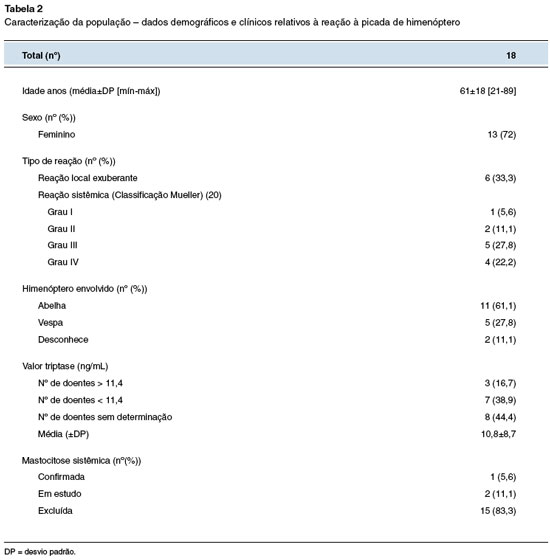
Durante o ano de 2021 foram referenciados ao Serviço de Imunoalergologia, a partir dos CSP, 19 doentes com suspeita de alergia ao veneno de himenópteros, para estratificação do risco de reação de hipersensibilidade grave à vacinação COVID-19, sendo excluído 1 doente por recusa desta vacinação. A Tabela 2 mostra a caracterização da população quanto aos seus dados demográficos e clínicos. Foram incluídos no estudo 18 doentes, sendo a maioria do sexo feminino (72%). A média de idades foi de 61±18 anos, sendo a idade mínima 21 anos e a idade máxima 89 anos.
Relativamente a patologias imunoalergológicas concomitantes, a mais prevalente foi a rinite alérgica, com 33% dos doentes a reportarem este diagnóstico. Outras patologias referidas foram asma (n = 2, 11%), mastocitose (n = 1, 6%) e urticária crônica (n = 2, 11%). Patologias não alergológicas, como hipertensão arterial, insuficiência cardíaca, dislipidemia e/ou doença pulmonar obstrutiva crônica, foram referidas por 22% dos doentes.
Na caracterização da reação ao veneno de himenópteros, 6 doentes referiram apenas reação local exuberante. De acordo com a Classificação de Mueller, a reação sistêmica mais frequente foi de grau III, tendo ocorrido em 5 doentes, como se verifica na Tabela 2. Relativamente às restantes reações sistêmicas, verificou-se 1 reação de grau I, 2 reações de grau II e 4 reações de grau IV. O himenóptero referido foi, na maioria das vezes, a abelha (61%), mas também houve registro de vários casos relacionados com vespa (28%). Não se conseguiu apurar o agente causador da reação nos restantes casos (n = 2, 11%).
Dos 18 doentes com história sugestiva de hipersensibilidade ao veneno de himenópteros, 3 (17%) apresentaram valores de triptase basal acima de 11,4 ng/mL, tendo sido encaminhados para vacinação em meio hospitalar. Estes 3 doentes tinham história de anafilaxia, representando 25% das anafilaxias ao veneno de himenópteros. Todos os doentes foram também questionados quanto a possíveis reações de hipersensibilidade grave prévia, tendo 33% referido história de anafilaxia a fármacos, com os anti-inflamatórios não esteroides a corresponder à metade dos casos, e 6% ao contraste endovenoso. Também foram referidas anafilaxias de causa alimentar (11%) e idiopáticas (11%).
Dos doentes referenciados por anafilaxia com veneno de himenópteros, 3 já tinham completado 5 anos de imunoterapia com veneno de abelha, não apresentando reações anafiláticas com novas picadas depois de terminar a vacina.Todos os restantes foram referenciados à consulta especializada de alergia a veneno de himenópteros, contudo apenas 2 mantiveram seguimento e aceitaram iniciar imunoterapia.
Após avaliação e estratificação do risco de todos os doentes em consulta de Imunoalergologia, 5 doentes (28%) foram vacinados em meio hospitalar, 3 por triptase basal elevada (um deles com diagnóstico confirmado de mastocitose), e 2 por outros fatores de risco (anafilaxia idiopática num doente, e história de alergia medicamentosa múltipla no outro), sob prémedicação de acordo com o protocolo, tendo os restantes sido encaminhados para vacinação nos centros de saúde ou centros de vacinação correspondentes.
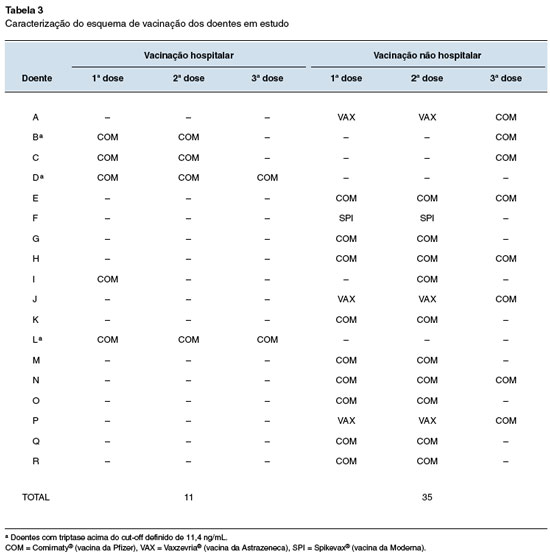
No total, foram efetuadas 11 administrações em meio hospitalar e 35 administrações em meio não hospitalar, como se pode verificar na Tabela 3, todas sem registro de intercorrências. Dada a ausência de reações de hipersensibilidade, 3 dos doentes que foram inicialmente vacinados em meio hospitalar com a vacina Comirnaty® puderam continuar o seu esquema vacinal no centro de vacinação por indicação médica. Esta decisão de continuação da vacinação em meio extra-hospitalar baseou-se no sucesso da primeira vacinação em meio hospitalar e na evidência crescente de segurança da vacinação de doentes com mastocitose6. Todos os doentes vacinados em meio hospitalar realizaram esquema de pré-medicação. Não se registraram reações adversas alérgicas nos doentes vacinados em ambiente hospitalar, nem nos vacinados nos CSP.
Discussão
O presente estudo retrospectivo observacional demonstrou a segurança da vacinação contra o vírus SARS-CoV-2 em doentes com história de alergia ao veneno de himenópteros referenciados dos CSP, incluindo doentes com valores de triptase sérica basal elevados.
Da nossa população inicial foi excluído um elemento por recusa de vacinação, tendo sido vacinados um total de 18 doentes, com idades compreendidas entre os 21 e os 89 anos. Foram administradas um total de 35 vacinas em meio não hospitalar, em 16 doentes, e 11 vacinas em meio hospitalar, em 5 doentes, sem intercorrências. Adicionalmente, não houve qualquer registro de intercorrências nos 3 doentes que iniciaram a vacinação em meio hospitalar e que prosseguiram em meio extra-hospitalar. Tal fato demonstra a eficácia do protocolo de estratificação de risco aplicado, assim como do esquema de pré-medicação.
Relativamente aos doentes com mastocitose confirmada ou suspeita, a sua primeira administração foi sempre realizada em meio hospitalar. No entanto, a European Academy of Allergy and Clinical Immunology lançou recentemente um position paper referindo não haver evidência para um risco acrescido de reações de hipersensibilidade nem no subgrupo de doentes com alergia ao veneno de himenópteros, nem no subgrupo com mastocitose que se encontrem estáveis25. Em ambos os casos, existe indicação para vacinação em meio extra-hospitalar, com supervisão por um período pós-vacinação de 30 minutos, sendo que os doentes com mastocitose confirmada deverão realizar um esquema de pré-medicação.
Neste contexto, Rama T. e cols. publicaram recentemente dois artigos que comprovam a segurança da vacinação contra a COVID-19 em doentes com diagnóstico de mastocitose, reiterando a necessidade da realização de um esquema de pré-medicação6,18. Numerosos outros estudos demonstraram, de igual forma, a segurança da vacinação26-32.
Quanto aos valores aumentados de triptase sérica basal em alguns doentes da nossa amostra, é importante referir que estes por si só não fazem o diagnóstico de mastocitose. Valores de triptase acima dos 20 ng/mL, na ausência de patologias concomitantes que expliquem valores desta grandeza, constituem apenas um critério minor para o diagnóstico de mastocitose sistêmica33. A determinação de triptase sérica não é um exame pedido de forma rotineira nos Cuidados de Saúde Primários e não é comparticipado pelo SNS. Assim, no desconhecimento da mesma, foram referenciados muitos doentes com história de anafilaxia para os quais o valor de triptase sérica basal nunca tinha sido obtido. Apesar de não cumprir os critérios de referenciação para vacinação COVID19 em ambiente hospitalar (Tabela 1)21, os autores consideram que a referenciação teve a mais-valia de alertar para este diagnóstico e para a importância de referenciar doentes com anafilaxia com picada de himenópteros para as consultas de Imunoalergologia.
Torna-se premente aperfeiçoar a comunicação entre CSP e cuidados secundários/terciários, bem como trabalhar na melhoria contínua dos critérios de referenciação nesta e em todas as áreas da Imunoalergologia, por forma a que os médicos possam atuar em parceria com os doentes, para benefício de ambos, evitando a sobrecarga dos cuidados de saúde secundários/terciários. Realçase, igualmente, a importância do conhecimento dos critérios de diagnóstico de anafilaxia, frequentemente subdiagnosticada e subtratada, sendo potencialmente fatal e exigindo tratamento imediato com adrenalina intramuscular para prevenir a progressão para falência multiorgânica34.
O estudo apresentado possui algumas limitações, nomeadamente o tamanho da amostra (n = 18), que limita a extrapolação dos resultados, sendo necessários mais estudos com amostras superiores para a obtenção de dados estatisticamente relevantes. Outra limitação é o desenho retrospectivo, dada a possível ausência de algumas informações dos processos clínicos, porém considera-se esta limitação pouco relevante, visto que foi possível obter praticamente todos os dados necessários para a realização do estudo. De referir o fato do diagnóstico de alergia a veneno de himenópteros ter sido apenas presumido, baseado numa história clínica sugestiva, quando da decisão sobre estratificação do risco. Não foram realizados testes cutâneos nem doseamento de IgE específicas para os venenos dos himenópteros suspeitos na fase inicial de triagem dada a urgência de decisão do local de vacinação. No entanto, os autores consideram que o presente estudo fornece informações pertinentes acerca da segurança da vacinação contra a COVID-19 em doentes com alergia ao veneno de himenópteros.
Conclusões
A vacinação contra a COVID-19 é segura nos doentes com história de reação de hipersensibilidade grave ao veneno de himenópteros e pode ser realizada nos cuidados de saúde primários, exceto em raras exceções. O protocolo de estratificação do risco de reação de hipersensibilidade grave aplicado demonstrou a sua eficácia na identificação dos doentes a vacinar em meio hospitalar. Realça-se a importância da melhoria contínua dos critérios de referenciação e dos protocolos aplicados, bem como da comunicação entre cuidados de saúde primários e cuidados de saúde secundários/terciários.
Referências
1. Dreskin SC, Halsey NA, Kelso JM, Wood RA, Hummell DS, Edwards KM, et al. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016;9(1):32.
2. Edwards AKM, Orenstein WA. COVID-19: Vaccines. Uptodate [Internet]. 2022. Disponível em: https://www.uptodate.com/contents/covid-19-vaccines?search=sars-cov-2vaccination&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1#references. Acessado em: 21/10/2022.
3. Hodgson SH, Mansatta K, Mallett G, Harris V, Emary KRW, Pollard AJ. What defines an efficacious COVID-19 vaccine? A review of the challenges assessing the clinical efficacy of vaccines against SARS-CoV-2. Lancet Infect Dis. 2021;21(2):e26-e35.
4. Kalinke U, Barouch DH, Rizzi R, Lagkadinou E, Türeci Ö, Pather S, et al. Clinical development and approval of COVID-19 vaccines. Expert Rev Vaccines. 2022;21(5):609-19.
5. Infarmed. Relatório de Farmacovigilância - Monitorização da segurança das vacinas contra a Covid -19 em Portugal [Internet]. Infarmed; 2022. Disponível em: https://www.infarmed.pt/documents/15786/4268692/Relatório+de+Farmacovigilância.+Monitorização
+da+segurança+das+vacinas+contra+a+COVID+19+em+Portugal+atualizado+31+janeiro+2022/709e77f5-ab06 092d-338b-44c99586f796
6. Rama TA, Miranda J, Silva D, Amaral L, Castro E, Coimbra A, et al. COVID-19 Vaccination Is Safe among Mast Cell Disorder Patients, under Adequate Premedication. Vaccines. 2022;10(5):1-9.
7. Carvalho JC, Cunha F, Coutinho IA, Loureiro C, Faria E, Bom AT. Hypersensitivity reactions to vaccines: Current evidence and standards for SARS-CoV-2 vaccines. Acta Med Port. 2021;34(13).
8. Greenhawt M, Abrams EM, Shaker M, Chu DK, Khan D, Akin C, et al. The Risk of Allergic Reaction to SARS-CoV-2 Vaccines and Recommended Evaluation and Management: A Systematic Review, Meta-Analysis, GRADE Assessment, and International Consensus Approach. J Allergy Clin Immunol Pract. 2021;9(10):3546-67.
9. Maltezou HC, Anastassopoulou C, Hatziantoniou S, Poland GA, Tsakris A. Anaphylaxis rates associated with COVID-19 vaccines are comparable to those of other vaccines. Vaccine. 2022;40(2):183-6.
10. Portugal, DGS - Direção-Geral da Saúde. Campanha de Vacinação contra a COVID-19 - Vacina SPIKEVAX® [Internet]. Norma da DGS n° 001/2021 de 14/01/2021. Portugal: DGS; 2021. p. 1-25. Disponível em: https://covid19.min-saude.pt/wp-content/uploads/2022/02/Norma_001_2021_act_03112021_pdf-1091kb.pdf.
11. Portugal, DGS - Direção-Geral da Saúde. Campanha de Vacinação contra a COVID-19 - Vacina VAXZEVRIA [Internet]. Norma da DGS n° 003/2021 de 08/02/2021. Portugal: DGS; 2021. p. 1-22. Disponível em: https://covid19.min-saude.pt/wp-content/uploads/2022/02/Norma_003_2021_act_17062021_pdf-1114kb.pdf.
12. Portugal, DGS - Direção-Geral da Saúde. Campanha de Vacinação contra a COVID-19 Vaccine Janssen® [Internet]. Norma n° 004/2021 de 30/04/2021 atualizada a 08/06/2021. Portugal: DGS; 2021. p. 1-24. Disponível em: https://www.dgs.pt/normas-orientacoes-einformacoes/normas-e-circulares-normativas/norma-n-0042021-de-30042021-pdf.aspx.
13. Portugal, DGS - Direção-Geral da Saúde. Campanha de Vacinação contra a COVID-19 - Vacina COMIRNATY® [Internet]. Norma da DGS n° 021/2020 de 23/12/2020. Portugal; 2021. Disponível em: https://www.sip-spp.pt/media/ilmffvrz/vacina-comirnaty-norma-021_2020-20_08_2021.pdf.
14. Gaspar A, Santos N, Faria E, Câmara R, Rodrigues-Alves R, Carrapatoso I, et al. Anaphylaxis: A Decade of a Nationwide Allergy Society Registry. J Investig Allergol Clin Immunol. 2022;32(1):23‑32.
15. Gaspar Â, Santos N, Faria E, Pereira AM, Gomes E, Câmara R, et al. Anaphylaxis in children and adolescents: The Portuguese Anaphylaxis Registry. Pediatr Allergy Immunol. 2021;32(6):1278‑86.
16. Ruëff F, Placzek M, Przybilla B. Mastocytosis and Hymenoptera venom allergy. Curr Opin Allergy Clin Immunol. 2006 Aug;6(4):284-8.
17. Brockow K, Jofer C, Behrendt H, Ring J. Anaphylaxis in patients with mastocytosis: a study on history, clinical features and risk factors in 120 patients. Allergy. 2008 Feb;63(2):226-32.
18. Rama TA, Moreira A, Castells M. mRNA COVID-19 vaccine is well tolerated in patients with cutaneous and systemic mastocytosis with mast cell activation symptoms and anaphylaxis. J Allergy Clin Immunol. 2021 Mar;147(3):877-8
19. Muraro A, Roberts G, Worm M, Bilò MB, Brockow K, Fernández Rivas M, et al.; EAACI Food Allergy and Anaphylaxis Guidelines Group. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014 Aug;69(8):1026‑45.
20. Mueller UR. Insect sting allergy: clinical picture, diagnosis and treatment. Gustav Fischer; 1990. p. 33-65.
21. Sociedade Portuguesa de Alergologia e Imunologia Clínica - Grupo de Interesse de Alergia a Fármacos. Protocolo de atuação na vacinação contra SARS-CoV-2 nos Serviços de Imunoalergologia Portugueses. Portugal: SPAIC; 2022.
22. Turner PJ, Ansotegui IJ, Campbell DE, Cardona V, Ebisawa M, El-Gamal Y, et al.; WAO Anaphylaxis Committee. COVID-19 vaccine-associated anaphylaxis: A statement of the World Allergy Organization Anaphylaxis Committee. World Allergy Organ J. 2021 Feb;14(2):100517.
23. Klimek L, Jutel M, Akdis CA, Bousquet J, Akdis M, Torres MJ, et al. ARIA-EAACI statement on severe allergic reactions to COVID-19 vaccines - An EAACI-ARIA Position Paper. Allergy. 2021;76(6):1624-8.
24. Sokolowska M, Eiwegger T, Ollert M, Torres MJ, Barber D, Del Giacco S, et al. EAACI statement on the diagnosis, management and prevention of severe allergic reactions to COVID-19 vaccines. Allergy Eur J Allergy Clin Immunol. 2021;76(6):1629-39.
25. Barbaud A, Garvey LH, Arcolaci A, Brockow K, Mori F, Mayorga C, et al. Allergies and COVID-19 vaccines: An ENDA/EAACI Position paper. Allergy Eur J Allergy Clin Immunol. 2022;77(8):2292-312.
26. Bonadonna P, Brockow K, Niedoszytko M, Elberink HO, Akin C, Nedoszytko B, et al. COVID-19 Vaccination in Mastocytosis: Recommendations of the European Competence Network on Mastocytosis (ECNM) and American Initiative in Mast Cell Diseases (AIM). J Allergy Clin Immunol Pract. 2021;9(6):2139-44.
27. Ieven T, Vandebotermet M, Nuyttens L, Devolder D, Vandenberghe P, Bullens D, et al. COVID-19 Vaccination Safety and Tolerability in Patients Allegedly at High Risk for Immediate Hypersensitivity Reactions. Vaccines (Basel). 2022;10(2):286.
28. Nittner-Marszalska M, Rosiek-Biegus M, Kopec A, Pawłowicz R, Kosinska M, Łata A, et al. Pfizer-biontech COVID-19 vaccine tolerance in allergic versus non-allergic individuals. Vaccines. 2021;9(6):553.
29. Ruano-Zaragoza M, Carpio-Escalona LV, Diaz-Beya M, Piris- Villaespesa M, Castaño-Diez S, Muñoz-Cano R, et al. Safety of COVID-19 vaccination in patients with clonal mast cell disorders. J Allergy Clin Immunol Pract. 2022;10(5):1374-1376.e3.
30. Klimek L, Bergmann KC, Brehler R, Pfützner W, Zuberbier T, Hartmann K, et al. Practical handling of allergic reactions to COVID-19 vaccines: A position paper from German and Austrian Allergy Societies AeDA, DGAKI, GPA and ÖGAI. Allergo J Int. 2021;30(3):79-95.
31. Caminati M, Guarnieri G, Senna G. Who Is Really at Risk for Anaphylaxis Due to COVID-19 Vaccine? Vaccines (Basel). 2021;9(1):38.
32. Lazarinis N, Bossios A, Gülen T. COVID-19 vaccination in the setting of mastocytosis-Pfizer-BioNTech mRNA vaccine is safe and well tolerated. J Allergy Clin Immunol Pract. 2022 May;10(5):1377-9.
33. Rama T, Moreira A, Delgado L. Abordagem diagnóstica e terapêutica das mastocitoses - Uma proposta de orientação clínica. Rev Port Imunoalergologia. 2020;28(1):31-49.
34. Muraro A, Worm M, Alviani C, Cardona V, DunnGalvin A, Garvey LH, et al.; European Academy of Allergy and Clinical Immunology, Food Allergy, Anaphylaxis Guidelines Group. EAACI guidelines: Anaphylaxis (2021 update). Allergy. 2022;77(2):357-77.