Número Atual: Outubro-Dezembro 2022 - Volume 6 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Eventos adversos imediatos à vacina febre amarela em crianças alérgicas ao ovo
Immediate adverse events to the yellow fever vaccine in egg-allergic children
Bianca Noleto Ayres Guimarães1; Tânia Cristina de Mattos Barros Petraglia1; Ana Karolina Barreto Berselli Marinho2; Adauto Dutra Moraes Barbosa3
DOI: 10.5935/2526-5393.20220060
1. Hospital Municipal Rocha Maia, Secretaria Municipal de Saúde, Centro de Referência para Imunobiológicos Especiais - Rio de Janeiro, RJ, Brasil
2. Hospital das Clínicas da Faculdade de Medicina da USP, Serviço de Imunologia Clínica e Alergia/Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
3. Universidade Federal Fluminense, Departamento Materno-Infantil - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Bianca Noleto Ayres Guimarães
E-mail: biancanoleto@hotmail.com
Submetido em: 08/07/2022
Aceito em: 07/10/2022
RESUMO
INTRODUÇÃO: A vacina contra a febre amarela é cultivada em ovos embrionados de galinha e por isso pode estar contraindicada em indivíduos alérgicos ao ovo. Quando indicada, deve ser aplicada com cautela, após atendimento especializado para avaliação de testes e necessidade de dessensibilização. Sua segurança nos alérgicos ao ovo ainda é pouco estudada.
OBJETIVO: Descrever uma população pediátrica encaminhada por alergia ao ovo, com ou sem diagnóstico comprovado, e os casos de eventos adversos do tipo imediata à vacina contra a febre amarela em um centro de referência para imunobiológicos especiais (CRIE).
MATERIAL E MÉTODOS: Estudo transversal realizado com coleta de dados retrospectivos de crianças entre 9 meses e 12 anos de idade, vacinadas contra a febre amarela com história de alergia ao ovo, no período de 2018 a 2019.
RESULTADOS: Dentre as 829 crianças, com diagnóstico presumido de alergia ao ovo, foi identificada uma maior prevalência de sintomáticos após exposição ao ovo, com IgE específica detectável para ovo, clara de ovo e/ou ovoalbumina. Testes para vacina febre amarela foram realizados em 25 crianças com suspeita de alergia grave ou anafilaxia ao ovo, sendo 15 (60%) positivos com a vacina aplicada após dessensibilização. Foram evidenciados apenas 11 (1,3%) casos de evento adverso imediato à vacina, todos classificados como evento adverso não grave e com acometimento especial da pele (reação local e exantema ou urticária). A maioria dos eventos ocorreu em menores de 2 anos, nos sintomáticos após ingesta de ovo e naqueles com altos valores de IgE específica para clara de ovo.
CONCLUSÃO: Este estudo evidencia que a vacina contra a febre amarela pode ser aplicada em crianças alérgicas ao ovo, de forma segura, inclusive naquelas com história de anafilaxia, desde que em ambiente adequado e com profissionais especializados.
Descritores: Vacina contra febre amarela, anafilaxia, dessensibilização imunológica, hipersensibilidade a ovo, efeitos colaterais e reações adversas relacionados a medicamentos.
INTRODUÇÃO
A febre amarela (FA) é uma doença viral potencialmente grave, transmitida por mosquitos, em humanos e outros primatas. Entre 2017 e 2018, foi registrado o surto mais expressivo de FA silvestre no Brasil (1.376 casos com 35% de letalidade) e o risco de reurbanização da FA voltou a ser uma preocupação quando o surto atingiu a região mais populosa do país. Desde 2019, o Programa Nacional de Imunizações (PNI) ampliou a recomendação da vacinação para todo o território nacional1.
A história de alergia à proteína do ovo (APO), mais prevalente em crianças2, muitas vezes impede ou dificulta a vacinação para FA, pelo risco de reações adversas a esta vacina, cuja composição apresenta proteínas do ovo3. Entretanto, faltam estudos que comprovem a segurança da aplicação da vacina FA em pacientes com APO4-7. O objetivo do presente estudo é de conhecer, entre crianças, a relação entre APO e o aparecimento de reações alérgicas à vacina que a contraindique.
MATERIAL E MÉTODOS
Estudo transversal, realizado através do levantamento de dados retrospectivos de uma população pediátrica vacinada para FA, no Centro de Referência para Imunobiológicos Especiais (CRIE) / Secretaria Municipal de Saúde / Hospital Municipal Rocha Maia (Rio de Janeiro, RJ), com história de alergia a ovo. Foram incluídas crianças, de ambos os sexos, com idade entre 9 meses e 12 anos, 11 meses e 29 dias, atendidas para vacinação entre janeiro/2018 e dezembro/2019, período escolhido pelo surto de FA na cidade e alta procura pela vacina.
As crianças encaminhadas para VFA com diagnóstico de APO receberam atendimento prévio pelo médico pediatra do serviço, que realizou uma anamnese dirigida para avaliar a gravidade clínica e laboratorial da APO e o risco de evento adverso imediato à VFA. Após avaliação médica inicial, crianças com histórico de alergia leve/moderada ao ovo receberam a VFA sob supervisão e observação no local por 30 a 60 minutos. Já aquelas com quadro clínico e laboratorial de alergia grave ou anafilaxia ao ovo foram encaminhadas para avaliação com o alergista do serviço e realização do teste cutâneo de leitura imediata (TCLI) para VFA.
Os TCLI para avaliação de hipersensibilidade do tipo I consistem nos testes de puntura ou prick com a vacina pura (diluição 1:1), seguido do teste intradérmico (ID) com a vacina diluída (1:100), caso o prick inicial seja negativo. As crianças que apresentaram resultado positivo em alguma etapa do TCLI receberam a VFA sob dessensibilização, em ambiente seguro e sob monitorização contínua, conforme protocolo da Sociedade Brasileira de Alergia e Imunologia (ASBAI)4. As reações imediatas consideradas como evento adverso pós-vacinal (EAPV) foram notificadas à vigilância em saúde, pelo médico do serviço. Conforme manual de EAPV do Ministério da Saúde, foi considerado como EAPV grave qualquer evento que tenha resultado em hospitalização, disfunção significativa e/ou incapacidade permanente, óbito ou risco de morte com intervenção clínica imediata para evitar o óbito8. Um evento pode ser leve, moderado ou intenso, independentemente de ser ou não grave, como uma hiperemia local intensa8.
A vacina FA (fabricante Bio-Manguinhos®), durante a campanha nacional ocorrida em 2018, foi aplicada na dose padrão (0,5 mL) nos indivíduos menores de 2 anos e viajantes e na dose de campanha (0,1 mL) nos demais (maiores de 2 anos e não viajantes). Foram excluídos do estudo os vacinados não encaminhados por APO, através de um documento formal, para aplicação da VFA no CRIE, os revacinados e aqueles que não ficaram sob observação após a aplicação, no período indicado pelo médico, conforme protocolo.
Os dados foram coletados a partir dos registros do Sistema SI-PNI (Sistema de Informações do Programa Nacional de Imunizações do Ministério da Saúde), das anamneses dirigidas, que incluíram dados determinados pelos médicos do serviço para definir o nível de gravidade da APO e das notificações de EAPV realizadas pelos médicos do serviço. Foram analisadas as seguintes variáveis: idade no momento da aplicação da VFA; sexo; informações clínicas e laboratoriais da anamnese dirigida (médico do CRIE), que basearam o diagnóstico para o encaminhamento; presença de comorbidades e outras doenças alérgicas associadas à APO; resultado do TCLI para VFA, quando realizado pelo alergista do CRIE; dose, forma de aplicação da VFA (se sob dessensibilização ou não) e sintomas de eventos adversos à VFA, quando presentes no período de observação. As informações clínicas para o diagnóstico de APO, relatadas nos atendimentos médicos do CRIE na anamnese dirigida, foram coletadas e estratificadas em sinais e sintomas ao ovo prévios à vacinação.
A pesquisa de sensibilização in vivo, através do teste de puntura ou prick, para ovo e/ou seus componentes, realizada previamente à avaliação do CRIE, pelos médicos assistentes dos pacientes, quando informada, foi coletada e identificada como prick negativo ou positivo. O teste de provocação oral para ovo não foi avaliado neste estudo por limitação da sua realização na prática clínica em serviços não especializados.
A pesquisa de sensibilização in vitro, com a dosagem de IgE sérica específica para ovo, clara de ovo, ovoalbumina e/ou ovomucoide, realizada principalmente pelo método fluoroenzimaimunoensaio (Immunocap® - Thermo Fischer Scientific)9, quando informada, foi identificada como não detectável/detectável. Os resultados detectáveis (baixo, moderado e alto) foram classificados conforme referências dos laboratórios de análises clínicas em que foram realizados. A data de realização dos exames, quando registrada, também foi coletada.
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da SMS/RJ (CAAE: 33512620.9.0000.5279).
RESULTADOS
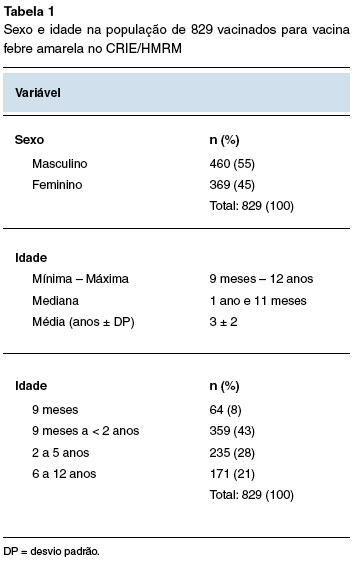
O estudo incluiu 829 crianças vacinadas para FA com possível APO, cujos dados podem ser observados na Tabela 1.
Critérios diagnósticos para APO
Foram encontrados os seguintes critérios para avaliação do diagnóstico presumido de APO: presença ou ausência de sinais e sintomas após exposição ao ovo (n = 688/83%); prick para ovo e/ou seus componentes (n = 190/23%) e IgE sérica específica para ovo, clara de ovo e/ou ovalbumina (n = 563/68%).
No total, foram identificadas 720 (87%) crianças com sintomas pós-exposição ao ovo, e/ou IgE sérica específica e/ou prick positivo para ovo/componentes. Em 12% (n = 97) não foram encontradas informações sobre sintomas ou exames de pesquisa para o diagnóstico de APO.
Dentre o total de 623 crianças (91%) com presença de sinais e sintomas após exposição ao ovo, 490 (79%) tiveram manifestações cutâneas, 219 (35%) gastrointestinais, 67 (11%) respiratórias, e 48 (8%) neurológicas. Em 28% (n = 172) das crianças havia o registro de sinais e sintomas de APO em mais de um órgão ou sistema. No entanto, a informação de anafilaxia ou suspeita de anafilaxia prévia ao ovo foi descrita em 22 (4%) crianças. Os sinais e sintomas de APO mais relatados foram: urticária (58%), dermatite (29%), vômito (26%), diarreia (14%), angioedema (10%), tosse (8%), irritabilidade (7%), dor abdominal (6%), rinite (4%) e anafilaxia (4%). A informação sobre o intervalo dos sintomas de APO e a data de aplicação da VFA não foi relatada na maioria dos registros, porém, no grupo de sintomáticos, 356 (57%) eram lactentes na data de aplicação da VFA.
Entre os componentes do ovo analisados, as dosagens de IgE sérica para clara de ovo, ovalbumina e ovo foram mais frequentemente encontradas, correspondendo respectivamente a 92%, 20% e 17% dos resultados encontrados. O registro da dosagem de IgE específica para ovomucoide foi encontrado em < 1%. No total, 499 (89%) crianças apresentaram resultados detectáveis de IgE sérica específica, indicativos de sensibilização, para ovo, clara e/ou ovalbumina, sendo 30% (n = 170) com resultado de dosagem de IgE sérica específica acima de 3,50 kU/L, valor considerado alto. A informação da data de realização desse exame estava presente em 176 (31%) crianças, destas 95% com menos de 12 meses e 81% com menos de 6 meses da data de aplicação da VFA.
A presença de comorbidades, como outras doenças alérgicas associadas ao quadro de APO prévio à vacinação foi descrita em 27% (n = 221) das crianças avaliadas. Destas, 35% apresentaram dermatite atópica, 28% alergia à proteína do leite de vaca (APLV), 8% outras alergias alimentares, 26% rinite, 17% asma ou bronquite e 22% ausência de outras doenças. Não foram encontrados registros de crianças com alergia a gelatina.
Para avaliação de sensibilização à VFA, TCLI foram realizados em 25 (3%) crianças pelo médico alergista do serviço: 20 com histórico ou suspeita de anafilaxia ao ovo, e 5 com história clínica de APO grave (urticária e/ou angioedema intenso). Valores altos de IgE sérica específica para ovo, clara de ovo e/ ou ovalbumina foram descritos em 21 das 22 crianças com dosagem informada. Prick para ovo foi positivo em 10 dos 11 testes informados. Dentre as 22 crianças com relato de anafilaxia prévia ao ovo, apenas 2 crianças (5 e 6 anos de idade), que apresentavam episódios de anafilaxia ao ovo enquanto lactentes, não realizaram o TCLI para VFA, por melhora evolutiva na gravidade da APO ao longo dos anos.
Para avaliação de sensibilização à VFA, inicialmente foi realizado o prick com a vacina pura, seguido do teste intradérmico (ID) com a vacina diluída (1:100), caso o prick inicial tenha sido negativo. Dentre os 25 prick realizados para VFA, 6 foram positivos e 19 negativos. Esses com resultados negativos para o prick fizeram o teste ID com a vacina diluída e 9 apresentaram positividade. Seguindo o protocolo de escalonamento de doses (ou dessensibilização), as 15 (60%) crianças com testes positivos (6 prick positivos e 9 ID positivos), receberam a vacina sob dessensibilização (Figura 1).
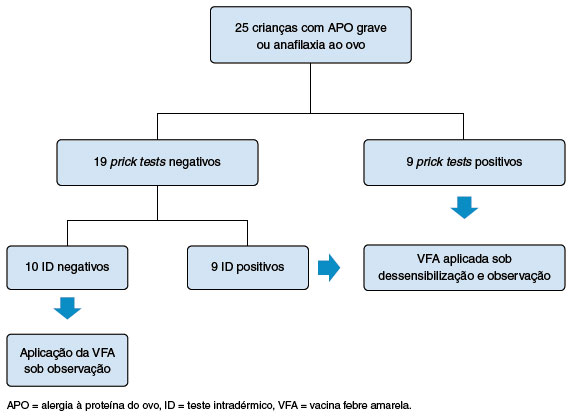
Figura 1
Fluxograma dos testes cutâneos de leitura imediata (TCLI) para vacina febre amarela realizados em crianças com história de alergia à proteína do ovo grave ou anafilaxia ao ovo no CRIE/HMRM
A dose padronizada da vacina com volume de 0,5 mL foi aplicada em 568 (69%) crianças. E a dose de 0,1 mL (campanha 2018), foi aplicada em 261 (31%) crianças maiores de 2 anos. Dentre as 15 crianças que receberam a vacina sob dessensibilização, 3 foram no período de campanha, na dose de 0,1 mL.
APO = alergia à proteína do ovo, ID = teste intradérmico, VFA = vacina febre amarela.
Eventos adversos à vacina febre amarela
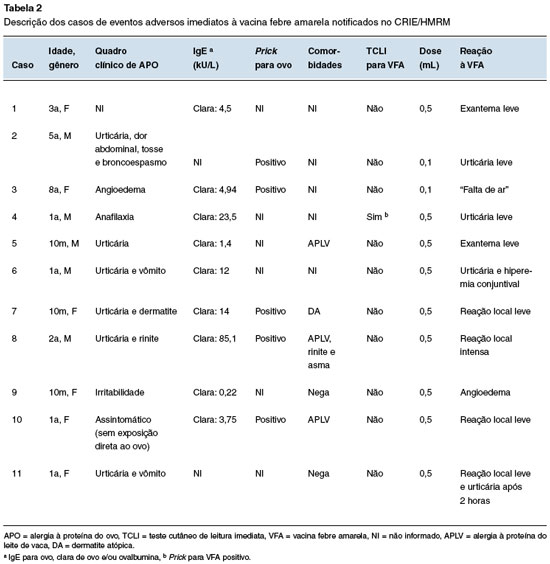
Dentre as 829 crianças vacinadas com indicação presumida de APO, apenas 11 (1,3%) apresentaram EAPV imediatos após a aplicação da VFA (Tabela 2). Todos os casos de eventos adversos imediatos observados foram caracterizados e notificados como evento adverso não grave (EANG). Não foram relatadas reações anafiláticas à VFA.
Uma criança, de 8 anos, referiu "falta de ar", mas de forma leve, sem descrição de alterações nos sinais vitais ou no exame físico, apresentando evolução para melhora no período de observação (caso 3). Foram descritas 4 (36%) crianças com reação imediata de pápula e hiperemia no local da aplicação: três na forma leve (casos 7, 10 e 11) e uma intensa (caso 8).
Sete (64%) crianças apresentaram manifestações cutâneas não localizadas na região da aplicação da vacina: uma com angioedema (caso 9), quatro com urticária (casos 2, 4, 6 e 1) e duas com exantema (casos 5 e 11). O caso 5 (lactente) apresentou hiperemia conjuntival leve associada à urticária. O caso 11 (lactente) apresentou reação local leve em poucos minutos, mas evoluiu com urticária 2 horas após a aplicação.
Nos EAPV imediatos relatados: 7 (64%) eram lactentes; 8 (73%) apresentaram histórico de manifestação cutânea após exposição ao ovo; 1 (9%) apresentou história suspeita de anafilaxia ao ovo; 4 (36%) apresentaram histórico de manifestação em mais de um órgão ou sistema após exposição ao ovo, mas sem o relato de anafilaxia ou de simultaneidade dos sintomas, e 7 (64%) apresentaram valor alto (> 3,50 kU/L) de IgE sérica específica para clara de ovo.
Dentre as 15 crianças que tiveram TCLI positivo (puntura/ID) para VFA, apenas uma, com histórico prévio de anafilaxia ao ovo, apresentou reação (urticária) durante a dessensibilização à VFA (caso 4).Todas as crianças que tiveram TCLI (puntura/ID) negativos para VFA não apresentaram reação.
Os casos de reação vacinal tiveram alta sob orientação e medicação. Nenhuma criança necessitou de medicação venosa, oxigenioterapia ou adrenalina. Foram identificados através dos registros de notificações EAPV, outras quatro crianças vacinadas para VFA no CRIE, mas com reações tardias, não graves, de exantema após seis horas da aplicação, não caracterizando uma reação do tipo imediata.
DISCUSSÃO
O presente estudo avaliou uma população de 829 pacientes com diagnóstico provável de APO, número amostral significativo, comparado aos estudos publicados até o momento5,10-17. Dentre os fatores demográficos avaliados, a idade se mostrou relevante quanto à análise de APO, a maioria tinha menos de 5 anos de idade, faixa etária em que o diagnóstico de APO é mais comum, especialmente na idade inferior a 2 anos, quando o diagnóstico de APO é ainda mais prevalente2,7.
Na avaliação de risco, realizada pelos médicos pediatras (CRIE), os critérios de sintomatologia após exposição ao ovo, relatada pelos responsáveis, associada aos exames de pesquisa IgE sérica específica ou TP para ovo e seus componentes foram os mais encontrados como rotina no diagnóstico e classificação da gravidade desta alergia. Estes critérios também são os mais evidenciados na prática clínica7,9. Em 87% das crianças, ao menos um destes critérios diagnósticos estava presente, não sendo encontradas informações de crianças assintomáticas com exame de pesquisa negativo para sensibilização ao ovo e/ ou componentes. Isso sugere que a maioria desta população era alérgica ao ovo.
A sensibilização ao ovo, detectada pela IgE sérica para ovo, clara e/ou ovalbumina, foi identificada na maioria, e destas, 170 crianças apresentavam altos valores (acima de 3,5 kU/L). A IgE específica para ovomucoide foi pouco solicitada pelos profissionais que encaminharam os pacientes para o CRIE, e esta dosagem não foi encontrada de forma isolada em nenhuma criança. Não está claro o motivo pelo qual poucos pacientes tinham o registro dessa IgE específica, e não foi possível investigar esta questão com detalhes. A detecção de IgE específica tem sido considerada como indicativo de sensibilização ao alimento, na maioria das vezes apenas orientando para o diagnóstico de APO com a utilização do TPO duplo cego placebo controlado. No entanto, o TPO, considerado teste padrão ouro para o diagnóstico de APO, não foi identificado na população estudada. Este exame necessita de um ambiente supervisionado, sendo pouco disponível na prática clínica9. A maioria das crianças recebe um diagnóstico clínico sem recorrer a desafio alimentar pelo TPO7.
Outras doenças alérgicas mediadas por IgE (alergia à proteína do leite de vaca, dermatite atópica, rinite e asma) foram prevalentes no grupo com comorbidades informada. Sabe-se que o histórico de doenças alérgicas, avaliado em outras pesquisas com significativa prevalência, pode ser um fator de risco para reações de hipersensibilidade a vacinas5,12,13.
O atraso na vacinação para FA na maioria das crianças é justificado pela APO, fato que exige uma prévia orientação de um profissional de saúde e o encaminhamento para aplicação da vacina em um centro especializado4,8,18.
Embora reações anafiláticas e reações de hipersensibilidades à VFA já tenham sido relatadas19-22, poucos estudos avaliaram eventos adversos à VFA em alérgicos ao ovo. Quatro estudos que realizaram protocolos de dessensibilização para VFA em anafiláticos ao ovo não evidenciaram eventos adversos graves após a vacinação5,12,13,16. O presente estudo identificou história ou suspeita de anafilaxia ao ovo em 4% (n = 22) das crianças vacinadas. Este número provavelmente foi subestimado, já que em 28% havia o registro de sinais e sintomas de APO em mais de um órgão ou sistema, porém sem a informação de anafilaxia ou o detalhamento do intervalo de tempo entre os sintomas. O diagnóstico de anafilaxia é geralmente pouco reconhecido, principalmente quando ocorre em crianças23.
Testes cutâneos para VFA (prick seguido do ID nos casos de negatividade) foram realizados em 25 crianças suspeitas de alergia grave ou anafilaxia ao ovo, com positividade de 60% (n = 15), sendo 6 prick positivos e 9 ID positivos. Este percentual de positividade pode ser considerado elevado quando comparado a outros estudos em crianças alérgicas ao ovo: Sharma e cols. (2020), avaliaram 11 crianças com APO e realizaram prick em 7 crianças (2 anafiláticas), todos negativos. Apenas 1 realizou teste ID, também negativo13. Gerhardt e cols. (2019) realizaram testes para VFA em 43 crianças comprovadamente alérgicas ao ovo (7 anafiláticas) e demonstraram prick negativo para todos os casos, e ID positivo em 6 (14%) crianças12. Julião et al. (2018) demonstraram prick para VFA em 5 crianças com APO (2 anafiláticos), todos negativos, sendo 2 ID positivos16. A maior positividade dos TCLI, no presente estudo, pode ser justificada pela população testada ter sido previamente selecionada conforme a maior gravidade de APO, sendo 19 (76%) referidos como anafiláticos ao ovo. A realização do teste ID nas crianças quando o prick foi negativo propiciou uma maior positividade na pesquisa de sensibilização à VFA, assim como nos outros estudos12,16.
Gerhadt e cols. evidenciaram reação imediata em 3 das 6 crianças com ID positivo que foram dessensibilizadas para VFA, e concluíram que o teste ID pode contribuir para predizer maior risco de reação vacinal12. No presente estudo, os 9 pacientes com ID positivo, dessensibilizados, não apresentaram reação, e apenas 1 lactente com TP positivo apresentou urticária imediata à VFA. A técnica do teste ID pode ser mais dolorosa e de difícil realização em lactentes, e apresenta maior possibilidade de irritação cutânea e falsa positividade13. Estudos mais amplos são necessários para se determinar o grau de sensibilidade e de especificidade dos TCLI para VFA.
O ovo é um dos componentes vacinais mais frequentemente evidenciado como indicador de uma reação imediata de hipersensibilidade após a vacinação24-26. Foram identificados 11 (1,3%) casos de eventos adversos imediatos à VFA, todos definidos como EANG, nesta população, que foi sugestiva de alto índice de APO e provável risco de reação imediata à VFA.
Estudos de grandes populações vacinadas para VFA demonstram índices pouco expressivos de reações imediatas sugestivas de hipersensibilidade19,22,27. No entanto, em estudos com pacientes alérgicos ao ovo ainda não há definição de qual é a real frequência de EAPV, porque há uma variabilidade populacional e um número pequeno de indivíduos APO5,10-17.
Nos casos de EAPV à VFA, foram identificados em sua maioria, lactentes, sintomáticos após exposição ao ovo e valores altos de IgE sérica específica para clara de ovo. Isto sugere que as reações à VFA provavelmente estão relacionadas à idade e à gravidade da APO. No entanto, esses resultados são pouco comparáveis, por não haver até o momento, estudos com maiores populações de alérgicos ao ovo5,10-17.
Urticária foi o sintoma mais observado tanto no critério diagnóstico de APO quanto no casos de reação imediata à VFA. Este resultado corrobora com grandes estudos populacionais, que não avaliam especificamente APO, mas relatam frequentemente a urticária nos eventos de hipersensibilidade e reação imediata à VFA19,22.
Não foi possível relacionar o volume da dose da vacina com a presença de eventos adversos. A maioria dos EAPV observados neste estudo foram na dose com volume de 0,5 mL (91%), porém a dose 0,1 mL (campanha de 2018) foi aplicada em 32%, todos maiores de 2 anos, idade em que a prevalência ou gravidade da APO geralmente diminui2,7.
Embora seja uma população amostral significativa de crianças com diagnóstico presumido de APO, não houve reação anafilática à VFA. As poucas reações observadas foram classificadas como evento adverso não grave, no entanto, reações imediatas à VFA ocorreram em crianças sem história de alergia grave ao ovo.
O protocolo de testes para VFA seguido da dessensibilização, nos casos de positividade, tornou a aplicação da VFA mais segura nas crianças alérgicas graves ao ovo.
Diante deste estudo é possível afirmar que a VFA pode ser aplicada em crianças alérgicas ao ovo com segurança, através da avaliação de um especialista, em ambiente adequado e supervisionado.
AGRADECIMENTOS
Ao serviço do Centro de Referência em Imunobiológicos Especiais do Hospital Municipal Rocha Maia, Rio de Janeiro.
REFERÊNCIAS
1. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Imunização e Doenças Transmissíveis. Plano de contingência para resposta às emergências em Saúde Pública: febre amarela [recurso eletrônico]. Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Imunização e Doenças Transmissíveis. 2ª ed. Brasília: Ministério da Saúde; 2021.Disponível em:https://bvsms.saude.gov.br/bvs/publicacoes/plano_contingencia_emergencias_febre_amarela.pdf.
2. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 1 - Etiopatogenia, clínica e diagnóstico.Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia. Arq Asma Alerg Imunol. 2018;2(1):7-38.
3. Bula VFA Bio-Manguinhos [Internet]. Disponível em: https://www.bio.fiocruz.br/en/images/stories/pdfs/bulas/fa/BMBUL04500V190702FA10Nacional.pdf. Acessado em: 25/08/2021.
4. Marinho AKB, Ouricuri AL, Valente CFC, Fernandes FR, Saciloto G, de Castro Diniz L, et al.Vacina contra a febre amarela:reações adversas e populações de risco. Arq Asma Alergia Imunol. 2017;3:245-56.
5. Rutkowski K, Ewan PW, Nasser SM. Administration of yellow fever vaccine in patients with egg allergy. Int Arc h Allergy Immunol. 2013;161:274-8.
6. Nilsson L, Brockow K, Alm J, Cardona V, Caubet JC, Gomes E, et al.Vaccination and allergy:EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017;28:628-40.
7. Clark AT, Skypala I, Leech SC, Ewan PW, Dugué P, Brathwaite N, et al; British society for Allergy and Clinical Immunology. British Society for Allergy and Clinical Immunology guidelines for the management of egg allergy. Clin Exp Allergy. 2010;40:1116-29.
8. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Imunizações e Doenças Transmissíveis. Manual de vigilância epidemiológica de eventos adversos pósvacinação [recurso eletrônico] / Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Imunizações e Doenças Transmissíveis. 4ª ed. Brasília: Ministério da Saúde, 2020.Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/manual_vigilancia_epidemiologica_eventos_vacinacao_4ed.pdf.
9. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 2 - Diagnóstico, tratamento e prevenção. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia. Arq Asma Alerg Imunol. 2018;2(1):39-82.
10. Ruiz G, Sanchis-Merino E, Monsalve B, Perez I, Allue M, Berbel C. Yellow fever vaccination in egg-allergic patients. J Epidemiol Res. 2016;2:22.
11. Muñoz-Cano R, Sanchez-Lopez J, Bartra J, Valero A. Yellow fever vaccine and egg allergy: really a problem? Allergy. 2010;65:533-4.
12. Gerhardt CMB, Feitosa GDSJ, Aquilante BP, de Barros Dorna M, dos Santos CDJN, Pastorino AC, et al. Segurança da vacina de febre amarela em pacientes comprovadamente alérgicos à proteína do ovo. Arq Asma Alerg Imunol. 2019;3:143-50.
13. Sharma K, Perrett KP, Wood N.Yellow Fever Vaccination in EGG-Allergic Children. Pediatr Infect Dis J. 2020;39:e76-e78.
14. Catelain A, Cousin F, Piperno D, Pacheco Y, Nicolas JF.Vaccination anti-amarile et allergie à l oeuf. Rev Fr Allergol Immunol Clin. 2002;42:163-4.
15. Mosimann B, Stoll B, Francillon C, Pécoud A.Yellow fever vaccine and egg allergy. J Allergy Clin Immunol. 1995;95:1064.
16. Juliao GS, Barbosa PA, Silva PF, Cunha MA, Formigari CF, Pastorino AC, et al. Yellow fever vaccine in egg-allergic patients: safety of a vaccination protocol. J Allergy Clin Immunol. 2018;141:AB256.
17. Charpin J, Vervloet D, Birnbaum J, Tafforeau M, Sentissi S.Yellow fever: desensitization to an anti-amaril 17D vaccine performed on a patient with anaphylaxis to eggs. Bull Acad Natl Med. 1987;171:1001-5.
18. Guia de Imunização SBIm/ASBAI - Asma, Alergia e Imunodeficiências 2020-2021 [Internet]. Disponível em: https://sbim.org.br/images/guias/guia-sbim-asbai-miolo-201013b-web.pdf. Acessado em: 24/08/2021.
19. Lindsey NP, Rabe IB, Miller ER, Fischer M, Staples JE. Adverse event reports following yellow fever vaccination, 2007-2013.J Travel Med. 2016;23:1-6.
20. McNeil MM, DeStefano F. Vaccine-associated hypersensitivity. J Allergy Clin Immunol. 2018;141:463-72.
21. Porudominsky R, Gotuzzo EH. Yellow fever vaccine and risk of developing serious adverse events:a systematic review.Rev Panam Salud Publica. 2018;42:e75.
22. Breugelmans JG, Lewis RF, Agbenu E, Veit O, Jackson D, Domingo C, et al.Adverse events following yellow fever preventive vaccination campaigns in eight African countries from 2007 to 2010. Vaccine. 2013;31:1819-29.
23. Bernd LAG, Sá AB, Watanabe AS, Castro APM, Solé D, Castro FM, et al. Guia Prático para o manejo da anafilaxia - 2012. Rev bras alerg imunopatol. 2012;35:53-70.
24. Stone CA Jr, Rukasin CRF, Beachkofsky TM, Phillips EJ. Immunemediated adverse reactions to vaccines.Br J Clin Pharmacol. 2019;85:2694-706.
25. Staples JE, Gershman M, Fischer M; Centers for Disease Control and Prevention (CDC). Yellow fever vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP).MMWR Recomm Rep. 2010;59:1-27.
26. Caubet JC, Ponvert C.Vaccine allergy.Immunol Allergy Clin North Am. 2014;34:597-613.
27. Franceschini F, Bottau P, Caimmi S, Crisafulli G, Lucia L, Peroni D, et al. Vaccination in children with allergy to non-active vaccine components. Clin Transl Med. 2015;4:3.