Número Atual: Outubro-Dezembro 2022 - Volume 6 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Combinação fluticasona e azelastina intranasal no tratamento de adolescentes com rinite alérgica de difícil controle
Combination of intranasal fluticasone and azelastine for difficult-to-control allergic rhinitis in adolescents
Gustavo Falbo Wandalsen; Carolina Boarini Albuquerque; Fernanda Pontin Calvo; Daniela Tartari Cunha; Luana Cézar Medeiros; Dirceu Solé
DOI: 10.5935/2526-5393.20220059
Escola Paulista de Medicina, Universidade Federal de São Paulo, Pediatria, Disciplina de Alergia, Imunologia Clínica e Reumatologia - São Paulo, SP. Brasil
Endereço para correspondência:
Gustavo Falbo Wandalsen
E-mail: gfwandalsen@uol.com.br
Submetido em: 26/07/2022
Aceito em: 22/09/2022
RESUMO
INTRODUÇÃO: A rinite alérgica (RA) tem prevalência elevada e é responsável por impacto significativo da qualidade de vida destes pacientes, refletindo-se negativamente no desempenho escolar, na vida social ou no trabalho. A associação de propionato de fluticasona e cloridrato de azelastina (PF-AZE) tem sido recomendada no tratamento de pacientes com rinite alérgica de difícil controle.
OBJETIVO: Avaliar a resposta ao tratamento com PF+AZE administrado a crianças e adolescentes com RA persistente moderada-grave (RAPMG) de difícil controle.
MÉTODOS: Ensaio clínico aberto não controlado prospectivo com intervenção terapêutica em que participaram adolescentes (n = 65) com RAPMG de difícil controle acompanhados em ambulatório especializado.
RESULTADOS: Houve melhora estatisticamente significante de todas as variáveis estudadas, o que mostrou melhor controle da rinite com a combinação PF+AZE. Utilizando-se a diferença mínima clinicamente importante como parâmetro de avaliação, 83% dos pacientes tiveram melhora da doença. Não houve relato de evento adverso grave, gosto amargo foi relatado por 38,5% dos pacientes e dois interromperam o esquema por evento adverso.
CONCLUSÃO: A combinação PF+AZE foi bem tolerada, segura e eficaz no tratamento de pacientes com RAPMG.Eventos adversos locais foram os mais comumente relatados.
Descritores: Rinite alérgica, corticosteroides, obstrução nasal.
INTRODUÇÃO
A rinite alérgica (RA) é doença inflamatória da mucosa de revestimento da cavidade nasal, frequente, e cujas manifestações clínicas podem ter grande impacto sobre a qualidade de vida dos pacientes acometidos, além de comprometerem negativamente o sono, o desempenho escolar ou laboral e a vida social, entre outros1. No Brasil, estudo epidemiológico identificou ser a prevalência de RA variável entre 25% e 30% entre crianças e adolescentes2.
Para o tratamento farmacológico da RA estão disponíveis: anti-histamínicos H1 tópicos ou orais, corticosteroides intranasais (CEI), antagonistas de receptores de leucotrieno, e, ocasionalmente, corticosteroides orais1,3,4.
Os CEI são os medicamentos mais efetivos e seguros no controle da inflamação alérgica e da RA, quando administrados em doses recomendadas em adultos e crianças, para o tratamento de formas persistentes. Entretanto, pacientes com formas graves podem permanecer sintomáticos mesmo em tratamento combinado de CEI e outro medicamento de controle1,3,4.
Recentemente foi disponibilizada a combinação de CEI (propionato de fluticasona) e anti-histamínico (cloridrato de azelastina) (PF+AZE) para uso tópico intranasal em pacientes com RA persistente moderadagrave (RAPMG)5, e que posteriormente foi estendido a todas as formas de RA, independentemente do tipo e gravidade1,6,7.
O emprego da combinação PF+AZE quando comparado ao da fluticasona isolada em pacientes com RA, mostrou ser a combinação clinicamente mais efetiva no controle dos sintomas desde o primeiro dia de tratamento, e que se manteve durante o ano de seguimento8. Neste estudo, 75% dos pacientes tratados com PF+AZE obtiveram redução dos sintomas, impacto positivo na qualidade de vida e na adesão ao tratamento. Além disso, observou-se boa tolerância e baixa incidência de eventos adversos, à semelhança do ocorrido com a fluticasona isolada8. Desse modo, a combinação PF+AZE passou a ser recomendada a pacientes com RAPMG, maiores de seis anos de idade, que não tinham a doença controlada1,9.
Assim, foram objetivos, deste estudo de vida real, avaliar a resposta ao tratamento com PF+AZE intranasal, por quatro semanas, em adolescentes com RAPMG não controlada apesar de estarem sendo tratados de modo efetivo.
MÉTODOS
Participaram do estudo aberto e não controlado adolescentes (12 a 20 anos) com RAPMG não controlada acompanhados há pelo menos seis meses em ambulatório especializado. O diagnóstico de RA foi feito por médico alergista1 e a sensibilização alérgica confirmada por IgE sérica específica e/ou teste cutâneo de leitura imediata positivos (diâmetro médio da pápula de induração igual ou maior de 3 mm além do controle negativo)10, a pelo menos um aeroalérgeno (Dermatophagoides pteronyssinus, Dermatophagoides farinae, Blomia tropicalis, Blatella germanica, Periplaneta americana, epitélio gato, cão, mix de polens, mix de fungos).
Todos os adolescentes tinham RAPMG não controlada (opinião médica), pois permaneciam com sintomas apesar de tratamento com CEI e/ou antihistamínico oral.
Pacientes com diagnóstico de asma não controlada, má formação anatômica da via aérea superior, doenças sistêmicas, déficit cognitivo, em vigência de infecção respiratória ou nas últimas três semanas, uso de corticosteroide sistêmico nos últimos 30 dias e/ou imunoterapia alérgeno-específica ou em tratamento com imunossupressores não foram incluídos no estudo.
Uma vez admitidos, o esquema de tratamento em uso foi suspenso, e os pacientes iniciaram novo esquema terapêutico com a combinação de dose fixa de PF (50 µg/jato) e AZE (137 µg/jato) intranasal (1 jato/ narina duas vezes ao dia) por 30 (± 5) dias.
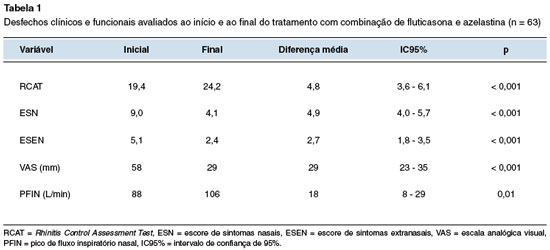
Ao início e ao final do estudo foram mensurados: escore de sintomas nasais (ESN), escore de sintomas extranasais (ESEN), questionário de controle da rinite RCAT (Rhinitis Control Assessment Test), escala visual analógica (VAS) sobre melhora nasal e pico de fluxo inspiratório nasal (PFIN).
O ESN foi calculado pela soma das notas dadas pelos adolescentes para: obstrução nasal, prurido nasal, coriza, espirros e gotejamento pós-nasal quantificados em sua intensidade com notas que variaram de 0 (ausente) a 3 (intenso), referentes à última semana11. Dessa forma, o ESN variou entre 0 e 15 pontos, e a rinite foi classificada em leve (0 a 4 pontos), moderada (5 a 10 pontos) ou grave (11 a 15 pontos)11. O ESEN (0 a 12 pontos) foi calculado de forma semelhante para os seguintes sintomas: prurido ocular, lacrimejamento, hiperemia ocular e prurido faríngeo11.
O RCAT, instrumento autoaplicável, traduzido e validado para o português (cultura brasileira)12 é composto por seis perguntas referentes aos sintomas vivenciados na última semana, e cada questão é pontuada, segundo a frequência de relato, em: 5 para nunca, 4 para raramente, 3 para às vezes, 2 para frequentemente, e 1 para muito frequentemente. A somatória de todas as perguntas fornece o escore total, sendo que os com escore total ≤ 22 foram classificados como não controlados12.
A avaliação do controle dos sintomas nasais na última semana foi obtida também pela VAS (0 = nenhum incômodo a 100 mm incômodo máximo)13. A avaliação objetiva da função nasal foi realizada pela mensuração do pico de fluxo inspiratório nasal (PFIN; Clement Clark®, UK) em litros por minuto (L/ min), sendo considerado o melhor valor obtido de três medições, desde que sem diferença superior a 10%14.
A opinião médica sobre o controle da rinite alérgica (controlada, parcialmente controlada ou não controlada) foi registrada ao início e ao final do estudo. A presença de eventos adversos foi questionada na avaliação final do estudo.
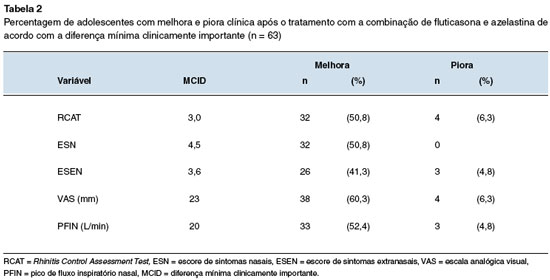
A resposta clínica individual para cada desfecho foi definida de acordo com a diferença mínima clinicamente importante (MCID), sendo de 23 mm para a VAS13; 3,0 pontos para o RCAT5; 4,5 pontos para o ESN15; 3,6 pontos para o ESEN13; e de 20 L/min para o PFIN16.
As diferenças médias dos valores obtidos ao início e ao final do estudo foram comparadas pelo teste t de Student para amostras pareadas. Fixou-se em 5% o nível de rejeição da hipótese de nulidade.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo e todos os pacientes assinaram o Termo de Consentimento Livre e Esclarecido.
RESULTADOS
Foram incluídos no estudo 71 adolescentes, sendo que seis não retornaram na visita final e dois abandonaram o tratamento por evento adverso. A média de idade dos 63 adolescentes (55,6% sexo feminino) que completaram o estudo foi de 14 ± 2 anos, variando entre 12 e 20 anos. Segundo a presença de outras manifestações alérgicas, 81% tinham asma, 57% dermatite atópica e 46% conjuntivite alérgica. Todos vinham sendo tratados com CEI e 25% recebiam antihistamínico sistêmico, por via oral, sem controle da RA. Oitenta e cinco por cento dos pacientes relatavam ser aderentes a esse tratamento.
Durante a avaliação inicial, empregando-se o ESN, 21 (33,4%) foram classificados como tendo RA grave, 38 (60,3%) moderada e 4 (6,3%) leve. De acordo com a pontuação do RCAT, 48 (76,2%) pacientes tinham valor igual ou menor que 22 (não controlados); segundo a VAS 52 (82,5%) pacientes eram graves/ não controlados (VAS ≥ 50mm); e de acordo com a opinião médica, 71% estavam não controlados e 29% parcialmente controlados. O intervalo entre as avaliações foi em média de 33 dias.
Na Tabela 1 são apresentados os valores obtidos pelos vários instrumentos utilizados, nos dois momentos do estudo. Houve redução significante do ESN, ESEN e VAS, assim como aumento do PFIN e do RCAT.
A avaliação dos sintomas nasais e extranasais, em separado, nos dois momentos do estudo mostrou redução significante de todos ao final do estudo (Figura 1). A Figura 2 mostra os valores individuais de variação do escore da VAS, RCAT e do ESN.
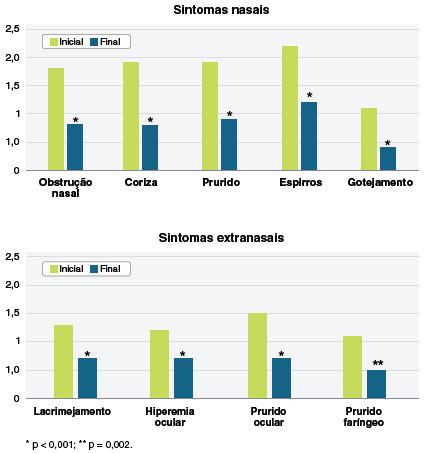
Figura 1
Escore individual médio dos sintomas nasais e extranasais (variação 0 a 3 pontos) ao início e ao final do tratamento com a combinação de fluticasona e azelastina (n = 63)
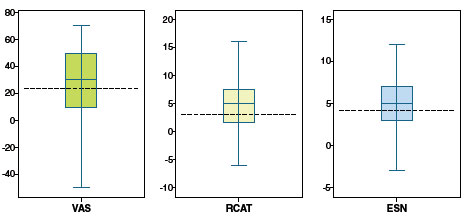
Figura 2
Variação individual da escala visual analógica (VAS), do questionário de controle da rinite alérgica (RCAT) e do escore de sintomas nasais (ESN) ao final do tratamento com a combinação de fluticasona e azelastina em relação aos valores iniciais (n = 63). A diferença mínima clinicamente importante para cada desfecho é mostrada pela linha tracejada
Na Tabela 2, segundo a MCID para os diferentes parâmetros avaliados, são apresentados os percentuais de pacientes que apresentaram melhora (superior à MCID) ou piora (abaixo) dos diferentes parâmetros.
Da mesma forma, foi constatado que após a instituição do tratamento com PF+AZE houve aumento no número de pacientes classificados pelo médico como controlados (0 vs. 71%) e redução dos não controlados (71% vs. 11%) (Figura 3).

Figura 3
Porcentagem de adolescentes classificados como controlados, parcialmente controlados e não controlados pelo médico ao início e ao final do tratamento com combinação de fluticasona e azelastina (n = 63)
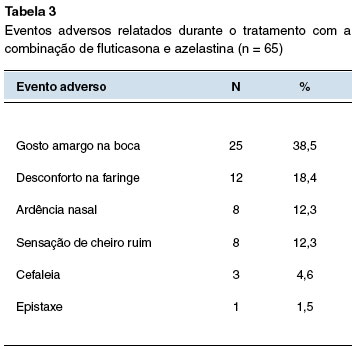
Algum evento adverso foi relatado por 56% dos adolescentes, com predomínio de gosto amargo na boca (38%), e não houve evento grave (Tabela 3). Seis pacientes não retornaram para a consulta final, e dois tiveram o esquema interrompido por evento adverso (3,1%).
DISCUSSÃO
Em nosso estudo de vida real, confirmamos os resultados observados por outros investigadores de que a combinação PF+AZE intranasal é efetiva no controle da RAPMG não controlada de adolescentes, apesar de tratamento com CEI e/ou anti-histamínico H1 oral11,17-28.
Independentemente do instrumento empregado para avaliar a eficácia do tratamento com PF+AZE (VAS, ESN, RCAT, PFIN), observamos índice elevado de controle da RA de nossos pacientes considerandose a MCID, ou seja, 87% obtiveram melhora em pelo menos um instrumento.
Em revisão recente sobre o tratamento de rinite alérgica moderada-grave com a combinação PF+AZE documentou-se melhora dos sintomas nasais oscilando entre 44% e 64%, quando comparado aos seus componentes administrados de modo isolado29.
Embora os pacientes aqui tratados não houvessem respondido de modo satisfatório ao tratamento com CEI isolado ou associado à anti-H1 sistêmico, não podemos inferir que a combinação foi melhor que os CEI isolados, uma vez que diferentes produtos vinham sendo usados pelos pacientes. Entretanto, ao avaliarmos os pacientes per se, houve redução significante da intensidade dos sintomas nasais e extranasais, à semelhança do relatado por outros autores11,17-28 (Figura 2).
A obstrução nasal, entre os sintomas mais frequentes da RA, é o que certamente mais incomoda os pacientes30. Ao avaliarmos os valores do PFIN, medida objetiva da patência nasal, verificamos que o grupo como um todo apresentou aumento significante do seu valor após o tratamento com a combinação e que mais de 50% tiveram aumento superior a 20L/ min, MCID definida para este instrumento16.
Outro dado interessante observado entre os nossos pacientes foi a redução do ESEN. Admitindo-se como parâmetro de avaliação o valor da MCID (ser igual ou superior), verificamos que mais de 40% dos pacientes apresentou redução do ESEN, sobretudo do prurido ocular. Acredita-se que o CEI reduza os sintomas oculares por efeito de classe, pois ao ligar-se aos receptores de glicocorticoide estimula o aumento da expressão de moléculas anti-inflamatórias, bem como de receptores beta-adrenérgicos, diminui a expressão de células e moléculas pro-inflamatórias, o que aumenta os benefícios da adição de antihistamínicos31.
Os eventos adversos decorrentes da utilização da combinação PF+AZE têm sido pouco frequentes e o relato de evento adverso grave, ausente25. Os eventos adversos mais apontados têm sido: disgeusia, náusea, espirros, desconforto nasal e epistaxe, todos em frequências baixas ou muito baixas25. Embora o relato de eventos adversos, na sua maioria locais, tenha ocorrido por parcela significativa dos nossos pacientes, apenas dois interromperam o esquema de tratamento e abandonaram o estudo.
Excetuando-se a medida do PFIN, todos os desfechos aqui avaliados têm um componente subjetivo, pois dependem de informações fornecidas pelos próprios pacientes. Assim, em nosso estudo utilizamos a MCID que avalia o que tem significado para o paciente e pode ser autorreferida ou medida objetivamente. A MCID corresponde à menor mudança em um desfecho que representa uma mudança significativa para o paciente32,33.Vários são os métodos disponíveis para aferir a MCID, mas o principal é que a mudança deve ser maior do que o erro de medição do instrumento que está sendo utilizado para avaliar o desfecho, e deve ser grande o suficiente para que os pacientes percebam a mudança clínica32,33. Assim, na avaliação dos nossos desfechos, embora poucos dos por nós utilizados tenham validação para a nossa população, empregamos como pontos de corte os consagrados por outros autores5,13,15,16.
É importante destacar que o percentual de pacientes com melhora clinicamente importante no ESN e no ESEN muito provavelmente foi subestimado em nosso estudo. Pela falta de critério especificamente definido para estes escores, optamos por definir valores mais conservadores de 30% do total de cada escore16.
O presente estudo apresenta algumas limitações. Por se tratar de estudo de vida real, não houve comparação com grupo placebo. Também não tivemos braços do estudo com o uso isolado das drogas (fluticasona e azelastina), não podendo fazer comparações destas com a combinação PF+AZE.
Em conclusão, a combinação INCS+AZE mostrou ser uma droga bem tolerada, segura e eficaz no tratamento da RA moderada/grave não controlada, revelada pela melhora significativa não só nos sintomas nasais, mas também nos sintomas oculares.
REFERÊNCIAS
1. Bousquet J, Schünemann HJ, Togias A, Bachert C, Erhola M, Hellings PW, et al. Next-generation Allergic Rhinitis and Its Impact on Asthma (ARIA) guidelines for allergic rhinitis based on Grading of Recommendations Assessment, Development and Evaluation (GRADE) and real-world evidence. J Allergy Clin Immunol. 2020;145(1):70-80.
2. Solé D, Wandalsen GF, Camelo-Nunes IC, Naspitz CK; ISAAC - Brazilian Group. Prevalence of symptoms of asthma, rhinitis, and atopic eczema among Brazilian children and adolescents identified by the International Study of Asthma and Allergies in Childhood (ISAAC) - Phase 3. J Pediatr (Rio J).2006;82:341-6.
3. Bousquet JJ, Schünemann HJ, Togias A, Erhola M, Hellings PW, Zuberbier T, et al. Next-generation ARIA care pathways for rhinitis and asthma: a model for multimorbid chronic diseases. Clin Transl Allergy. 2019;9:44.
4. Papadopoulos N, Bernstein J, Demoly P, Dykewicz M, Fokkens W, Hellings P, et al.Phenotypes and endotypes of rinithis and their impact on management: a PRACTALL report. Allergy. 2015;70:474-94.
5. EMC [Internet]. Dymista 137 micrograms/50 micrograms per actuation nasal spray. Summary of product characteristics. 2019. Disponível em: www.medicines.org.uk/emc/product/9450/smpc. Acessado em junho de 2022.
6. Wallace DV, Dykewicz MS, Oppenheimer J, Portnoy JM, Lang DM. Pharmacologic treatment of seasonal allergic rhinitis: synopsis of guidance from the 2017 joint task force on practice parameters. Ann Intern Med. 2017;167(12):876-81.
7. Dykewicz MS, Wallace DV, Baroody F, Bernstein J, Craig T, Finegold I, et al. Treatment of seasonal allergic rhinitis: an evidence-based focused 2017 guideline update. Ann Allergy Asthma Immunol. 2017;119(6):489-511.
8. Meltzer E, Ratner P, Bachert C, Carr W, Berger W, Canonica G, et al. Clinically relevant effect of a new intranasal therapy (MP 29-02) in allergic rhinitis assessed by responder analysis. Int Arch Allergy Immunol. 2013;161:369-77.
9. Derendorf H, Meltzer E, Hermann R, Canonica G. Clinical development of an advanced intranasal delivery system of azelastine hydrochloride and fluticasone propionate. Drugs Today (Barc). 2014;50:15-31.
10. Pepys J. Skin testing. Br J Hosp Med. 1975;14:412.
11. Meltzer E, Ratner P, Bachert C, Carr W, Berger W, Canonica G, et al. Clinically relevant effect of a new intranasal therapy (MP 29-02) in allergic rhinitis assessed by responder analysis. Int Arch Allergy Immunol. 2013;161:369-77.
12. Fernandes PH, Matsumoto F, Solé D, Wandalsen GF.Translation into Portuguese and validation of the Rhinitis Control Assessment Test (RCAT) questionnaire. Braz J Otorhinolaryngol. 2016;333:1-6.
13. Demoly P, Bousquet PJ, Mesbah K, Bousquet J, Devillier P. Visual analogue scale in patients treated for allergic rhinitis:an observational prospective study in primary care: asthma and rhinitis. Clin Exp Allergy. 2013;43:881-8.
14. Nathan RA, Eccles R, Howarth PH, Steinsvåg SK, Togias A.Objective monitoring of nasal patency and nasal physiology in rhinitis.J Allergy Clin Immunol. 2005;115(3 Suppl 1):S442-59.
15. Meltzer E, Wallace D, Dykewicz M, Shneyer L. Minimal Clinically Important Difference (MCID) in Allergic Rhinitis: Agency for Healthcare Research and Quality or Anchor-Based Thresholds? J Allergy Clin Immunol Pract. 2016;4:682-8.
16. Barnes M, Vaidyanathan S, Williamson P, Lipworth B.The minimal clinically important difference in allergic rhinitis. Clin Exp Allergy. 2010;40:242-50.
17. Kaulsay R, Nguyen DT, Kuhl HC. Real-life effectiveness of MP-AzeFlu in Irish patients with persistent allergic rhinitis, assessed by visual analogue scale and endoscopy. Immun Inflamm Dis. 2018;6(4):456-64.
18. Hampel FC, Ratner PH, Van Bavel J, Amar NJ, Daftary P, Wheeler W, et al. Double blind, placebo-controlled study of azelastine and fluticasone in a single nasal spray delivery device. Ann Allergy Asthma Immunol. 2010;105(2):168-73.
19. Carr W, Bernstein J, Lieberman P, Meltzer E, Bachert C, Price D, et al. A novel intranasal therapy of azelastine with fluticasone for the treatment of allergic rhinitis. J Allergy Clin Immunol. 2012;129(5):1282-9.
20. Price D, Shah S, Bhatia S, Bachert C, Berger W, Bousquet J, et al. A new therapy (MP29-02) is effective for the long-term treatment of chronic rhinitis. J Investig Allergol Clin Immunol. 2013;23(7):495-503.
21. Berger WE, Shah S, Lieberman P, Hadley J, Price D, Munzel U, et al. Long-term, randomized safety study of MP29-02 (a novel intranasal formulation of azelastine hydrochloride and fluticasone propionate in an advanced delivery system) in subjects with chronic rhinitis. J Allergy Clin Immunol Pract. 2014;2(2):179-85.
22. Klimek L, Bachert C, Mosges R, Munzel U, Price D, Virchow JC, et al. Effectiveness of MP29-02 for the treatment of allergic rhinitis in real-life: results from a noninterventional study. Allergy Asthma Proc. 2015;36(1):40-7.
23. Berger W, Bousquet J, Fox AT, Just J, Muraro A, Nieto A, et al. MP-AzeFlu is more effective than fluticasone propionate for the treatment of allergic rhinitis in children. Allergy. 2016; 71(8):1219-22.
24. Berger W, Meltzer EO, Amar N, Fox AT, Just J, Muraro A, et al. Efficacy of MP-AzeFlu in children with seasonal allergic rhinitis: importance of paediatric symptom assessment. Pediatr Allergy Immunol. 2016;27(2):126-33.
25. Klimek L, Bachert C, Stjarne P, Dollner R, Larsen P, Haahr P, et al.MP-AzeFlu provides rapid and effective allergic rhinitis control in real life: a pan-European study. Allergy Asthma Proc. 2016;37(5):376-86.
26. Berger W, Sher E, Gawchik S, Fineman S. Safety of a novel intranasal formulation of azelastine hydrochloride and fluticasone propionate in children: a randomized clinical trial. Allergy Asthma Proc. 2018;39(2):110-6.
27. Patel P, Salapatek AM, Tantry SK.Effect of olopatadine-mometasone combination nasal spray on seasonal allergic rhinitis symptoms in an environmental exposure chamber study. Ann Allergy Asthma Immunol. 2019;122(2):160-6.
28. Debbaneh PM, Bareiss AK, Wise SK, McCoul ED. Intranasal azelastine and fluticasone as combination therapy for allergic rhinitis: systematic review and meta-analysis. Otolaryngol Head Neck Surg. 2019;161(3):412-8.
29. Klimek L, Berger WE, Bousquet J, Smith P, Sole D, Scadding G, et al. MP-AzeFlu in Moderate-to-Severe Allergic Rhinitis: A Literature Review. Int Arch Allergy Immunol. 2021;182:1026-35.
30. Neffen H, Mello J Jr, Sole D, Naspitz C, Dodero A, Garza H, et al. Nasal allergies in the Latin American population: results from the Allergies in Latin America survey. Allergy Asthma Proc. 2010;31(Suppl 1):S9-27.
31. Seresirikachorn K, Chitsuhipakorn W, Kanjanawasee D, Khattiyawittyakun L, Snidvongs K.Effects of anti-histamine addition to intranasal corticosteroid for allergic rhiniits: a systematic and meta-analysis. Int Forum Allergy Rhinol. 2018;8(10):1083-92.
32. Maltenfort MG. The minimally important clinical difference. Clin Spine Surg. 2016;29(9):383.
33. Embry TW, Piccirillo JF. Minimal clinically important difference reporting in randomized clinical trials. JAMA Otolaryngol Head Neck Surg. 2020;146(9):862-3.