Número Atual: Outubro-Dezembro 2022 - Volume 6 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Marcelo Vivolo Aun
- Rosana Câmara Agondi
- Diogo Costa Lacerda
- Ullissis Pádua Menezes
- Maria Inês Perelló Lopes Ferreira
- Adriana Teixeira Rodrigues
- Ana Carolina D'Onofrio-Silva
- Tânia Maria Gonçalves Gomes
- Luiz Alexandre Ribeiro da-Rocha
- Denise Neiva Santos de Aquino
- Fernanda Casares Marcelino
- Gladys Queiroz
- Maria Fernanda Malaman
- Inês Cristina Camelo-Nunes
- Mara Morelo Rocha Felix
ARTIGO ESPECIAL
Atualização em reações de hipersensibilidade aos anti-inflamatórios não esteroidais - Parte 2: manifestações clínicas, fenótipos, diagnóstico e manejo
Update on hypersensitivity reactions to nonsteroidal anti-inflammatory drugs - Part 2: clinical features, phenotypes, diagnosis, and management
Marcelo Vivolo Aun1,2; Rosana Câmara Agondi2; Diogo Costa Lacerda2; Ullissis Pádua Menezes3; Maria Inês Perelló Lopes Ferreira4; Adriana Teixeira Rodrigues5; Ana Carolina D'Onofrio-Silva2; Tânia Maria Gonçalves Gomes6; Luiz Alexandre Ribeiro da-Rocha7; Denise Neiva Santos de Aquino8; Fernanda Casares Marcelino9; Gladys Queiroz7; Maria Fernanda Malaman10; Inês Cristina Camelo-Nunes8; Mara Morelo Rocha Felix11,12,13
DOI: 10.5935/2526-5393.20220054
1. Faculdade Israelita de Ciências da Saúde Albert Einstein, Hospital Israelita Albert Einstein - São Paulo, SP, Brasil
2. Universidade de São Paulo (FMUSP), Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
3. Faculdade de Medicina de Ribeirão Preto (FMUSP - Ribeirão Preto), Serviço de Alergia e Imunologia Clínica e Pediátrica - Ribeirão Preto, SP, Brasil
4. Universidade do Estado do Rio de Janeiro (UERJ), Serviço de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
5. Hospital do Servidor Público do Estado de São Paulo (IAMSPE), Serviço de Alergia e Imunologia - São Paulo, SP, Brasil
6. Hospital Central do Exército (HCE), Ambulatório de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
7. Universidade Federal de Pernambuco (UFPE), Centro de Pesquisas em Alergia e Imunologia do Hospital das Clínicas - Recife, PE, Brasil
8. Universidade Federal de São Paulo (UNIFESP-EPM), Disciplina de Alergia, Imunologia Clínica e Reumatologia - Departamento de Pediatria - São Paulo, SP, Brasil
9. Hospital Regional da Asa Norte (HRAN), Serviço de Alergia e Imunologia - Brasília, DF, Brasil
10. Universidade Tiradentes, Faculdade de Medicina - Aracaju, SE, Brasil
11. Hospital Federal dos Servidores do Estado (HFSE), Setor de Alergia e Imunologia Pediátrica - Rio de Janeiro, RJ, Brasil
12. Faculdade Souza Marques, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
13. Universidade Federal do Estado do Rio de Janeiro (UNIRIO), Departamento de Medicina Geral - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Marcelo Vivolo Aun
E-mail: marcelovivoloaun@gmail.com
Submetido em: 27/10/2022
Aceito em: 04/11/2022
RESUMO
Os anti-inflamatórios não esteroidais (AINE) são os fármacos mais frequentemente associados a reações de hipersensibilidade (RH) na prática clínica. Na parte 2 dessa atualização sobre as RH aos AINE, discutiremos os aspectos clínicos dessas reações, com foco nos sinais e sintomas, como diferenciar os fenótipos clínicos, fazer a orientação desses pacientes e quando indicar procedimentos complementares, como testes cutâneos, de provocação e dessensibilização.
Descritores: Anti-inflamatórios não esteroidais, hipersensibilidade a drogas, fenótipo.
INTRODUÇÃO
Na parte 1 desta revisão, discutimos a farmacologia dos anti-inflamatórios não esteroidais (AINE), incluindo o papel fisiopatológico da inibição das enzimas ciclo-oxigenase (COX) 1 e 2 na gênese de boa parte das reações de hipersensibilidade (RH), aspectos genéticos e epidemiológicos dessas reações e os mecanismos envolvidos na ocorrência das reações, sejam elas alérgicas (tipo I e IV de Gell e Coombs) ou não alérgicas1. Na presente parte 2, abordaremos o quadro clínico de cada um dos fenótipos clássicos de RH aos AINE, outros fenótipos possíveis e menos frequentes, as particularidades na população pediátrica e, principalmente, o manejo destes quadros, que inclui desde o diagnóstico até o tratamento, seja ele pela orientação adequada de restrição ou substituição dos fármacos envolvidos, seja pela dessensibilização, quando indicada.
MANIFESTAÇÕES CLÍNICAS E FENÓTIPOS
Clinicamente, as reações de hipersensibilidade (RH) aos AINE podem ser divididas pelo tempo de instalação em agudas, quando ocorrem em até 24 horas após a exposição ao fármaco (mais comumente ocorrem de forma imediata, em menos de 60 minutos após a administração) e tardias, quando ocorrem após essas 24 horas2. Porém, mais do que apenas a questão do tempo entre a exposição e a reação, o padrão de manifestação clínica tem fundamental importância na definição do fenótipo.
DOENÇA RESPIRATÓRIA EXACERBADA POR AINE (DREA)
Em 1922, Widal e cols. publicaram o primeiro artigo descrevendo a associação entre hipersensibilidade à aspirina, asma e pólipos nasais, eles também conduziram a primeira provocação com aspirina seguida de dessensibilização. Porém, esta síndrome foi reconhecida apenas nos anos de 1960 quando Samter publicou dois artigos com uma condição que ele denominou de tríade de Samter, e incluía asma, pólipos nasais e reações à aspirina. Muitos outros termos foram utilizados para esta doença respiratória: asma induzida por aspirina, hipersensibilidade à aspirina, intolerância à aspirina, dentre outros3. A partir de 2001, Stevenson e cols. cunharam o termo doença respiratória exacerbada por aspirina (DREA), incluindo não apenas a asma, mas também as vias aéreas superiores, além de valorizar a frequente associação com doença respiratória subjacente4.
Todos esses termos se referem à mesma condição de inflamação intratável de vias aéreas superiores e inferiores, além disso, muitos estudos, posteriormente, demonstraram a importância da inflamação eosinofílica no trato respiratório desta tríade. A exposição à aspirina não inicia ou mesmo perpetua a doença inflamatória subjacente, no entanto, uma vez que a doença está em curso, a aspirina e os AINE induzem a liberação ou síntese de mediadores críticos, que então causam todas as manifestações clínicas das reações respiratórias características3.
Clinicamente, a DREA se caracteriza pela tríade de rinossinusite crônica (RSC) com pólipos nasais (RSCcPN), asma e hipersensibilidade à aspirina ou outros AINE5,6. Assim, atualmente a sigla "DREA" deve ser descrita por extenso como "doença respiratória exacerbada por AINE", e não apenas aspirina.
Vários estudos na literatura mostraram que outras manifestações clínicas são frequentes na DREA, como a anosmia acentuada, atopia, intolerância ao álcool e menor intervalo entre as polipectomias6,7.
As características clínicas da DREA geralmente não estão presentes imediatamente no início da doença, na maioria das vezes elas se desenvolvem seguindo um padrão. A primeira manifestação clínica que geralmente aparece em pacientes com DREA é a rinite, que é referida como obstrução nasal, secreção nasal, anosmia/hiposmia e espirros. A anosmia/ hiposmia é frequente (89%) e intensa. A rinite crônica evolui para sinusite eosinofílica hiperplásica crônica, achado que pode ser observado em até 99% dos pacientes como uma hiperdensidade na tomografia computadorizada de seios da face. A primeira manifestação de asma aparece em média 2 anos após o início da rinite, e a hipersensibilidade à aspirina ou a outro AINE inibidor da COX-1 tende a aparecer 4 anos depois. No entanto, outros estudos demonstraram que a hipersensibilidade à aspirina/AINE pode aparecer a qualquer momento no curso da doença8.
A frequência de sintomas respiratórios induzidos pela ingestão de bebida alcoólica nos pacientes com DREA é elevada, os sintomas de vias aéreas superiores (rinorreia, obstrução nasal) são referidos por até 75% dos pacientes, e os sintomas de vias aéreas inferiores (sibilância e dispneia), por 51%9.
Embora a DREA tenha uma apresentação característica, incluindo a presença de sintomas respiratórios minutos a poucas horas após uso de qualquer AINE inibidor de COX-1 (reação aguda), a heterogeneidade existe nos pacientes com DREA3. Bochenek e cols. classificaram os pacientes com DREA em 4 subtipos: classe 1: asma moderada, RSC grave e eosinofilia periférica; classe 2: RSC leve, asma leve relativamente bem controlada; classe 3: asma grave não controlada, exacerbações graves e obstrução brônquica grave; e classe 4: asma não controlada com exacerbações frequentes e graves em mulheres, função pulmonar não comprometida e obesidade10.
Outro estudo classificou a DREA através de uma estratégia analítica, a chamada análise latente de classe, em três subfenótipos, considerando-se as vias inflamatórias e as manifestações clínicas da asma. Os subfenótipos incluíram 16 variáveis: características clínicas como gênero, índice de massa corpórea, idade de início da asma, história de exacerbação da asma, controle da asma e gravidade da asma, uso de corticoide inalado e/ou sistêmico, VEF1, eosinófilos séricos, IgE sérica total, atopia (através de teste cutâneo); e características inflamatórias no escarro induzido (EI), como PgD2, PgE2, LTE4, dentre outros.
- Classe 1: asma leve a moderada, sem comprometimento pulmonar, EI com número baixo de eosinófilos e outros mediadores;
- Classe 2: asma grave não controlada, com obstrução brônquica, exacerbações frequentes, inflamação eosinofílica acentuada e aumento de outros mediadores inflamatórios no EI;
- Classe 3: asma leve a moderada e relativamente bem controlada, inflamação eosinofílica e aumento de mediadores inflamatórios pró e anti-inflamatórios no EI.
Neste estudo, os níveis de LTE4 se correlacionaram com o número de eosinófilos periféricos11.
DOENÇA CUTÂNEA EXACERBADA POR AINE (DCEA)
A doença cutânea exacerbada por AINE (DCEA) é caracterizada por pacientes que apresentam urticária crônica espontânea (UCE) com ou sem angioedema como doença de base, nos quais ocorre piora aguda (minutos a poucas horas) dos sintomas cutâneos após a ingestão de um AINE, geralmente inibidores fortes da COX-112.
Estudos apontam a presença deste fenótipo em 12-30% dos pacientes portadores de UCE. Como a UCE é uma doença autolimitada, com duração variável de meses a anos, a DCEA pode desaparecer com a resolução da UCE. No entanto, existem diferenças fenotípicas quando comparados aos pacientes com UCE tolerantes a AINE. A tolerância aos AINE na presença de UCE demonstrou ser fator de bom prognóstico, pois estes pacientes apresentaram uma duração mais curta da UCE e com menor frequência de angioedema associado13. Outros estudos demonstraram que os AINE que fazem inibição seletiva da COX-2 podem ser usados nestes pacientes como opção terapêutica14,15.
URTICÁRIA/ANGIOEDEMA INDUZIDOS POR MÚLTIPLOS AINE (UAIMA)
Esse é o fenótipo mais frequente de RH aos AINE. Os pacientes apresentam urticária ou angioedema agudos (minutos a poucas horas) induzidos por AINE e que não possuem UCE como doença de base. Estes sintomas se manifestam apenas após a ingestão de um AINE, em geral inibidor forte de COX-1. Os pacientes podem relatar urticária isolada, angioedema ou a combinação de ambos. Em torno de 60% de todos os pacientes com UAIMA têm doença atópica concomitante16. Em um estudo realizado na Espanha, esses pacientes foram acompanhados por 12 anos e foi observado que 62% desenvolveram tolerância aos AINE após cinco anos do início da doença17. Por outro lado, outro estudo demonstrou que 33% destes pacientes desenvolveram UCE ao longo do acompanhamento18, achado esse que não foi confirmado anos depois em uma coorte espanhola17. Dessa forma, permanece controversa a teoria de que a UAIMA possa ser um fator de risco para desenvolvimento de UCE.
URTICÁRIA / ANGIOEDEMA / ANAFILAXIA INDUZIDOS POR ÚNICO AINE (UAAIUA)
A UAAIUA é biologicamente e fenotipicamente distinta das outras síndromes de hipersensibilidade aos AINE, pois os pacientes reagem agudamente a apenas uma classe de AINE, sendo a mais citada a das pirazolonas (que inclui a dipirona), e toleram os AINE inibidores fortes de COX-1 de classes distintas (aspirina, diclofenaco ou ibuprofeno, por exemplo)2,19.
Os sintomas são desencadeados pelo mecanismo de hipersensibilidade do tipo I de Gell e Combs (IgE-mediado) e suas reações são geralmente mais graves do que nas síndromes anteriores20. Como as clássicas reações mediadas pela IgE, ocorrem de forma imediata, em geral dentro de menos de uma hora após a exposição. Há relatos isolados de casos de UAAIUA associada a outras classes além das pirazolonas, como derivados do ácido propiônico (ibuprofeno ou cetoprofeno), mas ainda não se demonstrou a ocorrência de IgE específica para quaisquer outras classes de AINE, apenas aquela que tem a dipirona como exemplo principal disponível no mercado.
REAÇÕES TARDIAS INDUZIDAS POR ÚNICO AINE (RTIUA)
RTIUA possuem sintomas desencadeados por mecanismo do tipo IV (mediadas por células T). Os sintomas geralmente ocorrem dentro de 24-48 horas após a ingestão de um AINE. As reações podem variar desde sintomas leves, como exantema maculopapular e erupção fixa à droga (EFD) localizada, até síndromes graves, como síndrome de Stevens-Johnson (SSJ), necrólise epidérmica tóxica (NET) e EFD bolhosa generalizada (EFDBG)2,21.
A diferenciação morfológica das lesões cutâneas é fundamental para excluir os fenótipos acima. Achados dermatológicos como ocorrência de duração de cada uma das lesões acima de 24 horas, aparecimento de lesão residual, associação de vesículas, descamação ou exsudação permitem excluir que a manifestação cutânea tenha sido urticária. A partir daí, caso tenha sido induzida por um AINE, é possível confirmar RTIUA. O próximo passo seria definir qual das outras dermatoses tardias para definir o caso. A diretriz europeia de manifestações cutâneas das RH a medicamentos traz um algoritmo simples e objetivo para diagnosticar as chamadas "farmacodermias" e pode ser utilizado nas RH aos AINE também22.
OUTROS FENÓTIPOS
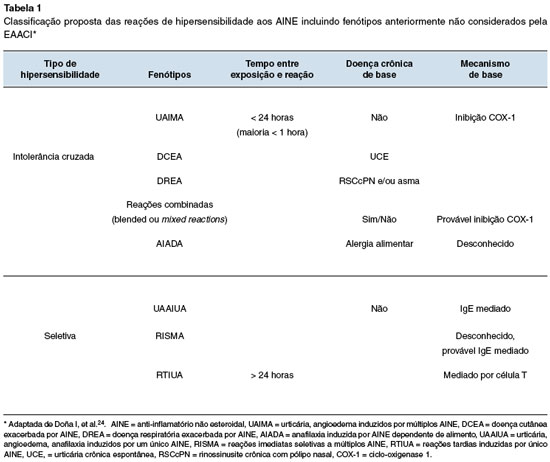
A classificação das RH aos AINE nesses cinco fenótipos clínicos (DREA, DCEA, UAIMA, UAAIUA e RTIUA), proposta há cerca de 10 anos pela EAACI (European Academy of Allergy Clinical Immunology), auxiliou muito no manejo desses casos na prática clínica2,23,24. Dentre elas, as RH não alérgicas, com intolerância cruzada entre as classes de inibidores de COX-1 (DREA, DCEA e UAIMA), são as mais frequentes em todas as faixas etárias. Por outro lado, o conhecimento incompleto dos mecanismos básicos das RH aos AINE dificulta a definição dos fenótipos e endótipos, e ressalta a necessidade de identificação de novos biomarcadores para aprimorar o diagnóstico e a classificação destas reações25.
Nem todos os pacientes com RH aos AINE podem ser classificados em um desses cinco fenótipos sugeridos pela EAACI. Alguns outros fenótipos foram descritos: reações mistas (ou combinadas); anafilaxia induzida por AINE dependente de alimentos e as reações imediatas seletivas a múltiplos AINE.
Reações mistas ou combinadas (mixed ou blended reactions)
As reações não alérgicas cutâneas (UAIMA e DCEA) e respiratórias (DREA) podem ser combinadas e, simultaneamente, envolver sintomas cutâneos e respiratório, ou até mesmo acometer outros órgãos26. Alguns estudos indicam que as reações mistas são responsáveis por mais que 25% das reações com intolerância cruzada em adultos, e em relação a todos os fenótipos é o segundo mais frequente27. Os sintomas mais comuns das reações combinadas são urticária e angioedema associadas à rinite ou broncoespasmo, embora outros sintomas como edema laríngeo, hipotensão e sintomas gastrintestinais também tenham sido descritos. Como acometem simultaneamente dois órgãos ou sistemas em um curto intervalo de tempo, essas reações acabariam configurando anafilaxia, mas na classificação europeia, a anafilaxia envolveria apenas o fenótipo IgEmediado (UAAIUA). A maior casuística brasileira de anafilaxia induzida por medicamentos mostrou que os AINE eram a classe farmacológica mais envolvida nesse tipo de reação e essas pacientes eram, quase na totalidade, reatores não seletivos apresentando essas blended reactions 28.
Numa revisão do mesmo grupo brasileiro publicada alguns anos mais tarde, foi proposto que a anafilaxia fosse incluída na lista de manifestações clínicas das RH não imunológicas, notadamente na mais frequente, que é a UAIMA29. Com o aumento de casos de reações mistas sendo evidenciado em outras partes do mundo, é possível que haja mudança em futuras classificações da EAACI.
Hipersensibilidade ou Anafilaxia induzida por AINE dependente de alimentos (HIADA ou AIADA)
A ingesta de AINE tem sido associada à anafilaxia induzida por alimento, e tem exacerbado anafilaxia induzida por exercício dependente de alimentos (AIEDA). O diagnóstico é difícil por não se identificar um fator causal, mesmo com teste provocação negativo ao fármaco suspeito se o alimento não estiver presente. Foi descrito que o teste de ativação de basófilos (BAT) poderia ajudar no diagnóstico. Acredita-se que a fisiopatologia envolve o aumento da permeabilidade intestinal pelo AINE, aumentando a absorção alergênica30. Outra possibilidade é o efeito direto do fármaco potencializando a ativação e desgranulação de mastócitos e basófilos. A intensidade da reação IgE mediada está relacionada à classe do AINE, dose e potência da inibição da COX-1. Um estudo avaliou 328 pacientes com suspeita de reações imediatas aos AINE; 199 (60%) confirmaram hipersensibilidade através do TP, e a HIADA foi comprovada em 52 casos (16%) e destes, 44 indivíduos (84%) apresentaram sensibilidade positiva para a proteína transportadora de lipídeos (LTP) Pru p 3, através de testes cutâneos e ou dosagens de IgE específica. A World Allergy Organization (WAO) e a EAACI sugerem que a HIADA deve ser considerada e os testes para alergia alimentar precisam ser inclusos na avaliação diagnóstica de pacientes com RH aos AINE31.
Reações imediatas seletivas a múltiplos AINE (RISMA)
Alguns estudos mostraram que indivíduos podem desenvolver reações imediatas seletivas a múltiplos AINE, mas tolerarem o ácido acetil salicílico (AAS)32,33. Na faixa etária pediátrica também já se descreveu crianças com urticária e angioedema induzidos pelo ibuprofeno e paracetamol e com tolerância ao AAS34.
O grupo espanhol tem descrito esse fenótipo e sugerido que não se defina um paciente como UAIMA, que seria de reatores não seletivos, ou seja, com intolerância cruzada entre AINE de classes distintas, até que se confirme, ou não, a reatividade também ao AAS35. Porém, até por não ter ocorrido replicação desses estudos em outras populações e por não se conhecer os mecanismos envolvidos nesse fenômeno, deve-se ficar atento à possibilidade de pacientes reagirem a mais de uma classe e tolerarem outras, incluindo o AAS. É possível que haja outros pontos que influenciem, como cofatores, infecção sobreposta, dose do fármaco ou intervalo entre as doses, etc.
Os avanços nos conhecimentos dos mecanismos fisiopatológicos envolvidos nas RH aos AINE têm leva-do à recomendação de reavaliar a classificação atual, uma vez que não contempla esses "novos fenótipos". Outros fatores importantes ainda não totalmente conhecidos são o desenvolvimento de tolerância ao longo do tempo, o papel da atopia, a evolução dos diferentes fenótipos e o potencial de conversão ou troca de fenótipo num mesmo indivíduo36.
A Tabela 1 mostra uma nova proposta de classificação das reações de hipersensibilidade aos AINE, incluindo fenótipos previamente não considerados pela EAACI24.
INTOLERÂNCIA CRUZADA
A maioria dos AINE realizam uma inibição não seletiva da enzima COX-1. Eles interferem no metabolismo do AA levando ao bloqueio da síntese das PG e à regulação positiva da via dos LT que contribuem para várias apresentações de RH aos AINE, notadamente UAIMA, DREA, DCEA e as blended reactions24,37. Nesses fenótipos, é provável que o paciente apresente intolerância cruzada entre as diferentes classes de inibidores fortes da COX-1, como praticamente todos os derivados do ácido carboxílico (AAS, diclofenaco, ibuprofeno, cetorolaco, etc.), além das pirazolonas, ácido mefenâmico e alguns oxicans1. Porém, alguns dos inibidores preferenciais da COX-2, como nimesulida, paracetamol e meloxicam são tolerados pela maioria dos pacientes reatores não seletivos com os fenótipos supracitados.
Embora muitos pacientes já cheguem para sua avaliação tendo utilizado essas medicações após suas primeiras reações, particularmente urticária e angioedema, outros não conhecem sua tolerância a essas opções. Claramente que, em pacientes que já utilizaram um desses fármacos após uma primeira reação a outro inibidor de COX-1, a história pessoal de tolerância dele deve ser o principal fator a avaliar na hora de orientar o uso futuro dessas medicações. Por outro lado, poucos estudos avaliaram a tolerância à nimesulida e meloxicam em pacientes com intolerância não seletiva aos AINE. Aparentemente a tolerância ao meloxicam (92 a 96%) é um pouco superior à da nimesulida (86 a 90%) em pacientes com UAIMA ou DCEA38-40. Em um estudo italiano40 que avaliou pacientes com intolerância não seletiva a AAS e/ou outros AINE, quando submetidos ao TP com celecoxibe, rofecoxibe ou meloxicam, só se encontrou reatividade nos indivíduos com sintomas cutâneos. Dentre aqueles com sintomas respiratórios isolados (DREA), todos toleraram as três medicações40.
Já o paracetamol parece ser bem tolerado na dose de 500 mg em adultos ou equivalente em crianças (10 a 15 mg/kg de peso por dose). Num estudo turco, a taxa de reatividade aos 500 mg foi de apenas 5,8%38. Em crianças, um estudo não encontrou nenhuma paciente com reatividade ao paracetamol41. Contudo, essa intolerância aumenta de forma diretamente proporcional à dose, podendo chegar a 25% se a dose de paracetamol for de 900 mg42. Num estudo brasileiro, 116 pacientes com UAIMA ou DCEA e que referiam intolerância também ao paracetamol foram provocados de forma simples-cego placebo controlada com 500 mg da medicação e a reatividade foi confirmada apenas em 6,9%, todos sem maior gravidade, além de mais 3,4% de indivíduos que reagiram ao placebo42.
Com relação aos inibidores seletivos da COX-2, os chamados coxibes, a tolerância parece ser ainda maior. Em uma extensa revisão de literatura publicada em 2019, Lilly Li e Tanya Laidlaw compilaram as casuísticas publicadas até aquele momento e encontraram uma taxa de 3,3% de reatividade aos coxibes em pacientes com quaisquer RH aos AINE e salientaram que, dentre mais de 3.000 provocações com coxibes, apenas um relato de edema laríngeo foi reportado. Além disso, nenhuma reação grave, necessitando ida à emergência ou uso de adrenalina. Avaliando especificamente os pacientes com DREA, encontraram apenas 0,13% de positividade (1 TP positivo em 753 provocações)44.
É importante salientar que os coxibes já foram associados a aumento de risco cardiovascular, o que levou à saída de alguns do mercado45. No Brasil, permaneceram disponíveis etoricoxibe e celecoxibe para uso oral e o parecoxibe, para uso parenteral. Destacamos que os dois primeiros seguem no mercado nacional, mas com doses inferiores àquelas de quando foram lançados. O etoricoxibe está liberado numa dose máxima de 90 mg, 1 vez ao dia, e o celecoxibe para 200 mg, 2 vezes ao dia. Portanto, esses fármacos devem ser evitados em idosos e portadores de doença cardiovascular ou cerebrovascular.
PECULIARIDADES NA CRIANÇA
Os AINE e os betalactâmicos são as principais causas de RH a medicamentos na faixa etária pediátrica46,47. As reações cutâneas induzidas por agentes infecciosos, como vírus, constituem um importante fator confusional no contexto das reações adversas a fármacos em crianças e são menos prováveis de serem confirmadas do que em adultos48. Em um grande estudo retrospectivo europeu, multicêntrico, que incluiu quase 700 pacientes de cinco países, com história de RH a AINE, a frequência de TP positivos com o agente suspeito foi de 19%, permitindo desrotular a maioria dos pacientes49.
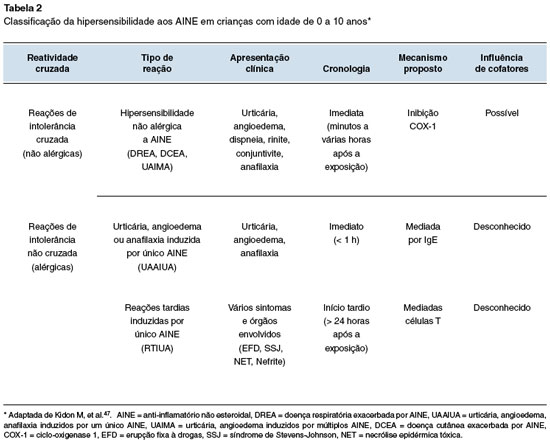
Classificação e mecanismos das reações de hipersensibilidade em crianças
Embora a vasta maioria dos pacientes pediátricos com RH aos AINE possam ser classificados fenotipicamente de forma similar aos adultos, uma parcela também não seria contemplada naqueles cinco fenótipos clássicos. Um estudo realizado por Cousin e cols.50 mostrou que 44% de 635 pacientes pediátricos com reações confirmadas de hipersensibilidade aos AINE não se enquadrava em nenhuma das categorias de classificação preconizadas pela ENDA2. Recentemente a ENDA propôs um consenso de classificação das RH aos AINE direcionada à população pediátrica, através de critérios distintos para crianças menores que 10 anos de idade e dos 10 anos até a adolescência, enfatizando as diferenças nestas duas faixas etárias47. Dados da literatura internacional sugerem que o fenótipo das chamadas reações mistas (cutâneas e respiratórias) é o mais frequente em crianças menores. Por outro lado, UCE é incomum nessa faixa etária e a DREA pode ser considerada rara. Assim, em crianças abaixo de 10 anos, a ENDA recomendou unificar a UAIMA, DCEA e DREA num único fenótipo, definido nessa publicação como "hipersensibilidade não alérgica"47. A classificação proposta pela ENDA para as RH aos AINE em menores de 10 anos está apresentada na Tabela 2.
Essa proposta de uma nova classificação foi baseada em estudos que identificaram que a maior parte das reações em crianças menores é de caráter não imunológico (intolerantes cruzados) com significante influência de cofatores. Já em crianças maiores e adolescentes o padrão clínico é mais semelhante aos adultos. Modificações na classificação das reações aos AINE em crianças permitirão um manejo mais adequado destas reações, porém novas classificações poderão ser necessárias em face aos novos conhecimentos relacionados aos mecanismos fisiopatológicos e à história natural da doença.
Diagnóstico das reações de hipersensibilidade aos AINE em crianças
O diagnóstico das RH aos AINE em crianças depende da análise de uma história clínica detalhada, com atenção aos novos fenótipos e o provável mecanismo envolvido na reação. No contexto dos conhecimentos atuais, os testes cutâneos e testes in vitro (laboratoriais) apresentam valores limitados e pouca aplicabilidade pela ausência de padronizações e pela escassez de estudos relacionados aos valores preditivos, principalmente na faixa etária pediátrica. O TP constitui o padrão ouro no diagnóstico e deve seguir as dosagens relacionadas à faixa pediátrica e o contexto da estratificação de riscos para sua utilização.
Os testes cutâneos, como punctura (prick test) e intradérmico (ID) podem ser utilizados nas reações imediatas (urticária, angioedema e anafilaxia) e quando há suspeita clínica de serem seletivas à dipirona47. Embora haja descrição de concentração não irritativa para a realização de testes cutâneos de leitura imediata com paracetamol, como não há apresentação parenteral no Brasil, sua realização não deve ser realizada, particularmente no teste ID. Em relação às RH tardias seletivas, não há estudos suficientes na faixa etária pediátrica, além da dificuldade técnica de realização dos testes cutâneos de leitura tardia em crianças menores.
Os testes in vitro têm pouca aplicabilidade. As alternativas, nas reações imediatas, seriam dosagem sérica de IgE específica e teste de ativação de basófilos51,52, entretanto, ambos não têm validação e acurácia definidas, particularmente em crianças, portanto não devem ser realizados fora de centros de pesquisa.
O TP pode ser realizado para confirmar a hipersensibilidade aos AINE, para definir o fenótipo clínico ou para avaliar a tolerância a um outro AINE (exemplo: inibidor seletivo ou preferencial de COX-2). Só deve ser indicado após correta estratificação de risco, podendo ser necessário mais de um procedimento na mesma criança53,54. O procedimento geralmente é aberto ou simples-cego placebo-controlado, devendo ser realizado em ambiente adequado para atendimento de possíveis reações graves e por especialista em alergia habilitado. Estudos preconizam doses iniciais entre 10 e 25% da dose terapêutica ajustada ao peso e idade da criança, entretanto doses menores poderão ser necessárias inicialmente se a história da reação for grave. As doses subsequentes poderão ser administradas com intervalos variando entre 30 a 60 minutos ou mais, dependendo do contexto clínico da reação suspeita55. O período de observação após completar a dose total do fármaco deverá ser entre 2 a 4 horas, ou até a estabilização clínica do paciente em caso de reações ao teste.
Em alguns casos, poderão ser necessárias doses adicionais após este período de observação e, nesses casos, poderão ser realizados no domicílio (TP estendido). Informações por escrito deverão ser fornecidas ao paciente e aos familiares da criança a respeito dos fármacos a serem evitados, os fármacos alternativos seguros com as respectivas doses e formulações.
O paracetamol em baixas doses mostrou ser bem tolerado em crianças como antitérmico56. Inibidores seletivos da COX-2, apesar de seguros para adolescentes, ainda não foram aprovados para crianças menores. Estudos em crianças com intolerância cruzada aos AINE, os inibidores preferenciais da COX-2 mostraram ser eficazes e seguros em mais de 80% dos pacientes57. Os inibidores seletivos da COX-2 (coxibes) só são aprovados para uso em maiores de 18 anos no Brasil, porém vários estudos em outros países mostram segurança desses fármacos, o que levou a serem sugeridas como opções, mesmo que off-label, nas diretrizes europeias47.
A história natural da hipersensibilidade aos AINE ainda não é bem esclarecida e, na faixa etária pediátrica, há fatores confusionais adicionais, tais como: a utilização de outros fármacos concomitantes aos AINE, dose-dependência e coexistência de infecções são considerados relevantes. O menor conhecimento sobre o metabolismo dos AINE em crianças, a escassez de estudos quanto à utilização dos testes cutâneos nas reações seletivas tardias, a dificuldade técnica, a falta de padronização das concentrações não irritativas dos AINE e a falta de apresentação parenteral para a maioria dos fármacos também dificulta o manejo destes pacientes. Neste contexto, o TP torna-se fundamental na confirmação do diagnóstico das RH aos AINE em crianças, assim como na escolha de um fármaco alternativo. Alguns autores relatam que o total de TP necessário no manejo de crianças com suspeita de RH é menor quando elas são testadas inicialmente com o AAS, independente da história da reação58,59.
RECOMENDAÇÕES PARA O DIAGNÓSTICO E MANEJO DAS RH AOS AINE
A estratégia de investigação das RH aos AINE envolve inicialmente uma história clínica detalhada do quadro apresentado, tempo entre exposição e aparecimento dos sintomas, número de reações e tratamento das mesmas. Quando necessários, os testes cutâneos de punctura e ID de leitura imediata são úteis apenas para RH mediadas por IgE. O teste cutâneo de leitura tardia é utilizado para reações tardias de hipersensibilidade aos AINE. Para os fenótipos não alérgicos de manifestação (UAIMA, DCEA e DREA), dependentes da via do AA, não há teste cutâneo ou in vitro disponíveis para o diagnóstico2,23.
O TP com o medicamento suspeito ainda é o padrão ouro para o diagnóstico, principalmente quando a história clínica é duvidosa, uma vez que não existem na literatura outros testes padronizados para o auxílio. O TP pode ser usado para confirmar alguns diagnósticos ou para definir se existe um padrão de reatividade cruzada ou de seletividade da reação ao medicamento investigado2,23. Na prática clínica, a dúvida mais frequente em geral envolve a diferenciação entre os pacientes com urticária, angioedema ou anafilaxia induzidas por AINE, em especial quanto a serem reatores seletivos ou não seletivos.
Quando o paciente ainda não apresentou reação com AINE de classes diferentes, a anamnese não permite definir o fenótipo clínico. Nesses casos, a recomendação internacional tem sido a de realizar um TP com AAS, em dose anti-inflamatória (500 a 1.000 mg). Pacientes com TP positivo deverão ser, então, considerados como portadores de UAIMA e devem evitar todos os inibidores de COX-1. Já os pacientes com TP negativo com AAS podem ser reatores seletivos ou mesmo não serem hipersensíveis, e a confirmação poderia exigir um teste cutâneo de leitura imediata ou mesmo TP com o fármaco suspeito47,60.
Embora os AINE sejam uma das causas mais frequentes de busca de consultas com alergistas por história de RH a medicamentos no Brasil e na América Latina, até o momento não há dados robustos na literatura sobre a frequência de cada fenótipo clínico dentre os pacientes com reações aos AINE, tampouco sobre a segurança e efetividade desse protocolo de investigação na nossa população.
Dessa forma, o desenho de um algoritmo diagnóstico das RH aos AINE depende de uma fenotipagem inicial baseada nos sintomas referidos pelo paciente quando das reações (urticária, angioedema, outras manifestações cutâneas sugestivas de reação tardia, manifestações respiratórias ou mistas), tempo entre exposição ao AINE e aparecimento do quadro e doença de base (exemplos: UCE ou asma e RSCcPN). Com base apenas nesses dados, a grande maioria dos pacientes vai ser enquadrada num dos cinco fenótipos clássicos (UAIMA, DCEA, DREA, UAAIUA e RTUIA) ou em algum dos novos fenótipos citados anteriormente (reações mistas, ou blended reactions, AIADA e RISMA), e definido como provável intolerante cruzado ou reator seletivo. A partir desse momento, a investigação e o manejo adequado deverão ser direcionados de acordo com esse fenótipo clínico.
Manejo da RTIUA
Pacientes com manifestações cutâneas distintas de urticária e angioedema, tais quais exantema, dermatite eczematosa, erupção fixa, etc., cuja manifestação é caracteristicamente tardia, devem ser diagnosticados como RTIUA, e podem, em casos de dúvida diagnóstica, se beneficiar de um patch test (teste de contato) clássico, com leituras de 48 e 96h, com a medicação suspeita, diluída a 10% em vaselina petrolada. Em casos de dúvida, uma leitura final de 7 dias pode ser necessária. Se a dúvida persistir, um TP pode ser realizado com um AINE de classe farmacológica diferente, apenas para confirmar a tolerância, ou com o próprio AINE suspeito, para confirmar ou excluir a RH prévia. Claramente esse TP estará contraindicado com o agente suspeito ou com outro da mesma classe em caso de reação tardia grave (órgãoespecífica, DRESS, SSJ, NET, PEGA).
Pacientes submetidos a TP com o AINE suspeito e cujo teste for negativo, deverão ser considerados tolerantes a todos, com o AINE sendo considerado não relacionado ao quadro apresentado previamente. Porém, pacientes com RTIUA confirmada por teste de contato ou TP positivo poderão ser liberados a usar AINE de classe diferente sem necessidade de investigação adicional.
Manejo da DREA e reações mistas
Em caso de sintomas respiratórios isolados (broncoespasmo, edema laríngeo, sintomas nasossinusais agudos), ainda mais em pacientes com asma ou RSCcPN, ou em pacientes com clínica sugestiva de anafilaxia (reação mista) não recomendamos TP para diagnóstico (com AAS em dose anti-inflamatória) fora de centros de referência e de pesquisa pelo risco alto de reações graves e de difícil tratamento61.
Nesses casos, o manejo deve seguir os passos dos casos de UCE ou UAIMA, com foco na liberação de AINE alternativos, como os inibidores preferenciais (paracetamol, nimesulida, meloxicam) de COX-2 ou seletivos de COX-2 (etoricoxibe, celecoxibe), conforme mostrado na Figura 1. Para DREA, os coxibes podem ser liberados sem TP desde que o paciente esteja com a doença de base controlada, preferencialmente com função pulmonar acima de 70% do previsto ou do melhor do paciente.
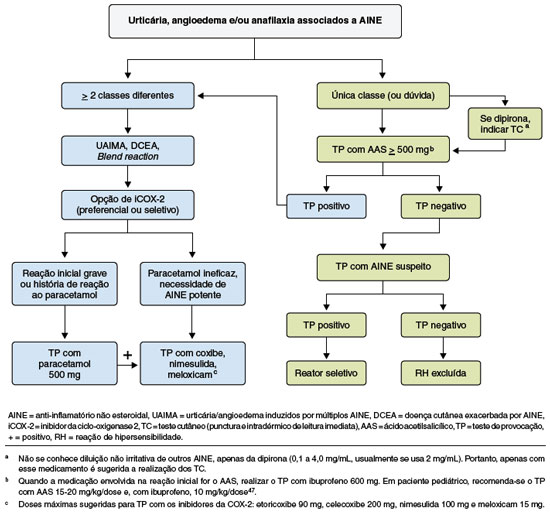
Figura 1
Algoritmo sugerido de abordagem do paciente com urticária, angioedema e/ou anafilaxia associados ao uso de AINE. Paciente com duas ou mais reações associadas a AINE de classes farmacológicas distintas devem ser abordados como reatores não seletivos, ou seja, por mecanismo não imunológico (inibição da ciclo-oxigenase 1), conforme o bloco da esquerda (azul). Contudo, quando há dúvida diagnóstica ou o paciente teve reação a apenas um AINE ou a mais de um AINE, porém de uma única classe química, inicia-se pelo bloco da direita (verde)
Manejo da DCEA
Em pacientes com UCE que possivelmente exacerbam com o uso de AINE, a confirmação da DCEA e, portanto, da intolerância aos AINE por mecanismo não imunológico, só pode ser feita após um TP positivo com AAS 500 mg ou dose superior. Se esse TP for negativo, pode-se considerar o paciente tolerante aos AINE e não é necessária recomendação adicional de exclusão ou restrição. Já naqueles com TP positivo ou naqueles com história inequívoca de exacerbação com AINE, pode-se liberar o uso de paracetamol 500 mg (ou dose equivalente para idade) como opção de analgésico e antitérmico, e recomendamos que demais AINE preferenciais ou seletivos de COX-2 sejam liberados se a tolerância for comprovada com TP negativo (Figura 1). Logicamente que em pacientes que referem também serem reatores ao paracetamol na dose de 500 mg ou em dose desconhecida, sugerimos realizar o TP para confirmar, ou não, a referida reatividade.
Manejo da UAIMA e UAAIUA
Em pacientes que claramente, pela história clínica, reagem (urticária, angioedema ou mesmo anafilaxia) com mais de um inibidor de COX-1 de classes diferentes, embora a literatura internacional recomende a confirmação da referida intolerância aos AINE com um TP com AAS, não recomendamos esse procedimento como rotina na prática clínica fora dos grandes centros de referência. O médico está autorizado a recomendar a exclusão de todos os inibidores fortes de COX-1 e liberar o uso de paracetamol 500 mg (ou dose equivalente para idade) como opção de analgésico e antitérmico. Assim como na DCEA, sugerimos que os demais AINE preferenciais ou seletivos de COX-2 sejam liberados se a tolerância for comprovada com TP negativo (Figura 1). Da mesma maneira, pacientes que referem também serem reatores ao paracetamol na dose de 500 mg ou em dose desconhecida, sugerimos realizar o TP para confirmar, ou não, a referida reatividade. Além disso, pacientes de mais alto risco, com história de reação inicial grave (anafilaxia), mesmo o paracetamol só deve ser liberado após um TP negativo.
No entanto, em pacientes que apresentam uma primeira reação a um AINE ou mais de uma reação, mas todas com o mesmo AINE (exemplo: dipirona) ou com mais de um AINE, mas todos da mesma classe (exemplo: ibuprofeno e cetoprofeno), pode se tratar de um caso de reator seletivo (UAAIUA). Nestes casos, os testes cutâneos de leitura imediata (punctura e ID) podem ser utilizados, caso o fármaco envolvido seja a dipirona, mas a definição do fenótipo só será concluída após uma provocação com AAS > 500 mg.Se o paciente tolerar o AAS nessas doses, poderá ser considerado um reator seletivo (UAAIUA) e será liberado a usar AINE de classes diferentes daquele causador das reações iniciais. Nesses casos que a dipirona está envolvida e o teste cutâneo é positivo, o mecanismo IgE-mediado estará confirmado. Entretanto, em caso de TP positivo para AAS, confirmar-se-á uma intolerância cruzada e valerá a recomendação citada acima de se priorizar AINE alternativos, inibidores preferenciais ou seletivos da COX-2. Esse mesmo fluxo deve ser utilizado em pacientes com história duvidosa, em que não fica claro o envolvimento do AINE, ou mesmo de uma ou mais classes distintas de AINE. Por outro lado, em pacientes cuja reação inicial citada tenha sido induzida exatamente pelo AAS, seguimos a recomendação do grupo espanhol, de realizar o TP com o ibuprofeno. Porém, é possível que a utilização de outros AINE inibidores fortes da COX-1 (ex: diclofenaco, cetorolaco, cetoprofeno, indometacina) possa servir com o mesmo objetivo.
Em todos esses grupos, analgésicos e/ou antiinflamatórios de mecanismos de ação distintos, que não atuam como inibidores de COX, tais como antiespasmódicos (escopolamina, hioscina), opioides (tramadol, codeína, morfina) e corticosteroides, podem ser liberados já na avaliação inicial, sem necessidade de comprovação de tolerância.
O algoritmo sugerido para manejo de pacientes com reações cutâneas imediatas (urticária, angioedema) ou anafilaxia induzidas por AINE (UAIMA e UAAIUA) está sumarizado na Figura 1.
DESSENSIBILIZAÇÃO COM AINE
Na provocação com AAS, o paciente é exposto a doses crescentes de aspirina, e o teste é interrompido quando este paciente apresenta sintomas respiratórios, ou quando a dose máxima da aspirina é atingida. A dessensibilização com aspirina é o processo pelo qual se atinge a tolerância à aspirina e após este período, o paciente deverá manter o uso contínuo e diário deste medicamento. Na DREA, a dessensibilização com aspirina é alcançada através da administração de altas doses de aspirina após a ocorrência de uma reação respiratória inicial62.
DESSENSIBILIZAÇÃO NAS DOENÇAS CARDIOVASCULARES (DCV)
Pacientes com hipersensibilidade à aspirina e DCV, com indicação para o uso deste medicamento, frequentemente não estão em terapia antiplaquetária apropriada. Vários protocolos de complexidade variável existem na literatura para dessensibilização à aspirina. O papel central da terapia com aspirina nas doenças cardiovasculares está muito bem estabelecido. Como um inibidor irreversível da enzima COX-1, a aspirina bloqueia a biossíntese do tromboxano A2, evitando a agregação plaquetária. A aspirina é indicada para prevenção primária e secundária na maioria dos pacientes com risco aumentado de infarto agudo do miocárdio, acidente vascular cerebral e isquemia cerebral, doença arterial periférica e fibrilação atrial. Estudos demonstraram que terapia com aspirina na dose antiplaquetária reduziu significativamente o risco de eventos vasculares em 33%63.
Com poucas exceções, a maioria dos pacientes com doença cardiovascular que tem história de hipersensibilidade à aspirina pode ser tratada de forma adequada por meio da identificação do tipo de reação ao AAS e submetidos à provocação ou à dessensibilização ao AAS de uma maneira bem tolerada e prática. A provocação e a dessensibilização com aspirina, em doenças cardiovasculares, podem ser realizadas tanto em regime de internação quanto em ambulatório63.
Em quase todos os ambientes, a necessidade urgente de aspirina é necessária pelo seu efeito antiplaquetário bem conhecido. Este efeito pode ser alcançado com 81 mg de AAS, o objetivo de atingir esta dose é razoável para a maioria dos pacientes. Não houve diferença significativa nos desfechos entre a dose baixa (75-100 mg AAS) e a dose alta (300-325 mg AAS por dia) na morte cardiovascular, infarto do miocárdio e acidente vascular cerebral em 30 dias63,64.
Abordagem simplificada para o desafio com AAS em doenças cardiovasculares. Os sintomas devem ser tratados com anti-histamínicos. Se ocorrerem sintomas graves, trate e repita a dose. Para pacientes com DREA, esteja preparado para tratar com broncodilatadores e anti-histamínicos nasais. A dose que tipicamente desencadeia sintomas na DREA está entre 60 e 100 mg. Uma vez tolerante, pode-se iniciar 81 mg/dia de AAS63.
DESSENSIBILIZAÇÃO NA DREA
A dessensibilização com aspirina foi realizada pela primeira vez por Widal e associados em 1922. Em 1976, Zeiss e Lockey relataram um período refratário de 72 horas após uma provocação oral positiva com aspirina. Em 1976, Bianco e cols. induziram asma com aspirina-lisina inalada em um paciente com DREA e, do mesmo modo, nas 72 horas seguintes, a inalação das mesmas doses de aspirina-lisina não induziu nenhum broncoespasmo (período refratário). Após o início com doses baixas de aspirina e seu aumento gradual, quando a dose-alvo de 325 mg é atingida, quaisquer doses adicionais de aspirina ou outros AINE inibidores da COX-1 não induzem reações de hipersensibilidade. A dessensibilização com aspirina, seguida pelo tratamento contínuo nas doses de 325 a 650 mg de aspirina duas vezes ao dia, é considerada o padrão de tratamento para pacientes com DREA após polipectomia (3 a 4 semanas antes). A aspirina pode ser descontinuada por até 48 horas sem que ocorra a perda da dessensibilização64,65.
Embora os benefícios clínicos da dessensibilização à aspirina tenham sido claramente demonstrados, o mecanismo pelo qual isso ocorre não está claro. Não se trata de adquirir um simples estado de tolerância à aspirina, mas a dose necessária para melhorar a inflamação brônquica é geralmente muito maior do que aquela necessária para iniciar uma reação respiratória ou manter a dessensibilização. No entanto, uma série de observações imunológicas foram identificadas na esperança de levar a uma melhor compreensão da patogênese da doença. No início do estudo, mesmo na ausência de ingesta de aspirina/ AINE, os pacientes com DREA mostraram ter níveis aumentados de leucotrienos (LTs), conforme medido pelo LTE4 urinário, e esses níveis aumentam em proporção à gravidade da reação durante a provocação com aspirina. Estudos avaliaram monócitos do sangue periférico de pacientes com DREA e demonstraram uma diminuição no LTB4 após a dessensibilização com aspirina. Outros achados incluem uma regulação negativa do receptor 1 de cisteinil LT (cysLT1) nas células da submucosa nasal e a inibição da produção de IL-4 nas células T após a dessensibilização da aspirina64-66.
Das muitas observações encontradas, o down-regulation dos receptores de IL-4, a diminuição da PgD2, diminuição dos efeitos de LTE4 e efeitos na expressão de IL-4 através da down-regulation de STAT-6 proporcionam oportunidades para se entender o mecanismo subjacente deste benefício65.
Em um estudo grande envolvendo pacientes com DREA, a intervenção cirúrgica era necessária a cada 3 anos, antes da dessensibilização, porém, após a dessensibilização seguida de manutenção com aspirina diariamente, a média deste intervalo passou para 9 anos. Alguns pacientes não apresentaram recorrência dos pólipos, entretanto, como esperado, duas complicações após o tratamento em longo prazo com aspirina, dor ou úlcera gástrica causada pela diminuição da síntese de PgI2 e inadequada repopulação de células da mucosa gástrica (< 15% dos pacientes). A segunda complicação é o sangramento na pele (equimose), mas ocasionalmente nariz, brônquios, bexiga ou trato gastrointestinal65.
OUTRAS INDICAÇÕES DE DESSENSIBILIZAÇÃO
A dessensibilização para pacientes com urticária e/ou angioedema induzidos por AINE está indicada quando há condições clínicas que necessitem de tratamento com anti-inflamatório contínuo e/ou na prevenção primária e secundária de doença cardiovascular (efeito antiplaquetário da AAS), pois a aspirina bloqueia a síntese de TXA2 prevenindo a agregação plaquetária67.
Os pacientes que reagem a vários AINE com sintomas de urticária e/ou angioedema e têm uma história consistente com urticária crônica podem ser submetidos ao TP com aspirina oral. Normalmente, as pré-medicações não são administradas antes desse tipo de desafio. Os anti-histamínicos são normalmente suspensos antes das provocações com AINE, pois esses agentes podem mascarar a detecção de sintomas iniciais ou leves. Os anti-histamínicos-H1 devem ser descontinuados pelo menos 48 horas antes da provocação67.
A dose inicial é de 81 mg ou 162 mg e é duplicada em intervalos de 90 minutos até que o paciente reaja ou a dose terapêutica desejada seja atingida. Se o paciente não desenvolver sintomas, pode receber com segurança um AINE estruturalmente diferente daquele que causou a reação inicial67.
Outra possível indicação de dessensibilização com AAS é na gestação de mulheres com história de RH ao AAS ou a outros AINE e com suspeita clínica de intolerância cruzada. O AAS na gravidez pode ser indicado para prevenção de complicações como pré-eclampsia, restrição do crescimento intrauterino, prematuridade e óbito fetal oriundas de trombofilias maternas (exemplo da síndrome do anticorpo antifosfolipídeo) ou de uma disfunção útero-placentária68. Para essas indicações, habitualmente utiliza-se doses baixas de AAS, similares às doses antiplaquetárias aplicadas nas DCV. Embora os estudos definindo a dose adequada do AAS como profilaxia dessas complicações obstétricas sejam escassos69, como a dose utilizada é comumente as mesmas das DCV, recomendamos protocolos similares aos citados acima, na sessão sobre dessensibilização nas DCV.
CONCLUSÕES / CONSIDERAÇÕES FINAIS
Os anti-inflamatórios não esteroidais são as medicações mais usadas no mundo e, ao mesmo tempo, os mais associados a reações de hipersensibilidade, particularmente no Brasil e na América Latina. Entretanto, essas reações têm apresentações clínicas variadas e que ocorrem por mecanismos fisiopatológicos diferentes (não imunológicos, IgE-mediados e mediados por células T). Conhecer esses fenótipos clínicos e a fisiopatologia é a única forma de individualizar o manejo dos casos clínicos, de modo que pacientes reatores seletivos por mecanismo alérgico não fiquem erroneamente em exclusão de toda uma classe farmacológica sem necessidade, mas também que os reatores não seletivos não sejam expostos a risco de reações graves ou que comprometem a qualidade de vida. Só dessa forma, poderemos adequar o tratamento da dor, inflamação e febre de indivíduos hipersensíveis a esses fármacos.
REFERÊNCIAS
1. AunMV, Agondi RC,Lacerda DC, Menezes UP,Perelló MI, Rodrigues AT, et al. Atualização em reações de hipersensibilidade aos antiinflamatórios não esteroidais - Parte 1: definições, farmacologia, epidemiologia, fisiopatologia e fatores genéticos. Arq Asma Alerg Imunol. 2022;6(3):307-17.
2. Kowalski ML, Makowska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al.Hypersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) -classification, diagnosis and management: review of the EAACI/ENDA(#) and GA2LEN/HANNA*. Allergy. 2011;66(7):818-29.
3. Stevenson DD, Szczeklik A. Clinical and pathologic perspectives on aspirin sensitivity and asthma. Curr Rev Allergy Clin Immunol. 2016;118:773-86.
4. Stevenson DD, Sanchez-Borges M, Szczeklik A. Classification of allergic and pseudoallergic reactions to drugs that inhibit cyclooxigenase enzymes. Ann Allergy Asthma Immunol. 2001;87:177-80.
5. Szczeklik A, Stevenson DD. Aspirin-induced asthma: advances in pathogenesis, diagnosis, and management.J Allergy Clin Immunol. 2003;111:913-21.
6. Kowalski ML, Agache L, Bavbek S, Bakirtas A, Blanca M, Bochenek G, et al. Diagnosis and management of NSAID-exacerbated respiratory disease (NERD) - a EAACI position paper. Allergy. 2019;74:28-39.
7. Kowalski ML. Heterogeneity of NSAID-exacerbated respiratory disease: has the time come for subphenotyping? Curr Opin Pulm Med. 2019;25:64-70.
8. Rodríguez-Jiménez JC, Moreno-Paz FJ, Terán LM, Guaní-Guerra E. Aspirin exacerbated respiratory disease: current topics and trends. Respir Med. 2018;135:62-75.
9. Cardet JC, White AA, Barret NA, Feldweg AM, Wickner PG, Savage J, et al. Alcohol-induced respiratory symptoms are common in patients with aspirin exacerbated respiratory disease. J Allergy Clin Immunol. 2014;2:208-13.
10. Bochenek G, Kuschill-Dziurda J, Szafraniec K, Plutecka H, Szczeklik A, Nizankowska-Mogilnicka E. Certain subphenotypes of aspirin-exacerbated respiratory disease distinguished by latente class analysis. J Allergy Clin Immunol. 2014;133:98-103.
11. Celejewska-Wójcik N, Wójcik K, Ignacak-Popiel M, Cmiel A, Tyrak K, Gielicz A, et al.Subphenotypes of nonsteroidal antiinflammatory disease-exacebated respiratory disease identified by latent class analysis. Allergy. 2019;75:831-40.
12. Sánchez-BorgesM,Caballero-Fonseca F,Capriles-Hulett A.Aspirinexacerbated cutaneous disease. Immunol Allergy Clin North Am. 2013;33(2):251-62.
13. Sánchez-Borges M, Caballero-Fonseca F, Capriles-Hulett A, González-Aveledo L. Aspirin-exacerbated cutaneous disease (AECD) is a distinct subphenotype of chronic spontaneous urticaria. J Eur Acad Dermatol Venereol. 2015;29(4):698-701.
14. Doña I, Blanca-López N, Jagemann LR, Torres MJ, Rondón C, Campo P, et al. Response to a selective COX-2 inhibitor in patients withurticaria/angioedema induced by nonsteroidal anti-inflammatory drugs. Allergy. 2011;66(11):1428-33.
15. Kim YJ, Lim KH, Kim MY, Jo EJ, Lee SY, Lee SE, et al. Cross-reactivity to Acetaminophen and Celecoxib According to the Type of Nonsteroidal Anti-inflammatory Drug Hypersensitivity. Allergy Asthma Immunol Res. 2014;6(2):156-62.
16. Sánchez-Borges M, Acevedo N, Caraballo L, Capriles-Hulett A, Caballero-Fonseca F. Increased total and mite-specific immunoglobulin E in patients with aspirin-induced urticaria and angioedema. J Investig Allergol Clin Immunol. 2010;20(2):139-45.
17. Doña I, Blanca-López N, Torres MJ, Gómez F, Fernández J, Zambonino MA, et al. NSAID-induced urticaria/angioedema does not evolve into chronic urticaria: a 12-year follow-up study. Allergy. 2014 Apr;69(4):438-44.
18. Asero R.Intolerance to nonsteroidal anti-inflammatory drugs might precede by years the onset of chronic urticaria. J Allergy Clin Immunol. 2003;111(5):1095-8.
19. Blanca-Lopez N, Soriano V, Garcia-Martin E, Canto G, Blanca M. NSAID-induced reactions: classification, prevalence, impact, and management strategies. J Asthma Allergy. 2019 Aug 8;12:217-33.
20. Woessner KM, Castells M. NSAID single-drug-induced reactions. Immunol Allergy Clin North Am. 2013 May;33(2):237-49.
21. Demir S, Olgac M, Unal D, Gelincik A, Colakoglu B, Buyukozturk S. Evaluation of hypersensitivity reactions to nonsteroidal anti-inflammatory drugs according to the latest classification. Allergy. 2015;70(11):1461-7.
22. Brockow K, Ardern-Jones MR, Mockenhaupt M, Aberer W, Barbaud A, Caubet JC, et al. EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity. Allergy. 2019;74(1):14-27.
23. Kowalski ML, Asero R, Bavbek S, Blanca M, Blanca-Lopez N, Bochenek G, et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs. Allergy. 2013 Oct;68(10):1219-32.
24. Doña I, Pérez-Sánchez N, Eguiluz-Gracia I, Muñoz-Cano R, Bartra J, Torres MJ, et al. Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Allergy. 2020 Mar;75(3):561-75.
25. Tanno LK, Torres MJ, Castells M, Demoly P; Joint Allergy Academies. What can we learn in drug allergy management from World Health Organization's international classifications? Allergy. 2018;73(5):987-92.
26. Doña I, Blanca-López N, Cornejo-García JA, Torres MJ, Laguna JJ, Fernández J, et al. Characteristics of subjects experiencing hypersensitivity to non-steroidal anti-inflammatory drugs: patterns of response. Clin Exp Allergy. 2011;41(1):86-95.
27. Doña I, Barrionuevo E, Salas M, Laguna JJ, Agúndez J, García-Martín E, et al. NSAIDs-hypersensitivity often induces a blended reaction pattern involving multiple organs. Sci Rep. 2018;8(1):16710.
28. Aun MV, Blanca M, Garro LS, Ribeiro MR, Kalil J, Motta AA, et al. Nonsteroidal anti-inflammatory drugs are major causes of drug-induced anaphylaxis. J Allergy Clin Immunol Pract. 2014;2(4):414-20.
29. Giavina-Bianchi P, Aun MV, Jares EJ, Kalil J.Angioedema associated with nonsteroidal anti-inflammatory drugs. Curr Opin Allergy Clin Immunol. 2016;16(4):323-32.
30. Matsuo H, Morimoto K, Akaki T, Kaneko S, Kusatake K, Kuroda T, et al.Exercise and aspirin increase levels of circulating gliadin peptides in patients with wheat-dependent exercise-induced anaphylaxis. Clin Exp Allergy. 2005;35(4):461-6.
31. Sánchez-López J, Araujo G, Cardona V, García-Moral A, Casas-Saucedo R, Guilarte M, et al. Food-dependent NSAID-induced hypersensitivity (FDNIH) reactions: Unraveling the clinical features and risk factors. Allergy. 2021;76(5):1480-92.
32. Pérez-Sánchez N, Bogas G, Cornejo-García JA, Andreu I, Doña I, Pérez-Alzate D, et al. Multiple nonsteroidal anti-inflammatory drug hypersensitivity without hypersensitivity to aspirin. J Allergy Clin Immunol Pract. 2016;4(3):524-5.
33. Bogas G, Pérez-Sánchez N, Andreu I, Doña I, Perkins JR, Blanca M, et al. Anaphylaxis to 2 NSAIDs in a Patient Who Tolerated ASA. J Investig Allergol Clin Immunol. 2016;26(4):266-8.
34. Guvenir H, Dibek Misirlioglu E, Vezir E, Toyran M, Ginis T, Civelek E, et al.Nonsteroidal anti-inflammatory drug hypersensitivity among children. Allergy Asthma Proc. 2015;36(5):386-93.
35. Pérez-Alzate D, Cornejo-García JA, Pérez-Sánchez N, Andreu I, García-Moral A, Agúndez JA, et al. Immediate Reactions to More Than 1 NSAID Must Not Be Considered Cross-Hypersensitivity Unless Tolerance to ASA Is Verified.J Investig Allergol Clin Immunol. 2017;27(1):32-9.
36. Blanca-López N, Bogas G, Doña I, Torres MJ, Blanca M, Cornejo-García JA, et al. ASA must be given to classify multiple NSAID-hypersensitivity patients as selective or cross-intolerant. Allergy. 2016;71(4):576-8.
37. Yeung WYW, Park HS.Update on the Management of Nonsteroidal Anti-Inflammatory Drug Hypersensitivity. Yonsei Med J. 2020;61(1):4-14.
38. Terzioğlu K, Sancar Ö, Ekerbiçer HÇ, Öztürk RT, Epöztürk K. Tolerability to paracetamol and preferential COX-2 inhibitors in patients with cross-reactive nonsteroidal anti-inflammatory drugs hypersensitivity. Asia Pac Allergy. 2020;10(3):e29.
39. Bavbek S, Celik G, Ozer F, Mungan D, Misirligil Z.Safety of selective COX-2 inhibitors in aspirin/nonsteroidal anti-inflammatory drug-intolerant patients: comparison of nimesulide, meloxicam, and rofecoxib. J Asthma. 2004;41(1):67-75.
40. Senna G, Bilò MB, Antonicelli L, Schiappoli M, Crivellaro MA, Bonadonna P, et al.Tolerability of three selective cyclo-oxygenase-2 inhibitors, meloxicam, celecoxib and rofecoxib in NSAID-sensitive patients. Eur Ann Allergy Clin Immunol. 2004;36(6):215-8.
41. Corzo JL, Zambonino MA, Muñoz C, Mayorga C, Requena G, Urda A, et al. Tolerance to COX-2 inhibitors in children with hypersensitivity to nonsteroidal anti-inflammatory drugs. Br J Dermatol. 2014;170(3):725-9.
42. Kim YJ, Lim KH, Kim MY, Jo EJ, Lee SY, Lee SE, et al. Cross-reactivity to Acetaminophen and Celecoxib According to the Type of Nonsteroidal Anti-inflammatory Drug Hypersensitivity. Allergy Asthma Immunol Res. 2014 Mar;6(2):156-62.
43. Zanandrea A, Mouco CC, Assis JP, Dias GMFS, Castro RB, Brugnoll RM, et al. Hypersensitivity to paracetamol: placebo effect or overdiagnosis? J Allergy Clin Immunol. 2017;141(2):AB43.
44. Li L, Laidlaw T. Cross-reactivity and tolerability of celecoxib in adult patients with NSAID hypersensitivity. J Allergy Clin Immunol Pract. 2019;7(8):2891-3.
45. El-Malah AA, Gineinah MM, Deb PK, Khayyat AN, Bansal M, Venugopala KN, et al.Selective COX-2 Inhibitors:Road from Success to Controversy and the Quest for Repurposing. Pharmaceuticals (Basel). 2022;15(7):827.
46. Lutfeali S, Khan DA.Pediatric Drug Allergies.Update on Beta-lactam, Nonsteroidal Anti-Inflammatory Drug, and Chemotherapeutic Reactions. Pediatr Clin N Am. 2019;66:1035-51.
47. Kidon M, Blanca-Lopez N, Gomes E, Terreehorst I, Tanno L, Ponvert C, et al. EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal anti-inflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018;29(5):469-80.
48. Rubio M, Bousquet PJ, Gomes E, Romano A, Demoly P. Results of drug hypersensitivity evaluations in a large group of children and adults. Clin Exp Allergy. 2012;42(1):123-30.
49. Mori F, Atanaskovic-Markovic M, Blanca-Lopez N, Gomes E, Gaeta F, Sarti L, et al.A Multicenter Retrospective Study on Hypersensitivity Reactions to Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) in Children: A Report from the European Network on Drug Allergy (ENDA) Group. J Allergy Clin Immunol Pract. 2020;8(3):1022-31.
50. Cousin M, Chiriac A, Molinari N, Demoly P, Caimmi D.Phenotypical characterization of children with hypersensitivity reactions to NSAIDs. Pediatr Allergy Immunol. 2016;27(7):743-8.
51. Gómez E, Blanca-Lopez N, Torres MJ, Requena G, Rondon C, Canto G, et al. Immunoglobulin E-mediated immediate allergic reactions to dipyrone: value of basophil activation test in the identification of patients. Clin Exp Allergy. 2009 Aug;39(8):1217-24.
52. Decuyper II, Mangodt EA, Van Gasse AL, Claesen K, Uyttebroek A, Faber M, et al. In Vitro Diagnosis of Immediate Drug Hypersensitivity Anno 2017: Potentials and Limitations. Drugs R D. 2017;17:265-78.
53. Zambonino MA, Torres MJ, Muñoz C, Requena G, Mayorga C, Posadas T, et al. Drug provocation tests in the diagnosis of hypersensitivity reactions to non-steroidal anti-inflammatory drugs in children. Pediatr Allergy Immunol. 2013;24(2):151-9.
54. Yilmaz O, Ertoy Karagol IH, Bakirtas A, Topal E, Celik GE, Demirsoy MS, et al. Challenge-proven nonsteroidal anti-inflammatory drug hypersensitivity in children. Allergy. 2013;68(12):1555-61.
55. Ertoy Karagol HI, Yilmaz O, Topal E, Ceylan A, Bakirtas A.Nonsteroidal anti-inflammatory drugs-exacerbated respiratory disease in adolescents. Int Forum Allergy Rhinol. 2015;5(5):392-8.
56. Kidon MI, Liew WK, Chiang WC, Lim SH, Goh A, Tang JP, et al. Hypersensitivity to paracetamol in Asian children with early onset of nonsteroidal anti-inflammatory drug allergy. Int Arch Allergy Immunol. 2007;144(1):51-6.
57. Loh W, Lim HH, Rao R, Goh A, Ong LX, Chiang WC. Tolerance to etoricoxib in children with nonsteroidal anti-inflammatory drug hypersensitivity. Asia Pac Allergy. 2015;5(1):40-6.
58. Simsek IE, Cogurlu MT, Aydogan M.Two approaches for diagnosis of nonsteroidal anti-inflammatory drug hypersensitivity in children. Ann Allergy Asthma Immunol. 2019;123:389-93.
29. Blanca-López N, Haroun-Diaz E, Ruano FJ, Pérez-Alzate D, Somoza ML, Vázquez de la Torre Gaspar M, et al. Acetyl Salicylic Acid Challenge in Children with Hypersensitivity Reactions to Nonsteroidal Anti-Inflammatory Drugs Differentiates Between Cross-Intolerant and Selective Responders.J Allergy Clin Immunol Pract. 2018;6(4):1226-35.
60. Aun MV, Kalil J, Giavina-Bianchi P. Drug-Induced Anaphylaxis. Immunol Allergy Clin North Am. 2017;37(4):629-41.
61. Khan DA, Banerji A, Blumenthal KG, Phillips EJ, Solensky R, White AA, et al.Drug Allergy:A 2022 Practice Parameter Update.J Allergy Clin Immunol. 2022:S0091-6749(22)01186-1.
62. Cahill KN. Immunologic effects of aspirin desensitization abd high-dose aspirin therapy in aspirin-exacerbated respiratory disease. J Allergy Clin Immunol. 2021;148:344-7.
63. Woessner KM. Aspirin desensitization for cardiovascular disease. Curr Opin Allergy Clin Immunol. 2015;15:314-22.
64. Giavina-Bianchi P, Aun MV, Galvão VR, Castells M. Rapid Desensitization in Immediate Hypersensitivity Reaction to Drugs. Curr Treat Options Allergy. 2015;2:268-85.
65. White AA, Stevenson DD.Aspirin-exacerbated respiratory disease. N Engl J Med. 2018;379:1060-70.
66. Katial RK, Strand M, Prasertsuntarasai T, Leung R, Zheng W, Alam R. The effect of aspirin desensitization on novel biomarkers in aspirin-exacerbated respiratory diseases. J Allergy Clin Immunol. 2012;126:738-44.
67. Simon RA. Diagnostic challenge and desensitization protocols for NSAID reactions.UpToDate.com.Literature review current through: Sep. 2022.
68. Benito-Garcia F, Pires I, Lima J.Aspirin Desensitization:Implications for Acetylsalicylic Acid-Sensitive Pregnant Women. Medicina (Kaunas). 2021;57(4):390.
69. Mkhize PZ, Phoswa WN, Khaliq OP, Dorsamy V, Moodley J. Aspirin in the prevention of preeclampsia: A protocol for systematic review and meta-analysis. Medicine (Baltimore). 2021;100(48):e27916.