Número Atual: Abril-Junho 2022 - Volume 6 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicações Clínicas e Experimentais
Dupilumabe no tratamento de rinossinusite crônica com pólipo nasal em adolescente
Dupilumab in the treatment of chronic rhinosinusitis with nasal polyps in adolescents
Caroline Pinto Pássaro1; Sérgio Duarte Dortas-Junior1; Nathássia da Rosa Paiva Bahiense Moreira1; Fabiana Chagas da-Cruz2; José Elabras-Filho1; Priscila Novaes Ferraiolo 1, Solange Oliveira Rodrigues Valle1
DOI: 10.5935/2526-5393.20220031
1. Hospital Universitário Clementino Fraga Filho (HUCFF-UFRJ), Serviço de Imunologia - Rio de Janeiro, RJ, Brasil
2. Hospital Universitário Clementino Fraga Filho (HUCFF-UFRJ), Serviço de Otorrinolaringologia - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Caroline Pinto Pássaro
E-mail: carolinepassaro@gmail.com
Submetido em: 02/02/2022
Aceito em: 19/02/2022
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
O uso do anticorpo monoclonal dupilumabe em adultos tem possibilitado o controle da inflamação crônica, reduzindo significativamente o tamanho e a recorrência de novos pólipos, melhorando os sintomas nasais e, consequentemente, a qualidade de vida desses indivíduos. Relatamos o caso de uma adolescente que evidencia a eficácia de dupilumabe no tratamento da rinossinusite crônica com pólipo nasal.
Descritores: Sinusite, asma, anticorpo monoclonal.
INTRODUÇÃO
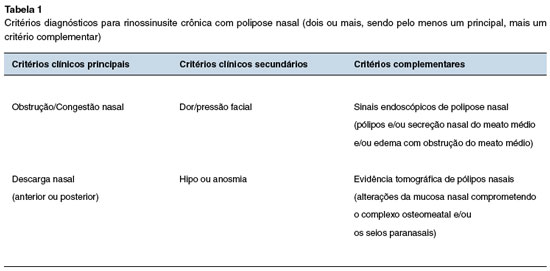
A rinossinusite crônica (RSC) é uma doença inflamatória crônica da mucosa nasal e dos seios paranasais, apresentando-se sem ou com pólipos nasais (RSCsPN e RSCcPN, respectivamente)1. Pólipos são massas inflamatórias benignas, que surgem nas vias aéreas superiores, manifestando-se, frequentemente, como obstrução nasal e hipo/anosmia2. O diagnósticotico clínico da RSCcPN é confirmado pela presença de sintomas sinonasais por 12 ou mais semanas e pela visualização de pólipos na cavidade nasal por endoscopia nasal ou tomografia computadorizada (Tabela 1)2. Até 60% dos pacientes apresentam comprometimento das vias aéreas inferiores, coexistindo com asma de início na vida adulta3,4. Entretanto, sua associação com asma na infância é menos comum e, se presente, fibrose cística e outras causas secundárias de RSC devem ser investigadas5.
Na maioria dos casos de RSCcPN, o tratamento é realizado com corticosteroide tópico e lavagem nasal com solução salina. Além destes, os pacientes sintomáticos graves necessitam de ciclos de corticosteroide e antibioticoterapia sistêmicos por períodos prolongados, sendo a polipectomia endoscópica (PCENS) indicada para os casos refratários6.
Os casos resistentes à terapia esteroidal e com pólipos recidivantes cursam com piora progressiva da qualidade de vida (avaliada pelo SNOT-22, sigla em inglês de Sino-Nasal Outcome Test)7, necessitando de tratamento com imunobiológicos específicos. Tal especificidade é determinada pelo mecanismo fisiopatológico/imunológico envolvido na formação dos pólipos, sendo a resposta imune tipo 2 encontrada em quase 90% dos casos8.
Nesse contexto, o primeiro imunobiológico aprovado para o tratamento da RSCcPN não controlada em adultos (≥ 18 anos) foi o dupilumabe (uso autorizado pela FDA em 2019, e pela ANVISA em 2020), um anticorpo monoclonal humano, imunoglobulina (Ig) G4, cujo alvo é a subunidade a do receptor de interleucina (IL)-4 (IL-4Rα), sendo também comum ao receptor da IL-13. Assim, há o bloqueio da sinalização de ambas as citocinas fundamentais no desenvolvimento da resposta imune tipo 28-10.
RELATO DE CASO
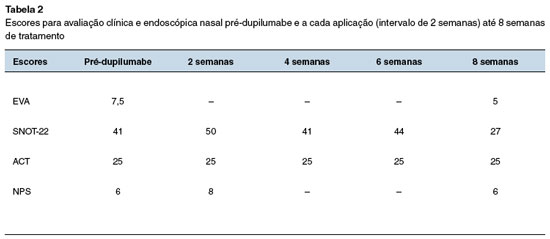
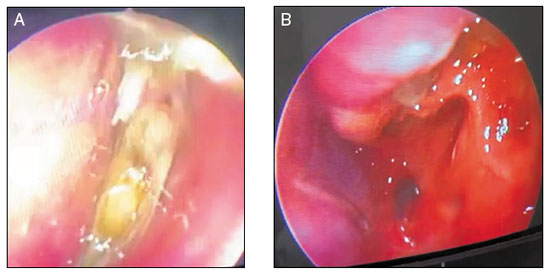
Paciente feminino, 17 anos, estudante, com história de asma desde a infância, controlada com o uso de xinafoato de salmeterol + propionato de fluticasona (25 μg/125 μg; 1 inalação 1x/dia). Há cinco anos, evoluiu com obstrução nasal recorrente e hiposmia. Inicialmente, foi avaliada pela equipe do Serviço de Otorrinolaringologia, realizou tomografia computadorizada de seios paranasais (TCSPN) que evidenciou pólipos nasais bilaterais, desvio septal à esquerda e velamento pansinusal, compatível com o diagnóstico de RSCcPN. Fora indicada e realizada PCENS, cuja histopatologia foi compatível com pólipo inflamatório alérgico. No pós-operatório imediato, apresentou edema e hematoma em seio maxilar direito, além de cultura de secreção nasal positiva para Enterobacter spp., com resposta satisfatória à budesonida intranasal 400 μg/dia associada à lavagem nasal com mupirocina (5 vezes/dia). Após quatro meses, houve recidiva dos pólipos que se estenderam além do meato médio, sendo submetida a nova PCENS. À investigação etiológica, foram realizados testes do suor e genético para fibrose cística, ambos negativos. Encaminhada ao Serviço de Imunologia, foi confirmada sensibilização a Dermatophagoides pteronyssinus e Blomia tropicalis, eosinofilia (1.103/mm3), IgE total = 460 UI/mL, além de níveis baixos de IgM (P3-P10). Após um período oligossintomática (aproximadamente 24 meses), evoluiu com episódios de agudização da rinossinusite, refratários ao tratamento medicamentoso convencional, complicando com pneumonia e exacerbação da asma. O tratamento clínico para asma e rinossinusite foram otimizados com fumarato de formoterol diidratado + dipropionato de beclometasona (6 μg/100 μg; 2 inalações 12/12h), além de montelucaste de sódio (10 mg; 1 comprimido 1x/dia) e lavagem nasal com solução de budesonida glicerinada 500 mL/dia. Recentemente, mesmo em uso das medicações nasais e, apesar da nova PCENS, ainda apresentava agudização dos sintomas, com necessidade recorrente de antibioticoterapia e uso frequente de corticosteroide sistêmico (seis ciclos de 7-14 dias em seis meses). No último ano, a paciente apresentava-se sintomática, com predomínio dos sintomas nasais, refratários ao tratamento, além de velamento completo dos seios paranasais e de células etmoidais, estendendo-se às fossas nasais, com piora progressiva da qualidade de vida, quando foi indicado o uso de dupilumabe, apesar de não licenciado para RSCcPN nessa faixa etária. Iniciado com 300 mg via subcutânea (SC) a cada duas semanas. Após oito semanas, evoluiu com melhora significativa dos escores SNOT-227, EVA (escala visual analógica)11 e NPS (nasal polyp score)12, mantendo a asma controlada pelo ACT (asthma control test)13 (Tabela 2 e Figura 1).
DISCUSSÃO
Cerca de 90% dos pacientes apresentam RSCcPN mediada por resposta imune tipo 2, com eosinofilia e formação de IgE, além de infiltração eosinofílica significativa da mucosa e dos pólipos nasais. Há síntese de níveis elevados de citocinas tipo 2 como a proteína catiônica eosinofílica, eotaxina, IL-4, IL-5 e IL-13. Estas interleucinas possuem papel importante no mecanismo fisiopatológico das comorbidades associadas, inclusive da asma, que acomete até dois terços dos pacientes com RSCcPN, prejudicando o controle clínico e piorando a qualidade de vida desses pacientes14-15.
Na prática clínica, as evidências de inflamação tipo 2 são a associação com asma de início tardio e/ou com doença respiratória exacerbada por aspirina (DREA), além de maior gravidade na apresentação da própria RSCcPN, com recorrência de pólipos após corticoterapia oral e/ou polipectomia. Outros parâmetros são eosinofilia, níveis elevados de IgE sérica e infiltrado eosinofílico à histopatologia dos pólipos16,17.
A abordagem terapêutica convencional da RSCcPN objetiva o controle do processo inflamatório nasal. Corticosteroide tópico intranasal e cursos repetidos de corticosteroide sistêmico podem ser necessários para os casos mais graves, acarretando efeitos colaterais por uso prolongado. Além disso, o tratamento cirúrgico é mais frequente pela recorrência dos pólipos16-17.
Recentemente, o uso de imunobiológicos tem sido indicado em pacientes com RSCcPN grave que apresentem evidências de inflamação tipo 2 (eosinofilia tecidual ≥ 10 cels/HPF ou eosinofilia sanguínea ≥ 250 cels/mcL ou IgE total ≥ 100 UI/mL). Nesse contexto, pacientes com RSCcPN que necessitem de cursos frequentes de corticoterapia sistêmica, com hipo/anosmia, associação com asma e redução significativa da qualidade de vida. O dupilumabe, por ser um anticorpo anti-IL-4/IL-13, tem indicação precisa para a RSCcPN. Vale enfatizar que é uma IgG4, cujo alvo é a IL-4Rα, compartilhada pela IL-4 e IL-13, bloqueando a sinalização dessas e, consequentemente, atenuando a resposta inflamatória17-19.
Em 2016, Bachert e cols. avaliaram a eficácia do dupilumabe na RSCcPN, em indivíduos com mais de 18 anos, tratados com dose de ataque de 600 mg SC seguida de 300 mg a cada duas semanas. Os pacientes apresentaram melhora significativa do SNOT-22, do escore endoscópico e do escore tomográfico de pólipo nasal (NPS e Lund-Mackay sinus - LMS, respectivamente). Além disso, o uso do dupilumabe melhorou a função pulmonar e o controle da asma (ACT) no subgrupo de pacientes com asma19.
A partir dos resultados positivos desse estudo, foram realizados outros dois, multicêntricos, o SINUS-24 e o SINUS-52 (com 24 e 52 semanas de acompanhamento, respectivamente), que também demonstraram que o uso de dupilumabe em adultos ≥ 18 anos com RSCcPN grave reduziu de modo significativo os escores SNOT-22, NPS e LMS, com aumento do ACT, quando comparado ao placebo. Dessa forma, evidenciaram a eficácia do dupilumabe em pacientes com RSCcPN refratária aos tratamentos clínico e cirúrgico, inclusive, naqueles com asma associada20.
No caso relatado, a paciente apresentava todos os critérios clínico-laboratoriais estabelecidos para o diagnóstico de RSCcPN com inflamação tipo 2 (Tabela 1, Figura 1)16. Evoluiu com piora clínica progressiva, caracterizada pela recorrência dos pólipos, refratários aos tratamentos clínico e cirúrgico, coexistência de asma não controlada, resultando em perda significativa da sua qualidade de vida. Considerando a gravidade do quadro clínico, especialmente pela recorrência dos pólipos e uso frequente de corticosteroides sistêmicos, optou-se por iniciar o dupilumabe, 300 mg SC a cada duas semanas, na tentativa de controlar o processo inflamatório nasal. Após oito semanas, evoluiu com melhora clínica significativa, corroborada pelos escores SNOT-22, EVA e NPS, mantendo a asma controlada pelo ACT (Tabela 2). A paciente não apresentou nenhum evento adverso durante o período.
Dessa forma, o dupilumabe tem se mostrado seguro e clinicamente eficaz no tratamento de doenças com resposta imune tipo 2, inclusive, da RSCcPN em adultos. Relatamos o caso de uma paciente adolescente (17 anos), com RSCcPN grave, que obteve controle clínico significativo, após oito semanas de uso do dupilumabe, na posologia licenciada para adultos com 18 anos ou mais. Logo, há necessidade de mais estudos que evidenciem tal eficácia em outras faixas etárias, evitando riscos futuros como o desenvolvimento de osteoporose e necrose óssea pelo uso frequente de corticosteroides sistêmicos.
REFERÊNCIAS
1. Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2012. Rhinology. 2012;23:1-298.
2. Hox V, Bobic S, Callebaux I, Jorissen M, Hellings PW. Nasal obstruction and smell impairment in nasal polyp disease: correlation between objective and subjective parameters. Rhinology. 2010;48(4):426-32.
3. Ragab A, Clement P, Vincken W. Objective assessment of lower airway involvement in chronic rhinosinusitis. Am J Rhinol. 2004;18(1):15-21.
4. Promsopa C, Kansara S, Citardi MJ, Fakhri S, Porter P, Luong A. Prevalence of confirmed asthma varies in chronic rhinosinusitis subtypes. Int Forum Allergy Rhinol. 2016;6(4):373-7.
5. Settipane GA, Chafee FH. Nasal polyps in asthma and rhinitis. A review of 6,037 patients. Allergy Clin Immunol. 1977;59(1):17-21.
6. Orlandi RR, Kingdom TT, Hwang PH, Smith TL, Jeremiah AA, Baroody FM, et al. International Consensus Statement on Allergy and Rhinology: Rhinosinusitis. Int Forum Allergy Rhinol. 2016;6 Suppl 1:S22-S209.
7. Kosugi EM, Chen VG, Fonseca VMG, Cursino VMP, Mendes Neto JA, Gregório LC. Translation, cross-cultural adaptation and validation of SinoNasal Outcome Test (SNOT) - 22 to Brazilian Portuguese. Braz J Otorhinolaryngol. 2011;77(5):663-9.
8. Bachert C, Zhang N, Cavaliere C, Wiping W, Gevaert E, Krysco O. Biologics for chronic rhinosinusitis with nasal polyps. J Allergy Clin Immunol. 2020;145(3):725-39.
9. Matsunaga K, Katoh N, Fujieda S, Izuhara K, Oishi K. Dupilumab: Basic aspects and applications to allergic diseases. Allergol Int. 2020;69(2):187-96.
10. Trimarchi M, Indelicato P, Vinciguerra A, Bussi M. Clinical efficacy of dupilumab in the treatment of severe chronic rhinosinusitis: The first case outside of a clinical trial. Clin Case Rep. 2021;9:1428-32.
11. Shukla RH, Nemade SV, Shinde KJ. Comparison of visual analogue scale (VAS) and the Nasal Obstruction Symptom Evaluation (NOSE) score in evaluation of post septoplasty patients. World J Otorhinolaryngol Head Neck Surg. 2020;6(1):53-8.
12. Meltzer EO, Hamilos DL, Hadley JA, Donal MD, Lanza C, Nradley MD, et al. Rhinosinusitis: developing guidance for clinical trials. Otolaryngol Head Neck Surg. 2006;135(5 Supp):S31-S80.
13. Roxo JPF, Ponte EV, Ramos DCB, Pimentel L, D'Oliveira Júnior A, Cruz AA. Portuguese-language version of the Asthma Control Test. J Bras Pneumol. 2010;36(2):159-66.
14. Bachert C, Zhang L, Gevaert P. Current and future treatment options for adult chronic rhinosinusitis: Focus on nasal polyposis. J Allergy Clin Immunol. 2015;136(6):1431-40.
15. Alobid I, Bernal-Sprekelsen M, Mullol J. Chronic rhinosinusitis and nasal polyps: The role of generic and specific questionnaires on assessing its impact on patient's quality of life. Allergy Eur J Allergy Clin Immunol. 2008;63(10):1267-79.
16. Fokkens WJ, Lund VJ, Hopkins C, Hellings PW, Kern R, Reitsma S, et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology. 2020;58(Suppl S29):1-464.
17. Anselmo-Lima W, Tamashiro E, RomanoFR, Miyake MM Roithmann R, Kosugi EM, et al. Guideline for the use of immunobiologicals in chronic rhinosinusitis with nasal polyps (CRSwNP) in Brazil. Braz J Otorhinolaringol. 2021 [Article in press].
18. Sastre J, Dávila I. Dupilumab: A new paradigm for the treatment of allergic diseases. J Investig Allergol Clin Immunol. 2018;28:139-50.
19. Bachert C, Mannent L, Naclerio RM, Mullol J, Ferguson BJ, Gevaert P, et al. Effect of Subcutaneous Dupilumab on Nasal Polyp Burden in Patients With Chronic Sinusitis and Nasal Polyposis: A Randomized Clinical Trial. JAMA. 2016;315(5):469-79.
20. Bachert C, Han JK, Desrosiers M, Hellings PW, Amin N, Lee SE, et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): results from two multicentre, randomised, double-blind, placebo-controlled, parallel-group phase 3 trials. Lancet. 2019;394(10209):1638-50.